Samenvatting Microbiology en Biochemistry
Hoofdstuk 1
4 organismen moeten op het tentamen bekend zijn: (zie ook stencil)
Thiamargarita Namibiensis
o Zeer groot organisme, met het blote oog waar te nemen.
o Grote vacuole met nitraat en kleinere insluitsels met zwavel.
o Nitraat voor ademhaling, zwavel voor onttrekking van energie.
o Groeit beste in afwezigheid van zuurstof, aëroob organisme maar ook denitrificerende bacterie
o chemolithotroof organisme
o drie cellen die in een keten liggen, maar elk apart kunnen leven
Borrelia Burgdorferi (ziekte van lyme)
o Één lineair chromosoom
o 17 plasmiden
Dehalobacter Restrictus
Haloquadratum Walsbyi
o Maakt zichzelf zo dun en rechthoekig mogelijk.
o Zo verlopen membraanprocessen optimaal. Optimaal licht opvangen om ATP te maken. Vacuolen
bewegen zich door zich te vullen en leeg laten lopen, kan daardoor op goede hoogte waardoor veel
licht op oppervlak komt van vacuole.
o Extreem halofiel, het bezit het eiwit halomucine. Dit eiwit beschermt tegen uitdroging door met
negatief geladen aminogroepen watermoleculen aan te trekken (waterlaag rondom de cel).
o Heeft een slijmachtige laag
Functies van bacteriën:
Vertering
Bederf
Melkzuurbacterie
Stikstofkringloop
Waterzuivering
Bacterie/virus
(ziekteverwekker)
Penicilline
Bescherming
Fermentatie
Hygiëne
Micro-organismen, in het bijzonder bacteriën en archaea, zijn de kleinste bewoners op aarde. De belangrijkste
structuren in deze organismen zijn: DNA, RNA, cytoplasmamembraan en ribosomen. Er zijn geen mitochondriën
aanwezig. Energieproductie vindt plaats in het celmembraan.
Net als bij alle levende cellen vinden er verschillende processen plaats:
Opname en uitscheiding van stoffen
Reproductie
Differentiatie
Communicatie
Beweging
Evolutie
De cel is een open systeem. Een cel neemt nutriënten op, zet ze om en scheidt ze dan weer uit. Chemicaliën
worden omgezet in nieuwe cellen, m.b.v. genetische informatie in bestaande cellen. Differentiatie houdt in dat
cellen nieuwe celstructuren kunnen vormen, zoals spore. In plaats van splitsen omgeeft de cel zijn DNA met een
dikke wand. Dit heet een spore en deze kan overleven onder zware omstandigheden. Communicatie tussen
cellen vindt plaats door middel van chemicaliën die opgenomen of uitgescheiden worden. Beweging van cellen
vindt plaats door middel van een flagel. Een cel kan één of meerdere flagellen hebben. De cellen bevatten
genetische informatie die nieuwe biologische eigenschappen kunnen bevatten. Prokaryoten kunnen DNA
opnemen uit andere organismen en zo hun biologische eigenschappen veranderen. De Fylogenetische boom
toont de evolutionaire relaties tussen cellen aan.
Prokaryoot
- DNA los in cel
- heeft geen mitochondriën
- in celmembraan wordt ATP aangemaakt
- geen chloroplasten, fotosynthese in membraan
Genetische functies:
ReplicatieGroei/reproductie
GenexpressieRNATranslatieEiwitten
Catalytische functies:
Energieconservering: ADP + PiATP
Metabolisme: Genereren van voorlopers van macromoleculen (suikers, aminozuren, vetzuren, enz.)
Enzymen: metabole katalysatoren.
Deze beide functies zijn nodig voor groei een reproductie.
Habitat: milieu waarin een microbiële (meng)populatie leeft
mengcultures/populaties hoe microorganismen bestaan in de natuur
Ecosysteem: omvat alle levende organismen plus de fysieke en chemische componenten van die habitat
Microbiële ecologie: studie van micro-organismen in hun natuurlijke milieu
Veranderingen in fysische en chemische omstandigheden, die ze eventueel zelf kunnen veroorzaken,
leiden tot veranderingen in de samenstelling van de (meng)cultuur (bijv. O2)
Microbiële ecologie is de studie van micro-organismen in hun natuurlijke milieu.
Het belang van micro-organismen voor de mens:
Micro-organismen hebben de situatie op aarde zoals deze nu is voor een groot deel gecreëerd.
Micro-organismen omvatten het grootste deel van de biomassa van de aarde.
Ze houden ons milieu in stand.
o O2-productie (door cyanobacteriën, aarde langzaam zuurstofrijker)
o Stikstofkringloop
o Zwavelkringloop
Aërobe micro-organismen halen adem met zuurstof. Zuurstof is dan de elektronenacceptor.
Een verbinding wordt geoxideerd en daarbij komen elektronen vrij. Via de ademhalingsketen komen deze
elektronen bij een elektronenacceptor terecht.
Anaërobe organismen halen adem met een andere verbinding van buitenaf, zoals NO3-, SO42-, CO2,…
Via de ademhalingsketen wordt ATP gegenereerd.
Ook zijn er fermentatieve organismen. Deze gebruiken een zelfgemaakte verbinding, zoals pyruvaat, als
elektronenacceptor. Een voorbeeld van een fermentatief organisme zijn gisten.
Elektronenacceptoren zijn elementen of verbindingen die één of meerdere elektronen kunnen opnemen. Ze
worden daarbij gereduceerd. Elke verbinding waarin de C, N, S, Fe, Mn, Se,….., in gereduceerde vorm voorkomt,
kan als energiebron dienen voor bepaalde micro-organismen.
Stikstof is belangrijk voor bodem, beperkt aantal prokaryoten kunnen stikstof omzetten in zuurstof.
Chemolitotrofie is het ademhalen door middel van anorganische verbindingen.
Grote tijd tussen Antonie en Pasteur: ‘Wat hebben we aan microbiologische kennis’ & moeilijk te bestuderen
(gebrek aan goede lenzen)
microorganisme zoals melkzuurbacteriën hebben geen ademhalingsketen maar gebruiken verbinding die ze zelf
maken die ze gebruiken als elektronenacceptor. Verbinding vaak pyrovaat of pyrodruivenzuur
Concept: Elke verbinding waarin de C, N, S* in gereduceerde vorm voorkomt, kan als energievorm dienen voor
bepaalde micro-organismen
plasmiden: genetische elementen die onafhankelijk van het ‘gastheer’-chromosoom repliceren
Hoofdstuk 2
2.1 t/m 2.4 Alleen powerpoint
Licht-microscopie
helderveld (a) en donkerveld (c): geen details in cellen, kleuring vaak noodzakelijk
(Gram-kleuring)
o beperking van helderveld microscoop is gebrek aan contrast tussen cellen en
hun omgeving
fasecontrast (b): kleine verschillen in brekingsindex kunnen worden waargenomen
(sporen en reservestoffen [PHB, zwavel]
fluorescentie microscopie: fluorescerende verbindingen aan/in cyanobacteriën
a) helderveld
b) fluorescentie bij
546 nm (chlorofyl a)
c) DAPI bindt specifiek
aan DNA materiaal
(E.M.): zie je
elektronenmicroscoop
in bacterie duidelijk DNA
materiaal
o SEM: bacteriën over
oppervlak
laat gaan
o TEM: transmissie
o grotere
oplossingskracht dan lichtmicroscopen, de grens van resolutie is 0,2 nm. De twee grote vormen van
elektronenmicroscoop zijn transmissie, wordt voornamelijk gebruikt om internale celstructuur te
observeren, en scanning, gebruikt om de oppervlakte van soorten te observeren.
Eukaryoot: Echte kern, mRNA moet door kernmembraan heen.
Prokaryoot: DNA/mRNA zijn in direct contact met ribosomen. Flagel draait rond bij prokaryoten in tegenstelling
tot bij eukaryoten
Archae: chromosomen lijken op die van bacteriën, maar dan opgerold en replicatie komt meer overeen met die
van eukaryoten.
Virussen nemen niets op, scheiden niets uit en kunnen enkel mbv een gastheer vermenigvuldigen. Is geen open
systeem, geen cel
Opbouw van cytoplasma van prokaryoten:
Kernmateriaal: DNA, geen kernmembraan
1 Chromosoom (DOGMA) en eventueel plasmiden.
Dubbelstrengs DNA
Transcriptie en translatie niet gescheiden.
Essentiële genen op chromosoom.
Speciale genen op plasmiden.
Plasmiden zijn losse stukjes DNA die een belangrijke rol spelen bij de eigenschappen van organismen. Deze
repliceren onafhankelijk van de gastheer. Komt zowel circulair als lineair voor. Dubbelstrengs. Sommige
plasmiden kunnen geïntegreerd raken in het chromosoom. Bevatten veel onnodige genen, maar komen ook
vaak van pas. Plasmiden overdracht tussen zowel prokaryoten onderling als tussen prokaryoten en eukaryoten,
veelal via conjugatie. Wanneer organismen plasmiden uitwisselen kunnen ze bijvoorbeeld resistent worden.
Overdracht van plasmiden kan op drie manieren.
Conjugatie: Cellen verbinden met elkaar en geven zo
plasmiden over.
o Conjugatie van plasmiden
o Conjugatie met chromosoom overdracht
Transformatie: Donorcel barst open. Vrij DNA wordt
opgenomen door ontvanger.
Transductie: DNA wordt overgebracht van cel naar cel
door virussen.
o Lytische cyclus: Faag valt aan op cel voor
vermenigvuldiging. Cel reproduceert faag. Er
ontstaan zowel normale fagen als fagen met
gastheer DNA. Deze laatste geven het DNA
door.
o Lysogene cyclus: Faag plant DNA in
gastheercel. Geen verdere gevolgen
voor gastheercel. Deze kan normaal
blijven delen. Dit heet een
getransdugeerde cel.
De Lysogene cyclus kan overgaan in de
Lytische cyclus.
Bacteriën kunnen in tegenstelling tot andere
prokaryoten meerdere chromosomen hebben.
Organismen zijn verdeeld in drie groepen:
Prokaryoten
o Bacteriën
o Archaea
Eukaryoten
Deze drie groepen vormen de drie hoofdtakken van de biologische boom. Deze biologische boom is in elkaar
gezet aan de hand van het rRNA.
Ribosomen in verschillende organismen hebben een Svedberg waarde. De Svedberg eenheid staat voor de
sedimentatiesnelheid van moleculen. In eukaryoten is deze waarde 80S en in prokaryoten is deze 70S. De enige
uitzondering in eukaryoten is de Svedberg eenheid in mitochondriën en chloroplasten. Deze organellen komen
namelijk voort uit prokaryoten.
Facultatief aëroob: een organisme dat kan overstappen op een
anaëroob ademhalingsproces wanneer er geen zuurstof aanwezig is.
Chemoorganotroof: gebruikt organische stoffen om ATP te genereren.
Corynebacteriën: maken uit vetzuren vetten, beënten met
stafylokokken minder last van zweetlucht
Metabole diversiteit: de manier waarop een organisme aan energie en
voedingsstoffen komt.
Fototroof (energie uit licht)/chemotroof (energie uit externe verbindingen)
o Chemoorganotroof: omzetten van organische verbindingen
o Chemolithotroof: omzetten van anorganische verbindingen
o Oxygene fotosynthese (O2 productie) en anoxygene fotosynthese (fotosynthese)
Organotroof (reducerende equivalenten uit organische verbindingen)/lithotroof (reducerende equivalenten
uit anorganische verbindingen)
Heterotroof (koolstof wordt verkregen uit organische verbindingen)/autotroof (koolstof wordt verkregen uit
CO2)
Microbiële diversiteit:
Grootte
Vorm
Fysiologie
Beweeglijkheid
Mechanismen celdeling
En andere kenmerken
Samenwerking van eukaryoten en prokaryoten in de natuur: Korstmos. Een combinatie van algen, schimmels en
cyanobacteriën. Algen zijn foto-autotroof. Schimmels zijn chemoheterotroof en produceren water voor de
algen, op oppervlak mineralen uit gesteente halen, nutriënten. Hyfen = meercellige draden overgaand in een
netwerk. Mycelium = meerdere hyfen, onder een paddenstoel.
Hoofdstuk 3
Organismen zijn er in alle vormen, maar de vorm zegt erg weinig over de eigenschappen van het organisme.
Bacteriën kunnen staaf, coc, spiril ~, spirocheet (inwendige flagel) en nog vele andere vormen hebben.
In de cel van een prokaryoot zit meer RNA dan DNA, want in ribosomen zit veel RNA. Bij veel ribosomen is het
een actieve cel. En zo’n 96% van de cel bestaat uit macromoleculen als eiwitten, vetten, DNA, RNA en
sachariden. Weinig monomeren en anorganische componenten.
Polysachariden zitten vooral aan de buitenkant en in vacuoles. Bacteriën hebben bij goede omstandigheden een
goed gevulde vacuole met organische verbindingen zodat ze die kunnen gebruiken bij voedselschaarste
Er is een enorme variatie in de grootte van bacteriën. Sommige bacteriën zijn zelfs met het blote oog
waarneembaar. Voor sommige organismen is deze lengte essentieel om in twee ecosystemen aanwezig te
kunnen zijn, of om verbindingen op te slaan in vacuolen.
Welke vormen van zwavel en stikstof zijn geschikt voor de ademhaling? Alle verbindingen met zwavel waar
elektronen aan de buitenste ring kunnen worden onttrokken. En voor stikstof alle verbindingen waar elektronen
aan de buitenste ring toegevoegd kunnen worden. Dit omdat zwavel als energiebron fungeert en stikstof is voor
de ademhaling.
Voordelen van het klein zijn voor prokaryoten:
Hoe kleiner de cel, des te groter wordt de verhouding oppervlakte/volume.
Hierdoor is er een hogere voedselopnamesnelheid per eenheid celvolume.
Kleinere cellen groeien sneller dan grote cellen.
Nadelen van het klein zijn voor prokaryoten::
Er is een minimale grootte voor prokaryoten om alle benodigde celbestanddelen in de cel te krijgen.
Hoe groter oppervlak om energie te absorberen meer energie
Het celmembraan van prokaryoten bestaat uit een dubbele laag fosfolipiden met hierin membraaneiwitten.
Periferale membraaneiwitten zitten aan één kant van het membraan en werken samen met integrale eiwitten
die door het membraan heen lopen. Sterolen (in eukaryoten) en hopanoïden (in prokaryoten) zorgen voor
stabiliteit van de membranen en zijn moeilijk afbreekbaar. Archaea bevatten geen vetzuren maar isopropeen
eenheden. Een dikke laag isopreeneenheden is steviger en kan tegen extreme omstandigheden. Ook hebben
archaea geen dubbel membraan. Bacteriën en eukaryoten hebben een ester, archaea hebben een ether.
Functies van het cytoplasmamembraan:
Selectief permeabele wand houdt verbindingen binnen en buiten
o Hydrofoob deel vormt barrière.
o Hydrofiel deel is geladen, houdt ionen tegen.
o Passief transport via diffusie, snelheid afhankelijk van concentratieverschil
o Actief transport via transporteiwitten.
Eiwitten in het membraan zijn betrokken bij tal van processen (transport, energiegenerering) en receptoren
(chemotaxis)
Energieconservering: energiegenerering en opwekken van proton motive force.
Een bacterie heeft geen mitochondriën cytoplasma is heel belangrijk tentamenvraag
Proton motive force: Een verschil in protonenconcentratie over het membraan. Meer protonen buiten de cel dan in
het cytoplasma. Deze PMF ontstaat door het transport van elektronen door de ademhalingsketen. Hierbij komt
energie vrij en met deze energie worden protonen naar buiten gestuwd.
Elektronen van lage naar hoge redoxpotentiaal: komt energie vrij, energie wordt gebruikt om H+ ionen van
cytoplasma naar buiten te laten gaan.
ATPase: brengt protonen terug het cytoplasma in, komt energie vrij, maken ATP komt door stroming van protonen
terug het cytoplasma in
Fermentieve organismen: kunnen suikers afbreken via glycolyse.
Anti-oxidant is in staat om door een reactie schadelijke vrije radicalen te neutraliseren, die door hun ongepaarde
elektron sterk geneigd zijn moleculen uit de omgeving te oxideren.
Transporteiwitten:
Antiporter:
Symporter:
Uniporter:
Zowel in Gram+ als in Gram- bacteriën komen ATP-binding casette transporters voor. De binding aan eiwitten vindt
plaats in het periplasma. Dit bevindt zich tussen de peptidoglycaanlaag en het celmembraan in.
De peptidoglycaanlaag beschermt het cytoplasmamembraan tegen openbarsten. Bij Gram+ is deze laag veel dikker
dan bij Gram-. Gram- heeft in tegenstelling tot Gram+ een buitenmembraan. De peptidoglycaanlaag zit aan het
celmembraan vast door middel van teichoïinezuren en lipoteichoïnezuur. De stevigheid van peptidoglygaan komt
voort uit de structuur. Het ussn web waarbij om en om moleculen aan elkaar vast zitten en zo een keten vormen (Nacetylglucosamine en N-acetylmuramic zuur). Deze ketens worden met elkaar verbonden door 4 aminozuren die een
binding met elkaar aangaan (L-alanine, D-glutaminezuur, diaminopimelinezuur, D-alanine)
Lysozymen breken de peptidoglycaanlaag open. Water diffundeert naar binnen en de cel knapt open (lysis).
Wanneer de cel niet open knapt is er sprake van een protoplast. Lysozymen komen voor in tranen, speeksel, bloed,
eieren en witte bloedcellen.
Gram- bacteriën hebben lipidepolysacchariden op het buitenmembraan. Deze hebben een negatieve lading,
verstevigen de membraanstructuur, beschermen de bacterie tegen aanvallen van buitenaf en vaak zijn deze lipiden
giftig. LPS bestaan uit Lipide-A (vetachtige vastmaker), core-polysacharide, O-specifiek polysacharide: korte
suikerketen aan buitenkant
De buitenmembraan van Gram- bacteriën is permeabeler dan het cytoplasmamembraan doordat er meer
transporteiwitten aanwezig zijn. Ook het periplasma bevat veel eiwitten.
Periplasma bevat veel eiwitten: hydrolytische enzymen, bindingseiwitten, chemoreceptoren; ze worden aangemaakt
in het cytoplasma
Slijmlaag op organismen:
Bestaat uit polysachariden of eiwitten
Genetisch bepaald
Vorming hangt af van milieuomstandigheden
Biedt bescherming tegen uitdroging, fagocytose, virussen en remt diffusie naar de cel.
Zorgt voor hechting aan oppervlakten. (biofilm) Een voorbeeld hiervan is tandplak.
Pili:
Fibrillen:
Flagellen:
Korter dan flagellen
Functies:
o Contact tussen bacteriën
o Hechting
o Transport van elektronen
Enkele micrometers lang
15-20 micrometers lang
Eiwitten
Eiwitten
Functie: hechting aan
Functie: beweging
oppervlakten
Belangrijk in het metabolisme: generering van energie (ATP) gaat via oxidatie van een stof (elektrondonor) en
reductie van een stof (elektronacceptor). Ten gevolge van het transport van de elektronen door een ademhalings- of
respiratieketen, kan ATP gemaakt worden
Reserve stoffen opgeslagen in insluitsels:
Organische polymeren:
o Koolstofbron
o Energiebron
Fosforus:
o Energiebron in energiegebrekkige situaties.
Zwavel:
o Energiebron
Ijzer:
o Onduidelijke rol. Wel hebben alle organismen met ijzeropslag gelijke eigenschappen.
Micro-aërofiel: leven alleen bij lage zuurstofconcentraties.
Magnetotactische bacteriën hebben allemaal flagellen, zijn Gram-, reageren op O2-concentratie en zijn allemaal
micro-aërofiel.
Organismen met een gasvacuole kunnen deze gebruiken om omhoog en omlaag te gaan.
Sporen zijn overlevingsstructuren van bepaalde bacteriën die veranderingen in het milieu kunnen overleven. Bij
gebrek aan nutriënten of andere ongunstige veranderingen wordt een spore gevormd. Deze veranderingen kunnen
hitte, pH, chemicaliën, uitdroging,…., zijn. In spore is een laag watergehalte. Spore kunnen alleen gevormd worden in
aanwezigheid van voldoende calcium-ionen. Spore hebben geen fysiologische activiteit.
Peritrichous: flagellen aan alle kanten van bacterie.
polair: een flagel
Lofotrichous: meerder flagellen aan gedeelte van oppervlak die ronddraaien
De flagellen draaien door eiwitten, die weer worden aangestuurd door proton motive force. Er is draaiing van 2
ringen, en draaiing van eiwitten in cytoplasma. Flagellen bewegen niet continu, heeft te maken met sterkte van PFM.
Verschillen in draaiirichting
Vorming van flagel: meer dan 50 genen, opbouw vanuit cytoplasmamembraan, flagelline gevormd in cytoplasma
Bacteriën kunnen bewegen door middel van vacuolen, flagellen en polysacharide slijmuitscheiding.
Flagellen in Archaea: veel voorkomend, dunner dan in bacteriën, meerdere (glyco)eiwitten, structuur en aanhechting
onbekend.
Wanneer er een aantrekkende stof aanwezig is maakt een bacterie langere “runs” en minder duikelingen. Er is
sprake van chemo/fototaxis.
Aerotaxus is de beweging van of naar zuurstof.
osmotaxus: van hoge naar lage concentratie
hydrotaxus: naar vocht toe
Hoofdstuk 4
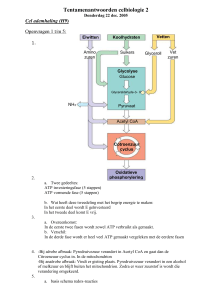
In de cel vinden verschillende processen plaats. Anabolisme (biosynthese) en catabolisme zijn hier voorbeelden
van. Catabolisme levert energie voor de biosynthese, beweging en transport. Al deze processen samen zijn het
celmetabolisme. Bij het celmetabolisme komen ook afvalstoffen vrij. Dit zijn verschillen verbindingen waaronder
CO2, fermentatieproducten en gereduceerde elektronenacceptoren.
Veel prokaryoten hebben koolstof nodig. Sommige als organische verbinding; deze organismen zijn heterotroof.
Anderen in de vorm van CO2. In het geval van CO2 is er ook een (an)organische verbinding nodig. Dit is omdat
CO2 via glucose omgezet wordt in celmateriaal. Hiervoor is er een verbinding nodig met elektronen om de
koolstof te reduceren. Dit proces waarbij CO2 omgezet wordt in celmateriaal heet de Calvin cyclus.
Ijzer is een super belangrijk element voor organismen, met name in de ademhalingsketen. Sideroforen zijn
sterke verbindingen die een verbinding met ijzer aan kunnen gaan. Deze zijn vaak aanwezig onder oxische
omstandigheden, wanneer er vrij ijzer aanwezig is. Ook kan ijzer binden aan mineralen. In anoxische
omstandigheden is ijzer vaak opgelost.
Exergonisch: vrije energie vrijlaten; Endergonisch: vrije energie consumeren
Metalen zijn van groot belang voor organisme, omdat deze vaak in het actieve centrum van eiwitten en
enzymen voorkomen. Ijzer speelt daarnaast een grote rol bij de ademhaling, maar wordt in de ademhaling door
sommige organismen vervangen door mangaan (Mn).
Anoxigene fototrofie: niet via water (zoals in oxygene/normale fotosynthese), via andere verbinding elektronen
reduceren vraag op tentamen!
Oxidatie/reductie reacties zijn betrokken bij de energiegenerering en energieconservering. Oxidatie is het
verlies of de afgifte van elektronen. Reductie is de opname van elektronen. Een oxidatiereactie is altijd
gekoppeld aan een reductiereactie. Bij een oxidatie/reductiereactie is zuurstof niet essentieel. Om aan te geven
hoe graag een stof geoxideerd/gereduceerd wordt is er de reductiepotentiaal ook wel redoxpotentiaal
genoemd. O2 heeft een erg hoge redoxpotentiaal en is daardoor een goede elektronenacceptor. Des te
positiever de potentiaal, des te liever neemt een stof elektronen op. Des te negatiever de potentiaal, de te
liever staat een stof elektronen af. Sommige stoffen kunnen afhankelijk van de stof waarmee ze reageren zowel
elektronen afstaan als opnemen.
Wanneer er een stof gereduceerd wordt, moet er ook een stof geoxideerd worden. Hoe groter het
potentiaalverschil tussen deze twee stoffen is, des te groter is de energie die vrij komt. De grootte van het
verschil kan afgelezen worden in de redoxtoren. Hoe groter het verschil tussen donor en acceptor, des te meer
energie komt vrij.
Enzymremming kan op meerdere manieren plaatsvinden: Competitieve remming, niet-competitieve remming
en denaturering. Competitieve remming houdt in dat er een compititieve inhibitor het enzym blokkeert. Deze
gaat op het enzym zitten waardoor deze niet meer met het substraat kan binden waar het enzym eigenlijk voor
is bestemd. Dit wordt vaak gebruikt in medicijnen. Niet-competitieve remming houdt in dat het enzym wel aan
het substraat kan binden, maar dat er ook een tweede verbinding aan het enzym bindt. Deze tweede verbinding
gaat vervolgens de enzymwerking tegen. Deze tweede verbinding is vaak een metaalion of antibiotica. Als
laatste kan er ook sprake zijn van denaturering. Door een verandering in pH of temperatuur kan de vorm van
het enzym veranderen en komt daardoor ook de werking te vervallen.
Catabolisme:
Energie wordt gemaakt in een exogene reactie door middel van substraat fosforylering (ATP-vorming) Dit
gebeurd onder andere in de glycolyse. Ook wordt er energie verkregen uit de ademhalingsketen. Dit heet
oxidatieve fosforylering. Elektronen zijn hiervoor noodzakelijk.
Elektronen worden opgeslagen op elektronendragers. In cellen zijn verschillende elektronendragers aanwezig.
ADP, NAD+, NADP+, FAD, FMN, coenzym Q en cytochromen. Deze elektronendragers zijn maar beperkt aanwezig
en worden telkens opnieuw gebruikt. gereduceerde vormen moeten dus steeds geoxideerd worden. De
elektronen gaan dan naar een terminale elektronenacceptor, zoals O2.
Verbindingen als ATP zijn enkel voor korte opslag, direct gebruik. Voor langdurige opslag worden onoplosbare
polymeren aangemaakt, zoals vetten, glycogeen of polyhydroxyboterzuur. Bacteriën gebruiken ook fosforus en
zwavel als verbindingen om energie mee op te slaan. Deze verbindingen slaan ze op in vacuolen.
Twee soorten energiegenerering: fermentatie en respiratie. Fermentatie is ATP vorming door
substraatgebonden fosforylering. Respiratie is ATP vorming door oxidatie fosforylering ten gevolge van proton
motive force die opgebouwd is over het celmembraan.
Glycolyse is een vorm van fermentatie bestaande uit drie delen. De gehele glycolyse vindt anoxisch plaats. In
het eerste deel wordt ATP geïnvesteerd, in het tweede deel komt ATP vrij en ook ontstaat er NADH. In het
derde deel ontstaan de fermentatieproducten. Er ontstaat maar 2 ATP per mol. De rest van de energie zit in de
fermentatieproducten. Wanneer er wel zuurstof aanwezig is kunnen deze producten verder afgebroken worden
in de citroenzuurcyclus.
In de citroenzuurcyclus worden de koolstofatomen van pyruvaat volledig afgebroken tot CO2. De elektronen die
hierbij vrijkomen worden opgeslagen als NAD+ en FAD. Deze twee verbindingen zijn beperkt beschikbaar en
moeten daarom geoxideerd worden. Dit gebeurd op het cytoplasmamembraan. In het membraan zitten
eiwitcomplexen. De verbindingen komen aan bij complex I en complex II en worden hier geoxideerd. De
vrijgekomen elektronen worden door een elektronentransportketen door het membraan geleid naar de
uiteindelijke elektronenacceptor. Hierbij komt het langs verschillende eiwitten met ieder een andere
redoxpotentiaal. Door de steeds lagere potentiaal komt er steeds energie vrij. Voor elke 2 elektronen die bij
complex I opgenomen worden, worden 4 protonen doorgelaten. Hierdoor ontstaat een protonenovermaat
buiten de cel. De energie die hierdoor ontstaat (pH gradiënt en elektrochemische potentiaal) heet de proton
motive force. Ook komt er energie vrij bij het laatste complex door het verschil in potentiaal tussen donor en
acceptor.
Proton motive force wordt gebruikt voor ATP-productie, actief transport en aandrijving van flagellen. De
aandrijving van flagellen gebeurd door ATP-ase. ATP-ase is reversibel. Dit houdt in dat het zelf een proton
motive force kan creëren.
Anaërobe respiratie: in plaats van zuurstof worden andere elektronenacceptoren gebruikt. Deze soort reacties
zijn ecologisch en industrieel gezien van groot belang. Afbraak van tetrachlooretheen is van groot belang voor
het milieu. Bacteriën gebruiken deze verbinding om mee adem te halen. Methanogenese vindt plaats in de pens
van herkauwers, hierbij wordt CH4 gebruikt.
Hoe kan organel toch hogere hoeveelheid protonen naar binnen? Protonen kunnen ook van binnen naar buiten.
Remmers (CO en CN-) en ontkoppelaars (oplosmiddelen: dinitrofenol)
Hoofdstuk 5
Groot aantal reacties zorgt samen voor toenamen in celbestanddelen, zoals eiwitten, ribosomen, celwandmateriaal,
nucleïnezuren,…. Hierdoor neemt de celgrootte toe en neemt ook het aantal cellen toe. Belangrijk bij toename van
het aantal cellen is de generatietijd van belang. Dit is de tijd die organismen nodig hebben om te delen. Deze hangt
af van genetische en milieufactoren.
De binaire deling gaat van start afhankelijk van de lengte en de grootte van het organisme. Bij een bepaalde
lengte/grootte wordt de DNA deling in gang gezet. Ook moet de peptidoglycaanlaag oplossen voordat het
membraan gesplitst kan worden. Hiervoor zijn autolysines (gereguleerd). Bij gram+ coccen wordt de
peptidoglycaanlaag op twee plekken opgelost. Bij staafvormige bacteriën zijn autolysines op meerdere plekken
actief.
Invloed van fysische en chemische factoren op groei en activiteit
Temperatuur
Waterbeschikbaarheid
Zoutconcentratie
Zuurgraad
Zuurstof
Straling
Druk
De microbiële groeicyclus bestaat uit 4 fasen. De lag fase is de aanpassingsperiode. De exponentiële fase is de groei,
hierbij kan de maximale groei bepaald worden. Aan de exponentiële fase komt een eind door voedseltekort,
productie van groeiremmende verbinding of door elektronacceptor limitatie. Bij de stationaire fase is er geen
toename van het aantal cellen, de reservestoffen worden verbruikt. De afstervingsfase komt door ophoping van
afvalproducten en pH daling.
De nadelen van microscopische tellingen zijn dat je dode en levende cellen telt, kleine cellen moeilijk te tellen zijn en
de dichtheid groter dan 106/ml moet zijn. Het aantal mo bepaald via directe microscopische telling en via
plaatmethode zijn vaak niet gelijk.
Organismen zijn in 5 groepen in te delen met verschillende temperatuuroptima.
Psychrofiel - 4 C – oceaan
Psychrotolerant – 25 C – koelkast
Mesofiel - 39 C - menselijke pathogenen
Thermofiel - 60 C - overal --> maar activiteit zal niet overal evenveel zijn
Hyperthermofiel - 88 C - hypterthermofiel
Extremofiel
Mesofielen en thermofielen hebben enzymen met zelfde functie, maar samenstelling van eiwit bij
aminozuurvolgorde is anders.
Structuur en adaptaties bij lage temperatuur
Psychrofiele bacteriën hebben enzymen met lage temperatuursoptima. Deze enzymen hebben verschillen in
secundaire structuur.
Psychrofiele bacteriën hebben onverzadigde vetzuren (dubbele bindingen in de lipiden in membranen),
daardoor blijven membranen langer ‘vloeibaar’.
‘Cold-shock proteins’
Structuur en adaptaties bij hoge temperatuur (boven de 65 graden leven alleen prokaryoten)
Hittestabiele enzymen en ribosomen. o.a. door kleine veranderingen in aminozuursamenstelling,
aanwezigheid zoutbruggen en vorming eiwitstabiliserende stoffen.
Verzadigde vetzuren (enkele bindingen) in de lipiden in membranen, membranen blijven langer stabiel
De interne pH van mo ligt tussen 5/6 en 7/8, met uitzonderingen. Alkalofiel heeft een hoge pH.
Mo hebben een bepaalde hoeveelheid water buiten de cel nodig om actief te kunnen zijn, de concentratie van
opgeloste stoffen speelt daar ook een rol bij. Bij een hypertonische oplossing (lage wateractiviteit) stoppen de
meeste mo met groeien (dehydratie). Sommige bacteriën kunnen de uitstroom van water compenseren door de
productie van ‘compatible solutes’. Hierdoor stijgt hun interne osmotische concentratie. Andere organismen
(halofiele bacteriën en Archaea) pompen K+ ionen naar binnen. Halotolerante (iets minder dan halofiel) en Halofiele
organismen kunnen in extreem hoge zoutconcentraties leven.
Anoxisch systeem is een systeem zonder zuurstof, zoals moeras, darm en mond.
Zuurstof afhankelijke mo:
obligaat aërobe mo: groeien alleen met O2 inclusief micro-aërofiele (leven bij lage O2 concentratie maar
hebben het wel nodig)
Facultatief (an)aërobe mo: kunnen met en zonder zuurstof, maar heeft betere groei met O2 want zuurstof
staat helemaal onderin de redoxtoren. Gist in afwezigheid van zuurstof, alleen de glycolyse vindt plaats, en
die genereert maar dan maar 2 ATP bij alleen fermenteren.
Aërotolerante anaërobe mo: ze hebben geen zuurstof nodig, maar het is ook niet schadelijk als het er wel is.
Obligaat anaërobe mo: gaan dood met O2 omdat in de cel tijdens respiratie van zuurstof tot water
radicalen/toxische verbindingen worden gevormd. Is overal waar de aanvoer van zuurstof limiterend is.
Zuurstof is op verschillende niveaus remmend:
populatieniveau: ‘thermodynamisch’ (niet echt remmend) vanwege plaats onderin redoxtoren
enzymniveau: biochemisch, remt specifieke eiwitten
molecuulniveau: chemisch met directe oxidatie, triplet naar singlet (als singlet is zuurstof erg reactief)en
radicaalvorming
Hoofdstuk 8
De meeste reactie in katalytische systemen gebeuren vrijwel niet in afwezigheid van enzymen. Enzymen zijn
zeer krachtige en specifieke katalysatoren. Een heel specifiek enzym die voor een enorme versnelling zorgt heet
ook wel proteolytisch enzym. Zeer specifieke enzymen zijn proteasen.
Veel enzymen hebben een cofactor nodig voor hun activiteit. Cofactoren zijn te verdelen in metalen en
organische moleculen. Wanneer een co-enzym stevig gebonden is noemt men het een prosthetische groep.
Wanneer het co-enzym alleen tijdens de katalyse gebonden is spreekt men van een co-enzym.
Enzymen kunnen energie van de ene vorm omzetten in een andere vorm. Zo zetten enzymen bij bepaalde
kwallensoorten potentiele energie om in lichtenergie.
De richting van een reactie wordt bepaald door het vrije energieverschil. Enzymen verlagen de
activeringsenergie en als bijgevolg daarvan stelt het evenwicht van de reactie zich sneller in. De reactiesnelheid
wordt vertienvoudigd. Het enzym verandert niets aan het uiteindelijke evenwicht, maar alleen hoe snel dit
bereikt wordt.
Eigenschappen van het katalytisch centrum van een enzym:
Het katalytisch centrum van een enzym is een driedimensionale inkeping of gat in het enzym.
Aminozuren die betrokken zijn bij het binden van substraten noemt men katalytische groepen.
Katalytische centra zijn unieke micro-omgevingen.
Het katalytisch centrum neemt een relatief klein deel van het enzym in beslag.
Substraten worden via meerdere zwakke reversibele interacties specifiek gebonden aan het katalytisch
centrum en worden optimaal ten opzichte van elkaar georiënteerd.
De specificiteit van een binding wordt bepaald door de precieze ruimtelijke oriëntatie van atomen in het
katalytisch centrum.
Enzymen zijn flexibel en de vorm van het katalytisch centrum kan zich aanpassen na binding van het
substraat.
Aminozuren die in de primaire structuur ver uit elkaar liggen kunnen samen het katalytisch centrum vormen.
Het enzym bevordert de transitietoestand van het substraat middels:
Elektrostatische interacties
Waterstofbruggen
Van Der Waals interacties
Hydrofobe interacties
De energie die vrijkomt bij de binding van het substraat leidt tot een verlaging van de activeringsenergie.
Hierdoor wordt het evenwicht eerder bereikt.
De studie van de snelheden waarmee enzymgekatalyseerde reacties verlopen noemt met enzymkinetiek.
Michaelis-Menten vergelijking omschrijft de kinetische eigenschappen van veel enzymen. De curve waarin de
reactiesnelheid wordt weergegeven vlakt altijd af, dit omdat er een evenwicht wordt bereikt.
Rekenshit nog even bekijken in de dia’s.
Sequentiële reactie: alle substraten moeten gebonden zijn aan het enzym voordat er een product gevormd
wordt.
Dubbele verplaatsingsreactie: een of meerdere producten verlaten het enzym voordat alle substraten gebonden
zijn. Er is sprake van vorming van een intermediair enzym.
Allostere enzymen: enzymen met meerdere sub-eenheden en meerdere actieve centra. De binding van een
substraat aan één eenheid beïnvloed de eigenschappen van een andere eenheid.
Enzymen kunnen geremd worden door specifieke moleculen. Hierbij maken we onderscheid tussen
irreversibele remming en reversibele remming. Bij irreversibele binding is de remmer zeer sterk gebonden aan
het enzym en bij reversibele remming is er een snelle dissociatie van het enzym-remmer complex.
Hoofdstuk 13
Fotosynthese vindt niet alleen in planten plaats, maar voor minstens 50% van alle fotosynthese, in bacteriën. Bij
fotosynthese komt niet altijd zuurstof vrij. Er bestaan vele soorten waarbij geen zuurstof vrijkomt.
Lichtenergie wordt omgezet in chemische energie. De energiebron hiervoor is licht, er is sprake van fototrofe
organismen. Er kunnen twee verbindingen worden gebruikt.
CO2: fotoautotrofe. Er is een elektronendonor nodig wanneer CO2 wordt gebruikt.
Organische verbindingen: fotoheterotrofe.
Anoxigene fotosynthese: Licht wordt enkel gebruikt om ADP tot ATP om te zetten. Verder wordt de energie uit
de reductie van H2S gehaald.
Oxigene fotosynthese: Licht wordt gebruikt voor 2 doeleinden. Licht wordt gebruikt om zuurstof te oxideren en
zo elektronen vrij te maken voor de reactie. En licht wordt gebruikt om ADP om te zetten in ATP.
De oxidatietoestand van een stof geeft aan hoe geoxideerd of gereduceerd een stof is. Je moet de
oxidatietoestand van een stof kunnen bepalen aan de hand van de volgende regels:
O2 en H2 zijn altijd neutraal.
In verbindingen is de oxidatietoestand van O vrijwel altijd -2 en die van H +1.
De som van alle oxidatietoestanden in een neutraal molecuul is altijd nul.
In een ion is de som van alle oxidatietoestanden samen gelijk aan de lading van dat ion.
In simpele koolstofverbindingen kan de oxidatietoestand van C berekend worden door het optellen van het
aantal H en O atomen met behulp van punt 2.
In organische verbindingen met meer dan één C mag je alle oxidatietoestanden gelijk laten zijn.
Ken het principe van het Z-schema waarin de oxygene fotosynthese wordt uitgelegd.
Eerst fotosysteem II waarbij de redoxpotentiaal afneemt, daarna neemt de redoxpotentiaal weer toe.
De elektronen gaan terug via een keten, en komen zo terug in fotosysteem I. Het is een niet-cyclische
elektronenstroom (geneert ‘proton motive force’), ADP wordt omgezet in ATP. Onder invloed van licht
neemt de redoxpotentiaal weer af. Vervolgens neemt de redoxpotentiaal weer toe waarin NAD(P)
omgezet wordt in NAD(P)H voor reductie van CO2.
En ken ook de halve cirkel waarin het principe van de anoxygene fotosynthese wordt uitgelegd.
De anoxygene fotosynthese vindt plaats in het cytoplasmamembraan van een paarse bacterie. Rood of
infrarood licht komt aan buitenkant (periplasma) van membraan aan. De elektronendonor wordt sterk
(redoxpotentiaal neemt af). Er is een cyclisch elektronentransport.
Ook de Calvin Cyclus moet bekend zijn. Deze bestaat uit drie stappen:
1. Carboxyleringsfase: CO2 met C5 wordt omgezet in 2 C3.
2. Reductiefase: ATP en NADPH worden toegevoegd en er ontstaat een andere C3 binding.
3. Regeneratiefase: ATP wordt toegevoegd en 10 C3 wordt opgezet tot 6 C5. En de C5 kan weer reageren met
CO2.
De eindstof van deel twee kan ook omgezet worden in fructose. De Calvin cyclus heet ook wel omgekeerde
glycolyse omdat veel stappen de omgekeerde reacties van de glycolyse zijn.
Chemo-organotrofe micro-organismen halen hun energie uit glucose en andere organische verbindingen. Een
deel van de energie wordt gewonnen door glycolyse en citroenzuurcyclus en het grootste deel van de energie
wordt gewonnen in oxidatieve fosforylering bij de ademhalingsketen.
Elektronentoren
Valt het erboven naar beneden: komt energie vrij
Valt het er beneden naar boven: organismen energie investeren, anders niet vanzelf omhoog
Vorming van NAD(P)H)
1. Direct van de anorganische verbinding
2. Via een omgekeerd elektronentransport (meeste chemolithotrofe organismen): dit kost energie; organismen
volgen de wetten van de thermodynamica.
Waterstofoxidatie:
Zeer snelle groei
Facultatief chemolitho-autotroof of chemo-organo-heterotroof
Alleen groei bij lage zuurstofconcentraties. De hydrogenases zijn zuurstofgevoelig doordat er erg veel
ijzeratomen in aanwezig zijn. Deze metalen liggen aan de buitenkant. Zuurstof zou hier direct mee reageren.
Calvin cyclus
H2 bijna helemaal afkomstig van fermentatieve omzettingen
Gereduceerde S-verbindingen kunnen elektronen leveren om energie te genereren. Hierbij ontstaat SO42-. Aan
de hand van oxidatietoestand moet je kunnen uitrekenen wat het aantal vrijgekomen elektronen is. SO42- heeft
geen elektronen meer in de buitenste ring. Organismen kunnen hier geen elektronen meer aan onttrekken.
Sommige organismen slaan S op in vacuolen om energie mee te genereren wanneer dit nodig is.
Nitrificerende organismen hebben een lage groeisnelheid en groeiopbrengst:
Autotroof, er is veel ATP nodig voor Calvin cyclus
Het potentiaalverschil tussen NH4+ en O2 is erg klein
Nitrificerende bacterie gebruikt CO2 als C-bron
NAD(P)H is nodig voor celopbouw in Calvin cyclus
Er vindt omgekeerd elektronentransport plaats om NAD(P)H te maken, dit kost energie.
Er gaat dus nogal veel energie verloren.
Zure regen heeft een pH>7 en is dus niet zuur, maar door de aanwezige ammonium vormt zure regen een
goede voeding voor nitrificerende bacteriën. Deze nitrificerende bacteriën zetten ammonium om in nitriet
waardoor er verzuring komt op gesteentes.
Oxidatie van ammoniak (NH3) in de afwezigheid van O2. Gist heeft geen peptidoglycaan en heeft een vacuole
met speciaal membraan anammoxosoom. Dit membraan beschermt de cel tegen toxisch intermediair H2N=NH2.
Het is autotroof. Ammoniak wordt geoxideerd. De omzetting vindt plaats in de vacuole. Komt in veel plaatsen
voor waar veel NO3 aanwezig is, en geen zuurstof. Zuurstof werkt remmend. Dit kan grote betekenis hebben
voor kennis over stikstofkringloop.
Vastlegging van stikstof alleen door prokaryoten.
Meeste nitrogenases zijn extreem gevoelig voor zuurstof:
Azotobacter: o.a. slijmlaag met water waardoor diffusiesnelheid van O2 verlaagd wordt.
Cyanobacteriën: vormen heterocysten, dat zijn grote, dikwandige cellen zonder pigmenten, die in staat
zijn om luchtstikstof op te nemen en chemisch te fixeren.
Hoofdstuk 14
Fermentatieve organismen vind je daar waar geen andere elektronenacceptoren aanwezig zijn dan de
eigengemaakte pyruvaat. Wanneer er wel andere elektronenacceptoren aanwezig zijn is de concurrentie te
groot. Fermentatieve organismen oxideren organisch verbindingen in tegenstelling tot andere organismen niet
helemaal tot CO2. Andere kenmerken van deze organismen zijn:
Energie alleen via substraatfosforylering
NAD+ regenerering door vorming en uitscheiding van fermentatieproducten.
Pyruvaat neemt elektronen op en wordt omgezet tot bijvoorbeeld lactaat.
De elektronen die door pyruvaat worden opgenomen gaan ergens naartoe. De verbindingen die uit pyruvaat
worden gevormd kunnen namelijk door andere fermentatieve organismen worden gebruikt. Dit heet
secundaire fermentatie. Alle producten die bij fermentatie ontstaan, op CO2 na, bevatten nog energie en
kunnen dus door andere fermentatieve organismen worden gebruikt.
H2, CO2 en acetaat die worden gevormd kunnen door methanogene organismen in methaan worden omgezet.
Syntrofie is een metabool proces waarbij minimaal twee verschillende organismen moeten samenwerken om
een verbinding af te breken. Dit vindt vaak plaats bij processen waarbij fermentatie plaats vindt.
Stel dat er energie toegevoegd moet worden voor een bepaalde reactie, maar deze energie is veel te hoog voor
een organisme om te leveren. Als een ander organisme dan een reactie tot stand breekt waarbij heel veel
energie vrij komt dan is de eerste reactie wel mogelijk. Een reactie kan dan van een endogene naar exogene
reactie gaan.
Chemolitotrofe organismen kunnen ademhalen met waterstof, zwavel, stikstof en ijzer. Sommige producten
hiervan kunnen weer door andere organismen worden gebruikt, zoals door denitrificerende bacteriën en
sulfaatreducerende bacteriën..
Aërobe organismen kunnen altijd de meeste energie genereren met hun ademhaling, omdat zuurstof onderaan
de “toren” staat. Aërobe organismen zullen hierdoor de meest dominante organismen zijn.
Dissimilatief metabolisme: gebruiken de verbinding als elektronenacceptor:
Grote hoeveelheden nodig
Verbinding wordt in gereduceerde vorm uitgescheiden.
Assimilatief metabolisme: verbouwen de verbinding tot celmateriaal:
Kleine hoeveelheden nodig
Geen uitscheiding
Acetogene en methanogene organismen zijn in staat om CO2 te gebruiken voor de ademhaling. Ze gebruiken
hierbij H2 als elektronendonor. Methanogene organismen behoren tot de archaea en zijn strikt anaëroob.
Hoofdstuk 15
Vrije energie wordt verkregen uit:
Zonlicht: fototrope organismen nemen zonlicht op gedurende de fotosynthese.
Oxidatie van componenten: chemotropen oxideren voedselmateriaal. Dit materiaal wordt gegenereerd door
fototrope organismen.
Glycolyse:
Vindt plaats in het cytoplasma
Pyruvaat dat wordt gevormd heeft verschillende bestemmingen:
o Lactaat: leidt tot verzuring van spieren bij sporten
o Ethanol: fermentatie, zoals bij een gist
o Acetyl CoA: verdere oxidatie via de citroenzuurcyclus
Katabole reacties: brandstoffenbruikbare energie, H2O en CO2
Anabole reacties: bruikbare energie en kleine moleculencomplexe moleculen
Amfibole reacties: zowel ketabool als anabool, afhankelijk van de energietoestand van de cel.
De citroenzuurcyclus wordt gebruikt om C2 groepen volledig te oxideren en daarbij 8 hoog energetische
elektronen te genereren in de vorm van NADH en FADH2. Ook is de citroenzuurcyclus een bron voor biosynthese
dankzij de verbindingen die geproduceerd worden. Omgekeerd zet de biosynthese pyruvaat om in oxaalacetaat
om te zorgen dat de intermediairen in de citroenzuurcyclus niet opraken. Deze reactie kost ATP en kan alleen
plaats vinden in aanwezigheid van het pyruvaatcarboxylase enzym. De reactie met pyruvaatcarboxylase kan
plaats vinden dankzij een koppeling van een thermodynamisch ongunstige reactie aan een thermodynamisch
gunstige reactie. Net als dat bacteriën samenwerken voor een bepaalde reactie gebruikt dit enzym een andere
reactie om de omzetting tot oxaalacetaat mogelijk te maken. Een voorbeeld is het koppelen van een reactie aan
ATP-hydrolyse.
Waarom is ATP zo energierijk:
In ATP zitten 3 fosfaten aan elkaar gekoppeld. De buitenste heeft 3 resonantie mogelijkheden en de
andere zelfs maar twee. Wanneer de fosfaten los zouden zitten zouden ze allemaal 4
resonantiestructuren hebben. Dat is veel gunstiger.
Daarbij stoten de ladingen op de fosfaatgroepen elkaar af.
Door hydratatie zijn de fosfaten los stabieler.
ATP reageert dus heel graag tot ADP+Pi, en hier komt veel energie bij vrij.
Er is maar een beperkte hoeveelheid ATP in ons lichaam en deze moet na gebruik weer opnieuw worden
omgezet.
Vetten zijn geschiktere brandstoffen dan glucose, omdat de koolstofatomen in vetten meer gereduceerd zijn.
Gereduceerde moleculen leveren meer energie op, omdat de elektronen die aan zuurstof worden overgedragen
vrije energie opleveren.
Extractie van vrije energie uit voedselmoleculen in de vorm van ATP:
Tijdens het katabolisme wordt een beetje ATP gegenereerd, maar het overgrote deel van de vrije
energie wordt tijdelijk opgeslagen in “reductie-equivalenten”.
De “reductie-equivalenten” hebben een hoge overdrachtspotentiaal en worden overgedragen naar
NAD+ en FAD. Hierbij worden NADH en FADH2 gevormd.
Vervolgens worden de “reductie-equivalenten” overgedragen aan de elektronentransportketen.
De beschikbare vrije energie wordt in de elektronentransportketen opgeslagen in de vorm van een
protonengradiënt, en deze gradiënt drijft de synthese van ATP..
Oxidatieve fosforylering vindt plaats in mitochondriën en houdt in dat er een ionengradiënt over een membraan
wordt gegenereerd. Deze ionengradiënt wordt weer gekoppeld aan een ATP-synthese.
Bij eukaryoten vindt de citroenzuurcyclus plaats in de matrix van een mitochondrië. Bij volledige oxidatie van
glucose in de mens ontstaat 30 ATP.
Fotosynthese en oxidatieve fosforylering hebben veel overeenkomsten:
ATP wordt gevormd via een proton motive force
Licht wordt gebruikt om elektronen naar een sterkere reductor over te brengen
In metabole routes keren vaak dezelfde patronen terug:
Geactiveerde dragers: ATP, NAD(P)H, FAD en CoA:
o NAD+ fungeert als coenzym
o FAD heeft twee reactieve plekken en kan hierdoor twee elektronen en protonen opnemen.
o FAD is altijd gebonden aan het redoxenzym waarmee een reactie gekatalyseerd wordt.
o NADPH wordt voornamelijk gebruikt als reductor tijdens de reductieve biosynthese van moleculen.
o Alle geactiveerde dragers bevatten adenine en difosfaat. En op coenzym A na hebben ze ook
allemaal ribose in hun atoom.
Sleutelreacties: deze worden steeds herhaald:
o Oxidatie/reductie reactie: elektronen overdracht.
o Formatie van covalente banden waarbij ATP vereist is
o Isomerisatie: reorganisatie van atomen om isomeren te vormen
o Groepstransfer: transfer van een functionele groep van een molecuul naar een andere.
o Hydrolytisch: banden verbreken door toevoeging van water
o Additie of verwijderen van functionele groepen: Het toevoegen van functionele groepen aan
dubbele bindingen, of ze verwijderen om dubbele banden te vormen.
3 manieren van regulatie:
o Controle van hoeveelheid enzym:
Snelheid van transcriptie en translatie/snelheid van degradatie
o Controle van de katalytische activiteit van enzymen:
Controle door middel van energiestatus van een cel
Metabole relaties tussen verschillende weefsels worden gecoördineerd door hormonen.
Reversibele covalente modificatie
Reversibele allosterische controle
o Controle van beschikbaarheid van substraat
Compartimentisering van reacties
Controle van de stroom van substraat van het ene compartiment naar het andere
Hoofdstuk 24
Kringlopen zorgen voor het voortdurend rondgaan van elementen waaruit al het leven op aarde is
samengesteld. Deze kringlopen bestaan uit vastlegging/gebruik door organismen en afbraak van afgestorven
organische stof/uitscheiding. Micro-organismen spelen een essentiële rol in de kringlopen. De chemische staat
van een element en de milieu-omstandigheden bepalen wat het organisme met het element doet. Zo kan
stikstof voor 3 doelen worden gebruikt:
Nitrificatie: energiegenerering/elektrondonor
Denitrificatie: elektronenacceptor
Inbouw in aminozuren
Methanogene bacteriën kunnen ademhalen met CO2 en kunnen kleine verbindingen omzetten. Methanotrofen
halen adem met O2 en gebruiken CH4 als energiebron.
Secundaire fermentatie kan alleen plaats vinden als er syntrofie plaats vindt. Syntrofie is de samenwerking van
meerdere organismen om een verbinding af te kunnen breken.
De koolstofkringloop moet uit het hoofd geleerd worden.
Indien er in een systeem zowel sulfaat als koolstof aanwezig is zullen de sulfaatreduceerders dominant staan.
Sulfaat staat lager in de “toren” en levert dus meer energie op.
Methanogene organismen zijn sterk afhankelijk van andere micro-organismen, zowel van exo-enzym
producerende als fermentatieve organismen.
De koolstofcyclus is verbonden met de stikstof en zwavelcyclus.
De stikstofcyclus is als volgt:
De zwavelcyclus bestaat uit vele processen waarvan er enkele bekend moeten zijn:
Chemolithotrofe oxidatie
Sulfaat assimilatie
Sulfaatreductie
Desulfurylatie
Biochemie (samenvatten wat er op de slides staat, aangezien de man deze
altijd gewoon voorlas)
Hoofdstuk 1
Cellulaire energie is de energie die wordt gebruikt door onder andere enzymen en eiwitten.
Alle organismen hebben dezelfde opzet:
Alle organismen bestaan uit cellen
DNA is in alle cellen de drager van genetisch materiaal
De manier waarop genetische informatie wordt omgezet in eiwitten is altijd hetzelfde
Dezelfde 20 aminozuren worden door alle organismen gebruikt om eiwitten te maken
De cellen gebruiken dezelfde standaard metabole routes
Moleculen zoals ATP, NADH en coenzym A hebben dezelfde functie in alle cellen.
Hieruit kan geconcludeerd worden dat alle organismen afstammen van een voorouder.
Alle cellen gebruiken dezelfde moleculaire systemen: de basisprocessen in alle cellen zijn uniform en bewaard
gebleven in de evolutie.
In de meeste gevallen wordt biologische diversiteit verklaard door relatief kleine veranderingen en niet door het
ontstaan van geheel nieuwe elementen.
Zo heeft de heemgroep door de tijd verschillende functies gekregen. Aanwezig in hemoglobine wordt zuurstof
reversibel gebonden en in een cytochroom worden elektronen doorgegeven. Afhankelijk van waar de
heemgroep zich bevindt heeft de heemgroep verschillende functies.
Er is een nauwe relatie tussen structuur en de functie van een biomacromolecuul. Zo verklaard de structuur van
DNA erfelijkheid en opslag van informatie op moleculair niveau:
De basenparen hebben een gelijke vorm. De structuur van DNA hangt dus niet af van de basesvolgorde.
Semiconservatieve (een deel is van de originele streng) synthese. Basenpaarvorming vormt de basis
voor het kopiëren van genetische informatie. Elke streng doet dienst als mal voor de complementaire
streng.
Belangrijk voor de structuur en stabiliteit van biomoleculen zijn covalente bindingen. Zeker als er
resonantiestructuren mogelijk zijn, zijn deze bindingen onwijs sterk.
4 niet-covalente bindingen of interacties die bepalend zijn voor de structuur van biomoleculen (DNA en
eiwitten)
Elektrostatische interactie: aantrekkingskracht tussen tegenovergesteld geladen groepen. De
dielectrische constante beïnvloedt de interactie. Wordt deze kleiner dan wordt de interactie sterker.
o E=(k*q1*q2)/(D*r2) (hoeft wss niet uit het hoofd)
Waterstofbrug
o Een H-atoom covalent gebonden aan een N of O wordt aangetrokken door een N of O. Het Hatoom is δ+. De N en O atomen zijn δ-.
o Sterkst verbinding wanneer donor en acceptor op een lijn liggen.
o Energie-inhoud van waterstofbruggen is niet onwijs hoog
Van Der Waals interactie
o Een fluctuerende verdeling van de electronenwolk rondom atomen zorgt voor een geringe
polarisatie (δ+ of δ-) die dan in een nabijgelegen atoom een tegenovergestelde polarisatie
induceert. De tijdelijke partiële ladingen vertegenwoordigen een onderlinge kleine
aantrekkingskracht.
Dipool-geïnduceerde dipool-interacties (molecuul zonder dipool krijgt ook een dipool
doordat deze verstoord wordt door een molecuul met dipool)
Hydrofobe interactie (het gevolg van de eigenschappen van water)
o Water is polair
o Er is een zeer grote cohesie tussen watermoleculen
o
o
Biomoleculen interacteren met water door vorming van waterstofbruggen en door
elektrostatische interacties. (water is een veelzijdig oplosmiddel)
Door bovenstaande eigenschappen ontstaat het hydrofobe effect, dit is de clustering van
apolaire stoffen. Deze apolaire clustering zorgt voor een toename van de entropie.
Van Der Waals interactie en Hydrofoob effect spelen de grootste rol bij de vorm van DNA. Atomen in DNA zitten
op ideale Van Der Waals afstand. De vier interacties spelen ook allemaal een rol bij de TATA-box.
Een waterstofmolecuul in ijs vormt wel 4 waterstofbruggen. Er is dus zeer veel interactie.
De totale energie van een systeem en zijn omgeving is constant. Energie wordt niet gevormd en gaat ook niet
verloren. Wel kan energie omgezet worden in een andere vorm. Bij een proces dat spontaan verloopt nemen de
entropie van het systeem en de omgeving toe.
Cellen lijken niet aan deze eisen te voldoen. Er wordt energie verbruikt om moleculen te synthetiseren. Toch
houdt een cel zich wel aan de regels. Het verbruik van energie dat in een cel plaats vindt wordt gecompenseerd
door de energie die uit de cel vrijkomt in de vorm van warmte, H2O en CO2.
Warmte is de minst bruikbare en meest wanordelijke vorm van energie die bestaat.
De vrije energie (G)-verandering geeft aan of een reactie of proces kan verlopen. Als ΔG kleiner is dan 0 verloopt
een proces spontaan.
ΔG=ΔH-TΔS
Enthalpie (H): de warmte inhoud, oftewel de totaal beschikbare energie.
Entropie (S): maat voor wanorde, oftewel spreiding van energie over subtoestanden. Als Stotaal groter is dan 0
verloopt de reactie spontaan.
Bij de vorming van een DNA-dubbelhelix wordt de entropie-afname van de afzonderlijke strengen
gecompenseerd door de toename van de entropie van de omgeving, dit doordat er warmte vrij komt.
Kennis over genomen verandert de biochemie:
Van verschillende organismen is de genoomsequentie opgehelderd
Verschillende ziekten zijn te koppelen aan specifieke veranderingen in de sequentie van het DNA
De aminozuurvolgorde is een eendimensionale code en bepaald middels elektrostatische interacties,
waterstofbrugvorming, Van Der Waals interacties en hydrofobe interacties de 3D-structuur van een eiwit. En
hiermee ook haar functionele eigenschappen.
Genoomsequentieweetjes:
Het menselijk genoom bevat 3 miljard basenparen
Het menselijk genoom bevat 25000 genen die voor eiwitten coderen
De rest van het DNA bevat informatie die onder andere de expressie van specifieke genen reguleert.
Elke persoon heeft een unieke basenvolgorde
Het gemiddelde verschil tussen twee personen is ongeveer 1 op de 1000 basenparen.
Genetische verschillen verklaren de neiging tot het ontstaan van ziekten
Je gedrag kan specifieke biochemische paden activeren die veranderingen in genexpressie kunnen
geven.
Hoofdstuk 2
Aminozuren zijn chiraal en in eiwitten zijn uitsluitend de L-aminozuren ingebouwd. De zijketens van de
verschillende aminozuren verschillen in:
Grootte
Vorm
Lading
De mogelijkheid tot het vormen van een waterstofbrug
Hydrofoob karakter
Chemische activiteit
Lading is afhankelijk van pH
pH laag protonated: NH3+ en COOH
pH hoog deprotonated: NH2 en COO pH midden zwitterion: positieve en negatieve lading, NH3+ en COOBegrippen die bekend moeten zijn:
Alifatisch: verbindingen met koolstofketens
Aromatisch: er geldt 4n+2, ringvorm met dubbele bindingen
Hydrofobiciteit: mate waarin een molecuul van water afstoot
Hydrofiel: stoffen die graag in water zijn
Waterstofbrugvorming: kan een zijtak waterstofbruggen aangaan
Alifatische hydroxylgroep: niet aromatische ketens
Sulfhydrylgroep: ook wel thiol genoemd. Een alcoholgroep waarbij de zuurstof is vervangen voor een
zwavel. R-SH
Zure groep
Basische groep
Er zijn bepaalde aminozuren, zoals homoserine, die niet in eiwitten voorkomen. Dit, omdat bijbehorende
zijketens ongewenste nevenreacties (cyclizering) geven. Deze nevenreacties treden niet op bij serine, daar komt
dan te veel spanning op de ring te staan.
Een peptidebinding is kinetisch zeer stabiel. Om een peptidebinding mogelijk te maken is een input van energie
nodig. Een peptidebinding wordt gevormd in een ribosoom door gebruik te maken van geactiveerde
aminozuren. Aminozuren worden geactiveerd door de activeringsreactie te koppelen aan de hydrolyse van ATP.
(tot AMP en 2Pi)
Een polypeptidebinding heeft een polariteit, ruggengraat en zijketens. Polypeptideketens zijn flexibel, maar
door dubbele bindingen is het bindingskarakter vlak. Hierdoor is het aantal mogelijke combinaties van de
eiwitruggengraat beperkt.
De (reversibele) vorming van een cystine koppelt delen van een polypeptideketen covalent aan elkaar, zuurstof
oxideert cysteines (met SH’s) tot cystines
Bijna alle peptide-bindingen zijn in transvorm om sterische hinder te voorkomen. In het geval van X-Pro
peptidebindingen komen cis-conformaties vaak voor, omdat er zowel bij de trans- als de cisvorm sprake is van
sterische hinder. Trans: één omhoog, één omlaag. Cis: beide omhoog of omlaag.
De 3D structuur van een polypeptideketen kan beschreven worden met de hoeken φ (phi) (dichter bij NH)en ψ
(psi) (dichter bij C=O) rond het C-alpha-atoom. De phi en psi hoeken hebben kunnen roteren (door
enkelvoudige binding)
Een polypeptideketen vouwt zich in een waterige micro-omgeving zo dat:
Hydrofobe zijgroepen zich binnenin bevinden (hydrofobe effect)
Er zich tussen de amino en –carboxylgroepen zoveel mogelijk waterstofbruggen vormen
Regelmatige, goed gepakte structuren ontstaan (Van de Waals interactie)
o α-helices
o
o
o
C=O heeft waterstofbrug met NH-groep dat 4 residuen verderop ligt
β-sheets
parallel: witte bolletjes allebei omhoog
antiparallel: ene bolletje omhoog, ander omlaag
β-turns (‘bocht’) en loops (‘lussen’) aan opp van eiwitten, spelen vaak rol bij interacties met
andere moleculen zoals eiwitten
loops: sheets die telkens omgekeerde richting op gaan
Specifieke aminozuurvolgordes geven aanleiding tot de vorming van:
alpha-helixachtige coiled coil (‘gerolde rol’)
triple (drievoudige) helix
In een enzym komt vaak een cofactor voor. Deze is om elektronen te kunnen transporteren.
Vezelachtige eiwitten geven structurele ondersteuning aan cellen en weefsels. Een voorbeeld: α-keratine:
twee helices zitten om elkaar heen gedraaid. Dit heet een α-helical coiled coil.
Deze helices hebben interacties door middel van ionogene, Van Der Waals en hydrofobe interacties
Door steeds herhalende fragmenten in keratine is interactie tussen de helices mogelijk
De helices kunnen ook door disulfidebruggen aan elkaar gebonden worden. Hoe meer van deze
bindingen aanwezig zijn, des te minder flexibel wordt het complex. Haar heeft weinig disulfidebruggen
en in horens zijn er juist veel disulfidebruggen.
Een ander voorbeeld is collageen:
In collageen komt veel glycine, proline en hydroxyproline voor. Om de drie aminozuren zit een glycine.
Collageen is het meest voorkomende eiwit in zoogdieren en heeft een triple helix structuur.
Door sterische hinder tussen de (hydroxy)prolines vormt de keten een helixstructuur.
In de polypeptideketen zelf komen geen waterstofbruggen voor. Wel tussen de 3 ketens.
De hydroxylgroep van hydroxyproline maakt extra waterstofbruggen mogelijk en dragen zo bij aan de
sterkte van collageen. Wanneer er niet genoeg hydroxyproline aanwezig is kan men last krijgen van
scheurbuik.
Wateroplosbare eiwitten vouwen zich altijd zo dat er een hydrofobe kern ontstaat. Membraaneiwitten maken
hier wel eens een uitzondering op en hebben de hydrofiele zijketens aan het eiwitoppervlak.
Veel DNA-bindende eiwitten bevatten een helix-turn-helix motief. Dit omdat deze moleculen dan in de DNA
groef kunnen binden. Deze helix-turn-helix herhaling noemt men het motief.
Een domein is een globulaire eenheid die meerdere malen voorkomt in een eiwit.
Quarternaire structuur: ruimtelijke organisatie van meerdere polypeptideketens die geassembleerd zijn tot een
multisubunitcultuur.
Eiwitten kunnen op verschillende manieren ontvouwen worden:
Ontvouwingsmiddelen: verbreken de niet-covalente interacties (elektrostatische, H-brug, van der
Waals, hydrofobe interacties) in eiwitten
β-mercapto-ethanol: verbreekt de disulfidebindingen
Na ontvouwing is de enzymactiviteit verdwenen. De ontvouwing kan gevolgd worden door spectroscopische en
fysische methodes.
Wanneer de β-mercapto-ethanol en ureum is verwijderd kan spontane hervouwing plaatsvinden (terwijl
oxidatie aan lucht plaats vindt). De informatie die codeert voor het vouwen van een eiwit ligt opgeslagen in de
aminozuurvolgorde van een eiwit.
Bij het terugvouwen kunnen verkeerde disulfidebindingen gevormd worden. Hierdoor is slecht 1% van
de oorspronkelijke activiteit terug te krijgen met spontane vouwing. Wanneer er dan weer een klein
beetje β-mercapto-ethanol (katalyseert de her rangschikking van disulfidebruggen) toegevoegd wordt
zal het eiwit zich herstellen. Dit, omdat de natieve toestand de hoogste stabiliteit (laagste vrije
energie) heeft.
Eiwitten zijn niet zeer stabiel. Hierdoor zijn ze flexibel. Deze flexibiliteit is nodig voor eiwitactiviteit.
Gevouwen eiwitten hebben een lage vrije energie (meer stabiel), lager dan in ongevouwen toestand. Dit
verschil is echter wel heel klein.
Eiwitvouwingsintermadiairen hebben slecht opgeborgen hydrofobe aminozuurzijketens en kunnen hierdoor aan
elkaar gaan plakken. Hierdoor ontstaan amyloïde fibrillen. Hierdoor ontstaan verschillende ziektes, zoals
Alzheimer, Parkinson, diabetees type-2, enz.
oligomeren van eiwitten vormen een tussenstadium naar fibrilvorming ,deze oligomeren beschadigen
vermoedelijk celmembranen celdood ziekte
Hoofdstuk 8
Enzymen zijn krachtige en zeer specifieke katalysatoren
Hydrolysereactie van peptidebinding wordt gekatalyseerd door een proteolytisch enzym (Trypsine,
enorme versnelling en is heel specifiek)
De peptidebinding is thermodynamisch labiel, maar kinetisch zeer stabiel
De meeste reacties in biologische systemen gebeuren vrijwel niet in afwezigheid van enzymen
De specificiteit van enzymen (zoals serine proteasen) komt door interacties van substraat met specifieke
residuen in een holte
Trypsine en trombine zijn proteasen (meer specifiek: het zijn serine proteasen)
Trypsine: afbraak van eiwitten in de darm
Trombine werkt alleen in op één eiwit: fibrinogeen. Trombine zet fibrinogeen in het bloed om in fibrine
(door hydrolyse van Arg-Gly-bindingen in specifieke peptidesequenties), dat vervolgens polymeriseert
en een stolsel vormt.
Proteolytische splitsing na grote aromatische zijketens gebeurd door chymotrypsine, na lange positief geladen
zijketens (Lys en Arg) door trypsine; na kleine zijketens (Ala, Gly en Val) door elastase
De meeste reacties in biologische systemen hebben amper waarneembare reactiesnelheden in afwezigheid van
enzymen.
Koolzuuranhydrase (carbonic anhydrase) is een van de snelste enzymen. Elk enzymmolecuul kan 106 moleculen
CO2 per sec. hydrateren. De katalytische cyclus wordt in een-miljoenste seconde doorlopen. Belangrijk: om van
CO2 af te komen, wordt koolzuur snel gemaakt en pH.
De fysiologische rol van koolzuuranhydrase
CO2 wordt in de rode bloedcel gehydrateerd door
koolzuuranhydrase
Het gevormde bicarbonaat wordt uitgewisseld met chloride
en zo via het bloed naar de longen vervoerd
In de longen is de CO2-spanning laag, CO2 wordt derhalve
afgegeven en koolzuuranhydrase vult dit aan door HCO3terug om te zetten in CO2, zodat CO2 effectief uit het bloed verdwijnt.
Veel enzymen hebben cofactoren nodig om actief te zijn (Apo-enzym + cofactor = holo-enzym)
Met cofactoren zijn reacties mogelijk die niet uitgevoerd kunnen worden met de standaardset van 20
aminozuren
Cofactoren zijn onder te verdelen in metalen en kleine organische moleculen (co-enzymen)
o prosthetische groep: wanneer het co-enzym stevig gebonden is
o co-substraat: wanneer het co-enzym alleen tijdens de katalyse gebonden is
Zink is essentieel voor de katalyse door koolzuurhydrase (=cofactor). Door de binding aan zink wordt de pKa van
water verlaagd van 15,7 naar 7.
Enzymen kunnen energie van ene vorm in andere omzetten (voorbeelden)
Lichtgevende kwal wordt potentiële energie van een substraat omgezet in licht
Fotosynthese: lichtenergie wordt omgezet in chemische bindingsenergie (NADPH en ATP); dat
resulteert uiteindelijk in productie van gereduceerde koolstofverbindingen (zoals glucose en vetzuren)
Mitochondriën: vrije energie aanwezig in
voedsel wordt via redoxreacties omgezet in
een ionengradiënt, die gebruikt wordt om ATP
te maken uit ADP en fosfaat.
Vrije energieverschil (dG) tussen producten en substraten:
bepaalt de richting waarin de reactie spontaan verloopt.
(geen info over grootte reactiesnelheid)
Relatie tussen standaard vrije energie verandering en
evenwichtsconstante
Waterstofbrugvorming kan grote invloed hebben op de ligging
van een evenwicht (energieinhoud van H-brug kan groot zijn)
G0 positief verloopt reactie niet spontaan (endotherme
reactie)
G’ (niet G0) is echter maatstaf of een reactie spontaan verloopt.
G’ < 0 reactie is exotherm, spontaan verloop.
Door de concentraties van reactanten en producten aan te passen kunnen reacties spontaan gaan verlopen.
Een enzym versnelt een reactie door de vorming van de overgangstoestand te vergemakkelijken.
ΔGǂ: activeringsenergie, vrije energieverschil tussen overgangstoestand en substraat, bepaalt
reactiesnelheid
Sǂ: overgangstoestand
V: reactiesnelheid
Enzymen verlagen ΔGǂ (stabiliseren overgangstoestand) en bijgevolg stelt het evenwicht van een reactie
zich sneller in (vergroten reactiesnelheid door bijvoorbeeld H-brug vorming)
ΔG: vrije energieverschil tussen producten en substraten, bepaalt de
richting waarin reactie verloopt.
Een enzym verandert niet het uiteindelijke evenwicht van een
chemische reactie!
De eerste stap tijdens enzymatische katalyse is de vorming van een
enzymsubstraat complex. (Kinase A heeft ATP en een pseudosubstraat
remmer). 2 substraten gebonden aan enzym met reversibele reactie.
Eigenschappen van het katalytische centrum van een enzym
Katalytische centrum: 3D inkeping of gat in het enzym
o relatief klein deel van totale enzymvolume
o ruimtelijke oriëntatie bepaald specificiteit van binding
o kan gevormd worden door residuen die ver uiteen liggen in de
primaire sequentie
Katalytische groepen: aminozuurzijketens die betrokken zijn bij de binding van substraten
Unieke micro-omgevingen: katalytische centra
Substraten worden via meerdere zwakke reversibele interacties specifiek gebonden aan het katalytische
centrum en optimaal tov elkaar georiënteerd
Enzymen zijn flexibel en derhalve kan de vorm van een actief centrum zich aanpassen na binding van het
substraat (‘induced fit’)
Interactie tussen enzym en substraat in het katalytische centrum bevordert de vorming van de transitietoestand in
de betrokken reactie middels de vier interacties (college 1). De energie die vrij komt bij binding van substraat
(bindingsenergie) leidt tot verlaging van de activeringstoestand. De verlaging van activeringsenergie versnelt een
reactie.
Michaelis-Menten vergelijking beschrijft de kinetische eigenschappen van veel enzymen (kennen! Wordt gevraagd
op tentamen met bijbehorende curve)
Enzymkinetiek: studie van de snelheden waarmee enzym gekatalyseerde reacties verlopen
Reactiesnelheid van chemische reactie:
o S –k P (K is de reactiesnelheidsconstante). V = -dS/dt = k*S
Reactiesnelheid van een enzym gekatalyseerde reactie
o Na vorming van het enzymsubstraat complex wordt het
product gevormd
o Reactiesnelheid: snelheid waarmee het product gevormd
wordt
Initiële reactiesnelheid (V0): beginsnelheid van katalyse, wordt
afgeleid uit initiële deel van reactiecurve (raaklijn op t=0)
Km: waarde van de substraatconcentratie waarbij de helft van de
bindingsplaatsen voor het substraat op het enzym bezet is (dan
heb je de helft van de maximale reactiesnelheid).
o maat voor substraatconcentratie die je nodig hebt om
significante enzymkatalyse te laten optreden
Kcat: aantal substraatmoleculen dat per seconde per
enzymmolecuul omgezet wordt in product, onder verzadigde
substraatconcentraties, en is een directe maat voor de katalytische
capaciteit van een enzym
o Kcat klein waardeloos enzym; Kcat groot heel goed
enzym
o ‘turnover getal’
o 1/kcat: tijd die een volledige katalytische cyclus duurt
Bij de meeste biochemische reacties zijn meerdere substraten betrokken
Sequentiële reactie: alle substraten moeten aan het enzym binden (vorming van een ternair complex) voordat
product gevormd wordt
Dubbele verplaatsingsreactie (‘Ping-Pong’): een of meerdere producten verlaten het enzym voordat alle substraten
gebonden hebben; vorming van een gesubstitueerd intermediair enzym.
Allostere enzymen: bestaan uit meerdere sub-eenheden en hebben meerdere ‘active sites’. De binding van een
substraat aan één sub-eenheid beïnvloedt de eigenschappen (katalytische capaciteit) van de andere sub-eenheid
(‘allos’ betekent ‘andere’, ‘stereos’ betekent ‘structuur’)
vertonen ander gedrag dan MichaelisMenten kinetiek
Enzymen kunnen geremd worden door specifieke
moleculen (=belangrijk regelmechanisme in
biologische systemen)
irreversibele remming: remmer is zeer sterk
gebonden aan het enzym
reversibele remming: snelle dissociatie van
enzym-remmer complex
o competitieve remming: verlaging van de snelheid van katalyse doordat substraat niet kan binden
aan het enzym terwijl remmer gebonden is, remmer in competitie met substraat
o uncompetitieve remming: verlaging van de snelheid van katalyse doordat een remmer bindt nadat
substraat gebonden is aan het enzym
o noncompetitieve remming: verlaging van snelheid van katalyse doordat remmer en substraat op
twee verschillende plaatsen aan het enzym kunnen binden (na binding van remmer kan substraat
nog steeds binden)
Hoofdstuk 15 (+delen van h16, 17, 18 en 19): Metabolisme, basische concepten en design
Levende organismes hebben een continue behoefte aan vrije energie voor belangrijke doelen, zoals:
Beweging: Mechanische arbeid tijdens spiercontractie of cellulaire bewegingen
Actief transport van moleculen of ionen (Na/K-pomp)
Biosynthese: De synthese van macromoleculen uitgaande van eenvoudige basisstoffen
Signaalversterking
Vrij energie wordt verkregen uit:
Zonlicht: fototrope organismes nemen zonlicht op gedurende de fotosynthese (omzetting van energiearme
moleculen, zoals CO2, in energierijke moleculen zoals suikers en vetzuren)
Oxidatie van componenten: chemotropen oxideren (koolstof-bevattend) voedselmateriaal; dit materiaal
wordt gegenereerd door fototrope organismen
Het metabolisme is samengesteld uit vele gekoppelde reeksen van reacties
Glycolyse
vrije energie-verandering behorende bij het totale proces moet negatief zijn om te
kunnen verlopen.
Alle reacties in de glycolyse worden gekatalyseerd door enzymen en deze metabole
route is sterk gereguleerd
Glucose wordt anaeroob gemetaboliseerd naar 2 pyruvaat moleculen in een serie van
10 gekoppelde reacties van de glycolyse
Onder anaerobe omstandigheden wordt pyruvaat vervolgens gemetaboliseerd naar
lactaat (de totale glycolyse heeft nu uit glucose 2 ATP opgeleverd)
Onder aerobe omstandigheden wordt pyruvaat via Acetyl CoA geoxideerd naar CO2
en H2O (de glycolyse, CZC en ademhalingsketen leveren samen uiteindelijk 30 ATP op
uit glucose)
vindt plaats in cytoplasma
netto productie: 2 ATP + 2 NADH + 2 pyruvaat
Metabole routes kunnen onderverdeeld worden in:
Katabolisme: brandstoffen (karbohydraten, vetten) CO2 + H2O +
bruikbare energie
Anabolisme: bruikbare energie + kleine moleculen complexe
moleculen
Amfibool: zowel anabool als katabool, afhankelijk van energietoestand
van de cel
De citroenzuurcyclus is een amfibole route:
CZC wordt gebruikt om acetylgroepen (C2) volledig te oxideren en daarbij 8 hoog energetische elektronen te
genereren in de vorm van NADH en FADH2 (dat is katabolisme (linkerfiguur en blauwe pijlen in
rechterfiguur)
CZC dient ook als bron voor biosynthese (dat is anabolisme, de paarse pijlen in rechterfiguur)
Bij biosynthese wordt ook pyruvaat naar oxaalacetaat omgezet (groene pijl), door pyruvaatcarboxylase, om
er voor te zorgen dat intermediairen in de CZC niet opraken (een anaplerotische/aanvullende reactie)
Anaplerotische reactie: vult intermediaire van de CZC weer aan
Carboxylering van pyruvaat tot oxaalacetaat is gekoppeld aan ATP-hydrolyse en wordt gekatalyseerd door het
biotine bevattende enzym pyruvaatcarboxylase. De reactie verloopt in drie stappen in de mitochondriën.
De anaplerotische reactie is ook belangrijk voor de vorming van glucose uit lactaat (via pyruvaat). Amino- en
ketozuren kunnen ook worden omgezet in glucose (gluconeogenese in lever en nieren; gebeurd bij vasten zodat
glucosegehalte in bloed constant blijft, voldoen aan metabole behoeftes van hersenen en rode bloedcellen)
Pyruvaatcarboxylase: Het ATP-grasp domein activeert CO2, het geactiveerde CO2 wordt overgedragen naar het
biotine (biotine bindingsdomein); het centrale domein katalyseert de
carboxylering van pyruvaat naar oxaalacetaat.
standaard negatieve vrije energieverandering kan verlopen
groot deel van vrije energie (uit ATP) wordt gebruikt om HCO3- te activeren tot carboxyfosfaat. Hiermee kan
CO2 aan biotine worden gebonden: levert geactiveerd CO2
Splitsing van CO2 van CO2-biotine-enzym complex heeft een negatieve G0. Dit hoogenergetisch intermediair
(CO2-biotine-enzym complex) wordt gebruikt om pyruvaat te carboxyleren tot oxaalacetaat.
Belangrijk principe in biochemie! Thermodynamisch ongunstige (energie-vragende) reactie (zoals pyruvaat
oxaalacetaat) kan voortgedreven worden door koppeling aan thermodynamisch gunstige (energieleverende) reactie (zoals ATP-hydrolyse) bijbehorende evenwicht wordt daardoor verschoven
o Het evenwicht tussen A en B verschuift meer richting overmaat B
ATP is een energierijk molecuul
De structurele basis voor de hoge potentiaal behorend bij fosforyl-overdracht van ATP
o resonantiestabilisatie
o elektrostatische repulsie
o stabilisatie van fosfaat door hydratie (bij ADP en Pi)
o Vrij fosfaat heeft meer energetisch gunstige resonantiestructuren (4x) dan de terminale fosfaat van
zowel ATP (3X) als ADP (3x) G0 voor hydrolyse van zowel ATP als ADP is groot
De fosforyl-overdrachtspotentiaal van ATP ligt tussen die van andere biologisch belangrijke gefosforyleerde
moleculen
o Alle componenten die in de tabel boven ATP staan kunnen door fosforyloverdracht naar ADP een
ATP-molecuul vormen, degenen die eronder staan kunnen gevormd worden door hydrolyse van ATP
o ATP is derhalve een geschikt intermediair voor overdracht van fosforyl-groepen
De hoeveelheid ATP is gelimiteerd en wordt snel omgezet, het moet derhalve na verbruik weer aangevuld
worden.
Vrije energie die verkregen wordt tijdens oxidatie van één-koolstof bevattende moleculen
o tijdens de oxidatie van koolstof en waterstof bij aerobe organismes is O2 de uiteindelijk
elektronenacceptor, en de oxidatie-producten zijn CO2 en H2O
Vetten zijn efficiëntere brandstoffen dan glucose, omdat in vetten koolstofatomen meer gereduceerd zijn.
Gereduceerde moleculen bevatten meer vrije energie dan geoxideerde moleculen
De elektronen die van koolstof en waterstof naar zuurstof gaan
leveren vrije energie (warmte) op
Stadia tijdens extractie van energie uit voedselmateriaal
1. Digestie: levert geen bruikbare energie op
2. Levert een beetje bruikbare energie op
3. Levert veel bruikbare energie op door productie van 8 e- met
een hoge overdrachtspotentiaal (opgeslagen als ‘reductieequivalenten’ in 3 NADH + 1 FADH2), die vervolgens door
oxidatieve fosforylering een protonengradiënt creëren (dat is
een elektrochemische potentiaal), dat leidt tot ATP-vorming
Oxidatie kan direct gekoppeld worden aan ATP-synthese
Het metabolisme (de glycolyse) oxideert de C-H naar een C-OH binding via tussenstappen: De vrije energie die
oxidatie kan opleveren wordt in eerste instantie opgeslagen als een ‘hoge fosforyloverdrachtspotentiaal’ en
wordt daarna gebruikt om ATP te maken. De NADH wordt gebruikt in de oxidatieve fosforylering om ook ATP te
genereren.
Extractie van vrije energie uit voedselmoleculen in de vorm van ATP
Het overgrote merendeel van de beschikbare vrije energie van voedselmoleculen wordt tijdelijk opgeslagen als
‘reductie-equivalenten’. (chemische species die het equivalent van een elektron doorgeven). De reductieequivalenten (elektronen) hebben een hoge overdrachtspotentiaal en worden overgedragen naar NAD+ en FAD
en daarbij worden NADH en FADH2 gevormd. De reductie-equivalenten worden vervolgens overgedragen aan
een elektronentransportketen (een ademhalingsketen). De elektronentransportketen slaat de beschikbare vrije
energie op in de vorm van een protonengradiënt (de elektronen zelf komen uiteindelijk bij O2 terecht), en deze
protonengradiënt drijft de synthese van ATP.
Elektronentransportketens genereren een ionengradiënt over een membraan, dat gekoppeld kan worden aan
ATP-synthese. Dit heet ‘oxidatieve fosforylering’ en treedt op in mitochondriën.
Elektronen-overdrachtspotentiaal:
dE0’: verandering in redoxpotentiaal
dG0: verandering in vrije energie
Complexen I, III en IV pompen protonen over de binnenste
mitochondriële membraan.
Sterke reductor: grote negatieve reductiepotentiaal
Sterk oxiderende stof: grote positieve reductiepotentiaal
Het potentiaalverschil tussen NADH en O2 drijft het elektrontransport door de ademhalingsketen
Dit elektronentransport is gekoppeld aan de vorming van een protonengradiënt
Mitochondriële elektronentransportketen (essentiële identiek aan bacteriële elektronentransportketen) Bij
eukaryoten vindt de CZC plaats in de matrix van een mitochondrië.
Oxidatieve fosforylering: de elektronentransportketen genereert een protonengradiënt die gebruikt wordt
voor ATP synthese.
Proton-motive force = chemische gradiënt (dpH) + ladingsgradiënt (ΔΨ)
Totale productie aan cytoplasmatisch ATP bij oxidatie van glucose: 20+6+4=30 ATP
Fotosynthese en oxidatieve fosforylering hebben veel overeenkomsten: ATP wordt gevormd via een ‘protonmotive force’. Licht wordt gebruikt om elektronen naar een sterkere reductor (negatieve redoxpotentiaal) over
te brengen.
Metabole routes bevatten vele terugkerende patronen
Geactiveerde dragers (Zoals ATP, NAD(P)H, FAD en CoA)
Sleutelreacties worden herhaald (6 reactietypes)
Metabole processen worden op drie belangrijke manieren gereguleerd
Geactiveerde dragers van elektronen:
Ten behoeve van brandstof (voedsel)
o NAD+: nicotine-amidering van NAD(P)+ neemt 1 H-atoom en 2 elektronen (een hydride-ion H-)
op
NADH wordt voornamelijk gebruikt voor de productie van ATP
NAD+: fungeert altijd als co-enzym , de redoxreactie die gekatalyseerd wordt door
NAD+-afhankelijke redoxenzymen
o FAD: flavine mononucleotide en AMP
kan 2 elektronen en 2 protonen opnemen
is altijd gebonden aan het redoxenzym (deze cofactor is dus een prosthetische groep)
ten behoeve van reductieve biosynthese van moleculen:
o NADPH: NADPH wordt voornamelijk gebruikt als reductor tijdens de reductieve biosynthese van
moleculen
van acylgroepen: Coenzym A
Geactiveerde dragers zijn kinetisch stabiel in afwezigheid van een katalysator (enzym), maar ze zijn
thermodynamisch labiel; dit veroorzaakt dat enzymen de stroom van vrije energie en de
reductiecapaciteit in een cel kunnen controleren
Functionele modules zijn behouden gebleven gedurende miljarden jaren van evolutie. Geactiveerde dragers
bevatten allen ADP-eenheden. Vermoedelijk zijn deze moleculen geëvolueerd vanuit vroegere op RNA
gebaseerde katalysatoren (ribozymen in de RNA-wereld), waarbij de adenine-ring bindt aan een uracyl-eenheid
in een holte van het ribozym. Toen de meer veelzijdige eiwitten RNA begonnen te vervangen als katalysator zijn
de ribonucleotide co-enzymen onveranderd in gebruik gebleven, omdat ze al zeer geschikt waren voor hun rol
in het metabolisme
Sleutelreacties worden telkens herhaald in het metabolisme (ook de voorbeelden weten??)
1. Oxidatie-reductie reacties: elektronenoverdracht
2. Ligatie: vorming covalente binding gekoppeld aan ATP hydrolyse tot ADP en Pi
a. anaplerotische reactie vult intermediairen vd CZC aan
3. Isomerisatie reacties herrangschikken bepaalde atomen binnen een molecuul
4. Groepsoverdracht reacties: overdracht van (functionele) groep van ene molecuul naar ander
5. Hydrolyse: splitsen bindingen door additie van water
a. hydrolyse van een peptidebinding
6. Lyase: toevoeging of verwijdering van functionele groepen om enkele of dubbele bindingen te maken
Metabole processen worden op drie belangrijke manieren gereguleerd
1. Controle van de hoeveelheid enzym
a. snelheid van transcriptie en translatie/snelheid van degradatie
2. Controle van de katalytische activiteit van enzymen
a. reversibele allosterische controle (zoals terugkoppelingsinhibitie)
b. reversibele covalente modificatie
c. Metabole relaties tussen verschillende weefsels worden gecoördineerd door hormonen, vaak door
regulatie van de
reversibele covalente
modificatie van
sleutelenzymen
d. controle dmv
energiestatus van
een cel
i. De energielading van een cel is ‘gebufferd’ en varieert in de meeste cellen tussen 0,8 en
0,95
3. Controle van de beschikbaarheid aan substraat
a. compartmentalisering van reacties (zoals bij vetzuur-oxidatie/synthese)
b. controle van stroom aan substraten van het ene compartiment naar het andere (zoals van cytosol
naar een mitochondrië)