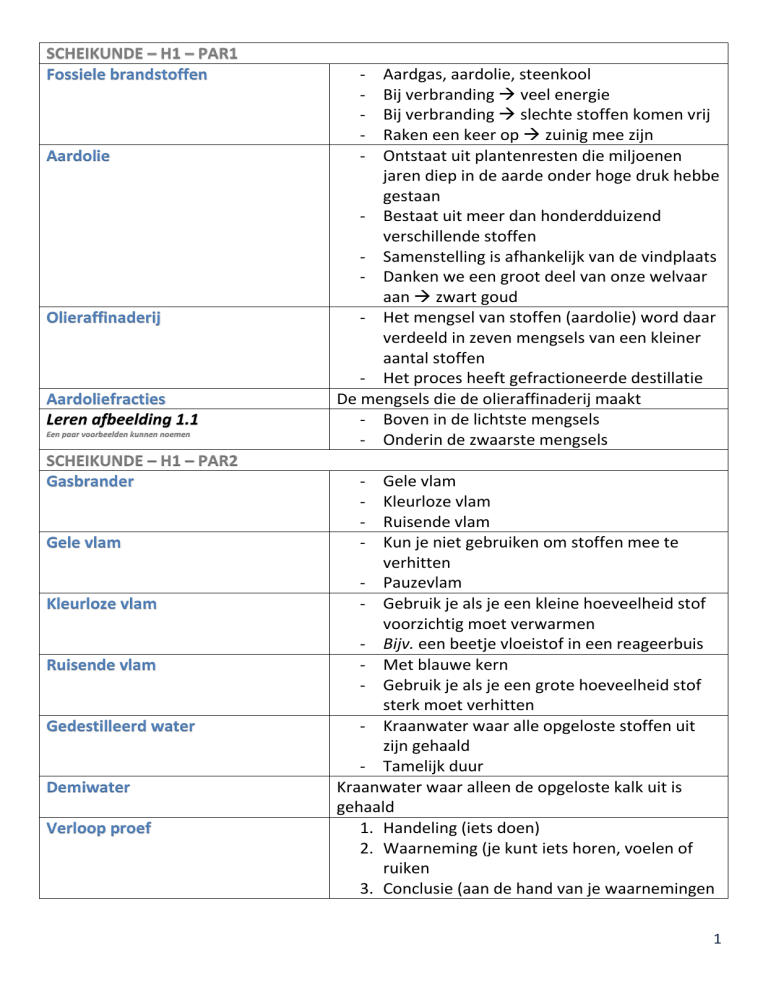
SCHEIKUNDE – H1 – PAR1
Fossiele brandstoffen
Aardolie
Olieraffinaderij
Aardoliefracties
Leren afbeelding 1.1
Een paar voorbeelden kunnen noemen
SCHEIKUNDE – H1 – PAR2
Gasbrander
Gele vlam
Kleurloze vlam
Ruisende vlam
Gedestilleerd water
Demiwater
Verloop proef
-
Aardgas, aardolie, steenkool
Bij verbranding veel energie
Bij verbranding slechte stoffen komen vrij
Raken een keer op zuinig mee zijn
Ontstaat uit plantenresten die miljoenen
jaren diep in de aarde onder hoge druk hebbe
gestaan
- Bestaat uit meer dan honderdduizend
verschillende stoffen
- Samenstelling is afhankelijk van de vindplaats
- Danken we een groot deel van onze welvaar
aan zwart goud
- Het mengsel van stoffen (aardolie) word daar
verdeeld in zeven mengsels van een kleiner
aantal stoffen
- Het proces heeft gefractioneerde destillatie
De mengsels die de olieraffinaderij maakt
- Boven in de lichtste mengsels
- Onderin de zwaarste mengsels
-
Gele vlam
Kleurloze vlam
Ruisende vlam
Kun je niet gebruiken om stoffen mee te
verhitten
- Pauzevlam
- Gebruik je als je een kleine hoeveelheid stof
voorzichtig moet verwarmen
- Bijv. een beetje vloeistof in een reageerbuis
- Met blauwe kern
- Gebruik je als je een grote hoeveelheid stof
sterk moet verhitten
- Kraanwater waar alle opgeloste stoffen uit
zijn gehaald
- Tamelijk duur
Kraanwater waar alleen de opgeloste kalk uit is
gehaald
1. Handeling (iets doen)
2. Waarneming (je kunt iets horen, voelen of
ruiken
3. Conclusie (aan de hand van je waarnemingen
1
Model
Stimulatie
SCHEIKUNDE – H1 – PAR3
Stofeigenschap
Stofconstante
Dichtheid
Gevarentekens (pictogrammen)
Leren 1.9a + 1.9b blz. 16
R-zinnen
S-zinnen
Chemiekaarten
Doorkijken 1.10 blz. 17
Inhoud chemie kaarten
Materialen
Natuurlijke polymeren
Synthetische polymeren
Composieten
SCHEIKUNDE – H1 – PAR4
Zuivere stof
Een vereenvoudigde weergave van de werkelijkheid
- Op eenvoudige wijze de omstandigheden
aanpassen
- Je ziet direct wat daar het resultaat van is
- Eigenschap die bij een stof hoort
- Bijv. kleur, smaak, oplosbarheid,
brandbaarheid, fase bij kamertemperatuur
- elke stof heeft een unieke combinatie van
stof eigenschappen
- stofeigenschap die je met een getal kunt
aangeven gevold door een eenheid
- bijv. het kookpunt en dichtheid
- massa van 1 m³ van die stof
𝑚𝑎𝑠𝑠𝑎
- 𝑑𝑖𝑐ℎ𝑡ℎ𝑒𝑖𝑑 =
𝑣𝑜𝑙𝑢𝑚𝑒
- Als eenheid kun je kg/m³ of g/cm³ gebruiken
- Nieuwe in 2015
- Afbeelding goed leren!!!
- Waarschuwingszinnen voor bijzondere
gevaren
- De r staat voor risk
- Veiligheidsaanbevelingen
- De s staat voor safety
Bevat alle bekende stoffen die in laboratorium en
industrie worden gebruikt
- Fysische eigenschappen
- Giftigheid
- Brandbaarheid
- Hoe je ongelukken kunt voorkomen
- Wat je moet doen in een noodsituatie
- Stoffen waar je iets van kunt maken
- Word onderverdeeld in vier groepen
1. Metalen
2. Natuurlijke polymeren
3. Synthetische polymeren
4. Composieten
Bijv. cellulose, zetmeel, eiwit, rubber
Bijv. plastics, kunstrubber
Een mengsel van twee of meer materialen.
- één stof
- bestaat uit de zelfde moleculen
2
Mengsel
Moleculen
Molecuultekening
Atomen
SCHEIKUNDE – H1 – PAR5
Fasen van stoffen
Vast
Vloeibaar
Gasvormig
Toestandsaanduidingen
Als er twee of meer stoffen door elkaar zijn
gemengd
- Deeltjes van een stof
- Er bestaat tientallenmiljoenen verschillende
moleculen
- Kan bestaan uit atomen van één soort maar
ook uit atomen van verschillende soorten
- Een model van een molecuul
- Gebruik je om iets beter te begrijpen en
verklaren
- Deeltjes van moleculen
- Er zijn 110 atomen
- Twee of meer vormen een molecuul
- Word bepaald door de afstand tussen de
moleculen en de plaats van de moleculen
- Vast
- Vloeibaar
- Gasvorming
- Bij een temperatuur die lager is dan het
smeltpunt
Moleculen:
- trillen op vaste plaats
- Afstand is klein
- Trekken elkaar sterk aan
- Bij een temperatuur die tussen het smeltpunt
en het kookpunt ligt
Moleculen:
- Bewegen lans elkaar
- Afstand is klein
- Trekken elkaar een beetje aan
- Van een temperatuur die hoger is dan het
kookpunt
Moleculen:
- Bewegen met grote snelheid langs elkaar
- Afstand is groot
- Trekken elkaar niet aan
- Vast (s)
- Vloeibaar (l)
- Gasvorming (g)
- Bijv. ijs = H2O(s), water = H2O(l), waterdamp =
H2O(g)
3
Van °C naar K
Van K naar °C
-
+ 273
Bijv. 10 °C = 283 K
- 273
Bijv. 373 K = 100 °C
Fasedriehoek
Vast
Gas
Vanderwaalskrachten
Kookpunt van een molecuul
Smeltpunt
Kookpunt
Smelttraject
Kooktraject
Scheiden
Scheidingsmethodes
condenseren
verdampen
vloeibaar
- Aantrekkingskrachten tussen molecullen
- Hant af van de massa van de moleculen
- Hoe zwaarder hoe hoeger de
vanderwaalskrachten
- Hangt af van de zwaarte en vorm
- Moleculen worden zwaarder
aantrekkingskracht neemt toe hoger
kookpunt
- Als een molecuul vertakt is is het kookpunt
hoger.
- Bij een zuivere stof
- De temperatuur van de stof is tijdens het
smelten gelijk
- Bij een zuivere stof
- De temperatuur van de stof is tijdens het
koken gelijk
- Bij een mengsel
- De temperatuur van de stof loopt tijdens het
smelten af
- Bij een mengsel
- De temperatuur van de stof loopt tijdens het
koken op
- Een mengels uitelkaar halen tot je zuivere
stoffen hebt
- Je sorteert moleculen
- De stoffen, moleculen en stofeigenschappen
blijven gelijk
- Extraheren
- Filtreren
- Indampen
4
Extraheren
Filtreren
Indampen
SCHEIKUNDE – H1 – PAR6
Atoomsoort
Periodiek systeem
- Het oplossen van stoffen
- Je maakt gebruik van verschil in
oplosbaarheid
- Het gebruikte oplosmiddel is het
extractiemiddel
- Bijv. zand van het het strand bevat zout, zout
kun je oplossen in water en dan hou je zand
over
- Het filteren van stoffen
- Je maakt gebruik van het verschil in deeltjes
grootte
- Dat wat door het filter gaat heet filtraat
- Dat wat blijft zitten heet residu
- Bijv. zout is kleiner dan zand. Als je zout en
zand met water in een fliter gooit dan gaat
het zout en water er door heen het blijft het
zand zitten
- Het verdampen van stoffen
- Je maakt gebruik van het verschil ik kookpunt
- Bijv. zout heeft een hoger kookpunt dan
water, je laat het water verdampen en het
zout blijft over
-
Verbindingen
Elementen
-
Een eigen naam
Een eigen symbool
Overzicht van alle atoomsoorten
Alle atoomsoorten in de zelfde groep lijken in
eigenschappen op elkaar
groep 1: alkalimetalen reageren heftig op
water
groep 17: halogenen reageren gemakkelijk
met metalen
groep 18: edelgassen reageren niet
gemakkelijk met andere stoffen
Stoffen met meerdere soorten atomen
Kun je ontleden
Stoffen met maar 1 soort atoom
Kun je niet ontleden
Leren 1.31!(HEEL BELANGRIJK) blz.
30
5
Metalen
Edelheid metalen
Leren/ door kijken 1.35 blz. 32
Lichte metalen
Zware metalen
Legeringen
Leren 1.38 (HEEL BELANGRIJK) blz.
33
SCHEIKUNDE – H1 – PAR7
Atoommodel
Rutherford
Atoommodel van Rutherford
- Hebben een glimmend oppervlak
- Geleiden warmte en elektrische stroom
- Kunnen vervormd worden, voorals als ze heet
zijn
- Kunnen in gesmolten toestand worden
gemengd met andere metalen
- Op grond van corrosie (reactie op stoffen uit
de omgeving, zuurstof of water)
- Edele metalen (groep 1 periodiek systeem)
- Halfedele metalen
- Onedele metalen
- Zeer onedele metalen
- Metalen met een kleine dichtheid
- Bijv. natrium, magnesiem, aluminium, titaan
- Metalen met een grote dichtheid
- Sommige verbindingen van atomen in zware
metalen zijn heel erg giftig
- Ontstaan door het mengen van gesmolten
metalen
- Heeft ander eigenschappen dan afzonderlijke
metalen
-
-
Atoomnummer
Atoombindingen/covalente
bindingen
-
Voorgesteld door Dalton
Eerst als een masief bolletje nu met kleur
Bedacht niet model voor een atoom
Een atoom bestaat uit een kern en elektronen
Der kern bestaat uit twee soorten deeltjes:
positief geladen protonen en ongeladen
neutronden (de massa van een proton is
gelijk aan die van een neutron)
De elkektronen zijn negatief geladen
De lading van een proton is even groot als de
lading van een elktron
Een atoom bevat evenveel protonen als
elektronen en is dus elektrisch neutraal (het
valt dus niet gemakkelijk uit elkaar)
Aantal protonenvan elke atoomsoort
Ontstaan doordat elektronen worden
‘gedeeld’ door de atomen
Geven we in een molecultekingen aan met
een streepje
6
Covalentie
Leren 1.43 blz. 38
Valentie van een atoomsoort
Ion
Opdracht 64 snappen blz. 39
Metaalbinding
SCHEIKUNDE – H2 – PAR1
Water
Hoeveelheid water
Figuur 2.1 blz. 49
Waterkringloop
Figuur 2.2 blz. 49
Beschikbaar water
Watervoorraad beter benutten of
vergroten
Conflicten
- Heta aantal bindingen dat een atoom kan
vormen
- Komt overeen met het aantal streepjes
- Hoeveel elektronen een atoom kan opnemen
of afstaan
- Deeltjes die daardoor ontstaan heten ionen
- Positieve lading als het atoom elektronen
heeft afgestaan
- Negatieve lading als het atoom elektronen
heeft opgenomen
- De binding tussen de positieven metaalionen
en de vrije elektronen
- Meest voorkomende vloeistof op aarde
- Enige stof (naast zwavel) die vast, vloeibaar
en gasvorimig op aarde voorkomt
- 2,5 % van al het water op de wereld is zoet
- Van die 2,5 % zoet zit maar 0,3 % in meren
en rivieren
- Verdamping
- Condencatie
- Neerslag
- Infiltratie
- Afstroming
- Hoeveelheid verandert niet
- Plaats verandert wel (zie waterkringloop)
- Hoe meer mensen er zijn, hoe minder water
per persoon beschikbaar is
- Zuiniger met water omgaan
- Dammen aanleggen en reservoirs bouwen
(probleem: te weinig geld en kennis +
milieuschade)
- Oppervlaktewater uit en ander gebied halen
(probleem: transportkosten zijn hoog)
- Grondwater oppompen (probleem: bodem
droogt uit en grondwaterpeil daalt)
- Ontzouten (probleem: duure techiek en veel
energie)
- Ongelijke verdeling zoet water
- vervuiling
SCHEIKUNDE – H2 – PAR2
7
Eigenschappen van water
Dichtheid
1.
2.
3.
4.
-
Soortelijke warmte
-
Hoog kookpunt
-
Groot oplosvermogen
SCHEIKUNDE – H2 – PAR3
Oplossen
Oplossing
Suspensie
Oplosbaarheid
Oplosbaarheid en temperatuur
-
Dichtheid
Soortelijke warmte
Hoog kookpunt
Groot oplosvermogen
Massa van 1 m³
Meeste stoffen dichtheid vloeistof kleiner
dan dichtheid vaste stof
Water dichtheid water (vloeibaar) is groter
dan dichtheid van ijs (vast)
Hoeveel warmte er nodig is om 1 kilo één
graad warmer te maken
Water heeft een grote soortelijke warmte
Waterrijkgebied weinig
temperatuursverschillen
Woestijn grote temperatuursverschillen
Water heeft een hoog kookpunt door kleine
positieve elektrische lading
Als molecuelen elkaar los willen laten moet er
dus meer energie, warmte, zijn om ze van
elkaar te krijgen hoger kookpunt
Water is een goed oplosmiddel voor veel
verschillende soorten stoffen
- Bestaande verbindingen worden tussen
moleculen verbroken, zowel van de stof als
van het oplosmiddel
- Nieuwe bindingen tussen moleculen van de
stof en het oplosmiddel ontstaan
Een mengsel dat altijd helder (doorzichtig) is
- Een mengsel dat altijd troebel (ondoorzichtig)
is
- Vaste stof is zweeft in kleine korreltjes in de
vloeistof (het is niet opgelost)
- Het maximaal aantal grammen van een stof
dat je kunt oplossen in een kilo van een
oplosmiddel
- Hangt af van stof, oplosmiddel, temperatuur
- Vaste stoffen hoge temperatuur
grotere oplosbaarheid
- Gassen hoge temperatuur kleinere
oplosbaarheid
8












