Cardiogeneticapoli VUmc
Geïntegreerd traject van opsporing, diagnostiek en behandeling
De gecombineerde cardiogeneticapoli van de afdelingen cardiologie en klinische genetica is bedoeld
voor patiënten met een structurele cardiomyopathie en hun familieleden. Door de toenemende kennis
van de genetische basis van structurele cardiomyopathieen kunnen mutaties in de betrokken genen
bij patiënten opgespoord worden. Vervolgens kan door presymptomatisch DNA onderzoek bij
familieleden vastgesteld worden of er bij hen sprake is van een verhoogde kans op het ontwikkelen
van cardiomyopathie. Dit maakt vroege opsporing en behandeling hiervan mogelijk.
Eén van de speerpunten van de afdeling cardiologie is diagnostisch beeldvormend onderzoek naar
structurele cardiomyopathie. Door middel van MRI, echocardiografie en zo nodig PET onderzoek kan
de regionale en globale functie van het hart in kaart gebracht worden. Door middel van deze non
invasieve diagnostiek kan een beeld verkregen worden van de ernst van de afwijkingen, en in
sommige gevallen van de oorzaak (1).
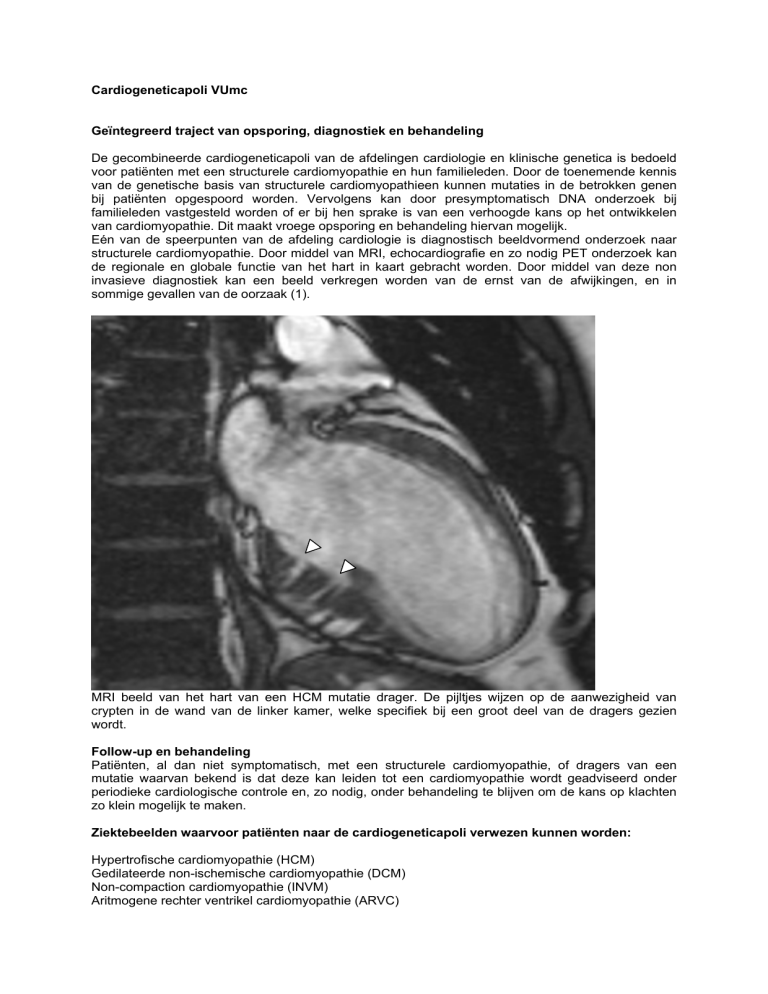
MRI beeld van het hart van een HCM mutatie drager. De pijltjes wijzen op de aanwezigheid van
crypten in de wand van de linker kamer, welke specifiek bij een groot deel van de dragers gezien
wordt.
Follow-up en behandeling
Patiënten, al dan niet symptomatisch, met een structurele cardiomyopathie, of dragers van een
mutatie waarvan bekend is dat deze kan leiden tot een cardiomyopathie wordt geadviseerd onder
periodieke cardiologische controle en, zo nodig, onder behandeling te blijven om de kans op klachten
zo klein mogelijk te maken.
Ziektebeelden waarvoor patiënten naar de cardiogeneticapoli verwezen kunnen worden:
Hypertrofische cardiomyopathie (HCM)
Gedilateerde non-ischemische cardiomyopathie (DCM)
Non-compaction cardiomyopathie (INVM)
Aritmogene rechter ventrikel cardiomyopathie (ARVC)
Hypertrofische cardiomyopathie
Epidemiologie en pathofysiologie
Hypertrofische cardiomyopathie (HCM) is met een prevalentie van 1 op 500 een relatief frequent
voorkomende erfelijke ziekte die gedefinieerd wordt door de aanwezigheid van linkerkamer hypertrofie
in de afwezigheid van een cardiale of systemische oorzaak. Bij jong volwassenen en sporters is HCM
de meest voorkomende oorzaak van plotse hartdood (2). HCM is een heterogeen ziektebeeld, waarbij
momenteel pathogene mutaties in 11 verschillende genen beschreven zijn. De meeste van deze
genen zijn betrokken bij het samentrekken van de hartspier, de sarcomeergenen. Bij meer dan de helft
van de patiënten met HCM wordt een autosomaal dominant overervende mutatie in één van de
sarcomeer genen gevonden.
Klinische presentatie
HCM kan op elke leeftijd optreden. Veel patiënten zijn asymptomatisch en worden bij toeval bij
medische keuringen ontdekt of door screening bij familieonderzoek geïdentificeerd. Echter, tekenen
van hartfalen, onbegrepen syncope, plotse hartdood of angina pectoris kunnen een HCM als
onderliggende oorzaak hebben.
Diagnostiek
Op een ECG kunnen aanwijzingen voor HCM gezien worden. De diagnose wordt klinisch bevestigd op
basis van het beeld van het hart op een echocardiogram en/of MRI.
Momenteel is DNA diagnostiek mogelijk van 11 genen waarvan bekend is dat mutaties hierin kunnen
leiden tot HCM. In eerste instantie worden bij een patiënt waarbij de diagnose HCM is gesteld eerst de
twee genen onderzocht waarin het frequentst een mutatie gevonden wordt. In Nederland zijn dat het
MYBPC3-gen en MYH7-gen. Duur: ongeveer 6 maanden. Bij ongeveer 60% van de patiënten wordt
hierbij een mutatie gevonden (2). Als deze eenmaal is geïdentificeerd duurt het
dragerschaponderzoek naar de mutatie bij familieleden enkele weken.
Gedilateerde niet-ischemische cardiomyopathie (DCM)
Epidemiologie en pathofysiologie
DCM kan zowel erfelijk als verworven zijn. Voorbeelden van verworven aandoeningen die kunnen
leiden tot DCM zijn ischaemie, infectie, coronair leiden, hypertensie, zwangerschap, autoimmuunziekten, alcoholmisbruik (2,3). Idiopathische gedilateerde cardiomyopathie is met een
prevalentie van ongeveer 37 per 100.000 veel zeldzamer dan HCM (3). Bij ongeveer 20 tot 50 % van
de idiopathische gevallen van DCM is er sprake van familiair voorkomen, in de meeste gevallen met
een autosomaal dominante overerving. Er kan echter ook sprake zijn van een autosomaal recessieve,
X-linked of mitochondriele overerving (2). Ook kan DCM een symptoom zijn van een spierziekte, zoals
musculaire dystrofie of de ziekte van Duchenne. DCM kan leiden tot hartfalen en plotse hartdood (4).
Vroege opsporing en behandeling zijn dan ook zinvol.
Klinische presentatie
DCM kan op elke leeftijd optreden. Hartfalen, ritme- en geleidingsstoornissen, of onbegrepen syncope
kunnen wijzen op de aanwezigheid van DCM
Diagnostiek
De klinische diagnose wordt gesteld aan de hand van het beeld van het hart op een echocardiogram
en/of MRI.
Het cardiologische fenotype, de familiegegevens van de patiënt en diens eerstegraads familieleden en
de overige risicofactoren voor DCM geven richting aan een mogelijk overervingspatroon waarna er
soms gericht DNA onderzoek naar een beperkt aantal genen mogelijk is. Bij ongeveer 30 tot 50 % van
de patiënten met DCM is sprake van een erfelijke vorm van de ziekte.
Non compaction cardiomyopathie (INVM)
Epidemiologie en pathofysiologie
Geïsoleerde non compaction van het ventriculaire myocard (INVM) is een zeldzame aangeboren
cardiomyopathie, verantwoordelijk voor ongeveer 10% van de structurele cardiomyopathieen bij
kinderen (5). De aandoening manifesteert zich vaak op kinderleeftijd en kent een hoge mortaliteit door
hartfalen en ritmestoornissen (5,6). Na HCM en DCM is INVM de meest voorkomende oorzaak van
primaire cardiomyopathie bij kinderen (7). De meeste gevallen van INVM erven autosomaal dominant
over. Ook zijn X-linked overerving en INVM in het kader van chromosoomafwijkingen beschreven.
DNA diagnostiek naar een aantal van de causale genen is mogelijk.
Klinische presentatie
INVM geeft meestal klachten vanaf de kinderleeftijd. De aandoening uit zich door hartfalen,
ritmestoornissen en een verhoogde kans op thrombusvorming.
Diagnostiek
Cardiologisch beeldvormend onderzoek, zoals een MRI-scan en genetisch onderzoek bij patiënten en
hun eerste graads familieleden zijn gezien de kans op plotse hartdood zinvol. DNA onderzoek van een
beperkt aantal genen is mogelijk. De aandoening is zeer heterogeen waardoor de kans op het
aantonen van een mutatie op dit moment nog laag is. Wel kan een controleadvies aan eerstegraads
familieleden gegeven worden.
Aritmogene rechter ventrikel cardiomyopathie
Epidemiologie en pathofysiologie
Aritmogene rechter ventrikel cardiomyopathie (ARVC) is een erfelijke hartaandoening die bij ongeveer
1 op de 3500 mensen voorkomt. De aandoening komt ongeveer drie keer zo vaak bij vrouwen als bij
mannen voor. Er treden pathologische veranderingen van de rechter ventrikel op waarbij het myocard
deels vervangen wordt door bindweefsel en vetweefsel (8).
Klinische presentatie
ARVC uit zich als een verwijding van de ventrikels. Dit kan aanleiding geven tot ritmestoornissen die
kunnen leiden tot plotse hartdood, met name bij jongeren en bij sporters. Deze ritmestoornissen
kunnen worden behandeld door middel van een interne cardioverter-defibrillator (ICD).
Diagnostiek
De klinische diagnose wordt gesteld aan de hand van een aantal criteria waaronder karakteristieke
ECG afwijkingen, aritmieën en morfologische veranderingen.
ARVC erft meestal autosomaal dominant over. De ernst varieert echter van patiënt tot patiënt en er
zijn ook dragers van de genetische aanleg voor ARVC die geen symptomen ontwikkelen. Inmiddels is
diagnostiek mogelijk naar mutaties in verschillende genen waarvan bekend is dat ze betrokken zijn bij
ARVC .
Cardiogeneticapoli
De afdeling cardiologie en klinische genetica organiseren de cardiogeneticapoli. Voorafgaand aan de
poli bespreken een cardioloog en een klinisch geneticus de aangemelde patiënt. Indien nodig zien zij
beiden de patiënt.
Doelgroep
- Patiënten met een structurele cardiomyopathie die mogelijk erfelijk bepaald is
- Eerstegraads familieleden van deze patiënten
Ziektebeelden waarvoor u patiënten naar de cardiogeneticapoli kunt verwijzen:
- Hypertrofische cardiomyopathie (HCM)
- Gedilateerde niet-ischemische cardiomyopathie (DCM)
- Non-compaction cardiomyopathie (INVM)
- Aritmogene rechter ventrikel cardiomyopathie (ARVC)
Patiënten en familieleden van patiënten met mogelijk erfelijk bepaalde ritmestoornissen kunt u naar
het AMC doorverwijzen; zij hebben expertise op dit gebied. Meer informatie over de cardiogenetica in
het AMC: www.cardiogenetica.nl.
Lokatie
VUmc, polikliniek klinische genetica
Receptie D
De Boelelaan 1118
1081 HV Amsterdam
Data en tijden
Iedere 1e en 3e vrijdag van de maand van 8.30-12.30 uur.
Procedure aanmelding
Verwijs patiënten naar de polikliniek klinische genetica voor diagnostiek en counseling:
- Vul het consultvel spreekuur klinische genetica in en verstuur dit naar het secretariaat polikliniek
klinische genetica
- Het secretariaat verstuurt toestemmings- en familieformulieren naar de patiënt
- Het secretariaat roept de patiënt op
Het duurt enige tijd voor de uitslag van DNA diagnostiek bekend is. De klinisch geneticus overlegt met
de cardioloog of de patiënt in deze periode presymptomatisch klinisch onderzocht moet worden.
Asymptomatische mutatiedragers worden voor periodieke controle verwezen naar de afdeling
cardiologie.
Contact
VUmc, polikliniek klinische genetica, receptie D
postbus 7957
1007 MB Amsterdam
tel: 020444 0150
fax: 020-444 0769
Artsen die spreekuur geven
Mw. dr. M.W. Elting, klinisch geneticus
Dhr. dr. A.C. Houweling, klinisch geneticus i.o.
Dhr. dr. W.E.M. Kok, cardioloog
Dhr. T. Germans, cardioloog i.o.
Referenties
1 Ischaemic and non-ischaemic cardiomyopathies- cardiac MRI appearances with delayed
enhancement. E. Jackson, N. Bellenger, M. Seddon, S. Harden, C. Peebles.
Clinical Radiology (2007) 62, 395-403.
2 Reviews of translational medicine and genomics in cardiovascular disease: New disease taxonomy
and therapeutic implications. M.A. Houman Ashrafian, H. Watkins
Cardiovascular genomic medicine (2007), 49 No 12, 1251-64.
3 OMIM, Online Mendelian Inheritance in Man, #115200,
http://www.ncbi.nlm.nih.gov/entrez/dispomim.cgi?id=115200
4 Meta-analysis of clinical characteristics of 299 carriers of LMNA gene mutations: do lamin A/C
mutations portend a high risk of sudden death? J.H. van Berlo, W. G. de Voogt, A. J. van der Kooi et
al. J. Mol. Med (2005) 83:79-83.
5 Isolated ventricular non-compaction: clinical study and genetic review. G. Loskot, E. Janiszewska,
M. Loskot, L. Szydlowski, L. Weglarz, A. Hollek. Europeace (2006) 8, 1064-67
6 Isolated ventricular non-compaction of the myocardium in adults. R. Jenni, E.N. Oechslin, B. van der
Loo. Heart Review, (2007) Jan; 93(1): 11-5.
7 The epidemiology of childhood cardiomyopathie in Australia. AW Nugent, P.E.F. Daubeney, P.
Chondros et al. New England Journal of Medicine (2003); 348: 1639-46.
8 Arrhytmogenic right ventricular cardiomyopathie/dysplasia. D. Corrado, G. Thiene. Circulation (2006)
Apr 4;113(13):1634-7. Review












