Hfst 9 VWO NG/NT 2
Uitwerkingen van de vragen en opdrachten van hoofdstuk 10
Paragraaf 10.2
Vragen en opdrachten
A2
a/b
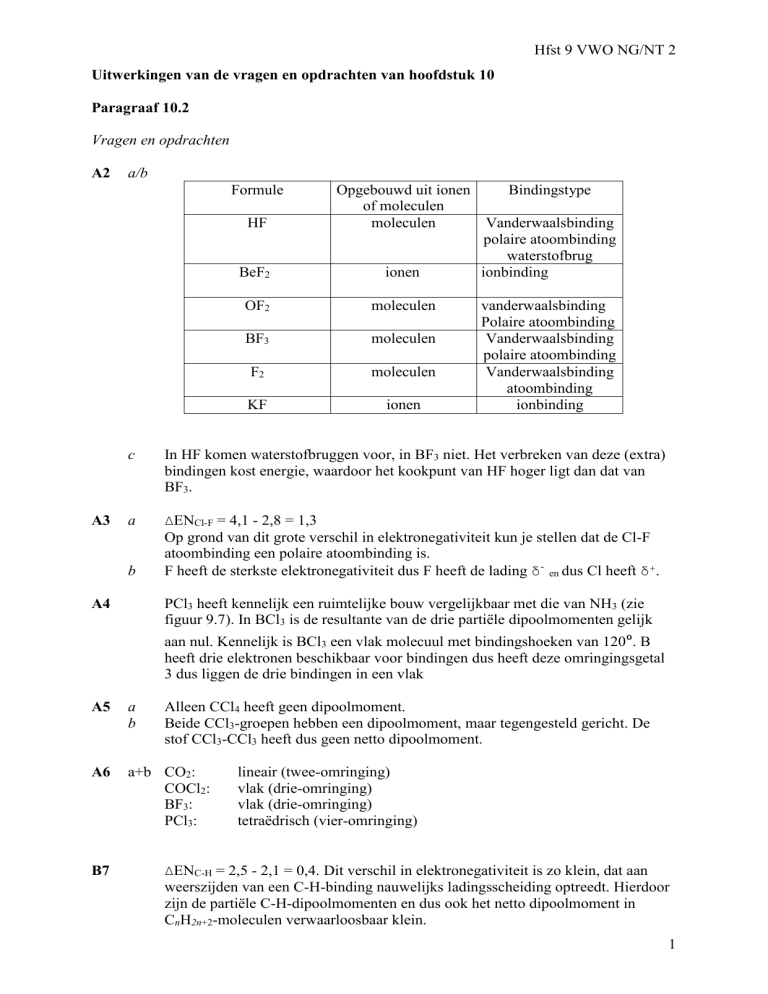
Formule
HF
BeF2
A3
Opgebouwd uit ionen
Bindingstype
of moleculen
moleculen
Vanderwaalsbinding
polaire atoombinding
waterstofbrug
ionen
ionbinding
OF2
moleculen
BF3
moleculen
F2
moleculen
KF
ionen
vanderwaalsbinding
Polaire atoombinding
Vanderwaalsbinding
polaire atoombinding
Vanderwaalsbinding
atoombinding
ionbinding
c
In HF komen waterstofbruggen voor, in BF3 niet. Het verbreken van deze (extra)
bindingen kost energie, waardoor het kookpunt van HF hoger ligt dan dat van
BF3.
a
ΔENCl-F = 4,1 - 2,8 = 1,3
Op grond van dit grote verschil in elektronegativiteit kun je stellen dat de Cl-F
atoombinding een polaire atoombinding is.
F heeft de sterkste elektronegativiteit dus F heeft de lading δ- en dus Cl heeft δ+.
b
A4
PCl3 heeft kennelijk een ruimtelijke bouw vergelijkbaar met die van NH3 (zie
figuur 9.7). In BCl3 is de resultante van de drie partiële dipoolmomenten gelijk
aan nul. Kennelijk is BCl3 een vlak molecuul met bindingshoeken van 120º. B
heeft drie elektronen beschikbaar voor bindingen dus heeft deze omringingsgetal
3 dus liggen de drie bindingen in een vlak
A5
a
b
A6
a+b CO2:
COCl2:
BF3:
PCl3:
B7
Alleen CCl4 heeft geen dipoolmoment.
Beide CCl3-groepen hebben een dipoolmoment, maar tegengesteld gericht. De
stof CCl3-CCl3 heeft dus geen netto dipoolmoment.
lineair (twee-omringing)
vlak (drie-omringing)
vlak (drie-omringing)
tetraëdrisch (vier-omringing)
ΔENC-H = 2,5 - 2,1 = 0,4. Dit verschil in elektronegativiteit is zo klein, dat aan
weerszijden van een C-H-binding nauwelijks ladingsscheiding optreedt. Hierdoor
zijn de partiële C-H-dipoolmomenten en dus ook het netto dipoolmoment in
CnH2n+2-moleculen verwaarloosbaar klein.
1
Hfst 9 VWO NG/NT 2
B8
a
b
ONO moet als lineair molecuul worden uitgesloten, omdat vectoroptelling van de
partiële NO-dipoolmomenten hier een resultante = 0 oplevert.
Ja, het molecuul bezit een NO-dipoolmoment, die niet vectorieel gecompenseerd
wordt door andere dipoolmomenten.
B9
In alle drie de moleculen is sprake van vier-omringing.
B10 a
In C2H4 treedt rond elk van beide C-atomen drie-omringing op; in C2H2 is dat
twee-omringing.
Rondom alle vier de C-atomen is sprake van 3-omringing.
b
C11 a
In H2O is sprake van vier-omringing: tetraëdrische bouw, dat wil zeggen de
theoretische bindingshoek bedraagt 109,5º.
In SO2 treedt drie-omringing op: de theoretische bindingshoek heeft hier een
b
c
waarde van 120º.
Gaande van CH4 naar H2O neemt het aantal niet-bindende elektronenparen toe
van 0 naar 2. Kennelijk nemen de elektronenwolken van niet bindende
elektronenparen wat meer ruimte in dan die van bindende elektronenparen. De
bindende elektronenparen worden als het ware naar elkaar toegedrukt, wat leidt
tot een afname van de bindingshoek.
Een andere benadering is: de afstoting die bindende elektronenparen van elkaar
ondergaan, is kleiner dan de afstoting die wordt ondergaan van een niet-bindend
elektronenpaar. Om de totale interelektronische afstoting te minimaliseren dient
de bindingshoek in het molecuul kleiner te worden.
Rond elk zwavelatoom treedt vier-omringing op. Een molecuul S8 bestaat dus uit
acht gekoppelde tetraëders, waarvan de bindingshoeken vrijwel gelijk zijn aan die
in een molecuul H2O (zie onderdeel b).
Paragraaf 10.3
Experiment 1
Zie voor de uitwerking van dit experiment de lestekst en figuur 9.16.
Vragen en opdrachten
A12 a
Twee, namelijk:
Cl
H
Cl
C
H
b
A13
Cl
H
C
Cl
H
Het molecuul heeft een tetraëdrische bouw.
Alleen paar 3 is geen stereoisomeer de rest wel
(1) spiegelbeeldisomeren;
(2) cis-trans-isomeren;
(3) conformatie isomeren
(4) cyclo-isomeren. Dus ook cis trans
2
Hfst 9 VWO NG/NT 2
B14
a
geen
Cl`
H
C
C
Cl
b
geen
H
H3C
H
C
C
Cl
H2C
CH3
c
H2C
Cl
C
H3C
H2C
H
CH3
C
C
H
Cl
cis 3-chloor-3-hexaan
trans 3- chloor-3-hexaan
d
CH2
C
CH2
H3C
CH3
geen
cyclohexene
e
H
H
H
C
H
H
C
H
C
C
H
C
C
H
CH3
C
CH3
C
H
trans 1,3 pentadieen
H
cis 1,3 pentadieen
F
CH3
Cl
C
C
H
H
C
H
C
CH3
H
C
C
C
Cl
H
trans 1-chloor-2-methyl-1,3-butadieen
H
H
C
H
cis 1-chloor-2-methyl-1,3-butadieen
B15 1, 3 en 4
3
Hfst 9 VWO NG/NT 2
B16 a
d
H
C
C2H5
H
C
C2H5
OH
CH3
CH3
H
b
e
O
C
C2H5
C
H
C2H5
OH
H
C2H5
C
C
H
CH2
CH3
CH3
c
C3H7
H
f
C
OH
C2H5
CH2
C
CH3
OH
B17 a
H3C
Cl
C
e
H2
C
H3C
OH
H2C
CH3
H2
C
C
H2
C
CH3
H
H
CH3
d
Cl
C
H
C18 a
b
C10H14O
De verbinding heeft een asymmetrisch centrum:
CH2
H3C
*
CH3
* 1 asymmetrisch centrumdus 2 spiegelbeeldisomeren
c
De ruimtelijke vorm van beide spiegelbeeldisomeren is verschillend, waardoor ze zullen binden a
Paragraaf 10.4
Vragen en opdrachten
A19
De rechterstructuur heeft geen asymmetrisch centrum en kan dus geen optische
activiteit vertonen. (in linkerstructuur is het middelste C atoom asymmetrisch)
4
Hfst 9 VWO NG/NT 2
B20 a
Cl
Cl
OH
HO
H
H
H
C
C
C
H
Cl
Cl
C
C
H
C
C
H
C
C
H
H
H
H
H
H
spiegelvlak
cis 2 chloor 1- cyclopropanol
cis 1,2 dichloorcyclopropaan
Nee, bij cis 1,2 dichloorcyclopropaan geen spiegelbeeldisomeren want is een
inwendig spiegelvlak aanwezig.
Cl
b
H
H
Cl
H
H
C
C
C
C
H
Cl
C
C
Cl
H
H
H
trans 1,2 chloor 1- cyclopropaan
Spiegelbeeldisomeren: er is geen inwendig spiegelvlak aanwezig.
c
H2
C
HO
HO
Cl
C
C
C
H
C
H2
H
H2
C
HO
C
H
C
H
H
C
Cl
H
Cl
C
OH
C
H
H
H
H2
C
H2
C
H
C
C
H
cis 3-chloor-1-cyclobutanol
geen spiegelbeeldisomerie
want vlak van tekening is
spiegelvlak
d
Cl
H
cis 2-chloor-1-cyclobutanol
geen inwendig spiegelvlak dus
spiegelbeeld isomerie
H
H2
C
H
C
C
H
H
H
C
OH
C
H
Cl
trans 2-chloor-1-cyclobutanol
geen inwendig spiegelvlak dus
spiegelbeeld isomerie
5
Hfst 9 VWO NG/NT 2
B21 a
2 (1,2 dimethylcyclopropaan) en 4( 1,2 dimehtyl cyclobutaan): geen inwendig
spiegelvlak aanwezig.
b
H
Br
C
C
Br
C
H2
C
H
H
1,1 dibroomcyclopropaan
H
C
H2
Br
C
Br
H
H
C
C
H2
C
cis 1,2 dibroomcyclopropaan
H
Br
C
Br
Br
Br
C
C
H2
H
trans 1,2 dibroomcyclopropaan
2 spiegelbeelden
c
B22
B23 a
b
c
In de trans-1,2-dibroomcyclopropaan-moleculen is geen inwendig spiegelvlak
aanwezig: deze isomeren zullen dus optische activiteit vertonen.(
a2
b2
c1
d3
e3
3e C atoom asymmetrisch
4e C atoom asymmetrisch
geen asymmetrisch C atoom dus geen stereoisomerie
Cis vorm heeft inwendig spiegelvlak, de transvorm niet dus 3
2e en 5e C atoom asymmetrisch. Een van de configuraties heeft inwendig
spiegelvlak dus geen 4 maar 3 isomeren
f8
2e , 3e en 4e C atoom asymmetrisch dus 2 · 2· 2 = 8 isomeren
In één der stereoisomeren is een inwendig spiegelvlak aanwezig.
Door substitutie van een H-atoom door een Cl-atoom aan C-atoom nr. 2 worden
zowel C(2) als C(3) asymmetrische koolstofatomen die niet gelijkwaardig zijn. Zo
ontstaan er van de stof 2-chloor-3-methylpentaan dus vier stereoisomeren.
+ 5º en - 10º
6
Hfst 9 VWO NG/NT 2
H
C24 a
H
C
H
C
C
*
CH2
H3C
H2C
CH3
C
H2
b
CH
*
C
H2
4 stereoisomeren
H
I
H2
C
H3C
II
H
C
C
*
*
CH2
C
H2
H
III
H2
C
H
IV
*
c
H
H
C
C
*
CH2
*
CH2
H
H2C
C
H2
H3C
CH3
*
H2C
C
H2
H
CH2
*
*
C
H2
CH3
I en II
hebben hetzelfde smeltpunt (spiegelbeeldisomeren), III en IV idem, I en III
hebben verschillende smeltpunten.
d
H
I
H2
C
H3C
CH3
C
*
*
CH2
C
H2
H
inwendigspiegelvlak
H
H2
C
II
H
CH3
H3C
H3C
C
C
H2
H
C
*
CH2
*
III
CH2
*
H
H2C
C
H2
*
CH3
Het spiegelbeeld van I is identiek aan I (inwendig spiegelvlak).
II en III hebben hetzelfde smeltpunt.
7
Hfst 9 VWO NG/NT 2
8