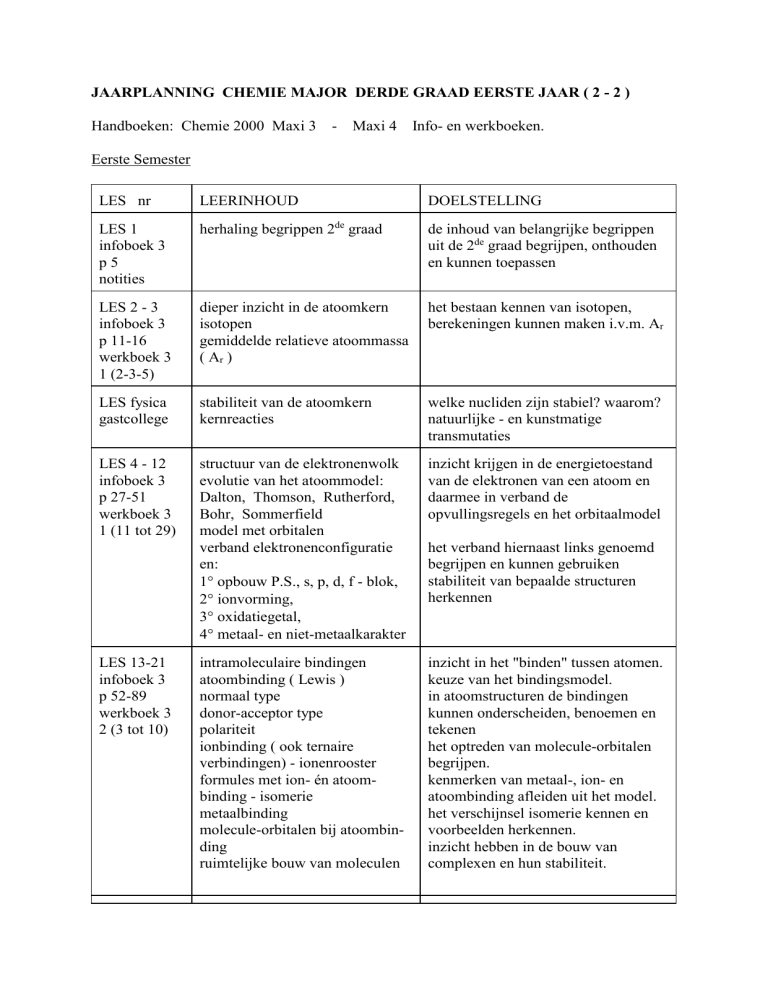
JAARPLANNING CHEMIE MAJOR DERDE GRAAD EERSTE JAAR ( 2 - 2 )
Handboeken: Chemie 2000 Maxi 3 - Maxi 4
Info- en werkboeken.
Eerste Semester
LES nr
LEERINHOUD
DOELSTELLING
LES 1
infoboek 3
p5
notities
herhaling begrippen 2de graad
de inhoud van belangrijke begrippen
uit de 2de graad begrijpen, onthouden
en kunnen toepassen
LES 2 - 3
infoboek 3
p 11-16
werkboek 3
1 (2-3-5)
dieper inzicht in de atoomkern
isotopen
gemiddelde relatieve atoommassa
( Ar )
het bestaan kennen van isotopen,
berekeningen kunnen maken i.v.m. Ar
LES fysica
gastcollege
stabiliteit van de atoomkern
kernreacties
welke nucliden zijn stabiel? waarom?
natuurlijke - en kunstmatige
transmutaties
LES 4 - 12
infoboek 3
p 27-51
werkboek 3
1 (11 tot 29)
structuur van de elektronenwolk
evolutie van het atoommodel:
Dalton, Thomson, Rutherford,
Bohr, Sommerfield
model met orbitalen
verband elektronenconfiguratie
en:
1 opbouw P.S., s, p, d, f - blok,
2 ionvorming,
3 oxidatiegetal,
4 metaal- en niet-metaalkarakter
inzicht krijgen in de energietoestand
van de elektronen van een atoom en
daarmee in verband de
opvullingsregels en het orbitaalmodel
intramoleculaire bindingen
atoombinding ( Lewis )
normaal type
donor-acceptor type
polariteit
ionbinding ( ook ternaire
verbindingen) - ionenrooster
formules met ion- én atoombinding - isomerie
metaalbinding
molecule-orbitalen bij atoombinding
ruimtelijke bouw van moleculen
inzicht in het "binden" tussen atomen.
keuze van het bindingsmodel.
in atoomstructuren de bindingen
kunnen onderscheiden, benoemen en
tekenen
het optreden van molecule-orbitalen
begrijpen.
kenmerken van metaal-, ion- en
atoombinding afleiden uit het model.
het verschijnsel isomerie kennen en
voorbeelden herkennen.
inzicht hebben in de bouw van
complexen en hun stabiliteit.
LES 13-21
infoboek 3
p 52-89
werkboek 3
2 (3 tot 10)
het verband hiernaast links genoemd
begrijpen en kunnen gebruiken
stabiliteit van bepaalde structuren
herkennen
LES 22 - 25
infoboek 3
p 89-109
werkboek 3
2 (11 tot 31)
intermoleculaire krachten
vanderwaals-, dipool-, H-brug-,
ion-dipool-, roosterkrachten.
toepassingen:aggregatietoestand oplosbaarheid - geleiding
complexen
het bestaan van de verschillende intermoleculaire krachten kennen en de
gevolgen ervan voor de eigenschappen
van de stoffen begrijpen.
Eerste Semester - Practica
nr PRACT
LEERPLAN
DOELSTELLING
1
bunzenbrander
vlamproeven
werking en de bunzenbrander begrijpen en
correct gebruiken.
het verband begrijpen tussen de waargenomen kleur en de elektronenconfiguratie
2
metaal- en niet-metaalkarakter
een aantal verschillen tussen de metalen en
niet-metalen opsporen.
3
complexen
de kleur en de oplosbaarheid van enkele
complexen onderzoeken
JAARPLANNING CHEMIE MAJOR DERDE GRAAD EERSTE JAAR ( 2 - 2 )
Handboeken: Chemie 2000 Maxi 3
- Maxi 4
Info- en werkboeken.
Tweede Semester
LES 25-28
infoboek 3
p 110-125
werkboek 3
3 (1 tot 4)
website
verdere kennismaking stofklassen
oxiden - hydroxiden - zuren zouten
naam - formule – oxidatiegetal uitbreiding naamvorming 4de
beheersen van: indeling, naamvorming,
formule, oxidatiegetal, omzettingen
tussen verbindingsklassen.
uitbreiding t.o.v. 4de : base + nietmetaaloxide - overbodige indices
weglaten - metalen met verschillende
oxidatiegetallen (Fe, Ni, Co, Cu, Hg,
Pb, Sn - eerste confrontatie met hun
positie in het P.S. )
LES 29-36
infoboek 3
p 126-157
werkboek 3
3 (8 tot 12)
stofklassen organische chemie
indeling koolstofverbindingen.
koolwaterstoffen:
verzadigd/ onverzadigd
vertakt/onvertakt
Monofunctionele koolstofverbindingen: functionele groepen.
naamvorming - formules.
beheersen van indeling koolstofverbindingen, koolwaterstoffen:
naamvorming, bruto-, elektronen-,
lewis-, structuur-, skeletformule.
uitbreiding t.o.v. 4de: nu ook voor
onverzadigde en vertakte ketens.
herkennen van de structuur en
eigenschappen van de functionele
groepen van de verschillende
stofklassen en beheersen van hun
naamvorming.
oefeningen isomerie.
de eigenschappen van de verschillende
stofklassen kunnen afleiden uit de bouw
van hun moleculen.
3
nr
leerinhoud
doelstelling
LES 37 42
infoboek 3
p 158-183
werkboek 3
4 (2 tot 29)
materieaspecten van de
chemische reacties
Herhaling van de begrippen:
- mol
- molaire concentratie
- molair gasvolume bij
norm- en andere
omstandigheden.
- dichtheid
Definiëren dat het molair gasvolume bij
normomstandigheden 22,4 L/mol bedraagt
en wordt bepaald door het aantal moleculen
en niet door de aard van het gas.
Berekeningen kunnen maken van het
gasvolume, de massa en/of het aantal
deeltjes bij norm- en andere
omstandigheden.
Berekeningen kunnen maken in verband met
dichtheid van zuivere stoffen en mengsels.
Verschillende uitdrukkingen
voor concentratiegegevens en
hun belang voor milieu,
veiligheid en huishoudchemicaliën.
Stoichiometrische berekeningen.
Omrekeningen kunnen maken tussen de verschillende eenheden van concentratie:
Mol/L, g/L, massa%, volume%, ppm en
ppb.
Berekeningen met al de hoger genoemde
eenheden kunnen maken aan
reactievergelijkingen in stoichiometrischeen andere verhouding.
4
LES 43-48
infoboek 4
p 13 - 40
werkboek 4
5 (1 tot 28)
Verandering van inwendige
energie ΔU tijdens chemische
processen.
Endo- en exo-energetische processen in verband kunnen brengen met een verschil in
energie-inhoud tussen de eindtoestand
( reactieproducten ) en de begintoestand
( reagentia ) en voorstellen in een
energiediagram.
Activeringsenergie.
Duiden dat zowel endo- als exo-energetische
reacties activeringsenergie (startenergie)
kunnen vereisen.
Enthalpieverandering ΔH
tijdens een chemische
reactie.
Enthalpieverandering ΔH definiëren als de
reactiewarmte Q bij constante druk.
De specifieke enthalpieveranderingen
benoemen.
De wet van Hess
Spontane en niet-spontane
reacties.
Entropieverandering S
tijdens een proces.
Het verband tussen de
verandering van Gibbs=vrije
energie G en het verloop
van een chemisch proces.
De wet van Hess interpreteren
als de wet van behoud van energie:
de totale energieverandering is onafhankelijk
van de gevolgde weg. Deze wet toepassen in
berekeningen van onbekende ΔH.
Het begrip enthalpie in verband kunnen
brengen met het aantal realiseringsmogelijkheden en wanordelijke toestand.
Aan de hand van voorbeelden kunnen
illustreren dat de spontaneïteit van een
chemisch proces niet exclusief wordt verklaard
door een verminderde enthalpie maar ook door
een toegenomen entropie.
De verschillende mogelijkheden van procesverloop in verband kunnen brengen met de
verandering van enthalpie en van entropie van
een chemische reactie.
De combinatie van enthalpieverandering en
entropieverandering in de verandering van
Gibbs=vrije energie begrijpen.
5
infoboek 4
p 41-45
werkboek 4
6 (2 tot 17)
snelheid van een chemische reactie:
botsingsmodel als basismechanisme
effectieve botsingen kunnen
omschrijven als botsingen tussen
reagensdeeltjes bepaald door hun
kinetische energie en oriëntatie
infoboek 4
p 46-50
werkboek 4
6 (2 tot 17)
notities
snelheidswet:
gemiddelde snelheid <vi>
ogenblikkelijke snelheid vt
reactiesnelheid kunnen omschrijven
met behulp van concentratieverandering van een stof binnen een bepaald
tijdverloop.
Het verband tussen <vi> en vt
begrijpen.
Tabellen en grafieken kunnen
opstellen en interpreteren
infoboek 4
p 50-56
werkboek 4
6 (2 tot 17)
demoproef
practicum
factoren die de reactiesnelheid
beïnvloeden
de invloed van concentratie,
verdelingsgraad, temperatuur, licht
en katalysator op de reactiesnelheid
kunnen verklaren en
identificeren in toepassingen
infoboek 4
p 56-63
werkboek 4
6 (2 tot 17)
notities
snelheidsvergelijking:
wet van Guldberg en Waage
verband tussen de experimentele
bepaling van de reactiesnelheid en
het reactiemechanisme
het verband tussen de
snelheidsvergelijking en de
snelheidsbepalende stap
van een reactie kunnen vinden
( in beide richtingen )
de orde van een reactie kunnen
bepalen
infoboek 4
p 64-66
reactiemechanismen: zie later in de
C-chemie
zie later in de C-chemie
6
JAARPLANNING CHEMIE MAJOR DERDE GRAAD EERSTE JAAR ( 2 - 2 )
Toepassingen – practica
Tweede semester
nr
leerinhoud
doelstelling
TOEP.1
Eigenschappen en toepassingen
van anorganische verbindingen
anorganische stoffen weten te situeren
in natuur, industrie en dagelijks leven
leerlingen brengen mee: stoffen,
verpakkingen, etiketten, reklame,
documentatie en houden een
spreekbeurt.
TOEP.2
Eigenschappen en toepassingen
van organische verbindingen.
organische stoffen weten te situeren in
natuur, industrie en dagelijks leven
leerlingen brengen mee: stoffen,
verpakkingen, etiketten, reklame,
documenten en houden een spreekbeurt.
TOEP.3
Infoboek 3
p147-154
Veilige omgang met organische
verbindingen
een gepaste houding kunnen aannemen
i.v.m. chemicaliën in eigen leven en in
de maatschappij.
nr
leerplan
doelstelling
PRACT.
4-5
Eigenschappen van - en
omzettingen tussen anorganische
verbindingsklassen
ervaring opdoen in het laboratorium
eigenschappen van verbindingen uit de
anorganische verbindingsklassen
zelf onderzoeken.
PRACT.
6-7
Eigenschappen van
alkanen - alkanolen - carbonzuren
ervaring opdoen in het laboratorium
eigenschappen van organische
verbindingsklassen zelf onderzoeken
PRACT.
8-9
Enthalpie en entropie
spontane en niet-spontane reacties
enthalpieveranderingen waarnemen en
meten. entropieveranderingen beredeneren
PRACT.
10
Reactiesnelheid
onderzoek naar factoren die
de reactiesnelheid beïnvloeden.
7
8
9