Nieuwe leerplannen chemie 3e graad ASO
vanaf 1 september 2014
Aanpassingen t.o.v. leerplan 2006
Vanaf nu zijn er twee verschillende leerplannen: dus ook twee boeken
verschillende leerboeken!
o
Op weg met Chemie 3A & 4A
Voor richtingen met component wetenschappen
o
Op weg met chemie 3B & 4B
richtingen met component wiskunde (zonder wetenschappen)
De onderzoeksopdrachten werden in de derde graad aangepast naar
analogie met 2de graad (voor de wetenschappelijke richtingen).
Dit om efficiënter aan de onderzoekcompetenties te kunnen werken.
De leerplannen hebben een meer conceptuele structuur. De contexten zitten nu meer op de achtergrond:
Thema’s
Bouw van de stoffen
Verdere kennismaking met
stofklassen
Concepten
Structuur en eigenschappen van de materie
Atoommodellen
Molecuulmodellen
Intermoleculaire krachten
Anorganische stofklassen
Organische stofklassen
De chemische reactie
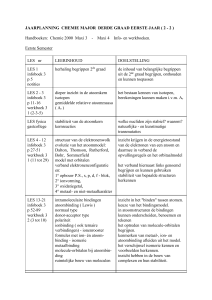
Lestijden
Materieaspecten
Thermodynamica
Reactiesnelheid
Chemisch evenwicht
Zuur-basereacties
Redoxreacties
Reactietypes in de koolstofchemie
Reactiesoorten
Dit overzicht geldt voor de 3 graaduren.
Voor meer graaduren is er uitbreidingsleerstof voorzien, voornamelijk bij de reactiesoorten)
Motstraat 32
2800 Mechelen
T: 015 36 36 36
F: 015 36 36 37
[email protected]
www.plantyn.com
8u
7u
3u
7u
8u
8u
1u
4u
7u
8u
6u
8u
Overzicht specifieke aanpassingen aan de leerplandoelen:
Atoommodellen
Molecuulmodellen
Intermoleculaire
krachten
Anorganische
stofklassen
Organische
stofklassen
Materieaspecten
Thermodynamica
Reactiesnelheid
Chemisch
evenwicht
Zuur-basereacties
Redoxreacties
Reacties in de
koolstofchemie
Ioniserende straling in fysica, geen overlappingen meer in leerstof toelaten
Lewisformules vanuit aangereikt skelet van moleculen en poly-atomische ionen
Grootte van atomen en ionen, bindingslengte
Hybridisatie van orbitalen om bindingen in koolwaterstoffen te verklaren
(verdieping ,V):
Dispersiekrachten (i.p.v. Vanderwaalskrachten)
Een aantal gegeven reactiepatronen in leerplandoelstellingen (B + V)
Nieuwe naamgeving IUPAC: het positienummer staat voor het deel van de naam
waarop het betrekking heeft
Voorbeelden: but-1-een i.p.v. 1-buteen, propaan-2-ol i.p.v. 2-propanol
Determinatietabel: komt niet meer voor in de tekst
geen grote wijzigingen
Activeringsenergie en reactie-energie in energiediagram
Enthalpie (entropie en vrije energie) als uitbreiding kwalitatief
Ogenblikkelijke reactiesnelheid :niet in doelstelling, wel bij de wenken.
Idem: Orde van een reactie
Standaardreductiepotentiaal en sterkte van reductoren en oxidatoren
Een elementaire syntheseweg voor een eenvoudige koolstofverbinding
voorstellen
Kunststoffen Herkennen en toepassingen verklaren vanuit de structuur
Biochemische stoffen en hun reacties en toepassingen: volledig naar biologie (zie
ook ioniserende straling)
Motstraat 32
2800 Mechelen
T: 015 36 36 36
F: 015 36 36 37
[email protected]
www.plantyn.com