Metabolisme en voeding samenvatting
Introductiecollege
Metabolisme en voeding
J. Kruit
Een goed afgesteld metabolisme voorkomt dat je ziek wordt, voeding heeft veel invloed op het
metabolisme. Microbiota in je darm hebben invloed op hoe voedsel verwerkt wordt, het kan
voorspellend werken over hoe je omgaat met voeding.
Catabole pathways: reacties die energie opleveren, voeding wordt afgebroken.
Anabole pathways: reacties die energie kosten, hierbij worden stoffen gemaakt. Bijvoorbeeld
eiwitten en vetten.
College 1
Energie metabolisme
J. Kruit
Er zijn veel metabolische reacties, deze staan alleemaal met elkaar in verbinding. Als er in één reactie
iets mis gaat dan heeft dat vervolgens invloed op allerlei andere reacties. Een goede regulering is dan
ook van belang.
Een van de belangrijkste metabolische reacties is: ATP↔ADP
Van ATPADP levert energie op dat gebruikt kan worden bij beweging, transport, biosynthese enz.
Van ADP ATP kost energie en gebeurt in mensen door oxidatie van brandstofmoleculen(voeding).
Fotosynthese zorgt hiervoor in planten.
ATP is een redelijk instabiel molecuul, de negatieve ladingen van fosfaat stoten elkaar af, dit levert
energie op. Het betekent echter ook dat ATP nooit lang in stand gehouden kan worden. Wanneer
ATP hydrolyseert tot ADP komt energie vrij doordat het molecuul van een hogere energietoestand
naar een lagere gaat. Spieren kunnen
hierdoor bijvoorbeeld samentrekken.
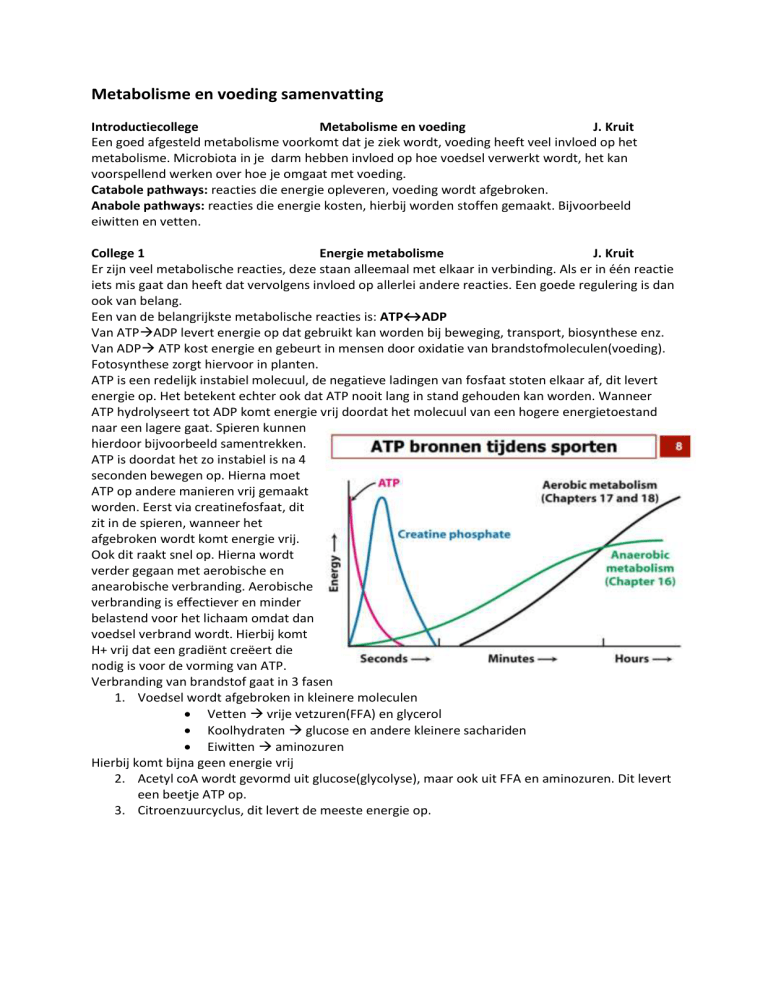
ATP is doordat het zo instabiel is na 4
seconden bewegen op. Hierna moet
ATP op andere manieren vrij gemaakt
worden. Eerst via creatinefosfaat, dit
zit in de spieren, wanneer het
afgebroken wordt komt energie vrij.
Ook dit raakt snel op. Hierna wordt
verder gegaan met aerobische en
anearobische verbranding. Aerobische
verbranding is effectiever en minder
belastend voor het lichaam omdat dan
voedsel verbrand wordt. Hierbij komt
H+ vrij dat een gradiënt creëert die
nodig is voor de vorming van ATP.
Verbranding van brandstof gaat in 3 fasen
1. Voedsel wordt afgebroken in kleinere moleculen
Vetten vrije vetzuren(FFA) en glycerol
Koolhydraten glucose en andere kleinere sachariden
Eiwitten aminozuren
Hierbij komt bijna geen energie vrij
2. Acetyl coA wordt gevormd uit glucose(glycolyse), maar ook uit FFA en aminozuren. Dit levert
een beetje ATP op.
3. Citroenzuurcyclus, dit levert de meeste energie op.
Glycolyse: De omzetting van glucose tot pyruvaat. Hierbij komt ATP vrij. Het pyruvaat wordt
vervolgens gebruikt in mitochondriën(normale inspanning/O2 levels) of tijdens lactaat(laag O2 in
spieren). Bestaat ook weer uit verschillende fases.
1. Er zijn twee stappen die energie
kosten, namelijk bij hexokinase
en phosphofructokinase. Deze
stappen zijn om deze reden niet
reversibel. Dit deel van de
glycolyse kost 2 ATP.
2. De tweede fase gaat 2x, uit één
glucose molecuul worden dus 2
pyruvaat moleculen gevormd. Er
zijn twee stappen waarbij
energie vrijkomt. Namelijk bij
phosphoglyceraat kinase en
pyruvaat kinase. In totaal komt
hier dus 4 ATP vrij. Daarnaast
komt er ook nog 2NADH vrij.
Het NADH moet omgezet
worden naar NAD+ gebeurt dit
niet dan stopt de glycolyse. De
omzetting van pyruvaat naar
ethanol en lactaat is dan ook
van belang om de redox balans
te behouden. Deze twee reacties
zijn anaeroob.
Er is ook een aerobe pathway
waarbij pyrufaat omgezet wordt
tot acetyl CoA, dit levert meer
engergie op.
3. Wanneer er tijdens rust weinig
ATP nodig is, dan ontstaat erveel
glucose-6 fosfaat, deze stof geeft
negatieve terugkoppeling op
hexokinase waardoor de glycolyse
geremd wordt. Rem je de
glycolyse niet dan is er te veel
ATP. Te veel ATP zorgt ook voor
remming van de glycolyse.
4. Bij lage ATP gehaltes is er
positieve feedback die voor een
stimulering van de glycolyse zorgt.
Glycolyse in tumoren is hoog, dit komt doordat ze veel glucose verbruiken bij groei en deling.
Zuurstof tekort in tumoren zorgt voor HIF1 activatie die weer zorgt voor vaatgroei en een toename
van glycolyse enzymen.
ATP is de universele drager van energie
Tijdens glycolyse wordt glucose omgezet in 2 pyruvaatmoleculen, dit levert netto 2 ATP en 2NADH
moleculen op.
NAD+ word geregenereerd door oxidatie van Acetyl CoA of door reductie van pyrovaat tot lactaat en
ethanol.
Regulatie van gycolyse vindt plaats door regulatie van hexokinase, fosfofructokinase en pyruvaat
kinase.
Citroenzuurcyclus
Voor pyruvaat de citroenzuurcylcus kan betreden moet het omgezet worden tot Acetyl CoA. Ook dit
proces is een irreversibel proces
De omzetting van pyruvaat naar acetyl coA wordt geregeld door pyruvaat dehydrogenase(PDH),
hierbij wordt NAD+ naar NADH omgezet. De aanwezigheid van ATP, NADH en Acetyl coA hebben een
remmen de regulering van PDH. De aanwezigheid van ADP en pyruvaat stimuleren de omzetting juist.
Ook in de citroenzuurcyclus zitten een paar punten die voor
regulering zorgen. Zie afbeelding
Deze regulering is nodig, omdat de cyclus ook voor
grondstoffen zorgt, wanneer je dus de hele cyclus remt zijn
deze grondstoffen ook niet meer beschikbaar. Voor de
grondstoffen die de citroenzuurcyclus oplevert zie de
afbeelding hieronder.
Tussen de citroenzuurcyclus en de oxidatieve fosforylering is een
koppeling. De elektronen die vrij komen tijdens de
citroenzuurcyclus worden namelijk gebruikt bij de vorming van de
gradiënt die nodig is om ADP in ATP om te zetten. Er zijn 5
elektronenpompen die een rol spelen bij het elektron transport
over het membraan. De ATP synthase gebeurt in de
mitochondriën. Protonen worden de mitochondrie ingepompt
veroorzaken een gradiënt ATP synthase.
Ontkoppeling OxFos
UCP1 is een ontkoppelingseiwit, wat geactiveerd wordt door vrije
vetzuren. Hierdoor is er proton instroom, waardoor het gradiënt
verdwijnt en ATP vorming niet meer efficiënt is. Dit proces
verstoord het metabolisme. Tijdnes dit proces komt hitte vrij, de
verbranding blijft namelijk doorgaan zonder dat er ATP vrijkomt. Dit proces is erg interessant bij
diëten omdat je dan vet verbrand zonder dat je veel hoeft te bewegen. UCP1 speelt een rol in
bruinvetweefsel, het zorgt namelijk voor thermogenese bij bv onderkoeling.
Pyruvaat dehydrogenese verbindt de glycolyse met de citroenzuurcyclus
De citroenzuurcyclus oxideert acetylgroep tot CO2. Netto levert dit 1 ATP, 2 NADH en 1 FADH op.
Koppeling citroenzuurcyclus met oxidatieve fosforylering levert ATP op
Elektron transport keten zorgt voor protonen gradient. Protonen gradient zorgt voor ATP synthese.
College 2
Koolhydraat metabolisme
J. Kruit
Glucose in het bloed moet sterk gereguleerd worden, gebeurt dit niet dan:
Hypoglykemie: Een te laag bloedsuikergehalte. Je wordt duizelig, begint te trillen, zweten enz.
Hyperglykemie: Een te hoog bloedsuiker. Je wordt dorstig, moe, hongerig enz.
In beide gevallen kun je uiteindelijk in coma raken.
Een goede glucosehomeostase is dus van belang, deze moet ervoor zorgen dat de bloed glucose
waardes altijd tussen de 4-6 mM zijn.
Koolhydraten krijg je binnen via voeding, er zijn verschillende soorten
- Monosachariden: deze kunnen rechtstreeks in het bloed opgenomen worden
- Disachariden: moeten afgebroken worden tot monosachariden voor ze opgenomen kunnen
worden.
- Polysachariden: moeten ook afgebroken worden. Gebeurt net als disachariden in de dunne
darm.
o α-glucosides: bijvoorbeeld zetmeel en glycogeen, zijn afbreekbaar
o β-glucosides: bijvoorbeeld cellulose, niet afbreekbaar in de dunne darm, klein beetje
in dikke darm.
Lactase is een bijzonder koolhydraat, bij mensen kan het in de darmen afgebroken worden met
behulp van het enzym lactase. De meeste dieren hebben het enzym lactase niet en sommige mensen
ook niet. Deze dieren/mensen breken lactase af mbv bacteriën. Wat een opgeblazen gevoel geeft
door gassen die erbij vrij komen. Ook hebben deze mensen vaker last van diarree.
Koolhydraat absorptie
1. enzymen op het darm lumen digesteren disachariden tot monosachariden.
2. Door diffusie of actief transport via SGLT receptoren gaan monosachariden de cellen binnen.
3. De opgenomen monosachariden verlaten de epitheelcellen via GLUT receptoren en diffusie
en komen zo in het bloed terecht.
4. Bloed transporteert de glucosemoleculen naar andere cellen in het lichaam.
Insuline speelt een belangrijke rol in de regulatie van dit proces. Insuline wordt door de β cellen van
de pancreas afgegeven, wanneer de bloedglucose gehaltes stijgen. In deze cellen vind vervolgens
glycolyse plaats waarna ATP gevormd wordt, ATP zorgt voor een gradiënt die vervolgens het signaal
is voor insuline afgifte. Je wil dus dat glycolyse in de betacellen niet geremd wordt, want ATP zorgt
voor de terugkoppeling die nodig is voor insuline afgifte. Hierdoor zijn de GLUT receptoren op de
pancreas beta cel ook veel minder gevoelig voor glucose dan op normale celen. Hierdoor is er altijd
glucose instroom in beta cellen mogelijk. Het hexokinase is in de glycolyse in de β cel dan ook
vervangen voor een ander molecuul(glucokinase) dat dezelfde functie heeft, maar de glycolyse niet
remt. Glucokinase zorgt pas voor remming als de
bloedsuikerlevels normaal zijn.
Insuline is noodzakelijk om de glucose piek weg te
werken. In spier en vetweefsel activeert insuline de
insulinereceptoren, deze geven signalen af die zorgen
voor een translocatie van de GLUT 4 receptor,
waardoor deze open gaat staan en glucose de cel
binnen laat. Hierna vindt onder andere glycogeen,
vet en eiwit synthese plaats. Ook vind er groei en
genexpressie plaats.
Spier en vetweefsel bufferen de bloedglucose waarden, in spieren wordt glucose opgeslagen als
glycogeen en in vetweefsel wordt het gebruikt voor vetsynthese.
Glycogeen
Glycogeen is een glucose polymeer. In spier en lever cellen is glycogeen zichtbaar als kleine zwarte
bolletjes. Insuline zorgt voor de omzetting van glucose naar glycogeen. Glycogeen moet ook
afgebroken worden wanneer er vraag naar energie/glucose is.
Deze pathway wordt gereguleerd door glucagon en
epinefrine. Deze stoffen komen vrij bij vasten en beweging
en induceren vervolgens de afbraak van glycogeen.
Glycogeen opslag is genoeg voor één dag vasten, daarna
moet het lichaam ene andere bron van energie vinden
omdat er dan niet meer genoeg glucose in het bloed is.
Na een maaltijd stijgt bloedglucose, hierdoor wordt
insuline afgegeven.
Insuline bindt aan de insuline receptor in de spier en
vetcellen, waarna GLUT4 naar het plasmamebraan wordt
vervoerd. Hierdoor vindt insuline afhankelijke glucose
opname plaats.
Glucose wordt opgeslagen in de spier en lever in de vorm
van glycogeen. Vasten of inspanning resulteert in de
afbraak van glycogeen.
Glycogeen opslag is genoeg voor één dag vasten.
Wat gebeurt er als de bloedglucose waardes te laag worden?
Neuronen doen hun werk niet meer goed, want glucose is primaire energie bron. In neuronen kan
geen vervangende vetzuuroxidatie plaats vinden, daarom ketonoxidatie, maar dit is toxisch.
Ook rode bloedcellen functioneren niet meer, want zij hebben geen mitochondriën en kunnen dus
niet anders dan op energie van glucose leven.
Er moet gluconeogenese plaats vinden.
Gluconeogenese
Vorming van nieuw glucose uit pyruvaat. Grondstoffen voor gluconeogenese en dus pyruvaat zijn
lactaat, aminozuren en glycerol. Proces vindt plaats in de lever, kleine rol voor nieren.
Voor de vorming van pyruvaat uit lactaat en sommige aminozuren en oxaloacetaat uit sommige
aminozuren is energie nodig. Gluconeognese levert dus geen ATP op.
Doordat glycolyse en
gluconeogenese tegengestelde
processen zijn is de manier van
reguleren ook tegengesteld.
Lactaat dat vrijkomt bij glycolyse in
de spieren kan in de lever gebruikt
worden voor gluconeogenese.
Wanneer glucose huishouding
verstoord is heb je in de meeste
gevallen last van diabetes.
College 3
Vetmetabolisme A
J. Kruit
Er zijn twee soorten vetzuren
- Verzadigd: geen dubbele bindingen
- Onverzadigd: Met een of meer dubbele bindingen
o Trans: H-atomen zitten aan tegengestelde kant van het molecuul. Dit zijn de
ongezonde vetzuren, dit zijn vetten die hard zijn en blijven. Ze zitten bijvoorbeeld in
frituurvet, magarine, koekjes etc. Deze vetten worden met een verhoogde kans op
hart en vaatziekten gecorreleerd.
o Cis: h-atomen aan dezelfde kant.
o ω -klasse vetzuren zijn essentiële vetzuren die we uit het voedsel moeten halen.
Vetzuren kunnen gebruikt worden als
- brandstof
- Bron van bouwstenen voor fosfolipiden en glycolipiden
- Als (transport)signaalmoleculen op eiwitten.
- Bouwstenen voor hormonen en intracellulaire signaalmoleculen
Vetten bestaan uit drie vetzuurketens en een glycerol molecuul, dit noemen we een triglyceride. Vet
wordt als triglyceride opgeslagen in een adipocyt. Een adipocyt bestaat uit een grote vetdruppel met
daaromheen de organellen.
Wanneer je vast kun je een dag overleven op je glycogeen reserves. Daarna kun je ongeveer 12
dagen vasten op eiwitten. Hierna moet je overgaan op vetverbranding dan kun je het nog 60 dagen
volhouden. Triglyceriden zijn ideaal als energie opslag omdat het een energierijk molecuul is,
daarnaast zijn triglyceriden stabiele stoffen. Reageren ze niet met de omgeving en hebben ze buiten
de rol als bouwstof geen andere functie in het lichaam. Doordat vet hydrofoob is en water afstoot
kan het goed opgeslagen worden, het lost namelijk niet op in water zoals eiwitten en glycogeen wel
doen.
Als je vet binnenkrijgt via voeding bestaat het uit een grote klomp vet,
dit moet verteerd worden tot kleinere klompjes. Dit gebeurt via
emulgatie met galzouten. De productie van galzouten kost veel
energie, daarom worden ze aan het einde van de dunne darm weer
opgenomen in het bloed en terug naar de lever getransporteerd.
Voor de productie van galzouten wordt het molecuul cholesterol
gebruikt. Galzouten worden in de lever geproduceerd en in de galblaas
opgeslagen, via de galgang komen ze in de dunne darm.
Als de galgang verstopt is dan worden vetten niet meer afgebroken.
Ook kunnen in vet oplosbare vitaminen niet meer opgenomen worden
en is de afbraak van hemoglobine niet goed mogelijk.
De kleinere klompjes vet zijn na emulgatie met galzouten te bereiken
door lipases die de vetten verder verteren tot monoglyceriden en vrij
vetzuren. Hierna worden ze de darmcel in getransporteerd waar ze
weer tot triglyceride gevormd worden. Deze triglyceriden aggregeren
vervolgens tot chylomicronen, die omringd worden met lipoprotein.
Via exocytose komen de chylomicronen vervolgens in de lymfebaan en
daarna in het bloed waar ze verder verspreid worden over het
lichaam. In de lymfevaten worden vervolgens door lipoprotein
lipase(LPL) vrij vetzuren uit de chylomicron gehaald die in vetweefsel
opgenomen kunnen worden. De overgebleven delen van het
chylomicron wordt door de lever geklaard. Deze vorming van
chylomicronen gebeurt alleen bij lange vetzuurketens, korter ketens
kunnen na binding met albumine gewoon in het bloed opgenomen
worden.
Galzouten en lipases zijn belangrijk voor de opname van vetten door de darm.
In de enterocyt worden triglyceriden opnieuw uit glycerol en vetzuren gevormd, waarna deze worden
ingebouwd in chylomicronen en uitgescheiden via het lymfesysteem.
Lipoproteine lipase (LPL) hydrolyseert de triglyceriden tot vrije vetzuren die kunnen worden
opgenomen door weefsels.
Wanneer iemand last heeft van LPL deficientie zie je dat deze persoon extreem hoge triglyceride
waardes in zijn bloed heeft. Ook hebben deze mensen vaak een groeiachterstand doordat ze minder
energie voor groeit tot hun beschikking hebben. Dit komt doordat vetten niet meer gehydroliseert
worden en er dus heel veel chylomicronen in het bloed blijven zitten.
Bij vasten en beweging is de verbranding van vetten nodig. Hiervoor moeten signalen afgegeven
worden. Bij vasten is dit de afgifte van glucagon en bij bewegen de afgifte van adrenaline. Deze
stoffen activeren een receptor op vetweefsel die vervolgens een pathway activeert waarbij
triglyceriden afgbroken worden tot FFA en glycerol. Glycerol wordt in de levercel gebruikt voor de
glycolyse(eindproduct pyruvaat) of gluconeogenese(eindproduct glucose). FFA worden in andere
weefsels gebruikt voor vetzuuroxidatie via de citroenzuurcyclus.
Vetzuur oxidatie
1. FFA + CoA + ATP -> acyl Coa vind plaats in
het cytosol
2. Nu transport naar mitochondriën, hier
reageert acyl CoA met Carnitine, waarbij acyl
carnitine en CoA gevormd worden.
3. Deze stappen kunnen weer ongedaan
gemaakt worden, maar het kost in principe
ATP. Het is nodig om acyl coA over het
mitochondrie membraan te laten
transloceren.
4. Acyl CoA wordt vervolgens gebruikt in de
citroenzuurcyclus.
De citroenzuurcyclus levert int totaal 10 ATP
moleculen op, namelijk 3 NADH= 3x 2,5 ATP,
1FADH2 =1,5 ATP en 1 GTP= 1ATP
Rekenvoorbeeld: Een palmitaat molecuul. Heeft 16 C
atomen, hieruit kunnen 8 acetyl CoA gevormd
worden, samen levert dit 8x10= 80 ATP op.
Daarnaast komt er bij de afbraakt van het molecuul
tot acetyl CoA ook nog 7 NADH en 7FADH2 vrij.
Dit is dus 7x2,5 + 7x1,5 = 28 ATP
De activatie van palimitaat kost 2 ATP.
Uiteindelijk dus 106 ATP.
Oxaloacetaat is nodig voor acetyl CoA om de
citroenzuurcyclus te betreden. Er is weinig oxaloacetaat
wanneer mensen
- Vasten
- Diabetes hebben
- Een ketogeen dieet volgen
Dit omdat tijdens deze processen de lever geen vetzuren
kan verbranden. Het gebruikt daarom oxaloacetaat.
Wanneer lichaamsuikers niet genoeg energie leveren, gaat het lichaam over op de afbraak van
vetzuurketens, dit wordt ook wel ketogenese genoemd. Hierbij worden ketonen gevormd die als
brandstof kunnen dienen in cellen. Dit proces vindt plaats in de lever. De levercel heeft hiervoor
vetzuren nodig, die het om zet tot acetyl coA en vervolgens tot ketonen. De ketonen gaan via het
bloed naar andere weefsels waar ze gebruikt worden in de citroenzuurcyclus.
Wanneer er teveel ketonen gevormd worden doordat er geen glucose is dan spreek je van ketoacidose. Hierdoor daalt de pH van het bloed en kun je in coma raken. Dit gebeurt bijvoorbeeld bij
diabetes type 1.
Tijdens vasten en intensieve beweging stimuleren glucagon en adrenaline de triglyceride afbraak in
de adipocyten.
Glycerol gaat via het bloed naar de lever. Glycerol wordt gebruikt voor gluconeogenese.
Vrije vetzuren worden gebruikt voor energie generatie via de vetzuur oxidatie.
In de lever wordt tijdens vasten oxaloacetaat gebruikt voor gluconeogenese. Acetyl CoA van vrij
vetzuren worden gebruikt voor ketonen formatie.
Tijdens vasten worden vetten afgebroken tot vrije vetzuren, de meeste hiervan komen via LDL
receptoren in de lever en worden in de lever tot deeltjes die VLDL(very low density lipids) heten
gegenereerd. VLDLs zijn kleiner dan chylomicronen die veel makkelijker vetzuren transporteren. De
VLDLs worden nog wel omgezet tot LDLs die geassocieerd worden met een groter risico op hart en
vaat ziekten. Dit komt doordat ze gemakkelijk cellen kunnen betreden. Bijvoorbeeld macrofagen,
deze gaan dan vervolgens reageren met de bloedvatwand waar ze voor artherosclerose zorgen.
De meeste vetzuren krijg je uit je
voeding binnen, maar het is in de lever
mogelijk vrije vetzuren te
synthetiseren. Meestal is pathologisch,
een voorbeeld hiervan is een vette
lever als gevolg van insuline resistentie
bij diabetes.
College 4
Vetmetabolisme B
U. Tietge
Cholesterol: is een essentiele voedingstof voor alle vertebraten. Het is een bouwstof voor steroïd
hormonen en reageert ook met galzouten. Het cholesterol metabolisme is sterk gereguleerd. De
synthese kost veel energie, namelijk 18 ATP en 16 NADH. De lever is van belang bij cholesterol
metabolisme. Cholesterol is onoplosbaar in water. Cholesterol kan niet afgebroken worden door
zoogdieren.
Cholesterol metabolisme: Komt het lichaam in door voedsel, of wordt nieuw gesynthetiseerd. Gaat
het lichaam uit via ontlasting, omzetting naar galzouten. Dit doet het door eerst omgezet te worden
een oxysterol en daarna tot galzout.
Cellulair cholesterol metabolisme:
De cholesterol synthese regulatie wordt streng
gecontroleerd, hiervoor is sprake van zowel
positieve als negatieve terugkoppeling.
De regulatie vindt plaats in het ER en hier zijn drie
eiwitten bij betrokken.
- Insig
- SCAP
- SREBP
SCAP ligt tussen Insig en SREBP in, wanneer er in
SCAP cholesterol aanwezig is, dan is SCAP gebonden
aan Insig en SREBP. Gaat het cholesterol level naar beneden dan laat SCAP Insig los en SREBP ook een
klein beetje. Hierdoor wordt een receptor op het golgi systeem geactiveerd, wat vervolgens een
signaal afgeeft dat de cholesterolsynthese aangezet moet worden.
Cholesterol kan het lichaam ook binnen komen via het voedsel. Het wordt vervolgens in de darmen
door chylomicronen opgenomen. Deze transporteren het cholesterol naar de lever. Vanaf daar kan
het via VLDLs en LDL in de perifere weefsels komen.
Echter kan het cholesterol ook weer via de VLDL of LDL terug naar de darmen of de lever. Dit noem je
de transintestinale cholesterol excretie pathway.Cholesterol in deze vorm wordt ook wel slecht
cholesterol genoemd.
De reverse cholesterol transport pathway bevat goed cholesterol. De LDL worden dan namelijk door
de perifere cellen in HDL omgezet en komen vervolgens in de lever terecht, daar zorgt het voor
galzout excretie. Uiteindelijk komen die weer in de darmen terecht.
Lipoproteins: vetbolletjes, met aan de binnnenkant de polaire TG en cholesterol, de OH groep van
cholesterol bevindt zich in de apolaire buitenmembraan. Er zijn verschillende lipoproteinen.
Chylomicronen > VLDL > IDL > LDL > HDL
HDL is een speciaal lipoprotein, doordat het tegen artherosclerose kan beschermen.
In het darmepitheel zit de NPC1L1 receptor, deze
receptor zorgt voor opname van cholesterol in de darm.
Komt ook veel voor op de lever van mensen, daar zorgt
het voor heropname van cholesterol dat niet door de
galblaas gebruikt wordt.
Andere receptoren die zowel in lever als darmcellen
voorkomt zijn de ABCG5/ABCG8, deze zorgen ervoor dat
plantensterolen(PS) verwijderd worden. Het grootste
deel wordt al in de darm verwijderd, de overgebleven PS
worden in de lever verwijderd. Wanneer er een mutatie
in deze receptor is zie je dat er veel meer PS opgenomen
worden en dat de kans op artherosclerose veel hoger is.
Het LDL metabolisme, ookwel de forward pathway. De lever geeft VLDL af die weer omgezet worden
in LDL. Vervolgens bindt LDL aan de LDL receptor op perifere cellen. LDL gaat vervolgens deze cel
binnen via een endosoom. Het endosoom wordt vervolgens afgebroken, het cholesterol gaat verder
de cel in en de LDL receptor wordt gerecycled en weer terug naar et celmembraan getransporteerd.
Wanneer er veel cholesterol in de cel is wordt de synthese geremd, is er weinig cholesterol dan
wordt de synthese gestimuleerd. Tegelijkertijd komt er ook een signaal vrij dat aangeeft of er meer of
minder LDL receptoren moeten komen. Is er veel cholesterol dan komt er een signaal vrij dat ervoor
zorgt dat de recycling van LDLR geremd wordt. Is er weinig cholesterol dan wordt de productie van
LDLR juist gestimuleerd.
Wanneer er veel LDL cholesterol aanwezig is in het bloedplasma wordt dit aangevallen door de
extracellulaire matrix. Het comlex dat nu ontstaat wordt herkend door macrofagen die voor
inflammatie zorgen. Hierdoor wordt de LDL complex opname door macrofagen niet gestopt
waardoor foamcellen ontstaan die weer door andere macrofagen opgeruimd moeten worden. Er
ontstaat chronische inflammatie die slecht is voor de celwand waardoor uiteindelijk artherosclerose
ontstaat.
Er is dus een beschermend mechanisme nodig die dit proces voorkomt. Ons lichaam heeft daar iets
op gevonden, namelijk HDL. HDL remt via CETP LDL?????
Aangetoond is dat wanneer iemand veel HDL heeft de kans op artherosclerose kleiner is.
Maar waar komt HDL vandaan?
Cholesterol kan niet vrij voorkomen in het
lichaam, daarom wordt het geësteriseerd.
Tot cholesterolester (CE).
CE wordt selectief opgenomen door SR-BI
receptoren. Er zijn echter ook stoffen die
ervoor zorgen dat CE weer terug omgezet
wordt tot vrij cholesterol, dit is ongunstig
want dan raak je HDL weer kwijt, omdat het
vrije cholesterol vervolgens via de nieren
uitgescheiden wordt.
De ABCA1 receptor is erg belangrijk voor de
vorming van HDL, doordat het cholesterol de
de perifere cel uit transporteerd zodat het
HDL kan worden.
Wanneer er een mutatie is in het ABCA1 gen dan is er veel minder HDL en is de kans op CVD groter.
ABCA1 heterozygoten hebben ook minder HDL dan homozygoten. Door de ABCA1 receptor activatie
wordt ook ApoA1 geactiveerd samen zorgen ze ervoor dat cholesterol omgezet wordt in HDL. ApoA1
receptoren bevinden zich alleen in de lever en darmcellen, hierdoor komt HDL ook alleen maar in
deze cellen gemaakt.
Al het HDL bevindt zich vervolgens in het plasma, dit wil je niet waardoor een deel daarvan selectief
opgenomen wordt via de SR-BI receptor.
Waarom is HDL nu zo goed? Het reageert met enkele pathways die voor arhterosclerose zorgen bij
LDL.
- Remt endotheel ontsteking
- Remt LDL oxidatie en dus afgifte van vrij zuurstofradicalen
- Remt macrofaag activatie
- Remt Foam cel vorming
Verder zorgt HDL ook voor
- Cholesterol efflux en reverse cholesterol transport
- Zorgt voor NO productie door endotheel
- Remt plaque vorming in aderen.
Zoals gezegd is voor cholesterol efflux en reverse cholesterol transport HDL nodig. Dit gaat in een
aantal stappen
1. De perifere cel uit
2. De lever in
3. De lever uit
De eerste stap is de cholesterol efflux, dit gaat via een aantal receptoren. Namelijk
- ABCA1: zorgt voor cholesterol efflux
- ABCG1: Doet hetzelde als ABCA1 maar dan met grotere deeltjes
- SR-BI: zorgt voor efflux, maar dan alleen volgens de gradient.
De receptoren moeten geactiveerd worden, dit gebeurt via LXRα en LXRβ zij geven in de weefsels
stoffen af die deze receptoren activeren.
LXRα komt in bijna alle weefsels voor en reguleert het cholesterol metabolisme
LXRβ doet ditook, maar komt in minder weefsels voor, boendien reageet het op hoge cholesterol
levels.
De cholesterol komt vervolgens via andere receptoren weer de lever in waardoor er daar galzouten
gevormd worden die via de galgang afgevoerd worden naar de darmen.
Het is ook mogelijk dat cholesterol direct vanuit de bloedbaan de darmen in kan, het gaat dan niet
via de galgang. Daarnaast gebeurt dit alleen bovenin het darmkanaal. Dit wordt TICE (trans intestinal
cholesterol excretion) genoemd.
Als je LXR activeert wordt er meer cholesterol via de feces uitgescheiden.
College 5
Eiwitmetabolisme
J. Kruit
Via voeding komen aminozuren het lichaam binnen, ook komen er eiwitten binnen die afgebroken
worden tot aminozuren. Verder worden er nieuwe aminozuren gemaakt door het lichaam. Al deze
aminozuren komen in een pool waarna ze opnieuw tot eiwitten gesynthetiseerd worden, of een rol
spelen in andere pathways of geoxideerd worden.
Het grootste deel van je eiwitten krijg je via de voeding binnen. In het maagdarmkanaal worden
eiwitten door proteolytische enzymen geknipt tot aminozuren en oligopeptiden. De aminozuren en
oligopeptiden worden vervolgens via transporters over het membraan getransporteerd de darm
cellen in. In het lumen bevinden zich ook aminopeptidases die oligopeptides knippen tot tri- en
dipeptides. Bekende aminopeptidases zijn pepsine en trypsine. In de darmcellen worden de eiwitten
verder afgebroken tot aminozuren met behulp van peptidases. Daarna worden ze het bloed in
getransporteerd. Een eiwit dat afgebroken moet worden wordt door ubiquitine gemarkeerd. Dit
vindt plaats in de cel in het proteosoom. Het proteasoom breekt het eiwit af in eiwitfragmenten en
ubiquitinedeeltjes die weer gerecycled worden.
De eiwitfragmenten worden vervolgens doormiddel van proteolyse afgebroken tot aminozuren.
Aminozuren kunnen niet opgeslagen worden en ze kunnen ook niet uitgescheiden worden. Deze
aminozuren worden op verschillende manieren gebruikt
- Heel gelaten en gebruikt voor biosynthese, de aminozuren die hier niet voor gebruikt kunnen
worden worden voor de volgende processen gebruikt.
o Amino groepen worden gebruikt voor de nitrogen disposal door de ureacyclus
o Aminozuren worden verder afgbroken tot koolstof ketens die vervolgens gebruikt
kunnnen worden in de glucose/glycogeen synthese, voor vetzuursynthese en
cellulaire respiratie.
Er zitten grote verschillen in de afbraaktijd van eiwitten, ook maakt het voor de afbraak uit waar in
het lichaam het eiwit zich bevind. Eiwitten met een kort halfwaarde tijd moeten een sterk
gereguleerde genexpressie hebben, zodat er altijd genoeg aanwezig is.
Een laatste functie van eiwitdegeneratie is dat stukjes aminozuur ook gebruikt worden voor
antigeenpresentatie.
De meeste overgebleven aminozuren wordt eerst de aminogroep van de koolstofketen afgebroken,
de koolstofketens worden gebruikt in pyruvaat, acetyl CoA etc. Zodat ze uiteindelijk omgezet kunnen
worden in glucose, glycogeen of vet. De aminozuurgroep wordt in de ureacyclus gebruikt.
Hievoor wordt de amino groep omgezet in glutamaat waar weer een NH4+ groep afgehaald kan
worden die daarna de ureacyclus in gaat. Hierbij wordt gebruik gemaakt van twee enzymen
aminotransferase(voor elk aminozuur een andere soort) en glutamaatdehydrogenase.
Bovenstaande vind plaats in de lever cellen, maar wat als aminozuren zich in bijvoorbeeld spiercellen
bevinden? Ook dan wordt de stikstof groep los gemaakt en vervolgens na binding met pyruvaat als
alanine naar de lever getransporteerd en daar verder afgebroken.
NH4+ wordt vervolgens in de lever
omgezet in urea.
Dit proces verloopt via de urea
cyclus. Het NH4+ wordt als eerste
omgezet tot carbamoyl fosfaat.
Hierna gaat het de cylcus in waarna
urea eruit komt. Urea kan
vervolgens door het organisme
uitgescheiden worden.
De koolstofskeletten van de aminozuren worden
zoals gezegd gebruikt als voeding voor de
gluconeogenese.
Wanneer je de twee cycli op de vorige pagina met elkaar vergelijkt zie je dat fumaraat en asparaat in
allebei de cycli voorkomen. De ureacyclus is dus weer verbonden met de gluconeogenese.
Metabolisme tijdens het vasten
De eerste prioriteit van je metabolisme is de bloedglucose waardes op peil te houden. Nadat het
glycogeen op is dan moet er gluconeogenese plaats vinden. Dit kan via eiwitten. Dit is echter niet
optimaal want eiwitten kunnen niet opgeslagen worden, ze hebben allemaal een functie en wanneer
ze afgebroken worden gaat dit automatisch gepaard met functieverlies. Eiwitten kunnen dus wel
tijdelijk gebruikt worden voor gluconeogenese, maar daarna moet het metabolisme andere bronnen
voor energie zoeken, waarbij de eiwitten behouden kunnen blijven. Daarom gaat het lichaam
ketonen produceren. Hersenen kunnen dit omzetten tot acetyl CoA en zo de energie die dit oplevert
gebruiken.
Ketonen worden in de lever gevormd uit acetyl CoA dat vrijkomt bij de vrije vetzuur oxidatie.
College 6
Hormonale regulatie van energie metabolisme
J. Kruit
Energie homeostase is een balans. Verbruik je meer energie door beweging dan je binnenkrijgt dan
verlies je gewicht. Krijg je echter meer energie binnen dan er uitgaat dan kom je aan.
Mensen kunnen in verschillende stadia leven. Overvoed > Gevoed > Neutraal > Gevast > Uithongeren
Katabole staat: er wordt meer energie verbruikt dan aanwezig is, energie wordt vrijgemaakt door
vetzuur oxidatie.
Anabole staat: Er is meer energie dan nodig, energie wordt opgeslagen door glucose oxidatie.
Om deze balans te behouden zijn er verschillende hormonen.
Als je net gegeten hebt kom je in het stadium gevoed. Er komen dan verschillend hormonen vrij en
verschillende processen worden gestart.
- Galzoutsynhtese gaat omhoog
- Galblaas wordt geleegd
- Glucose opname wordt via de GLUT4 insuline gevoelige receptor gereguleerd
- Inslulne wordt afgegeven
- Glycolyse vind plaats
- Gylcogeen synthese gaat omhoog
- Lipogenese
- Leptine wordt afgegeven dat een verzadigingssignaal geeft.
- CCK wordt afgegeven.
Wanneer je door blijft eten raak je overvoed
- Vetweefsel wordt gevormd en je groeit
Stop je echter met eten en ga je bewegen, dan nemen bovenstaande processen langzaam af totdat
de directe energie op is. Je bevind je nu in een gevaste staat.
- Galzoutsynthese neemt af
- Galblaas wordt gevuld
- Glucose geproduceerrd
- Gluconeogenese
- Glycogeen afbraak
- Lypolyse
- Er komen hormonen als ghrelin, glucagon, catecholamines en cortisol vrij die deze processen
stimuleren en een hongergevoel opwekken.
Ga je niet eten dan honger je je zelf uit
- Ketogenese
- FAO -> vetzuur oxidatie
- Groei neemt af
- Lichaam gaat bij sommige dieren in winterslaap
Om deze balans te behouden zijn er veel verschillende signalen die ervoor moeten zorgen dat deze
balans behouden blijft. De hersenen spelen hierin een integrale rol.
Korte termijn signalen door o.a peptides die snel afgebroken worden:
- Maagvulling: Wanneer de maag gevuld is wordt dit door de nervus vagus opgemerkt, deze
geeft vervolgens een verzadiging signaal af aan de hersenen.
- Cholecystokinin(CCK): Is een peptide dat ervoor zorgt dat de vertering gestimuleerd wordt.
Geeft bovendien een verzadigingsignaal af aan de hersenen. CCK wordt door I cellen aan het
begin van de dunne darm geproduceerd en zorgt voor galblaas contractie legen galblaas.
Ook zorgt het in de pancreas voor de afgifte van enzymen die nodig zijn bij de vertering van
eiwitten, koolhydraten en vetten. Door de verzadigende werking is gekeken of CCK ook als
medicijn voor afvallen kan dienen, dit bleek niet te kunnen. Het heeft namelijk maar kort
effect. Het zorgt er voor dat je eerder verzadigd raakt en dus minder eet per eetbeurt, maar
wel vaker gaat eten. Het heeft dus geen effect op gewichtsverlies.
- Secretine: Is een peptidehormoon dat de zuurgraad reguleert in de dunne darm, heeft geen
effect op verzadiging.
- Peptide YY(PYY): zorgt voor afname eetdrang. Wordt ook gebruikt als verteringsenzym
- Glucagon like peptide 1(GLP1): Is maar kort aanwezig (2 min) heeft echter wel op veel
organen en systemen een effect.
o Zorgt voor in de darmen voor lipoproteine secretie
o Stimuleert insuline secretie door de pancreas.
o Zorgt voor een afname van de glucagon secretie
o Stimuleert daarnaast de β-cel proliferatie en de remt de β-cel apoptose.
o Stimuleert in het brein de voedseliname en zorgt voor neuroprotectie
o Stimuleert via het brein de bloedstroom en de glucose output van de lever
o Enz.
GLP1 wordt door L-cellen in de darmen geproduceerd.
- GIP: heeft net als GLP1 meerdere functies en is maar kort aanwezig in het lichaam. Ze zijn
daarom niet interessant voor diabetes therapie
o Botformatie omhoog en resorptie omlaag.
o Lipogenese en adipkine secretie omhoog.
o In pancreas stimulatie b cellen en glucagon en insuline secretie
o In brein neuroprotectie en neurogeneratie
o In hart TG metabolisme omhoog
DPP4 is een stof die GLP1 en GIP knipt waardoor ze zo snel weer afgebroken worden. Er zijn
medicijnen die deze stof remmen waardoor GLP1 en GIP langer aanwezig blijven. Dit heeft
een positief effect op diabetes type 2. Ook zijn er agonisten voor GLP1 die hetzelfde effect
proberen te behalen. Deze agonisten moeten geïnjecteerd worden dus zijn wel veel
invasiever, ze worden daarom ook alleen gebruikt bij mensen met diabetes met een BMI
boven de 30. Ze zorgen wel voor gewichtsverlies.
Langetermijn signalen
Leptine: Is een adipokine dat door de vetcelllen uitgescheiden wordt, hoe meer vetcellen hoe meer
leptine afgifte. Leptine geeft een verzadigingssignaal af.
Leptine mutatie muizen zijn insuline resistent en een goed model voor diabetes in muizen.
Leptine werkt afvallen tegen, doordat het geproduceerd wordt door vetcellen. Als er door afvallen
minder vetcellen aanwezig zijn is er ook minder leptine en heb je dus een kleiner verzadigingsgevoel.
Andersom werkt dit natuurlijk ook.
Ghrelin: Een hormoon dat vrijkomt in je maag, het zorgt ervoor datje zin in eten krijgt. Wordt
afgegeven als je een lege maag hebt.
Onbewerkt voedsel zorgt voor een verzadigingsgevoel, bewerkt voedsel als brood doet dit veel
minder.
Insuline: stimuleert anabole processen en remt katabole processen. Het zorgt dus voor energie
opslag. Het zorgt dus onder andere voor glucose opslag en glycolyse en glycogeensynthese.
Wanneer je BMI toeneemt neemt vaak je insulineresistentie ook tegen. Insulineresistentie betekent
dat je meer insuline nodig hebt om dezelfde hoeveelheid glucose op te slaan. Het gevolg is dat je
pancreas meer insuline aanmaakt en je insuline plasma levels ook hoger zijn. Wanneer de
hoeveelheid insuline niet meer toereikend is om alle glucose op te nemen spreek je van diabetes.
Ze hebben in onderzoek gekeken of insuline dik maakt. Hiervoor twee groepen muizen. Een groep
met lage insuline expressie en een groep met normale insuline expressie. Deze hebben ze op een
hoog vet dieet of een normaal dieet gezet.
Je zag dat de dieren die normale insuline levels hadden dikker werden, maar de dieren die dit niet
hadden op gewicht bleven. Beide groepen aten wel evenveel, maar de laag insuline groep beweegt
meer. Minder insuline zorgt er dus voor dat muizen minder dik worden.
Insuline maakt dus dik omdat het zorgt voor energieopslag.
College 7
Transcriptionele regulatie over energiemetabolisme
H. Jonker
Het menselijk lichaam is afhankelijk van een goede regulatie. Een voorbeeld van een regulatie proces
is het verbranden of opslaan van energie.
Meldonium: Een doping middel. Het stimuleert de glucose verbranding in het hart. Hierdoor is er
minder O2 nodig in het hart, want er hoeft geen vetverbranding plaats te vinden. Op deze manier
kan meldonium prestatie verhogend werken.
Ons lichaam heeft minimaal 1800 ca per dag nodig om alle metabole processen goed te laten
functioneren. Gemiddeld 70% van die energie wordt gebruikt voor BMR(basaal metabolic rate). Dit is
de hoeveelheid energie die iemand in rust per dag nodig heeft. De BMR kan enorm variëren. Mensen
met hetzelfde lichaamsgewicht en bouw kunnen een BMR ebben die wel 1000 ca verschilt.
Tegenwoordig veel mensen met obesitas en overgewicht hier zijn verschillende oorzaken voor
- Genetica: het menselijk lichaam is er op ingesteld alle koolhydraten en vetten op te slaan, dit
omdat mensen vroeger altijd voedsel tekorten hadden.
- Mensen bewegen minder dan vroeger, dus verbruiken minder energie
- Ons eten is minder gevarieerd. Ook bevat het producten die makkelijk verteerbaar zijn.
- Porties nemen in grote toe
- Er wordt reclame gemaakt voor slecht voedsel.
De regering probeert deze trend te stoppen met wet en regelgeving, maar dit gaat nog niet erg
soepel. Overgewicht neemt nog steeds toe. Voorbeelden zijn de fat taks op vetrijk voedsel. En
financiering van medicijnen die eetlust verminderen.
Hormonen (bv glucagon en insuline)dienen als metabole switches. Ze activeren een receptor die
vervolgens een pathway in gang zet die uiteindelijk leid tot de activatie van de transcriptie van een
gen. Dit gen codeert voor een eiwit dat weer een rol speelt in ontwikkeling, reproductie of
metabolisme. De hormonen kunnen vrijkomen door voeding, beweging, drugs of toxines.
Er is een hele familie van nucleaire hormoon receptoren, namelijk die van de steroïd hormonen
Na de ontdekking van steroïde hormonen werden langszamerhand steeds meer receptoren ontdekt
die reageerden op deze steroïden. Omdat al deze receptoren op elkaar leken werden ze in een
familie ingedeeld. Later werden er receptoren ontdekt die wel tot deze familie behoorden, maar
waar geen ligand of hormoon bekend van was dat er op paste. Weer later bleek dat deze
weesreceptoren geactiveerd werden door stoffen uit de voeding van mensen.
Na onderzoek bleek dat 13% van de medicijnen waarvan ze wisten dat ze werkten, maar niet
waarom op deze nucleaire receptoren invloed hadden. Nucleaire receptoren werden interessant
voor diabetes onderzoek, voordat de onderzoekers hier iets mee k onden moesten ze eerst beter
weten hoe dit werkte
De nucleaire receptor familie werkt met chemical switches. Na binding van een ligand aan de
receptor worden acetyl groep gebonden aan het complex. Hierdoor opent de centromeer en is
transcriptie mogelijk en kan het gen afgelezen worden. Laat het ligand weer los dan wordt de acetyl
groep weer verwijderd en sluit de centromeer.
We gaan nu eerst verder kijken naar de regulatie van FXR een galzoutreceptor.
Als de FXR uitgeschakeld is dan meer galzouten, meer cholesterol en meer TG.
Functie galzouten: galzouten emulgeren vetten, waardoor deze opgenomen kunnen worden en als
energie bron kunnen dienen. Galzouten worden na gebruik in de darm weer heropgenomen in het
bloed en terug naar de lever getransporteerd.
FXR komt zowel in de darm als de lever tot expressie. In de lever zorgt het voor een stimulatie van de
afgifte van galzouten en een remming van de heropname van galzouten in de lever.
In de darm zorgt het voor een remming van de secretie in de darmen en voor een stimulatie van
heropname in het bloed.
In de lever zitten galkanaaltjes en kleinere
galgangen, gal wordt in de hepatocyten
gemaakt. Er zijn daarbij drie soorten
receptoren van belang
- Cholesterol receptor
- Galzoutreceptor
- Fosfolipide receptor
De NTCP receptor zorgt dat galzouten de
levercel terug binnen komen.
Ook cholesterol komt via receptoren de
levercel binnen, namelijk de LDLR voor LDL
en SRB1 receptor voor HDL. Cholesterol
wordt gebruikt voor de galzoutproductie via
de CYP7a1 receptor. Als er via deze
pathways veel galzout de lever cel
binnenkomt dan remt het FXR deze
pathways, tegelijkertijd stimuleert het de
afgifte van galzouten aan de galgangen.
In de darmcellen: Via de galgangen komt het galzout in de darm, via de zogenaamde ASBT receptor
worden galzouten de darm cel in getransporteerd. De OSTa/b receptor zorgt ervoor dat galzouten
weer in het bloed komen en afgevoerd worden naar de lever. FXR heeft ook in darmcellen een
functie, het zorgt namelijk voor remming van opname van galzouten in de darm cel en voor een
stimulering van de afgifte van galzouten aan het bloed.
FXR wordt dus geactiveerd in de aanwezigheid van galzouten en zorgt ervoor dat ze de cel waarin
deze zich bevinden zo snel mogelijk weer verlaten.
LXR is het neefje van FXR
LXR wordt door cholesterol geactiveerd, het zorgt ervoor dat cholesterol in de cel minder wordt. Dit
doet het door de afgifte aan de galgang te stimuleren. Door reverse cholesterol transport te
stimuleren en door het CYP7a1 te activeren dat cholesterol in galzouten omzet. Uiteindelijk minder
cholesterol in het bloed en dus een kleinere kans op artherosclerose. Echter de TGs gaan wel
omhoog wanneer je LXR stimuleert.
Een LDLR knock out muis kan geen choleseterol uit het bloed opnemen waardoor een grotere kans
op artherosclerose. Wanneer je een LXR ligand neemt dan neemt de kans op artherosclerose af.
Regulatie lever vetmetabolisme
FXR en LXR hebben effect op TGs in de lever.
Hoog vet dieet lypolyse zorgt voor omzetting vet tot FFA FFA gaan de lever cel inworden
omgezet in TG TGs worden opgeslagen vette lever
TGs kunnen ook als VLDLs de cel verlaten, dan worden ze als energiebron gebruikt.
FFA kunnen ook gebuikt worden in vrije vetzuuroxidatie in de mitochondriën. Het acetylCoA dat
hierbij vrijkomt wordt weer omgezet via lipogenese in FFAs.
LXR zorgt voor stimulatie van de lipogonese waarbij FFAs gevormd worden. Daarnaast stimuleert het
ook de uitscheiding van TGs via VLDL.
Er zijn drie belangrijke vetreceptoren, de PPAR
- PPARγ: Adipokinese zorgt voor de opname en opslag van vet
o Uiteindelijk wordt je door overactivatie van deze receptor dik
o Het medicijn TZD verlaagd de bloedsuiker spiegel en verhogen insuline gevoeligheid.
PPARγ is de target voor dit ligand. Nadeel van TZDs is dat het zorgt voor een
verhoogde kans op hartfalen en dat de patienten dikker werden en meer last kregen
van oedeem en botontkalking.
-
PPARα: is van belang bij verbranding en heeft verschillende functies.
o Het stimuleert de vorming van HDL, waardoor minder TG en minder FFA.
o Het remt lipogenese, ook hierdoor minder FFA
o Stimuleert vrije vetzuurverbranding, waardoor er weer minder TGs en FFA zijn.
PPARα wordt geactiveerd tijdens het vasten. Ze hebben PPARα KO muizen op voeden/vasten
dieet gezet. KO muizen hadden veel meer FFAs bij vasten dan de controle groep.
Tegelijkertijd hadden ze veel minder ketonen. Het gevolg is dat deze dieren last krijgen van
hypoglycemie, doordat er veel meer glucose verbrand wordt. Bovendien krijgen ze een vette
lever, want meer FFAs.
- PPARδ: spelen ook een rol bij verbranding. Functie was lange tijd onbekend omdat ze geen
ligand hadden die er op aan greep en de KO muizen lethaal waren. Om toch de functie te
kunnen bepalen hebben ze het gen in muizen tot overexpressie gebracht.
o Overexpressie muizen zijn dunner
o PPARδ zorgt voor betaoxidatie, maar zorgt ook voor ontkoppeling(extra
vetverbranding). Hierdoor bevatten de cellen van de muizen veel minder vet.
Om de functie beter te kunnen bepalen hebben ze het ook in spiercellen tot overexpressie
gebracht. De spieren werden hierdoor roder van kleur.
Twee soorten spieren
Type 1: slow spieren, komen veel voor bij duursporters en zijn rood van kleur. Duursporters
doen aan meer vetverbranding, anders kunnen ze het sporten niet lang genoeg volhouden.
Type 2: fast spieren, komt veel voor bij krachtsporters, zijn wit van kleur. Krachtsporters
hebben energie maar kort nodig dus kunnen op suikerverbranding hun sport doen.
In muizen zag je dat er meer rode spieren waren, ze doen dus aan meer vetverbranding.
Betekent dit dat ze ook beter zijn in duursporten?
Controle en PPARδ muizen werden aan het duursporten gezet en inderdaad de PPARδ
muizen hielden het langer vol dan hun soortgenoten. Tot zo’n 2 x langer.
Terug naar meldonium, deze stof heeft invloed op de PPARα, doordat het de vrije vetzuur oxidatie in
spieren stimuleert hebben deze gemakkelijker toegang tot energie en werkt het prestatie
verbeterend.
College 8
Voeding en epigenetica
T. Plösch
Tijdens de hongerwinter hadden de mensen veel minder toegang tot voeding. Ze kregen per dag
tussen 800-1000 caloriën binnen, daarnaast was het voedsel voedingstofarm. De voeding bevatte
bijna alleen koolhydraten. Later is onderzocht of dit voedingspatroon tijdens de zwangerschap ook
effecten heeft gehad op de kinderen. Daarvoor werd de groep zwangere vrouwen in drie groepen
opgedeeld.
- Vrouwen waarbij het begin van de zwangerschap samen viel met de Hongerwinter. Kinderen
van deze vrouwen hadden een verhoogd risico op onder andere suikerziekte, overgewicht,
CVD, borstkanker, depressie enz.
- Vrouwen waar het midden van de zwagerschap samen viel met de Hongerwinter. Kinderen
van deze vrouwen hadden een verhoogde kans op suikerziekte, longziekten en nierziekten.
- Vrouwen waar het einde van de zwangerschap samen viel met de Hongerwinter. Kinderen
van deze vrouwen hadden een verhoogde kans op suikerziekte.
Het eerste trimester is blijkbaar erg bepalend voor de gezondheid van het kind, maar waarom?
Het zijn geen genetische veranderingen of mutaties, dus moet het iets anders zijn. Epigenetisch???
Barker keek naar voeding tijdens de zwangerschap en het geboortegewicht en keek 60 jaar later naar
het voorkomen van hart en vaatziekten. Het bleek dat kinderen met een laag geboorte gewicht een
grotere kans op hart en vaat ziekten op latere leeftijd hadden. Mogelijke oorzaken
- DNA methylatie: Aan de CG base combinatie wordt een methylgroep gebonden.
- Histonmodificatie: zorgt ervoor dat DNA streng wel of niet afgelezen kan worden
- Non-coding RNA: Gaat op DNA zitten waardoor de streng niet afgelezen kan worden
Hoe werkt DNA transcriptie ook alweer?
Een DNA streng wordt uitelkaar gehaald, vervolgens bindt RNA polymerase 2 aan een promoter, het
DNA wordt vervolgens verder afgewikkeld en kan afgelezen worden en de transcriptie plaats vinden.
DNA methylatie:
- In een promotor van een gen bevinden zich veel CG posities achter elkaar. Deze kunnen
gemethyleerd worden en wanneer veel van deze CG posities gemethyleerd zijn dan kan het
gen niet afgelezen worden en wordt de expressie geblokkeerd.
- Voor de promotor zit een CG eiland. Misschien dat wanneer deze geblokkeerd is dan ook
geen transcriptie van het gen, omdat de promotor niet kan binden door de aanwezigheid van
de mehylgroepen iets eerder op de streng
- Alle CG verderop in de streng gemethyleerd. Hierdoor kan de promotor alleen maar op de
juiste plek binden en wordt het gen elke keer goed afgelezen.
- DNA methylatie gebeurt ook herhalende strengen, hierdoor kunnen ze niet afgelezen
worden, waardoor de kans op kanker afneemt.
Histonen: DNA zit opgerold om histonen, het is dan niet afleesbaar. Wanneer histonen zich uitrollen
kan het DNA wel afgelezen worden. Dit oprollen en afrollen wordt gereguleerd door binding van
onder andere acetyl, methyl, ubiquitine, sumolitatie en fosforisatie. Doordat er zoveel mogelijkheden
vna binding zijn is het lastig te voorspellen wanneer histonen geacitveerd of gedeactiveerd worden.
Maar wanneer bijvoorbeeld actylgroepen
binden aan histonstaarten dan kan het
DNA beter afgelezen worden. Zie ook
afbeelding:
Maar net epigenetische veranderingen van
het DNA worden in principe niet
doorgegeven, ze staan namelijk niet
opgeslagen in het DNA. Hoe kan het dat er
wel methylatie is?
Voor methylatie is energie en SAM nodig.
SAM komt vrij bij verschillende cycli van
processen waar stoffen uit het dieet
belangrijke bouwstoffen voor zijn.
Wanneer er bij een gebrek aan voeding, minder energie aanwezig is en ook minder grondstoffen kan
er minder methylatie plaatsvinden. Hierdoor minder bescherming van transcriptie en daardoor de
kans op ziektes groter.
Bv calorierestrictie hierdoor minder vetten, eiwitten en koolhydraten, dus minder energie en
daardoor minder SAM en dus minder methylatie.
Extra toediening folium: Folium heeft een positieve invloed op DNA en histon methylatie. Het zorgt
zelfs voor epigentische veranderingen en meer methylatie, De gevolgen hiervan op lange termijn zijn
nog onbekend.
Epigenetica is een ingewikkeld onderzoeksgebied, omdat je niet makkelijk kunt zeggen of een ander
fenotype komt door een mutatie of door een epigenetische verandering.
Daarom veel onderzoek in de agouti muis, doordat ze zoveel als proefdier gebruikt worden zijn ze
genetisch identiek. Toch zitten er verschillen in huidskleur. Dit moet dus door de omgeving komen.
Agouti moeder muizen die extra methyl kregen in hun dieet bleken jongen te krijgen die meer een
WT uiterlijk hadden. Na verder onderzoek bleek dat in de agouti muis voor het gen van huidskleur
een retroviraal partikel zit. Wanneer deze afgelezen wordt schakelt het alle genen die daarna komen
uit. Dus ook het gen voor WT huidskleur. Krijgt een moeder veel methyl in haar voeding dan wordt
dit retrovirale partikel geblokeerd en niet afgelezen en krijgen de jongen een WT huidskleur.
Komt dit dan ook in de mens voor?
Om dit te onderzoeken hebben ze een aantal jaar een slecht ontwikkeld ghanees dorp de
zwangerschappen gevolgd. De metabolieten die in de voeding zaten van de moeders verschillenden
per seizoen en dit had kleine epigenetische veranderingen tot gevolg, omdat er een ander patroon
van methylering was.
Epigenetic changes are long‐time carriers of information:
– DNA methylation
– Histone modification
– Small RNAs
The epigenome can be modified by nutritional components or lack of those components
These changes result in changed gene expressions Until now, no clear relationship with phenotypes
College 9
Obesitas en type 1 diabetes
E. Corpeleijn
Obesitas als je een BMI boven de 30 hebt(overgewicht boven de 25). Je hebt dan buitensporig veel
vet. Obesitas komt veel meer voor tegenwoordig. Ongeveer 50% van de nederlanders is te zwaar. Er
wordt gedacht dat extra gewicht voordelig is tijdens operaties. Ook overgewicht bij kinderen komt
steeds vaker voor. Hierin zijn grote verschillen per gemeente of provincie. Drenthe is in nederland de
provincie waar overgewicht het meest voor komt.
Overgewicht/obesitas heeft veel gezondheidsrisico’s
- Longziekten als hypoventilatie, apneu en abnormale werking.
- Vette lever
- Onvruchtbaarheid
- Osteoperose
- Hersenbloedingen
- CVD
- Diabetes
- Hoge bloeddruk
- Verhoogde kans op kanker
Iets te zwaar zijn heeft echter ook een paar voordelen
- Je hebt een betere overlevingskans bij acute problemen als longontstekingen en operaties
- Mensen worden vaker gecontroleerd door artsen op hun cardiometabole gezondheid,
abnormaliteiten worden dan ook eerder geconstateerd.
- Als je spontaan gewicht verliest zonder hiervoor iets te doen dan kan het zijn dat er iets aan
de hand is waarna je naar de dokter gaat en dit ontdekt.
Rerverse causation: Tussen A en B is zichbare verwantschap. Soms kan dan gedacht worden dat A B
beïnvloed terwijl dat in de praktijk precies andersom is.
Diabetes
Type 1: komt al op jonge leeftijd voor doordat de β cellen geen insuline produceren of afwezig zijn.
Type 2: ontstaat op oudere leeftijd, komt door overgewicht, waardoor er een relatief insulinetekort
door insuline resistentie ontstaat. Β cellen functioneren niet goed.
Beide ziektes geven ernstige complicaties als nierfalen, CVD, neurologische schade en slechter zicht.
Diabetes komt voornamelijk voor in de westerse landen. 1 op de 10 mensen heeft type 1.
Er is een correlatie te zien tussen het voorkomen van diabetes en overgewicht.
In zuid amerika en Azië komt meer diabetes voor dan je op basis van overgewicht cijfers zou
verwachten.
Insuline resistentie: De insuline gevoeligheid van mensen
verschild. Sommige mensen hebben een lage
insulinegevoeligheid, maar produceren wel veel insuline.
Hierdoor kan de glucose spiegel normaal blijven. Wanneer
het lichaam dit echter niet meer kan compenseren dan
neemt de glucose spiegel toe en krijg je diabetes. Zie ook
figuur.
Dit is te beïnvloeden door je levenstijl, ook leeftijd heeft
effect(hoe ouder hoe groter de kans op diabetes), daarnaast
kunnen genen zowel een positief als negatief effect hebben.
Iemand met veel spierweefsel heeft een kleinere kans op
diabetes, omdat spierweefsel meer glucose nodig heeft dan
vetweefsel. Hierdoor glucose spiegels in het bleod
makkelijker op peil te houden en de kans op diabetes is kleiner.
Lichamelijke activiteit en diabetes: Meer beweging, kans op overgewicht kleiner. Meer spierweefsel.
Ook ben je fitter, waardoor je de complicaties van diabetes beter aan kunt.
Er is onderzoek gedaan of diabetes voorkomen kan worden wanneer prediabetes al geconstateerd is.
Hiervoor hebben ze 2 groepen mensen genomen met een BMI van rond de 30. De ene groep hebben
ze behandeld en de andere groep niet.
De groepen zijn gerandomised:
De patienten is niet verteld of ze wel of niet behandeld worden dit omdat je dan niet in de ene groep
hele gemotiveerde patienten hebt en in de andere niet. (selectie bias)
Je haalt zo ook confouding eruit. Diabetes is op zich zelf een risicofactor, maar er zijn ook
complicaties die met diabetes samenhangen. Bij een random verdeling zijn deze risicofactoren ook
per toeval en random verdeeld.
In onderzoek is het lastig om te bepalen wat oorzaak en gevolg is.
In het onderzoek dat besproken is hebben ze een groep mensen op een dieet gezet en begeleid laten
bewegen. De controle groep werd niet begeleid, maar wel gemeten.
Groep 1 verloor in het eerste jaar en ook in de jaren erna gewicht. De controle groep ook in het
eerste jaar een klein beetje, maar daarna niet meer. In het derde jaar kwamen ze zelfs aan. Ook
scoorde de controlegroep slechter op fitheid.
Resultaat: de controle groep kreeg vaker en eerder diabetes dan de interventiegroep.
Dus leeftijdinterventie verlaagd de kans op diabetes type 2. Het is effectiever dan eerder starten met
diabetes voorkomende medicatie. Daarnaast is het ook haalbaar en kostenbesparend.
Obesitas leidt tot insuline resistentie
Bij mensen met een slechte beta-cel functie leidt dit tot diabetes mellitus type 2
Leefstijl speelt een belangrijke rol bij het voorkomen van diabetes mellitus type 2: daarbij gaat het
niet alleen om gewichtsverlies maar ook om gezonde voeding en voldoende bewegen.
College 10
Microbiota, voeding en gezondheid
H. Harmsen
Darmmicrobiota wordt gedomineerd door anaerobe bacteriën die o.a. vitamines produceren. Ook
spelen ze een rol in het detoxificeren van voedsel en het deconjugeren van gal. Beschermen de darm
tegen kolonisatie van andere bacteriën.
Is de balans van het microbioom verstoord dan spreek je van een dysbiosis. Dit wordt geassocieerd
met verschillende ziekten als obesitas, type 2 diabetes, infecties, autisme en darmkanker.
Voedingstoffen worden via digestie in het verteringstelsel en via absorptie naar het bloed verteerd.
Echter niet alle voedingsdeeltjes worden hierbij opgenomen. De voedingstoffen die ontsnappen aan
de humane vertering worden door dikke darm bacteriën gefermenteerd.
Fermentatie: Een proces waarbij bacteriën gebruikt worden voor het omzetten van voedingstoffen.
Hierbij komen fermentatieproducten als korte vetzuren en gassen als waterstof, methaan en
koolstofdioxide.
Het menselijk darm-microbioom bevat verschillende stammen bacteriën. Er zijn drie belangrijke
typen.
- Bacteroides
- Prevotella
- Ruminococcus
Voeding is bepalend voor de samenstelling van de het bioom. Zo komt in Europa voornamelijk type 1
en 3 voor, maar in burkina faso juist heel veel type 2.
Mensen met de ziekte van Crohn hebben veel Escheriachia coli en weinig faecalibacteriën. De
faecalibacterium is verantwoordelijk voor de productie van butyraat.
Faecalibacterium is een anaerobe bacterie die moeilijk te kweken is en een inidicator is voor een
gezonde darm. Het produceert butyraat en heeft een anti-inflammatoir effect op de darm.
Bacteriën bevinding zich in de darm en worden gescheiden van het epitheel van de darm door een
muscuslaag. Dichtbij de darmcellen bevindt zich meer zuurstof dan in het lumen van de darm. Dit
zorgt er ook voor dat de bacteriën die voornamelijk aneroob zijn in het lumen blijven en zich niet
naar het epitheel verplaatsen.
Simplele suikers worden door oa streptococuccus, lactobacillus en enterococcus omgezet in lactaat
wat weer door veilionelle omgezet wordt in acetaat.
We zien dat mensen die veel suikers eten(westen) een toename van lactobacillen en streptokokken
te zien is. Daarnaast is er ook een groeit in de prevalentie van obesitas.
Vezels worden door microbiota afgebroken, hier komt butyraat bij vrij.
Dikke muizen hebben veel firmicutes in hun dieet en magere muizen hebben in verhouding veel
meer bacteriodetes.
Er is veel interactie tussen dieet, obesitas en
microbioom:
Microbioom produceert korte vetzuurketens die
een signaal voor verzadiging zijn. Aan de andere
kant zorgen ze voor energie opslag, genexpressie
en meer inflammatie.
HF-dieet: Het microbioom veranderd, hierdoor is
de muscuslaag minder beschermd en wordt minder
dik. Daarom is het voor bacteriën gemakkelijker de
epitheel barrière te doorbreken en de kans op
ontstekingen ook groter.
Akkermansia bacterie; versterkt de epitheel
barrière van de darm. Daarnaast versterkt het de
glucose tolerantie.
Choline in het dieet is betrokken bij cholesterol
metabolisme. Een microbe zet choline om in TMA.
TMA wordt vervolgens omgezet in mehtaan een
TMAO een bouwsteen van cholesterol.
Een moeder heeft veel effect op de darmflora van het (on)geboren kind. Het kind krijgt via de
moeder op verschillende manieren microbiota binnen
Oraal: voorkauwen van voedsel. Dit wordt geremd door voeding uit potjes
Borstvoeding: dit wordt geremd door flessenvoeding
Huidcontact; dit kan geremd wroden door veel en vroeg wassen
Vaginaal: Tijdens de geboorte, dit kan voorkomen worden door keizersnede
Daarnaast kan de ontwikkeling van een microbioom bij een kind geremd worden door antibiotica
vroeg in het leven.
Bovendien verandert het microbioom van de vrouw drastisch tijdens de zwangerschap. De vrouw
komt gewicht aan en als gevolg hiervan wordt haar ontlasting meer microben gevonden die
geassocieerd worden met ontsteking en toegenomen energieinhoud. Het metabolisme wordt dus
door de zwangerschap beiïnvloed door darmmicrobiota.
C. difficile is een bacterie die toxines produceert en daarmee ernstige diaree veroorzaakt. C difficile is
aanwezig in het microbioom maar wordt gereguleerd door andere anearobe bacteriën. Wanneer je
antibiotica gebruikt verstoor je deze regulering en kan dit voor nieuwe infecties zorgen. Feces
transplantatie kan hierbij de uitkomst zijn om weer een darmflora te krijgen dat in balans is.
Probiotica zijn levende micro-organismen (meestal bacterien), die in adequate hoeveelheden een
gunstig effect hebben op de betreffende gastheer. Prebiotica zijn substraten (niet verteerbaar door
mens) welke een gunstig effect hebben op de bacteriën in het colon. Synbiotica is een combinatie
van pre- en probiotica.
Darmbacteriën produceren stoffen die de darm in goede conditie houden.
Vezelrijk dieet levert voedsel voor darmbacteriën.
Bij colitis of auto-immuun ziekten is de balans tussen butyraatbacteriën en potentieel pathogenen
verstoord.
Bij obesitas is er een verstoorde balans tussen microbiële samenstelling en energieopname.
Pre en probiotica kunnen de balans terugbrengen.
Vitaminen kunnen de goede darmbacteriën misschien ook stimuleren.
Werkcolleges
Eetmeter
Alcohol wordt door ADH ogezet, wanneer je teveele alcohol hebt wordt het omgezet door iets
anders in de microsomen.
Behalve NADH krijg je ook acetyl coA, NADH remt de citroenzuurcyclus. Maar doordat je wel acetyl
CoA krijgt ontstaat er ketonenformatie. Ook is er meer vetzuursynthese in de lever, waardoor je een
vette lever krijgt. Hierdoor weer verhoogde triglycerides in je bloed. Daarnaast zorgt de toegenomen
hoeveelheid NADH er ook voor dat de pyruvaat omgezet wordt in lactaat ipv andersom. Hierdoor
wordt er in de lever geen glucose meer aangemaakt. Als er dan ook geen glucose in de alcohol zit bv
bij wodka dan ga je meer eten omdat je een hypoglycemie hebt. Je wordt er dus ook dikker van.
Tijdens het verwerken van alcohol gebeuren er allemaal processen waardoor je je niet goed voelt.
Alcohol verhoogd de darmpermabiliteit, dit neemt toe als je op een avond heel veel drinkt. Hierdoor
krijg je meer toxische stoffen in je lichaam. Daardoor weer meer cytokines in je bloed. Deze
ontstekingsreactie is slecht als het chronisch is, hierdoor grotere kans op hart en vaatziekten. Wordt
chronisch bij langdurig overmatig drankgebruik.
Vitamines: B1 deficientie tast spieren aan en ook de hersenen. wAnt heeft invloed op de koolhydraat
vertering. Een tekort wordt ook beri beri genoemd, hierdoor verlamming van spieren, nourologische
dysfunctie en CVD. Komt veel voor bij bevolkinsgropen die voornamelijk witte rijst eten. Ook
korsakoff komt door B1 defficientie, onder andere doordat alcoholisten een slecht voedingspatroon
hebben, ook remt alcohol de vitamine B1 opname.
Vitamine A, D en E zijn vetoplosbare vitaminen die door chylomicronen verplaatst worden.
B1 en C zijn water oplosbaar.
Dit betekent dat A, D en E dus beter opgeslagen kunnen worden. Dit betekent ook dat er teveel kan
zijn dat weer toxisch is.
Vitamine D: Kun je oiv zonlicht zelf maken uit cholesterol. In de winter in NL niet genoeg zon, dus
moet het in de darmen door de chylomicronen opgenomen worden. Vitamine D zorgt voor de
absorbtie van Calcium en fosfor. Zorgt voor een goede botsamenstelling en remt celproliferatie en
differentiatie
Fytosterolen zorgen ervoor dat je minder cholesterol opneemt uit je voedsel. Fytosterol is een
voorbeeld van een fytochemicalie. Nadeel is dat het waarschijnlijk meer effecten heeft dan nu
bekend. Ook koffie bevat fochemicalien die invloed hebben.
Diabetes
PPARγadipogeneseinsulineresistentie neemt
af meer glucose opname door insuline
kleinere kans op diabetes.
Maar wanneer je met TZDs PPARγ stimuleert dan
naast deze voordelen ook gewichtstoename en
een grotere kans op CVD.
FGF1 betrokken in PPARγ pathway. Zit later in de
pathway activatie kan misschien alleen de
positieve effecten van PPARγ hebben.
Komt tot expressie bij HF dieet en stimuleert
celgroei. Meer niet bekend.
Nieuw onderzoek
Bij afwezigheid van FGF1 een verschuiving van
vetopslag in weefsels naar vetopslag rond de
lever. Ook zorgt FGF1 ervoor dat glucose gehaltes in bloed lager worden bij obese muizen.
Daarnaast zorgt FGF1 voor een hogere insuline gevoeligheid.
Energie metabolisme
UCP: Zorgt voor een opheffing van de protonen gradient waardoor er geen ATP gesynthetiseerd kan
worden. Tegelijkertijd komt bij dit proces warmte vrij. UCP komt in bruinvetweefsel voor.
Bruinvetweefsel is metabool erg actief. Bruinvetweefsel wordt niet gebruikt voor vetopslag net als
witvetweefsel, maar wordt gebruikt om energie voor warmte te leveren bij kou. De UCP1 expressie in
bruinvetweefsel zorgt dan ook voor veel bloedvaten om die warmte te vervoeren.
Wanneer mensen in de kou gezet worden activeert dit beige/bruinvetweefsel, ook gewichtsverlies
zorgt hiervoor. BAT is minder in obese mensen. hIerdoor is BAT activatie mogelijk gunstig voor
mensen met metabool syndroom.
Galzouten spelen een belangrijke rol in het vetmetabolisme. Echter in te hoge concentraties kunnen
ze schade aanrichten aan cellen. Dit komt doordat ze ontstekingen, aptose en necrose veroorzaken.
Er zijn twee belangrijke galzout receptoren
- FXR: heeft veel functies en komt in veel organen tot in expressie. Belangrijkste functies zijn
de rol in galzoutmetabolisme, vetopname, vet en suikerstofwisseling. Celproliferatie en
ontsteking.
- Komt in minder organen tot expressie, maar zorgt er onder andere voor dat de galblaas
gevuld wordt. Daarnaast speelt het een rol bij ontstekingen en de energiehuishouding.
De receptoren kunnen gebruikt worden als drugstarget. Tegen onder andere obesitas, insuline
resistentie, hyperlipidemie en aderverkalking. Activatie van deze receptoren beschermd tegen de zo
net genoemde ziekten. Dit komt doordat het voor activatie van o.a. het vetmetabolisme zorgt en
hierbij gewichtverlies op kan treden.
Calorie restrictie
Define “ageing” and interpret the term in an evolutionary context and explain ultimate and proximate
ageing theories, and give examples.
Veroudering twee manieren om te definieren. 1. Als je ouder wordt verlies vruchtbaarheid en is er
een toename in mortaliteit. 2. Veroudering is een progressief verlies van functie door leeftijd.
Veroudering komt bij verschillende soorten voor, maar is niet universeel er lijken soorten te zijn die
niet verouderen. Er zijn verschillende theoriën die de oorzaak van veroudering proberen te
beschrijven. Er zin ultimate theorieën die de waarom vraag beantwoorden, zij komen vaak uit bij
natuurlijke selectie. Je verouderd om zo via natuurlijke selectie je soort in stand te kunnnen houden.
Daarnaast leven wilde dieren niet zolang tot ze aan ouderdom overlijden, het is dus voor de natuur
niet nodig om genen te selecteren die veroudering voorkomen. Een tweede theorie is de
antagonistische pleiotropie: Er zijn genen die aan het begin van het leven voordelig zijn en later niet
meer, maar dan zijn ze niet meer vruchtbaar dus kan er geen selectie op zijn. Een derde theorie is die
van die van disposable soma: Hierin beschermen de gewone celllen(soma) de kiemcellen. Kiemcellen
die een rol spelen bij groei en reproductie hebben een negatief effect op levensduur. Weefselcellen
hebben juist een positief effect op levensduur. Kiest het lichaam voor kiemcellen, dan veel en vaak
reproduceren, maar wordt het organisme niet oud en kan het niet voor jongen zorgen. Kiest het voor
soma dan weinig reproductie, maar wordt het organisme wel oud en kan het voor de jongen zorgen.
Er zijn ook proximate theoriën die de hoe vraag beantwoorden. Hierin zijn twee stromingen. Ten
eerste is er de genetische theorie die ervanuit gaat dat veroudering geprogrammeerd is. De tweede
theorie zegt dat veroudering komt door schade die je gedurende je leven oploopt.
Een bekende theorie is die van de vrije radicalen, maar ook kortere telomeren is een bekende
theorie.
Daarnaast wordt gedacht dat bij elke replicatie er meer schade aan de cellen/DNA is waardoor er
uiteindelijk veroudering is. (cellular/replicative senescence)
Een andere theorie is de theorie van calorierestrictie: waarbij CR voor een langer leven zorgt.
Define the term “calory restriction”
CR: Inname van voedingstoffen en mineralen met 30-40% afnemen. Dit zorgt voor een constant
hongergevoel.
Principles outlined in ageing theories to the topic of calory restriction:
Doordat het dieet direct invloed heeft op gezondheid, ziekte en uiteindelijk dood kan CR ervoor
zorgen dat je langer leeft. Het zou beschermen tegen insulinegevoeligheid doordat je minder glucose
binnenkrijgt. Daarnaast zou het oxidatieve schade door veroudering terug kunnen draaien en de
gevolgen van veroudering op het zenuwstelsel en de voortplantingsorganen remmen.
Explain major differences between small lab animals and primates, which may lead to different
responses to CR
De proefdieren waarop verouderingsonderzoek wordt gedaan leven allemaal vrij kort en
reproduceren veel en snel. Wij mensen leven juist vrij lang en doen veel langer over reproductie. De
vraag is dan ook of we de kennis van proefdieren op ons mensen toe kunnen passen. Daarom
onderzoek gedaan naar primaten, die meer op mensen lijken. De resultaten uit twee grote zijn echter
tegenstrijdig. Beide groepen hebben een aantal fouten gemaakt dus een duidelijk antwoord is er nog
niet.
Explain major considerations in the setup of calory restriction studies in primates, especially regarding
the measurement and implementation of CR
Grootste verschil tussen de twee onderzoeken is de mate van CR. Voor de ene groep ligt de restrictie
op 10-40% en de andere groep op een groter percentage tov free feeding.
Verder was er genetische diversiteit tussen de twee onderzoeksgroepen
Ook de groepsgrote verschillende.
Explain different setup and observations in the NIA and UW CR studies, and outline possible
explanations
NIA nam een afname in gewicht van de rhesus apen waar.
UW: Namen in gewicht toe.
Belangrijkste conclusie van beide onderzoeken is dat de CR dieren gezonder zijn dan
controlegroepen. Vraag is of je zo wil leven als het je maar een paar jaar extra oplevert?
Explain the importance of control groups in CR studies
Zonder controle gropen kun je een langere levensduur aanzien als gevolg van CR. Als blijkt dat ook de
controle groep langer leeft dan komt het niet door de voeding, maar door verbeterde leefomgeving.
Name further factors, in addition to CR, that affect life and health span