Susan Peters, MSc
Spierziekten en genetica
Chromosomen en genen
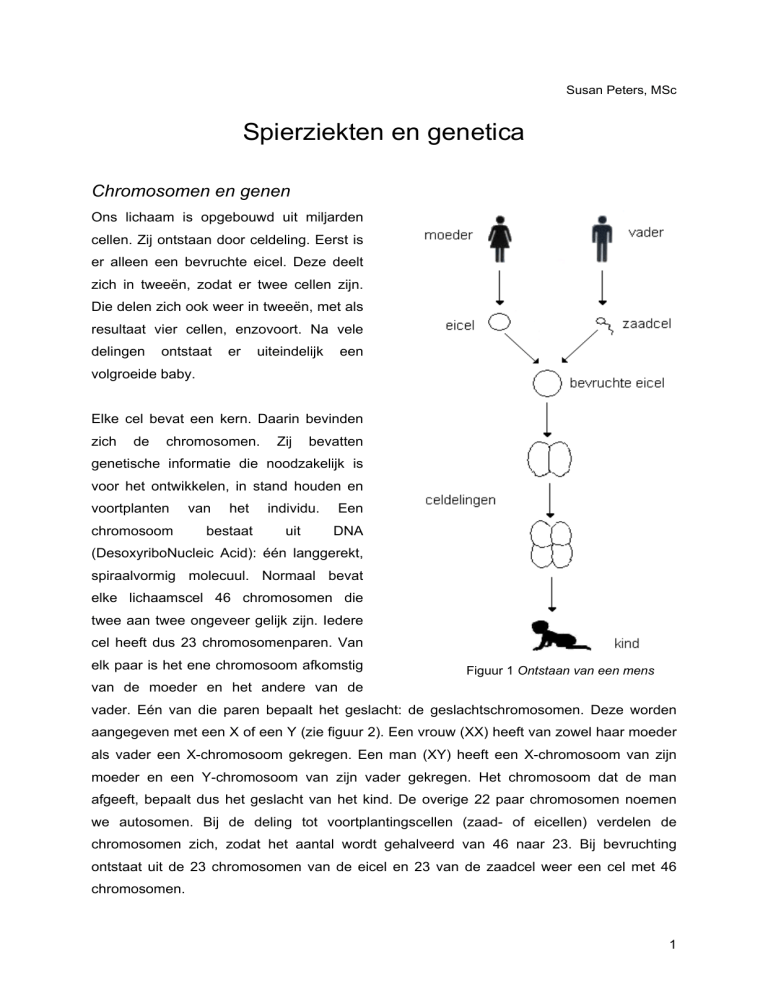
Ons lichaam is opgebouwd uit miljarden
cellen. Zij ontstaan door celdeling. Eerst is
er alleen een bevruchte eicel. Deze deelt
zich in tweeën, zodat er twee cellen zijn.
Die delen zich ook weer in tweeën, met als
resultaat vier cellen, enzovoort. Na vele
delingen
ontstaat
er
uiteindelijk
een
volgroeide baby.
Elke cel bevat een kern. Daarin bevinden
zich
de
chromosomen.
Zij
bevatten
genetische informatie die noodzakelijk is
voor het ontwikkelen, in stand houden en
voortplanten
chromosoom
van
het
bestaat
individu.
Een
uit
DNA
(DesoxyriboNucleic Acid): één langgerekt,
spiraalvormig molecuul. Normaal bevat
elke lichaamscel 46 chromosomen die
twee aan twee ongeveer gelijk zijn. Iedere
cel heeft dus 23 chromosomenparen. Van
elk paar is het ene chromosoom afkomstig
Figuur 1 Ontstaan van een mens
van de moeder en het andere van de
vader. Eén van die paren bepaalt het geslacht: de geslachtschromosomen. Deze worden
aangegeven met een X of een Y (zie figuur 2). Een vrouw (XX) heeft van zowel haar moeder
als vader een X-chromosoom gekregen. Een man (XY) heeft een X-chromosoom van zijn
moeder en een Y-chromosoom van zijn vader gekregen. Het chromosoom dat de man
afgeeft, bepaalt dus het geslacht van het kind. De overige 22 paar chromosomen noemen
we autosomen. Bij de deling tot voortplantingscellen (zaad- of eicellen) verdelen de
chromosomen zich, zodat het aantal wordt gehalveerd van 46 naar 23. Bij bevruchting
ontstaat uit de 23 chromosomen van de eicel en 23 van de zaadcel weer een cel met 46
chromosomen.
1
Figuur 2 Een zoon of dochter
Op de chromosomen liggen de genen, waarvan de mens er naar schatting 30.000 heeft.
Ieder gen is een stukje afgebakend DNA dat als het ware een recept vormt voor een eiwit.
Van elk chromosoom hebben we twee exemplaren. De daarop liggende genen hebben we
dus ook in tweevoud. Eén gen is afkomstig van moeder en het andere van vader. Alle genen
vormen samen het genoom, dat in iedere lichaamscel hetzelfde is. Ofschoon alle cellen in
het lichaam dezelfde genen bevatten, hebben ze niet allemaal dezelfde rol. Dit wordt
veroorzaakt doordat niet elk gen altijd ‘aangezet’ wordt. Dat hangt onder andere af van de
plaats in het lichaam waar de cel zich bevindt. Het totaal aan genen dat een mens heeft, is
uniek en vormt zijn genotype. Hoe deze genen uiteindelijk tot uiting komen, bijvoorbeeld in
het uiterlijk van iemand of de ziekten die hij krijgt, noemen we het fenotype.
Figuur 3 Weergave van de opbouw van een chromosoom (links) uit DNA (rechts)
A. Schematische weergave (sterk vergroot) van een chromosoom.
B. Het materiaal waaruit een chromosoom is opgebouwd wordt DNA (desoxyribonucleïnezuur)
genoemd. Dit DNA is gerangschikt in een spiraalvorm.
C. De spiraal is opgebouwd uit een aantal kleinere eenheden (nucleïnezuren), die onderling met
elkaar verbonden zijn in de vorm van een wenteltrap.
D. Een aantal van de kleinere eenheden vormen een gen, dat codeert voor een bepaalde
eigenschap. Bij een verandering in één zo’n eenheid kan er al sprake zijn van een (erfelijke)
afwijking.
2
Van gen naar eiwit
Bijna alles draait om eiwitten. Zij zijn de bouwstenen van ons lichaam en essentieel voor een
cel. Ze zorgen voor stevigheid en bepalen de celfunctie; of het bijvoorbeeld een spiercel,
zenuwcel of huidcel wordt. Sommige eiwitten zijn enzymen, welke bijvoorbeeld een
belangrijke rol hebben in de stofwisseling. Eiwitten vormen dus de basis voor het goed
functioneren van ons lichaam. Wanneer er iets fout gaat met een eiwit kan dat leiden tot
ziekte. Bijvoorbeeld een fout met dystrofine (een eiwit dat zorgt voor de stevigheid van de
spiercel en het vermogen om samen te trekken) veroorzaakt Duchenne en Becker
spierdystrofie. Een ander voorbeeld van een eiwit is frataxine (dat waarschijnlijk
ijzermoleculen transporteert) dat is aangetast bij de ataxie van Friedreich.
Eiwitten zijn opgebouwd uit aminozuren, hun volgorde bepaalt de eiwiteigenschappen. De
aminozuren moeten echter eerst aan elkaar gekoppeld worden. Dat gebeurt via de recepten
van het DNA. DNA is opgebouwd uit vier basen; adenine, guanine, cytosine en thymine
(AGCT). In de celkern wordt het DNA overgeschreven in RNA (RiboNucleic Acid). RNA
maakt als het ware een kopie van het DNA (zie figuur 4). Thymine (T) wordt hierbij
vervangen door uracil (U). De code op dit RNA kan worden opgedeeld in telkens drie
achtereenvolgende basen. Deze noemt men een triplet of codon. Zij coderen voor een
aminozuur. Er kunnen zo’n twintig verschillende aminozuren worden gevormd. Het codon
CGU codeert bijvoorbeeld voor arginine. Er bestaan ook codons die voor de genregulatie
zorgen. Zo is er een codon dat zegt dat begonnen moet worden met overschrijven
(startcodon) en er is een codon dat aangeeft dat het klaar is (stopcodon).
Figuur 4 Dubbele DNA-streng die na splitsing in RNA wordt overgeschreven
3
Mutaties
Veranderingen in het erfelijk materiaal die bij celdelingen aan andere cellen kunnen worden
doorgegeven, noemen we mutaties. Mutaties zijn eigenlijk foutjes in het DNA. Deze kunnen
onschuldig zijn, maar ook heel ernstige gevolgen hebben. Met name als een mutatie
optreedt in een belangrijk deel van een gen, kunnen de gevolgen groot zijn. Mutaties kunnen
in alle cellen optreden, maar zijn alleen overerfbaar als ze in een geslachtscel voorkomen.
We onderscheiden verschillende soorten mutaties: allereerst op chromosoomniveau. Daarbij
is er bijvoorbeeld een chromosoom teveel of te weinig, of ontbreekt een deel. Bij spierziekten
komen dit soort mutaties vrijwel niet voor. De tweede soort is gelegen in een gen. Een gen
kan een deel missen (we noemen dit een deletie), er kan juist een stuk inzitten dat er niet
hoort (insertie), er kunnen delen omgeruild zijn (inversie) of er kan één base verruild zijn voor
een andere (puntmutatie). Een deletie kan tot gevolg hebben dat een eiwit één of meerdere
aminozuren mist. Stel dat een gen bestaat uit basen die de zin ‘zij had een kat’ vormen. Bij
een deletie waardoor de basen van ‘een’ wegvallen, komt er te staan: ‘zij had kat’. Deze zin
valt nog aardig te begrijpen. Ernstiger wordt het wanneer de deletie er toe leidt dat de rest
van de boodschap een andere betekenis krijgt. Dit gebeurt bijvoorbeeld als er één enkele
base ontbreekt, bijvoorbeeld de letter ‘h’. De drieletterwoorden van de DNA-boodschap
schuiven dan allemaal één base op, zodat ze van betekenis veranderen. De zin luidt dan: zij
ade enk at’. Deze zin is onbegrijpelijk. Er is een soort niet werkend ‘onzin-eiwit’ ontstaan
(missense mutatie). Ook wanneer er door een mutatie te vroeg een stopcodon voorkomt
(nonsense mutatie) of juist ontbreekt kan dat problemen opleveren. Het eiwit wordt dan maar
deels gemaakt of er komt een heel stuk bij.
Deleties zien we veelvuldig bij de spierdystrofieën van Duchenne en Becker. Bij Becker
ontbreekt een stukje van het dystrofine-eiwit. Het eiwit is dus niet helemaal goed, maar voor
een groot gedeelte werkt het nog wel. Bij Duchenne heeft het deel van de boodschap na de
deletie echter ook zijn betekenis verloren. Er wordt een ‘onzin-eiwit’ gemaakt. Vandaar dat
Duchenne spierdystrofie ernstiger is.
‘Loss-of-function’ en ‘gain-of-function’ mutaties
Een ‘loss-of-function’ mutatie resulteert in vermindering of volledig verlies van activiteit van
het eiwit. Wanneer één van de twee genen van een genenpaar gemuteerd is, zal in het
ergste geval slechts de helft van de normale hoeveelheid eiwit worden gemaakt. Zeker bij
enzymen is de werking van het normale genproduct meestal ruim voldoende om de reacties
uit te voeren. Er is een overcapaciteit. Bij een mutatie op beide genen kan echter helemaal
geen eiwit worden gemaakt. Daardoor treedt de ziekte op. Veel recessief geërfde ziekten
betreffen een ‘loss-of-function’ mutatie, bijvoorbeeld de ziekte van Pompe.
4
Een ‘gain-of-function’ mutatie is het tegenovergestelde, dat leidt juist tot verhoogde activiteit
of een totaal nieuwe functie van het genproduct. Hierdoor functioneert het niet zoals het zou
moeten en dat leidt tot ziekte. Het gemuteerde gen overheerst het andere. Thomsen
myotonie is een voorbeeld van een ziekte veroorzaakt door een dergelijke mutatie.
Overervingspatronen
Soms wordt een ziekte veroorzaakt door een verandering in één gen. Of het gemuteerde gen
op een geslachtschromosoom ligt of op één van de andere chromosomen (de autosomen),
bepaalt het overervingspatroon. Van de geslachtschromosomen is met name het Xchromosoom van belang aangezien het Y-chromosoom vrijwel geen genen bevat. De genen
die een genenpaar vormen, zijn bovendien niet altijd even ‘sterk’. Zo bestaan er dominante
(overheersende) en recessieve (verborgen) genen. Een dominant gen zal altijd tot uiting
komen, ook als het maar op één van de twee chromosomen voorkomt. Een recessief gen
komt daarentegen alleen tot uiting wanneer beide chromosomen ditzelfde gen hebben. Als
een persoon slechts op één van de chromosomen een schadelijke recessieve mutatie heeft,
is hij gezond. Hij draagt echter wel de erfelijke informatie die codeert voor de ziekte en
daarom noemen we hem drager. Dit alles is belangrijk voor de kans op de ziekte voor de
kinderen. De meest voorkomende overervingspatronen worden hieronder uitgelegd.
Autosomaal recessieve overerving
Het gemuteerde gen ligt hierbij op een autosoom en de ziekte komt niet tot uiting als ook een
normaal exemplaar van het gen aanwezig is. Het gezonde gen zorgt dan voor compensatie.
Iemand met een autosomaal recessieve spierziekte heeft twee gemuteerde genen en geeft
daarvan dus altijd één aan zijn kind. Een gezonde partner, die het gemuteerde gen niet
draagt, geeft het kind een gezond gen. Het kind wordt in dit geval altijd drager. Een kind
wordt alleen ziek als het van beide ouders het gemuteerde gen krijgt. Meestal zijn dan beide
ouders drager. Hun kinderen hebben 25% kans om van allebei het gemuteerde gen te
krijgen en dus ziek te worden; 50% kans om gezond maar drager te zijn, en 25% kans om
gezond en geen drager te zijn. Deze kansen gelden bij elk kind opnieuw. Het kan dus
gebeuren dat in een gezin twee kinderen achtereen de ziekte krijgen, maar ook dat juist
geen enkel kind het krijgt. Jongens en meisjes hebben bij deze overervingswijze gelijke
kansen. Als de partner van de patiënt wel drager is, hebben de kinderen 50% kans op de
ziekte. Voorbeeld van autosomaal recessieve spierziekten zijn de spinale spieratrofie typen I,
II en III, en de ataxie van Friedreich.
5
Figuur 5 Schema van een autosomaal recessieve
overerving als beide ouders drager zijn.
Autosomaal dominante overerving
Hierbij ligt het gendefect eveneens op een autosoom. Eén gemuteerd gen is al voldoende
om ziek te worden. Mensen met een dergelijke aandoening zullen meestal een partner
treffen die geen mutatie in hetzelfde gen bezit. De zieke ouder kan het gemuteerde gen of
het gezonde gen doorgeven, allebei met een even grote kans. De gezonde ouder geeft altijd
een gezond gen door. Hun kinderen hebben daardoor 50% kans op overerving van het gen
en daarmee de ziekte. Ook hier is geen kansverschil tussen de geslachten. Voorbeelden van
ziekten met deze overervingswijze zijn FSHD en myotone dystrofie.
Figuur 6 Schema van autosomaal dominante
overerving als een der ouders aangedaan is.
6
Geslachtsgebonden recessieve overerving
Het gendefect ligt hierbij op het X-chromosoom. De gemuteerde aanleg komt meestal niet, of
zwak, tot uiting als ook de normale aanleg aanwezig is. Vrouwen (XX) kunnen draagster zijn.
Zij hebben dan naast het gemuteerde gen op het ene X-chromosoom een normaal gen op
het andere. Een man (XY) heeft slechts één X-chromosoom. Als het gen daarop gemuteerd
is, heeft hij niet de compensatie van een tweede X-chromosoom zoals een vrouw.
Geslachtsgebonden aandoeningen treffen daarom meestal mannen (jongens) en maar
zelden vrouwen (meisjes). Dit heeft bijzondere gevolgen voor de overervingskansen. Een
man geeft aan zijn zoons altijd een Y-chromosoom. Daardoor kan een zieke man de
aandoening niet doorgeven aan zijn zoons. Al zijn dochters erven echter wel zijn Xchromosoom met de gemuteerde aanleg. Een dochter zal daarom altijd draagster worden.
Elk van haar kinderen heeft dan weer 50% kans om het gemuteerde gen te krijgen. Bij een
dochter leidt dat tot dragerschap, bij een zoon tot de ziekte. Deze overervingswijze zien we
bijvoorbeeld bij de spierdystrofieën van Duchenne en Becker.
Figuur 7 Schema van geslachtsgebonden recessieve
overerving als de vrouw draagster is.
Geslachtgebonden dominante overerving is voor spierziekten niet bekend.
Mitochondriële overerving
Ook buiten de celkern bestaat erfelijke informatie (DNA), namelijk in de mitochondriën. Dit zijn
celonderdelen die voor energievorming zorgen. Bij het samensmelten van de geslachtscellen
neemt een zaadcel zijn mitochondriën niet mee, maar de eicel wel. Een mutatie in het
mitochondriële DNA wordt daarom alleen door de moeder doorgegeven. Het geslacht van het
7
kind maakt geen verschil. Bij de ziekten MERRF en MELAS vinden we een dergelijke
overerving.
Hoewel een cel maar één kern heeft, heeft het daarentegen meerdere mitochondriën. Het
kern DNA is in principe gelijk in iedere cel van een individu. Het mitochondrieël DNA kan
echter verschillen, zelfs binnen één cel, omdat daar verschillende mitochondriën zijn. Dit
fenomeen heet heteroplasmie. Hierdoor kan het gebeuren dat er in verschillende weefsels
van een individu zowel normale als foute eiwitten worden gemaakt. De verhouding tussen
normaal en gemuteerd mitochondrieël DNA kan binnen een persoon variëren per weefsel en
kan ook veranderen met de tijd. Het verschilt ook per weefsel hoe schadelijk het gemuteerde
DNA is. De hoeveelheid en verdeling van mitochondriën met een mutatie verklaren soms het
verschil in fenotypen bij personen met erfelijke mitochondriële aandoeningen. Binnen één
familie kunnen de symptomen van de ziekte daardoor sterk verschillen.
Figuur 8 Mitochondriële overerving
Mosaïcisme
Bij mosaïcisme heeft een deel van de lichaamscellen een andere erfelijke samenstelling dan
de rest. Het betreft voornamelijk nieuwe gendefecten. Stel bijvoorbeeld dat in een
willekeurige celdeling na de bevruchting in één cel een mutatie optreedt, dan zullen alle
daaruit voortkomende cellen die mutatie bevatten. In de overige cellen is dit echter niet het
geval. Het kan daardoor voorkomen dat iemand maar gedeeltelijk ziek of drager is. Met
name dat laatste blijkt zich nogal eens voor te doen bij Duchenne spierdystrofie. Soms wordt
bij een jongen met deze aandoening een mutatie vastgesteld, die bij bloedonderzoek bij zijn
moeder niet wordt teruggevonden. De mutatie is dus niet terug te vinden in haar
lichaamscellen. Dan moet er rekening gehouden worden met de mogelijkheid dat de mutatie
wel in een deel van haar eicellen voorkomt. Daarmee bestaat toch een herhalingsrisico.
8
Epigenetische fenomenen
Chromosomen
zijn
opgebouwd
uit
chromatine:
een
combinatie
van
DNA
en
chromosoomeiwit (histonen). We onderscheiden twee soorten chromatine; euchromatine dat
uit de actieve genen bestaat en heterochromatine dat het inactieve DNA bevat. Door
chemische veranderingen van het DNA of de histonen kan de chromatinestructuur wijzigen
zonder dat de basenvolgorde verandert. Dit noemen we epigenetische fenomenen. Dit
gebeurt met name door methylering, dat de overschrijving van DNA naar RNA kan
verhinderen. Het is belangrijk voor de genregulatie, dus of genen wel of niet tot uiting komen.
Hieronder staan enkele epigenetische fenomenen beschreven die van belang kunnen zijn
voor bepaalde spierziekten.
Imprinting
Bij imprinting is er sprake van een verschil in het tot uitdrukking komen van erfelijk materiaal,
afhankelijk of het van vader ofwel van moeder is geërfd. Dezelfde genetische informatie
afkomstig van vader (paternaal) of moeder (maternaal) kan hierbij resulteren in een
verschillend fenotype. Imprinting veranderd genen in de geslachtscellen waardoor die genen
inactief worden. Bij maternale imprinting wordt het gen dat van moeder is geërfd inactief
gemaakt en komt dat van vader juist tot uitdrukking. Imprinting van het gen van vaders kant
(paternale imprinting) zorgt ervoor dat het gen vaders kant inactief wordt en dat van moeder
tot uitdrukking komt.
Wanneer het gen dat niet inactief wordt gemaakt een mutatie bevat, kan dat tot ziekte leiden.
Dus als de moeder een gemuteerd gen doorgeeft en er is sprake van paternale imprinting,
dan komt het gemuteerde gen bij het kind tot uiting. Wanneer er echter maternale imprinting
plaats zou vinden, dan komt het bij het kind niet tot uitdrukking. Deze kan het gen dan op zijn
beurt wel weer doorgeven aan zijn of haar kinderen. Het geslacht van het kind is voor
imprinting niet van belang, alleen dat van de ouder die het gen doorgeeft. Genetische
imprinting van een gen is altijd óf paternaal óf maternaal, dat ligt dan vast voor dat gen en
verandert ook niet.
Een belangrijk aspect van imprinting is het uitwissen en opnieuw instellen van het gen bij
elke generatie. Zo blijft het consistent met het geslacht van de ouder. Een gen met maternale
imprinting wordt in de mannelijke geslachtscel weer actief. Bij een gen met paternale
imprinting daarentegen zal hier opnieuw imprinting plaatsvinden. De precieze werkwijze is
onbekend.
9
X-chromosoom inactivatie
Bij alle vrouwen wordt één van de twee X-chromosomen in elke cel grotendeels
geïnactiveerd. Dit gebeurt willekeurig, in een vroeg stadium van de embryonale ontwikkeling.
Vrouwen die draagster zijn van een recessieve X-gebonden aandoening zijn in het algemeen
gezond of vertonen slechts lichte verschijnselen. Het gezonde gen op het andere Xchromosoom werkt voldoende. Toch kunnen vrouwen soms ernstig zijn aangedaan wanneer
het normale X-chromosoom in het grootste deel van de cellen is geïnactiveerd. Dit kan
voorkomen bij draagsters van Duchenne.
Instabiele grootte repeats
Sommige erfelijke (spier)ziekten worden veroorzaakt door een vergroot aantal herhalingen
(repeats) van een bepaald codon. Voorbeelden hiervan zijn ataxie van Friedreich, FSHD en
myotone dystrofie. De grootte van dit aantal is niet altijd stabiel. Bij een instabiel aantal
herhalingen varieert de grootte tussen de generaties. Dit komt voor bij ataxie van Friedreich
en myotone dystrofie.
Als gevolg van instabiele herhalingsgrootte kan anticipatie optreden. Dat betekent dat de
ziekte in elke volgende generatie op jongere leeftijd begint en het ernstiger verloopt. We zien
dit bijvoorbeeld bij myotone dystrofie.
Genomics en proteomics
Genomics is de term voor grootschalig onderzoek naar erfelijkheid en genen, afgeleid van
het woord genoom. Men wil de bouwstenen van het leven ontdekken. De DNA-samenstelling
wordt ontrafeld om de menselijke genoomkaart te maken. Een essentiële rol is weggelegd
voor de bioinformatica. Daarmee is het mogelijk geworden om alle informatie te verzamelen,
op te slaan, te organiseren, te interpreteren, te analyseren en te communiceren. Via het
internet is veel informatie voor iedereen toegankelijk.
Proteomics is een vervolg op genomics. De naam proteomics komt van het woord ‘proteïne’,
dat eiwit betekent. Zoals al eerder beschreven kunnen cellen van dezelfde persoon, met
allemaal hetzelfde DNA, toch zeer uiteenlopende verschijningsvormen hebben. Proteomicsonderzoek bekijkt welke eiwitten in welke mate in het lichaam voorkomen. Daarnaast worden
veranderingen en interacties tussen eiwitten onderzocht. Een belangrijk doel van proteomics
is de koppeling hiervan aan biologische eigenschappen, zoals de ontwikkeling van cellen en
weefsels, maar ook aan het ontstaan van ziekten. Wanneer eiwitinteracties beter bekend
zijn, kunnen meer diagnostische tests voor aandoeningen worden verwacht. Het zou
eveneens aanknopingspunten voor behandeling kunnen bieden.
10
Bij het schrijven van deze tekst is gebruik gemaakt van onderstaande website en literatuur:
-
www.erfelijkheid.nl, Erfocentrum
-
‘Handboek spierziekten’, Vereniging Spierziekten Nederland
-
e
‘Genen in beweging Erfelijkheid in de 21 eeuw’, Elsevier
-
th
‘Emery’s elements of medical genetics’ 11 edition, Mueller and Young
-
‘Informatiefolder Myotone dystrofie voor medici’, Vereniging Spierziekten Nederland
-
‘Proteomics, van techniek tot inzicht’, Mediator - april 2005 - jaargang 16 - nummer 3
11












