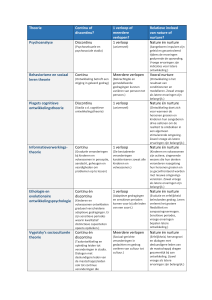
1.4 Chemische reacties
Wet van massabehoud
• Bij een chemische reactie is de massa
van de beginproducten gelijk aan de
massa van de eindproducten.
• De deeltjes worden alleen op een andere
manier gerangschikt.
Reactietemperatuur
• De temperatuur waarbij een reactie gaat
verlopen.
• Symbool van energie: E
• Eenheid: Joule (J)
• E = Eeind – Ebegin
ENDOTHERM
• Kost energie E= +
• Ontledingsreacties
EXOTHERM
• Komt energie bij vrij
E = • Verbrandingsreacties
Exotherme reactie
Reactie waar energie bij vrij komt in de
vorm van licht, warmte (stollen)
Exotherme reactie,
reactie
warmte wordt afgegeven
de temperatuur van het
water stijgt
Exotherm
O2(g) + 2H2(g)
Exotherme reactie
E
ΔE
ΔE = negatief, de reactie kan
spontaan verlopen
2 H2O (l)
Exotherm
Wat zie je wel
De reactie
verloopt
spontaan. De
reactie
producten
hebben een
lagere energie
toestand dan de
beginproducten.
Er komt energie
vrij bij de reactie.
Endotherme reactie
Reactie die energie kost (smelten, ontleden)
Warmte wordt opgenomen,
temperatuur van het water
daalt
ENERGIE DIAGRAM
O2(g) + 2H2(g)
Endotherme reactie
E
ΔE
ΔE = positief, de reactie kan alleen
verlopen wanneer voortdurend
energie wordt toegevoegd.
De reactiewarmte is gelijk aan ΔE:
Verschil tussen de Ebeginen Eeind
2 H2O (l)
Endotherm
Wat zie je nooit
De reactie verloopt niet
spontaan. Er moet
voortdurend energie
worden toegevoegd.
Activerings energie
overgangstoestand
Eact
beginstoffen
E
ΔE < 0
eindstoffen
Wanneer de reactie eenmaal begonnen is, zorgt de vrijkomende
energie dat de rest van de reactie kan verlopen.
Activerings energie
overgangstoestand
Eact
beginstoffen
E
eindstoffen
De meeste reacties moeten op gang worden geholpen, de energie die
daarvoor nodig is heet activeringsenergie.