www.VETserieus.nl
Beste Student,
De documenten op VETserieus.nl zijn alleen bedoeld als ondersteuning bij
het studeren. De samenvattingen worden nagekeken door studenten tijdens
het volgen van de lessen en waar nodig aangepast. Dit project heeft als doel
foutloze samenvattingen te bieden die met hun tijd meegaan, ondanks dit
streven is er altijd een kans dat er fouten in de documenten staan. Mocht je
tijdens het lezen van de samenvatting fouten vinden kun je dat doorgeven
via de contactpagina op de site of direct een mail sturen naar
[email protected]
De student is verantwoordelijk voor zijn of haar leermethode en voor het
uiteindelijke resultaat. Allemaal veel succes met de voorbereidingen!!
Hartelijke groet,
VETserieus.nl
Samenvatting Circulatie
HC1
Volwassen zoogdieren hebben een dubbele bloedsomloop, dit betekend at de rechter harthelft
(rechter atrium en ventrikel) de bloed naar de longen pompt (en dus zuurstof arm bloed) via de
truncus pulmonalis; de vena pulmonalis voert weer de zuurstof rijk bloed van de longen naar de
linker atrium, de linker harthelft (linker atrium en ventrikel) pompt het bloed naar het lichaam. Alle
organen zijn parallel geschakeld en krijgen zuurstof rijk bloed uit de arteriën. De venen voren het
zuurstof arm bloed terug naar de rechter harthelft. De poortader voert zuurstofarm bloed maar
voedingsrijk bloed van de darmen naar de lever.
De truncus brachiocephalicus splitst uit de aorta naar craniaal, en splitst verder in de linker en
rechter a.carotis communis die de hoofd verzorgt van bloed. Ook uit de aorta kan de rechter en
linker a. subclavia splitsen (bij de hond, kat en varken), deze verzorgt de voorpoten van bloed (de
a.subclavia kan ook uit de truncus brachiocephalicus splitsen (zoals bij de rund en paard))
De druk in de arterie systeem (90mm Hg) is veel hoger dan dat in de veneuze systeem (3 mmHg). De
linker ventrikel die verantwoordelijk is voor de transpoort van zuurstof rijk bloed heeft een veel
dikkere spier wand en een hogere druk (120 mmHg) dan de rechter ventrikel, die maar een druk van
30 mmHg heeft bij piek systolische druk.
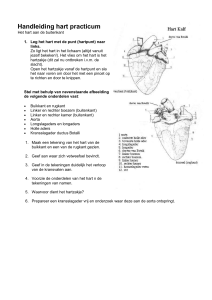
De hart ligt vaak tussen de 3e en 6e rib, maar dit kan verschillen per diersoort. De apex (punt van het
hart) ligt schuin naar achter met een bovenwaartse helling naar craniaal. De hart ligt in de
mediastinum en wordt bedekt door een paar vliezen, namelijk de (van de hart naar buiten): de
pericardium visceralis (oftewel epicard), pericardholte, pericardium parietalis. Deze vliezen samen
vormen de hartzakje.
De strengetjes in het hart worden de chordae tendinae genoemd en de plek waar ze aanhechten, 7,
zijn de musculus pappilaris. (zien als de scheerlijnen van de tent, voorkomen dat de kleppen
doorslaan richting het atrium, worden niet gebruikt om de kleppen open te trekken).
In een vroeg embryonaal stadium is het hart een S-vormige buis, met 4 belangrijke structuren (1 t/m
4)
Het atrium en ventrikel zijn op dit moment nog ongedeeld, en dus één atrium, één ventrikel (gewoon
een buis)
Sinus venosus: ontvangt bloed uit het lichaam (dus van de v. cardinalis, umbilicalis en vitallina),
truncus arteriosus pompt het bloed naar de kieuwboog arteriën.
Een aantal zaken moeten veranderen: atrium en ventrikel moeten een septum krijgen, de kleppen
moeten ontstaan, de sinus venosus en truncus arteriosus moeten verdwijnen. Het rechter deel van
de sinus venosus (rechter sinus hoorn) neemt in volume en belangrijkheid toe, de linker neemt juist
af. Logisch want het veneuze bloed moet uiteindelijk in het rechter hartdeel terecht komen. De
rechter venen dragen dus ook bij aan de ontwikkeling van de vena cava caudalis en cranialis, de sinus
venosus zelf verdwijnt dus uiteindelijk wel. Van de linker sinushoorn blijft slechts één structuur over,
de sinus coronarius, deze mondt uiteindelijk ook uit in het rechter atrium en bevat het veneuze
bloed afkomstig uit de hartwand.
In de binnenkant van het hart in de embryonale fase zien we eerst nog geen scheiding tussen de atria
en verntrikels. De uitmonding van de sinus venosus ligt al wel in het toekomstig rechter atrium.
Wanneer het septum tussen de atria verder uitgroeit hebben we nog een kleine
verbindingsmogelijkheid tussen de atria, het foramen ovale. Ook tussen de ventrikels krijg je een
septum, maar hiertussen geen shunt meer (deze groeit uit het apex richting de atria). Het foramen
ovale speelt een belangrijke rol: tijdens de embryonale fase is het veneuze bloed afkomstig van de
placenta en dus zuurstofrijk. Deze hoef je niet meer door de longen te sturen (de longen zijn ook nog
niet functioneel), maar direct de circulatie in. Dit kan van rechter atrium direct door naar linker
atrium door foramen ovale. De rechter sinushoorn wordt opgenomen in de wand van het rechter
atrium = gladwandige deel van het atrium. Het oorspronkelijke deel van het atrium wordt het
aurikel (hartoortje) genoemd. Soortgelijk in het linker atrium, waarbij het gladwandige linker atrium
gevormd wordt door de oorspronkelijk uitgroeiende longvenen. Hierdoor zie je 4 veneuze openingen
in het linker atrium, het waren namelijk 4 longvenen.
In de truncus arteriosus zorgt voor de uitstroom van het hart naar de kieuwbogen in de embryonale
fase. Vanuit de rechter zijde wil je dat het bloed naar de longen gaat, en dus naar de 6de kieuwboog,
en aan de linker zijde wil je dat het bloed naar de aorta gaat en dus de 4de kieuwboog. De septum
ontwikkeld zich spiraal vormige waardoor dit mogelijk wordt gemaakt. Dit verklaard ook waarom de
aortaboog en de truncus pulmonalis als een spiraal om elkaar heen gedraaid zijn.
4 kleppen van het hart: mitralis, pulmonaal, tricuspidalis, aorta. Aan de hand van de ligging met
intercostaalruimten kun je de kleppen goed ausculteren. Bij het rund gebruiken we PAM-T, PAM
links, T rechts. Alle kleppen bestaan uit 3 slippen, behalve de mitralisklep, deze is 2-slippig.
Wanneer je op een dwarsdoorsnede kijkt van het hart is de middelste klep altijd die van de aorta
boog, ontspringt dus mooi midden in het hart.
De eerste harttoon is na de systole (samentrekking) van het atrium en is het dichtslaan van de AVkleppen (mitralis en tricuspidalis) en de tweede harttoon is na de systole van de ventrikels en het
dichtslaan van de semilunaire kleppen (pulmonaal en aorta). De systole van het atrium komt eerder
dan die van het ventrikel, dit omdat het ventrikel veel sterker is en anders tegen het atrium in zou
kunnen contraheren. (S1-S2: Br Tp).
Het start moment van de cyclus is de systole van het atrium omdat hier de sinusknoop zijn signaal
afgeeft. Deze knoop ligt in het gladwandige deel van het rechter atrium en triggert de hartcyclus. Hij
is dus ook afkomstig van de rechter sinushoorn van de rechter venosus opgeslokt door rechter
atrium en ligt nu dus daar.
De bloedvoorziening van het hart zelf wordt door de coronairvaten verzorgd (coronaria dextra en
sinistra). De rechterzijde van het hart wordt door rechter coronair arterie voorzien, links door links
natuurlijk. Deze zijn afkomstig uit de aorta. Bij het paard en het varken is een symmetrische
coronairvat verdeling. Rund en carnivoren asymmetrisch, wat dit precies is in practicum1.
Terug naar embryologie, de bloedstroom door het embryonale hart links en volwassen hart rechts:
1 t/m 3 verdwijnen dus bij het geboorte. Wanneer het zuurstofrijke bloed niet door het foramen
ovale gaat maar toch de pulmonaal arterie in gaat, kan het via de ductus arteriosus toch nog de aorta
in (het bloed vanuit de kop neemt voornamelijk deze route).
Door alle shunts spreek je tijdens de embryonale fase van een gecombineerde cardiac output (= het
bloed dat per minuut het hart verlaat). Tijdens de embryonale fase tel je dus de output van links en
rechts bij elkaar op, het onderscheid is namelijk door alle tussenwegen en shunts erg moeilijk =
gecombineerde cardiac output is 100%.
Zoals je ziet is het voor links en rechts niet gelijk verdeeld, en de cardiac output is voor het rechter
hartdeel ongeveer 2/3 en voor het linker hartdeel 1/3. Rondom de geboorte en vlak erna sluiten alle
shunts, links en rechts moeten dan gelijk worden, links en rechts hebben namelijk dezelfde cardiac
output. De 34% van links moet dus 50% worden en de 66% van rechts ook. De flow in de linker
ventrikel neemt dus toe, bovendien valt de placenta weg (hele lage vaatweerstand) waardoor de
totale weerstand in het abdomen toeneemt. P = Q * R. De flow en weerstand nemen toe, dus de
druk in het linker ventrikel moet ook toenemen. Aan de rechterzijde moet juist de flow afnemen,
bovendien gaan de longen openstaan (met een lage vaatweerstand), waardoor de druk dus ook
afneemt. Hierdoor zijn er dus sterke drukverschillen tussen links en rechts. Hetzelfde geldt voor de
aorta (links) en de A. Pulmonalis (rechts). Dit zorgt ervoor dat na de geboorte het bloed via de ductus
arteriosus de andere kant op gaat stromen, van aorta naar pulmonalis signaal om de ductus
arteriosus te sluiten.
De belangrijkste drukken na de geboorte in en rondom het hart zijn:
De druk in het rechter atrium is lager dan die van de linker atrium, dit verschil is veel kleiner dan in
de ventrikels. De piekdruk van de aorta is gelijk aan die van de LV tijdens de systole. De bovendruk
van de pulmonalis is tijdens de systole gelijk aan die van het rechter ventrikel. De onderdrukken
verschillen wel heel erg.
PDA: machinegeruis, tijdens systole en diastole dus continue, door turbulente stroming.
VSD: een souffle tijdens systole omdat het verschil tussen systolische drukken veel groter is dan
tijdens de diastolische drukken van de ventrikels.
Practicum 1
Dissectie kat:
Het hart wordt omgeven door een aantal vliezen, van buiten naar binnen zijn dit:
- Pleura mediastinalis
- Lamina fibrosa: dient als versteviging van het hartzakje en aan het sternum door het
ligamentum sternopericardiacum verbonden.
- Lamina parietalis van het pericard
- Lamina visceralis van het pericard (synoniem aan epicard)
Tussen de laatste twee lagen bevindt zich de pericardiale holte waarbinnen een smerende laag
vloeistof zit. Hierdoor kan het hart zich makkelijk bewegen.
Het bloed komt via de vena cava caudalis vanuit de buikholte de thorax binnen via het foramen
venae cavae in het diafragma. Deze vene voert het bloed af van de achterbenen en buikorganen en
mondt uit in het rechter atrium.
Vanuit craniaal loopt ook een vene het rechteratrium in, welke het bloed afvoert van de hals, hoofd
en voorbenen. Dit is de vena cava cranialis.
Vanuit de thoraxwand wordt bloed afgevoerd via de arteria azygos dextra, welke kan uitmonden op
de v. cava cranialis of direct op het rechter atrium.
De aorta ontspringt uit het linker ventrikel en loopt dan een stukje omhoog (ascendens), maakt een
boog (arcus aortae) en loopt in de descendens naar caudaal. De bloedvoorziening craniaal geschiedt
uit 2 grote ontspringingen in de aorta. Voor caudaal ontstaan er uit de aorta descendens 9 paar
arteriën (arteriae intercostalis), beginnend vanaf de 4e of 5e intercostaalruimte. De 1e, 2e en 3e
worden verzorgd door zijtakken van de arteria subclavia.
De darmtractus wordt voorzien van een 3tal ongepaarde arteriën, welke allemaal zijtakken zijn van
de aorta descendens. Van craniaal naar caudaal:
- Arteria coeliaca: ontspringt direct, is ongepaard en voorziet met 3 zijtakken de milt
(lienalis), lever (hepatica) en maag (gastrica sinistra).
- Arteria mesenterica cranialis heeft heel veel zijtakken naar alle delen van de darm,
rechter lob pancreas en mesojejunum (aa. Jejunales)
- Arteria mesenterica caudalis in ook ongepaard en loopt in het .mesocolon, voor het colon
descendens en het rectum. Sommige delen gaan samen lopen met zijtakken van de a.
mesenterica cranialis.
De buikholte wordt ook voorzien door een aantal gepaarde arteriën. Delen van het ruggenmerg, huid
en spieren dorsaal hiervan worden verzorgd door de a. lumbales. De arteriën voor de nieren zijn de
a. renales en liggen vaak op een verschillend niveau, wanneer ze de aorta verlaten. De linker is vaak
dubbel en de rechter ligt craniaal van de linker. De arteria ovaria/testicularis zijn homoloog aan
elkaar bij poes en kater, en varieert in dikte en vorm naar gelang er veranderingen plaats vinden in
de uterus. De a. testicularis kruitst de ventrale zijde van de ureter en loopt samen met de vene en
een zenuwplexus naar de testes.
De caudodorsale buikwand, de flank en de craniale zijde van de dij wordt voorzien door de
a.circumflexa ilium profunda, welke de sublumbale spieren kruist .
De aorta eindigt in de gepaarde a. iliaca externa naar de achterpoten, de gepaarde, a.iliaca interna
naar de bekkenholte en de ongepaarde a.sacralis mediana naar de staart. Uit de a. iliaca externa
ontspringt ook de a. femoralis, waar je bij de hond de pols opneemt.
De toevoerende venen lopen meestal terug naast de betrokken arterie, en komen uit op de vene
cava caudalis voor het grootste deel van de buikholte. Uit de darmen komt het bloed via de vene
portae eerst in de lever en dan via de venae hepaticae ook op de vene cava.
Aan de hartbasis vinden we de grote arteriën, terwijl het hartpunt los ligt. De aorta komt midden
vanuit de hartbasis. Vanuit de craniale zijde van de aorta ontspringen twee arteriën.
1. De truncus brachiocephalicus welke de a. carotis communis (dextra en sinistra) naar de hals
vormt en en de a. subclavia dextra naar de rechtervoorpoot.
2. Arteria subclavia sinistra: naar de linker voorpoot.
Aan de dorsale zijde van de aorta descendens ontspringen de intercostaal arteriën.
Om de pols op te nemen wordt bij het paard ook de a. facialis gebruikt, welke over de kaakomslag
loopt. Deze is afkomstig uit de truncus linguofacialis. Na passage van de incisura vasorum
(halsgroeve) splitst de facialis zich in 3 takken, onderkaak, bovenkaak, neus/oog.
De twee grote venen vanuit het lichaam zijn de v. cava caudalis en cranialis. De caudalis loopt samen
met de nervus phrenicus via de plica venae cavae door het foramen vena cavea naar het hart.
Voor bloedafname gebruiken we altijd venen, de 3 mogelijkheden hiervoor zijn: de vene jugularis in
de hals, de vena cephalica in de voorpoot en de vena saphena in de achterpoot.
Dissectie varkenshart:
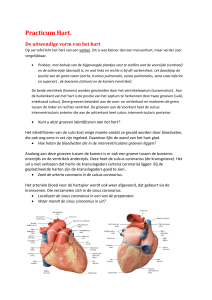
Het atrium en ventrikel worden uitwendig zichtbaar gescheiden door de sulcus coronarius, welke
wordt onderbroken door de oorsprong van de truncus pulmonalis. Tussen de truncus pulmonalis en
aorta loopt het ligamentum arteriosum.
Een aantal diersoort verschillen van het hart zijn:
Oriëntatie
Vorm apex
Projectie
hartas
op ribwand
Kat
45 graden
stomp
x
Ictus cordis
x
Puncta
maxima
P: links, 2-3
A: links, 2-3
M: links, 56
T: rechts, 45
P: links, 2-3
A: links, 4
M: links, 56
T: rechts, 35
Verdeling
coronairvaten
asymmetrisch
Hond
45 graden
Stomp
3e – 6e ICR
L: 4e-6e ICR
R:3e-5e ICR
Rund
Steil,
verticaal
Steil,
verticaal
45 graden
Stomp
2e – 5e ICR
L:4e-5e ICR
asymmetrisch
Puntig
3e – 6e ICR
L:4e-5e ICR
symmetrisch
x
symmetrisch
Paard
varken
Stomp/puntig x
asymmetrisch
De bepaling van de puncta maxima bij het paard en rund zijn niet zinvol, omdat de ribben in die
gebieden slecht gepalpeerd kunnen worden. De puncta maxima bij het rund liggen min of meer op
een horizontale lijn, halverwege boeg en olecranon, van craniaal naar caudaal PAM. De projectie van
de aorta is hier wel iets dorsaal van en de AV-kleppen liggen net onder de m. triceps bachii. Aan de
rechterzijde gebruiken we dezelfde lijn en beluisteren we ver naar craniaal.
Bij het paard is dit hetzelfde maar dan ligt de AV-klep net achter de m. triceps brachii.
Ook een ictus cordis is bij zowel rund als paard niet goed waar te nemen, de apex ligt immers tegen
het mediastinum aan. Wat je wel voelt is de contractie van het linker ventrikel.
Bij alle diersoorten, behalve de kat, ligt het pericard tegen het mediastinum aan. Dit draagt bij het
rund dus ook bij aan een traumatische pericarditis na scherp-in.
De wand tussen de atria is vrij dun, en op één plek zeer dun. Dit is de fossa ovalis, het overblijfsel van
het foramen ovale.
Histologie:
De wand van de verschillende delen van het circulatieapparaat is opgebouwd uit 3 lagen:
1. Tunica intima: een endotheellaag met daaronder bindweefsel
2. Tunica media: spierweefsel en elastisch weefsel
3. Tunica adeventitia: bindweefsel
Tussen de intima en de media kunnen we bij arteriën een lamina elastica interna en tussen de media
en adventitia soms een l. elastica externa. Met name de media kan tussen verschillende delen van
het circulatieapparaat verschillen en op basis hiervan maakt men ook onderscheid tussen elastische
en musculeuze arteriën. Het is zo aangepast aan stroomsnelheid, druk, volume en pompfunctie.
Bij grotere vaten zien we ook nog een vasa vasorum welke de vaten zelf weer van bloed verzorgen
en lymfevaten de vasa lymfatica vasorum.
Algemene kenmerken van de verschillende bloedvatwanden zijn:
Elastische Musculeuze Arteriole Capillair
arterie
arterie
Doorsnede
(micromet
er)
Endotheel
Spieren
(glad)
Elastisch
apparaat
bindweefs
el
5-15
1-10
Postcapillaire
venule
Musculeuze
venule
100-300
30-300
7-9
10-30
continu
continu
continu
Continu of
gefenestreerd
Alternere
nd met
elastische
membran
e
50-70
elastische
membran
e
4-40 lagen
1-3
lagen
x
Continu,
zelden
gefenestreerd
x
l. elastic
interna en
externa +
circulaire
vezeltjes
Geen,
alleen in
adventitia
l.
elastica
interna
x
x
Geen
Geen
Collageen
Weinig,
in
adventiti
a veel
Venen
(m.u.v. vene
cava)
0,1-10
continu
continu
1-2 lagen
Wisselend
losse lagen
circulair en
longitudinaal
Geringe
vezeltjes
Alleen in
grote venen
de l. elastica
interna.
Collageen
Heel
en
belangrijk,
fibroblasten voornamelijk
in
adventitia.
De grote lichaamsslagaderen zijn van het elastische type (aorta, subclavia, carotis), de t. media is zeer
elastisch. De intima en externa zijn niet altijd duidelijk aanwezig. In de adventitia vindt je de vasa
vasorum.
Met behulp van een resorcine fuchsine kleuring kun je de elastische vezels goed zichtbaar maken,
welke dan donkerpaars worden. De arteriën hebben deze elastische kenmerken om de
drukverschillen op te kunnen vangen (windketel effect).
De arterie digitalis is van het musculeuze type dus veel glad spierweefsel met circulaire oriëntatie in
de t. media heeft. In musculeuze arteriën zien we altijd een l. elastica interna, meestal sterk geplooid.
Een l. elastica externa is niet duidelijk te zien. De t. adventitia is veel dikker dan bij elastische arteriën
en hier bevindt zich ook een vasa vasorum.
Belangrijk nog te vermelden over de venen is dat we een klepstructuur kunnen aantreffen, een
uitstulping van de t. intima. Deze kleppen bevatten geen spierweefsel en worden bewogen door
drukverschillen. De functie is het voorkomen van terugstroming van het bloed.
De arteriolen en venulen zijn dunner maar de arteriolen hebben over het algemeen wel een
elastische wand terwijl deze in de venulen geheel ontbreekt. Verder hebben de venulen een veel
wijder lumen. Ook lymfevaten hebben een wijd lumen en een weinig ontwikkelde wand. In
lymfevaten kunnen ook soms klepstructuren voorkomen.
De lagen van het hart zijn van binnen naar buiten het endocard- myocard- epicard (= parietalis
visceralis). Het endocard is homoloog met de t. intima van de bloedvatwand. De hartspiervezels in
het myocard lopen in alle richtingen en tussen de groepjes hartspiercellen (vlechtwerkachtig
patroon) ligt losmazig bindweefsel waar we bloedvaten, vetcellen en zenuwbundels van het Purkinje
netwerk te vinden (blazige roze gekleurde cellen). Het verschil tussen hartspiercellen en
skeletspiercellen is dat hartspiercellen vertakt zijn. Ze zijn aan elkaar verbonden door middel van
intercaleerschijven. Het epicard is de sereuze membraan van het hart.
Het geleidingssysteem bestaat uit gespecialiseerd hartspierweefsel, en is de SA en de AV knoop. In
het knoopweefsel zijn de functionele eenheden de knoopvezels. Dit zijn atypische hartspiervezels
met weinig myofibrillen, een grote centraal gelegen kern en een lichtgekleurde zone eromheen. In
het knoopweefsel vinden we ook bloedvaten. Het knoopweefsel gaat aan één zijde geleidelijk over in
het hartspierweefsel.
De Purkinjevezels bestaan ook uit gespecialiseerde hartspierweefsel in de wanden van de kamers.
Deze zijn veel groter en blaziger, maar met een kleine kern. Er is hier een goede doorbloeding maar
ook veel vetweefsel.
Vooral bij het rund en het paard dringen de purkinje-vezels tot diep in het hartweefsel door.
HC2
In principe is de hartcyclus op te delen in 4 fasen, fase I en II van de systole (contractie) en fase I en II
van de diastole (relaxatie). De systole neemt ongeveer 1/3 van de tijd in, de diastole ongeveer 2/3
van de tijd.
In woorden is het ook belangrijk de hartcyclus te begrijpen, we beginnen hierbij in de diastole,
vullingsfase van de ventrikels. Start op diastole van ventrikels = fase II diastole.
- Druk ventrikel daalt tot onder de druk van het atrium AV-kleppen open vulling van
ventrikel, en druk daalt verder door uitzetting van het ventrikel tijdens het eerste deel
van de vullingsfase.
- Druk in ventrikel stijgt iets in het tweede deel van de vullingsfase, bloed wordt in het
ventrikel geduwd vanuit de veneuze druk, maar nooit een hogere druk dan die van het
veneuze vaatbed (= vullingsfactor, 5-6 mm Hg). Behouden van lage druk. Vulling tot 90%.
- Signaal sinusknoop, systole atrium vulling ventrikel tot 100%, druk nu 7-9 mm Hg, dus
nog steeds lage druk.
- Signaal vanuit sinusknoop verspreidt zich door septumwand naar ventrikel, systole
ventrikel, druk neemt enorm toe in ventrikel AV-kleppen gaan dichts, S1-harttoon.
- Ventrikel op dit moment is een afgesloten ruimte, gelijk volume maar een snelle
opbouwende druk door contractie = isovolumetrische contractie = 1e fase systole.
- Druk stijgt in LV tot 80 mm Hg en RV tot 20-25 mm Hg. Zodra deze druk bereikt is
(onderdruk van arteriën) gaan aortaklep en pulmonaal klep open ejectiefase.
- Bloed stroomt uit maar de druk neemt in het ventrikel nog steeds toe. Halverwege de
ejectiefase is de piekdruk (120 mm Hg) in het ventrikel en door verbinding met de arterie
ook in de arterie bereikt, 120 mm Hg = fase II systole.
- De grotere druk maakt het moeilijker om bloed uit te pompen, dus aan het eind in de
ejectiefase neemt de druk in het ventrikel weer af door wegstromen bloed. Hiermee
neemt de druk in de aorta ook af.
- Om terugstroming van bloed (windketel effect) door deze drukverlaging te voorkomen
sluiten de aorta en pulmonaalklep, S2-harttoon = eind systole fase II.
- Tijdens de hieropvolgende diastole daalt de druk in het ventrikel weer en de aorta druk
neemt af tot 100 mm Hg (kleppen zijn dicht dus onafhankelijk van ventrikel) isolvolumetrische relaxatie = fase I diastole.
- Drukafbouw neemt snel af door de relaxatie en de AV-kleppen gaan door dit verschil
weer open. Belangrijk dat dit snel gebeurt zodat de AV-kleppen ook snel weer open
kunnen. Druk daalt van 100 naar 5 mm Hg (druk in aorta staat hier los van, en daalt tot
ongeveer 80 mm Hg) vullingsfase van ventrikels tijdens de diastole = fase II. En we zijn
weer terug het cirkeltje rond.
De totale duur van de diastole is langer dan die van de systole, en de systole van het ventrikel start
dus op het moment dat die van het atrium is afgelopen.
Bovenstaand zien we deze cyclus nog een keer. De zwarte lijn hier is een volume lijn en geen druk
lijn. Verder opvallend is het hobbeltje aan het einde van fase 1 de contractie van het atrium. Deze
gegevens zou je ook tegenover elkaar kunnen uitzetten in de vorm van de PV-arbeidslus. De druk zet
je uit op de Y-as en het volume op de X-as.
Zoals je kunt zien betekent elk hoekpunt iets, ook de oppervlakte onder de grafiek en de breedte
hebben betekenis. Hobbeltje rechts onderin is de atrium contractie. Het slagvolume is het verschil
tussen eind-systolisch en eind-diastolisch volume, hoe groter hoe leuker. Daalt slagvolume, daalt
cardiac output, dus HF moet dan omhoog. C.O. (cardiac output)= SV (slagvolume) * HF
(hartfrequentie).
Als de PV lus breder wordt, wordt dus ook de SV hoger. Dit gebeurt door de contractiliteit van het
hart te vergroten, het hart kan zich dan langer leegknijpen en tegen de druk van de aorta opbouwen.
Het EDV (eind diastolisch volume) is dus kleiner. De maat voor contractiliteit is vanuit de oorsprong
een lijn te trekken naar het hoekpunt van EDV, linksboven.
Een hart is een spier, dus achter een vergrote contractiliteit zit ook een moleculair mechanisme.
Méér calcium geeft een betere contractiliteit = inotropie.
Adrenaline en (nor)adrenaline hebben een positieve inotroop effect = beter contractiliteit
In de hartspiercel treedt calcium-geïnduceerde-calcium afgifte op. Gaat als volgt: door de
actiepotentiaal gaat de calciumkanaal op met membraan (van de t-tubulus (deel van SR)) open staan.
Hierdoor stroomt een klein beetje calcium de cel in. Deze geringe instroom triggert het
Sarcoplasmatisch reticulum (SR) om héél veel calcium af te geven contractie. Deze contractie door
meer calcium is het gevolg van de vorming van ‘cross-bridges’ op het sarcomeer, méér Ca is meer
cross-bridges.
De calcium afgifte kan verhoogd worden door het hormoon adrenaline. Deze bindt aan de cel via de
bèta-1-receptor en brengt een hele 2nd-messenger cascade op gang (cAMP -> protein kinase A).
Deze cascade zorgt voor fosforylatie van de calciumkanalen. Hierdoor neemt de instroom van de
spanningsgevoelige kanalen toe, waardoor de trigger op het SR toeneemt. Het SR geeft meer Ca af,
hardere contractie = inotroop effect. De PV-lus wordt dan breder en de hellingslijn (delta Y/delta X)
neemt toe. Deze lijn noemen we de eind-systolische druk/volume lijn. De helling is dus een maat
voor contractiliteit en slagvolume. Deze is onafhankelijk van variaties in preload en afterload, maar
neemt toe bij een toename van de contractiliteit, bijv. na toediening van catecholamines. En een
verandering in de vorm van de P-V lus (druk en/of volume) t.g.v. veranderingen in veneuze
vullingsdruk (preload) of arteriële bloeddruk (afterload) is dus geen afspiegeling van een verandering
in contractiliteit.
Het is ook mogelijk om een eind-diastolische druk/volume lijn te trekken naar het hoekpunt
rechtsonder. Dit is echter een passief proces en niet een actief proces zoals bij de eind-systole
geweest is (contractie). De PV-lus ligt altijd tussen deze twee lijnen.
Preload: is de veneuze vullingsdruk (voorbelasting), zorgt voor vulling van het hart (toename
gunstig).
Afterload: is de arteriële druk, nabelasting, is dus waar het hart tijdens de ejectiefase tegenop moet
boksen (toename ongunstig).
Wanneer het hart door een sterkere contractie het slagvolume vergroot daalt de druk in de veneuze
zijde. Het bloed wordt immers meer in de arteriële zijde gepompt en moet ergens vandaan komen.
Omdat adrenaline ook voor een HF verhoging zorgt zal de vullingstijd afnemen, hierdoor zou het EDV
afnemen en dus ook weer het slagvolume. Dus vullingsdruk en vullingstijd nemen af. Het hart heeft
een aantal mechanismen om deze nadelen te voorkomen:
1. De afname van EDV wordt voorkomen door een verhoogde contractie van de atria ook en
dus weer een grotere EDV.
2. De afname in veneuze druk wordt tegengegaan door contractie van de spieren zelf. Deze
duwen als het ware het bloed naar veneuze zijde waardoor de druk weer toeneemt =
spierpomp.
3. Tijdens inspanning neemt ook de ademhaling toe, de diepere inademing zorgt voor een
sterkere onderdruk van de thorax. De hartwand zet iets uit door aanzuiging en het bloed
stroomt hierdoor makkelijker het hart in.
Door deze aanpassingen neemt het EDV dus helemaal niet af, zelfs een beetje toe! Met andere
woorden de preload neemt juist toe.
Bovenstaande regels gaan volgens de wet van Starling, dat wil zeggen ik stop er meer in dus komt er
ook meer uit. Dus als ik de veneuze vullingsdruk verhoog, neemt mijn slagvolume ook toe. Dit heeft
alles te maken met de extra sarcomeerlengte waar een optimum voor bestaat (rond de 2,2-2,4
micrometer), of anders een optimum voor overlap tussen actine/myosine filamenten. Door iets extra
in het hart te stoppen rekken de sarcomeer lengte net iets uit tot het optimum, waarbij de ‘crossbridges’ tussen myosine en actine optimaal zijn. Iets uitrekken geeft dus automatisch een optimalere
contractie en dus SV en is dus geen inotroop effect maar een preload effect. Een toename van de
preload is dus tot op zekere hoogte gunstig. Wanneer je de EDV op de x-as zet en de Y-as het
slagvolume, zal je een rechte lijn krijgen met een helling van 1 = starlingcurve.
Nu lijkt het misschien dat het verhogen van de preload altijd (middels de wet van starling gunstig is).
Dit is om 2 redenen niet correct. Allereerst, een te hoge veneuze druk (preload) geeft oedeem
vorming vanuit de capillairen (meer filtratie, minder resorptie). Bovendien beïnvloed de preload de
cardiac output, waardoor je dus een negatieve feedback krijgt bij een sterke verhoging, het heeft dus
helemaal geen zin dan.
Linksboven: toename contractiliteit groter SV inotroop
Onder: toename veneuze vullingsdruk groter SV wet van Starling
Rechtsboven: toename afterload (hogere
arteriële bloeddruk) SV omlaag.
Inotroop effect is dus aan de linkerzijde
van de PV-lus, de wet van Starling is dus
aan de rechterzijde van de PV-lus waar te
nemen.
WC4
De cardiac output is niet alleen afhankelijk van de eigenschappen van het hart zelf, maar ook van de
heersende toestand in het vaatbed. Zo is de cardiac output ook afhankelijk van bijvoorbeeld het
aanbod in de vorm van preload.
Formeel wordt ook wel gesteld dat de vulling van het hart afhankelijk is van de mogelijkheden tot
uitrekking (+ tijdens hogere AF, en – tijdens een pericarditis) en het drukverschil over de
ventrikelwand.
De vullingsdruk is de druk die van binnen uit op de ventrikelwand werkt, en min of meer gelijk aan de
veneuze druk. Deze veneuze druk staat wel onder invloed van vele factoren: lichaamsstand,
bloedvolume, zwaartekracht. Tonus van perifere venen, skeletspierpomp, respiratie en cardiac
output (deze daalt dan! Zie HC2).
De prestaties van het hart hangen ook af van een aantal andere zaken. De grootte van de opening
van de aorta, waarbij een kleinere opening meer kracht voor dezelfde output vergt. Dit kan het geval
zijn bij bijvoorbeeld een aorta stenose. Ook de arteriële druk dient als weerstandsmaat voor het hart
om bloed in de aorta te krijgen, vergroot deze wordt het lastiger.
De weerstand in de longen is veel lager dan die van de parallel geschakelde organen samen, maar de
bloedstroom door beiden is wel gelijk. Dit betekent dat de druk ook lager is want p = r * q.
Dukes figuur 14.4 op p. 233 is het allerbelangrijkste figuur om goed te begrijpen. Vergeet dus niet
hier nog naar terug te gaan. De pieken in het ECG zijn hierin ook belangrijk. Als hulplijn kun je hierbij
de tekst in de studiewijzer, p. 33 gebruiken.
Een ECG:
P: signaal van de sinusknoop atrium contractie.
QRS: R is hierin het startsignaal tussen de ventrikel systole. (tijd dus P en R is dus ook een maat voor
de signaaloverdracht binnen het hart).
T: diastole van de ventrikels
Een harttoon is dus hoorbaar direct na de R-top (S1), waarbij de AV-kleppen zich sluiten.
Met de ejectiefractie (fractional shortening) wordt het eind-diastolische volume / slagvolume x 100%
bedoeld. Dit is dus het percentage van hoeveel er uit het hart gaat relatief aan wat er in komt en dus
hoe krachtig de slag van het hart is. Deze is nooit 100% en maximaal rond de 70%. Het is een fractie
dus niet afhankelijk van de grootte van het dier. De ejectiefractie kan berekend worden met behulp
van een echocardiogram, waarbij de diameter van het lumen van het ventrikel tussen eind-diastole
en eind-systole gemeten en daarna berekend wordt. De T-top in het ECG is dan de eind-systole en de
QRS-top is de eind diastole. Om de EF te berekenen heb je dan een formule van het ventrikellumen.
De preload is strikt genomen de spanning in de wand aan het eind van de diastole. Deze is
echter gerelateerd aan het EDV die op zijn beurt weer afhangt van de Centrale veneuze druk. De
toename van preload verhoogt ook het SV wanneer de rest constant blijft, de PV-lus wordt dan aan
de rechterzijde breder. De moleculaire gedachte hierachter is uiteraard het Starling mechanisme.
In de starlingcurve zien we een rechte lijn. Het snijpunt met de x-as staat voor het eind-systolische
volume. Je zet in de starlingcurve het EDV op de x-as en het slagvolume op de Y-as. Wanneer door
toedoen van adrenaline de contractiliteit toeneemt en de afterload gelijk blijft zal de curve ook
omhoog gaan (omhoog, maar de helling blijft altijd 1). Immers, het SV neemt gelijk aan de preload
toe. Wanneer de contractiliteit daalt zal de curve juist naar beneden zakken. Dit kan bijvoorbeeld
gebeuren als gevolg van een taurine deficiëntie bij honden en katten ( dilated cardiomyopathie,
DCM). Dit aminozuur is betrokken bij o.a. de regulering van calciumstromen in de cel, deze neemt af.
Het lichaam gebruikt het Starling mechanisme om de cardiac output te herstellen/verhogen. Centraal
veneuze druk neemt toe hart rekt uit en optimaal sarcomeerlengte betere contractiliteit en
groter SV grotere CO.
De externe arbeid die het hart verricht tijdens een contractiecyclus verricht is drukverschil maal
volumeverschil en dit is gelijk aan de oppervlakte onder de PV-lus. De vaatweerstand moet met deze
verrichte arbeid overwonnen worden, dus de afterload. Wanneer door een te hoge afterload de
aorta kleppen niet openen vindt geen arbeid plaats omdat er geen volume verschil tussen diastole en
systole komt, dit noemen we een isovolumetrische contractie. Wel is er natuurlijk energie verbruikt
door de contractie en deze komt vrij als warmte en noemen we het potentiële elastische energie. In
het voorbeeld van de PV-lus is de externe arbeid de oppervlakte van de PV-lus, de potentiële
elastische energie is de oppervlakte tussen de systolische druk/volume lijn en de rechte lijn van de
isolvolumetrische contractie. Deze twee bij elkaar opgeteld is de totale verbruikte energie. Het
verschil tussen de potentieel elastische energie en arbeid is de warmte die vrijkomt. Een verhoging
van de drukarbeid is kostbaarder in zuurstof dan een volumearbeid. Dit is te zien door de toename
van de oppervlakte van de driehoek.
Tijdens pressure overload wordt het hart blootgesteld aan een verhoogde afterload/ arteriële
bloeddruk. Of bijv. tijdens een aortastenose als uitstroomweerstand verhoogd is. Volume overload is
gerelateerd aan een toename van de preload en een toename van het slagvolume.
Een volumebelasting leidt tot een excentrische hypertrofie van de hartspier, een drukbelasting juist
tot een concentrische hypertrofie. Omdat myocardcellen slecht delen een hypertrofie (grotere
cellen) en geen hyperplasie (meer cellen).
Hypertrofie van het hart is een complex proces dat wordt aangestuurd door veel factorenzoals
groeifactoren, catecholamines, angiotensine II, endotheline-1, etc. Al deze factoren zorgen via
specifieke second messenger systemem voor het aan of uitzetten van transcriptiegactoren.
Daarnaast zijn er bijzondere sensoren die de mechansiche stress van volume en pressure overload
meten en dit doorgeven aan de celkern. Bij dit speelt calcium een belganrijke rol, de calium
concentratie is verhoogd tijdens de eerste van volume en pressure overload, zoals ook het geval zou
zijn in een normaal hart dat extra arbeid verricht. Dit extra clacium bindt aan de welbekende
Calmoduline. Het CaCalmoduline complex bindt aan calcineurie, een CaCalmoduline afhanklijke
phosphatase. Het geactiveerde calcineurine defosforileert de transcriptiefactor NFAT, waarna dit
celkern in kan en zorgt voor de expressie van genen die betrokken zijn bij hypertrofie van het hart.
Een excentrsiche hypertrofie wordt ook wel eens dilatatie genoemd, maar dit is niet juist, omdat
dilatatie passief is en hypertrofie actief. Een dilatatie kan wel op een hypertrofie volgen, waarbij de
pompfunctie van het hart instort.
Bij een drukoverload worden de sarcomeren parallel ingebouwd, een dikkere wand en meer
contractiekracht. Bij een volumeoverload worden de sarcomeren serieel ingebouwd, waardoor de
wand groter wordt.
Concentrische hypertrofie: een aantal pathologsiche situaties die gepaard gaan met een
drukbelasting van het linkerventrikel zijn: arteriële hypertensie (hyperaldosteronisme,
hyperthyreoïdie) en aorta stenose zorgen voor toename eindsystolisch volume en afname
slagvolume.Het effect op de PV-lus is bij gelijkblijvende contractie en preload is dat deze hoger zal
komen door toegenomen druk in het ventrikel en smaller door afgenomen slagvolume wegens
afterload. Catecholamines verhogen de contractiliteit en het slagvolume, dus de PV-lus wordt weer
breder.
De hypertrofie die optreedt kan eerst compensatoir zijn, maar daarna ook decompensatoir worden
wanneer het niet meer gecompenseerd kan worden. Bij een decompensatoire situatie zien we
klinische veranderingen, bij een compensatie nog niet. Een mogelijke oorzaak voor decompensatie is
dat de hypertrofie zorgt voor een grotere afstand tussen de T-tubuli en het sarcoplasmatisch
reticulum. Hierdoor raakt het proces van calcium-geïnduceerde calcium afgifte verstoord. Een ander
probleem kan zijn dat de angiogenese geen tred meer houdt met de hypertrofie. Hierdoor
verminderd de coronairvat-perfusie. Pressure overload kost veel energie en dus ook zuurstof. Het
hart kan veel substraten verbranden, maar altijd aeroob. Onvoldoende aanvoer van O2 gaat ten
koste van het vermogen van het hart om arbeid te leveren. De C.O. is onvoldoende. Tot slot kan er
nog een probleem ontstaan met de toegenomen wanddikte op mechanisch gebied. De compliantie
van de hartwand neemt af waardoor de einddiastolische duk/volume lijn steiler wordt. Bij
gelijkblijvende preload neemt het EDV af. De C.O. daalt en de veneuze druk stijgt. De stijging van de
veneuze druk zorgt nauwelijks voor herstel, maar kan wel bijdragen aan oedeemvorming in borst of
buikholte (backward failure).
Excentrische hypertrofie: kan komen door PDA of VSD. Hierbij is er een links-rechtsshunt van het
bloed, en zorgt via de rechter geleidingsbuis en longen voor een volumebelasting van het linker
ventrikel. Een volume overload, veroorzaakt door een toename in preload kan ook komen door een
mitralis of aortaklepafwijking (als gevolg van een endocarditis). Bij een mitralisklep hoor je dan een
souffle of de systole, bij een aortaklep juist tijdens de diastole.
De volumebelasting van het linkerventrikel gaat gepaard met een stijging van de vullingsdruk. Het
mechanisme van Starling kan in de beginfase bijdragen aan herstel van het effectieve slagvolume en
de C.O. Door de langdurige verhoging van de slagarbeid ontstaat excentrische hypertrofie. Dit kan
lange tijd goed gaan, maar kan ook omslaan in hartfalen, zoals hier het geval is. Het lichaam probeert
o.a. door het vasthouden van extra vocht de preload te verhogen, maar de preload reserve was al
verbruikt. Echter, wanneer de preload te veel stijgt kan dit leiden tot een verhoogde hydrostatische
druk in de longen en oedeemvorming hoesten en zwaar en moeilijk ademhalen.
De afname van het effectieve slagvolume zorgt voor daling van de C.O., vandaar de lusteloosheid en
de inspanningsintolerantie. Het hart reageert tijdens inspanning niet meer op prikkels die het
slagvolume zouden laten toenemen.
De snelle daling van de diastolische arteriële druk zorgt voor een toename van de polsdruk (=Ps-Pd).
De arteriële druk daalt snel tijdens de diastole omdat het bloed zowel naar het lichaam als het
ventrikel kan stromen.
Wanneer er nog sprake is van een compensatie zal het slagvolume toenemen om voor de lekkage te
compenseren. Het effectieve slagvolume naar buiten blijft daarmee dus wel gelijk.
Thrombi kunnen een gevaar voor het hartopleveren wanneer ze losraken: Door het losraken van
thrombi kunnen coronair vaten worden afgesloten (hartinfarct) waardoor necrose kan optreden. De
contractiliteit van het hart daalt en dus het slagvolume.
Een andere oorzaak voor het ontstaan van decompensatie ligt in de excentrische hypertrofie zelf en
is beschreven door de wet van la Place. Deze wet zegt dat de druk in het ventrikel direct een gevolg
is van de spanning in de wand. Deze wandspanning wordt opgewekt door de contractiekracht van
alle myocardcellen samen. Wanneer de straal toeneemt (ventrikel) wordt de overdracht van de
krachten in de wand op het bloed in het lumen minder effciënt. De wet van la Place is dus ook: P = T
/ 2r, waarbij T staat voor de wandspanning.
Aan de hand van dit gegeven kun je dus zeggen dat excentrische hypertrofie leidt tot een afname van
het slagvolume en dus decompensatie. Immers, de contractie van de cardiomyocyten wordt minder
efficiënt omgezet in druk in het ventrikel. Dit kan ervoor zorgen dat het ventrikel de druk tijdens
systole minder lang kan volhouden afname SV.
De systolische druk in linkerventrikel en aorta zijn gelijk dus die kan perifeer worden gemeten met
een manchet rond de bovenarm. Deze methode geeft een boven- en een onderdruk (Ps en Pd). De
diastolische druk in de aorta (Pd) en die in het ventrikel hebben niets met elkaar te maken. Om de
diastolische druk in het linkerventrikel te meten zal een drukgevoelige katheter in de kamer moeten
worden geschoven.
De aortadruk en diameter lopen vrijwel synchroon. Dit is een eigenschap van een elastische
structuur. Tijdens de ejectiefase wordt de aortawand uitgerekt (y) door een instroom van bloed en
een toename van de druk (x); compliantie is een maat voor het gemak waarmee dit gebeurt (delta V
/ delta P). De aortawand beschikt dan over potentiële elastische energie. Een gedeelte van die
energie komt weer vrij na de snelle ejectiefase als de elastische potentiële energie in de aortawand
wordt omgezet in kinetische energie van het stromende bloed. In dit geval is de druk de
onafhankelijke parameter. Een elastische buis kan nooit zelf zijn diameter veranderen en daarmee de
druk in de buis.
HC3
Lokale regulatie van de vaatweerstand leidt in één orgaan tot metabole hyperemie = interne
regulatie vaatweerstand. Wanneer alle organen dit tegelijk zouden doen, zou het systeem instorten
met een veel te lage bloeddruk, vandaar dat er een overkoepelend controle mechanisme is voor de
totale bloeddruk = externe regulatie vaatweerstand.
Er zijn geen fluctuaties in druk en flow in de periferie meer, maar wel natuurlijk dicht bij het hart. Dit
heeft alles te maken met de elastische eigenschappen van de aorta wand = windketeleffect. De aorta
kan bij een grote bloedstroom en druk ‘opslaan’ in het elastische reservoir, en haalt dit tijdens een
druk/volume verlaging weer op. Niet alles komt gelijktijdig dus in de weerstandsvaten. Dit is ook de
reden dat de volume en druk niet gigantisch valt tijdens de diastole als de aortakleppen dicht gaan,
hierdoor is tijdens de diastole ook bloedstroom richting de organen. Bij aderverkalking nemen de
elastische eigenschappen van de aorta wel af.
Cardiac output = hartfrequentie x slagvolume. Wanneer deze bijvoorbeeld 5 liter/min is, is dit per
minuut door alle organen samen ook 5 liter, door de longen 5 liter. Dus door elk deel van het vaatbed
is dat 5 liter.
In bovenstaand plaatje kun je de drukvariaties zien in de verschillende onderdelen van het vaatbed.
Je ziet dus ook dat de fluctuaties tussen hart en aorta al gigantisch af zijn genomen, dat wegens de
elasticiteit dus.
In de grote venen ontstaan er echter opnieuw fluctuaties, dit komt doordat het rechter atrium
contraheert en er tussen het atrium en vene cava geen kleppen zitten. Tijdens een contractie krijg je
een terugstroom in de vene cava = veneuze pols.
Gemiddelde druk kan berekend worden:
• Pg = 2/3 Pd + 1/3 Ps
Een andere manier om de bloeddruk uit te rekenen is: Pg = C.O. × Rtot. De gemiddelde bloeddruk
heb je dus nodig om iedere minuut een bepaald volume door een bepaalde weerstand heen te
duwen.
De vaattonen zijn heel iets anders dan de harttonen. Met een manchet en fonendoscoop kun je deze
beluisteren. De bloeddruk is nagenoeg diersoort onafhankelijk (warmbloedig), giraffe is natuurlijk
een uitzondering evenals vogels, maar voor andere dieren meestal 80/120.
Bloed raak je niet onderweg kwijt (flow, cardiac out put) maar druk raak je wel kwijt afhankelijk van
de weerstand die je tegen komt. Wanneer deze erg groot wordt neemt de bloeddruk af. Dit gebeurt
met name in de weerstandsvaten wat de arteriolen zijn, hier raak je dus een groot deel van je
bloeddruk kwijt. Ook in de capillairen is een aanzienlijke weerstand, maar hier zijn er veel meer van
dus de invloed van weerstand is lager. Hoe meer weerstanden parallel zijn geschakeld des te lager is
de vervangingsweerstand (1/Rv = 1/R1 + 1/R2 + 1/R3 etc).In de vene cava heb je slechts nog een
bloeddruk van iets boven 0.
De capillair heeft de dunste wand die je in het vaatbed kunt vinden: endotheellaag +
basaalmembraan. Bovendien zitten er in capillairen venstertjes (gefenestreerd). Daarom in de
capillairen veel uitwisseling van vocht, stroming, convectie (Jv), heen en terug. Deze hangt af van een
aantal zaken:
1. Lp = permeabiliteit aquaporines (transcellulair) en fenestra en interendotheliale ruimtes
(paracellulair)
2. Pc = druk in het capillair (30 mmHg)
3. Pi = druk in het interstitium, zeer klein, (-2 mmHg)
4. πp: oncotische (eiwitten) druk plasma (25mmHg)
5. πi: oncotische druk in het interstitium. (15mmHg)
6. σ: reflectiecoëfficiënt, 1 is ideaal.
(S= oppervlak).
Aan het begin van de capillair is de bloeddruk (Pc) hoger dan de oncotische druk vocht naar
interstitium = filtratie.
Zo vanaf halverwege is juist de oncotische druk hoger (weerstand in capillair laat de bloeddruk dalen)
vocht vanuit interstitium = resorptie. Over het algemeen wordt er iets meer gefiltreerd dan
geresorbeerd, maar deze balans wordt hersteld door de lymfestroom en terug gevoerd naar het
rechter atrium.
Er zijn meerdere redenen waardoor dit fout kan gaan: lymfangitis dus geen lymfestroom dus er
hoopt vocht op in het interstitium oedeem. Andere redenen voor oedeem vorming is wanneer de
bloeddruk aan veneuze zijde omhoog gaat, door congestief hartfalen, veneuze trombus, lever
cirrhosis. Consequentie is dus méér filtratie en minder resorptie.
Andere oorzaak is minder eiwitten in het bloed door lever cirrhosis, nierfalen (eiwitten uitplassen) en
aandoeningen van het darmstelsel. De oncotische druk daalt oedeemvorming.
Laatste reden voor oedeemvorming is ontsteking. Door activatie ontstekingsfactoren en cytokines,
deze binding aan de endotheelcellen. Deze binden aan de actine en myosine filamenten van de
endotheelcellen, de endotheelcel contraheert en er komen grotere venstertjes in het capillair.
Hierdoor gaan in de formule Lp en sigma omhoog, meer filtratie, minder resorptie en dus oedeem
vorming. Ook eiwit gaat door de capillairen naar het interstitium, dus ook de oncotische druk neemt
af.
De uitwisseling van gassen, metabolieten en nutriënten gaan via diffusie en niet via bovenstaande
mechanisme, dit staat er dus los van.
Metabole hyperemie ontstaat wanneer een orgaan zijn vaatweerstand aanpast. Het drukverval blijft
over alle organen hetzelfde. Het orgaan verlaagd zijn weerstand door vasodilatatie. Wanneer de
diameter 2x zo groot wordt, dan neemt de weerstand met een factor 16 af = wet van Poiseuille.
Omdat dit het effectiefst is in de weerstandsvaten is het belangrijk juist daar vasodilatatie te laten
plaatsvinden. Vasodilatatie kun je bereiken door K+ kanalen in de gladde spiercellen open te laten
gaan hyperpolarisatie. Dit gebeurt doordat er allerlei stoffen uit actief spierweefsel vrijkomen.
Spanningsgevoelige Ca+ kanalen gaan sluiten, minder calcium in de cel vasodilatatie.
Actief weefsel, zoals bijv. een actieve skeletspier, hartspier of zenuwweefsel, geeft metabole
producten af zoals H+, K+, lactaat, ADP etc. Deze stoffen zorgen voor het opengaan van K+ kanalen in
de membraan van de gladde spiercellen in de wand van de arteriolen. Hierdoor krijg je
hyperpolarisatie (blok 5) en dus sluiten de spanningsgevoelige Ca-kanalen. Minder calcium in de
gladde spiercel zorgt voor vasodilatatie en dus meer bloedvoorziening, mits de bloeddruk constant is.
Dit mechanisme is sterk ontwikkeld in hart, longen en hersenen.
Kijk straks na verhaal over sympathicus en parasympathicus nog even terug naar dit plaatje.
Om te zorgen dat de totale bloeddruk constant blijft en andere organen niet in de problemen komen
hebben we de baroreceptorreflex. Deze reflex beïnvloed de cardiac output en de weerstand. De
cardiac output omhoog door hartfrequentie (sinusknoop), slagvolume (contraciliteit) en preload
verhogen (hoge veneuze druk, wet van starling).
De baroreceptorreflex meet de bloeddruk in de vaten, bijvoorbeeld in de A. Carotis.
Meten lage bloeddruk in de Carotis signaal naar hersenstam N. Vagus (parasympathicus,
acethylcholine) minder en Symphaticus meer (noradrenaline) hartslagfrequentie omhoog. Hier
stopt de invloed van de parasympathicus (deze heeft dus alleen invloed op de hartslagfrequentie),
maar de sympathicus heeft ook effect op de bloedvaten noradrenaline vasoconstrictie weerstand omhoog en voorkomen van de daling van de gemiddelde bloeddruk.
•
Bloedvaten bevatten meerdere adrenerge receptoren, alpha 1 of beta 2, of allebei.
Aanwezige mix van adrenerge receptoren: α1, β2:
- activatie α1 geeft vasoconstrictie
- activatie β2 geeft vasodilatatie
•
De relatieve concentraties van noradrenaline en adrenaline
- noradrenaline (sympatische vezels) heeft voorkeur voor α1
- adrenaline (uit bijniermerg bij flinke inspanning) heeft voorkeur voor β2
•
Post-ganglionaire sympatische neuronen geven (continu) noradrenaline af.
- Via α1 receptor gladde spiercel vasoconstrictie arteriolen huid (heeft alleen α1), nier,
ingewanden, niet-actieve skeletspieren
- geen, of zeer beperkte invloed in hersenen, coronair vaten en placenta (schaarse
sympathische innervatie)
•
Bij zeer zware inspanning geeft de bijniermerg adrenaline af:
- Via β2 receptor gladde spiercel vasodilatatie arteriolen lever, coronair vaten (β2 > α1) en
actieve skeletspieren
- vasoconstrictie in nieren en ingewanden via α1 (deze organen hebben ook alleen maar
α1.
Sympathische zenuwvezel zorgen voor de activatie van alpha-1 receptoren in huid en darmen en
daarmee voor vasoconstrictie; activatie alpha-1 receptoren zorgt voor het openen van de Calciumkanalen en daarmee voor vasoconstrictie van de arteriolen. Omdat de bloedvaten in de huid en de
darmen vol zitten met alpha-1 receptoren en
metabole hyperaemie slecht ontwikkeld is zullen deze organen in tijden van “schaarste” altijd de
pineut zijn. Organen zoals het hart en de hersenen hebben juist een zeer sterke metabole
hyperaemie, en bovendien bevatten de coronairvaten veel beta-2 receptoren voor circulerend
adrenaline, zodat zij altijd voldoende bloed krijgen. De bloedvaten in de skeletspieren hebben alpha1 en beta-2 receptoren en metabole hyperaemie is goed
ontwikkeld in skeletspier: in actieve spieren winnen metabole hyperaemie en beta-2 activatie het
van alpha-1 activatie, maar in inactieve skeletspieren is het omgekeerd.
WC5
Chonotroop effect: hartslagfrequentie
Inotroop effect: slagvolume, contractiliteit.
Dromotroop effect: voortgeleidings
De totale vaatweerstand is veel lager dan de afzonderlijke weerstanden van ieder orgaan. Dit is altijd
zo bij parallelle weerstanden omdat het bloed meerdere kanten (organen) op kan stromen.
In tegenstelling tot andere organen zijn hersenen obligaat aeroob en een bloed/zuurstoftekort leidt
dus direct tot problemen. Vandaar ook dat het heel belangrijk is dat deze organen voldoende bloed
krijgen.
Nog een keer de baroreceptorreflex: een daling van Pg wordt door Baroreceptoren in de aortaboog
en sinus caroticus waargenomen en doorgegeven aan de hersenstam. Vanuit de hersenstam worden
de nervus vagus (oranje = parasympathisch) en de sympathische vezels (rood-blauw) aangestuurd.
Minder Ach zorgt ervoor dat de vuurfrequentie van de sinusknoop stijgt (muscarine receptoren in
sinusknoop minder geactiveerd). Meer noradrenaline (beta-1 receptoren in sinusknoop geactiveerd)
zorgt ook voor een stijging van de hartfrequentie. Noradrenaline bereikt ook de gewone
hartspiercellen en versterkt daar het proces van calcium-induced calcium release _ toename
contractiliteit/inotropie en dus toename slagvolume. Dit alles gebeurt binnen 1 seconde en zorgt
voor een toename van de C.O., en daarmee voorkomt deze reflex een daling van de bloeddruk als
een orgaan door metabole hyperaemie de vaatweerstand beïnvloedt.
Met name tijdens de diastole stroomt er bloed door de coronairvaten!
Hyperthyroïdie is een aandoening die met name bij de kat voorkomt. Overmatige productie van het
schilklierhormoon zorgt voor een toename van celmetabolisme , maar heeft tegelijkertijd een groot
effect op hart en bloedvaten wat o.a. leidt tot hypertensie. Dit gebeurt doordat het schildklier
hormoon de sympatico-adrenerge effecten op het vaatbed versterkt, zoals vasoconstrictie in de
periferie. Om dit te behandelen zijn er een aantal opties. Allereerst is het gebruik van een alpha-1
blokker aan te raden, omdat het resulteert in vasodilatatie. In de praktijk kan hiervoor gebruik
gemaakt worden van specifieke (bèta 1) en niet-specifieke (bèta 1 en 2) blokkers. Specifieke Beta-1
blokkers verlagen zowel de chronotropie (remming sinusknoop HFomlaag) en de inotropie (SV
omlaag) van het hart, dus de C.O.
Om de bloeddruk te normaliseren kan ook gebruik gemaakt worden van Ca-kanaal blokkers. Een
voorbeeld hiervan is amlodipine. In dit geval worden de effecten van alpha-blokkers en bètablokkers gecombineerd. De calcium kanalen in de gladde spiercellen van de vaatwand en de calcium
kanalen in de membraan van de hartspiercellen zijn immers van het zelfde type. Een specifieke Cakanaal blokker kan dus zorgen voor vasodilatatie en een afname van het slagvolume.
De pols is te palperen en het gevolg van een drukgolf die zich na elke hartslag verspreidt. De
compliantie is een maat voor de elasticiteit van de vaatwand en dus ook de demping in die drukgolf.
De formule voor compliantie is dan ook: C = toename in volume / toename in druk. Dit kan ook
herschreven worden tot polsdruk (= Ps-Pd) = slagvolume gedeeld door compliantie. Polsdruk is dus
het verschil tussen systolische en diastolische druk.
Een aantal veranderingen kunnen aan de hand van deze formule beredeneerd worden.
SV omhoog; cardiac output omhoog dus Pg omhoog (Pg=C.O. X R), mits R constant is. Een
groter SV leidt tot een hogere piekdruk (Ps) omdat tijdens de (kortere) ejectiefase een
groter volume door de aorta geduwd moet worden. Na het sluiten van de aortaklep
neemt de druk in de aorta langzaam af totdat de volgende ejectiefase begint. De laagste
waarde die bereikt wordt in de aorta (Pd) zal waarschijnlijk iets boven het oude niveau
-
-
-
liggen, maar waar precies is moeilijk aan te geven, zolang de polsdruk (Ps-Pd) maar groter
is dan voorheen.
Compliantie omlaag; demping omlaag dus hogere piekdruk en lagere onderdruk. Het
windketeleffect is weg; Tijdens de ejectiefase zal de aortawand minder meegeven en kan
dus niet als reservoir dienen. Het hele slagvolume moet er dus ineens doorheen.
Hiervoor is een hogere piekdruk nodig. Omdat een niet-elastische aortawand geen
energie heeft kunnen opslaan tijdens de ejectiefase, kan de wand ook geen energie
teruggeven aan het bloed na het sluiten van de aortaklep. De aortawand is niet in staat
om de druk op de ketel te houden (windketeleffect). En dus zal de druk in de aorta na het
sluiten van de aortaklep snel omlaag gaan en PD dalen. Pg kan dus gelijk blijven als Ps
stijgt en Pd daalt.
Totale perifere vaatweerstand omhoog; zoals bij humane primaire hypertensie
(veterinair minder relevant). De toename van de vaatweerstand zorgt voor toename van
Pg (Pg=C.O. X R). Omdat het arteriële bloed minder makkelijk kan doorstromen vindt er
een ophoping van bloed in de grote arteriën plaats. Hierdoor worden die arteriën iets
uitgerekt waardoor ze tegen hun elastische limiet aanlopen; afname compliantie. Dit
zorgt voor een toename van de polsdruk. Oudere mensen met hoge bloeddruk hebben
vaak een zeer hoge polsdruk door afname compliantie (arteriosclerose) en primaire
hypertensie.
PDA; Het hart moet zeer grote slagvolumes slaan om de effectieve cardiac output op pijl
te houden Ps stijgt. Omdat het bloed tijdens diastole een extra uitstroommogelijkheid
heeft daalt de bloeddruk snel en ligt Pd lager dan normaal. Zolang de C.O. op peil kan
worden gehouden zal de Pg gelijk blijven.
Naast een arteriële pols kennen we ook een vene pols. De veneuze pols kun je bijv. zien/voelen in de
jugulair groeve van het paard. De drukgolf is o.a. te danken aan de systole van het atrium en het
opbouwen van de druk in het atrium. Vanwege de afwezigheid van kleppen tussen atrium en vena
cava zal de drukgolf zich voortplanten in het veneuze vaatstelsel.
Wanneer er sprake is van hartfalen kan het eind-diastolisch volume en druk fors toenemen in het
ventrikel. De stuwing (congestie) die hierdoor aan veneuze zijde plaatsvindt zorgt voor het uitrekken
van de grote venen waardoor de wand tegen de elastische limiet gaat aanlopen, de compliantie
neemt af. Compliantie is verantwoordelijk voor het dempen van de fluctuaties in druk en flow (zie
windketeleffect in arteriën). Wanneer die demping verminderd is zullen de drukpulsen vanuit het
hart minder worden gedempt en zal de venepols zich verder langs de vena jugularis manifesteren.
Een hypertensie in de veneuze zijde leidt makkelijk tot oedeem vorming terwijl dit aan de arteriële
zijde niet het geval is. De verklaring hiervoor is dat de hoge weerstand van de arteriolen de
capillairen afschermt van een hoge arteriële
bloeddruk. Aan de kant van de venen zit geen beschermende arteriole en dus geen bescherming.
High altitude disease is een aandoening dat bij een significant deel van de slachtkuikens voorkomt.
Het kan leiden tot rechter hartfalen en ascites. Het is een welvaartsziekte en kwam oorspronkelijk
alleen voor bij hoenders die op grote hoogte werden gefokt, hence the name. De verdere gegevens
over deze aandoening staan op p. 31 van de syllabus. De laatste vraag: viagra heeft naast een
erectiebevorderende ook een andere werking, het zorgt er namelijk voor dat de bloeddruk in de
longcirculatie omlaag gaat. Nu zelf nog een redenatie maken of dit dan bij kippen wel of niet zou
werken.
HC4
De meeste congenitale hartafwijkingen kun je indelen in:
1. Stenose: vernauwing (leidt tot drukbelasting van het ventrikel voor de stenose)
2. Shunt: abnormale verbinding tussen compartimenten (volumebelasting van het ventrikel na
de shunt)
3. Klepinsufficiëntie: lekkage van kleppen (volumebelasting van het ventrikel na de lekkende
klep)
Stenose:
Een pulmonalis stenose is een vernauwing van de longslagader op het niveau van de kleppen. Dit
ontstaat wanneer de kleppen tijdens de embryonale ontwikkelingen niet goed los gekomen zijn. De
beste manier om te bekijken met een echo (zwart = bloed, grijs = weefsel). Normaal is de druk in het
rechterventrikel en a.Pulmonalis gelijk tijdens de systole want het is één gezamenlijke ruimte. Bij een
stenose neemt de druk echter enorm toe in het rechter ventrikel. Door de vergrote druk en de
stroming door de nauwere opening ontstaat turbulentie en dus een souffle op de pulmonalis klep
tijdens de systole.
Deze drukgradiënt tussen de ventrikel en de pulmonalis zou je kunnen meten met een katheter,
maar dit is erg invasief. Een andere methode is aan de hand van de Bernoulli formule: delta P = 4v2.
De V in deze formule is de snelheid van stroom door de opening, welke aan de hand van een Doppler
echo te meten is. De uitkomst, delta P, is het drukgradiënt tussen RV en AP. De drukgradiënt geeft
een interpretatie over de ernst van de stenose, hoe groter de gradiënt hoe ernstiger de stenose. (40
mm Hg is gering; 80 mm Hg is ernstig)
Door de drukbelasting in het rechter ventrikel ontstaat in een concentrische hypertrofie (= wet van la
Place). Lumen wordt kleiner en wand dikker. Door deze hypertrofie kan, wanneer deze heel erg
wordt, zelfs het linker ventrikel iets verdrukt raken.
Door de verminderde stroom uit de rechter ventrikel raakt ook de linker ventrikel minder gevuld.
Hierdoor komt er minder zuurstof in de circulatie, waaronder in de hersenen. Dit kan leiden tot
bijvoorbeeld flauwte. Tegen de verwachting in is een verminderde longcirculatie NOOIT het
probleem van zuurstof tekort, dus puur en alleen het gebrek aan goede linker ventrikel vulling.
De diagnose wordt gesteld met een hartauscultatie of een spectrum doppler echocardiogram
(overlaten aan specialist).
Therapie bestaat uit het openen/oprekken van de kleppen met behulp van een luchtballonnetje.
Wanneer hierdoor de kleppen misschien iets gaan ‘lekken’ is dat niet erg, minder erg dan stenose in
ieder geval.
Aortastenose
Lijkt een beetje op een pulmonalisstenose, maar de oorzaak is door een subvalvulaire fibreuze ring.
Net onder de kleppen zit een ringvorminge vernauwing. Je ziet deze aandoening vrij vaak. Met
behulp van auscultatie hoor je een systolische souffle op de aortaklep. En dus ook de intensiteit van
de souffle als maat voor ernst van de stenose. Ook dit leidt tot een te grote druk in het linker
ventrikel en leidt dus ook tot concentrische hypertrofie. Doordat de coronairvaten onvoldoende
capaciteit hebben voor myocardperfusie door de hypertrofie ontstaan mogelijk witte necrose
plekken met bindweefselvorming op het hart (fibrose). De drukgradiënt is wederom met behulp van
een Dopplerecho te berekenen aan de hand van de Bernoulli formule.
De verschijnselen hangen heel erg af van de ernst van de stenose, sommige honden zullen een
normaal leven leiden, sommige honden gaan dood (mediane overlevingstijd: 3 jaar). De definitieve
diagnose is met een Doppler echocardiogram.
De therapie is niet met een ballon dilatatie omdat de klep niet het probleem is, maar de fibreuze ring
welke na oprekking gewoon weer terug groeit. Helaas dus geen effectieve behandeling bekend.
Shunt/ PDA
Eén van de meest voorkomende congenitale hartafwijkingen bij de hond is de persisterende ductus
arteriosis, bij tijdig ingrijpen goed te behandelen (met bijvoorbeeld een coil-embolisatie) (als één van
de weinige hartaandoeningen). Leidt tot een volumebelasting van het LA en LV door het
terugstromen naar de a. Pulmonalis van de Aorta. Dit komt uiteindelijk in de linkerharthelft als
volumebelasting en leidt daar tot een excentrische hypertrofie. De wand blijft hierbij relatief even
dik. Rechter hartdeel heeft hier helemaal niets mee te maken en daar zien we (in eerste instantie)
dus ook geen veranderingen.
De souffle is continue machinekamer geruis tijdens zowel de diastole als de systole met het punctum
maximum op de pulmonalisklep. De ‘jet’ stroomt precies op de pulmonalisklep en vandaar het
bijgeruis daar.
Omdat de shunt pas in de aorta descendens plaats vindt krijgt de abdominale aorta te weinig bloed,
maar de thoracale aorta niet.
Insufficienties: (kleplekkage)
Door een insufficientie van de tricuspidalis klep, stromt er bloed terug van de RV naar de RA
waardoor er filevorming plaatst vindt in de vena caudalis, dat leidt tot vocht ophoping in de buik
(ascites). Ook krijgt de RA excentrische hypertrofie door de volumebelasting.
Prioriteiten van het circulatiestelsel in de juiste volgorde:
1. Handhaving normale arteriële bloeddruk, met behulp van baroreceptoren in de Carotis en
Aortaboog.
2. Behouden van normale bloedstroom naar de periferie
3. Behouden normale veneuze en capillaire bloeddruk.
De bovenstaande prioriteiten kunnen ook tot problemen leiden bij bijvoorbeeld een PDA, door
decompensatie van het lichaam. De hond gaat namelijk dood door verstikking door longoedeem (bij
elke aandoening van linkerhart). Aan de hand van de prioriteitenlijst kun je deze decompensatie
verklaren.
Prioriteit nummer 1: baroreceptoren detecteren een normale bloeddruk, dus doen niks. De shunt zit
namelijk voorbij de baroreceptoren en wordt dus niet geregistreerd.
Prioriteit 2: de weefselperfusie worden in de nieren door macula densa receptoren gedetecteerd. Dit
valt wel op, de nieren krijgen immers minder bloed door verminderde nierperfusie. Deze gaan het
Renine-Angiotensine-Aldosteron-Systeem activeren. Hierdoor wordt meer volume vastgehouden in
het lichaam, en een groter circulerend volume. Gunstig voor het hart omdat door de preload
verhoging ook het SV en cardiac output omhoog gaat.
RAAS: gebeurt door nieren die een verminderde weefselperfusie meten, gaat renine produceren renine zet angiotensinogeen naar angiotesine I om en dan indirect in angiotensine II deze
stimuleert de ADH (argininevasopressine) wat water vasthoud.
Angiotensine II zorgt ook voor de afgifte van aldosteron. Door het vasthouden van natrium stijgt ook
hiermee het plasma volume omdat er vocht vastgehouden wordt preload en slagvolume (volgens
Frank Starling) gaan omhoog, dit hormonale systeem is een lange termijn aanpassing.
Prioriteit 3: door het verhoogde circulerende volume gaat het Eind diastolisch volume van ventrikel
en daarmee atrium omhoog, hiermee gaan ook de veneuze druk en capillairen druk omhoog. Door
de compensatie bij prioriteit 2 kan prioriteit 3 dus niet gehandhaafd worden. Deze verhoogde druk
leidt tot oedeem en dus de hond stikt. De druk in het linkeratrium gaat omhoog, maar anders dan de
ventrikel kan het atrium zich niet goed aanpassen. Deze zal dus alleen gaan vergroten maar dat
houdt een keer op. Hierdoor stroomt het bloed niet goed in het atrium, verhoogde druk in longen longoedeem en hond stikt. Bij cardiaal longoedeem is altijd een verhoogde druk in het linker atrium
als gevolg van congestief linker hartfalen. Microscopisch zie je vocht in de alveoli in plaats van lucht.
En klinisch zie je dit door het uittreden van vocht tijdens de ademhaling, er komt dus schuim uit de
bek. Belangrijk is een bijgeruis op tijd te diagnosticeren.
Een PDA kun je behandelen door het plaatsen van een spiraaltje in de ductus arteriosus, en een
ouderwetse manier door een open hart operatie en het bloedvat afbinden. De prognose is dan goed.
De laatste paar aandoeningen zijn niet behandeld maar moeten uiteraard wel nog bekeken.
WC6
Van de congenitale afwijkingen kennen we dus shunts, insuffuciënties en stenoses. Als gevolg van
lekkages of andere routes onstaan bij shunts en insufficiëntie een volumebelasting. Bij een stenose
hebben we juist te maken met een drukbelasting. Wat betreft de verkregen afwijkingen maken we
onderscheid tussen afwijkingen aan het pericard, myocard of de kleppen.
2
3
Uitleg
Belasting
Lichamelijk Onderzoek
Bij een PDA is er een
verbinding tussen de aorta en
de a. pulmonalis. Hierdoor
loopt er tijdens de systole en
dyastole bloed naar de a.
pulmonalis waar het bloed
tegen de pulmonalisklep
oploopt. Bloed komt
uiteindelijk uit in de RV, waar
het gepompt wordt naar het
LA en daarna doorstroomt in
de diastole naar het LV.
Bloed stroomt van LV naar RV
door een opening in het
septum. Hier loopt het tegen
de Tricospidalisklep aan.
Extra bloed komt in LA en
stroomt tijdens de dyastole
naar het LV.
Bloed stroomt van LA naar RA
door een opening in het
septum. Het extra bloed
stroomt gelijk tijdens de
dyastole door naar het RV.
Volumebelasting LV.
- Continue souffle te
horen (machinekamer).
de
- PM: 3 IC L ter hoogte
van de pulmonalisklep
4
- Steile pols doordat het
volume afneemt door de
shunt.
longoedeem hoesten
Volumebelasting LV.
- Souffle op de systole
de
- PM: 4 IC R ter hoogte
van tricospidalisklep
- normale pols
longoedeem hoesten
Volumebelasting RV.
- Souffle op de systole
de
- PM: 3 IC L
- pols normaal door
1
relatieve stenose
Stenose
- Aortastenose
Vernauwing van de Aorta
Drukbelasting LV
- Systolische souffle
de
- PM: 4 IC L
4
- zwak en breede plols
Pulmonalisstenose
Vernauwing van de a.
Pulmonalis
Drukbelastig RV
Insuffiecientie
Mitralisklepdisplasi
e
Uitleg
Verkeerde aanmaak van
Mitralisklep, waardoor deze
lekt. Bloed lekt via de klep
tijden een systole naar het
LA, waarna het de volgende
diastole terugkeert naar het
LV.
Doordat er telkens zo’n
uitwisseling is van
vloeistofwordt het RAAS
systeem geactiveerd om de
bloeddruk op peil te houden.
Verkeerde aanmaak van
Tricuspidalisklep, waardoor
deze lekt. Bloed lekt via de
klep tijden een systole naar
het RA, waarna het de
volgende diastole terugkeert
naar het RV.
Belasting
Volumebelasting LA +
LV
- Systolische souffle
de
- PM: 3 IC L
- normale pols
2
Lichamelijk Onderzoek
- Systolische souffle
de
- PM: 5 IC L
- normale pols door RAAS
Shunt
- Persisterende
Ductus Arterioses
Ventrikelseptumde
fect
Atriumseptumdefe
ct
Tricuspidalisdisplasi
e
Volumebelasting RA +
RV
- Systolische souffle
de
- PM: 4 IC R
- normale pols door RAAS
Symptomen
C.O. niet goed,
verminderd
uithoudingsvermogen
.
Uithoudingsvermoge
n minder
3
Symptomen
Long oedeem
3
Rechterhart-falen
Bij een ernstige tricuspidalisinsufficiëntie krijg je verschijnselen van rechterhartfalen. Dit komt omdat
het rechterhartdeel overbelast wordt. Dit is een volumebelasting, immers er lekt meer volume terug.
Ten gevolge van deze aandoening kun je een tricuspidalisdisplasie waar nemen.
Bij een linker AV-klep insufficiëntie zal de eigenaar andere dingen waarnemen, het dier heeft een
grotere buikomvang, weegt ook meer maar is wel vermagerd. Bij een klepinsufficiëntie is het RAAS
systeem geactiveerd door minder circulerend volume. Aan medicinale therapie zou je kunnen
denken aan:
- ACE remmers
- Diuretice: furozemine
- Pimobendan: inodilator is een positef ionotroopmiddel + vasodiladatie
Dysfunctie van verschillende orgaansystemen kan tot een verminderde inspanningstolerantie leiden.
Gevolgen van een niet meer goed functionerend circulatoir systeem zijn:
- Minder aanvoer van nutrienten en afvoer van afvalstoffen, door darmen, nieren, lever.
- Hartfunctie heeft meer energie nodig t.o.v. andere delen van het lichaam.
- Coronairvaten eisen ook steeds meer bloed. Deze vaten krijgen hun bloed tijdens de diastole
bij verhoogde hartfrequentie is er minder tijd in de diastole om coronairvaten te vullen
- redistributie tijdens inspanning naar lichaamsdelen wordt dan lastig
Dit uit zich in een verminderd uithoudingsvermogen. Een koe zal hierom ook een daling in de
melkgift krijgen.
Dan is in het werkcollege nog een voorbeeld van een verminderd inspanningsvermogen als gevolg
van een VSD bij een drachtige merrie. De vraag is dan of abortus aan te raden is. Het paard kan het
vrucht gewoon nog voldragen, mits deze geen inspanningen meer hoeft te leveren. Het dier is nu
nog in compensatie en is daarom nog te behandelen, omdat deze er voorheen er nog geen last van
had. De dracht maakt alleen dat de verschijnselen nu eerder tot uiting komen. Wel moet rekening
gehouden worden met de partus, want dit is ook weer een inspanning.
Bij Lichamelijk Onderzoek moet je je afvragen of de aandoening systolisch is of dyastolisch en waar
het Punctum Maximum zich bevindt:
- Systole: AV dicht A + P open: stenoses en AV-klep insufficiëntie te horen.
- Diastole AV open A + P dicht: aorta of pulmonalisklep insufficiëntie te horen.
Relatieve Stenose: is een stenose doordat er meer bloed doorheen moet wat dus minder goed past,
maar er niet per definitie sprake is van een vernauwing. Door de verhoogde stroom ontstaat echter
een soort van vernauwing en ook turbulentie.
Linkerhartfalen
Longoedeem hoesten
Rechterhartfalen
- v. porta stuwing: ascites
- v. jugularis stuwing: venepols
- ductus thoracicus stuwing: liquothorax
- perifeer oedeem alleen bij LBH en P
Beiden
Vermindering van het
uithoudingsvermogen
HC5
Pathologische veranderingen leiden tot decompensatio cordis, dat wil zeggen pathologische
veranderingen leiden tot een decompensatie in het hart hartfalen.
Met name belangrijk om McGavin bij de syllabus te gebruiken, zeker omdat het pathologie gedeelte
van het practicum ontbrak. Ook het hart heeft een beperkt reactiepatroon op prikkels, net als alle
eerder behandelde orgaansystemen. Dus verschillende aandoeningen kunnen tot eenzelfde
reactiepatroon leiden, en binnen één aandoening kunnen er ook wisselende reactiepatronen en
klinische manifestaties plaatsvinden.
Bij een congenitale afwijking kan er sprake zijn van teveel groei of regressie tijdens de embryonale
ontwikkeling of kort erna.
- Persisterende rechter aortaboog: normaal gesproken groeien de linker aortaboog en linker
arteria pulmonalis uit, welke dus aan dezelfde kant van de slokdarm liggen. Wanneer in
plaats van de linker de rechter aortaboog persisteert dan vormt deze samen met de a.
pulmonalis een ring om de slokdarm. Dit komt omdat deze twee verbonden zijn door de
ductus arteroisus. Het ligament wat hiervan overblijft na de geboorte vormt de ring en knijpt
de slokdarm af. Vaatstructuren zijn wel normaal functioneel.
Op het pericard kunnen we een niet-inflammatoire verandering of een pericarditis vinden.
1. Niet-inflammatoire: te veel vloeistof in hartezakje (hydropericard bij waterige vloeistof) door
problemen in het hart zelf en hierdoor stuwing en oedemen, eiwitverlies (hypoproteinemie =
nierproblemen, leverproblemen, maagdarmproblemen) leiden ook tot een hydropericard,
toxische stoffen kunnen de vaten lek maken (endotheel beschadiging) en ook een
hydropericard geven. Een hemopericard is een hartezakje gevuld met bloed. Een
hemopericard zien we bij honden nogal eens als gevolg van een hemangiosarcoom,
endotheel van bloedvaten (meestal in het rechterhartoor). De neoplasie kan makkelijk
scheuren wat leidt tot een hemopericard.
2. Pericarditis: bijna altijd door een infectieuze oorzaak, vrijwel altijd ook hematogeen
aangevoerd dus via het bloed. De ontsteking kan zich op verschillende manieren
manifesteren, aan de hand van exsudaat (sero-fibrineus, purulent, combinatie, chronisch met
bindweefsel). Bij jonge dieren zien we dit vaker als gevolg van een gegeneraliseerd probleem,
een polyserositis bijvoorbeeld, wat een ontsteking van de sereuze vliezen (hartezakje, pleura
van borst en buik, meningen en gewrichten horen hier ook een beetje bij).
Bij een fibrineuze pericarditis zien we een dof laagje op het hart, met licht elastische maar
wel scheurbare eigenschappen = fibrine! Bij een chronische pericarditis zien we uiteraard
bindweefsel. De fibrine is dan dus niet altijd meer goed zichtbaar. Bindweefsel kun je in t.t.
fibrine niet makkelijk losscheuren. Bij een koe zien we een chronische pericarditis nogal eens
als gevolg van een scherp-in. Dit kan zich uitbreiden tot een myocarditis of een thromboendocarditis (combinatie van pathologische afwijkingen).
Wanneer je achteraf aan euthanasie nog een sectie wilt verrichten moet je niet op de plek
euthaniseren waar je sectie op wilt verrichten. Het euthanasie middel slaat namelijk meer als
kristalletjes (korrelig beslag). Vertroebelen dus het sectiebeeld.
Er is een schijnbare discrepantie tussen wat je ziet en wat voor gevolgen het heeft. Maar de ernst van
klinische afwijkingen is niet lineair met de schijnbare ernst van pathologische afwijkingen. Deze
discrepantie kan echter ook komen door het acute of chronische verloop waardoor er geen/wel nog
aanpassingsmechanismen kunnen plaatsvinden, Als je dit bedenkt is de discrepantie (deels)
verklaarbaar.
Bij het myocard kijken we naar de vorm en het functioneren. Deze kan bij meer of heftigere
inspanningen fysiologisch hypertrofiëren, maar dit kan ook pathologisch zijn. Ook de functie kan
pathologisch of fysiologisch veranderen. In de ventrikelwand vinden we de meest opvallende
veranderingen.
- Moerbeihartziekte (microangiopathie) = er is iets mis met de kleine bloedvaatjes onder het
myocard. Hierdoor sterven een groot aantal celletjes af en kunnen we ook microscopisch
met een PTAH-kleuring de necrose zichtbaar maken (deze wordt dan roze ten opzichte van
het normale donkerpaars). De oorzaak voor moerbeihartziekte is voedsel, namelijk een
vitamine E en seleniumtekort. Hierdoor raken de kleine bloedvaatjes beschadigd en sluiten af
cellen hebben ischaemie en necrotiseren.
-
Myocarditis als gevolg van Parvo-virus: komt door entingen niet meer echt voor en
maternale immuniteit op jonge leeftijd. Dit virus gaat vooral in delende cellen zitten, maar bij
hele jonge dieren delen de hartspiercellen ook nog. De dieren die geen maternale immuniteit
hebben, tast het Parvo-virus ook de myocardcellen aan myocarditis. Histologisch niet heel
duidelijk, maar wel insluitlichaampjes in hartspiercellen. Dieren gaan snel dood. Een
myocarditis als geheel is meestal het gevolg van systemische infectieuze ziekten of als gevolg
van een degeneratieve aandoening.
Cardiomyopathie: is een beetje een vage term, zegt dat er iets mis is met de hartspierwand, maar
meer ook niet. Twee hoofdgroepen.
- Primair: oorzaak niet bekend (idiopatisch). Dit aantal in deze groep neemt door onderzoek
steeds meer af.
o hypertrofische vorm (kat, hond, rat en varken): concentrische hypertrofie
o gedilateerde (congestieve) vorm (kat, hond, hamster, kalkoen, varken en rund):
excentrische hypertrofie.
o restrictieve vorm (alleen kat): net onder het endocard zit een laagje bindweefsel, hart
rekt niet meer goed uit en het slagvolume daalt.
- Secundair: specifieke aandoeningen. Myocarditis, spierdystrofie, nutritionele myopathieën.
Netter zou zijn om in deze gevallen meer over de specifieke termen te spreken en niet
slechts de vage cardiomyopathie. .
Katten met een cardiomyopathie hebben vaak een sterk vergroot atrium. De symptomen die je
hierbij zou verwachten zijn: hoesten, snel vermoeid, kortademig, oedemen subcutaan, en eigenlijk
dus alles wat je bij hartfalen voorstelt. Vaak zijn deze katten óf plotseling doodgegaan, of een paar
dagen weg en verlamd thuiskomen, koude achterpoten, geen pols in de a. femorales, in het distale
deel van de aorta vinden we dan een grote trombus. Dit komt door de wervelingen als gevolg van de
cardiomyopathie trombusvorming en dus een afsluiting van de aderen.
Endocard:
Veranderingen kunnen degeneratief zijn maar ontstekingen komen veel vaker voor. Ontstekingen
worden onderscheiden op lokalisatie: vavulair (kleppen) parietaal / muraal (wand) of chordiaal (soms
op de chorda tendinae). Met name de valvulaire ontstekingen hebben vervelende gevolgen met
bijvoorbeeld klepinsufficiëntie.
De oorzaak is meestal bacterieel, en soms parasitair of metabool, maar relatief weinig.
Wat betreft de degeneratieve veranderingen:
- Calcificatie: mineralisatie door het eten van veel plantaardigvoedsel met vitamine D-achtige
stoffen. De calcium kan op het hart neerslaan.
- Myxomateuze klepdegeneratie/ endocardiose: onregelmatige glazige verdikkingen van AVkleppen. Gevolg hiervan is dat de klep niet goed sluit door de knobbels, en dus gaat lekken.
Het bloed lekt tijdens de systole terug naar het atrium. Dit heeft als gevolg dat de druk in het
atrium toeneemt, en deze wat wijder wordt. Wanneer het een kleiner defect betreft wordt
het bloed met grote kracht door een kleine opening teruggespoten. Dit geeft irritatie van het
atrium (jet-lesions) en leidt tot bindweefselvorming in het atrium. Door de irritatie krijg je
ook stuwing van de longen, wanneer links, of een veneuze stuwing wanneer rechts.
- Endocarditis: bij een ontsteking van het endocard (op de klep) kan er fibrineafzetting plaats
vinden. Deze kan afbrokkelen en zo een trombus veroorzaken. Deze vorm van endocarditis
wordt dan ook wel een valvulaire tromboendocarditis genoemd. De mogelijke gevolgen van
een endocarditis zijn: stenose (niet vaak); een trombo-embolie door afbreken van brokje
fibrine; klepinsufficiëntie.
De effecten van een trombo-embolie zijn afhankelijk van de locatie (hartinfarct door necrose;
nierinfarct; embolische longontsteking).
Vaten:
Ook bij vaten kun je dezelfde afwijkingen krijgen als bovengenoemd, degeneratief en ontsteking.
Een voorbeeld van een degeneratieve verandering is arteriosclerose (chronische artiele afwijking niet
berusten op ontstekingen) of calcinose als gevolg van een uremie.
Een ontsteking van de vaatwand zelf heet een vasculitis, een onsteking van de lymfevaten een
lymfangitis en met een phlebitis wordt een aderontsteking bedoeld. Virussen kunnen de vaatwand
infecteren waardoor deze gaan lekken zwellingen door oedeem. Dit ligt aan heel veel ziekten ten
grondslag (blauwtong; feline infectieuze peritonitis; boosaardige catarrhaal koorts).
Feline infectieuze peritonitis kent een natte (exsudatieve) en droge (granulomateuze) vorm. Aard van
veranderingen (natte c.q. droge vorm) afhankelijk van immuunrespons. Verspreiding van virus in
lichaam via macrofagen. Depositie van Ag-Ab-complexen in wand van kleine vaten.
Immuuncomplexen complement activatie, chemotaxis van neutrofiele granulocyten en weefsel
destructie in diverse organen waaronder de vaatwand dus ook een vasculitis. (Type III
overgevoeligheid). Dit leidt tot allerlei symptomen afhankelijk van de lokatie van de vaatbeschadiging
(blind worden, hersenbeschadiging, oedemen in de buik).
WC7
Casus 1: na een castratie met het juiste middel en dosering en zonder voorafgaande lichamelijke
afwijkingen wordt de kat na 12 uur benauwd en overleed na 22 uur met verstikkingsverschijnselen.
Tijdens de operatie waren er geen complicaties. Microscopisch beeld van de hartspier geeft veel
macrofagen; plekken van degeneratie (lichtroze, eosinofiel); oedeem door degeneratie; bleke
rommelige lichtroze plekken, verlies van dwarsstrepen op de spiercellen. De specifieke lokatie van
deze veranderingen waren aan de lumenzijde van het myocard, omdat de cellen daar gevoeliger zijn
voor zuurstoftekort (mogelijk door verminderde bloedvoorziening uit coronairvaten). Deze zone
noemen we ook wel de subendotheliale zone van het hart. Macroscopisch zien we sectie donkere
hyperemische longen, gezwollen en slechts samengevallen longen, veel vloeistof in de longen.
De veranderingen zijn redelijk acuut omdat er geen bindweefselvorming heeft plaatsgevonden. Hoe
korter na de narcose, hoe minder verschijnselen.
De klinische verschijnselen van benauwdheid kunnen als volgt verklaard: myocardschade leidt tot
een verminderde pompfunctie samengevallen hyperemische longen verminderde
longcirculatie en gasuitwisseling en stikken.
De relatie met de anasthesie is de cardiovasculaire bijwerking van anasthesie. Het functioneert als
een alpha-2-dopamine agonist en geeft hypoxie in de hartspierwand. Het kan bij alle dieren
voorkomen maar katten zijn over het algemeen wel gevoeliger.
Een goede voorkoming is er niet. Het dier wegen, een goede voorbereiding, preklinisch onderzoek en
gebruik van voorgeschreven middelen helpen uiteraard wel. De dierenarts moet over de risico’s
goede voorlichting geven.
Casus 2: een kat van 2 jaar wordt plotseling benauwd, anorexisch en een ondertemperatuur. 2 dagen
na start van deze symptomen overleed het dier. Bij sectie wordt een vergroot hart een een
hydrothorax gevonden. Het linkerventrikel vertoont een excentrische hypertrofie, en in het myocard
worden bleke foci met bindweefsel gevonden. Microsopisch worden cysten gezien op de grens van
de ontstekingslaag, bleke plekken met bindweefsel, macrofagen, lymfocyten, plasmacellen en
polymorfkernigen om de necroseplekken heen. Bij sectie wordt macroscopisch een stompe bolle
vorm van het hart gezien zonder duidelijke apix, bleke plekken in de hartwand. Deze kat heeft een
toxoplasma infectie. De excentrische hypertrofie komt ter compensatie van een volume-belasting. De
hydrothorax ontstaat als gevolg van het vervolgende linkerhartfalen. (intermezzo; een chylothorax is
lymfe en hemothorax bloed). Door de hypertrofie kan ook de zenuwgeleiding minder goed verlopen
waardoor de hartfunctie nog minder wordt.
Een aantal oorzaken voor cardiomyopathie bij katten zijn taurine deficiëntie, hyperthyroïdie,
tumoren en congenitale afwijkingen. Bij deze kat zou je naast de toxoplasma geen tumoren
verwachten en wel congenitale aandoeningen wegens de leeftijd.
Casus 3: een rudn wordt enige tijd na de partus algemeen ziek, het dier had een positieve vene
jugularis pols en subcutaan oedeem (kossum en tussen kaaktakken meestal). De gewrichten waren
overvuld, het dier lag en wilde niet eten, de lichaamstemperatuur was verhoogd. Tijdens auscultatie
wordt rechts een souffle gehoord, de leverpercussie was vergroot. Macroscopisch wordt bij sectie
een verdikking van de rechter AV-klep aangetroffen, deze ziet er woekerend en dof uit. Dit is van die
mate dat het leidt tot een klepinsufficiëntie. Microscopisch is ook te zien dat de klep verdikt is en
onregelmatig van vorm. Er is een toename van onstekingscellen en bindweefsel, en liggen
fibrinestukken op de kleppen.
De oorzaak voor dit beeld is een thrombo-endocarditis van de rechter AV-klep veroorzaakt door
arcanobacterium pyogenes. Omdat er al bindweefselvorming is, is het proces chronisch te noemen,
deze vindt namelijk 5-7 dagen na de ontsteking plaats. Deze ontsteking zou via een embolie ook tot
longontsteking kunnen leiden. Door het rechterhartfalen vindt een stuwing plaats in de vene cava en
de lever. De lever is daardoor vergroot, maar een deel is necrotiserend. Dit is zone 3 in de lever en
leidt tot ‘nootmuskaat tekening’.
De verwekker van deze ontsteking kan met een afdrukje en een gramkleuring worden aangetoond.
Het algemeen ziek zijn komt door een alghele bacteriemie, ontstekingsmediatoren en wellicht een
sepsis.
Aan de bloed-eiwit veranderingen verwachten we een verhoging in gamma-globulines ten koste van
albumine. De eerste zal dus verhoogd zijn, de tweede verlaagd. Eveneens zullen de acute fase
eiwitten toenemen. Het witte bloedbeeld zal een leukocytose met linksverschuiving geven. Tot slot
verklaren we de gewrichtsovervulling door een metastase in de vorm van een artritis. De pijn die
hiermee gepaard gaat leidt tot minder rechtop staan van de koe, hierdoor een verminderde
doorbloeding en dus een mindere vochtafvoer.
WC8
Er zijn een groot aantal agentia die het hart en bloedvatenstelsel infecteren. Deze kunnen variëren
van virussen, bacteriën en parasieten zoals wormen en protozoën. Het voorkomen van deze agentia
en de voorkeurslocatie verschilt sterk per diersoort. Ook omgevingsbacteriën die normaal
commensaal zijn zouden bij een open wond of andere beschadigingen tot problemen kunnen leiden.
Hier zijn een groot aantal te noemen, bijvoorbeeld de veroorzakers van een traumatische
pericarditis.
Trombose kan door een aantal verschillende factoren ontstaan. Virchow’s driehoek geeft hier een
goed overzicht van.
In bovenstaande staat eigenlijk dat alle drie de hoekpunten kunnen leiden tot trombose. Bovendien
is het belangrijk je te realiseren dat trombose zelf ook weer tot deze 3 factoren leidt. Bovendien kan
een abnormale bloedstroom tot endotheelschade leiden (bijv. turbulenties) en andersom. Een
hypercoagulabiliteit leidt tot snellere vorming van stollingsfactoren, endotheelschade tot ontsteking,
fibrine afzetting en een embolie. Bovendien heeft intact endotheel een negatief geladen oppervlakte
en stoor erytrocyten, bloedplaatjes en factoren af. Dit doet beschadigd endotheel niet. Een
ciculatoire stase tot betere afzetting van stollingsfactoren. Eén factor op zich zou echter al voldoende
kunnen zijn om trombose te veroorzaken.
Casus 1: ziek veulen van 5 maanden, had een navelontsteking, loopt kreupel en blijft achter in de
groei. Af en toe is er koorts.
Het vermoeden bestaat op een endocarditis. Van een endocarditis weten we dat deze bij
verschillende diersoorten op verschillende kleppen meer voorkomen. De belangrijkste discrepantie is
bij het rund voornamelijk op de rechter AV-klep en bij het paard en hond voornamelijk in de linker
hartdelen. Bij het paard en hondje is dit zo omdat door de hogere turbulente het endotheel sneller
beschadigd raakt. Omdat de ontsteking meestal vanuit een bacteriemie komt hecht deze op
endotheelschade aan. Bij het rund komt de ontsteking vaak vanuit een trombo-embolie, welke vanuit
de grote circulatie in het hart terecht komt. De trombus komt als eerste in het rechter hartdeel
terecht waar de ontsteking dus dan ontstaat. Een aantasting van de linker kleppen zorgt uiteindelijk
voor linker hartfalen en andersom. Bij een paard die je verdenkt van endocarditis verwacht je de
volgende verschijnselen aan te treffen: algemeen ziek, vermagering, verschijnselen van hartfalen
(links) in later stadium, koorts, kreupelheid bij metastase en polyartritis bij metastase. De
verschijnselen van een losgeraakte trombo-embolie kan op meerdere plekken.
Om de waarschijnlijkheidsdiagnose te bevestigen kun je gebruik maken van echo en herhaaldelijke
bloedkweken. De prognose is echter, zeker in een later stadium, ongunstig. Eventueel zou je
langdurig (2-3 maanden) AB kunnen toedienen en het hartfalen symptomatisch behandelen.
Casus 2: traumatische pericarditis bij het rund. Hij is ernstig ziek, eet niet meer, de temperatuur is
verhoogd, een dag of 10 geleden ook even niet in orde, at toen wat minder en leek krom te staan en
pijn te hebben, spontaan opgeknapt maar sinds gisteren weer ziek.
De volgorde van de pathogenese verloopt als volgt;
1. Perforatie van de netmaag door een scherp voorwerp
2. Lokale peritonitis, pijn
3. Aanprikken van het pericard
4. Pericardovervulling (klotsen door combinatie van vocht en gas)
5. Bemoeilijkte hartwerking, druk op grote venen, hypertensie
6. Consolidatie, bindweefselvorming, klotsen niet meer hoorbaar.
Er zijn verschillende typen van pericard overvulling, hydropericard of hemopericard al dan niet
gepaard met gasvorming (bruits de glou glou). Deze pericarditis wordt veroorzaakt door een
mengcultuur afkomstig van de spijker. Andere verwekkers van andere vormen van een pericarditis
zijn: clostridium chauvoei; Mannheimia hemolytica en vanuit het endocard de arcanobacterium
pyogenes. De prognose voor koeien met deze aandoening is infaust, eventueel langdurig AB.
Het tweede deel van het WC bestond uit het lezen van een groot aantal artikelen. Er waren in totaal
3 onderwerpen.
Casus 1; hond benauwd en hoest, lichamelijk en aanvullend onderzoek geeft verdenking van
dirofilaria immitis = hartworm. Op zich is het niet waarschijnlijk dat de hond deze infectie in
Nederland oploopt, de vector is een mug die zich niet handhaafd bij temperaturen onder de 15
graden. De verdere cyclus van de hartworm is:
L3 komt de gastheer binnen en migreert naar het bloed waar het zich tot L4 ontwikkeld. Vanuit daar
migreert de L4 naar een klein adertje en vervolgens met de bloedstroom mee naar de A. Pulmonalis.
Dit duurt ongeveer 3 maanden. In de A. Pulmonalis ontwikkeld zich de adulte variant in nogmaals 3
maanden en de PPP is dus 6 maanden. Daar vindt geslachtelijke voortplanting plaats, en er worden
microfilaria geproduceerd. Deze ontwikkelen zich als L1 en circuleren in het bloed. Bij het prikken
door de mug neemt deze hem op en in de mug ontwikkeld L1 zich tot L3.
De schade ontstaat intravasaal door mechanische belemmering van de worm en beschadigingen.
Hierbij kan trombosevorming in de takken van A. Pulmonalis plaats vinden. De mechanische invloed
van de wormen en de stoffen die zij produceren maakt het endotheel eveneens onregelmatig. De
permeabiliteit van het endotheel verhoogd en dat zorgt voor longinfiltratie van leukocyten. Dit geeft
een ontstekingsreactie.
Wanneer het ernstig wordt is er een mogelijkheid op het vena cava syndroom: een groot aantal
wormen kruipt hierbij vanuit de A. Pulmonalis naar het RV. Dit zorgt voor een mechanische
belemmering van de tricuspidalisklep en ecuut congestief rechter hartfalen. Door mechanische
beschadiging van de erytrocyten (botsen tegen de wormen) kan intravasale hemolyse optreden met
een hemoglobinurie en icterus als gevolg (door afbraak in lever en overbelasting in lever). Door de
mechanische belemmering in het RV vindt ook hypotensie en shock plaats.
De Franse hartworm is een andere soort en heet de angiostrongylus vasorum. Deze worm komt
sinds een paar jaar in Nederland voor. Infecties verlopen door het opeten van een slak/slijm. De
cyclus van deze pathogeen is: opname van slak waarin L3 zit, migratie naar de longvaten via
mesenteriale lymfeknopen, PPP is dan 40-60 dagen. De volwassenen komen via de longvaten in het
RV en pulmonaal arterieën, waar ze eitjes leggen. De L1 migreert naar de alveoli en de longen,
worden opgehoest, doorgeslikt en uitgepoept. De slak eet deze weer op.
De verschijnselen zijn een verbruikscoagulopathie van stollingsfactoren (DIS) waardoor bloedingen
op veel plaatsen ontstaan. De hieropvolgende hemorragische diathese leidt tot anemie. Eventueel
ontstaan er neurologische verschijnselen door L1 migratie naar de hersenen. Door opstommingen
ontstaan ook rechter hartfalen en endotheelschade met trombose vorming. Omdat de wormen
minder ruimte in beslag nemen is er geen vena cava syndroom.
Wanneer je wormen massaal gaat behandelen met bijvoorbeeld Ivermectine zou je rekening moeten
houden met een massale sterfte overmatige antigeen presentatie allergische reactie.
De strongylus vulgaris kan bij het paard voor ernstige koliek zorgen. Dit komt omdat er soms een
massale binnendrang van de larven in de darm plaats vindt. Dit leidt tot grote darminfacrten of
normale krampkoliek.
Opdracht 2: Equine Virale Arteriïtis (EAV) veroorzaakt door het gelijknamige virus. Verloopt meestal
subklinisch en speelt in Nederland geen grote rol. Het kan toch schade geven en is bij de export van
paarden van belang.
Indien de infectie niet subklinisch verloopt zien we dat het virus zich in vaten en capillairen aan het
endotheel hecht. Dit leidt tot vermeerdering in het endotheel waardoor deze kapot gaat. Vooral in
het respiratoire gedeelte leidt dit tot het lekken van vloeistof en dus oedemen. Het kan in alle
organen gaan zitten en tal van verschillende verschijnselen geven. De infectieroutes van dit virus zijn
via lichaamssappen, en de opname is meestal respiratoir. De hengsten zijn over het algemeen
dragers en dus subklinisch geïnfecteerd maar kunnen via sperma het virus verspreiden. Bij een
infectie met de bevruchting leidt dit tot afwijkingen van het vrucht en abortus of congenitaal
geínfecteerden. Merries en veulens, of ook wel de Jopies, worden het meeste klinisch geïnfecteerd.
Blauwtong heeft een zelfde soort pathogenese met vaatbeschadigingen.
Opdracht 3: op een SPF bedrijf hebben de biggen extreem hoge hartslag en plotseling overlijden, de
biggen hebben een ECMV infectie.
Deze infectie wordt veroorzaakt door het encephalomyocarditis virus, wat een RNA virus is,
behorende tot de familie cardioviridae, picornaeviridae. De infectie verloopt het meest oro-nasaal,
via de feces van knaagdieren. Het virus komt binnen op de tonsillen en migreert in macrofagen naar
de bloedcirculatie. Vanuit de bloedcirculatie hechten ze aan specifieke myocard receptoren, (VCAM1) en komen zo binnen in de myocardcel. Daar vindt extensieve replicatie plaats in het cytoplasma en
geeft op die manier een myocarditis. Het myocard kan als gevolg hiervan gaan necrotiseren.
Tegen deze infectie wordt normaliter een goede immuniteit opgebouwd.
Een andere virale aandoening bij de hond die een myocarditis kan veroorzaken is het Canine Parvo
Virus. Bij zeer jonge honden die net hun maternale immuniteit verliezen.
HC6
De eerste actiepotentiaal is afkomstig van de sinusknoop. Het verlaat de sinusknoop en verspreidt
zich over de atrium. Daarna komt het bij de AV knoop (reserve pacemaker), die het doorstuurt naar
de bundel van His die de signaal verspreidt over de ventrikel.
Rechts van boven naar onder is
volgorde in tijd.
Sinusknoop: heeft een afgeronde vorm van actiepotentiaal. Nadat de actiepotentiaal is geweest
(repolarisatie) begint in rust al de polarisatie weer te te stijgen (geleidelijke repolarisatie). Cellen in
de sinusknoop brengen zichzelf naar de drempelwaarde. Een depolarisatie wordt uiteraard altijd
gevolg door een repolarisatie. De geleidelijke repolarisatie onstaat door geleidelijke natrium-
instroom, via ‘funny channels’. Deze kanalen staan al open bij -80 mv, in plaats van dicht zoals
gewoonlijk in rustpotentiaal. Wanneer een bepaalde drempel waarde bereikt wordt gaan
spanningsgevoelige calcium kanalen open depolarisatie. De cardiomyocyten rondom de SA-knoop
worden via gap-junctions geëxciteerd. Hierna gaan de kalium kanalen open, deze stroomt naar
buiten en leidt tot een repolarisatie. Speelt zich 60-80 keer per minuut af.
Dit principe ion-kanalen is belangrijk voor het gebruik voor farmacotherapie.
Sinusknoop geeft het startsignaal, atrium cellen doen mee, maar ventrikels moeten niet mee doen
omdat deze later moeten contraheren. Er moet dus een pauze ingebouwd worden, daarvoor is de
annulus fibrosus aanwezig. Dit is een niet geleidende laag tussen atrium en ventrikel. Dat is niet
genoeg, want de ventrikels moeten op enig moment wel contraheren. De plek waar het door het
annulus fibrosus heen kan is de bundel van His. Enige oversteek plaats.
Vanuit de AV-knoop komt het in de bundel van His terecht. De AV-knoop vertraagd dus het signaal
en geeft het daarna door. De AV-knoop fungeert bovendien als een ‘reserve pacemaker’ te zien aan
een langzame repolarisatie in rust. De AV-knoop overheerst normaal echter niet, omdat de
sinusknoop een sneller ritme induceert. Wanneer deze wegvalt overheerst de AV-knoop dus wel,
maar op lagere frequentie. De vertraging in de AV-knoop heeft met weinig gap-junctions te maken.
Het duurt dus lang voordat alle cellen het signaal hebben doorgegeven en in de bundel van His
aankomt. Er is dus een groot gat tussen depolarisatie van AV-knoop en bundel van His.
De hartfrequentie kan verhoogd worden door een combinatie van aanpassingen in de sinusknoop en
de AV-knoop (anders zijn ze niet op elkaar afgestemd). Hartslagfrequentie maximaal is 220 – leeftijd.
Wanneer de hartslag frequentie verhoogd wordt is de systole duur nagenoeg gelijk, maar de diastole
wordt sterk verkort. Daarom is het belangrijk dat allerlei organen gaan helpen omdat de vullingstijd
heel erg verkort wordt.
In bovenstaande figuur is het groene lijntje de kalium ionen die uitstromen en een repolarisatie
veroorzaken en het gele lijntje de inwaartse natrium stroom door de funny channels, dit veroorzaakt
fase 4. Het zwarte lijntje is de algemene de-/repolarisatie en het rode lijntje de inwaartse calcium
instroom wat zorgt voor de depolarisatie van sinus-/AV-knoop.
Adrenaline (bèta 1-receptor, sympathisch) en acteylcholine (Muscarine 2 receptor, parasympathisch)
hebben een effect op al deze ion-kanalen.
- Calciumkanaal: adrenaline activatie, acethylcholine remming betrokken bij
drempelwaarden en depolarisatie drempelwaarde omlaag bij adrenaline, omlaag bij
acethylcholine. Dit wordt bepaald door het aantal calcium kanalen dat mee doet adrenaline is hoge HF, acethylcholine is lage HF.
- Natrium funny channels: pacemaker kanaal. Adrenaline een positief effect, acethylcholine
een negatief effect. Meer funny channels geeft namelijk een snellere bereiking van de
drempelwaarde.
- Kalium kanalen: verantwoordelijk voor repolarisatie. Alleen onder invloed van acethylcholine
met een postief effect meer kalium kanalen open. Kalium is bepalend voor rustpotentiaal,
meer kanalen open dus cel dichter bij het evenwicht van kalium (= -90 mv) en dus een lager
rustpotentiaal. Hierdoor duurt het langer voor de drempelwaarde bereikt wordt.
Adrenaline is dus positief chronotroop en inotroop, actehylcholine negatief dromotroop
(voortgeleiding elektrisch signaal) en negatief chronotroop.
Het autonome zenuwstelsel heeft dus invloed op AV-knoop en sinusknoop. In rust is de
parasympathische invloed belangrijker. Blokkade leidt tot enorme hartstijging, terwijl stimulatie
slechts een lichte daling geeft.
Bij een paard is dit voornamelijk sterk aanwezig, de AV-knoop wordt zo sterk geremd dat we zelfs af
en toe geen AV-knoop signaal zien bij een sinussignaal (2e graads AV-blok, fysiologisch). Bij ons is dit
overigens wel erg.
Het signaal steekt uiteindelijk over van de bundel van His naar de septumtakken in beide ventrikels
op weg naar de apex van het hart. Dit gaat via het netwerk van Purkinje vezels, bij de meeste
diersoorten aan de enocardiale zijde. Bij paard en rund aan de epicardiale zijde. Deze zorgen ervoor
dat de actiepotentiaal op de normale cardiomyocyten wordt overgedragen. De actiepotentiaal treedt
hier dus als laatste op actiepotentiaal.
Samengevat:
• Sinusknoop - pacemaker
• AV-knoop - vertragen geleiding
• bundel van His - elektrische brug
• bundeltakken - hoge snelheidslijn
• Purkinje vezels – overdracht
Geleidingssysteem coördineert dus de mechanische contractiecyclus.
Om te begrijpen wat de relatie is tussen de actiepotentiaal en mechanische reactie moeten we naar
de actiepotentiaal kijken. Na een actiepotentiaal is een plateau-fase (aanhoudende depolarisatie van
200 ms). Tijdens deze fase staan spanningsgevoelige Ca-kanalen open. Hierna gaan de K-kanalen
open = repolarisatie. Het calcium wat tijdens de plateau-fase instroomt, is essentieel voor de
calcium-geïnduceerde-calcium afgifte, en dus de trigger voor het SR om calcium af te geven systole ventrikel.
Dromotroop: voortgeleiding
Inotroop; contractiliteit
Chronotroop: hartslagfrequentie.
Ook purkinje-vezels hebben bovenstaand funny-channels, deze kunnen dus ook in bepaalde situaties
als pacemaker voorkomen. Dit komt bij ernstige hartritme stoornissen voor.
ECG
P-top: depolarisatie atrium (systole atria).
QRS: depolarisatie van het ventrikel (systole ventrikel)
T-top: repolarisatie van de ventrikels (start diastole ventrikel)
Tussen P en Q is de systole van het atrium.
Tussen de Q en de T is de systole van het ventrikel.
Eerste harttoon op QRS (AV-kleppen dicht) en tweede op T (repolarisatie van ventrikel).
De plateau-fase is in een ECG niet te zien. Dit komt doordat je alleen de overgangssituaties in de ECG
ziet, de plateau-fase is 0. De lading is dan namelijk aan de binnen en buitenkant hetzelfde, en pas na
de actiepotentiaal zijn sommige cellen gedepolariseerd en anderen niet. Het verschil hiertussen en
de kringstroompjes hierdoor wordt opgepikt door een ECG. Dus alleen overgangssituaties worden
gemeten.
Een ECG opname is altijd een verschil opname tussen 2 elektrodes (elektrodenpaar), het verschil
tussen deze spanningen worden gemeten. Wanneer ze op hetzelfde spanningsveld zitten meten deze
dus helemaal niets. Je plakt daarom meerdere elektroden op het lichaam waardoor de kans op een
verschil groter is.
HC7
Om een hart ritme te maken zijn hebben we een paar dingen nodig; een sinus knoop, AV knoop,
bundel van His, en purkinje vezels. Bij het paard zijn de Purkinje-vezels wijdvertakt tot diep in het
myocard en niet in twee bundels, dus beperkte ECG mogelijkheden.
De AV-knoop en purkinje vezels zijn bekend als latente pacemakers, dit noem je ook wel ‘wandering
pacemakers’. Echter acceleratie van deze latente pacemakers door medicijnen, hartziekte of
verandering in tonus autonome zenuwstelsel: SA knoop overruled leidt tot onregelmatigheden
Een veranderende vagotonie leidt tot aritmieën. Dit kan ontstaan vanuit het centrale zenuwstelsel
maar ook als het gevolg van perifere receptoren, zoals chemo- of baroreceptoren. De fysiologische
activiteit van het hartritme staat onder invloed van het:
- Parasympatische activiteit (nervus vagus, vagotonie): varieert met bloeddruk.
• Onderdrukt SA knoop activiteit, HF omlaag
• Vergroot intra-atriale geleiding: kortere atriale actie potentiaal
• Vertraagt AV geleiding
- Sympatische activiteit, volgende punten omhoog:
• HF omhoog
• AV geleiding omhoog
• Exciteerbaarheid cellen omhoog
• O2 consumpie omhoog door HFomhoog, myocardiale contractie kracht en wand
spanning omhoog
De bedoeling is dat deze twee in zekere mate in rust zijn, maar een groter aandeel voor de
parasympathicus.
Bij het paard ziet een ECG er anders uit, R top is omlaag en ook de T-top kan omgekeerd worden. De
essentie van de onderdelen van de ECG moet hetzelfde zijn, maar de vorm kan veranderen
afhankelijk van de plaatsing van de elektroden. Bij een paard zou je ook een bi-fasische P-top kunnen
zien, door het grote hart en dus een iets assymetrische geleiding door linker en rechter atrium. Niet
erg en normaal, maar wel typisch voor het paard.
2 hoofdgroepen van aritmieën:
Storing in prikkelvorming:
• Veranderde automaticiteit: sinusaritmie, wanderering pacemaker (P-top door een ander
stukje atriumweefsel maar niet de SA-knoop, wel een normale contractie en
depolarisatiegolf), SVES (APC, PAC), VES (VPC)
Latente pacemakers komen in actie
Storing in prikkel geleiding;
• Conductie blok: SA blok, AV blok graad 1-3
• Re-entry: extra prikkeling uit een bijvoorbeeld necrotisch gebiedje gaat rondzingen, zorgt
voor pathologische tachyaritmiën (AF, SV-tachycardie, V-tachycardie). Er gebeurt hierdoor
altijd iets extra’s. atriumfibrilatie is ook een gevolg van het rondzingen van een signaal.
Randvoorwaarden zijn dat het normale signaal dood loopt door bijvoorbeeld necrotisch
weefsel en gaat rondzingen in de tussentijd wordt een cel alweer gerepolariseert opnieuwe depolarisatie door rondzingend signaal. En dit blijft dus continu het geval.
Bij een fysiogische ritmestoornissen is altijd een normale HF en normale polskwaliteit, bij een
pathologische stoornis meestal verhoogde HF (maar niet altijd) en afwijkende polskwaliteit.
Regelmatige onregelmatigheid is meestal fysiologisch en onregelmatige onregelmatigheid is meestal
pathologisch. Een sinus-aritmie is een belangrijke uitzondering, deze is ook een onregelmatige
onregelmatigheid maar fysiologisch. Ook een respiratoire aritmie kan als onregelmatige
onregelmatigheid worden aangemerkt. Toch zijn ook bij deze polsfrequentie en kwaliteit normaal.
Stappen voor de beoordeling van een ECG:
• Stap 1. Zijn alle onderdelen er; identificeer P-QRS-T
• Stap 2. Bepaal regelmaat aan hand R top
• Stap 3. Bepaal P-Q interval
• Stap 4. Bepaal of alle P’s identiek zijn
• Stap 5. Bepaal of alle T’s identiek zijn
• Stap 6. Bepaal of QRS complexen gelijk zijn
• Stap 7. Bepaal de grootte/ vorm onderdelen.
Fysiologische ritmestoornissen:
Bij een fysiologische aritmie en gepaste arbeid kan het herstel met een seconde plaatsvinden. Hier
moet je op metingmoment/auscultatiemoment op letten, doe je dit te laat is de aritmie alweer terug.
1. Sinus aritmie:
- respiratoir (hond, jong dier,soms paard): soort regelmaat…bij inademing gaat
hartfrequentie omhoog, bij uitademing omlaag, dus golf beweging
- niet respiratoir (paard): een onregelmatige onregelmatigheid met soms lange, en soms
korte pauzes.
Alle onderdelen van het ECG zien er wel normaal uit.
Een sinusbradycardie en een sinustachycardie kunnen fysiologisch en pathologisch zijn.
2. SA blok: hele P-top valt uit, gaat ook niet naar AV-knoop door, hele hartactie dus ook uit. Er zit
meestal een soort van patroon in, bijvoorbeeld 3 op 1, waarschijnlijk om de bloeddruk te kunnen
reguleren. Het is dus een regelmatige onregelmatigheid. Bij een uitval is de afstand tussen 2 toppen
dus 1x tweemaal zo lang.
3. AV blok: regelmatige onregelmatigheid. en de P-top is mogelijk te horen als een S4.
• 3a.Eerste graad: deze hoor je niet en is puur een ECG diagnose. De P-Q tijd is verlengd.
• 3b.Tweede graad: Regelmatige stukken onderbroken door uitval QRST in vast patroon, bv
3/1.
– Type 1/ Wenkebach: progressieve verlenging P-Q tijd voordat QRS uitvalt, soms P
top te horen als S4
– Type 2/ Mobitz: geen verandering P-Q tijd alvorens ORS uitvalt, soms P top te
horen als S4.
Samenvattend voor fysiologische aritmieën: Altijd normale pols/hart frequentie, Altijd normale
polskwaliteit, Gaan weg bij sympatische overdrive (arbeid of parasympaticolytica/ symp.mimetica),
Komen vooral voor bij paard (vagotonie), in mindere mate hond (m.u.v. resp. sinusaritmie), Functie in
regulatie bloeddruk, Diverse soorten, uitgaande van SA of AV knoop.
Pathologische ritmestoornissen.
Bij een pathologische ritmestoornis zien we: Meestal tachycardie* (*bij paard lang niet altijd),
Meestal zwakke inequale pols, Meestal wisselende intensiteit hartetonen, Meestal onregelmatig
onregelmatig hartritme, soms afgewisseld met stukken regelmaat (m.u.v. Ventriculaire tachycardie).
Daarom de pols dus ook lang genoeg opnemen, min. 1 minuut! Als het echt duurt kan je er ook een
kastje aanhangen, en voor langere duur het hartritme opnemen.
Omdat de pomp minder effciënt is, zal dat dit de CO verlagen, en het lichaam moet hiervoor
compenseren. De ritmestoornis zelf leidt tot een hogere HF of de compensatie tot een hogere HF.
Dus vandaar vaak een tachycardie. Een hartfrequentie opnemen met pols en hart tegelijk om de
uitval te meten, bovendien is alleen in de pols vaker de onregelmatigheid op te nemen. In het hart
wil alles soms wel eens normaal lijken. Wanneer de opname te lang duurt zou je er een
‘registratiekastje’ aan kunnen hangen voor een langere periode, 24 uur.
Een pathologische aritmie van prikkelvorming is afkomstig uit atrium of ventrikel, waarbij ergens een
extra focus ontstaat (door bijvoorbeeld necrose of ontsteking), dat aanzet tot een contractie van
abberante oorsprong. De contractie kan eventueel aan re-entry doen en gaan rondzingen en op die
manier voor bijvoorbeeld atriumfibrilatie zorgen.
Bij een pathologische geleidingsstoornis zien we voornamelijk een stoornis in de geleiding, meestal in
het kader van een 3e graads- AV- blok.
Supraventriculaire pathologische ritmestoornissen:
Oorzaken van deze problemen zijn: Autonome imbalans; Hypokalaemie (in zweet zit veel kalium);
Hypoxie; Infecties leiden tot allerlei foci (myocarditis,viraal/bact.).
Afwijkende prikkelvorming in de
1. SVES: Afwijkende P top (vorm, timing) QRS altijd normaal. De P-top kan bovenop de T-top
belanden, waardoor het er heel raar uit gaat zien. Regelmatige stukken onderbroken door
extra slagen, soms gevolgd door compensatoire pauze. Een enkeling kan nog wel eens zonder
problemen zijn, SVES die niets betekent. Wanneer het niet normaal is eerst de primaire
oorzaak opheffen; boxrust; ontstekingsremmers (cortico’s).
Bij reentry probleem: Atrium fibrillatie; Atrium fladderen, Atriale tachycardie. In alle gevallen
doet het atrium maar wat.
Re-entry probleem:
2. Atrium fibrilatie: makkelijker bij paarden en grote hondenrassen door grote atria, meer
weefsel om in rond te zingen, en predispositie door hoge vagotonie (toegenomen atriale
conductie en verkorting atriale actie potentiaal leidt tot electrische inhomogeniteit).
Decompensatie is eerder de oorzaak van atrium defribilatie en niet het gevolg. Bij het paard
heeft slechts 10% van de atriumcontractie inlvoed op de ventriculaire vulling dus de gevolgen
veel kleiner, bij de hond is het erger want daar is de bijdrage maar liefst 30%. De oorzaken
zijn erg variërend. Het kan per ongeluk zijn maar ook snelle atriale contracties icm SVES,
hypoxie, hypokalaemie. Het kan door een vergroot atrium tgv AV- insufficiëntie (nog meer
weefsel!), of door ziek atrium weefsel. Een re-entry van prikkel leidt tot atrium fibrilleren.
We zien een onregelmatig onregelmatigheid; inequale pols;
wisselend verhoogde venepols; wisselende intensiteit hartetonen; en na / tijdens arbeid nog
steeds onregelmatig. In rust heeft het paard geen tachycardie; hond altijd tachycardie. In
arbeid kan het paard dit wel hebben, dan arbeidsintolerant. Bij geen significante
hartafwijkingen > 92 % kans op herstel bij
quinidine (evt + digoxine ) therapie. 4 maanden aanwezig en/of atriumdilatatie succes
minder en 60 % kans op recidief. Quinidine is wel nogal giftig, negatief inotroop, positief
chonotroop, bloeddrukverlagend en gevaarlijk. Dus oppassen met het gebruik en zeker niet
bij hartfalen!
Een atriale tachycardie is dat de atrium contractie normaal is maar de ventrikel niet. Dit kan
bij zeer sterke galop weer normaliseren, dan is het ventrikel weer regelmatig en neemt de
atrium frequentie over. De behandeling is hetzelfde als bij atrium fibrilatie.
Patholgische ventriculaire problemen.
Eigenlijk hetzelfde verhaal als supraventriculair, talloze oorzaken: toxinaemie; sepsis; electroliet
verstoring ( K /Mg, Ca); metabole afwijkingen (rhabdo,vit E); hypoxie; toxines zoals monensin,
digoxine; virale, bacteriele myocarditis; pericarditis en endocarditis.
Afwijkende prikkel oorsprong
1. VES; regelmatige stukken onderbroken door extra slagen meestal gevolgd door
compensatoire pauze
, geen bijbehorende P top, QRS bizarre van vorm (groot, wijd), R op T: risico voor fibrilleren.
Een enkele zonder klachten kan klinisch irrelevant zijn bij paard! Met name indien direct na
arbeid (symp/parasymp dysbalans).
Behandeling VES : V. tachycardie is spoed geval: Oplossen primaire oorzaak, bij een enkele
losse: 6=8 weken boxrust, bij meerdere Lidocaine, phenytoine, procainamide afh van oorzaak
NSAID/ corticosteroiden / AB, Specialisten werk.
bij reentry probleem:
1. Ventriculaire tachycardie
2. Ventrikel fibrilleren
Geleidingsstoornis:
1. Derde graads AV blok: Geleiding van atrium naar ventrikel ontbreekt, P niet gerelateerd
aan volgende QRS-T, Over algemeen gevolg van hartziekte, of medicijn intoxicatie (mn
Quinidine), QRS complex kan wijd worden, acute opvang: atropine / adrenaline;
chronisch: pacemaker.
WC9
P top is het gevolg van de atrium depolarisatie
QRS complex is het resultaat van de depolarisatie van de ventrikel
T top is het gevolgd van de repolarisatie
P-Q interval is de tijd die nodig is voor het signaal van de AV node doortegeven te worden aan de
bundel van His, en is gelijk aan de duur van de systole van de atria.
S-T segment is de duur van de ventrikelsystole.
T-Q en T-R is de duur van de ventrikeldiastole.
Bij paarden komen voornamelijk fysiologische aritmieën voor maar ook bij de hond kun je ze
tegenkomen. Dit zijn bij het paard vaak in rust door de overheersende vagustonus en bij de hond
respiratoir. Deze onstaan beiden door een overheersing van de parasympathicus of door een
disbalans tussen de parasympathicus en de sympathicus. De parasympathicus heeft namelijk een
negatief inotroop en chronotroop effect.
Het onderscheid tussen fyiologisch en pathologsich maak je door gepast arbeid te doen of een
parasympathicolyticum (Buscopan, Atropine kan bij het paard koliek geven) toe te passen. Bij een
respiratoire aritmie moet je nog denken aan het ausculteren en gelijktijdig op de ademhaling letten.
Auscultatie en palpatie op pols en hart tegelijk. Verder kun je natuurlijk een ECG maken.
Bij het rund doen we eigenlijk geen ECG omdat daar alléén atriumfibrilatie en VES voorkomen, en
deze op auscultatie makkelijk te onderscheiden zijn. Volgens de docent is een atriumfibrilatie en
ventrikel tachycardie overigens niet goed te onderscheiden, dus wel een korreltje zout bij deze
aanname.
Klinisch gezien verwacht je bij pathologische aritmieën ook symptomen zoals allerhande symptomen
van hartfalen, lage bloeddruk, slechte polskwaliteit en inequaal en een oplopende vene pols.
Om klinisch onderscheid te maken tussen de verschillende pathologische aritmieën kijk je naar
kenmerken van de pols, auscultatie, compensatoire pauze bij VES, uitloop van de vene pols. Maar
echt uitsluitsel krijg je hier meestal niet mee.
De gevolgen verschillen een beetje per aandoening (zie syllabus) maar hierbij moet je denken aan:
minder vulling, EDV omlaag, verhoogde hartslag (niet bij paard, behalve bij klepinsufficiëntie), minder
perfusie van de coronairvaten leidt tot myocard defecten en nog meer aritmie.
Oorzaken die ten grondslag kunnen liggen aan een aritmie zijn cardiomyopathie, hartfalen met
dilatatie als gevolg, ontstekingen, ionaire onevenwichten en intoxicatie. Behandeling hangt dus ook
af van de oorzaak.
De eerste hulp is oxygenatie intra-nasaal en de oorzaak behandelen indien bekend. Zodra je echt
medicijnen moet geven, moet je doorverwijzen naar een specialist. Dit omdat de therapeutische
breedte van medicijnen erg smal is en effecten vaak nogal heftig.
De medicijnen die je kunt gebruiken zijn overgeslagen maar staan uitgebreid in de syllabus (en deze
samenvatting) benoemd.
Dan worden er nog een aantal plaatjes van ECG gegeven. Deze moet je zelf bekijken maar van boven
naar beneden: SVES 2x; SVES 1x; 2e graads AV-blok; VES-tachycardie; AV-blok met tijdelijke
sinusaritmie en SVES; atriumfibrilatie; VES; sinustachycardie; SA-blok; Sinus aritmie, mogelijk
respiratoir.
HC8
In de human geneeskunde komen hartproblemen vaker voor dan bij diergeneeskunde en daarom
hebben we maar enkel middelen voor de hart bij dieren. Met het farmaca kunnen we de
prikkelgeleiding, het hartspier zelf (bij insufficiëntie van de hartkleppen) en het perifere vaatbed
(waardoor je de pre- of afterload kan veranderen). Voor infectieuze of parasitaire hartaandoeningen
kunnen we gebruik maken van anti-infectiva en antiparasitica.
Als er een afwijking van het hart ritme plaatsvindt noemen we het hartdysritme, hieronder verstaan
we een afwijkende prikkelgeleiding en kunnen we anti-arritmica (anti-dysritmica) gebruiken om het
hartritme te herstellen.
Er kunnen ook hartfalen ontstaan door probleem met de kleppen (klep insufficiëntie) en bij
cardiomyopathie. Hier is de hartminuutvolume afwijkend en die kun je herstellen door het gebruikt
van hartglycoisden; fosfodiesteraseremmers en ACE-remmers.
Hartritme:
Het hartritme wordt bepaald door een cascade van elektrofysiologische processen, de structuur die
hier voor verantwoordelijk is, zijn de spanningsafhankelijke ionkanalen, en kunnen we dus met
farmaca de functie van de ionkanalen beïnvloeden (bijvoorbeeld de calcium instroom, natrium
instroom of de kalium uitstroom).
Er zijn veel oorzaken die hartritme stoornissen kunnen veroorzaken, het kan aangeboren zijn, of
komen door stress (dit komt vaak bij paarden voor). Het kan ook door een hypokaliemie komen of
door de bijwerking van geneesmiddelen, maar ook sommige toxische planten kunnen hartritme
stoornissen opwekken, bij paarden krijgen ze deze toxische planten binnen door het opeten ervan,
maar katten gaan er vaak mee spelen of water uit een vaas drinken.
Deze middelen ga je gebruiken bij een onregelmatig hartritme.
1. Remmers van natrium instroom
2. B1- adrenoceptor antagonisten
3. Remmers van kalium uitstroom
4. Calcium antagonisten
Anti-aritmica:
Supraventriculair: ga je een calcium antagonist gebruiken (diltiazem)
Boezemfibrilleren: digoxine
Ventriculair: natrium instroomblokkers (lidocaine, fenytoine)
Supra-ventriculair en ventriculair: natrium instroom blokkers, kalium uitstroom blokkers(sotalol),
beta-1 bokkers (sotalol)
Myocard:
Bij primaire en secundaire functiestoornissen van de hartspier ontstaat er vaak een verminderde
contractie kracht en een verhoogde preload (einddiastolische volume). Uiteindelijke gaan er
hartfalen onstaan.
Medicatie:
Om de hartfalen te verbeteren wil je de hart work-load reduceren door het dier te laten rusten, ook
wil je de zuurstof concentratie verbeteren door vasodilatatie en een inotroop werking op de hart. Dit
kan door de contractiekracht van het hart te verbeteren, de oedeem te reduceren en het perifere
weerstand te verlagen.
Groep 1: contractiekracht verbeteren (positief ionotroop werking)
Digitalis-glycosiden
Dit remt het Na-K-ATPase, hierdoor blijft er meer calcium in de cel en dat leidt tot een betere
contractie van het hart. Digoxine kan niet bij alle diersoorten gebruikt worden, en dus bij katten
moet je een alternatief vinden.
Bij deze medicijn is het van belang dat je TDM (therapeutische drug monitoring) en dus de
bloedspiegels meet om de optimale dosis te vinden. Het is van belang dat je vooral kijken naar eet
gedrag van de hond, als dat goed gaat, is de dosis goed, bij te hoge dosis gaan de honden braken,
anorexia, diarree en artimieen. De gewenste werking van het farmaca is een verhoging van de
vagotonus en dus een daling van de hartfrequentie.
B1- sympathicomimetica (dobutamine)
Deze verhoogd ook de intracellulaire calcium hoeveelheid maar het heeft een groot hoeveelheid
zuurstof, glucose en ATP nodig. Het wordt dus niet langdurige gegeven omdat dan juist het hartspier
achteruit gaat, dus alleen bij acuut gevallen geven.
Fosfodiesterase remmers: (pimobendan)
Deze inactiveren de enzym (fosfodiesterase) die cAMP inactiveren, hier door is er meer cAMP
intracellulair en dus ook een toename in de calcium concentratie. Hierdoor heeft het ook een
positieve inotrope werking op het hart (beter contractie), daarnaast wordt ook het myocardcel
gevoeliger voor calcium en ontstaan er vasodilatatie.
Groep 2: perifere weerstand verlagen (oedeem verlagen)
ACE-remmers: remmers van angiotensine-converting enzym
Wordt vaak bij oudere honden gebruikt, het stopt het omzetten van angiotensine 1 in angiotensine
2, waardoor de RAAS systeem onderdrukt wordt en daarom neemt de pre en afterload af, en
uiteindelijk is er een verlichting van de hartarbeid.
Diuretica: middelen die de uitscheiding van vocht bevorderen
Vermindering circulerend volume door vocht uit het lichaam drijven (urine-volume neemt toe).
Hierdoor neemt ook de pre- en afterload af. Deze middel wordt niet meer voor het rest van het leven
gegeven en het wordt alleen gegeven wanneer het moet.
Groep 3:primair effect op de bloedvaten (vasodilatatie)
Organische nitraten: (NO)
Bekijk syllabus samenvatting
Alfa-1-adrenoceptor antagonisten:
Bekijk syllabus samenvatting
Therapiekeuzes: wordt op de basis van de ernst van de aandoening
Class 1: asympotmatic (geen verschijnselen)
Class 2: mild tot matig hartfalen: exercise intolerance, coughing, dyspnea, ascites
Class 3: gevorderd hartfalen: severe dyspnea, marked ascites, hypoferfusion at rest
Samenvatting syllabus Circulatie
Bij vogels en vooral papegaaien worden cardiale bijgeluiden vaak niet onderkent. De hoge hartslag
en de belemmering van de luchtzakken voor beeldvorming zijn hier oorzaken van.
Cardiale bijgeluiden
Inleiding
Hart auscultatie
• Regelmaat
• Intensiteit van de harttonen
• Bijgeruisen
Puncta maxima PM, zijn de plaatsen op de thoraxwand waar de sluiting van de kleppen
(harttonen) het best gehoord kunnen worden.
Bij bijgeluiden onderscheiden systolische en diastolisch en daarbinnen nog vroeg,mid, eind of
holo/pan wat de gehele duur betekent.
Bijgeruisen:
Cardiale oorsprong (souffles). Wervelingen van het bloed. Turbulentie. Deze souflle wordt
beschreven aan de hand van een aantal kenmerken: intensiteit (1-6), fremitus bij palpatie van de
ictus cordis, punctum maximum, tijdstip van de souffle, toonhoogte, aard. Bij verschillende
ziektebeelden kan een karakteristieke souflle te horen zijn. We kunnen de soort afwijking en de
lokatie (punctum maximum) dan vaststellen. De intensiteit van het bijgeruis geeft informatie of de
ernst.
- Functionele geruisen: Bijgeruisen in een gezond hart. Worden veroorzaakt door
veranderingen in de stroomsnelheid of in de viscositeit. Hoe sneller de bloedstroom en hoe
dunner het bloed, des te luider een bijgeruis wordt. Vb. is anemie, bloed wordt dunner.
Vooral hoorbaar op de aortaklep omdat het bloed hier onder fysiologische omstandigheden
het snelst stroomt. (koliek / koorts). Omdat jonge dieren een wat lager hematocriet en hoger
slagvolume hebben kunnen er bij hen ook bijgeruisen worden waargenomen.
- Organische geruisen: worden veroorzaakt door bijvoorbeeld klepgebreken die stenose of
klepinsufficiëntie tot gevolg hebben, of door shunts.
Extracardiale oorsprong
- Klotsgeluiden t.g.v. een traumatische pericarditis (bruits de glou glou)
- Krakende geluiden bij een pleuritis
Ondanks deze opties moet voor een definitieve diagnose vaak gebruik gemaakt worden van een
echocardiogram met kleuren en spectraal doppler.
Fysiologische of functionele bijgeluiden bij het paard
Functionele bijgeluiden hebben geen pathologische oorsprong en worden flow murmur genoemd.
Vaak bij koliek of koorts, en worden erger bij verdere hemodynamische veranderingen.
De grootte van het paardenhart, de grote volumina die rondgepompt worden en de viscositeit van
paardenbloed dragen bij aan de veelvuldig waarneembare flow murmurs met als PM meestal die van
de aortaklep bij het paard. Ook honden hebben echter fysiologische bijgeluiden. Bij andere
diersoorten zien we dit minder vaak.
Voorbeelden:
-
Gespleten 1e harttoon mitralis en tricuspidalis sluiten niet gelijktijdig. Is normaal bij
paarden. (kan ook de start zijn van een pathologisch probleem)
-
Gespleten 2e harttoon pulmonalisklep en aortaklep sluiten niet gelijktijdig. Bij het paard
meestal niet pathologisch. Wel pathologisch bij ernstige pulmonale hypertensie.
-
Een zachte vroegdiastolische souffle als gevolg van een snelle vulling van de ventrikels is bij
het (jonge) paard een normale bevinding. PM bij mitralis of tricuspidalis. Bij het rund kan een
souffle op de pulmonalisklep zonder betekenis voorkomen.
-
Een continue souffle bij veulens tot 3 dagen post partum is een veel voorkomend verschijnsel
als gevolg van het nog niet volledig gesloten zijn van de ductus arteriosus.
Pathologische bijgeluiden
Echografisch kunnen veelvuldige geringe kleplekkages gezien worden die geen klinische betekenis
hoeven te hebben. Sterker nog, als er verder geen afwijkingen zijn, leiden kleplekkages zelden tot
klinische problemen.
Systolische bijgeluiden:
Oorzaken klepafwijkingen
- Endocardiose (=klepverdikking)
- Prolaps van de klep (instulping de klep)
- Geruptureerde chorda tendina ( peesbandje van de hartklep)
- Congenitale malformatie
- Bacteriële endocarditis
Systolische bijgeluiden kunnen op alle kleppen voorkomen, maar een pulmonalisklep afwijking wordt
meestal niet gevonden bij auscultatie en alleen met echo. Pathologische afwijkingen van de
pulmonalisklep zijn zeldzaam. Wel pathologisch als het samengaat met pulmonale hypertensie,
vergroting van het hart of atriumfibrillatie. Pulmonale hypertensie kan ook leiden tot een systolische
souffle op de tricuspidalis.
Secundair aan een dilaterende cardiomyopathie of een myocarditis kan door het wijd worden van de
annulus fibrosus de mitralis of tricuspidalis gaan lekken. Een aortastenose is bij het paard en rund
zeldzaam, en dan meestal het gevolg van een endocarditis (rund vaak rechter AV-klep)
Diastolische bijgeluiden:
- Soms fenestraties (gaatjes) van de aortakleppen diastolische souffle congenitale
anomalie en is meestal zonder klinische consequenties.
- Aorta-insufficiëntie komt wel vaak voor klepdegeneratie (het meest) / bacteriële
endocarditis / ventrikelseptumdefect. Kenmerkt zich door luide holodiastolische souffle, kan
samen gaan met een steile pols (Pd wordt lager)
- Pulmonaal-insufficiëntie diastolische bijgeluiden. Bijgeluiden komen nauwelijks voor.
Continue bijgeluiden:
Dit is een bijgeruis gedurende het hele hartcyclus, een aandoening die daarmee gepaard gaat is een
persisterende ductus arteirosus.
Ritmestoornissen
Inleiding
Geleidingssysteem van het hart
- Sinusknoop: in de wand van het rechter atrium en bestaat uit spier en zenuwweefsel. De
depolarisatie induceert de hartslag en regel de intervallen tussen de hartslagen.
Atrioventriculaire knoop: rechterkant van het atriumseptum. De enige structuur waarbinnen
de depolarisatiegolf gaat van atrium naar ventrikel kan verspreiden.
- Bundels van His: komt uit de AV-knoop. Zijn spiervezelbundels die aan beide zijden
subendocardiaal van het ventrikelseptum naar de apex van het hart gaan. De Purkinje vezels
bij het paard zitten vertakt door het ventrikel en niet in 2 "paden" hetgeen verklaart waarom
er met het ECG bij het paard niet snel een linker of rechter hart falen/ probleem te zien is en
bij mens en GD wel.
Aritmieën onregelmatigheden in het hartritme. Ontstaan als gevolg van abnormale prikkelvorming
of prikkelgeleiding. Zijn niet altijd pathologisch! ECG nodig voor de zekere diagnose, maar bij klinisch
onderzoek kunnen ook een aantal afwijkingen vastgesteld: onregelmatige pols / inequale pols /
polsuitval / tachycardie / bradycardie.
-
Fysiologische aritmieën hebben een functie in de regulatie van de bloeddruk ontstaan o.i.v. de
vagotonus (overheersende parasympathicus) en verdwijnen bij gepaste arbeid. Deze komen veel
voor bij het paard.
Stoornissen in de prikkelvorming
1. Sinusritme normale ritme. Prikkelvorming is afkomstig van de sinusknoop (P-top) en de
hartfrequentie in rust valt binnen de referentiewaarden van de betreffende diersoort.
Voorafgaand aan de QRS-top is altijd een P – top en het interval P-R is altijd gelijk. Ook de
polariteit van de P-top hoort gelijk te zijn. Wanneer aan deze voorwaarden voldaan is kunnen
we twee afwijkingen tegen komen die niet altijd pathologsich zijn:
a. Sinusbradycardie hartfrequentie is lager dan de ondergrens van de
referentiewaarden. Normaal tijdens slapen, maar ook door extra-cardiale oorzaken
als hyperkaliëmie, hypothermie of verhoogde intracraniale druk.
b. Sinustrachycardie hartfrequentie is hoger dan de bovengrens van de
referentiewaarden. Normaal tijdens inspanning maar ook bij pijn, stress,
hypovolemie, anemie, hartfalen, hyperthermie of hyperthyreoïdie.
Bij een sinusaritmie is er een onregelmatige onregelmatigheid in de activatie-intervallen van de
sinusknoop. Deze activatie wordt vooral langs neurogene weg beïnvloed en indiceert een
parasympathicotonus. Sinusaritmie is normaal bij honden / paarden. Verdwijnt als de sympaticotonie
toeneemt, dus tijdens arbeid of na toediening van een parasympaticolyticum (Buscopan)
Een vorm van sinusaritmie is de respiratoire sinusaritmie. Tijdens inspanning is de hartfrequentie
sneller dan tijdens de uitademhaling. Veroorzaakt door variërende vagustonus tijdens de ademhaling
maar heeft dus wel een duidelijk ritme. We zien het vooral bij jonge honden/paarden/runderen,
oudere paarden/runderen vrijwel nooit.
Bij paarden kan direct na inspanning een aritmie of zelfs AV-blok optreden als gevolg van een
disbalans tussen parasymphaticus en symphaticus.
Sinustachycardie / sinusbradycardie / sinusaritmie zijn meestal fysiologisch. Soms een onderliggende
oorzaak, die uiteraard wel behandelen.
2. Supraventriculaire extrasystolen / supraventriculaire tachycardie
Abnormaliteiten in de prikkelvorming kunnen tot het ontstaan van extrasystolen leiden. En kunnen
Supraventriculaire extrasystolen (SVES) of Ventriculaire extrasystolen (VES) zijn afhankelijk van waar
de prikkel vandaan komt. In beide gevallen komt de prikkel ergens anders vandaan dan de
sinusknoop. ECG nodig om onderscheid te maken. Voor een onderscheid tussen beiden is een ECG
nodig.
SVES prikkel komt van het supraventriculaire gebied (LA / RA / AV-knoop). QRS normaal omdat de
route van depolarisatie voor de ventrikels hetzelfde is. P toppen abnormaal (afwezig of negatief of
verkeerde plaats). Kunnen ontstaan door abnormaliteiten in de wand van de atria (uitrekking).
Enkele SVES hoeven niet behandeld te worden. Veroorzaken geen hemodynamische stoornissen.
Supraventriculaire tachycardie Als meer dan drie SVES achter elkaar in een rij staan. Een
supraventriculaire tachycardie met een zeer hoge HF kan op korte termijn tot hypotensie leiden
zwakte / flauwte. Toedienen van een anti-arritmica is dan nodig.
3. Atriumfibrillatie = supraventriculaire aritmie.
Er ontstaat geen gecoördineerde depolarisatie van de atria, maar een trilling met een frequentie van
rond de 500 depolarisatiegolven per minuut. Meest voorkomende pathologische ritmestoornis bij
het paard, en kan bij paarden en honden zonder onderliggende hartafwijking ontstaan. We spreken
dan over lone-fibrillatie. Kan echter ook het gevolg zijn van een onderliggende hartaandoening zoals
vergroting van linker/rechter atrium, cardiomyapathie of myocarditis. Bij het rund en paard ook als
gevolg van verkeerde elektrolytenbalans.
Een aantal nadelige effecten:
o Geen goede atrium contractie (normale bijdrage van atrium aan ventrikel vulling =
10-30%) ventrikelvolume daalt slagvolume daalt. (kan bij honden tot
verminderd uithoudingsvermogen leiden)
o Kan overslaan in een ventrikelfibrillatie en dus een sterke tachycardie
Kortere diastole geeft onvoldoende ventrikelvulling en kleiner SV
Door kortere diastole is de bloedvoorziening van het myocard onvoldoende,
waardoor ischemische gebieden kunnen ontstaan.
Langdurig tachycardiegeïnduceerde cardiomyopatie.
Verdenking gebaseerd op: onregelmatige pols met polsuitval. Lijkt dus op sinusaritmie. Maar
atriumfibrillatie blijft na arbeid bestaan. Bij hartauscultatie een onregelmatige onregelmatigheid met
normale HF en bij GD een verhoogde HF. ECG is bevestigend. Bij het rund kan op auscultatie het
onderscheid al gemaakt worden.
Aan de ECG zien we: Geen P-toppen. Zijn vervangen door atriumoscillaties die onregelmatig van
vorm en frequentie zijn: f-waves met een frequentie van 300-500 p/min. QRS normaal maar wel een
onregelmatig venrtikelritme. Prikkelgeleiding via normale weg.
Behandeling
o Controle van de ventrikelfrequentie (anti-arritmica bijv. dixogine wat de
ventrikelfrequentie omlaag brengt)
o Herstellen van het sinusritme (medicamenteus: chinidine of elektrische cardioversie)
Bij het rund is de atriumfibrillatie vaak revesibel, bij het paard soms. Wanneer de onderliggende
oorzaak wordt aangepakt natuurlijk wel.
4. Ventriculaire extrasystolen VES, komen vanuit een autonome focus van de linker of rechter
ventrikelwand en is een onregelmatige onregelmatigheid. Depolarisatie van de ventrikels
niet via Bundel van His en Purkinje-netwerk afwijkende QRS- complexen tijdens de
extrasystole. Grote T-toppen en geen P-toppen.
Oorzaken:
o Cardiaal
GD: cardiomyopathieën / concentrische hypertrofie van de ventrikels
(stenose)
Paard en rund: Myocarditis
o Extracardiaal heel divers
Hypokaliëmie / hypercalciëmie/hypoxie / shock/ digoxine intoxicatie/
endotoxiemie/monensine-intoxicatie.
We spreken van een ‘accelerated’ idioventriculair ritme wanneer meer dan 3 VES achter elkaar maar
HF binnen de referentiewaarden. Ventriculaire tachycardie is ook meer dan 3 VES achter elkaar maar
HF te hoog. Een ononderbroken verntriculaire tachycardie kan zelfs weer tot een regelmatig
hartritme leiden. De pols is zwak en inequaal, zwakte, flauwte en een ventriculaire tachycardie kan
tot sterfte leiden.
Spoedeisende anti-arritmische behandeling. Intraveneuze toediening van lidocaïne onder continue
ECG begeleiding. Paard: fenytoine ook een alternatief.
5. Ventrikelfibrillatie: ventrikelmusculatuur trekt niet meer gecoördineerd samen, waardoor de
CO zeer laag! Soms binnen enkele seconden tot de dood geleid, maar duurt maximaal enkele
minuten. Door de ernstige hypotensie krijgt geen enkel orgaan voldoende bloed, dus ook
hart en hersenen. Het dier is buiten bewustzijn / gaat zich strekken / lucht happen /
bleekblauwe slijmvliezen / geen voelbare pols / geen harttonen / mydriasis (verwijding
pupil). Urineren en defeceren kunnen optreden.
Behandeling: elektrische defibrillatie, alle myocardcellen worden dan gelijktijdig gedepolariseerd. De
talrijke lokale depolarisatiegolven worden dan opgeheven.
Geleidingsstoornissen
1. Sino-atriale blok: de geleidingsoverdracht van de prikkel uit de sinusknoop naar het
atriummusculatuur is vertraagd. Tijdelijke onderbreking, fysiologisch en toevalsbevinding.
Komt bovendien zelden voor. Pauzes in de hartactie welke regelmatig kunnen optreden.
Onderscheid met sinusaritmie is een onregelmatige onregelmatigheid (verschil) en een
regelmatigheid bij SA-blok. Maar na arbeid of na parasympaticolyticum verdwijnen beide
aritmieën.
2. Atrioventriculaire blok= AV-blok. Is de impulsoverdracht van de atria naar de ventrikels
gestoord. 3 Graden in ernst waarvan alleen de 3e pathologisch is. Bij paarden komen
storingen in de AV geleiding veel voor door de hoge vagustonus, die het paard van nature in
rust heeft.
o AV-blok 1e graad: atrio-ventriculaire geleiding is vertraagd. PQ-tijd is langer dan
normaal. Beschreven bij getrainde mensen en paarden. Fysiologisch.
Toevalsbevinding bij een ECG.
o AV-blok 2e graad: De atriumpolarisatie (P-top) wordt niet elke keer door een
ventriculaire depolarisatie gevolgd (QRS-top). De P-top kan, zeker bij het paard, als
een 4e hartetoon worden waargenomen. Kan leiden tot een regelmatige
onregelmatigheid. Kan door een afwijking van de AV-knoop ontstaan of verhoogde
vagustonus of digoxine (vingerhoedskruid) intoxicatie. Komt bij paarden veel voor
maar geeft geen uitsluitsel over een eventueel onderliggende pathologische oorzaak.
Ook zegt het niets over de kwaliteit van de hartspier. Kenmerkend zijn uitvallen van 1
of meer polsgolven. Aritmie verdwijnt na voldoende arbeid. Of de oorzaak van een 2e
graads AV-blok een verhoogde vagustonus of een aandoening van de AV-knoop is,
kunnen we achterhalen door een kortwerkend parasympaticolyticum toe te dienen,
waardoor het effect van de n. vagus tijdelijk wordt uitgeschakeld.
o AV-blok 3e graad: Zeldzaam bij alle diersoorten voorkomend, maar pathologisch!
Depolarisatie van de atria wordt nooit door een depolarisatie van de ventrikels
gevolgd. Daardoor zorgen distale pacemakers voor de depolarisatie van de ventrikels
(idioventriculair ritme). Deze pacemakercellen (in distale deel van AV-knoop en
Purkinje vezels) hebben een veel lagere pacemakerfrequentie vergeleken met de
sinusknoop. Zorgen dus voor een minimale CO.
Op een ECG nemen we regelmatige P-toppen waar, en ook een regelmatige maar veel te lage
ventrikel (QRS) activiteit. De vorm van QRS kan normaal of afwijkend zijn. De lage frequentie kan
leiden tot hypotensie onder andere in de hersenen (flauwte) en wordt bij belasting weinig hoger. De
arbeidstolerantie is dus zeer laag.
Bij onderzoek zien we een zeer lage en regelmatige polsfrequentie. Er ontstaat een bradycardie
hypotensie. Dit kan leiden tot flauwtes, zwakte en verminderd uithoudingsvermogen.
Door bradycardie ontstaat ook een te lange vullingstijd van de ventrikels, die als een volumebelasting
wordt beschouwd. Dit leidt op langere termijn tot congestief hartfalen. Verhoging van de HF kan
alleen maar met het implanteren van een pacemaker, waarna de ventrikelfrequentie wordt bepaald
door het signaal dat de hoogste frequentie dicteert.
Hartfalen
Inleiding
Cardiovasculaire systeem is verantwoordelijk voor
o Normale arteriële bloeddruk (1e prioriteit)
o Een normale doorstroom naar de periferie (weefselperfusie) (2e prioriteit)
o Normale druk in het veneuze en capillaire systeem (3e prioriteit)
Belangrijkste is het op peil houden van de arteriële bloeddruk!
Vb: Mitralisklepinsufficiëntiedeel van het bloed stroomt van LV terug naar LASV wordt dus
kleinerBloeddruk daaltDit nemen baroreceptoren waarLichaam gaat bloeddruk herstellen
door vasoconstrictie m.b.v. het sympatisch zenuwstelselVasoconstrictie verhoogt de nabelasting
van het LVSV wordt kleinerbloedstroom naar de periferie wordt minder zodat arteriële
bloeddruk kan normaliserenNu 2e prioriteit verbeterenRAAS-systeem wordt geactiveerdvocht
wordt vastgehoudenmeer plasmavolumeeinddiastolisch volume LV gaat omhoogdus ook het
SV gaat omhoogdoor verhoogde EDV in LV gaat ook de druk in de vv. pulmonales omhoog3e
prioriteit wordt genegeerd, veneuze bloeddruk stijgtcardiaal longoedeem. (Congestief linker
hartfalen, decompensatoir)
Congestief linker en rechter hartfalen
Congestief hartfalen vochtophoping in bepaalde gebieden in het lichaam als gevolg van een
ernstige hartziekte
- Afwijkende functionerende kleppen
- Myocard
- Aangeboren hartafwijking (PDA)
- Linker congestief hartfalen: drukverhoging LAdruk verhoging vv. pulmonalesvocht
hoopt op in het interstitiumvervolgens in de alveoli van de longencardiaal longoedeem.
- Rechter congestief hartfalen: drukverhoging RAstuwing vv.jugulares en hepatomegalie
(lever vergroting) door leverstuwingleverstuwing veroorzaakt ascites. Bij grote dieren is
ook perifeer oedeem het gevolg in weefsels die losmazig zijn (kossum, tussen kaaktakken,
uier).
Ascites bij rechterhartfalen is gemodificeerd transudaat; dunne gele of roze vloeistof vanwege zijn
hoge bloedcel- en eiwitconcentratie. Eiwit is afkomstig uit de gestuwde ruimte van Disse
(spleetvormige ruimte tussen de levercellen en sinusoïden), waaruit hepatische lymfe door het
leverkapsel in de buikholte lekt.
Liquothorax kan ook bij rechterhartfalen optreden teveel vocht in de borstholte wat ook
gemodificeerd transudaat afkomstig uit het darmlymfe is, soms in combinatie met ascites. Daarbij
wordt ook vaak een geringe hoeveelheid vocht in het pericard gevonden. Bij katten kan een
liquothorax ook het gevolg zijn van linker hartfalen, omdat de lymfedrainage van de viscerale pleura
bij de kat niet in het rechter maar linker atrium uitmonden.
Verder moet vermeld worden dat bovenstaande niet geldt voor vogels, deze hebben geen diafragma
dus geen liquothorax. Wel hebben ook vogels last van ascites.
De mechanismen voor congestief hartfalen zijn voor links en rechts hetzelfde, dus als voorbeeld
alleen de linker beschreven.
Congestief linker hartfalen treedt op als de druk in de vv. pulmonales sterk stijgt. Omdat tussen de
vv. pulmonales en het LA geen klep zit, is de druk in het LA evenhoog als in de vv. pulmonales. Omdat
de mitralisklep tijdens de diastole openstaat, is de druk in het LV en het LA evengroot. Dus bij
verhoging van de diastolische druk in het LV gaat de druk in de vv. pulmonales ook omhoog.
2 grote groepen van ziekten die tot linker hartfalen leiden zijn: een verhoogde diastolische druk in
het LV door volumebelasting of diastolische dysfunctie.
- Volumebelasting voorbeelden: PDA / aortaklepinsufficiëntie / bradycardie ( te lange
vullingstijd, 3e graads AV-blok)
- Diastolische dysfunctie LV: hypertrofische cardiomyopathie (hart relaxeert slecht tijdens
diastole)
Congestief linker hartfalen kan zich acuut of chronisch ontwikkelen, afhankelijk van de
achterliggende hartziekte.
- Acuut: druk in LA stijgt heel snel, er is geen tijd voor vergroting van het LA.
- Chronisch: door chronische druk verhoging wordt LA vergroot.
Chronisch congestief hartfalen begint met het ziekteproces en dan gaat zich hartfalen ontwikkelen
dankzij de compensatiemechanismen. Door de onderliggende hartziekte daalt de arteriële bloeddruk
(cardiomyopathie, mitralisklepinsufficiëntie). Slagvolume daalt doordat bloed van LV naar LA terug
stroomt bij een mitralisklepinsufficiëntie of door dalende contractiliteit bij dilaterende
cardiomyopathie. Dus ook de systolische bloeddruk daalt. Bij acuut bloedverlies bijvoorbeeld speelt
de acute weg een grotere rol, bij bijv. een mitralisklepinsufficiëntie juist de chronische weg. De acute
drukveranderingen worden door de baroreceptoren in de aortaboog en a. carotis gedetecteerd
(activatie van het sympathisch zenuwstelsel).Terwijl een chronische drukverlaging het renineangiotensine-aldosteron systeem (RAAS) activeert (langzame hormonale regeling).
Chronische daling van het SV wordt in de nieren gesignaleerd. Door activatie van RAAS wordt
slagvolume groter door verhoging van het plasmavolume. Er wordt natrium en dus water
vastgehouden. ADH (arginine-vasopressine) uit de hypofyse speelt ook een rol voor het vasthouden
van vocht. Door verhoogde plasmavolumeexcentrische hypertrofie LVSV stijgt.
Door achterliggende hartziekte zal SV nooit helemaal herstellen, dus RAAS blijft actief. Lumen LV
wordt steeds groter door het volume (+/- 30% meer) (=excentrische hypertrofie) totdat het niet
groter kan grote stijging van de diastolische ventrikeldrukhoge druk in vv. pulmonaliscardiaal
longoedeem.
Longoedeem treedt op als het in de longcapillairen gefilterde vocht aan de arteriële kant niet meer
afgevoerd kan worden aan de veneuze zijde door de sterk vergrote druk in de vv. pulmonales aan de
veneuze kant en door de lymfevaten.
Verschijnselen:
Linker hartfalen:
Door longoedeem treedt een verstoorde ventilatie-perfusieverhouding in de longen op hypoxie.
Dit leidt afhankelijk van de ernst tot verminderde uithoudingsvermogen / benauwdheid / roze
schuim (in premortaal stadium)/ hoesten.
Hond: ademt snel en oppervlakkig zonder stridor, geluid en lijkt dus op hijgen. Hoesten door alveolair
longoedeem, ophoping vocht in de kleine bronchiën.
Paard: abdominale ademhaling door interstitieel longoedeem. Er worden geen ronchi gehoord,
snurkend geluid..
Kat: bij katten treedt meestal geen hoesten op.
Rechter hartfalen: hepatomegalie / stuwing van de vv. jugulares. Meestal zien we ook ascites /
liquothorax of perifeer oedeem (vooral rund en paard). Honden en katten krijgen zelden perifere
oedemen, dan denken we eerder aan een hypoalbumemie. Benauwdheid door vocht in de thorax /
paard koliek of wisselend dunne mest door stuwing van het splanchnisch vaatbed en rek op het
leverkapsel / sterk toegenomen buikomvang die undulatiepositief kan zijn bij ascites.
Diagnostiek
Linker hartfalen: op basis van de ziektegeschiedenis en het lichamelijk onderzoek van het circulatieen respiratieapparaat sterke verdenking. Bij congestief linker hartfalen worden vaak tachycardie /
vergrote ictus cordis / cardiaal bijgeruis of bij GD galopritme gevonden. Bewijs komt vanuit
röntgenfoto’s van de longen maken, samen met aanwijzingen voor stuwing pulmonaal vaatbed en
een vergroot LA. Voor de oorzaak is een echocardiogram nodig.
Rechter hartfalen: Kan door lichamelijk onderzoek van het circulatie-, respiratie- en digestieapparaat
worden vastgesteld. Om twijfel weg te nemen zien we levervenen en de vena cava caudalis verbreed
bij echografisch onderzoek. Oorzaak vaststellen met een echocardiogram.
Therapie:
Als de oorzaak van hartfalen niet weggenomen kan worden, moeten de patiënten levenslang
medicamenteus behandeld worden om de symptomen te onderdrukken. Wanneer de oorzaak
weggenomen kan worden zal een tijdelijke symptomatische therapie volstaan.
Linker hartfalen:
Zonder behandeling zal een patiënt die lijdt aan cardiaal longoedeem stikken.
- De enige manier om het vocht uit de alveoli te halen is het toedienen van een diureticum,
bijvoorbeeld furosemide. Door diurese gaat de druk in het LA dalen, waardoor meer vocht uit
het longinterstitium wordt afgevoerd. De negatieve interstitiële druk trekt vervolgens het
vocht uit de alveoli, die ook door de lymfevaten wordt afgevoerd.
-
Hok / boxrust (voorkomen van inspanning en stress) belangrijk bij elk benauwd dier door de
hypoxie die al in rust optreedt.
-
Toedienen van zuurstof via neussonde. De hogere zuurstofspanning in de alveoli zorgt onder
meer voor vasodilatatie van de longcapillairen en daardoor voor een afname van de
weerstand in de longen.
-
Parenterale vloeistoftoediening is bij GD gecontraïndiceerd. Bij het paard is een snelle of
hoog gedoseerde IV vloeistoftoediening gecontraïndiceerd.
Een optimale behandeling vereist echter de faciliteiten van intensive care, kennis van een internist of
cardioloog.
Rechter hartfalen:
Rechter hartfalen door een harttamponade (vloeistof in het hartezakje) is een spoedgeval. Door de
tamponade kan het hart zich involdoende uitzetten en verkleind de diastolische vulling van het hart.
Je behandeld deze met een specialist met een pericardiocentesis. Het gebruik van furosemide is
gecontrïndiceerd.
Er is geen enkel medicijn dat alle nodige effecten heeft waarmee chronisch linker en rechter
hartfalen optimaal behandeld kan worden. Daarom een combinatie van medicijnen: diuretica / ACEremmers / negatief chronotroop / positief inotroop.
Prognose: Bij sommige aandoeningen is het mogelijk om de oorzaak weg te nemen, maar volledig
herstel is niet te verwachten als er als verschijnselen van hartfalen zijn opgetreden. Dan is een
symptomatische behandeling de enige oplossing. Vanwege economische redenen is hartfalen bij LH
altijd infaust, slachten is dan ook niet meer zinvol.
Hartaandoeningen
Aangeboren afwijkingen
1. Persisterende ductus arteriosus (PDA): één van de belangrijkste afwijkingen bij de hond en
komt vaker bij vrouwelijke dan mannelijke honden voor (als één van de weinigen). Bij kat,
paard en LH zeer zelden voorkomend, maar bij het veulen enkele dagen na de geboorte nog
tijdelijk aanwezig zijn. Het is als na de geboorte een open verbinding blijft bestaan tussen de
aorta en de a. pulmonalis. Na de geboorte komt de sluiting van de ductus arteriosus tot stand
door contracties van spierweefsel in de wand van het vat. Het proces wordt beïnvloed door
bradykinines, prostaglandines en de arteriële O2-spanning. Bij de hond wordt de sluiting
verhinderd door het ontbreken van een musculaire laag in de ductus arteriosus.
Bij PDA stroomt een grote hoeveelheid bloed van de aorta via de open ductus arteriosus in de a.
pulmonalis. De extra hoeveelheid bloed veroorzaakt in de a. pulmonalis en longen meestal geen
problemen. Extra hoeveelheid bloed komt wel in LA en LV terecht volume belasting excentrische
hypertrofie. Door de dilatatie van de annulus van de mitralisklep ontstaat een secundaire
insufficiëntie van de mitralisklep. RA en RV blijven normaal. Geen behandeling resulteert in linker
hartfalen door decompensatie cardiaal longoedeem wegens de verhoogde einddiastolische druk
in het ventrikel.
Verschijnselen: Congestief linker hartfalen (hoesten / benauwdheid / verminderde
uithoudingsvermogen) in de leeftijd tussen enkele weken tot een half jaar. Pols: steile pols als gevolg
van de abnormale grote polsdruk
Auscultatie: continue en zeer luide souffle op de pulmonalisklep te horen. Mitralisklep meestal een
zacht systolisch geruis.
Diagnostiek: continue en zeer luide souffle op de pulmonalisklep. Echocardiogram omdat het
onderscheid met andere aandoeningen op auscultatie soms moeilijk is.
Therapie door specialist: op zo vroeg mogelijke leeftijd sluiting van de ductus arteriosus. Kan op 2
manieren:
1. Buitenaf met een ligatuur, afbinden bloedvat, open hart operatie.
2. Binnenuit door, via een in de aorta geplaatste katheter, een metalen spiraaltje of
parapluutje in de ductus te plaatsen.
Prognose: Als er nog geen hartfalen is gunstig! Volledig herstel. Minder gunstig op latere leeftijd
maar sluiting nog steeds aan te raden.
2. Pulmonalisstenose (PS): gelokaliseerde vernauwing van de a. pulmonalis. Het is een
congenitale afwijking die meestal berust op het verkleefd blijven van de randen van de
semilunaire kleppen (valvulaire PS). Het komt veel voor bij de hond, naast PDA en
aortastenose. Gelijke mate bij reuen en teven. Bij kat, paard en LH nauwelijk. Om ondanks de
nauwe uitstroom een adequaat SV te handhaven, moet de druk in het RV hoger zijn dan
normaal (isometrische hyperfunctie). Deze drukbelasting veroorzaakt een concentrische
hypertrofie van de RV. Omdat hierdoor de coronaire perfusie suboptimaal is, kunnen zich
ischemische gebieden ontwikkelen, wat tot ventriculaire tachycardie kan leiden. Hoe luider
bijgeruis, hoe kleiner de opening, hoe meer vernauwing, hoe ernstiger. De verschijnselen
hangen af van de ernst, van niets tot verminderd uithoudingsvermogen / flauwtes /
plotselinge sterfte.
Auscultatie: rauw systolisch stenosegeruis met PM in het klepgebied van de a. pulmonalis. De pols is
niet afwijkend. Stroomsnelheid en drukgradiënt berekening met doppler echo. Hoe groter
drukgradiënt, hoe ernstiger. Behandeling is met een ballondilatatie, verkleefde kleppen worden
opengescheurd, door een specialist.
3. Aortastenose (AS): komt het meest voor bij de hond (Newfoundlander, Boxer), bij varkens
vaak postmortaal gevonden, overige dieren meestal niet en dan alleen als gevolg van
endocartiditis. Het is een gelokaliseerde vernauwing in de uitstroombaan van het LV of de
stam van de aorta. Aangeboren of verkregen. De congenitale aortastenose berust op het
verkleefd blijven van de randen van de semilunaire kleppen (valvulaire AS), het te nauw zijn
van de aorta ascendens (supravalvulaire AS), of het ontwikkelen van een fibreuze ring in de
uitstroombaan onder de kleppen (subvalvulaire AS). De verkregen AS ontstaat als gevolg van
een stenoserende endocarditis van de aortaklep. Bij subvalvulaire AS wordt de ejectie van
bloed uit het LV belemmerd door een fibreuze ring die zich vormt onder de aortaklep. De
fibreuze ring is tijdens de geboorte nog niet aanwezig, maar gaat zich in de loop van de 1e
levensweken ontwikkelen en tijdens de groei verergeren. Ondanks de nauwe uitstroombaan
moet voor het handhaven van de SV de druk in het LV bij contractie veel hoger zijn dan
normaal (isometrische hyperfunctie). Drukbelasting concentrische hypertrofie. Hierdoor is
de coronaire perfusie (bloedvoorziening van de linker ventrikelwand) onvoldoende
ischemische gebieden en vervolgens tot een infarct en fibrose. Deze myocardveranderingen
zijn een ideale basis voor het ontwikkelen van ernstige ritmestoornissen (bijv. ventriculaire
tachycardie), die tot flauwtes en plotselinge sterfte kunnen leiden. Klinische problemen
hangen af van de ernst van de stenose. Geringe stenose normale levensverwachting
zonder klinische problemen. Ernstige aortastenose verminderd uithoudingsvermogen,
flauwtes, geen effectieve behandeling / dood voor 5e jaar / systolisch bijgeruis met PM op
aortaklep. Bovendien zijn deze dieren gepredisponeerd voor een endocarditis van de
aortaklep.
Diagnose bevestigen met doppler-echocardiogram, maar prognose is slecht.
4. Ventrikelseptumdefect (VSD): opening in het ventrikelseptum. Vanwege de hogere druk in
het LV wordt bloed tijdens elke contractie van het LV naar het RV geperst. Het volume en de
richting van de bloedstroom door de shunt hangt af van de drukgradiënt en de grootte van
het defect.
•
•
•
Klein VSD: links naar rechts shunt. Hart wordt niet overbelast.
Middel VSD: oppervlak van het defect is kleiner dan het oppervlak van de aortaopening.
Links naar rechts shunt. Resulteert in een volumebelasting van het LV, via de longen.
Bloed gaat van LVRVa. pulmonalislongenv. pulmonalisLALV: excentrische
hypertrofie.
Groot VSD: druk in LV en RV is gelijk. Cyanose.
Komt het meeste voor bij de kat, rund en paard maar zelden bij de hond. Meest voorkomende
aangeboren hartafwijking bij het paard / rund. Bij kleine defecten zijn er geen klinische
verschijnselen. Bij een middelgroot VSD treedt congestief linkerhartfalen op, soms samen met
rechter hartfalen`. Groot VSD treedt groeiachterstand / verminderd uithoudingsvermogen / cyanose.
Bij kleine en middelgrote defecten is een systolisch bijgeruis hoorbaar op alle kleppen met het PM in
het gebied van de tricuspidalisklep. Bij paard en rund valt op dat het PM ver naar voren ligt, tussen
tricuspidales en aorta in, maar ligt bij grote huisdieren dan wel rechts. Dieren met een klein VSD
hebben vanwege de grote weerstand van de kleine opening vaak een luid systolisch bijgeruis, dat
gepaard gaat met een fremitus.
Auscultatie biedt geen zekerheid en diagnose wordt gesteld m.b.v. een doppler-echocardiogram.
Kleine defecten hoeven niet behandeld te worden. Geen operatieve behandeling mogelijk.
Congestief hartfalen symptomatisch behandelen, behalve voor LH.
5. Tetralogie van Fallot (TF) het is bij alle dieren een zeldzame afwijking en omvat 4
afwijkingen:
a. Groot VSD
b. Pulmonalisstenose
c. Rechtsverplaatsing van de aorta
d. Concentrische hypertrofie van het RV
Door pulmonalisstenose krijg je de concentrische hypertrofie van het RV. Het groot VSD wekt
anatomisch de indruk dat de aorta naar rechts is verplaatst. Op deze manier komt veneus bloed uit
het RV in de grote circulatie, met als gevolg cyanose (blauwe slijmvliezen). Door de chronische
hypoxie treedt stimulering op van de erytropoëse door toename van de afgifte van renaal
erytopoëtine, met als gevolg erytrocytose, dus een hogere bloedviscositeit. De verschijnselen zijn
afhankelijk van de pulmonalisstenose, de grootte van het VSD en de erytrocytose. Deze kunnen
omvatten: slecht uithoudingsvermogen / groeiachterstand / dyspneu (vooral bij inspanning of stress).
Diagnose wordt gesteld m.b.v. een echocardiogram. Prognose is moeilijk wegens het weinig
voorkomen en dieren zijn meestal dood voordat ze bij de dierenarts komen.
Verkregen afwijkingen
Inleiding
Disfunctionerende kleppen komen vaak bij GD, P en LH voor, als gevolg van degeneratie of
ontsteking. Of en toe komen rupturen in de chorda tendinae voor als oorzaak voor de klepdisfunctie.
Misvormde kleppen laten tijdens hun sluitingsfase bloed teruglekken naar de achtergelegen
hartdelen. Ook kunnen de beschadigde kleppen zodanig door de ontsteking van vorm veranderen dat
ze als een partiële obstructie in de bloedstroom fungeren. Door deze functiestoornissen ontstaan ter
plaatse van de abnormale klep turbulenties in de bloedstroom, waarvan de geluiden zich
voortplanten naar de omgeving en bij de auscultatie als bijgeruisen van de hartactie worden
waargenomen. Omdat een klepaandoening doorgaans een progressieve belasting veroorzaakt van
een deel van het hart, kan dit leiden tot hartfalen. De diagnose is met behulp van een
echocardiografie (kleppen, ventrikels, atria in beeld) / doppler echografie (mate van lekkage).
Bij rund / varken regelmatige een endocarditis: oorzaak is meestal een bacteriële infectie. Bij een
rund is dan de ontsteking van de kleppen het belangrijkste. Bij andere diersoorten komt een
endocarditis niet heel veel voor.
Klepafwijkingen:
1. Myxomateuze degeneratie van de AV-kleppen: meest voorkomende hartziekte bij de hond.
Oorzaak is onbekend. Vooral bij kleine rassen vanaf het 5e levensjaar, maar ook bij grote
rassen en vaker bij reuen dan teven. Bij cavalier king spaniel leidt eigenlijk elke hond boven
het 10e levensjaar aan deze aandoening. De klepaantasting wordt gekenmerkt door
degeneratie van collageen en afzetting van proteoglycanen en glucosaminoglycanen in de
klep. De ziekte is progressief. De aandoening misvormt de kleppen. Ze kunnen zich niet meer
goed sluiten, waardoor klepinsufficiëntie optreedt. In 2/3 van de gevallen wordt alleen de
mitralisklep aangetast. In 1/3 van de gevallen mitralisklep + tricuspidalisklep. Heel soms
alleen tricuspidalis.
In alle gevallen worden ook de chordae tendinae aangetast. De afwijkende chordae kunnen
ruptureren, waardoor een stuk van de klep tijdens de systole in het atrium valt (klepprolaps). Een
ernstige mitralisinsufficiëntie veroorzaakt een daling van de arteriële bloeddruk, die via
neurohormonale compensatiemechanismen (RAAS) resulteert in een stijging van het circulerend
volume. Mitralisinsufficiëntie leidt tot een volumebelasting van het LV. De resulterende verhoogde
diastolische druk in het LV veroorzaakt een vergroting van het LA cardiaal longoedeem met
hoesten en dyspneu. In een vroeg stadium, wanneer het atrium nog niet tot een maximum is
opgerekt, kan ook hoesten optreden, maar dat komt omdat het vergrote linker atrium tegen de
hoofdbronchus aandrukt en een mechanische prikkeling wordt opgewekt.
Insufficiëntie van de tricuspidalisklep resulteert in een volumebelasting van het RV en als het ernstig
genoeg is een verhoging van de CVD.
Verschijnselen: Pas bij congestief hartfalen zien we verschijnselen, deze kunnen links (verminderde
uithouding, kortademig, hoesten) of rechts (ascites) zijn.
Diagnose: Auscultatie van het hart is een systolische souffle te horen met het PM in het gebied van
de mitralisklep. Souffle kan uitstralen naar de rechter thoraxwand. Hoe luider het bijgeruis, des te
erger de klepinsufficiëntie. Echocardiogram en thoraxfoto bij hoesten en benauwdheid.
DDx, thoraxfoto essentieel bij DDx voor hoesten. Mitralisinsufficiëntie kan ook veroorzaakt worden
door:
o Dilaterende cardiomyopathie
o Endocarditis
o Mitralisklepdysplasie
o Verder bij hoesten denken aan chronische luchtwegaandoening bij oudere honden
Therapie: Honden die geen verschijnselen van congestief hartfalen vertonen hoeven niet behandeld
te worden. Er is geen medicijn bekend, waarmee we de progressie van de ziekte kunnen beïnvloeden
en ontstaan van congestief linker hartfalen kunnen uitstellen. Ernstige klepveranderingen kunnen
met open hart chirurgie behandeld worden.
Prognose; De behandeling van congestief hartfalen kan de ernst van de verschijnselen verminderen,
maar de klepafwijkingen blijven bestaan. Tussen ontstaan van verschijnselen en hartfalen kan enkele
jaren zitten. Bij ernstig longoedeem overlijden de meeste patiënten binnen ¾ jaar, ondanks
medicamenten.
2. Klepaandoeningen bij het paard: stoornissen in de sluiting van de kleppen komen regelmatig
voor, er worden bijgeruisen waargenomen maar geen klepafwijkingen bij lekkage.
Training kan een subklinische lekkage van de tricuspidalisklep induceren.
Degeneratieve klepveranderingen zijn de meest voorkomende oorzaak. Dit zijn knobbelige
afwijkingen aan de kleppen, die kunnen voorkomen langs de randen van alle kleppen. Ze leiden
echter lang niet altijd tot klepinsufficiënties. De etiologie van deze klepveranderingen is niet bekend.
Zowel een auto-immune reactie als een infectie met larven van Strongylus vulgaris worden genoemd.
Verder is een bacteriële endocarditis bij grote huisdieren een oorzaak van afwijkende kleppen, met
als gevolg insufficiëntie of stenosering. Veel stoornissen in de sluiting van de kleppen worden echter
volledig gecompenseerd. Als er in de loop van de tijd klinische verschijnselen ontstaan, betreft dit
meestal een mitralisklepinsufficiëntie als gevolg van de linksbelasting van de circulatie (linker
hartfalen, verminderde uithouding en hoesten). Een aorta insufficiëntie kan leiden tot een
prestatievermindering, overbelasting links, verminderde coronaire perfusie met als gevolg een
extrasystole tijdens de arbeid. Een aandoening aan de kleppen rechts (mits gering) leidt zelden tot
hartleiden maar kotm veelvuldig voor.
Hiernaast komt nog een ruptuur van de chordae tendinae / klepprolaps voor, met klinische
verschijnselen afhankelijk van ernst en locatie. Rechterhartfalen valt überhaupt bij grote huisdieren
eerder op dan linker hartfalen.
Vergroting van de atria als gevolg van aanpassing van de volumebelasting door de klepregurgitatie is
bij het paard (in combinatie met de van nature hoge vagustonus) een predisponerende factor voor
het ontstaan van atriumfibrillatie. Soms worden fenestraties in de kleppen gevonden waarnij lekkage
optreedt. Kleine defecten hebben meestal geen klinische gevolgen.
Endocard afwijkingen
Endocarditis: ontsteking van het endocard. Binnenkant van het hart, het endotheel.
Meestal zijn de kleppen aangetast: endocarditis valvualis, maar soms ook de wand (endocarditis
parietalis) of de chordae tendinae (endocarditis chordalis). Komt regelmatig voor bij het rund en
varken, bij andere dieren niet zo vaak.
De oorzaak van endocarditis is bijna altijd een metastatische bacteriële infectie. Komt tot stand door
hematogeen transport van bacteriën. 2 Mogelijkheden
- Er is al een beschadiging van het endocard. Als er dan een bacteriemie optreedt De
bacteriën hechten zich vast aan het beschadigde endotheel.
-
Het dier lijdt aan een lokaal ontstekingsproces ergens in het lichaam, van waaruit bacteriën –
al dan niet gebonden aan embolieën van losgeraakte delen van trombi- met
ontstekingscellen in de circulatie komen. De embolieën worden door de bloedstroom in en
tegen het endotheel geperst en er ontwikkelt zich dan een lokaal ontstekingsproces. Het
endocard hoeft hierbij niet voorafgaand beschadigd te zijn.
Honden/paarden: meestal aorta- of de mitralisklep. Dit door de hogere druk en bloedstroomsnelheid
in de linker harthelft wat een grotere kans op endotheelbeschadiging geeft. Meestal vanuit een
bacteriemie met gram-positieve kokken.
Rund: meestal een endocardits rechterharthelft. Arcanobacterium pyogenes is de belangrijkste
veroorzaker. Deze bacterie komt meestal via trombi in de bloedbaan terecht. Deze emboli slaan dan
neer op de rechter AV-kleppen. De endocarditis in de linker harthelft ontstaat bij het rund vaak
vanuit een metastatische pneumonie, waarbij weer emboli met de bloedstroom mee
getransporteerd kunnen worden, met als gevolg een metastatische nefritis of artritis.
Varken: belangrijkste veroorzakers erysipelothrix rhusiopathiae en streptococcus suis.
De door de ontsteking beschadigde kleppen lekken tijdens hun sluitingsfase bloed terug, waardoor
klepinsufficiëntieontstaat. De beschadigde kleppen kunnen ook in hun functie worden belemmerd
door fibrineophopingen. Ook kunnen ze zodanig door de ontsteking van vorm veranderen, dat ze als
een partiële obstructie in de bloedstroom fungeren (stenose).
Er kunnen dan lokale turbulenties in de bloedstroom ontstaan die als bijgeruisen zijn waar te nemen.
Bij een ernstige tricuspidalisinsufficiëntie of pulmonalisstenose neemt de CVD toe. Bij een mitralis- of
aortaklepinsufficiëntie treedt volumebelasting van het LV op, die tot cardiaal longoedeem kan leiden.
Complicaties die vanuit de ontstekingsprocessen in het linker hart kunnen optreden, zijn uitzaaiingen
in de grote circulatie. Bijv. nefritis, artritis, naar de coronaire vaten myocarditis. Deze embolieën
zorgen niet alleen voor het verspreiden van de bacteriën, maar veroorzaken ook infarcten in de
organen waarin ze vastlopen. Zo kan dus ook een paralyse in de poot ontstaan (niet bij LH).
Verschijnselen: in het begin algemeen ziek. Daarna een intermitterende koorts / vermageren /
verminderd presteren.
Pas in een later stadium treden verschijnselen van een gestoorde hartfunctie op. Keupelheid treedt
op als gevolg van uitzaaiing van bacteriën (=septische artritis), en bij chronisch kan ook een
immuungemedieerde polyartritis optreden. Rund: daling van de melkgift / vermagering.
Afhankelijk van de aangetaste kleppen kan linker of rechter congestief hartfalen ontstaan. Brady- of
tachyaritmieën kunnen ontstaan door uitbreiding van de endocarditis naar een myocarditis met
aantasting van het geleidingsysteem of het ventriculaire myocard. Door trombo-embolieën kunnen
diverse verschijnselen optreden, afhankelijk van waar de embolie terechtkomt.
Diagnostiek: verdenking van endocarditis is sterk bij:
- stabiele of wisselende koorts.
-
Paard / rund: verhoogde CVD / tachycardie / embolische processen / cardiaal bijgeruis.
-
Bloedonderzoek: rechtsverschuiving van het witte bloedbeeld / sterk verhoogd totaal eiwit /
toegenomen γ-globulinefractie / positieve glutaaraldehydetest.
Definitieve diagnose: echocardiogram / herhaalde bloedkweken (bacteriëmie aantonen). Dit laatste
is ook nodig om een effectief antibioticum te kiezen.
DDx: oorzaken voor chronische koorts, andere hartaandoeningen en trombose van de vena cava bij
het rund.
Therapie: runderen met een endocarditis dienen te worden geëuthanaseerd. Bij GD (P) wordt
langdurend ( minimaal 2-3 mndn) antibiotica toegediend op basis van het antibiogram. Als er sprake
is van hartfalen, dan wordt dit symptomatisch behandeld. Immunosuppressiva zijn
gecontraïndiceerd.
Prognose: Runderen infaust. Bij het ontwikkelen van hartfalen bij GD is de prognose ongunstig.
Langdurige antibacteriële behandeling is nodig. De kleppen kunnen blijvend misvormd zijn, met als
gevolg blijvende circulatiestoornissen. Recidief is mogelijk van de bacteriën.
Myocard afwijkingen
Aandoeningen van het myocard leiden tot congestief hartfalen. Er zijn twee vormen:
- Myocarditis: Ontsteking van de hartspier, oorzaak is vaak bekend.
-
Cardiomyopathie: Een niet-inflammatoire aandoening van de hartspier, daardoor een
dysfunctie van het LV/RV.
1. Myocarditis: kan primair optreden als onderdeel van een virale, bacteriële of parasitaire
infectieziekte of secundair-metastatisch ontstaan vanuit een endocarditis (purulente
ontstekingshaarden) of ontstekingsprocessen elders in het lichaam. Een embolie veroorzaakt
in de hartspier meestal een anemisch infarct, dat dof en lichter van kleur is met vaak een
hemorragisch zoompje. De plaats waar een embolus vastloopt, bepaalt het effect op de
functie van het hart (pappilair spieren, prikkelgeleiding).
Vb. van infectieziekten die gepaard kunnen gaan met een myocarditis:
o MKZ :(myocarditis aphthosa). Nonpurulente ontsteking, tijgerhart. Bij jonge dieren
die daardoor plotseling kunnen sterven.
o CPV: puppy’s van 3 weken oud
o Paardeninfluenza vaak. Maar bij paarden ook virusarteriïtis, infectieuze anemie,
African horse Sickness (import)
o ECMV: encefalomycarditisvirus via een intra-uterien infectie bij het varken, is een
picornavirus van knaagdieren en transmissie door orale route na contact met
knaagdieren. Volwassen dieren geen symptomen, vruchten via intra-uterien sterven.
Beste preventie is het bestrijden van ratten en muizen.maar ook transmissie tussen
varkens.
o Trombo-embolie van een endocarditis bij het rund
o Salmonella gallianarum bij de kip: haardvormig niet purulent.
o Pasteurella spp., protozo Encephalitozoom cunuculi en Tyzzer’s disease bij
knaagdieren
Andere oorzaken voor myocardafwijkingen zijn: endotoxinemie, hypoxie, vitamine E-deficiëntie,
rhabdomolyse (spierbevangenheid) en monensin-intoxicatie.
Verschijnselen: naast sloomheid / soms koorts / anorexie de gevolgen van een systolische dysfunctie
of van pathologische aritmieën congestief linker of recthter hartfalen of plotselinge dood door
ventriculaire tachycardie en ventrikelfibrillatie.
Diagnostiek: Het klinisch onderzoek, bloedonderzoek, ECG en echografisch onderzoek leidt vaak
alleen maar tot een waarschijnlijkheidsdiagnose. De definitieve diagnose kan eigenlijk alleen maar
m.b.v. histopathologisch onderzoek van het myocard worden gesteld, klinisch dus hooguit een
verdenking.
Met een echocardiogram kunnen we de systolische dysfunctie van het LV waarnemen, maar ook een
te lage contractiliteit en een compensatoire excentrische hypertrofie.
DDx: cardiomyopathieën
Therapie en prognose: elimineren van de primaire oorzaak en symptomatische behandeling van het
congestief hartfalen en de aritmieën, door een specialist. LH behandeling om economische redenen
beperkt. Prognose GD niet altijd ongunstig.
2. Cardiomyopathieën (CM), zijn gegeneraliseerde myocardaandoeningen en kunnen
idiopathisch of met bekende oorzaak zijn. De primaire (idiopathische) CM zijn progressief
verlopende hartaandoeningen en komen het meest bij katten / honden voor. Bij het rund
komt een erfelijke aandoening voor, waarcshijnlijk gekoppeld aan het Red- Holstein gen. Bij
paarden wordt de term zelden gebruikt.
Dilaterende cardiomyopathie bij de hond (DCM): gekenmerkt door een systolische dysfunctie van
het LV of van beide ventrikels. Het myocard van de ventrikels is niet meer in staat om met een
voldoende kracht en snelheid samen te trekken. Het verlaagde SV, dat door de verminderde
contractiliteit ontstaat, leidt tot een daling van de arteriële bloeddruk. Dit leidt tot natriumretentie
en daardoor tot vasthouden van vocht (RAAS). De resulterende volumebelasting leidt tot
excentrische hypertrofie (dilatatie) van het betreffende ventrikel, waardoor het SV groter wordt
(compensatie). Door de dilatatie van het ventrikel (en daarmee de annulus van de AV-kleppen) treedt
insufficiëntie van de mitralis- of tricuspidalisklep op. De verhoogde diastolische druk in het LV leidt
uiteindelijk tot cardiaal longoedeem. In RV tot ascitis / liquothorax.
(bij de kip treedt zelden longoedeem op maar eerder een hydrops, een verschijnsel van rechtzijdig of
tweezijdig hartfalen)
Bij de hond: Vooral bij honden, grote rassen en cocker spaniëls. Reuen worden vaker aangetast dan
teven. Zowel bij jongvolwassenen als bij oudere dieren. De oorzaak van DCM is onbekend, maar een
genetische achtergrond speelt zeker een rol. Ook een reversibele vorm beschreven bij honden en
katten als gevolg van een taurine- of een L-carnitine-deficiëntie.
Verschijnselen: verminderd uithoudingsvermogen / hoesten / benauwdheid bij congestief linker
hartfalen en toename van de buikomvang door ascites of dyspneu (bemoeilijkte
ademhaling/benauwdheid) door liquothorax bij congestief rechter hartfalen.
Bij sommige hondenrassen kunnen ook flauwtes of plotselinge sterfte ten gevolge van ventriculaire
tachycardie gevolgd door ventrikelfibrillatie optreden. Bij rechter hartfalen treedt vaak vermagering
op ten gevolge van anorexie en spieratrofie.
Bij congestief hartfalen is de pols zwak en snel. Als atriumfibrillatie of VES ontstaan, is de pols ook
onregelmatig met polsuitval. In het eindstadium kunnen de slijmvliezen bleek zijn en is de CRT
verlengd. Cardiale shock treedt alleen maar op bij dieren met congestief hartfalen omdat het
behouden van de arteriële bloeddruk normaal prioriteit nummer 1 is.
Diagnostiek: De diagnose congestief rechter hartfalen wordt gesteld op basis van de verschijnselen
en de bevindingen bij het lichamelijk onderzoek. De diagnose DCM kan alleen worden gesteld m.b.v.
aanvullend onderzoek: echocardiografie door een specialist. Om de diagnose van congestief linker
hartfalen te kunnen stellen als oorzaak van verminderd uithoudingsvermogen, hoesten of
benauwdheid, zijn thoraxfoto’s nodig om de aanwezigheid van longoedeem en het vergrote LA vast
te stellen.
Therapie: Bij de behandeling wordt onderscheid gemaakt tussen acuut en chronisch congestief
hartfalen. Acuut hartfalen: direct ingrijpen door IV toedienen van diureticum (furosemide),
intranasale zuurstof en hokrust.
Chronisch hartfalen: diureticum (pimobendan), ACE-remmer en digoxine.
Prognose: DCM als gevolg van taurine- of L-carnitinedeficiëntie is reversibel, kan wel maanden
suppletie kosten. Idiopatische DCM heeft een ongunstige prognose. Die ziekte is progressief en de
hartspierafwijkingen zijn irreversibel. Met dagelijkse medicatie kunnen de patiënten wel een goede
kwaliteit van leven tot het sterven krijgen.
Hypertrofische Cardiomyopathie (HCM) bij de kat:
Bij HCM, ontstaat een sterke hypertrofie (verdikking) van de hartspiervezels (concentrische
hypertrofie) van de LV-wand. Deze veroorzaakt een verminderde compliantie van het ventrikel met
een diastolische dysfunctie als gevolg. Dit komt tot uiting in onvoldoende relaxatie van het ventrikel
tijdens diastole. De diastolische vulling van het afwijkende LV gaat met een hoge druk gepaard (dikke
wand, klein lumen): congestief linker hartfalen.
HCM komt het meest voor bij katten ( meest voorkomende hartaandoening) / vleeskippen /
vleesvarkens. Bij het paard moeten we bij de verschijnselen eerder denken aan een misbruik van
anabolen.
Kat: Komt zowel voor bij raskatten (Maine Coon en Ragdoll) als bij de huiskat. Zowel jonge als oude
dieren. Vaker bij katers. HCM kan uiteindelijk tot congestief linker hartfalen leiden. Bij katten treedt
bij linker hartfalen vaak ook liquothorax op. Door de chronisch verhoogde diastolische druk gaat het
LA dilateren. Trage bloedstroom in het gedilateerde LA kan aanleiding geven tot trombusvorming in
het aurikel. Daarnaast treden als gevolg van een verminderde coronaire perfusie ischemische
gebieden, infarcten en vervolgens fibrose in de ventrikelwand op, waardoor die nog stugger wordt.
Door de ischemie kunnen ook ventriculaire ritmestoornissen optreden.
CM wordt bij katten vaak gecompliceerd door trombo-embolie. Zolang de trombus in het LA blijft
zitten, geen problemen. Gaat trombus met de bloedstroom mee kan hij overal terechtkomen. Vaak
komt hij in de aorta bij de afsplitsing van de a. iliaca voor, omdat de trombus zo groot is dat hij de
takken van de aorta of de aorta descendens al niet meer kan passeren.
Verschijnselen: vaak geen symptomen. De meest voorkomende verschijnselen zijn het gevolg van
een congestief linker hartfalen of een trombo-embolie. Benauwdheid kan naast l. hartfalen ook een
gevolg zijn van liquothorax. Katten hebben niet de neiging om te hoesten bij longoedeem. Hoestende
katten: respiratoire aandoeningen. Bij liquothorax is het vocht in de borstholte gemodificeerd
transudaat of chylus.
Congestief rechter hartfalen wordt bij HCM eigenlijk nooit gezien.
Door ventriculaire tachycardie kunnen flauwtes of plotselinge sterfte optreden. De verschijnselen
van een trombo-embolie hangen af van de plaats en de mate van afsluiting, maar zijn doorgaans
ernstig met heftige pijn, paralyse van achterpoten of belemmering van verschillende
orgaansystemen.
Diagnostiek: Bij hartauscultatie is vaak een systolisch bijgeruis of galopritme hoorbaar, maar de
hartauscultatie kan ook normaal zijn. De diagnose kan alleen worden gesteld door aanvullende
onderzoek m.b.v. echocardiografie door een specialist.
De diagnose trombo-embolie van de aortatrifurcatie wordt gesteld op basis van de verschijnselen en
de afwijkingen bij het lichamelijk onderzoek. De diagnose van linker hartfalen is bij de kat lastiger te
stellen.
Bij elk benauwde kat moeten we naast astma ook aan linker hartfalen denken. Voor de diagnose
longoedeem of liquothorax moeten we een röntgen, echografie of thoracocentesis gebruiken.
Therapie: Op grond van theoretische overwegingen worden een bètablokker (atenolol) of een Cakanaalblokker (diltiazem) gegeven. De belangrijkste maatregel bij benauwdheid is het vermijden van
stress. Toedienen van zuurstof. Bij een liquothorax moet een thoracocentese worden uigevoerd om
zoveel mogelijk vloeistof uit de borstholte te verwijderen. Als er longoedeem is, furosemide. Katten,
die niet meer benauwd zijn, kunnen worden overgezet op een levenslange onderhoudsmedicatie
met een ACE-remmer en diureticum (furosemide).
De pijn bij een trombo-embolie bestrijden, en de trombo-embolie mogelijk oplossen met aspirine
(acetylsalicylzuur) deze is bloedverdunnend. Er is verder dan dit geen echte behandeling van de
trombus.
Prognose: Prognose wisselt. Katten met HCM kunnen normaal leven. Bij een trombo-embolie of met
linker hartfalen kunnen ze plotseling overlijden, met de juiste behandeling is het mogelijk nog
jarenlang leven maar vaak overlijden ze of worden geëuthaniseerd. Een trombolie-embolie heeft
over het algemeen een matig tot slechte prognose.
3. Specifieke cardiomyopathieën
‘Mulberry heart disease (moerbeihartziekte) en ‘white muscle disease’ bij het varken
Worden beide veroorzaakt door een vitamine E tekort in het rantsoen. De aandoening verergert door
een tekort aan selenium, methionine en cystine en een hoog vetgehalte van het dieet.
Moerbeihartziekte wordt gekenmerkt door acuut hartfalen en plotselinge dood, zonder stress en
komt voor bij alle leeftijden. Genetische factoren spelen mogelijk ook een rol.
Varkens vertonen anorexie / depressie / spierzwakte. Mortaliteit is 100%. De plotselinge dood treedt
op door een combinatie van congestief hartfalen en hydropericard. Bij pathologisch onderzoek wordt
vloeistof en fibrine in alle lichaamsholten aangetroffen. De lever is vergroot. Het pericard is gevuld
met gelatineuze vloeistof en op het hart zijn bloedingen zichtbaar van basis tot aan de hartpunt.
Vergelijkbare laesies zijn zichtbaar op het endocard.
Microaniopathieën en spierdegeneraties kunnen ook aanwezig zijn. Als vooral de spierdegeneraties
opvallen spreekt men van ‘white muscle disease’, wat naast bij het varken ook bij het paard
voorkomt.
Geen therapie voor de zieke varkens. Bij de overige dieren kunnen parenteraal α-tocopherol/
seleniumpreparaten toegediend worden om verdere gevallen te voorkomen. Meer vitamine E in het
voer.
Rhabdomyolyse (spierbevangenheid) bij het paard
Kan leiden tot hartspierdegeneratie. Als gevolg hiervan kan dysfunctie van het myocard ontstaan met
eventueel ritmestoornissen en hartfalen.
‘High altitude disease’ bij pluimvee
Andere benaming: ascites, buikwaterzucht, en in de literatuur als ‘pulmonary hypertension
syndrome’ PHS.
De ziekte kwam aanvankelijk alleen voor bij kippen op grote hoogte. Nu niet meer. De ziekte treft
vooral snelgroeiende vleeskuikens. De grootste uitval wordt gezien tijdens de 4e en 5e levensweek en
betreft vooral mannelijke dieren.
Verschijnselen: vermagering / sufheid / groeivertraging. In het eindstadium cyanose / ascites.
Kuikens zijn dan benauwd.
In de pathogenese vormt hypoxie de belangrijke factor. De hypoxie induceert d.m.v. een verhoogde
productie van erytropoëtine een verhoogde hematocriet en een toegenomen bloedconsistentie.
Door hypoxie kan het endotheel van de a. pulmonalis endotheline produceren, waardoor
vasoconstrictie ontstaat. Dit leidt tot een verhoogde perfusieweerstand in de long.
Op een gegeven moment kan het hart de gevraagde arbeid niet meer leveren en gaat
decompenseren, met lever- en longstuwing en uiteindelijk hydropericard en ascitis als gevolg. Het
hart is vergroot door hypertrofie en dilatatie van voornamelijk RV.
Factoren die van invloed zijn op het ontstaan van HAD
o Hoe sneller de groei, hoe groter de kans
o Lage temperatuur leidt tot een hogere stofwisseling en daardoor grotere O2-behoefte.
o Respiratoir probleem op jonge leeftijd, deel van de longen kan daardoor blijvend beschadigd
zijn waardoor er onvoldoende opname van O2 plaatsvindt.
Tegenwoordig wordt geselecteerd op verminderde gevoeligheid bij vleeskuikens.
‘Sudden death syndrome’ bij pluimvee
Acute hartinsufficiëntie bij vleeskippen. Doodgroeiers / flip-overs.
Flip-overs zijn een belangrijke oorzaak van uitval in gezonde en snelgroeiende koppels slachtkuikens.
Vooral de snelgroeiende mannelijke kuikens. Deze kuikens worden ook wel doodgroeiers genoemd.
Voor kuikenhouders is een enkeling wel juist een teken van maximale prestatie van de groep.
Het getroffen kuiken slaakt een kreet, springt in de lucht, fladdert nog wat, valt achterover en sterft
t.g.v. acuut hartfalen. De dieren worden door op hun rug aangetroffen met gestrekte pootjes en
heten daarom flip-overs.
Pathogenese niet helemaal duidelijk, waarschijnlijk speelt zuurstoftekort een belangrijke rol. Het
sectiebeeld levert naast vergrote en bleke lever en bleke nieren, niet veel op. Soms worden ook
degeneratieve veranderingen in de hartspier en bloedinkjes in de nieren en borstspier
waargenomen.
Myocardinfarct
Betreft necrose van een deel van de hartspier door afsluiting van de verzorgende coronaire arteriën.
Atherosclerose (aderverkalking) is vooral bekend bij het varken en bepaalde vogelsoorten, maar
komt niet heel veel voor. Bij het rund, schaap en hond treedt artherosclerose mogelijk op als gevolg
van een hyperthyreoïdie. Bij GD worden regelmatig myocardinfarcten aangetroffen bij ernstige
aortastenose bij de hond en bij HCM bij de kat. Ook worden ze waargenomen bij alle diersoorten in
het kader van een bacteriële endocarditis (vastlopende embolieën)
Door de ischemie treedt celbeschading op, waardoor prikkelvormingscentra ontstaan op basis van
spontaan depolariserende hartspiercellen. Levensbedreigende aritmieën (ventriculaire tachycardie
en ventrikelfibrilatie) kunnen dan optreden. Bij zeer grote infarcten daalt het SV nog extra vanwege
de afname van de contractiliteit, want het afgestorven myocardgebied is niet meer in staat om
samen te trekken. Een myocardinfarct veroorzaakt in de meeste gevallen geen specifieke
verschijnselen. Acute sterfte of flauwtes kunnen optreden als gevolg van ernstige ventriculaire
aritmieën.
De waarschijnlijkheidsdiagnose wordt bij GD gesteld op basis van een echocardiogram door het
zichtbaar maken van een hypodynamische wandbeweging en de eventuele onderliggende hartziekte,
die tot het myocardinfarct leidde. Bij paarden is een myocardinfarct een zeldzaam verschijnsel, dat
mogelijk zijn oorzaak vindt in het vastlopen van embolieën als gevolg van een parasitaire infectie.
Bij een levensbedreigende aritmie: anti-arritmica. Prognose hangt af van de oorzaak maar meestal
ongunstig.
Pericard afwijkingen
Pericardovervulling:
de aanwezigheid van een abnormaal grote hoeveelheid vloeistof in het pericard (=hartzakje). PCO
kan ontstaan als gevolg van ontsteking (pericarditis), stuwing, hypoproteïnemie of bloeding.
Verstoring van het evenwicht tussen resorptie en productie van vloeistof in het pericard kan ook tot
overvulling leiden,maar is dan idiopatisch (hond / paard.
-
Hydropericard: teveel dun en helder vocht in het hartzakje. Stuwing of hypoproteïnemie.
-
Hemopericard: bloed in het hartzakje. Bloedstollingsstoornis of ruptuur van een harttumor
binnen de pericardomslag. Bij het paard soms een aortaruptuur. Bij vogels door intoxicatie
met sulfaverbinding tegen coccidiose (door stollingsstoornissen). Doodsoorzaak niet
bloedverlies maar druk op het hart door hemopericard.
Als de ophoping van vocht in het pericard zo groot is, dat de druk op het hart de diastolische vulling
van de ventrikels belemmert: harttamponnade. Bij langzame ophoping van vocht kan het pericard
zich zodanig aanpassen (uitrekken), dat de intrapericardiale druk gering stijgt, ook als zich een
tamelijk grote hoeveelheid vocht in het pericard ophoopt. In dat geval blijft de functie van het LV
redelijk intact en ontwikkelt zich alleen rechter hartfalen. Bij een peracute PCO is er geen tijd voor
aanpassing en een kleine hoeveelheid vocht in het pericard kan dan al een ernstige drukverhoging
veroorzaken.
De idiopathische PCO bij de hond komt vooral voor bij grote rassen van middelbare leeftijd. In de
meeste gevallen veroorzaakt PCO dan rechter hartfalen.
PCO door een hartbasistumor of hemangiosarcoom (oudere honden) veroorzaakt meestal een
cardiale shock door een peracute vochtophoping als gevolg van een bloeding vanuit de tumor
(harttamponade). Of zich rechter hartfalen of een cardiale shock ontwikkelt, is afhankelijk van de
druk in het pericard. Als de intrapericardiale druk minder is dan de diastolische druk (=CDV) van het
RV, wordt de vulling van het hart niet belemmerd en ontwikkelen zich ook geen verschijnselen. Als
de intrapericardiale druk hoger is dan de diastolische druk in het RV, wordt de vulling van het RV wel
belemmerd: congestief rechter hartfalen.
Pericardovervulling leidt tot veneuze stuwing, waardoor het HMV daalt. Hierdoor neemt de
glomerulaire filtratie af, wat leidt tot een verhoogde aldosteronproductie met als gevolg water- en
zoutretentie, waardoor de CVD nog meer toeneemt en dus nog meer stuwing optreedt. De
suboptimale diastolische vulling van het LV leidt tot een daling van het SV en daardoor daalt de
bloeddruk ook. Dit wordt door baroreceptoren gesignaleerd en vervolgens wordt het sympatische ZS
gestimuleerd.
Verschijnselen: worden mede bepaald door de achterliggende oorzaak van de pericardovervulling.
Verminderde inspanningstolerantie / flauwtes / toegenomen buikomvang bij een matige
intrapericardiale drukverhoging.
Ernstige pericardiale drukverhoging: acuut optredende shock, leidt snel tot de dood.
PCO: nooit longoedeem!! Maar omdat het pericard hoestreceptoren bevat, kan hoesten wel het
eerste verschijnsel zijn.
Diagnostiek: De perifere pols is snel en zwak. Verhoogde CVD (gestuwde vene jugularis). Ictus cordis
is niet of minder duidelijk voelbaar. Het hart is bij auscultatie niet of gedempt hoorbaar. Bij
hartpercussie wordt een vergrote absolute hartdemping gevonden. ECG: lager dan normaal voltage.
Als een dier in shock wordt aangeboden, moeten we altijd de vv. jugulares onderzoeken, want PCO is
1 van de weinige aandoeningen, die shock veroorzaakt in combinatie met gestuwde vv. jugulares.
M.b.v. echocardiografie kan een PCO en soms een achterliggende oorzaak in beeld worden gebracht.
DDx: congestief hartfalen t.g.v. een dilaterende cardiomyopathie. Bij het paard aan klepafwijkingen,
endocarditis of myocarditis.
Therapie: verwijderen van het vocht d.m.v. een percutane punctie van het pericard door een
specialist. Bij de hond kan een pericardresectie worden overwogen als het eerste niet helpt. Diuretica
en ACE-remmers zijn gecontraïnduceerd, omdat zij de vulling van het hart nog verder verminderen.
Prognose: Afhankelijk van de oorzaak. Bij de idiopatische PCO is de kans op een recidief ongeveer
50%.
Een hemangiosarcoom heeft vanwege multipele metastasen een slechte prognose. De kwaliteit van
leven kan enige tijd nog goed zijn door langzame groei. Een chirurgische ingreep is niet zinvol.
Pericarditis:
ontsteking van het hartzakje. Zowel epi- als pericard zijn hierbij betrokken. Komt vooral voor bij rund
/ varken / veulen.
Rund: meestal traumatisch vanuit de netmaag.
Andere landbouwhuisdieren en paard: veelal hematogeen of vanuit processen in de pleura of in de
longen. Paard: vaak idiopatisch.
Varken: infectieuze pneumonieën.
Neonatale veulens: polyserositis t.g.v. een sepsis.
Vogels: een niet-infectieuze pericariditis bij jicht als gevolg van de afzetting van uraten.
Papegaaien en parkieten: fibrineuze pericarditis als gevolg an chlamydophila psittaci.
Verschijnselen van een pericarditis zijn afhankelijk van de hoeveelheid en de aard van het exsudaat.
Hemodynamische veranderingen vergelijkbaar met die van een pericardovervulling. Grote
hoeveelheden exsudaat belemmeren de hartwerking, vooral de diastole. De aard van pericarditis is
meestal fibrineus of serofibrineus. Door fibrinevorming ontstaat een sponsachtig weefsel, dat de
geleiding van de harttonen belemmert. Omdat overvulling van het pericard de diastolische vulling
van de ventrikels belemmert, stijgt de CVD. Het op peil houden van de circulatie wordt vooral
gerealiseerd door verhoging van de HF. Al heel spoedig na het ontstaan van een (sero)fibrineuze
pericarditis groeit fibro-angioblastenweesfel in de fibrine, na verwijdering van fibrine blijft daardoor
bindweefsel over. Wanneer de beide fibrinelagen contact met elkaar hebben, kan ook het
ingegroeide fibro-angioblastenweefsel met elkaar in verbinding komen. Dat resulteert in vergroeiing
van het pericard met het epicard. Deze vergroeiing kan optreden in de vorm van bindweefseldraden
(brides), maar ook kunnen het peri- en epicard over een groot oppervlak geheel met elkaar vergroeid
zijn.
Rund: 95% door een traumatische pericarditis. Het optreden van verschijnselen kan dagen tot
maanden duren. Daarnaast wordt een fibrineuze pericarditis een enkele keer gezien bij infecties met
bijv. clostridium chauvoei en Mannheimia hemolytica.
De samenstelling van de inhoud van de pericardholte zal variëren, afhankelijk van de bacteriën die
met het corpus alienum meekomen. Zal doorgaans bestaan uit een mengflora van omgevingskiemen.
Wanneer Arcanobactium pyogenes een rol speelt, zal er naast fibrine veel stinkende etter in het
pericard komen. Soms wordt er gas gevormd door de aanwezige bacteriën.
Verschijnselen: ontstaan meestal binnen enkele dagen. Prognose dan meestal al infaust.
Een pericarditis veroorzaakt verschijnselen van algemeen ziek zijn. Verminderde eetlust /
verminderde melkproductie / koorts. Na enkele dagen kan oedeem optreden tussen de kaaktakken
en in het kossum, soms tot vlak voor de uier.
Bij auscultatie variëren de bevindingen: geen bijzonderheden / verminderde intensiteit links rechts
en daardoor verandering verhouding links rechts/ geen geluiden meer. De bevindingen zijn
afhankelijk van het stadium. Ook kunnen we wrijvingsgeruisen horen, die ontstaan doordat fibrine op
het peri- en endocard langs elkaar schuiven tijdens de hartactie. Deze krakende en knisperende
geluiden zijn synchroon met de hartslag. Gas in het hartzakje: muzikale klotsgeluiden (bruits de glou
glou). Een ernstige belemmering van de hartwerking geeft aanleiding tot leververgroting door
stuwing en ascites. Soms hydrothorax.
Diagnose: lichamelijk onderzoek. Verschijnselen zijn zeer typisch.
DDx: geen ddx voor traumatische pericarditis, deze zijn te duidelijk. Voor een niet-traumatische
pericarditis: infectie met Mannheimia hemolytica (dan ook verschijnselen van polyserositis en
pneumonie) / Endocarditis die gepaard gaat met hydrothorax (uit te sluiten door nauwkeurig klinisch
onderzoek) / longabces/ pleuritis humida / infectieuze bovine leukose / thymussarcoom.
Therapie: euthanasie
Varken: infectieus van oorsprong en ontstaat hematogeen of vanuit ontstekingen van de pleura of
longen. Bij biggen wordt een fibrineuze pericarditis aangetroffen bij infectieuze polyserositis, die
wordt veroorzaakt door o.a. Streptococcus suis, haemophilus parasuis, actinobacillus
pleuropneumoniae.
Een fibrineuze pericarditis kan bij het varken volledig herstellen, maar vaak ontstaat
bindweefselvorming (vergroeiing) tussen peri- en epicard: beperking van de diastolische functie en
uiteindelijk hartfalen. Vaak is het een toevalsbevinding.
In het vroege stadium: algemeen ziek / eten minder / groeiachterstand / soms sterfte.
Chronische stadium: blijvende groeivertraging
Vogels: Pericarditis urica is niet-infectieus. Hierbij ontstaan neerslagen van urinezuur op de sereuze
oppervlakte van het pericard. Vaak vinden deze neerslagen ook op andere plaatsen in het lcihaam
plaats. Deze aandoening wordt jicht genoemd. De pericarditis urica staat niet op zichzelf maar is een
onderdeel van het gevolg van nierfalen bij vogels. Ontstaat bij verstoring van de urinezuursecretie.
Oorzaken van infectieuze aard zijn het nefropathogeen infectieus bronchitisvirus en septikemie.
Bloedvaten
Vaataandoeningen
Trombo-flebitis
Flebitis is ontsteking van een vene.
Tromboflebitisof pereflebitis is een afsluiting van een ader door een bloedstolsel met ontsteking van
de vaatwand en omgeving.
Tromboflebitis of periflebitis van de v. jugularis kan ontstaan als gevolg van:
- Agressieve componenten van injectievloeistoffen
- Niet steriel toedienen van IV injecties
- Periveneuze injecties
- Bacteriële contaminatie van, reactie op of niet stabiel zittende venekatheters.
- Traumatische plaatsing van IV injecties of katheters.
- Ontstekingsprocessen in de buurt van de v. jugularis.
Kan bij alle diersoorten voorkomen maar meest bij paard / rund.
Verschijnelen:
Acute flebitis van de v. jugularis bij het paard: koorts / pijn / zwelling van het bloedvat / stuwing
perifeer van de laesies. Als het vat geheel is afgesloten kan zwelling van het hoofd aan de aangetaste
zijde optreden. Extreme gevallen: zwelling in het larynxgebied respiratoire problemen.
Chronische Tromboflebitis van de v. jugularis: v. jugularis is een harde streng in de jugulaire groeve.
Diagnostiek: M.b.v. echografisch onderzoek onderscheid tussen een Tromboflebitis en een
periflebitis.
Aspiratie van pockets vocht voor bacteriologisch onderzoek en een antibiogram.
Therapie: Als de injectievloeistof periveneus terecht komt: omgeving van de injectieplaats infiltreren
met een hyaluronidase- bevattend preparaat of zalf om snelle afvoer te bevorderen. Bij warme
zwelling: hals koelen met ice-packs of koud water.
Acute fase: AB i.v.m. een mogelijke septische ontsteking. NSAID’s. Ter voorkoming van
trombusvorming in het herstellende, nauwe bloedvat is een anticoagulatietherapie geïndiceerd
(heparine).
Bij een chronische tromboflebitis kan rekanalisatie en herstel van een getromboseerd vat optreden.
Dit duurt over het algemeen vrij lang. In 1e instantie wordt de afvoer van het bloed verzorgd door
collateralen. Als er geen rekanalisatie optreedt, zullen de collateralen zich verder ontwikkelen. De
trombus kan chiriurchisch verwijderd of vervanging van de vene kan, maar is kostbaar.
Trombo-emolieën kunnen elders in het lichaam problemen veroorzaken, bekende hiervan zijn:
endocarditis, myocarditis en trombo-embolus van de grote arteriën.
Een (peri)flebitis kan ontaarden in een flemoneuze ontsteking (onsteking van losmazig bindweefsel).
Deze kan zich snel over een groot gebied uitbreiden en is een zeer ernstige complicatie, die
onmiddelijke en intensieve therapie vereist met o.a. antibiotica die gericht zijn tegen infectie met
anaerobe bacteriën.
Prognose: chronische tromboflebitis is gereserveerd. Bij een Tromboflebitis waarbij geen
rekanalisatie van het vat is opgetreden, kan het hoofd langdurig dik blijven als beide vene jugularis
zijn aangetast. Bovendien is een eenzijdige blijvende trombosering niet gunstig voor het gebruiksdoel
van het paard.
Equine virusarteriïtis bij het paard (EVA)
virale infectie bij paarden waarbij een ontsteking van de arteriolen ontstaat. Komt wereldwijd voor.
Meestal subklinisch. Klinische verschijnselen: koorts / oedemen aan het hoofd, benen en genitalia /
algehele malaise. Virus wordt ook geassocieerd met infectieuze abortus. Hengsten kunnen de
infectie via het sperma op gevoelige merries overbrengen.
Hartwormziekte bij de hond / kat / fret:
Dirofilaria immitus wormen in de a. pulmonalis.
Worm wordt overgebracht door een tussengastheer, een geïnfecteerde bloedzuigende mug. Deze
brengt subcutaan infectieuze larven (L3) in bij de gastheer. Deze larven ontwikkelen zich tot een
volgend stadium en migreren in een klein adertje, waarvandaan ze met de bloedstroom naar de a.
pulmonalis worden gevoerd. Daar komen ze ongeveer 3 maanden na de infectie aan. Hier
ontwikkelen ze zich in ongeveer 3 maanden tot volwassen wormen, waarna ze zich voortplanten en
zeer grote aantallen microfilariën (larven) produceren. De prepatentperiode van hartwormziekte is
tenminste 6 maanden. De microfilariën circuleren in de bloedbaan, waar ze eventueel door een
bloedzuigende mug kunnen worden opgezogen. Mug blijft geruime tijd infectieus, maar alleen bij
een omgevingstemperatuur van meer dan 15 graden.
De intravasale schade door de volwassen wormen veroorzaken een mechanische belemmering van
de bloedstroom. Dit kan leiden tot trombosevorming in de takken van de a. pulmonalis. Endotheel
wordt onregelmatig door de irriterende stofwisselingsproducten van de wormen en door hun
mechanische invloed. Dit kan leiden tot verhoogde permeabiliteit van de longcapillairen en
vervolgens tot longinfiltraties van leukocyten. Meeste honden met hartworminfecties: subklinisch.
Klinische verschijnselen: hoesten / verminderd uithoudingsvermogen / flauwtes.
‘Vena cava-syndroom’ levensbedreigend. Wanneer veel wormen vanuit de a. pulmonalis de RV
ingaan. Veroorzaakt een mechanische belemmering van de bloedstroom bij de tricuspidalisklep:
acuut congestief rechter hartfalen en een massale intravasale hemolyse (hemoglobinurie en icterus).
Bloed kan niet meer van RA in RV, dus linker hart krijgt ook minder bloed: hypotensie / shock.
Voor de diagnose is de buitenland anamnese naar warmere gebieden van belang. ELISA test-kit kan
antigenen in het bloed aantonen, die door de volwassen vrouwelijke wormen zijn geproduceerd.
De behandeling moet wegens complicaties door een specialist gedaan.
Omdat het heel moeilijk is om de hartwormziekte te genezen, speelt preventie een belangrijke rol. 3
Middelen: selamectine als spot-on / milbemycine, 1x per maand tablet / moxidectine als spot-on.
Angiostrongylus vasorum is een andere worm die in de a. pulmonalis van de hond verblijft.
‘French heartworm’. Noord- en West-Europa. Endemische parasitaire infectie.
Is een nematode (rondworm) die via het opeten van geïnfecteerde slakker of kikkers wordt
overgedragen. Verminderd uithoudingsvermogen / respiratoire verschijnselen / hemorragische
diathese (verhoogde doorlaatbaarheid). Géén vena-cava syndroom.
Strongylus vulgaris en wormaneurysma bij het paard
Komt door verbetering van ontwormingsregime niet meer zo veel voor, maar kan nog wel.
Veroorzaakt arteriïtis.
De volwassen parasiet leeft in het caecum. Na opname van de infectieuze larven dringen ze door het
slijmvlies van de dunne of dikke darm en dringen in de submucosa de arteriolen binnen, waar ze tot
L4 vervellen. Langs de intima van de arteriolen en arteriën kruipen ze tegen de bloedstroom in. Na
ongeveer 3 weken komen ze aan in de a. mesenterica cranialis waar ze zich doorgaans verder
ontwikkelen. Na circa 3 tot 4 maanden vervellen ze tot het 5e stadium, laten zich meevoeren met de
bloedstroom, penetreren de darmwand en komen aan in het caecum. Prepatentperiode is 5-6
maanden.
Ernstige ziekte treedt in 2 perioden op.
1. Bij infecties met enkele honderden larven tegelijk gebeurt dit tijdens de eerste 3 weken, dus
voordat de larven in de a. mesenterica cranialis aankomen. Dit leidt tot darminfarcten, of
(kramp)kolieken.
2. 3 tot 4 maanden na de infectie, wanneer de ontstekingsreacties in de a. mesenterica cranialis
het grootst zijn. De larven veroorzaken een ontsteking in de wand met
endotheelbeschadiging, waardoor afzetting van fibrine optreedt trombo-endarteriïtis.
Door verandering van de t. media kan de vaatwand de arteriële bloeddruk niet meer
weerstaan en rekt uit wormaneurysma (plaatselijke verwijding van een bloedvat). Op den
duur kunnen de vaten weer nauwer worden door verbindweefseling. Minder vaak zien we
ook een trombo-endarteriïtis in andere arteriën zoals de aorta, splanchicus en hart.
Verschijnselen meestal door vernauwing van het lumen van de darm en soms door loslaten van
brokjes fibrine (infarcering van de darm peritonitis).
Diagnose na klinisch onderzoek gesteld: intermitterende koliek / koorts / verminderde motiliteit MDK
/ verdikte pijnlijke en soms gedilateerde scheilswortel.
Bloedonderzoek: chronisch ontstekingsbeeld met leukocytose / rechtsverschuiving / afwijkingen aan
het eiwitspectrum.
Echografisch: verminderde doorbloeding / verdikte wand
Therapie: behandeling van de eventueel aanwezige peritonitis of vasculitis (breedspectrum AB en
NSAID’s). Ontworming en anticoagulantia.
Aneurysma en aortaruptuur bij pluimvee.
Komt vooral bij de kalkoen voor en dan in het bijzonder de snelgroeiende hanen. Ook bij de kip kan,
maar niet zo vaak. Er treedt een peracute sterfte op.
Aortaruptuur vooral in het abdominale deel van de aorta gezien. Gaat gepaard met en wordt
waarschijnlijk voorafgegaan door degeneratie van elastische vezels en van spiercellen
(medianecrose) aneurysma.
Belangrijke oorzaken van een aneurysma met een aortaruptuur bij de kalkoek zijn hypertensie met
zoötechnische en nutritionele achtergronden (zout) en lathyrisme. Bij het laatste is de voedings
verontreindigd met de zaden van lathyrus odoratus, welke het oorzakelijke toxine bevatten.
Kip heeft als oorzaak: koperdeficiëntie en een zeer hoge concentratie zink in het voeder.
Hypertensie
Hypertensie is een chronisch te hoge systolische of gemiddelde bloeddruk. We spreken hierbij over
het arteriële systeem.
Hypertensie een te hoge bloeddruk in de systemische arteriën systemische arteriële
hypertensie.
Hypertensie in de A. Pulmonalis noemen we pulmonale hypertensie.
Stuwing te hoge druk in het systemisch veneuze systeem. Bijvoorbeeld portale hypertensie.
Systemische arteriële hypertensie = normale hypertensie.
Meestal secundair aan een onderliggende ziekte, zoals niefalen, hoge productie van aldosteron of
(nor)adrenalineproductie door de bijnieren. Vooral bij de kat komt dit voor. Je moet opletten dat bij
onderzoek de bloeddruk ook wegens stress omhoog kan gaan.
De nadelige effecten van hypertensie zien we vooral in de ogen / hersenen / nieren / hart.
Bij de kat is acute blindheid het meest voorkomende verschijnsel als gevolg van een ablatio retinae
(netvliesloslating) of hyphaema (bloeding in de voorste oogkamer). Ook kunnen centraalneurologische verschijnselen optreden.
Hypertensie kan niet alleen het gevolg, maar ook de oorzaak van nierfalen zijn. Hypertensie leidt
meestal niet tot cardiale verschijnselen, maar in het LV ontwikkelt zich wel een geringe tot matige
concentrische hypertrofie.
Diagnose: bloeddrukmeting door specialist (bloedige, invasieve en onbloedige
meetmethoden).Daarnaast wordt gezocht naar de onderliggende oorzaak, en oogonderzoek bij
blindheid om andere oorzaken uit te sluiten.
Hypertensie bij de kat wordt levenslang behandeld met een arteriële vasodilatator: amlodipine, de
onderliggende oorzaak wordt behandeld en daar is de prognose van afhankelijk.
Pulmonale hypertensie, cor pulmonale
De gemiddelde druk in de a. pulmonalis is verhoogd. Treedt op bij alle diersoorten. De
pathofysiologische mechanismen die tot pulmonale hypertensie kunnen leiden kunnen in 3 groepen
worden onderverdeeld:
- Chronisch verhoogde druk in het LA t.g.v. congestief linkerhartfalen.
- Verhoogde flow in de a. pulmonalis (VSD / PDA)
- Verhoogde weerstand van de a. pulmonalis t.g.v. een trombus of embolus in de a.
pulmonalis, of vasoconstrictie (door alveolaire hypoxie als gevolg van te lage
zuurstofspanning in de lucht op bijvoorbeeld grote hoogte; of obstructie in de luchtwegen)
Pulmonale hypertensie heeft nadelige effecten op de vaatwanden en het hart. De wand van de
takken van de a. pulmonalis wordt sterk hypertrofisch, waardoor het lumen nauwer wordt. Dit maakt
de pulmonale hypertensie nog erger. Het RV moet tegen een verhoogde nabelasting pompen,
waardoor ventrikelhypertrofie ontstaat. Omdat het bloed niet gemakkelijk door de a. pulmonalis
heen kan, krijgt de linker harthelft voorts te weinig bloed aangeboden. Dit kan leiden tot cardiale
shock als het ernstig is en anders flauwtes als het minder erg is.
Cor pulmonale wordt gebruikt om afwijkingen van het hart die zijn ontstaan t.g.v. een chronische
longaandoening te benoemen.
De verschijnselen van een pulmonale hypertensie: verminderd uithoudingsvermogen / tachypneu
(versnelde ademhaling) / dyspneu (benauwdheid) / flauwtes / cardiale shock.
Bloeddruk in de a. pulmonalis meten m.b.v. een dopplerechocardiograaf door een specialist. Ook
moet de oorzaak achterhaald worden, en behandeld. De meest effectieve vasodilatator van de a.
pulmonalis is zuurstof. De prognose is ongunstig vanwege de irreversibele verandering in de wand
van de takken van de a. pulmonalis.
Farmacologische beïnvloeding van het cardiovasculaire systeem
Verschillende groepen farmacotherapeutica:
- Anti-arritmica
- Middelen ter verbetering van de myocardfunctie (inotrope werking)
- Middelen ter verlaging van de perifere weerstand
- Middelen die hemostase (=bloedstolling) en trombose beïnvloeden
- Middelen ter preventie en behandeling van hartworm
Sommige therapeutica vallen onder meerdere groepen, dus arbitraire scheiding.
Behandeling van aritmiën:
Bovenstaand zien we een myocard cel!
Anti-arritmica hebben tot doel het hartritme te herstellen. Er zijn geen diersoortspecifieke middelen,
dus humane middelen worden gebruikt.
Op basis van hun werkingsmechanisme worden ze onderverdeeld in de volgende klassen (indeling
van Vaughn Williams):
- Klasse I: medicijnen die de spanningsafhankelijke natriumkanalen blokkeren.
Deze medicijnen blokkeren de lokale natrium-kanalen op dezelfde wijze als anasthetica.
Dit gaat als een habituele blokkade: hoe groter de activiteit van het ionkanaal, hoe groter het effect
van het anti-arritmicum. Bijvoorbeeld gebruikt bij de behandeling van tachyaritmie, zonder de gehele
slagfrequentie omlaag te gooien.
Het natrium-ionkanaal kent 3 functionele stadia: rust / open / refractair. Normaal verkeert het Nakanaal in een rusttoestand, echter na depolarisatie van het membraan opent het zich (activatie). Na
een aantal milliseconden sluit het zich weer en blijft tijdelijk refractair (=ongevoelig). Ze werken
vooral tijdens het geactiveerde of het refractaire stadium (zie figuur, fase 1 of 3). Het resultaat van de
blokkade is een vertraging van de prikkelgeleiding.
Subklassen van klasse I:
o Ib: lidocaïne en fenytoïne. Binden aan open ionkanalen tijdens de depolarisatie (fase
0) en dissociëren voor de nieuwe AP. Premature slagen worden zodoende
voorkomen en het hartritme normaliseert.
o Ic: flecaïnide en mexiletine. Associëren en dissociëren veel trager en bewerkstelligen
een meer gegeneraliseerde vermindering van de prikkelbaarheid (sterk effect).
Smalle veiligheidsmarge en worden niet routinematig toegepast.
o Ia: kinidine en procaïnamide. Ligt tussen Ic en Ib in.
- Klasse II: medicijnen die de β-adrenoceptor blokkeren (β-blokkers)
Hart heeft een unieke populatie adrenerge β1-receptoren. Activatie van deze receptoren leidt via
cAMP tot verhoging van de intracellulaire Ca-concentratie en een verhoogde prikkelbaarheid en zelfs
dysritmie (effect van adrenaline).
De β1-antagonisten (β-blokkers) remmen de aanmaak van cAMP met als gevolg een verlaging van de
intracellulaire Ca-concentratie. Blokkeren zowel fase 4 als fase 2, waardoor .
daling van de HF (SA-knoop) / AV-geleidingssnelheid en vermindering van de inotropie.
Propranolol: niet-selectieve-β-blokker. Blokkeren naast β1 op het hart ook β2-receptoren op de
bronchiën en de bloedvaten. Bijwerking: bronchoconstrictie / vasoconstrictie.
Atenolol: selectievere β1-antagonist. Minder bijwerkingen.
Β-Blokkers vooral toegepast bij: sinustachycardie / AF / SV-tachycardie / VES / tachycardieën (stress)
- Klasse III: medicijnen die de K-uitstroom remmen (re-entry blokkers)
Sotalol en amiodaron. Verschillende activiteit maar zeker allemaal het verlengen van de
actiepotentiaal. De kalium uitstroom wordt geremd en re-entry van een (elektrische) impuls wordt
verhinderd doordat het langer duurt voordat de cel repolariseert.
Voordeel: geen negatief inotrope werking in tegenstelling tot de andere klassen.
Re-entryterugkeren van een prikkel in het hart uit een gebied dat al geprikkeld is, zodat het hart
nogmaals geprikkeld wordt bijv. atriumfibrilatie.
- Klasse IV: medicijnen die de spanningsafhankelijke Ca-kanalen blokkeren.
Calciumantagonisten (verapamil en diltiazem) vertragen de signaaloverdracht, vooral in de SA- en
AV-knoop. Hier is de actiepotentiaal namelijk afhankelijk van geleidelijke Ca-instroom (funnychannels). Er treedt een remming op van de sinusfrequentie en AV-geleiding, een verkorting van het
plateau van de AP en een vermindering van de contractiekracht. Ze werken ook vasodilatatoir, omdat
de contractie van gladde spieren in de wand van de bloedvaten eveneens afhankelijk is van de
intracellulaire calciumconcentratie.
Behandeling van bradyaritmieën en overige anti-aritmica
Bradyaritmieën = een te lage hartfrequentie. Voornamelijk worden parasympathicolytica toegepast:
atropine..
Hartglycosiden versterken juist de werking van de n. vagus. Hierdoor worden de spontane
depolarisaties van de SA-knoop vertraagd. Bij AF en Afladderen. In de humane geneeskunde wordt
ook wel adenosine toegepast wat geen negatief inotrope en vaatverwijdende effecten heeft. Wel
vetraagd het de HF en de prikkelgeleiding in de AV-knoop, de werking bij dieren is onvoldoende
onderzocht.
Beïnvloeding van de myocardfunctie
Er zijn twee soorten:
- Positief inotrope middelen hartglycosiden en fosfodiësteraseremmers
Beïnvloeden primair de functie van het myocard.
- ACE-remmers / diuretica / vasodilatatoren verlichten de hartarbeid door vermindering van
de perifere weerstand.
Hartglycosiden:
Komen voor in bladeren van sommige planten (vingerhoedskruid = digitalis)
Blokkeren Na/K-ATPase in de celmembraan van de hartspier. Dit leidt tot verhoging van de
intracellulaire natriumconcentratie, waardoor de uitstroom van intracellulair calcium geremd wordt
(NA/Ca uitwisselingspoort). Hierdoor neemt de calciumbeschikbaarheid in de hartspiercel toe, met
als gevolg een positief inotroop effect. Naast een direct effect op de hartspiercel verhogen de
hartglycosiden de vagustonus waardoor de HF afneemt (verlenging refractaire periode in de AVknoop). De tweeldeige werking leidt tot een economisch hartfunctie waarbij HMV toeneemt. De
effecten van hartglycosiden nemen toe wanneer de plasma K-concentratie afneemt (bijv. na
herhaalde toediening van furosemide). Er is dan sprake van een verminderde competitie tussen K en
de hartglycosiden voor de bindingsplaats op het Na/K-ATPase. Hartglycosiden zijn verbindingen met
een smalle therapeutische breedte.
Digoxine (hartglycosiden) kan oraal opgenomen met een goede biologische beschikbaarheid. De
eliminatietijd is per diersoort sterk verschillend. Wordt voornamelijk geëlimineerd via de nieren, dus
oppassen bij patiënten met nierproblemen. Dan is digitoxine als alternatief, welke door de lever
gemetaboliseerd wordt. Digotoxine kan niet bij de kat!! Halfwaardetijd van 100 uur.
Gezien de smalle therapeutische breedte van hartglycosiden leidt overdosering al snel tot
bijwerkingen en intoxicatieverschijnselen. De aanbevolen dosering van digoxine is gebaseerd op
dieren met een normale voedingstoestand. Bij deze dosering is rekening gehouden met het feit dat
digoxine de eigenschap heeft aan eiwit te binden. Bij dieren met overgewicht dient de dosering dus
te worden berekend op basis van het streefgewicht van het dier, omdat digoxine zich nauwelijks over
vetweefsel verdeelt.
Bijwerkingen treden vaak op door de smalle therapeutische breedte van digoxine
Braken / anorexie / diarree: typische eerste intoxicatieverschijnselen bij hond en kat.
Daarnaast kunnen cardiale bijwerkingen optreden: (supra)ventriculaire ritmestoornissen. Vaak is
echter niet duidelijk bij deze stoornissen of ze onderliggend zijn van het ziekteproces of door het
medicijn komen.
Digitalis kan overgedoseerd worden wanneer er sprake is van: hypokaliëmie / hpercalciëmie /
hypernatriëmie / afwijkende schildklierhormoon concentraties.
Bij intoxicatie moet je direct stoppen met toedienen, elektrolytenbalans herstellen en aritmie
behandelen. Een plasmaconcentratie bepaling kan de therapie vervolgens optimaliseren.
Interacties met andere geneesmiddelen zijn die de kinetiek van digoxine beïnvloeden of die invloed
hebben op de plasma K-concentratie.
Belangrijke contra-indicaties betreffen het SA-blok, AV-blok, hypertrofische cardiomyopathie en
ventriculaire tachycardie.
PDE III-remmers: fosfodiësterase remmers
Fosfodiësterases (PDE) zijn enzymen die cAMP inactiveren en een isovorm hiervan PDE III komt
vooral in myocardcellen voor. Remming van het enzym verhoogt dus ook de intracellulaire cAMPconcentratie. Daardoor toename van de vrije intracellulaire Ca-concentratie in het myocard, zodat de
contractiekracht toeneemt. (Positief inotroop)
PDE III-remmer: pimobendan, matig selectief.
Het positief inotrope effect op het myocard komt op 2 manieren tot stand.
1. Remming van PDE III stijging van de intracellulaire Ca-concentratie.
2. Myocardcellen worden gevoeliger gemaakt voor calcium.
Pimobendan heeft ook een vasodilaterend effect als gevolg van remming van PDE III en PDE IV in de
bloedvaten, waardoor de perifere weerstand afneemt. De therapeutische breedte van pimobendan
is groter dan van andere PDE-remmers en digitales en wordt dan ook langdurig gegeven bij honden
met chronisch hartfalen.
Sympathicomimetica
In gevallen van acuut hartfalen kunnen kortdurend ter stimulatie van de hartfunctie (hartstilstand)
adrenaline of dobutamine gebruikt worden. Deze heeft een kortdurende werking. Alleen door
specialisten!
Sympaticolytica (β-blokkers). Remmend effect op de HF en contractiekracht door blokkade van de
β1-receptor op het hart. (zie klasse II anti-aritmica)
Middelen die vasodilatatie bewerkstelligen
Vasodilatatieve middelen (middelen die de perifere weerstand verlagen) kunnen worden toegepast
bij een verhoogde perifere weerstand van de vaten en bij hypertensie. Als gevolg van hypertensie
kan orgaanschade optreden. Vooral de nieren / hersenen / hart zijn gevoelig voor schade door hoge
bloeddruk. Bij dieren is vooral bij oudere katten sprake van hypertensie. Als de primaire oorzaak niet
bekend is kan de bloeddruk op zichzelf worden aangepakt. Hierbij wordt de negatieve schade op
organen voorkomen. Hier zijn een aantal groepen voor;
1. Middelen met een primair effect op de bloedvaten
o organische nitraten (nitroglycerine, nitroprusside) induceren een relaxatie van
gladde spiercellen door de vorming van NO. Tussen deze stoffen zijn verschillen in
potentie op verschillende lokaties. Nitroprusside resulteert in de dilatatie van zowel
arteriolen als venulen, terwijl nitroglycerine vooral vaten in het veneuze systeem
dilateert. Resultaat van de vasodilatatie is een daling van de CVD en zodoende een
reductie van door het hart te leveren arbeid. Nitroglycerine wordt snel opgenomen
in de mondholte, heeft binnen enkele minuten effect. Peroraal is minder effectief,
omdat een groot gedeelte door het ‘first pass effect’ verloren gaat. Transcutaan is
ook mogelijk (draag dus handschoenen!) met een werkingsduur van 4-6 uur.
Nitroprusside moet Intra Veneus. Hypotensie kan gemakkelijk ontstaan.
o α1-blokkers: α1-receptoren komen voor op bloedvaten. Stimulatie van α1adrenoceptoren resulteert in vasoconstrictie. Blokkade van deze receptor heeft een
vermindering van de vasculaire weerstand in de arteriolen tot gevolg. Eerst krijg je
hierdoor een reflexmatige toename in HF en RAAS, maar na langdurige toepassing
normaliseert het weer. Bij een verhoogde sympathicotonus gaat de werking omhoog.
2. Middelen met een effect op de bloedvaten en het circulerend volume
o Diuretica; Verminderen het circulerend volume en daarmee de longstuwing bij
hartfalen. Acuut: furosemide
o ACE-remmers; Worden veelvuldig bij honden met congestief hartfalen toegepast.
Enalapril, benazepril en ramipril zijn pro-drugs: pas na hydrolyse in de lever
werkzaam. ACE-remmers remmen het ‘angiotensine converting emzyme’. Hierdoor
wordt angiotensine I niet meer omgezet in angiotensine II. Bij hartfalen wordt vaak
een activatie van het RAAS gezien. Doordat de nierperfusie minder wordt, neemt de
renineconcentratie in het bloed toe, waardoor meer angiotensine I en II ontstaat. De
aldosteronconcentratie stijgt vervolgens, waardoor vochtretentie en vasoconstrictie
optreedt. Hart wordt nog zwaarder belast, decompensatie. De ACE-remmer
blokkeert deze negatieve spiraal. Het heeft een vochtretentie verminderend effect
en als neveneffect vasodilatatie. Het kan in combinatie met furosemide, digoxine en
PDE-remmers.
Bijwerking: als patiënt diuretica gebruikt + er komt een ACE-remmer bij, sterke bloeddrukdaling.
Langzame opbouw is dan het idee.
3. Middelen met een effect op de bloedvaten en het hart
o PDE-remmers; Fosfodiësterases zijn enzymen die cAMP inactiveren. PDE-remmers
werken positief inotroop door verhoging van de intracellulaire
calciumbeschikbaarheid en verlagen de perifere R.
o Ca-kanaal blokkers: Calciumantagonisten blokkeren de spanningsafhankelijke Cakanalen primair in de SA- en AV-knoop. Hierdoor treedt remming op van de
sinusfrequentie en AV-geleiding. Tevens werken ze vasodilaterend, vooral op ateriën
en arteriolen. Afhankelijk van het geneesmiddel treedt er versterkte
myocardrelaxatie op en neemt de hartcontractiliteit af. Hypertensie kat: amlodipine
o (β-blokkers); Hart bezit β1-receptoren, worden geblokkeerd. Dus primair voor
behandeling van het hart. Maar tevens wordt de renine-afgifte in de nier geremd via
β1-receptor blokkade. Oudere niet-specifieke middelen zorgen echter ook voor
broncho en vasoconstrictie, en de toepassing is beperkt.
Middelen die hemostase en trombose beïnvloeden
Toegepast bij defecten in, of een overmaat aan coagulatie.
Heparine remt de stollingscascade door antitrombine III te activeren. AT III bindt aan de actieve
serineplaats van trombine: trombine wordt onderdrukt.
Door aan AT III te binden verandert heparine de structuur van AT III en verhoogd vervolgens de
snelheid van de werking. AT III heeft ook een remmende werking op andere stollingsfactoren ( factor
X).Heparine moet aan AT III en aan trombine binden om effect te hebben, ,maar voor factor X is
binding aan alleen ATIII voldoende.
Low Moleculair Weight Heparine hebben via AT III alleen een remmend effect op factor Xa. Ze zijn te
klein om ATIII en trombine tegelijk te binden.
Bijwerking: verhoogde bloedingsneiging door remmen van de stollingscascade. Deze kan verholpen
worden door een heparine anatgonist: protamine.
Heparine kan niet oraal worden toegedient.
Anticoagulantie (oraal)
Stoffen die de bloedstolling tegengaan/ vertragen.
Warfarine: vitamine K-antagonist (in rattengif). Remt de werking van vitamine K, hierdoor wordt de
activatie van de stollingsfactoren II / VII / IX / X voorkomen. Wordt vanuit het MDK snel opgenomen
en bindt aan plasma-eiwitten. Het wordt in de lever gemetaboliseerd en heeft een variabele
halfwaardetijd. Het veilig toedienen wordt verder gecompliceerd door vele bijwerkingen.
Middelen die de aggregatie van trombocyten beïnvloeden
Aspirine. (bloedverdunners) is een NSAID dat irreversibel aan het enzym cyclo-oxygenase bindt.
Hierdoor vindt remming van de activiteit van cyclo-oxygenase plaats en wordt minder tromboxane
A2 gevormd door trombocyten / minder prostaglandine I2 gevormd door het endotheel. De dosering
die gebruikt wordt (mini-asprine) is echter te laag om effecten in prostglandinen op te wekken.
Effecten houden aan zolang de trombocyt leeft, maar het endotheel kan wel het nieuwe enzym
aanmaken, dus korter effect op prostaglandinen.
Middelen die de fibrinolyse bevorderen
Nog weinig in de diergeneeskunde gebruikt.
Streptokinase is een stof afkomstig uit culturen van streptokokken. Omdat hier echter antilichamen
tegen worden gevormd, is hij na 4 dagen tot een jaar niet meer bruikbaar. Daarom ‘recombinant
tissue plasminogen activators’ (tPA),welke niet antigeen zijn en welke met name op fibrine-gebonden
plasminogeen effect hebben. Wanneer de stollingscascade wordt geactiveerd, wordt tegelijker tijd
ook de fibrinolyse bevorderd via verschillende endogene plasminogeenactivatoren. Bloedprop
induceert de secretie van tPA. tPA zet plasminogeen om in plasmine. Plasmine lost de bloedprop op.
Middelen ter preventie en behandeling van hartworm
Dirofilaria immitis; Behandeling: ivermectine / milbemycine / moxidextine
In gevallen van een acute pneumonitis t.g.v. een hartworminfectie wordt een behandeling met
cortico’s aanbevolen. Andere symptomatische behandelingen zouden nodig kunnen zijn. Preventief
kunnen deze middelen ook toegepast.
Angiostrongylus vasorum: leidt tot congestief hartfalen. Milbemycine of een combinatie van
imidaclopride en moxidectine. Het preventief toepassen van deze middelen is lastig.