Waarschuwing: sommige dingen missen in deze samenvatting, ik vind deze namelijk
vanzelfsprekend. Dit kan in jouw geval anders zijn, dus let op.
Scheikunde samenvatting se 1
Hoofdstuk 1: scheiden en reageren
Een zuivere stof is 1 stof met zijn specifieke eigenschappen, dus bestaande uit 1 soort
molecule of atomen. Als een zuivere stof maar uit 1 soort atomen bestaat is het ook een
element.
Een mengsel is een stof bestaande uit verschillende soorten moleculen. Om uit te zoeken of
een stof zuiver is of een mengsel, kun je de stof verwarmen. Bij een zuivere stof blijft de
temperatuur tijdens het smelten of koken dan hetzelfde (kook- of smeltpunt) en bij een
mengsel loopt de temperatuur langzaam op (kook- of smelttraject).
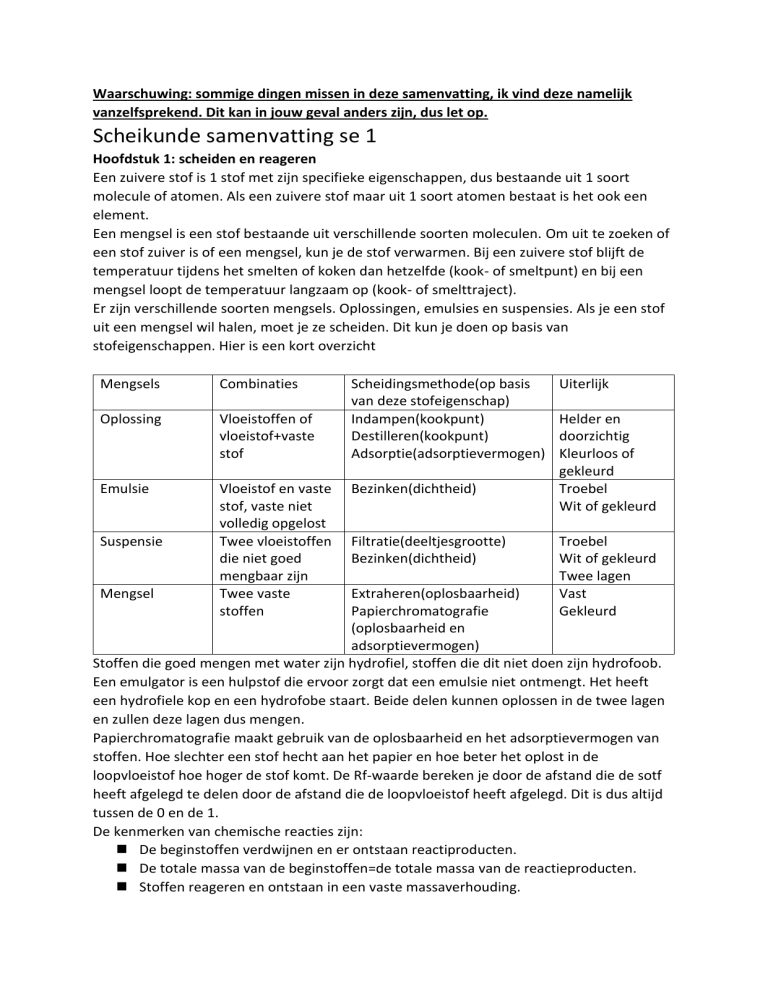
Er zijn verschillende soorten mengsels. Oplossingen, emulsies en suspensies. Als je een stof
uit een mengsel wil halen, moet je ze scheiden. Dit kun je doen op basis van
stofeigenschappen. Hier is een kort overzicht
Mengsels
Combinaties
Oplossing
Vloeistoffen of
vloeistof+vaste
stof
Emulsie
Vloeistof en vaste
stof, vaste niet
volledig opgelost
Twee vloeistoffen
die niet goed
mengbaar zijn
Twee vaste
stoffen
Suspensie
Mengsel
Scheidingsmethode(op basis
van deze stofeigenschap)
Indampen(kookpunt)
Destilleren(kookpunt)
Adsorptie(adsorptievermogen)
Bezinken(dichtheid)
Filtratie(deeltjesgrootte)
Bezinken(dichtheid)
Uiterlijk
Helder en
doorzichtig
Kleurloos of
gekleurd
Troebel
Wit of gekleurd
Troebel
Wit of gekleurd
Twee lagen
Vast
Gekleurd
Extraheren(oplosbaarheid)
Papierchromatografie
(oplosbaarheid en
adsorptievermogen)
Stoffen die goed mengen met water zijn hydrofiel, stoffen die dit niet doen zijn hydrofoob.
Een emulgator is een hulpstof die ervoor zorgt dat een emulsie niet ontmengt. Het heeft
een hydrofiele kop en een hydrofobe staart. Beide delen kunnen oplossen in de twee lagen
en zullen deze lagen dus mengen.
Papierchromatografie maakt gebruik van de oplosbaarheid en het adsorptievermogen van
stoffen. Hoe slechter een stof hecht aan het papier en hoe beter het oplost in de
loopvloeistof hoe hoger de stof komt. De Rf-waarde bereken je door de afstand die de sotf
heeft afgelegd te delen door de afstand die de loopvloeistof heeft afgelegd. Dit is dus altijd
tussen de 0 en de 1.
De kenmerken van chemische reacties zijn:
De beginstoffen verdwijnen en er ontstaan reactiproducten.
De totale massa van de beginstoffen=de totale massa van de reactieproducten.
Stoffen reageren en ontstaan in een vaste massaverhouding.
Er is een minimale temperatuur nodig, reactietemperatuur.
Er is een energie-effect.
Een reactie waarbij energie vrijkomt heet exotherm. De chemische energie in de stof wordt
omgezet in andere energie. Een reactie die energie nodig heeft heet endotherm.
Ontledingsreacties zijn altijd endotherm en verbrandingsreacties zijn altijd exotherm.
Energie-effecten treden ook soms op bij oplossen of faseveranderingen.
De energie die nodig is om een reactie plaats te laten vinden is de activeringsenergie. Bij een
endotherme reactie moet je naast de activeringsenergie ook energie blijven toevoeren
gedurende de reactie.
De verschillen in energie kun je laten zien in een energiediagram. Zo zien die eruit:
De vijf factoren die de reactiesnelheid bepalen zijn:
De verdelingsgraad
De soort stof
De temperatuur
De concentraties
De katalysator
Deze factoren zijn uit te leggen door middel van het botsende deeltjes model.
De concentratie: Er is een grotere concentratie, dus meer deeltjes per m 3, dus meer kans
dat ze botsen. Dit geldt alleen bij homogene mengsels, mengsels van stoffen in 1 fase (bv
vloeistof dus).
De temperatuur: de temperatuur wordt hoger, dus de deeltjes gaan sneller bewegen, dus ze
zullen sneller en heftiger botsen. Per tien graden temperatuurstijging verdubbelt de
reactiesnelheid ongeveer.
De verdelingsgraad: als de verdelingsgraad is groter is, is de stof fijner, dus is er meer
oppervlak om te raken, dus zal er sneller een botsing zijn. Dit speelt een rol bij heterogene
mengels.
De andere twee factoren zijn uit te leggen dankzij de activeringsenergie.
De soort stof: de soort stof maakt uit voor hoeveel energie nodig is om in de geactiveerde
toestand te geraken.
De katalysator: een katalysator zorgt ervoor dat er minder energie nodig is om in de
geactiveerde toestand te geraken.
Hoodstuk 2: bouwstenen van stoffen
Dalton zei dat een atoom een massief bolletje was en elke atoomsoort zijn eigen afmetingen
heeft.
Rutherford zei dat ze bestaan uit een positief geladen kern en daaromheen een
elektronenwolk van negatief geladen elektronen. Daartussenin zit een lege ruimte. Later
bleek de kern uit losse bolletjes te bestaan, neutronen en protronen. Verschillen tussen
atomen worden veroorzaakt door het aantal protonen in de kern. Het atoomnummer geeft
het aantal protonen aan. De som van de protonen en neutronen in de kern is het
massagetal. Het aantal neutronen kan binnen een soort atoom verschillen. Een atoom is
elektrisch neutraal.
Bohr zei dat de elektronen in banen om de kern zaten. Deze banen heten
elektronenschillen. De verdeling van de elektronen over de schillen heet de
elektronenconfiguratie. Isotopen zijn atomen met hetzelfde atoomnummer maar een ander
massagetal.
Zuivere stoffen die uit 1 soort atoom bestaan zijn elementen. Deze zijn ingedeeld in het
periodiek systeem. De kolommen heten groepen en de rijen heten perioden. Sommige
groepen hebben hun eigen naam:
Groep 1: alkalimetalen, H doet niet mee. Zachte metalen die van boven naar
beneden steeds heftiger reageren
Groep 2: aardalkalimetalen, harder en minder reactief dan de alkalimetalen. Ze
reageren ook niet met water
Groep 17: halogenen, reageren goed, vooral met metalen. Grootste deel komt als 2atomig voor in de natuur(BrINClHOF)
Groep 18: edelgassen, reageren bijna niet.
Ionen zijn atomen met een lading. Deze zijn of een elektron kwijtgeraakt of hebben een
elektron teveel. De elektronen in de buitenste schil heten valentie-elektronen. Elementen
met evenveel valentie-elektronen vallen in dezelfde groep in het periodiel systeem. Bijna
alle elementen willen 8 elektronen in hun buitenste schil hebben, en dit heet de octetregel.
De atoommassa wordt uitgedrukt in u, atomaire massaeenheid. De massa van een ion is
niet anders dan die van het atoom, omdat we de massa van elektronen verwaarlozen.
Rekenregels:
Telwaarden rond je niet af
Bij meetwaarden moet je rekening houden met nauwkeurigheid.
- Bij + en – moet je afronden op het laagste aantal decimalen.
- Bij keer en gedeeld door moet je afronden op het laagste aantal getallen.
De mol is een eenheid die gebruikt wordt om een hoeveelheid stof aan te geven. Dit is het
rekenschema:
Zoals je ziet is van mol af altijd keer, behalve bij molariteit.
Hoofdstuk 3: moleculaire stoffen
Stoffen zijn in te delen in drie groepen:
Metalen: geleiden stroom in vaste en vloeibare toestand, bestaan alleen uit
metaalatomen.
Zouten: geleiden stroom in vloeibare toestand, bestaan uit metaalatomen met nietmetaalatomen.
Moleculaire stoffen: geleiden geen stroom, bestaan alleen uit niet-metaalatomen.
Metaalbinding is de binding die ontstaat doordat valentie-elektronen in een metaalatoom
los laten. Zo ontstaat een positief atoom omringd door negatieve elektronen, die elkaar
aantrekken.
In een zout is ionbinding: het positieve ion (metaal) en het negatieve(moleculaire) trekken
elkaar aan.
In een moleculaire stof is alleen vanderwaalsbinding, de aantrakkingskracht tussen
moleculen.
De naam van een moleculaire stof eindigt altijd op –ide. Een atoombinding is een paar
elektronen dat wordt gedeeld door twee atomen.
Als het verschil in elektronegativiteit tussen de 0,4 en 1,7 ligt is de binding polair ( binas
tabel 40A. Bij een verschil van kleiner dan of gelijk aan 0,4 is de binding apolair.
Het kook- of smeltpunt van een stof hangt samen met de sterkte van de vanderwaalsbinding
( en andere bindingen). Als de molecuulmassa groter is, is de vanderwaalsbinding dat ook,
en het kookpunt ligt dus ook hoger.
Uitzonderingen in die regel worden veroorzaakt door onder andere waterstofbruggen, een
NH of OH groep. Moleculen die een lading hebben zijn polair, heten dipoolmoleculen, en
hebben dipool-dipoolbindingen. De O en N van de groepen hebben een groot verschil in
elektronegativiteit met de H, en vormen dus een sterke dipool-dipoolbinding, de
waterstofbrug.
Polaire stoffen lossen goed op in polaire stoffen en apolaire in apolaire. Apolaire stoffen
lossen niet goed op in polaire stoffen. Polaire stoffen zijn dus hydrofiel, want water is polair,
en apolaire stoffen zijn hydrofoob.
Een dynamisch evenwicht is een evenwicht waarbij de stof nog wel verplaatst tussen twee
andere.
Het percentage,%, is een honderdste. Promillage is een duizendste en ppm is een miloenste.
Hoofdstuk 4: zouten en zoutoplossingen
Een zout ontstaat tijdens een reactie tussen en metal en een niet-metaal. De binding is een
ionbinding.
Enkelvoudige ionen zijn ionen die uit 1 atoomsoort bestaan. De naam van een ion krijg je
door ion te zetten achter de naam van het atoom. Als verschillend ladingen mogelijkheden
zet je in romeinse cijfers de lading neer op deze manier: ijzer(III)ion. Een samengestedl ion
bestaat uit verschillende atoomsoorten.
De naam van het zout is dan makkelijk: de naam van het positieve ion gevolgd door de naam
van het negatieve ion.
Hydratatie is de omringing van een ion door water.
Het oplossen en indampen van zouten kun je als formule opschrijven.
Oplossen:
NaCl Na+ + Cllet op: kijk eerst naar tabel 45A of de stof goed oplost in water!
Dit is een oplosvergelijking.
Bij het indampen van een zout gebeurt het tegenovergestelde:
Na+ + Cl- NaCl
Als de maximale hoeveelheid van een stof is opgelost in een oplosmiddel, is de oplossing
verzadigd. Anders is de oplossing onverzadigd.
De vier zouten die reageren met water heten metaaloxiden: natronloog,kaliloog,kalkwater
en barietwater. NaOH, KOH, Ca(OH)2, Ba(OH)2
Sommige zouten nemen water op in hun kristalrooster als water toegevoegd wordt. Deze
stoffen heten zouthydraten. Dit geef je zo weer:
CuSO4 + 5H2O CuSO4 · 5H2O
Als je meer water toevoegt kan het zout alsnog gewoon oplossen.
Als een zout gehydrateerd wordt, is dit exotherm. Het afstaan van kristalwater is
endotherm. Een aantal formules staan in tabel 45B. Voor kleurveranderingen zie 65B.
De keuze van glaswerk beinvloedt de nauwkeurigheid van de meting.
De molariteit is het aantal mol van een stof per liter, aangegeven met M.
Hoofdstuk 5: reacties van zouten
Een s in tabel 45B in binas betekent dat die twee ionen samen niet oplossen en een vaste
stof, een neerslag vormen.
Als je bijvoorbeeld KI en Pb(II)(NO3)2 in een oplossing doet, splitsen ze eerst in de ionen
aangezien ze allemaal goed oplossen.
KI K+ + IPb(II)(NO3)2 Pb2+ + NO3Dan kijk je in tabel 45B en zie je dat:
INO3Pb2+
S
G
+
K
G
G
Pb2+ en I- zullen dus een neerslag vormen: Pb2+ + I- Pb(II)I2
Dit heet een neerslagreactie.
De drie toepassingen va nneerslagreacties zijn:
Een ionsoort verwijderen uit de oplossing
Een zout maken
Een ionsoort aantonen
Om een ionsoort te verwijderen zoek je een ion dat alleen slecht oplost met het ion wat je
uit de oplossing wil halen en dat voeg je toe met natrium of nitraat
Hoofdstuk 6
De organische chemie is de oude naam voor koolstofverbindingen. Koolwaterstoffen zijn stoffen die
uitsluitend uit kool- en waterstofatomen bestaan.
Koolwaterstoffen kunnen vertakt en onvertakt zijn. Een vertakking is een alkylgroep (methyl, ethyl,
propyl, etc.). Een homologe reeks is een groep stoffen die dezelfde algemene formule heeft (Vb.
Alkanen met CnH2n+2). Isomerie is dat twee of meer verschillende stoffen dezelfde molecuulformule
hebben, maar verschillende structuurformules. De stoffen heten dan isomeren.
Verzadigde koolwaterstoffen zijn stoffen met uitsluitend enkele bindingen tussen de atomen.
Onverzadigde koolwaterstoffen zijn stoffen met een of meer dubbele atoombindingen.
Alkanen – verzadigd, CnH2n+2
C – C – C – C (butaan)
Alkenen – onverzadigd, 1 dubbele binding, CnH2n
C – C = C – C (but-2-een)
Alkynen – onverzadigd, 1 driedubbele binding, CnH2n-2
C – C ≡ C – C (but-2-yn)
Als een molecuul in een ring voorkomt, heet het een cyclische verbinding, die wordt aangegeven in
de naam door het voorvoegsel cyclo-. Onvertakte en vertakte ketens heten ook wel acyclisch.
Cycloalkanen – verzadigd, cyclisch, CnH2n (isomeer aan alkenen)
(Er zijn ook cycloalkenen, cycloalkynen, etc. Cyclobut-1-een)
cyclobutaan
Aromaten zijn stoffen waarin een benzeenring voorkomt. Benzeen heeft de molecuulformule C6H6,
en alle C-atomen staan op gelijke afstanden van elkaar, ondanks de drie dubbele bindingen die er in
voorkomen. Alle koolwaterstoffen zonder benzeenring heten alifatisch. Als de benzeenring als
zijgroep voorkomt, heet het een fenyl (Vb. Methylfenyletheen)
Naamgeving:
(zie ook Binas tabel 66D)
1. Langste onvertakte keten (dubbele bindingen moeten in de hoofdketen, ookal is dat niet de
langste optie)
2. Stamnaam geven
3. Zorg dat de alkylgroepen met de laagste nummering beginnen
4. Naam zijgroep voor naam hoofdketen
5. Zelfde keten meerder keren: di, tri, tetra, etc.
6. Meerdere zijgroepen: alfabetische volgorde
Vb. 4-ethyl-2,2-methylhexaan
Bij alkenen, alkynen, etc. Wordt de plaats van de dubbele binding met een cijfer aangeduid voor het
achtervoegsel. (Vb. But-1-een)
Alkadiënen – onverzadigd, 2 dubbele bindingen, CnH2n-2
Buta-1,3-dieen
In koolstofverbindingen kunnen naast kool- en waterstofatomen ook zuurstof-, stikstof- en
halogeenatomen voorkomen. Zo’n atoom of groep atomen worden een karakteristieke groep
genoemd. Stoffen met dezelfde karakteristieke groep, vormen met elkaar een klasse. De
karakteristieke groep met de hoogste prioriteit (Binas tabel 66D) heet de hoofdgroep en bepaalt het
achtervoegsel achter de stamnaam. (Vb. Ethanol)
Halogeenverbindingen kennen geen achtervoegsel; ze kunnen geen hoofdgroep zijn.
Halogeenatomen vormen altijd een zijgroep, en worden met een hun atoomnaam aangegeven (Vb.
Fluorethaan). De vorming van een halogeenverbinding kan plaatsvinden door middel van een
chemische reactie waarbij substitutie of additie plaatsvindt.
Bij substitutie wordt een H-atoom vervangen door een halogeenatoom. Er valt niet van te voren te
bepalen welk H-atoom vervangen zal worden. Deze reactie verloopt alleen onder invloed van licht.
Additie kan alleen plaatsvinden bij een onverzadigde stof. De dubbele binding wordt een enkele
binding, en aan beide C-atomen komt een halogeenatoom.
Ethers zijn verbindingen waarin de karakteristieke groep C – O – C zit.
Ook deze kunnen niet met een achtervoegsel aangegeven worden. Als
aan deze groep alleen H-atomen en/of alkylgroepen zijn gebonden,
heten het alkoxyalkanen. (Vb. Methoxyethaan)
De algemene formule is CnH2n+2O.
Alle koolstofverbindingen waarin de hydroxylgroep -OH voorkomt, heten alcoholen.
De simpelste groep in de alcoholen is de alkanolen. Dit is een alkaan waarin een H-atoom vervangen
is door -OH. Als de hydroxylgroep de belangrijkste groep is in het molecuul, dan wordt het
achtervoegsel -ol gebruikt (Vb. Ethanol). Is er een groep met een hogere prioriteit aanwezig, dan
komt het voorvoegsel hydroxy-. De algemene formule is CnH2n+2O. Alkoxyalkanen en alkanolen zijn
dus isomeer.
Als er een -OH groep direct aan een aromatische ring (benzeenring) gebonden is,
heet dat een fenol. (Vb. Benzenol)
Aldehyden zijn verbindingen waarin de groep:
Voorkomt. De simpelste groep aldehyden is die van de alkanalen, welke maar een aldehyde groep
hebben. Als het de belangrijkste groep is, wordt het achtervoegsel -al gebruikt (Vb. Methanal). Is het
niet de belangrijkste groep, dan wordt het voorvoegsel oxo- gebruikt (Vb. Oxoetaanzuur).
Ketonen zijn verbindingen met de groep:
Alkanonen zijn de simpelste groep, met maar een ketongroep. Als het de belangrijkste groep is,
wordt het achtervoegsel -on gebruikt (Vb. Propanon). Is het niet te balngrijkste groep, wordt ook
hier het voorvoegsel oxo- gebruikt. Als het 1-oxo... is, is het een alkanal. Als het 2-oxo... is, of een
hoger cijfer, dan is het een alkanon.
Carbonzuren zijn de belangrijkste karakteristieke groep. Is er een groep (-COOH)
aanwezig, dan is het een alkaanzuur. Dit krijgt altijd het achtervoegsel -zuur (Vb.
Methaanzuur). Als het C-atoom niet tot de hoofdgroep kan worden gerekend, dan
komt het achtervoegsel -carbonzuur in plaats van -zuur. (Vb. Benzeencarbonzuur)
Als er twee carbonzuren in een molecuul zitten, heet het een dizuur, als er drie in
voorkomen een trizuur, etc. (Vb. Ethaandizuur)
Esters is een klasse van verbindingen met de groep:
De eenvoudigste groep zijn de alkylalkanoaten (Vb. Ethylethanoaat). Hierin in de alkyl het aantal Catomen dat aan de enkelgebonden O vast zit. Esters worden gemaakt van een carbonzuur en een
alcohol. Daarbij ontstaat water. Dat is altijd een evenwichtsreactie.
Soms wordt een beschrijving gegeven van een naam van een ester in plaats van een systematische
naam, omdat het anders erg ingewikkeld wordt, zoals (1-methylethyl)propanoaat = de ester van
propaanzuur en 2-propanol.
Oliën (vloeibaar bij kamertemp., onverzadigd) en vetten (vast bij kamertemp., verzadigd) zijn esters
van glycerol (Porpaan-1,2,3-triol) en vetzuren. De meeste oliën en vetten zijn triglyceriden: tri-esters
van glycerol.
De vetzuren bestaan uit lange, onvertakte ketens met een even aantal
C-atomen.
Bij sommige vetzuren komen 1 of meer dubbele bindingen voor.
Triglyceride
(Binas 67G is bekendste vetzuren)
Aminen zijn groepen met de groep:
Er bestaan primaire, secundaire en tertiare aminen. De R-groepen zijn meestal alkynen.
Als er geen belangrijkere groep aanwezig, komt het achtervoegsel -amine achter de stamnaam. In
dat wel het geval, dan komt voorvoegsel amino- (Vb. Aminoethaanzuur).
Aminozuren zijn verbindingen met zowel een amino- als een (carbon)zuurgroep in het molecuul.
Systematische naam
Ethanol
Benzenol
Ethaan-1,2-diol
Propaan-1,2,3-triol
Methaanzuur
Ethaanzuur
Systematische naam
Propaanzuur
Butaanzuur
Pentaanzuur
Dodecaanzuur
Octadecaanzuur
Triviale naam
Alcohol
Fenol
Glycol
Glycerol
Mierenzuur
Azijnzuur
Triviale naam
(Propionzuur)
Boterzuur
Valeriaanzuur
Laurinezuur
Stearinezuur
Hoofdstuk 12: molecuulbouw en stofeigenschappen
Bij de ruimtelijke bouw van een molecuul spelen alleen de valentie-elektronen een rol. In
een lewisstructuur teken je de structuurformule van een molecuul met alle valentieelektronen. Bij het opstellen van een lewisstructuur moet je altijd letten op de octetregel,
dus elk atoom moet 8 elektronen in 4 paren om zich heen hebben, waarbij bindingen tellen
als 2 elektronen voor beide atomen. Deze bindingen worden nog steeds weergegeven met
een streepje. Denk erom dat een waterstofatoom altijd maar 2 valentie-elektronen heeft,
en P, N en S een uitgebreid octet kunnen hebben.
Stappenplan lewisstructuur opstellen, met als voorbeeld CO32-:
1. Bepaal het aantal valentie-elektronen (binas tabel 99, linksonderin het atoomblokje)
C heeft 4
O heeft 6
De lading is 2-, dus dat is nog 2
1*4+3*6+2=24 elektronen
2. Bereken het aantal elektronen dat nodig is om aan de octetrelgel te voldoen
C moet 8
O moet 8
1*8+3*8=32
3. Bereken hoeveel elektronen je tekortkomt
Stap 2 – stap 1
32-24= 8 tekort
Dit moeten dus de bindingen zijn, aangezien deze elektronen gedeeld worden
4. Bereken het aantal bindende paren
8/2=4 bindingen
5. Bereken hoeveel niet bindende paren overblijven
Stap 1/2 – stap 4
24/2-4=8 paren over
6. Teken de lewisstructuur
de formele lading is de lading van 1 atoom in een samengesteld ion.
Stappenplan om deze te bepalden, weer met carbonaation:
1. Bepaal het aantal elektronen bij elk atoom. Hierbij telt elke binding voor 1 elektron.
C: 4*1 = 4 voor bindingen
Enkelgebonden O’s: 1*1 + 2*3(voor vrije paren) = 7
Dubbelgebonden O: 2*1 + 2*2 = 6
2. Bepaal de valentie-elektronen van elk atoom (= stap 1 voor lewisstructuur tekenen)
C: 4
O: 6
3. Bereken formele lading
Valentie-elektronen – getelde elektronen (stap 2 – stap 1 per atoom)
C: 4-4=0
Dubbelgebonden O: 6-6=0
Enkelgebonden O’s: 7-6=1
4. Noteer de formele ladingen
De enkelgebonden O’s hebben dus 1 elektron teveel, dus ze hebben een formele
lading van -1
Er moeten cirkels om de minnetjes, maar dat is veel werk.
Om de ruimtelijke bouw te weten, moet je naar het omringingsgetal kijken van het centrale
atoom. Dit zijn alle atomen die direct zijn verbonden aan het centrale atoom plus de vrije
elktronenparen van het atoom. De C in het carbonaation heeft dus een omringingsgetal van
3. Dit is dan hoe de moleculen eruit zien ruimtelijk gezien:
Omringingsgetal
Molecuulbouw
Bindingshoeken
2
Lineair
180 graden
3
Driehoek
Ongeveer 120 graden
4
Tetraëder (4 keer een
Ongeveer 109 graden
driehoek als vlak)
een molecuul is pas polair als er een polaire binding in te vinden is en er een duidelijk
negatief en positief punt te ondercheiden zijn. Om dit te bepalen heb je dus ook de
ruimtelijke structuur nodig.
Als je voor 1 molecuul of ion meerdere lewisstructuren kan tekenen heet dit mesomerie. De
twee structuren heten dan mesomere grensstructuren doen. Deze noteer je met een pijl
ertussen , ↔. De stof bestaat dan uit alle mogelijke grensstructuren tegelijk.
Om alle mesomere grensstructuren te vinden teken je eerst de lewisstructuur met formele
ladingen. Vervolgens verplaats je elektronenparen. Hierbij moet je er wel op letten dat dit
kan natuurlijk.
Een reactiemechanisme is de beschrijving van het verloop van een reactie.
Bij een substitutiereactie vervang je een deel van het molecuul.
Het reactiemechanisme van een substitutiereactie met radicalen, met als voorbeeld de
vorming van broommethaan:
1. Initiatie: Broom wordt onder uv licht omgezet tot twee radicalen
Br2 2Br●
2. Propagatie: het radicaal reageert met methaan
Br● + CH4 HBr + CH3●
En vormt een waterstofbromide en een methylradicaal. Het methylradicaal reageert
vervolgens met broom tot broommethaan en broommethaan.
CH3● + Br2 CH3Br + Br●
3. Terminatie: de overige radicalen botsen en reageren tot broommethaan.
CH3● + Br● CH3Br
Het ionair mechanisme:
Het negatieve ion noem je nucleofiel en het positieve ion noem je elektrofiel
Sorry daarvoor, heb alleen paint en ben nou eenmaal niet geweldig.
Bij een additiereactie maak je uit 2 moleculen 1 molecuul.
Radicaalmechanisme additie, met als voorbeeld HCl + etheen chloorethaan:
1. Initiatie: waterstofchloride wordt 2 radicalen
HCl H● + Cl●
2. Propagatie: etheen reageert met het chloorradicaal en wordt een
chloorethaanradicaal.
Cl● + CH2=CH2 CH2Cl-CH2●
Dit reageert door met waterstofchloride tot chloorethaan en een chloorradicaal
CH2Cl-CH2● +HCl CH2Cl-CH3 + Cl●
3. Terminatie: het waterstofradicaal reageert met het chloorethaanradicaal
CH2Cl-CH2● + H● CH2Cl-CH3
Het ionair mechanisme van een additie, met als voorbeeld de vorming van 1,2dichloorethaan:
Structuurisomeren zijn verschillende stoffen met verschillende eigenschappen
Steroisomeren zijn stoffen waarbij de volgorde van atomen hetzelfde is maar de ruimtelijke
oriëntatie anders is.
Een vorm hiervan is cis-trans-isomerie. Hierbij kunnen bepaalde atomen of groepen
tegenover elkaar of naast elkaar staan:
Spiegelbeeldisomeren zijn moleculen die niet identiek aan hun spiegelbeeld zijn. Dit zijn
altijd ook stereoisomeren. Zodra je een asymmetrisch koolstofatoom, een koolstofatoom
met 4 verschillende groep eraan ziet, is het een spiegelbeeldisomeer.
Stoffen die de trillingsrichting van licht kunnen verdraaien noem je optisch actief. Deze
stoffen bestaan altijd uit spiegelbeldisomeren. Het ene isomeer verdraaid het licht naar
links, de ander naar rechts. Als je van beide isomeren evenveel in een mengsel hebt
verdraaid die het licht niet, dit heet een racemisch mengsel. Het verdraaien an de
trillingsrichting kun je meten met een polarimeter.
Bij meerdere asymmetrische C-atomen kun je gemakkelijk de spiegelbeeldisomeren
berekenen: bij n C-atomen is het aantal spiegelbeeldisomeren 2n.












