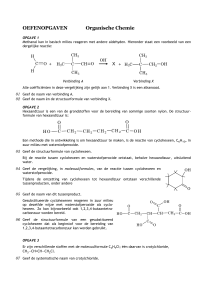
Alcoholen
Primair alcohol
Secundair alcohol
Tertiair alcohol
Bereiding
• uit alkeen door additie van H2O
• door hydrolyse van halogeenalkaan
• door reductie van alkanal en alkanon
• door reactie van alkanal en alkanon
met Grignard reagens, gevolgd door
hydrolyse
• door reactie van primair amine met
HNO2
• door alcoholische gisting van glucose
Eigenschappen
• OH – groep = hydroxylgroep
• reactie met anorganische zuur
• reactie met organische zuur tot
ester ( = evenwichtsreactie)
• oxidatie tot alkanal / alakanon /
carbonzuur
• reactie met metaal tot alcoholaat
• ontwatering bij lage temp en
overmaat alcohol ter vorming van
ether
• reactie met zuuramide tot ester ( =
evenwichtsreactie)
• reactie met zuurchloride tot ester
Ethers
Bereiding
Asymmetrisch ether
Eigenschappen
• door ontwatering van alcoholen bij
lage temp en overmaat alcohol
• door reactie van halogeenalkaan en
alcoholaat (= Williamsonsynthese)
Aminen
Bereiding
• door reactie van halogeenalkaan met
NH3
• door reactie van zuuramide met
NaClO (= Hofmanse afbraak)
Symmetrisch ether
• vooral als oplosmiddel en
extractiemiddel (weinig polair)
• weinig reactief
• brandbaar / explosief (worden
omgezet to peroxiden, zelfs in de
fles, die zeer explosief zijn)
Primair / secundair en
tertiair amine
Eigenschappen
• reactie van primair amine met
HNO2 tot alcohol
• Brönsted base
• vorming van quaternaire
ammoniumzouten
Aldehyden en ketonen
O
R’ = H -> aldehyde
R’
R’ = C-keten -> keton
R–C
Eigenschappen
Bereiding
• reactie met Grignard reagens tot
alcohol
• door oxidatie van alcohol
• door reductie van carbonzuur
• reductie tot alcohol
Carbonzuren
Bereiding
• door oxidatie van primair alcohol of
alkanal
• door reactie van Grignard reagens +
CO2, gevolgd door hydrolyse
• door reactie van zuurchloride met
H2O
• door reactie van zuuramide met
HNO2
Eigenschappen
• zwakke zuren pKa > 2
• reactie met alcohol tot ester
• reactie met anorganische
hydroxiden tot organische zouten
• reductie tot alkanal / alcohol
• reactie met PCl3 / PCl5 of SOCl2 tot
zuurchloride
• reactie met NH3 tot zuuramide
Esters
Bereiding
Eigenschappen
• door reactie van carbonzuur met
alcohol
• reactie met H2O tot carbonzuur en
alcohol
• door reactie van zuurchloride met
alcohol
• reactie met NH3 tot zuuramide en
alcohol
• door reactie van zuuramide met
alcohol
• reactie met anorganische base tot
zout en alcohol
Zuurchloriden
Bereiding
• door reactie van carbonzuur met PCl3
/ PCl5 / SOCl2
Eigenschappen
• reactie met H2O tot carbonzuur en
HCl
• reactie met NH3 tot zuuramide en
HCl
• reactie met alcohol tot ester
Zuuramiden
Bereiding
• door reactie van zuurchloride met
NH3
• door reactie van ester met NH3
• door reactie van een carbonzuur met
NH3
Eigenschappen
• reactie met NaClO tot amine, CO2
en NaCl (Hofmanse afbraak)
• reactie met HNO2 tot carbonzuur,
N2 en H2O
• reactie met alcohol tot ester en
NH3
Aardolie
aardgas
zuurchloride
Alkaan
Alkeen
polymeer
amide
amine
halogeenalkaan
ester
carbonzuur
Alkyn
Aromatische
KWS
Aldehyde / keton
alcohol
ether
suiker
Organische synthese
A. Verbranding
Vooral alkanen zijn brandbaar
CH4 + 2 O2 CO2 + 2 H2O
2 CH4 + 3 O2 2 CO + 4 H2O
weinig reactief (paraffinen) , sterke covalente
bindingen, apolair
door gefractioneerde destillatie gewonnen uit aardolie
enkel reactie met O2 en dihalogenen
B. Halogenering
Algemeen: CnH2n+2
Licht
+ X2 CnH2n+1X + HX
licht
CH4 + Cl2
CH3Cl + HCl
1. Initiatie homolytische splitsing
Cl
Cl
U.V.
Cl
+
Cl
Door belichting (UV) ontstaan er chloorradicalen die zeer reactief zijn
Het aantal radicalen neemt toe = typisch voor initiatie
2. Propagatie kettingreactie
CH 4 +
Cl
CH 3 + Cl 2
CH 3 + HCl
CH3 Cl
+
Het gevormde chloorradicaal reageert met een methaanmolecule
Het aantal radicalen blijft gelijk = typisch voor propagatie
Cl
CH2 Cl
+ Cl 2
CH3 Cl
+
Cl
CH 2Cl 2 +
CH2 Cl
Op analoge manier kunnen CHCl3 en CCl4 ontstaan
3. Terminatie kettingreactie
Radicalen reageren met elkaar.
Het aantal radicalen neemt af = typisch voor terminatie
Cl
+ HCl
C. Kraking
Bij pyrolyse van alkanen wordt de C – C binding verbroken
Er ontstaan alkylradicalen, die opnieuw kunnen combineren tot alkanen of alkenen
Thermische kraking / katalytische kraking
D. Eliminatie
= Reactie waarbij door onttrekking van 2 atomen of atoomgroepen aan het
substraat, een meervoudige binding ontstaat.
a) Ontwatering van alcoholen
Algemeen:
H2SO4
alcohol
hoge temp
alkeen + H2O
H2SO4/170°C
CH3 – CH2 –OH
CH2 = CH2 + H2O
b) halogeenzuureliminatie
Algemeen:
hoge T/KOH
halogeenalkaan
CH3 – CH2 – CHCl – CH3
alkeen + HX
hoge T/KOH
CH3 – CH = CH – CH3 + HCl
CH3 – CH2 – CH = CH2
E. Additie
= Reactie waarbij een -bindingwordt verbroken en 2 atomen of
atoomgroepen worden gebonden.
a) Additie van halogenen
Algemeen:
alkeen + X2
CH2 = CH2 + Br2 CH2Br – CH2Br
halogeenalkaan
Elektrofiele additie
b) Additie van zuren
Algemeen:
alkeen + HX
halogeenalkaan
CH3 – CH = CH2 + HBr CH3 – CHBr – CH2
Elektrofiele additie
! Regel van Markovnikov!
c) Additie van H2
Algemeen:
alkeen + H2
CH3 – CH2 – CH = CH2 + H2
alkaan
Kat. Pt
CH3 – CH2 – CH2 – CH3
d) Additie van H2O
Algemeen:
alkeen + H2O
alkanol
CH2 = CH2 + H2O CH3 – CH2OH
Grignard reagentia
• zeer belangrijk voor organische
synthese
• gemaakt door halogeenalkanen in
droge etherige oplossing (er mag
geen spoortje water aanwezig
zijn, want dit kan met het
magnesiumpoeder en met het
gevormde product reageren!) te
laten reageren met magnesium.
•Deze synthese werd voor het
eerst uitgevoerd door Victor
Grignard, vandaar de naam.
• algemeen:
R – X + Mg
ether
R – Mg – X
voorbeeld:
CH3 – X + Mg
ether
CH3 – Mg – X
• Broom- en joodalkanen zijn het
best geschikt
H
H
- +
C Mg
I
H
Grignardreagentia zijn dus reagentia
waarin een koolstofatoom tamelijk
sterk negatief geladen is en daarom zo
belangrijk voor organische reacties
F. Substitutie
a) Vorming van alcoholen door hydrolyse van halogeenalkanen
Algemeen:
halogeenalkaan + H2O
alcohol + HX
CH3 – CH2 – Cl + H2O CH3 – CH2 –OH + HCl
Nucleofiele substitutie
b) Vorming van esters
Algemeen:
1. Alcohol + anorganisch zuur zout + H2O
H+
2. Alcohol + organisch zuur
1.
CH3 OH + HBr
2.
CH3COOH + C2H5OH
CH3 OH + HOSO3H CH3OSO3H + H2O
CH3Br + H2O
CH COOC H
3
ester + H2O
2
5
+ H2O
c) Vorming van aminen
Algemeen:
halogeenalkaan + NH3
amine + HX
CH3 –Br + NH3 CH3 – NH2 + HBr
primair amine
CH3 –Br + CH3 – NH2 CH3 – NH – CH3 + HBr
secundair amine
CH3
CH3 –Br + CH3 – NH – CH3 CH3 - N - CH3 + HBr
tertiair amine
Opmerking: amine = base (Brönsted)
CH3 – NH2 + H2O CH3 – NH3+ + OH-
Nucleofiele substitutie
G. Degradatie
Hofmannse afbraak
Algemeen:
amide + NaClO
CH3 – C
O
amine + CO2 + NaCl
+ NaClO CH3 – NH2 + CO2 + NaCl
NH2
Opmerking: Bij organische synthese:
Om de C-keten te verkorten: Hofmannse afbraak
Om de C-keten te verlengen: Grignard reagentia
Opmerking: nog enkele belangrijke reacties
H2SO4 / T>150°C
1. Alcohol
alkeen + H2O
H2SO4 / T<150°C/ overmaat alcohol
Alcohol
Vb. 2 CH3–CH2–OH
ether + H2O
CH3-CH2-O-CH2-CH3 + H2O
2. Williamsonsynthese:
Na-alcoholaat + halogeenalkaan ether + NaCl
Vb. CH3-ONa + CH3-CH2-Cl
CH3-O-CH2-CH3 + NaCl
3. Amine + HNO2 alcohol + N2 + H2O
Vb. CH3-NH2 + HNO2 CH3-OH + N2 + H2O
H. Reacties met aromatische verbindingen:
elektrofiele substitutie
a) Herhaling: benzeen
Kékulé (1865)
elektronen zijn verdeeld over alle bindingen:
mesomerie of resonantie stabiliteit enkel
elektrofiele substituties op benzeenring
Voorstelling:
BENZEEN
C6H6
De benzeenring komt voor in
zeer veel gebruiksstoffen.
Kan kanker veroorzaken
Licht ontvlambaar
Giftig: gevaar voor ernstige schade aan de gezondheid bij langdurige
blootstelling door inademing, aanraking met de huid of opname langs
de mond
Blootstelling vermijden - aanwijzingen raadplegen voor gebruik
Bij ongeval of indien men zich onwel voelt onmiddellijk een arts
raadplegen (etiket tonen)
H
Cl
C
Cl
CCl3
DDT
O
OH
C
O
NH2
CH
C
CH2
O
NH
CH
C
O
CH3
COOH
CH2
O
C
COOH
O
Benzoëzuur
(bewaarmiddel)
Aspartaam (zoetstof)
Aspirine
CH3
b) Isomerie bij benzeenderivaten
disubstitutieproducten
CH3
1
CH3
2
CH3
CH3
1
1
3
1,2-dimethylbenzeen
o-xyleen
ORTHO
2
2
3
CH3
1,3-dimethylbenzeen
m-xyleen
META
4
CH3
1,4-dimethylbenzeen
p-xyleen
PARA
trisubstitutieproducten
1,2,3-trinitrobenzeen
1,2,4-trinitrobenzeen
1,3,5-trinitrobenzeen
aromatische verbindingen als substituent
O
C
O
difenylether
difenylketon
oriënterende kracht van de substituenten
1. Elektrondonors: OH-, O-, NH2, halogenen
NH2
Aminobenzeen
(aniline)
NH2
NH2
NH2
NH2
Elektrondonors als substituent zijn ortho- para-richtend
1. Elektronacceptors: NO2, NH3+, CN, COOH
NO2
NO2
NO2
NO2
El
El
nitrobenzeen
El
Elektronacceptors zijn meta-richtend
o-
El
m-
p-
c) Voorbeelden van elektrofiele substitutiereacties
Halogenering
+ Br2
FeBr3
Br
+ HBr
Br 2
FeBr 3
of
AlBr 3
++++
broombenzeen
Friedel-Craftreactie
Nitrering
NO2
H2SO4
+ HNO3