Chromosomen/chromatiden
http://www.vcbio.science.ru.nl/virtuallessons/cellcycle/chromosome/
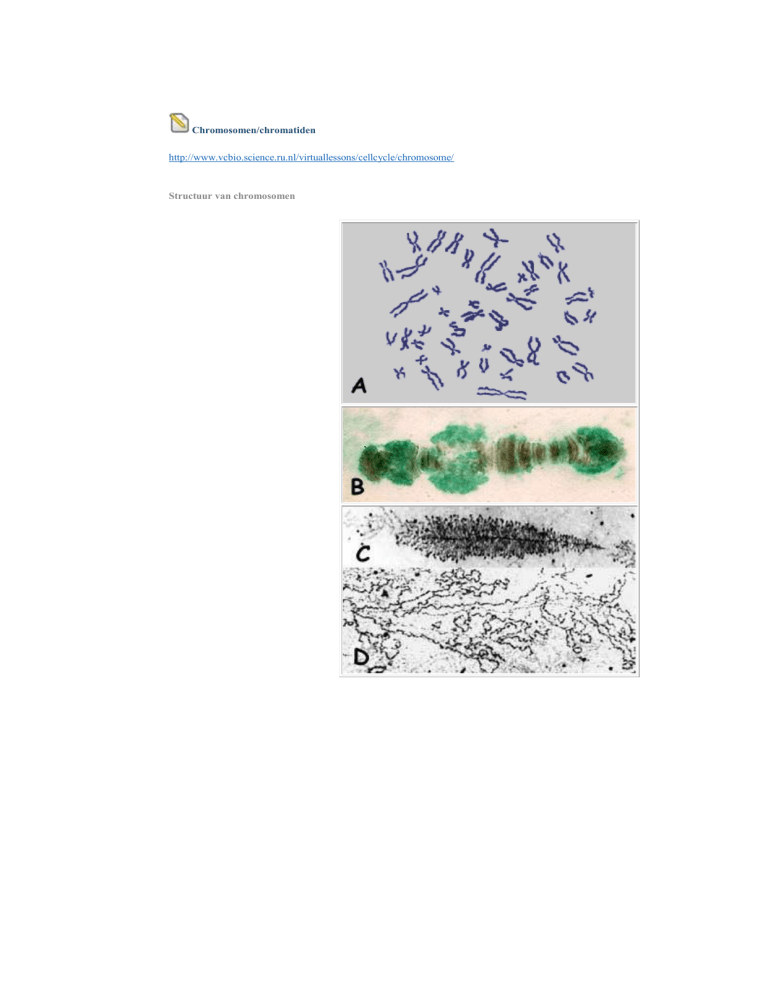
Structuur van chromosomen
Een chromosoom bestaat uit
een lang DNA-molecuul, dat ligt opgerold rond eiwitmoleculen. Vooral de histonen (positief geladen regio' s met
arginine en lysine-rijke, sterk basische eiwitten) spelen een rol bij het "inpakken" van DNA doordat ze aan het
negatief geladen DNA molecuul kunnen binden. Het DNA en de chromosoomeiwitten samen worden ook
wel chromatine genoemd (met de uitgang ine).
Tijdens het normale voortbestaan van cellen is het DNA van de chromosomen niet volledig opgerold. Op plaatsen
waar het DNA wordt afgelezen is het zelfs helemaal ontrold, zodat de betrokken enzymen erbij kunnen. Pas aan
het begin van celdelingen, zowel bij mitose als meiose, wordt het DNA zeer strak en spiraalsgewijs opgerold. Dit
proces wordt condensatie of spiralisatiegenoemd en zorgt ervoor dat de chromosomen als compacte pakketen
makkelijk verdeeld kunnen worden (Figuur E, of klik voor een Zoom. Opgerolde chromosomen zijn goed
zichtbaar onder een lichtmicroscoop).
Legende bij de figuren A-E. (A en E. Computer-gegenereerde illustraties; foto's B-D: J. Derksen).
A Een karyogram van de mens, Homo sapiens. Deze licht-microscopische preparaten worden standaard gemaakt
van metafase stadia van lymfocyten die met Giemsa's gekleurd worden. De twee chromatiden van ieder
chromosoom zijn in dit stadium gescheiden zichbaar. De verdubbeling van de chromosomen heeft
plaatsgevonden in de voorafgaande S-fase.
B Reuzechromosoom van de speekselklier van de mug Chironomus tentans. Het chromatine is donkerbruin
gekleurd met orceine. Stukken met sterk gecondenseerd chromatine (de banden) wisselen af met stukken minder
sterk gecondenseerd chromatine (interbanden). De grote opzwellingen of Balbianiringen zijn plaatsen waar zeer
veel RNA gesynthetiseerd wordt. Ze zijn gekleurd met Fast Green.
C Het ribosomale gen van de nucleolus van Drosophila (het fruitvliegje). (ribosomale genen produceren het RNA
voor de ribosomen die in de cel de translatie van het messenger RNA naar het eiwit uitvoeren). De afbeelding laat
de typische "kerstboom structuur" zien met als "stam" het gen en daaraan vasthangend talrijke RNA/eiwit ketens
die in lengte toenemen naarmate de synthese vordert. Het preparaat is gemaakt door het chromatine in een
basische oplossing uiteen te laten vallen en daarna in het electronen microscoop af te beelden ("Miller
spreiding").
D Afbeelding van een gen dat codeert voor eiwitten; het produceert dus messenger RNA. De afbeelding is op
dezelfde wijze gemaakt als in C. In vergelijking met C zijn de zijketens minder talrijk, langer en vaak
ingevouwen.
E Schema van het oprollingsproces van een DNA molecuul tot een gecondenseerd chromosoom gedurende de
deling.
Een chromosoom bestaat echter niet alleen uit genen als dragers van erfelijke informatie. Op chromosomen
komen er ook structurele stukken DNA tussen de genen in, met name het telomeer en het centromeer, die beide
een bijzondere functie hebben tijdens replicatie en celdelingen:
1.
2.
Het centromeer (centron = midden, meros = deel) is het gebied van het chromosoom waar de na de
replicatie gevormde chromatiden bijeengehouden worden. Dit gebied bevat de kinetochoor, een
eiwitcomplex waaraan de draden van de kernspoel zich aanhechten tijdens de mitose, dan wel de
meiose. Het centromeer blijft relatief ongespiraliseerd tijdens de profase en metafase en verschijnt dan
als "primaire insnoering". Bivalenten is de naam voor de paren homologe chromosomen die
verstrengeld zijn (in synapsis) gedurende profase I en metafase I van de meiose.
Het telomeer (Gr. telos = eind, meros = deel) is een stukje DNA dat aan de uiteinden van de
chromosomen voorkomt en dient ter bescherming tegen afbrokkelen van het DNA. Sterk repeterende
zogenaamde satelliet sequenties worden in samenhang gebracht met telomeren. Tijdens de replicatie
kunnen de telomeren niet altijd volledig worden gekopieerd waardoor ze na zo'n celdeling een stukje
korter worden. Wanneer het enzym telomerase in de cel aanwezig is kunnen de telomeren weer
verlengd worden, maar bij te ingerijpende verkorting is wordt het chromosoom onomkeerbaar
beschadigd waardoor de cel niet meer correct kan delen en afsterft. Daarentegen kunnen cellen met
een actief telomerase zich voortdurend blijven delen.
Chromosomen worden getypeerd op basis van grootte, plaatsing van het centromeer en de aan/afwezigheid van satellieten.
A. Telocentrisch, B.
Acrocentrisch en C.
Metacentrisch chromosoom
2n 1 c betekent twee homologe
(diploide) maar ongerepliceerde
chromosomen (enkel
chromatide).
1n 1c een enkele chromosoom
(haploid) dat ongerepliceerd is.
2n 2c zijn twee homologe
chromosomen (diploid)
bestaande elk uit twee zusterchromatiden (twee gele en twee
blauwe).
1n 2c is een enkel chromosoom
waarin DNA gedupliceerd is.
Computer-gegeneerde
illustratie gebaseerd op
een microfoto: rood =
chromosomen en gele
fluorescentie = telomeren
die met een specifiek
probe zijn gemerkt.
Enkelvoudig en tweevoudig n en c
De begrippen over aantallen chromosomen en chromatiden zijn best verwarrend en daarom zetten we
ze in deze "opfriscursus" op een rijtje:
o
o
o
o
Het chromosomenaantal in de vorm van chromosomen wordt aangeduid met de kleine
letter bnb.
Het chromatidenaantal, dat is het aantal sets DNA moleculen, wordt aangegeven met de
kleine letter bcb.
Normale lichaamscellen van diploide organismen bevatten steeds paren homologe
chromosomen. Deze cellen zijn in principe genetisch allemaal gelijk aan elkaar en aan de
zygote (het produkt van de bevruchting) waar ze van af stammen. Per set homologe
chromosomen is steeds een exemplaar van de moederkant en een andere exemplaar van de
vaderkant geerfd. Maar let op, door de meiotische "herrangschikking" (= crossing-overs) is
er een andere pool genen aanwezig per sets chromosomen dan bij de vader en bij de
moeder!
Geslachtscellen hebben slechts een exemplaar van elk chromosoom
o
o
o
o
o
o
Een ongerepliceerd chromosoom bevat een enkel dubbelstrengs-DNA-molecuul.
Een gerepliceerd chromosoom bevat twee identieke dubbelstrengs-DNA-moleculen, de
chromatiden (met de uitgang tiden), die bij het centromeer aan elkaar vast zitten.
Door scheiding van het chromatidenpaar tijdens de celdeling (vanaf de anafase bij de
mitose of vanaf anafase II bij de meiose) ontstaan de twee enkelvoudige parensets
(dochter)chromosomen.
Haploid is de aanduiding voor een cel of voor een organisme met maar een enkele
chromosomenset (n). Als dit voor al zijn cellen geldt, dan wordt ook het hele organisme als
haploid gezien. Een haploide cel blijft na replicatie in wezen n, maar verdubbelt van c naar
2c. Ieder chromosoom bestaat dan uit twee chromatiden.
Diploid is de aanduiding voor cellen met een dubbel aantal chromosomen (2n), waarbij de
ene set chromosomen homoloog is aan de andere. (De geslachtschromosomen van mensen
bijv. vormen hierbij een uitzondering.) Een diploide cel blijft na replicatie in wezen 2n,
maar verdubbelt van 2c naar 4c.
Mensen hebben gewoonlijk 22 paren homologe chromosomen (autosomen) en als
geslachtchromosomen 2 x chromosomen (bij meisjes/vrouwen), of 1 x en 1 y chromosoom
(bij jongens/mannen), dus in totaal 46 chromosomen per lichamscel (zie menselijk
karyogram; waarbij 2n = 46) en 92 chromatiden per cel na replicatie.
Het mannelijk chromosoom is verder geëvolueerd dan de rest van het menselijk
DNA.
Dat suggereert een nieuw onderzoek van Amerikaanse wetenschappers./14 januari 2010
http://www.nu.nl/wetenschap/2162426/mannelijk-dna-blijkt-meest-ontwikkeld.html
Onderzoekers van het gerenommeerde Whitehead Institute in de Amerikaanse stad Cambridge hebben het Ychromosoom – oftewel het mannelijk chromosoom - van de mens vergeleken met dat van chimpansees.
Uit de studie blijkt dat het Y-chromosoom van de mens voor 30 procent verschilt van het mannelijk chromosoom
van chimpansees.
Het Y-chromosoom lijkt daarmee verder geëvolueerd dan het overig menselijk DNA. Het verschil tussen de rest
van het menselijk genoom en het DNA van chimpansees bedraagt namelijk maar ongeveer twee procent.
Zes miljoen jaar
De resultaten van de studie zijn gepubliceerd in het wetenschappelijk tijdschrift Nature.
De onderzoekers troffen op het menselijk Y-chromosoom zelfs complete genen aan die ontbraken op het
mannelijk chromosoom van chimpansees. Die verschillen moeten in een relatief korte periode zijn ontstaan,
omdat de moderne mens en chimpansee slechts zes miljoen jaar geleden uit een gemeenschappelijke
voorouder ontstonden.
Snelle evolutie
“Het Y-chromosoom lijkt het snelste te evolueren van alle menselijke chromosomen”, zo verklaart
hoofdonderzoeker David Page op Discovery News. “Het is een bijna onophoudelijk proces van genconstructie.
Je kunt het vergelijken met een huis dat steeds opnieuw wordt gebouwd.”
Overigens benadrukken de onderzoekers dat de snelle ontwikkeling van het mannelijk chromosoom
niet betekent dat mannen genetisch ook meer ontwikkeld zijn dan vrouwen
Het ontrafelde Y-chromosoom blijkt zichzelf te kunnen repareren.
Rik Nijland op 21 juni '03
http://www.volkskrant.nl/archief_gratis/article970087.ece/Adam_kwam_uit_Eva?service=PrintWie dacht dat het
menselijk genoom allang ontrafeld was - de afgelopen paar jaar is die boodschap immers met veel bombarie
de wereld in gebracht - is eraan voor de moeite
Uit een artikel in Nature , blijkt namelijk dat het mannelijk geslachts- of Y-chromosoom, een van de 46
chromosomen in mensencellen, nog even was blijven liggen. Geen wonder misschien ook, want uit de
publicatie blijkt dat het een taai, tijdrovend werk is geweest om de basevolgorde van dit chromosoom te
ontwarren.
De automatische machines die de basenparen in het DNA op volgorde kunnen leggen, hadden weinig vat op dit
chromosoom omdat het uit zoveel zich herhalende stukjes bestaat. Die moesten met een speciale techniek
aan elkaar worden gepuzzeld.
Vaak duiden zich herhalende DNA-fragmenten op een weinig opwindende functie in het lichaam. Ook daarom
was het Y-chromosoom terzijde geschoven. Maar in dit geval bracht een veertigtal Amerikaanse onderzoekers
samen met één Nederlander - drs. Sjoerd Repping van het Centrum voor Voortplantingsgeneeskunde van het
AMC in Amsterdam - toch een hoop interessante gegevens boven water.
Zo bevat het Y-chromosoom nog stukken oud DNA van pakweg 300 miljoen jaar geleden, toen het
vrouwelijke X-chromosoom en het Y-chromosoom ontstonden uit een gemeenschappelijk sekseloos
voorouder-chromosoom. In dit gedeelte bevindt zich een aantal genen die het reilen en zeilen van cellen
in het hele lichaam regelen.
Wat opvalt, aldus de onderzoekers, is dat een deel van deze genen slecht of helemaal niet lijkt te
functioneren.
Vergelijkbare genen op het X-chromosoom met dezelfde achtergrond werken beter en zijn minder
aangetast door allerlei mutaties.
In die zin is het Y-chromosoom een wat gedegenereerde kopie van het X-chromosoom. Alsof Adam een
verlopen versie is van Eva.
Daarnaast bestaat Y uit stukjes X-chromosoom die meer recent in de historie de overstap hebben
gemaakt naar het mannelijke chromosoom. Hierin bevinden zich volgens Repping een tweetal genen
waarvan de betekenis nog onduidelijk is.
Het meest interessante en grootste gedeelte wordt gevormd door een merkwaardige groep zeer
overeenkomstige stukken DNA, door de onderzoekers palindromen genoemd (denk aan woorden als
parterretrap). Het zijn pal naast elkaar zittende DNA-strengen die vrijwel identiek zijn. Hier bevinden zich
genen die van belang zijn voor de mannelijke voortplanting.
Volgens Repping was al bekend dat het Y-chromosoom vier gebieden bevat die invloed hebben op
de kwaliteit van het sperma, en dus de mannelijke vruchbaarheid. De tientallen genen hierin komen alleen
in de testis tot expressie. Afwijkingen hierin beïnvloeden de vruchtbaarheid.
'Het Y-chromosoom is in honderden miljoenen jaren een soort safe haven geworden voor dergelijke
genen. Daar zitten ze ook op de juiste plaats. In een vrouw hebben ze niets te zoeken, of zijn ze
misschien zelfs nadelig.'
De palindromen zijn ook om een andere reden van belang. Ze wisselen af en toe gedeelten uit om fouten in
het DNA te herstellen. Normale chromosomen doen dat ook, maar 'pikken' daartoe bij de
zaadcelvorming een goed stukje van hun counterpart, het vergelijkbare chromosoom dat van de andere
ouder komt.
Het Y-chromosoom heeft echter geen partner.
Waarschijnlijk, aldus onderzoeksleider David Page, kunnen de palindromen genen aan elkaar overdragen
waarbij fouten worden gerepareerd. Daardoor kan het Y-chromosoom goed blijven functioneren.
Hij verwacht dat de genetische kaart van dit chromosoom op termijn misschien ook inzicht verschaft in
verschillen in gevoeligheid tussen man en vrouw voor bepaalde ziekten.
Tot nu toe werden die toegeschreven aan hormoonverschillen en niet aan de geslachts-chromosomen. Maar
die aanname werd gedaan, aldus Page, toen nog veel mensen dachten dat er geen genen op het Ychromosoom voorkwamen.
http://www.nrc.nl/W2/Lab/DNA/chromosomen.html
Chromosomen
De 22 geslachtsongebonden chromosomen en de geslachtsbepalende chromosomen X en Y vormen samen
het humane genoom. Het verband tussen chromosoomafwijkingen en ziekte is al decennia bekend uit
microscopisch onderzoek. Zo is het syndroom van Down (mongolisme), waarbij iemand met drie chromosomen
21 leeft, onder de microscoop vast te stellen. De afgelopen 10 jaar is daarnaast de ligging van steeds meer
ziekteverwekkende genen op de chromosomen bekend geworden.
Een tamelijk willekeurige selectie staat in het overzicht van alle chromosomen. Nu de basevolgorde van het
DNA op de chromosomen is vastgesteld, zullen binnen korte tijd nog veel meer koppelingen tussen genen en
ziekten plaatsvinden.
De chromosomen zijn in graphics weergegeven in klassieke bandpatroontjes die ontstaan als de chromosomen
voor microscopisch onderzoek worden gekleurd.
Tot nu toe zijn 131 genen op chromosoom 1 gevonden die de oorzaak van een ziekte kunnen zijn als er een
foutje in is geslopen. Enkele aan chromosoom 1 gebonden ziekten zijn: maculadegeneratie bij veroudering,
aangeboren staar, een type hartspierziekte, melanoom, een dominant overerfende doofheid, ziekte van
Hirschsprung (een ernstige aangeboren darmziekte), ziekte van Gaucher (vaak dodelijke ziekte waarbij
hersenvetten zich ophopen in organen en botcellen), een spierdystrofie, een van de darmkankergenen, twee
vormen van erfelijke prostaatkanker, een van vier tot nu toe bekende Alzheimerveroorzakende genen, milde
vorm van het Ushersyndroom (doofheid en kokerzien).
Twee dominant overerfende hartspierafwijkingen; een aantal collageenafwijkingen die tot bot- of
bindweefselziekten leiden, staar die ontstaat door fouten in het gen voor het ooglenseiwit crystalline, de aanleg
van meer dan vijf vingers of tenen, aanleg voor vetzucht en voor zwangerschapsvergiftiging horen bij de ziekten
die met 88 genen op chromosoom 2 in verband zijn gebracht. Ook een van beide genen voor het
Waardenburgsyndroom ligt op 2. Dat syndroom is genoemd naar de Nederlandse oogarts P. Waardenburg
(1886-1979), de grondlegger van de klinische genetica in Nederland. Patiënten zijn vaak doof, hebben
‘adelaarswenkbrauwen', een brede neuswortel, helderblauwe irissen en één witte haarlok.
80 tot nu toe op chromosoom 3 gevonden genen veroorzaken - als er een fout in zit - ziekte. Drie van die
ziekten dragen mooie namen, maar zijn tamelijk gruwelijk. Het Cornelia-de-Langesyndroom is een zeldzame
neurologische kinderziekte waarbij autisme, groeiachterstand en zwakzinnigheid samengaan. Charcot-MarieTooth neuropathie type 2B is een syndroom waarbij bewegings- en gevoelszenuwen verloren gaan. De
toevoeging ‘type 2B' geeft aan dat inmiddels bekend is dat varianten van het syndroom door verschillende
genen worden veroorzaakt. Bij Von Hippel-Lindau syndroom ontstaan bloedvatgezwelletjes in het netvlies, in
hersendelen en in de huid en er groeien cysten in de nieren en pancreas.
Op het topje van de korte arm van chromosoom 4 ligt het gen voor de ziekte van Huntington, een dominant
overge챘rfde erfelijke neurologische ziekte die pas tegen het 50ste levensjaar begint. Het gen werd na
jarenlang speurwerk in 1993 gevonden. De pati챘nten krijgen bewegingsstoornissen, dementeren en sterven
meestal binnen enkele jaren. Nu het gen is gevonden kan worden getest en met zekerheid worden voorspeld
wie ziek zal worden of niet. Een ethisch dilemma dat daarbij rijst is dat iemand soms niet wil weten of hij wel of
niet ziek wordt, maar wel wil weten of eventuele kinderen gevaar lopen. Andere ziekten van chromosoom 4: een
leukemie die wordt veroorzaakt doordat een losgeraakt deel van chromosoom 11 aan chromosoom 4 bindt.
Daardoor ontstaat een ziekmakend gen. Er zijn 50 ziektegenen op 4 bekend.
Chromosoom 5 is het langste chromosoom waarvan de volgorde in ruwe versie (draft) klaar is. Een
chromosoom is ‘ruw' af als minstens 90% van de volgorde vijfmaal is bepaald. De gouden standaard voor ‘af' is
tienmaal sequensen, waardoor de nauwkeurigheid nog toeneemt. De volgorde 5 is bepaald door het Joint
Genome Institute in Walnut Creek, California. Dat instituut wordt betaald door het Amerikaanse Department of
Energy, een van de grote sponsors van het humane genome project. Het Joint Genome Institute heeft de
chromosomen 5, 16 en 19 ‘gedaan'.
Op chromosoom 5 zijn 61 bij ziekten betrokken genen bekend. E챕n gen voor een hormoonreceptor bepaalt
zowel een gevoeligheid voor astma als voor vetzucht. Een ander bepaalt de vatbaarheid voor een difterieinfectie.
Een van de meestgezochte genen is ‘het' schizofrenie-gen. Gevonden is het nog niet en het zijn er
waarschijnlijk meerdere. Er zijn twee genen op chromosoom 6 die belangrijke kandidaat zijn, maar de meest
recente publicatie wees weer naar chromosoom 1. Duidelijk is dat schizofrenie, een van de belangrijke
psychiatrische aandoeningen, in families voorkomt en een genetische component heeft.
Een aantal genen die de vatbaarheid voor suikerziekte verhogen zijn op chromosoom 6 gelokaliseerd. Het zijn
genen die coderen voor een deel van het afweersysteem, wat het vermoeden versterkt dat diabetes op jonge
leeftijd kan ontstaan als na een gewone infectie het afweersysteem zo wordt geactiveerd dat de
insulineproducerende cellen in de pancreas als schadelijke indringers worden beschouwd en worden
aangevallen. Op 6 zijn 75 ziektegenen bekend.
Onder de 62 ziekteveroorzakende genen op chromosoom 7 zitten twee klassiekers: gen voor cystische fibrose
en voor leptine.
Cystische fibrose (taaislijmziekte) is de meest voorkomende (1 op 2.500 baby's) erfelijke ziekte onder blanken.
Na een frustrerend lange zoektocht werd in 1989 de basevolgorde van het gen vastgesteld. Een therapie op
basis van de genetische kennis is er echter nog niet. Wel is de diagnostiek sterk verbeterd.
Leptine, het eiwit dat wordt gemaakt door het obesegen, is een tweede hit. Het werd gevonden dankzij een
muizenmutant die zich steevast moddervet eet. Het patent op het obesegen was in het najaar van 1994 20
miljoen dollar waard, maar bij proeven in mensen lijkt leptine een beperkt effect te hebben.
Op de chromosomen 5, 8 en 19 liggen genen die waarschijnlijk een rol spelen bij de koortsstuipen die kleine
kinderen soms krijgen. In Europa maken 2 tot 5% van de peuters ooit een koortsstuip door, maar in Azi챘 is het
wel 20%. Een ziektemechanisme is nog onbekend. Ook van een gevonden epilepsiegen op chromosoom 8 is
de functie nog onbekend.
Hoe zeldzaam sommige genetische ziekten zijn blijkt bij erythrokeratolysis hiemalis, ofwel de huidziekte van
Oudtshoorn. Die veroorzaakt huidschilfering in de winter en was alleen in Zuid-Afrika bekend. Alle pati챘nten
hebben dezelfde genafwijking op chromosoom 8. Er is dus ooit 챕챕n (blanke) founder geweest. De vondst van
een Duitse familie met de ziekte deed een Duitse oorsprong vermoeden, maar de Duitsers hebben een andere
mutatie. Op chromosoom 8 zijn 50 ziektegenen gevonden.
CHROMOSOOM 8
Rood: /
pseudogene GULOP
GC08P027491
http://www.cababstractsplus.org/google/abstract.asp?AcNo=20043001108
http://en.wikipedia.org/wiki/Chromosome_8_%28human%29
Onder de 56 ziektegenen op chromosoom 9 kan het ABL-gen chronische myeloïde leukemie (CML)
veroorzaken. CML ontstaat door blootstelling aan straling of sommige chemicaliën. In de leukemiecellen is vaak
het Philadelphia-chromosoom te vinden, een verlengd chromosoom 9 waar een stukje van chromosoom 22 op
is terechtgekomen. Het verlengde chromosoom is onder de microscoop zichtbaar bij chromosoomonderzoek
van de kankercellen en was zo een hulpmiddel bij de diagnose. Genetici hebben een jaar of vijf geleden
opgehelderd hoe leukemie ontstaat na de verhuizing van het brokstukje van 22 naar 9: het gen ABL dat codeert
voor een eiwit dat celdeling stimuleert wordt vastgeplakt aan een ander gen. Dat laatste gen is veel vaker actief.
Het gevolg is dat het ABL-eiwit veel te vaak wordt afgelezen zodat ongecontroleerde celdeling en daarmee
kanker ontstaat.
Op chromosoom 10 zijn 49 ziekmakende genen bekend. Een ervan toont hoe een simpele mutatie tot
dagelijkse overlast leidt. Onze genen zijn niet alleen nodig voor groei en voortplanting; voor iedere lichamelijke
activiteit zet het regelsysteem genen aan om benodigde eiwitten te produceren. Het gen PNLIP codeert voor de
het door de pancreas geproduceerde enzym dat vet splitst in vetzuren. Wie dit lipase mist en toch vet eet heeft
chronische diarree en zo is deze - zeer zeldzame - ziekte ontdekt. Het gen is in 1991 gevonden. De ziekte was
overigens al met medicijnen die het pancreaslipase bevatten te verlichten.
Er zijn honderden enzymen betrokken bij de spijsvertering. Die worden steeds aan de hand van hun gen na een
maaltijd geproduceerd en snel daarna weer afgebroken.
Het gen dat sikkelcelanemie veroorzaakt is 챕챕n van de 98 bekende ziekteveroorzakende genen op
chromosoom 11. Sikkelcelanemie is de meestvoorkomende erfelijke ziekte onder mensen van het negro챦de
ras (1 op de 650 geboorten). Het betrokken gen HBB codeert voor het eiwit b챔ta-hemoglobine, een
zuurstoftransporterend eiwit in de rode bloedcellen. Aangedane rode bloedcellen hebben een sikkelvorm.
Daaraan dankt de ziekte zijn naam. Bij sikkelcelanemie is 챕챕n aminozuur in de eiwitketen veranderd.
Thalassemie is een ernstiger defect in hetzelfde eiwit, vaak leiend tot de dood op kinderleeftijd. Het zijn
vanouds twee ziekten, maar ze blijken te worden worden veroorzaakt door defecten aan één gen. Vaak gaat
het andersom en wordt 챕챕n ziekte door meerdere gendefecten veroorzaakt.
Chromosoom 11
Meer inzicht over oorzaak autisme
19 februari 2007
Er zijn genen ontdekt die een belangrijke rol spelen bij het ontstaan van autisme.
Dat bericht het Universitair Medische Centrum Utrecht (UMCU) naar aanleiding van een groot internationaal onderzoek
naar de genetische oorzaken van autisme.
Baanbrekend onderzoek
De resultaten van dit onderzoek staan beschreven in de maart-editie van het tijdschrift Nature Genetics, waar het UMCU
alvast een kijkje in heeft kunnen nemen.
Het baanbrekende onderzoek is uitgevoerd door het Autism Genome Project (AGP) Consortium, waarin onderzoekers uit
vijftig researchgroepen uit Amerika en Europa samenwerken. Namens het UMC Utrecht zijn Herman van Engeland,
Maretha de Jonge, Chantal Kemner en collega’s van de afdeling Kinder- en Jeugdpsychiatrie bij het onderzoek betrokken.
Behandeling voor autisme
De conclusies zijn tweeledig. Ten eerste is op chromosoom 11 (bepaalde drager van erfelijkheidsmateriaal) een gebied
ontdekt met genen die betrokken zijn bij het ontstaan van autisme.
Verder blijkt dat sommige mensen met autisme afwijkingen hebben in genen die betrokken zijn bij neuronale
communicatie, dat aan de basis staat van taal en communicatie. Vooral afwijkingen in de boodschapperstoffen glutamaat en
GABA blijken verband te houden met autisme. Deze stoffen zijn essentieel voor het functioneren van het brein.
Wellicht kan met deze kennis een begin gemaakt worden met de ontwikkeling van een behandeling voor autisme, zo
suggereert het UMCU.
Genetische factoren
Autisme is een ernstige ontwikkelingsstoornis. Pati챘nten die eraan lijden hebben problemen met sociale interactie en
communicatie. Het wordt wel gezien als de psychiatrische aandoening die het sterkst door genetische factoren bepaald
wordt.
Het project draaide om het vinden van genetische overeenkomsten tussen autistische familieleden. Wetenschappers
verzamelden en analyseerden daarvoor genetisch materiaal van 8000 gezinsleden uit bijna 1500 families waar autisme in
voorkomt.
De onderzoekers maakten daarvoor gebruik van zogenaamde SNP’s, eenletterige veranderingen in het DNA die genetische
variatie aangeven. Via microarrays spoorden de onderzoekers de SNP’s op die samenhangen met autisme. Verder
analyseerden ze het DNA van autismepatiënten op de aanwezigheid van copy number variations, veranderingen in het
aantal kopieën van bepaalde stukken DNA.
Links:
Wat is autisme?
Study Suggests Autism Causes Are Genetic
Chromosoom 12 is de langste van de groep korte chromosomen. Er zijn toch nog 65 ziekteveroorzakende
genen op bekend. Naar 챕챕n ervan wordt bij alle pasgeborenen gezocht in het hielprikbloed. Fenylketonurie
(PKU) is een stofwisselingsziekte veroorzaakt door het defecte enzym fenylanalinehydroxylase. Dat breekt het
aminozuur fenylanaline af. Als dat niet gebeurt ontstaat zwakzinnigheid. Een fenylanaline-arm dieet voorkomt
de zwakzinnigheid grotendeels. Er zijn inmiddels in het betrokken PAH-gen tientallen mutaties gevonden die
PKU veroorzaken. Er zijn milde en ernstige vormen van de ziekte, die zijn gecorreleerd met mutaties. Sommige
mutaties komen veel voor in Noord-Europa, andere vooral in Zuid-Europa of Japan.
Chromosoom 12 en chromosoom X
Genes for Hemophilia A & B and von Willebrand disease
http://sandwalk.blogspot.com/2007/04/genes-for-hemophilia-b-and-von.html
Een echte genetische klassieker onder de 27 ziektegenen op chromosoom 27 is het retinablastomagen. Het is
vanouds bekend van een oogkanker uitgaande van het netvlies die al bij jonge kinderen aan het licht komt.
Kinderen die de ziekte aan beide ogen krijgen lopen ook een verhoogd risico op andere tumoren later in het
leven. Ziekte aan 챕챕n oog is meestal een nieuwe mutatie, kennelijk laat in de embryonale fase ontstaan.
Ziekte aan beide ogen ontstaat vaak door overerving van het dominant ziekmakende gen.
De korte arm van chromosoom 14 (40 tot nu toe gevonden ziektegenen) wordt voorlopig niet gesequenced,
omdat dat technisch vrijwel onmogelijk is. Hetzelfde geldt voor de korte armen van 13, 15, 21 en 22. Die
chromosoomdelen bestaan bijna helemaal uit repetitief DNA (gearceerd weergegeven). Dat zijn duizenden
keren herhaalde fragmenten DNA met steeds dezelfde basevolgorde. Waarschijnlijk ligt er toch hier en daar
een gen. Ook het DNA op de verbinding van korte en lange arm (de centromeer) en op de uiteinden (telomeren)
worden niet gesequenced.
De ziekte van Tay Sachs heeft zijn genetische thuisbasis op chromosoom 15. Tay Sachs komt veel voor onder
Ashkenazi-joden. Kinderen met de ernstige vorm worden dement, blind, raken verlamd en sterven als ze twee
of drie jaar oud zijn. Er bestaan ook vormen van de ziekte (veroorzaakt door andere mutaties in het gen) die
pas op volwassen leeftijd tot uiting komen, met veel minder ernstige verschijnselen. In streng-religieuze joodse
families wordt er eerst getest en dan pas getrouwd, om het voortbestaan van de ziekte te verhinderen.
Chromosoom 15
Human OCA2 Gene Is Responsible for Eye Color and Skin Color
#fullpost {display:none;}
Oculocutaneous albinism Type II [OMIN 203200] is a common type of albinism (especially in Africans). It
characterized by loss of pigment-containing melanocytes in the skin. The genetic locus of this phenotype was
localized to a single region on chromosome 15 and the gene was named OCA2 (oculocutaneous albinism
Type II). SeeBeull's Blog; a blog written by a young man suffering from oculocutaneous albinism Type II.
The gene maps to 15q11-2-q12 and it has 24 small exons spread out over more than 350 kb (350,000 base
pairs) [EntrezGene 4948]. The 836 aa coding region produces a protein called P protein, which has been
localized to the membranes surrounding melanocytes.
Meer dan de helft van de mensen met rood haar heeft die kleur te danken aan een variatie in hun gen voor
melanocortine 1 receptor (MC1R). Roodbonte koeien onderscheiden zich ermee van hun zwartbonte
soortgenoten en labradorretrievers danken er hun kleurvariatie aan. Het komt allemaal doordat wij zoogdieren
twee huidpigmenten hebben (pheomelanine en eumelanine, resp. rood en zwart). Eumelanine wordt gemaakt
via de melacortine 1 receptor en als die niet goed werkt is er weinig zwart pigment. Op chromosoom 16 zijn 49
ziektegenen gevonden.
Chromosoom 16
Human MC1R Gene Controls Hair Color and Skin Color
http://sandwalk.blogspot.com/2007/03/human-mc1r-gene-controls-hair-color-and.html
It is often thought that the red hair/fair skin/freckles phenotype is recessive but
genotypes of people with these characters are often heterozygous, suggesting that it is inappropriate
overproduction of pheomelanin, rather than underproduction of eumelanin, that is mainly responsible for the
traits. (Gain-of-function mutations are often dominant.)
The gene (MC1R) is located on chromosome 16 at q24.3 [EntreGene="4157]. The gene is unusual because it
does not contain introns and it has large 5賈 and 3賈 untranslated regions (UTRs).
There are over 30 known variants of this gene segregating in the human population. The variant responsible for
red hair in the British population is a substitution of histidine for aspartate at amino acid 294 (D219H). This
single amino acid substitution seems to account for all of the traits associated with red hair.
Op dit korte chromossom zijn tot nu toe toch 73 ziektegenen geteld. Twee ervan zijn belangrijk bij het ontstaan
of voortbestaan van borstkanker: p53 en BRCA1. P53 is een tumorsuppressorgen dat een sleutelrol speelt in
het stilzetten van de celdeling zolang er nog fouten in het DNA moeten worden gerepareerd. Het is een van de
eerste ontdekte tumorgenen en daardoor is zijn rol overschat. BRCA1 is later gevonden en blijkt met BRCA2
(op chromosoom 13) - indien gemuteerd - een belangrijke veroorzaker van borstkanker op jonge leeftijd.
Chromosoom 17
Onderzoekers David Koolen en Bert de Vries van het Radboud Ziekenhuis in Nijmegen hebben een
'zwakke plek' in het menselijk DNA ontdekt. Een ouder met deze afwijking heeft meer kans op een
kind met een verstandelijke handicap, spierzwakte en karakteristieke gezichtskenmerken.
Toekomstige ouders kunnen zich laten testen op de afwijking.
Bij een groep verstandelijk gehandicapten bleek hetzelfde stukje DNA uit chromosoom
zeventien te ontbreken. Vervolgens werd duidelijk dat het ontbrekende stukje bij 챕챕n van de
ouders 'andersom' in het chromosoom zit.
Deze 'omkering' vormt volgens de onderzoekers een kwetsbare plek in het DNA.
Het komt voor bij twintig procent van de westerse bevolking.
Maar lang niet iedereen bij wie dat zo is, krijgt een verstandelijk gehandicapt kind, legt De Vries uit. Die
mensen lopen een gering verhoogd risico van kleiner dan 0,1 procent op een kind met de aandoening. „Er zijn
heel veel andere risicofactoren die we niet kennen waardoor zij meestal geen en heel soms dus wel een
kind met deze handicap krijgen.”
De bewuste verstandelijke handicap gaat onder meer gepaard met spierzwakte in de vroege jeugd, die op latere
leeftijd lijkt bij te trekken.
De Vries en zijn collega's hebben zelf pas drie van de naar schatting vijfhonderd tot duizend mensen met die
aandoening gezien. „De rest zal de komende jaren nog herkend gaan worden. Op die manier krijgen deze
ouders eindelijk een antwoord op de vraag waarom hun kind deze handicap heeft.”
In Nederland hebben iets meer dan 3 miljoen mensen deze 'zwakke plek' in het DNA.
Dat heeft tot vijfhonderd tot duizend gehandicapte kinderen geleid.
Brekend chromosoom 01/02/2007
inzicht in ontstaan chromosomale afwijkingen
Een studie van de K.U.Leuven onder leiding van Eric Legius van het Centrum voor Menselijke
Erfelijkheid biedt nieuwe inzichten in wat er zich afspeelt bij het ontstaan van een chromosomale
afwijking en heeft ook enkele gevoelige plaatsen in het menselijk genoom gelokaliseerd waar een en
ander misloopt. De resultaten staan gepubliceerd in het decembernummer 2006 van het
vaktijdschrift Nature Genetics.
Asymmetrische uitwisseling
Tijdens de reductiedeling in geslachtscellen komen de chromosomen van hetzelfde
chromosomenpaar tegen elkaar te liggen en wisselen met elkaar stukken uit. In de structuur van
chromosomen komen stukken DNA voor die in de loop van de evolutie enkele malen gedupliceerd
zijn. Wanneer twee gedupliceerde stukken DNA op hetzelfde chromosoom tegen elkaar komen te
liggen, kan er een asymmetrische uitwisseling plaatsvinden.
Het gevolg is een verlies (deletie) of verdubbeling (duplicatie) van een stuk chromosoom. Het
Leuvense onderzoek toonde aan dat bijna alle dergelijke verliezen op chromosoom 17 zich op twee
kleine plaatsen (loci)situeren. Hier doen zich tijdens de geslachtsdeling ook heel wat uitwisselingen
voor. Ook in de overeenkomstige regio op chromosoom 19 werden twee dergelijke plaatsen ( hot
spots ? )aangetroffen.
Baat
Dit inzicht laat niet toe om deze afwijkingen te voorkomen, maar maakt het wel mogelijk om de
oorzaak van bepaalde chromosomale afwijkingen beter te begrijpen.
Een beter inzicht in de gevoelige plaatsen van het menselijk genoom biedt ook de
mogelijkheid om bij voorkeur deze plaatsen onder de loupe te gaan nemen op afwijkingen om
zo nieuwe erfelijke ziektebeelden te onderzoeken.
Sommige genetische eigenschappen ( en defecten ) zijn gerelateerd aan
chromosoomschade.
Breuken kunnen ziekten veroorzaken, maar ook de evolutie stuwen. – SPL Chromosomen zijn de
dragers van de erfelijke kenmerken. De genen liggen netjes zij aan zij op die dragers.
Voor een goed functioneren is het belangrijk dat chromosomen zo intact mogelijk van de ene
generatie naar de andere worden doorgegeven. Toch kan er van alles mislopen. Zo is het niet
uitgesloten dat chromosomen breken, waardoor het moeilijk wordt een normaal functionerend
lichaam in elkaar te puzzelen. Eric Legius van het Centrum voor Menselijke Erfelijkheid van de KU
Leuven bestudeert met een aantal collega's dit breekproces. In het vakblad Nature
Geneticsbeschrijven ze elementen die het breken van chromosomen in de hand werken.
Zo gebeurt een breuk gemakkelijk op plaatsen waar opeenvolgende stukken op een chromosoom
sterk op elkaar gelijken. Bij de deling van de chromosomen (nodig voor een normale voortplanting)
kunnen gebroken stukken verkeerd aan elkaar geplakt worden, waarbij er op één chromosoom
een stuk te weinig is, op het andere een stuk te veel. Dat leidt tot een soort verkeerd geknoopte
jas.
Het euvel geeft aanleiding tot genetische aandoeningen zoals een type neurofibromatose, waarbij
er gezwellen groeien op zenuwen.
Legius en zijn collega's konden echter ook aantonen dat dezelfde zwakke punten een rol in de
evolutie lijken te spelen, omdat ze ook op normale wijze uitwisselingen tussen stukken
chromosoom in de hand werken. Wat tot nieuwe genetische constellaties leidt, die soms
gunstig zijn voor de overleving.
Dirk Draulans
Dec 19, '06
(van KITTY )
Onderzoek van onderzoeksgroep prof. dr. Eric Legius leidt tot nieuwe inzichten in het
ontstaan van bepaalde chromosomale afwijkingen
Heel wat studies over menselijke genetische variatie hebben inzichten verschaft in
processen die zorgen voor de menselijke diversiteit.
Toch blijven sommige processen moeilijk te begrijpen.
Bepaalde delen in chromosomen zijn immers niet altijd gemakkelijk te karakteriseren. Het
decembernummer van het tijdschrift Nature Genetics publiceerde een studie van de
onderzoeksgroep rond prof. dr. Eric Legius van het Centrum voor Menselijke Erfelijkheid van UZ
Leuven. Het onderzoek, dat getrokken werd door doctoraatstudent Thomas De Raedt, maakt
gebruik van de analyse van genetische variatie tussen personen om onderliggende
recombinatieprocessen te bestuderen en leidde tot totaal nieuwe bevindingen.
Chromosomen zijn de dragers van het erfelijkheidsmateriaal (DNA). Zij bevatten de volledige
genetische informatie die noodzakelijk is voor het ontwikkelen, in stand houden en voortplanten van
een organisme.
In de structuur van chromosomen komen stukken DNA voor die in de loop van de evolutie enkele
malen gedupliceerd zijn. Deze komen soms naast elkaarvoor op hetzelfde chromosoom met
ertussen een niet-gedupliceerde regio.
Chromosomen van hetzelfde chromosomenpaar komen tegen elkaar aan te liggen en wisselen met
elkaar stukken uit tijdens de reductiedeling (meiotische deling) in de geslachtscellen.
Wanneer er echter twee gedupliceerde stukken DNA op hetzelfde chromosoom verkeerd
tegen elkaar komen aanliggen tijdens de reductiedeling dan kan er een asymmetrische
uitwisseling plaatsvinden tussen de twee chromosomen.
Het resultaat is dat een van de twee chromosomen een stuk mist en het andere een stuk teveel
heeft. Dit is te vergelijken met het verkeerd dichtknopen van een jas waarbij onderaan de ene helft
van de jas te kort is en de andere te lang.
Deze gedupliceerde DNA-stukken zijn dus “gevoelige” plaatsen ( = hotspots )waar
chromosomale fouten kunnen optreden, met als gevolg het verlies van een stuk chromosoom
(deletie) of een verdubbeling van een stuk chromosoom (duplicatie).
Het onderzoek toont aan dat de breekpunten van dergelijke deleties in zo’n gedupliceerde regio
op chromosoom 17 bijna allemaal op twee kleine plaatsen samenvallen.
Deze twee plaatsen vertonen ook veel uitwisselingen (recombinaties) tussen de chromosomen
17 tijdens een normale reductiedeling.
Bij de mens is deze gedupliceerde regio niet enkel aanwezig op chromosoom 17. Er is ook
챕챕n kopij aanwezig op chromosoom 19.
Onderzoek van deze kopij op chromosoom 19 toonde eveneens een sterke evidentie voor zeer
frequente uitwisselingen (recombinaties) tijdens dereductiedeling en dit op net dezelfde twee
plaatsen( loci ) als op de overeenkomstige regio’s op chromosoom 17.
Dit is erg bijzonder omdat de gedupliceerde stukken DNA op chromosoom 17 en 19 al 6 miljoen
jaar geleden ontstaan zijn en sindsdien onafhankelijk evolueren.
Dit betekent dat de specifieke plaatsen op het DNA die gebruikt worden om uitwisselingen tussen
twee overeenkomstige chromosomen tot stand te brengen over een verloop van 6 miljoen jaar
stabiel gebleven zijn en nog steeds intensief gebruikt worden.
Op basis van vroeger vergelijkend onderzoek tussen de mens en de chimpansee werd er niet
verwacht dat er een dergelijke uitgesproken stabiele evolutie zou kunnen bestaan van deze
“hotspots” voor recombinatie tijdens de reductiedeling.
Het onderzoek toont verder hoe deze “gevoelige” plaatsen voor een bepaald type van
genetische fout tot stand gekomen zijn op onze chromosomen en welke krachten
verantwoordelijk zijn voor deze “gevoeligheid” en dit over een verloop van miljoenen jaren.
Dit inzicht laat momenteel nog niet toe om deze afwijkingen te voorkomen. Ze zijn immers het
gevolg van natuurlijke en normale processen die moeten plaatsgrijpen in onze chromosomen maar
die soms mislopen als de structuur van het chromosoom tegenzit.
Het menselijk genoom is niet perfect stabiel en laat veranderingen toe. Dit is belangrijk
geweest in de evolutie maar af en toe betaalt de mens daar een prijs voor.
Dit onderzoek maakt het wel mogelijk om de oorzaak van bepaalde chromosomale afwijkingen
die we observeren, beter te begrijpen. Een beter inzicht in de "gevoelige plaatsen" van het
menselijk genoom laat toe om bij voorkeur deze plaatsen te onderzoeken op afwijkingen om zo
nieuwe erfelijke ziektebeelden te ontdekken.
bron ; http://www.zorgkrant.nl/read.html?id=3377
Sep 28, '07 Human Genes Involved in the Signal Hypothesis Pathway
http://sandwalk.blogspot.com/2007/09/human-genes-involved-in-signal.html
Van de 25 ziektegenen op chromosoom 18 is het gen MAFD1 het nog omstreden resultaat van de speurtocht
naar de genetische basis van manische depressiviteit, een ziekte waarin opwinding afwisselt met ernstige
depressie. Ook chromosomen 4, 5, 11, 13, 18, 22 en X hadden en hebben kandidaatgenen voor de ziekte. Zelfs
overerving op het mitochondriaal DNA is overwogen, omdat de ziekte soms sterk via de moeder wordt
doorgegeven. De genetische oorzaak van deze ziekte is nog lang niet opgelost.
Over de ziektegenen die in de rest van dit overzicht aan de orde komen zegt het niets, maar de onderzoekers
van het Joint Genome Institute in Walnut Creek California die vorige maand ruwe versies van de chromosomen
5, 16 en 19 af hadden lieten computerprogramma's naar genen zoeken. Op 19 liggen er zeker 353, maar
waarschijnlijker zijn het er tussen de 740 en 800. Tot nu toe waren aan de hand van ziektes 65 genen op
chromosoom 19 bekend.
Op dit chromosoom zijn tot nu toe 24 ziektegenen ontdekt. Daaronder bevindt zich het ADA-gen, dat codeert
voor het enzym adenosine deaminase. Als dit gen beschadigd is, leidt dat tot complicaties in het
afweersysteem. Pati챘nten die homozygoot zijn - en dus twee foute kopie챘n erven - zijn er zeer slecht aan toe.
Ze ontwikkelen Severe Combined Immunodeficiency (SCID).
De basenvolgorde van dit chromosoom is al in mei gepubliceerd: het telt 225 genen. Daarvan waren er 21 als
ziekteveroorzakende genen bekend. Het syndroom van Down (mongolisme) is de bekendste ziekte op
chromosoom 21. Dat is geen genafwijking, maar het gevolg van een extra chromosoom 21. Pati챘nten hebben
drie chromosomen 21 in al hun celkernen.
Het eerst ontrafelde chromosoom. Op chromosoom 22 zijn bij de volgordebepaling 545 genen aangetroffen,
waarvan er voorheen pas 33 als ziektegenen bekend waren. Het gen dat het DiGeorge syndroom veroorzaakt
is het bekendste. Bij deze erfelijke ziekte treedt er een stoornis in het embryo op waardoor de thymus
(zwezerik) niet volledig ontwikkelt.
Een van de geslachtschromosomen. Op dit grote chromosoom zijn maar liefst 162 ziektegenen gelokaliseerd.
Vrouwen bezitten twee kopie챘n van dit chromosoom, mannen slechts 챕챕n. Als gevolg daarvan komt iedere
afwijking op dit chromosoom bij mannelijke pati챘nten aan het licht. Bekende voorbeelden daarvan zijn
spierdystrofie van Duchenne en het fragiele X-syndroom.
Veel minder ernstig is X-gebonden kleurenblindheid, waar acht procent van de mannelijke bevolking in WestEuropa aan lijdt. Vijfenzeventig procent van hen mist een goede kopie voor het groengevoelige oogpigment en
een kwart mist het roodgevoelige pigment.
http://pharyngula.org/index/weblog/comments/evolution_of_the_X_chromosome
De X-code.
Vrouwen zijn genetische diverser dan mannen.
Het X-chromosoom is definitief ontrafeld. En het is nog wonderlijker dan gedacht.
Sander Voormolen.
HET MENSELIJKE X-chromosoom bevat in totaal 1098 genen, zo blijkt uit een studie van tientallen Britse,
Duitse en Amerikaanse wetenschappers die de detailstructuur van het chromosoom ophelderden. De
onderzoekers hebben nu 99,3 procent van de exacte DNA-volgorde op dit geslachtschromosoom in handen.
Het X-chromosoom is biologisch en medisch gezien 챕챕n van de interessantste, omdat het een bijzondere
overerving kent en omdat veel bekende erfelijke ziekten eraan zijn verbonden (Nature, 17 maart 2005).
De mens heeft per cel 23 paar chromosomen, waarvan 챕챕n paar geslachtschromosomen. Dat paar bepaalt of
een mens als man of als vrouw ter wereld komt. Vrouwen hebben in iedere lichaamscel twee X-chromosomen,
mannen een X- en een Y-chromosoom.
De geslachtschromosomen zijn in de laatste 300 miljoen jaar ge챘volueerd uit 챕챕n paar autosomen, normale
chromosomen. X en Y, die dus dezelfde oorsprong hebben, zijn in de loop der tijd enorm van elkaar gaan
verschillen. Waar X een relatief normaal chromosoom bleef, verloor Y steeds meer genen. Het menselijk Ychromosoom is veel korter dan het X-chromosoom en bevat nu nog slechts 86 genen.
VERFIJND. De complete DNA-volgorde van het Y-chromosoom werd twee jaar geleden al gepubliceerd
(Nature, 19 juni 2003) en onlangs verder verfijnd (Genome Research, februari 2005). Na het tot stand komen
van een ruwe overzichtskaart van het menselijk genoom in 2001, zijn diverse onderzoeksgroepen nog altijd
druk met het verfijnen van de genoomkaart. Inmiddels zijn al diverse 'complete' kaarten van menselijke
chromosomen gepubliceerd, de kortste het eerst.
Nu ook de detailstructuur van X bekend is, hebben de onderzoekers het chromosoom onmiddellijk vergeleken
met 'broertje' Y. Slechts 54 van de 1098 genen op het X-chromosoom komen ook nog op het Y-chromosoom
voor. Tijdens de zogeheten reductiedeling die voorafgaat aan de vorming van geslachtscellen kunnen
chromosomen paarsgewijs genen uitwisselen in een proces dat recombinatie heet. Zo ontstaan varianten van
de chromosomen met nieuwe combinaties van genen die aan het nageslacht worden doorgegeven. X en Y
verschillen echter zoveel van elkaar dat die recombinatie slechts mogelijk is in een klein stukje aan het uiteinde
van het x-chromosoom. De meeste gemeenschappelijke genen liggen dan ook in dat gebied, maar de
onderzoekers identificeerden er ook 25 daarbuiten. Het Y-chromosoom heeft slechts 15 genen die niet op het
X-chromosoom voorkomen.
AUTOSOMEN. Zo 'normaal' als het X- chromosoom lijkt ten opzichte van het kleine Y-chromosoom, het wijkt
toch ook behoorlijk af van de niet-geslachtschromosomen (autosomen). Het X-chromosoom bevat relatief veel
'junk-DNA', zich telkens herhalende base-sequenties, zonder duidelijke betekenis. Mede daardoor is
de'gendichtheid' van 7,1 genen per miljoen baseparen aan de lage kant voor een gemiddeld menselijk
chromosoom.
Op het X-chromosoom ligt ook het langste menselijke gen, dat van het eiwit dystrofine, dat zich uitstrekt over
ruim 2,2 miljoen baseparen. Hoewel het X-chromosoom slechts vier procent van alle menselijke genen bevat,
ligt bijna tien procent van alle bekende erfelijke genafwijkingen op dit chromosoom. Veel X-gebonden
aandoeningen, zoals spierdystrofie en kleurenblindheid, komen vooral bij mannen voor. Zij hebben immers
slechts 챕챕n X, en met een kapot of slecht functionerend allel op dit chromosoom kunnen zij niet terugvallen
op het andere X-chromosoom.
Bij vrouwen wordt altijd al vroeg in de ontwikkeling 챕챕n van beide X-chromosomen in de cel permanent op
non-actief gesteld. Dit fenomeen, silencing genoemd, is volgens biologen in de evolutie ontstaan om te
voorkomen dat er te veel van een bepaald eiwit gemaakt wordt, wat schadelijk zou kunnen zijn. Op deze manier
is de activiteit van de X-gebonden genen in mannen en vrouwen gelijk, doordat er in alle gevallen slechts 챕챕n
genkopie actief is.
Tenminste, dat was de theorie, de praktijk blijkt weerbarstiger. In een vrouwenlichaam is bijvoorbeeld niet altijd
in alle cellen dezelfde kopie van het X- chromosoom stilgelegd, en soms is het zwijgen van dat tweede
chromosoom niet volledig, zo blijkt uit een eveneens in de Nature van deze week gepubliceerd onderzoek van
Laura Carrel van het Penn State University College of Medicine en Huntington Willard van de Duke University.
De onderzoekers keken in eerste instantie naar 94 X-gebonden genen in bindweefselcellen van verschillende
vrouwen. Tot hun verrassing bleek maar liefst 15 procent van de genen op de tweede X in meer of mindere
mate aan de inactivatie te ontsnappen. Nog eens twintig procent van de genen op het X-chromosoom lieten een
variabel activiteitenpatroon zien; bij de ene vrouw waren ze actief, bij de ander stil. En heel opmerkelijk: bij geen
enkele vrouw was dit patroon gelijk. Met behulp van de nieuwe detailkaart herhaalden Carrel en Wilard de
analyse, met een iets andere techniek maar nu met 612 X-gebonden genen - met vergelijkbare resultaten.
Het levende bewijs dat er iets aan de hand is met
activiteit van de vrouwelijke X-chromosomen
vormt de schildpadpoes. Deze poezen hebben van
hun ouders twee verschillende allelen van het gen
voor vachtkleur ge챘rfd op hun X-chromosoom.
De schildpadpoes - altijd een vrouwtje - dankt
haar gevarieerde vacht aan het feit dat in
lichaamscellen soms het ene X-chromosoom het
Meer tot de verbeelding sprekend is de lapjeskat.
Lapjeskatten zijn ook steeds poezen. De genetische
informatie voor de witte buikkleur ligt op een ander
chromosoom dan het X-chromosoom.
zwijgen is opgelegd en soms het andere.
(novum)
Het mannelijke geslachtschromosoom met vier ziektegenen die verband houden met het mannelijke geslacht.
Drie ervan veroorzaken azoïspermie: de man produceert geen goede spermacellen meer. Het vierde gen, SRY,
bepaalt het mannelijk geslacht. Als dit gen beschadigd is, komen de testes niet tot ontwikkeling. Patiënten zijn
man maar hebben geheel of gedeeltelijk de uiterlijke kenmerken van een vrouw.
SRY gen.
Het Y-chromosoom heeft een stukje meer dan een X chromosoom, namelijk het SRY gen. Dit zet een hele
extra keten aan met testosteron als middelpunt. Als dit kapot gaat worden mannen gewoon vrouwen en als dit
gen per ongeluk in het X chromosoom terecht komt krijg je ook nogal vreemde resultaten.
Je kunt zeggen, dat er een embryologisch basismodel is met (inderdaad...) iets meer vrouwelijke
kenmerken. Bij mannen ontwikkeld de clitoris door tot penis en deze blijft bij vrouwen onderontwikkeld en bij
vrouwen ontwikkelen de borsten door.
Best een ingenieus model dus.
Vrouwen zijn gezonder en worden ouder, maar hun voortplantingstelsel is moleculair gezien veel meer
omstreden dan dat van de man. Die eicellen liggen namelijk al vanaf de geboorte te rijpen met allerlei
problemen van dien als je iets later moeder wilt worden vanwege je carrière. Als eicellen op dezelfde manier
zouden ontstaan als spermacellen hoefde een stel van over de 40 zich geen zorgen meer te maken over het
krijgen van een mongooltje en kon die voortplanting misschien nog wel wat langer door gaan,
Verder blijkt inderdaad dat er tussen de mannelijke bevolking heel wat meer kneuzen zitten en dat is weer terug
te voeren op dat enkele X-chromosoom, maar er zitten ook veel geniën tussen wat waarschijnlijk ook weer X
gebonden is.
De mannelijke gedachte is inderdaad technischer en dat is weer met autisme te linken, maar de normale man
heeft ons hierdoor wel duizenden jaren beschaving, technologie (en oorlog) gebracht.
Summary of Genes on Human Chromosomes
http://sandwalk.blogspot.com/2007/03/summary-of-genes-on-human-chromosomes.html
http://www.ensembl.org/Homo_sapiens/index.html
Click on a chromosome for a closer view
Browse your Genome
Click on the Chromosome to show
http://www.ncbi.nlm.nih.gov/genome/guide/human/
http://projects.tcag.ca/variation/
klik voor varianten van het menselijk genetisch materiaal op
elke afzonderlijke chromosoom
Genome-wide view of CNVs
Click on a cytoband to get a list of variants detected within that region
PZ MEYERS
Basics: How can chromosome numbers change?
http://scienceblogs.com/pharyngula/2008/04/basics_how_can_chromosome_numb.php
There in the foaming welter of email constantly flooding my in-box was an actual, real, good, sincere
question from someone who didn’t understand how chromosome numbers could change over time — and
he also asked with enough detail that I could actually see where his thinking was going awry. This is great!
How could I not take time to answer?
So here’s the question:
How did life evolve from one (I suspect) chromosome to… 64 in horses, or whatever organism you want to
pick. How is it possible for a sexually reproducing population of organisms to change chromosome
numbers over time?
Firstly: there would have to be some benefit to the replication probability of the organisms which carry the
chromosomes. I don’t see how this would work. How is having more chromosomes of any extra benefit to
an organism’s replicative success? Yes, perhaps if those chromosomes were full of useful information…
but the chances of that happening are non existent and fly in the face of ‘small adaptations over time’.
Secondly, the extra chromosomes need to come from somewhere. I’m not sure about this, but I believe
chromosome number are not determined by genes, are they? There isn’t a set of genes which determines
the number of chromosomes an organism has. So the number is fixed, determined by the sexually
reproducing parents. Which leads me to believe that if the number does change, and by chance the
organism is still alive and capable of sexual reproduction, that the number will start swinging back and
forward, by 1 or 2, every generation, and never stabilising. The chances of this happening are also very
very slim.
Let’s clear up a few irrelevant misconceptions first. Life probably started with no chromosomes — early
replicators would have been grab bags of metabolites, proteins, and RNA that would have simply sloppily
split in two, with no real sorting. DNA and chromosomes evolved as accounting and archiving tools: they
were a way to guarantee that each daughter cell in a division reliably received a copy of every gene. Also,
most living things now just have one ‘chromosome’, a loop of DNA, and perhaps a small cloud of DNA
fragments. So to keep this simple we’re going to ignore all that, and consider only us diploid eukaryotes,
where the question of chromosome numbers becomes a real issue.
Normally, I’d be scribbling madly on a whiteboard, so we’ll have to make do with some scribbles on the
computer screen. Here, for instance, is a typical cartoon chromosome. It’s a string of DNA, and scattered
along it we have sequences for genes, that I’ve labeled “A”, “B”, “C”, “D”, and “E”. I’ve also drawn a circular
blob in the middle: that’s important. It’s not a gene, it’s a structure called the centromere, which gets all
wrapped up in proteins to form a kinetochore. It’s a sort of anchor point; when the cell needs to move
chromosomes around, as it does during cell division, it hitches motor proteins to the kinetochore and using
drag lines called spindle fibers, tows it to a new destination.
I mentioned that this was a diploid organism — that just means that every chromosome comes in pairs.
This cell would have a similar chromosome to the one that has the ABCDE genes on it; here I’ve draw it as
containing the same genes, but in slightly different forms: abcde. This matters because during meiosis,
when gametes (sperm and egg) are formed, the two chromosomes line up with one another and the cell
machinery tows one chromosome to one daughter cell, and the other to the other daughter cell. It’s
accounting; it makes sure each daughter gets a copy of all of the genes, one A or one a, one B or one b,
etc., for instance.
For now, put the fact that there are two copies of each chromosome at the back of your mind and don’t
worry about it. Let’s think about a single chromosome and ask what can happen to it.
Here’s something fairly common. An error in copying the DNA can lead to the loss of a piece of DNA. This
happens with a low frequency, but it does happen — if we sequenced your DNA, we might well find a few
bits missing here and there. We can get situations like this, where a whole gene gets lost.
Don’t panic! Remember that we have two copies of every chromosome, so while this one is missing the
“D” gene, there’s that other chromosome floating around with a “d” gene. This is not necessarily bad for the
individual, it just means he doesn’t have a spare any more.
Another kind of error that can happen with a low frequency is a duplication, where the machinery of the cell
accidentally repeats itself when copying, and you get an extra copy of a piece of a chromosome, like so:
This person has two copies of D on this chromosome now (and remember that other chromosome, with it’s
d gene — he actually has 3 copies in total now). This is not usually harmful: it gives the individual a little
extra redundancy, and that’s about it. It can change the total amount of the D gene product in the cell, and
if it’s a gene for which precise dosage is important, it can have visible effects…but in most cases, this is a
neutral change.
You may have noticed that nothing has changed the chromosome numbers yet. Here’s a situation that can
lead to the formation of a new chromosome: what if there is a duplication of the centromere, rather than a
gene?
Remember, I told you that the centromere/kinetochore is where the cell attaches lines and motors to haul
the chromosome to the appropriate daughter cell. In this case, two lines are attached; what if one tries to
pull one centromere to the left, and the other tries to pull the other centromere to the right? Tug of war!
The end result is that the chromosome is broken into two chromosomes. I think this is a key concept that
the questioner is missing: chromosome numbers really aren’t significant at all! You don’t need to add
significant new information to create a new chromosome, and as I’ll show you in a moment, a reduction in
chromosome numbers does not represent a loss of genetic information. Chromosome are disorganized
filing cabinets, nothing more; we can shuffle genes around between them willy-nilly, and the
cell mostly doesn’t care. A fission event like the one described above basically does nothing but take one
pile of genes and split them into two piles.
But there are some important effects. This may not be an entirely neutral situation. Let’s bring back that
abcde chromosome, and pair it up with our two new chromosomes, AB and CDE.
The accounting is accurate. This cell has two copies of the A gene, an “A” and an “a”, just like normal, and
the two new chromosomes can still pair up efficiently with the old chromosome in meiosis, just like before.
This is a healthy, functioning, normal cell, except for one thing: if it goes through meiosis to make a sperm
or egg, it’s going to make a larger number of errors. There are three centromeres there, to be split into two
daughter cells! Never mind what the Intelligent Design creationists tell you — the cell is really, really stupid,
and it will more or less decide by eeny-meeny-miny-moe how to divvy up those chromosomes. If by
chance the split is that one daughter gets AB + CDE, and the other gets abcde, both daughters have the
full complement of genes and all is well. However, the split could also be that one daughter gets AB and
nothing else, while the other gets CDE + abcde … and that’s no good. One is missing a whole bunch of
genes, and the other has an overdose of a bunch.
The net result is that although this individual is fine and healthy, a significant number of his or her gametes
may carry serious chromosomal errors, which means they may have reduced fertility. They aren’t sterile,
though; some of their gametes will have the full complement of genes, and can similarly produce new
healthy individuals who will probably have fertility problems. (Note: the significance of those fertility
problems will vary from species to species. Organisms that rely on producing massive numbers of progeny
so that a few survive to adulthood would be hit hard by a change that cuts fecundity; species that rely on
producing a few progeny that we raise carefully to adulthood, like us, not so much. So you have to have
sex 20 times to successfully produce a child instead of 5 times; that won’t usually be a handicap.)
So our two chromosome individual will have a reduced fertility as long as he or she is breeding with the
normal one chromosome organisms, but those split chromosomes can continue to spread through the
population. They are not certain to spread — they’re more likely to eventually go extinct — but by chance
alone there can be continued propagation of the two chromosome variant. Which leads to another
misconception in the question: something doesn’t have to provide a benefit to spread through a population!
Chance alone can do it. We don’t have to argue for a benefit of chromosome fission at all in order for it to
happen.
So we can have a population with a low frequency of scattered chromosomal variants, some carrying the
rare two chromosome variant and others the more common one chromosome form. What if two individuals
carrying the two chromosome variant breed? They can produce offspring that look like this:
How many centromeres are there? Four, not three. This is a situation the cell machinery can handle
reliably, and this individual will consistently produce good gametes that accurately carry AB + CDE,
nothing more, nothing less, and will have no reduction in fertility. Now we have a potentially interesting
situation: individuals with the one chromosome situation have full fertility when breeding with other
individuals with one chromosome; individuals with two chromosomes have full fertility when breeding with
other individuals with two chromosomes; it’s when individuals with two different chromosome
arrangements try to breed that fecundity is reduced. This is a situation where speciation is a possibility.
One last thing: what about reducing chromosome numbers? That’s easy, too. Here’s an organism with an
AB chromosome, and a different chromosome with the genes MN on it. They can simply fuse in the region
of the centromere.
This happens with a low frequency, too, and has been observed many times (hint: look up Robertsonian
fusions on the web.) I think the key issue to understand here is that chromosome number changes are
typically going to represent nothing but reorganizations of the genes — the same genes are just being
moved around to different filing cabinets. This has some consequences, of course — you increase the
chances of losing some important file folders in the process, and making it more difficult to sort out
important information — but it’s not as drastic as some seem to think, and chromosome numbers can
change dramatically with no obvious effect on the phenotype of the organism. These really are “small
adaptations over time”, or more accurately, “small changes over time”, since there is no necessary
presumption that these are adaptive at all.
I’ve discussed fusion events and how they relate to evolution before, and there’s an interesting difference
in context there, too. My prior article was a response to Casey Luskin, an ignorant creationist who used his
misunderstanding of genetics to foolishly assert the existence of a major problem, and that’s where we
have a conflict: ignorance is not a problem, but stupidly using your ignorance to push invalid ideas is. This
question in my mailbox is also ignorant — the fellow really doesn’t understand the basics of genetics — but
it’s self-recognized ignorance that, in a good way, prompts him to ask a sincere question.
If you want to dig a little deeper, there are many ways genetic information can be rearranged on
chromosomes, and this has opened the doors to some interesting evolutionary research. I’ve described
how we can map the reshuffling of chunks of genetic information over time, a process called synteny
mapping, which allows us to reconstruct ancestral chromosomes. A fish might have 42 chromosomes, and
we might have 46, but we can still trace how the ancestral arrangement was scrambled in many different
ways to generate the modern arrangements.
FISIE
1.- Het begint allemaal met een verdubbeling van de centromeer /
2.- Splitsing ( breken ) van het chromosoom aan ( tussen ) de verdubbelde centromeren tijdens het
proces van "celdeling "
FUSIE
fusion events and how they relate to evolution
zie ook
--> genetic reshuffling ,
Synteny mapping ,
http://www.tamu.edu/classes/plan/magill/gene603/Lecture%20outlines/Synteny/SYNTENY_MAPPING.html
---> reconstruct ancestral chromosomes.
Chromosomes
http://en.wikipedia.org/wiki/Category:Chromosomes
Wikipedia
Chromosome abnormalities
D
A
AZF1
Allosome
Autosome
Derivative chromosome
Dyad (biology)
G banding
Human 棺-globin locus
Isochromosome
Karyotype
Lampbrush chromosome
Locus (genetics)
Marker chromosome
Ring chromosome
G
C
H
Centromere
Chromatid
Chromosomal duplication
Chromosomal inversion
Chromosomal translocation
Chromosome 1 (human)
Chromosome 10 (human)
Chromosome 11 (human)
Chromosome 12 (human)
Chromosome 13 (human)
Chromosome 14 (human)
Chromosome 15 (human)
Chromosome 16 (human)
Chromosome 17 (human)
Chromosome 18 (human)
Chromosome 19 (human)
Chromosome 2 (human)
Chromosome 20 (human)
Chromosome 21 (human)
Chromosome 22 (human)
Chromosome 3 (human)
Chromosome 4 (human)
Chromosome 5 (human)
Chromosome 6 (human)
Chromosome 7 (human)
Chromosome 8 (human)
I
K
L
M
R
Chromosome 9 (human)
Chromosome regions
Chromosome
S
Small supernumerary marker chromosome
Subtelomere
Telomere
X chromosome
Y chromosome
T
X
Y
Aug 17, '07
Te veel chromosomen
Een afwijkend aantal chromosomen is nadelig voor de vermenigvuldiging van cellen. Dit
constateren Amerikaanse onderzoekers onder leiding van Eduardo Torres na onderzoek op
gemanipuleerde gistcellen. Ze publiceren hierover in het tijdschrift Science (17
augustus).Gistcellen die te veel chromosomen hebben, maken meer eiwitten aan dan cellen
met een normaal chromosomenaantal en verbruiken daardoor veel energie. De onderzoekers
denken dat de vermenigvuldiging hierdoor negatief wordt be챦nvloed.
Het is waarschijnlijk dat bij menselijke cellen met een afwijkend aantal chromosomen
(zogeheten aneuploidie) hetzelfde optreedt.
Celkweken met bindweefsel van mensen met het syndroom van Down toonden aan dat
celdelingen daar langzamer optreden dan bij weefsel van anderen. Het syndroom van Down wordt
veroorzaakt door aneuploidie: mensen met Down hebben chromosoom 21 in drievoud. Normaal
zitten in menselijke cellen van elk chromosoom twee exemplaren.Foute cellen delen slechter, dat
klinkt logisch. Het rare is dat kankercellen ook meestal aneuploide zijn.
En die vermenigvuldigen te snel. Juist in de afwijkende chromosoomaantallen zien sommige
wetenschappers de sleutel voor de ongebreidelde groei van bepaalde tumoren. Verder onderzoek
moet aantonen hoe kankercellen de negatieve effecten van aneuploïdie te boven komen en
zelfs omkerenhttp://www.the-scientist.com/news/home/53488/
Jun 4, '07
Trends in breuken/Zoogdierevolutie versneld
http://noorderlicht.vpro.nl/artikelen/23294952/
Links
°"Het einde van het begin - Mens heeft nog minder genen", Noorderlicht nieuwsbericht, 22
oktober 2004.
°
'Kip geeft code prijs - Pluimvee heeft evenveel genen als wij' Noorderlicht nieuws, 8 dec 2004
°'Menselijk genoom nu 'echt' volledig in kaart - HUGO-consortium publiceert in Nature, Celera in
Science', Noorderlicht nieuws, 12 februari 2001
°"DNA
labrat in kaart plattegrond van ingredienten en recepten", Noorderlicht nieuwsbericht 2 april 2004
°'Van muis en mens - DNA labmuis in kaart', Noorderlicht nieuws, 5 december 2002
Het computerprogramma Evolution Highway is hier te vinden.
Het
menselijk genoom bevat 3 miljard baseparen, of letters: A, C, T en G.
Vergelijkend onderzoek aan het DNA van acht soorten zoogdieren laat zien dat chromosomen
bij voorkeur op hele bepaalde plekken breken. Die breekpunten kunnen wel eens een sleutelrol
spelen bij het ontstaan van kanker. Bovendien ontdekten de onderzoekers dat zoogdieren een
extra evolutionaire groeispurt hebben gemaakt sinds het uitsterven van de dinosauriers.
U dacht dat de evolutie subtiel was? Met hier en daar, eens in de miljoenen jaren, een kleine mutatie in
het DNA, als ware het een spellingshervorming in het erfelijk materiaal? Vergeet het maar.
Chromosomen pakken dat heel anders aan. Stukken DNA verwisselen van plaats in het chromosoom,
of, nog woester, verhuizen integraal van het ene naar het andere chromosoom.
Lange tijd werd gedacht dat dat evolutionaire knip- en plakwerk tamelijk willekeurig was. Chromosomen
braken dan eens hier, dan eens daar, was het idee. Uit vergelijkend onderzoek aan het DNA van acht
verschillende zoogdieren - mens, muis, rat, kip, kat, hond, paard en koe - blijkt dat de breekpunten in
het DNA verre van willekeurig zijn.
25 Onderzoekers uit de Verenigde Staten, Singapore en Frankrijk hielden elk het genoom van een
ander dier tegen het licht, en vergeleken dat met het genoom van de mens. De Nederlandse Annelie
Everts-van der Wind, onderzoekster aan de Universiteit van Illinois, boog zich over het erfelijk materiaal
van de koe, en co철rdineerde samen met Harris Lewin, Bill Murphy en Denis Larkin de internationale
inspanning om alle puzzelstukjes bij elkaar te krijgen. "Het was vooral veel bellen en e-mailen,"
herinnert Van der Wind zich het afgelopen jaar. "Het is voor het eerst dat de complete genomen van
meerdere soorten zoogdieren met elkaar vergeleken wordt," vertelt Van der Wind. "Tot nu toe werden
soorten namelijk twee-aan-twee vergeleken. De muis met de mens, of de mens met de rat, drie soorten
waarvan het genoom gedetailleerd in kaart is gebracht."
Van lang niet alle bestudeerde dieren was het genoom zo uit den treure bekend als dat van mens, muis
en rat, licht Van der Wind toe, maar de grove landkaarten die er wel waren bleken gedetailleerd genoeg
om een vergelijking te kunnen maken. De volledige DNA-volgorde van de kip kwam helaas net iets te
laat - december 2004 - om bij het onderzoek betrokken te worden. "We waren toen al op de helft van
het onderzoek", aldus Van der Wind. En hoewel de precieze DNA-volgorde van de hond bij het begin
van het onderzoek wel bekend was, mochten de onderzoekers het niet gebruiken omdat de resultaten
nog niet in een wetenschappelijk tijdschrift gepubliceerd waren. Ook de hond moest het dus doen met
een uittreksel.
Bij de onderzochte dieren blijken de chromosomen bij voorkeur op vastomlijnde plaatsen te breken alsof er een stippellijntje op het genetisch materiaal staat met een schaartje erbij. Hier knippen.
Waarom het DNA juist daar in stukken breekt en niet ergens anders, is onduidelijk. "Ja, dat is natuurlijk
de grote vraag," lacht Van der Wind.
De chromosomen breken bovendien bij voorkeur op plaatsen waar de gendichtheid het grootst is.
Gemiddeld zitten er twaalf genen - coderende stukjes DNA - in een miljoen baseparen, rond de
breekpunten zijn dat er achttien.
Een flink aantal van die breekpunten wordt er bovendien van verdacht een rol te spelen bij het ontstaan
van kanker bij de mens. Maar om daar zeker van te zijn, is het wachten op de volledige DNA-volgordes
van alle onderzochte soorten.
De onderzoekers maakten bij hun analyse gebruik van een computerprogramma, de 'Evolutie Snelweg'
geheten. Daarmee ontdekte Bill Murphy bovendien dat sinds het verdwijnen van de dinosauriërs, 65
miljoen jaar geleden, de zoogdierevolutie flink versneld is. Waar voordien zoogdierchromosomen elke
miljoen jaar 0,11 tot 0,43 keer braken, gebeurde dat na de verwoestende meteoriet twee tot vijf keer zo
vaak. Zoogdieren evolueerden in de tijd na de dino's dus extra snel. Alsof de zoogdieren halsoverkop
de vrijkomende plekken in het leefmilieu opeisten.Annelie Everts-van der Wind is voorlopig
tevreden. Het artikel dat deze week in Science verscheen, is tevens het laatste hoofdstuk van
haar proefschrift, waar ze eerder dit jaar op promoveerde. En dat gebeurt niet vaak, zegt ze, zo'n
Sciencepublicatie. "Het is moeilijk om in ons vakgebied tot de voorhoede door te dringen." Het
is nu in ieder geval gelukt. (Jacqueline de Vree)
Het complete genoom van de muis werd in december 2002 in kaart gebracht.
Ill: Nadya Ruvinskaya.
William Murphy et al, 'Dynamics of mammalian
chromosome evolution inferred from multispecies comparative maps', in: Science, 22 juli 2005.












