DE KUNST VAN HET KIJKEN
207
Uw diagnose?
dr. J. Lambers-Scherrenburg1, dr. I.C.A. Munnix2, dr. L.F.J. van Groningen3, dr. F.W.M.B. Preijers4 en
dr. M.A. MacKenzie3
(NED TIJDSCHR HEMATOL 2017;14:207-8)
ZIEKTEGESCHIEDENIS
Een 36-jarige vrouw, G2P1, presenteerde zich bij de
gynaecoloog met een progressieve trombocytopenie bij
een zwangerschapsduur van 32+5. Bij een zwangerschapsduur van 12 weken was reeds een laat stadium
van een actieve Parvo-B19-infectie (IgG- en IgM-positief)
vastgesteld. Aanvankelijk werd de trombocytopenie
geduid in het kader van deze Parvo-B19-infectie en bij
de zwangerschap. Nu waren er echter ook blasten in het
perifere bloed zichtbaar. De patiënte ervoer klachten van
toenemende vermoeidheid en orthopneu. Bij lichamelijk
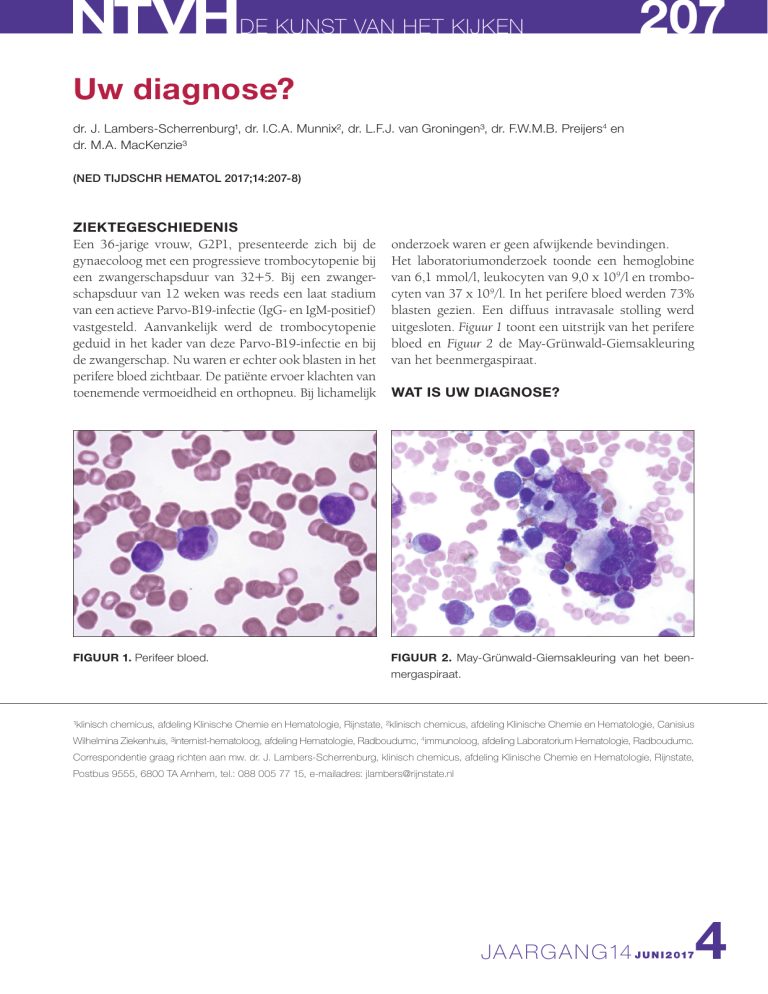
FIGUUR 1. Perifeer bloed.
onderzoek waren er geen afwijkende bevindingen.
Het laboratoriumonderzoek toonde een hemoglobine
van 6,1 mmol/l, leukocyten van 9,0 x 109/l en trombocyten van 37 x 109/l. In het perifere bloed werden 73%
blasten gezien. Een diffuus intravasale stolling werd
uitgesloten. Figuur 1 toont een uitstrijk van het perifere
bloed en Figuur 2 de May-Grünwald-Giemsakleuring
van het beenmergaspiraat.
WAT IS UW DIAGNOSE?
FIGUUR 2. May-Grünwald-Giemsakleuring van het beenmergaspiraat.
1klinisch chemicus, afdeling Klinische Chemie en Hematologie, Rijnstate, 2klinisch chemicus, afdeling Klinische Chemie en Hematologie, Canisius
Wilhelmina Ziekenhuis, 3internist-hematoloog, afdeling Hematologie, Radboudumc, 4immunoloog, afdeling Laboratorium Hematologie, Radboudumc.
Correspondentie graag richten aan mw. dr. J. Lambers-Scherrenburg, klinisch chemicus, afdeling Klinische Chemie en Hematologie, Rijnstate,
Postbus 9555, 6800 TA Arnhem, tel.: 088 005 77 15, e-mailadres: [email protected]
JA A RG A NG14 J U N I 2 017
4
JA A RG A NG14 J U N I 2 017
Tevens kunt u daar zoeken naar artikelen die in onze andere tijdschriften zijn gepubliceerd.
WWW.ARIEZ.NL
ALLE GEPUBLICEERDE ARTIKELEN KUNT U VINDEN OP ONZE WEBSITE:
Antwoord: Bij deze 36-jarige zwangere bleek sprake te zijn van een acute myeloïde leukemie (AML) met myelodysplasie-gerelateerde veranderingen. In een zeer celrijk beenmergaspiraat werd een sterke toename van kleine tot
middelgrote myeloïde blasten (83%) gezien met een fijne kernstructuur, matige hoeveelheid cytoplasma en soms
een rafelige rand. Daarnaast was er een opvallende toename van de megakaryopoëse, bestaande uit veel micromegakaryocyten, jonge vormen, hypersegmentatie en losliggende kernen, passend bij ernstige dysplasie. Ook in
de erytroïde lijn werd duidelijke dysplasie gezien.
De immuunfenotypering van het beenmerg toonde een afwijkende onrijpe myeloïde populatie met expressiepatroon CD45+, CD117+, CD7+, CD33+, MPO-, TdT-, CD15- en gedeeltelijke expressie van CD34, CD13,
CD133, CD11b en HLADR. Tevens was 50% van de cellen CD235a+, CD36+ en CD71+ (erytroïd) en 50% van
de cellen CD41+ en CD61+ (megakaryocytair).
De diagnose AML met myelodysplasie-gerelateerde veranderingen kan worden gesteld op basis van AML met
‘multilineage’ dysplasie, AML met MDS-gerelateerde cytogenetische afwijkingen of een voorgeschiedenis met
MDS of MDS/MPN. Deze casus betreft een AML op basis van ‘multilineage’ dysplasie. Cytogenetisch onderzoek
toonde in de helft van de metafasen een tetraploïd patroon. Daarnaast werden mutaties gevonden in FLT3-ITD
en NPM1. Deze AML werd dan ook beschouwd als ‘poor risk’. Hoewel een AML met myelodysplasie-gerelateerde
veranderingen relatief veel voorkomt, is de diagnose van een AML tijdens de zwangerschap zeldzaam.1,2 De incidentie van leukemie tijdens de zwangerschap wordt geschat op 1:75.000-100.000 zwangerschappen, waarbij
de meeste leukemieën acuut zijn: twee derde is myeloïd en een derde lymfoblastair.2 De lage incidentie en soms
subtiele presentatie van AML in de zwangerschap vertragen vaak de diagnose. Fysiologische veranderingen
geassocieerd met de zwangerschap, zoals anemie of trombocytopenie, kunnen een hematologische aandoening
tijdelijk maskeren.3 De zeldzame diagnose van AML tijdens de zwangerschap vormt een therapeutisch dilemma.
Aanbevolen wordt de behandeling zo snel mogelijk te starten en af te stemmen op de zwangerschapsduur.4-7
De patiënte in deze casus werd ingeleid bij een zwangerschap van 33+3, waarna door middel van een ongecompliceerde vaginale partus een gezonde zoon werd geboren. Drie dagen na de partus werd gestart met de eerste
remissie-inductiekuur bestaande uit idarubicine en cytarabine (conform de standaardgroep van de HOVON-132).
Na de eerste remissie-inductiekuur werd geen remissie bereikt, het beenmerg toonde nog 18% blasten. Aansluitend
werd een tweede remissie-inductiekuur gegeven (daunorubicine en cytarabine) die resulteerde in persisterende
aplasie zonder lokalisatie van de AML. Vervolgens werd een allogene MUD-stamceltransplantatie verricht, na
conditionering door middel van decitabine, fludarabine en TBI in de PLMA34-studie. Post-transplantatie is er
sprake geweest van een CMV-reactivatie en een acute graft-versus-hostziekte van de darm (stadium 1, ‘overall’
graad II). Momenteel verkeert de patiënte in een persisterende remissie van de AML.
REFERENTIES
1. Haas FJ. Pregnancy in association with a newly diagnosed cancer: a population-based epidemiologic assessment. Int J Cancer 1984;34:229-35.
2. Pavlidis NA. Coexistence of pregnancy and malignancy. Oncologist 2002;7:179-87.
3. VandenBriele C, Dierickx D, Amant F, et al. The treatment of hematologic malignancies in pregnancy. Ob Gyn 2010;2(2):74-87.
4. Van der Burg LM, Van Marwijk Kooy M, Verdonck LF, et al. Acute myeloïde leukemie in het tweede en derde trimester van de zwangerschap. Ned Tijdschr
Hematol 2014;8:359-62.
5. Chelghoum Y, Vey N, Raffoux E, et al. Acute leukemia during pregnancy: a report on 37 patients and a review of literature. Cancer 2005;104:110-7.
6. Milojkovic D, Apperley JF. How I treat leukemia during pregnancy. Blood 2014;123:974-84.
7. Brenner B, Avivi I, Lishner M. Hematological cancers in pregnancy. Lancet 2012;379:580-7.
208
DE KUNST VAN HET KIJKEN












