Stop de opmars van bacteriële infecties!
Opmars van de bacterie in het veld
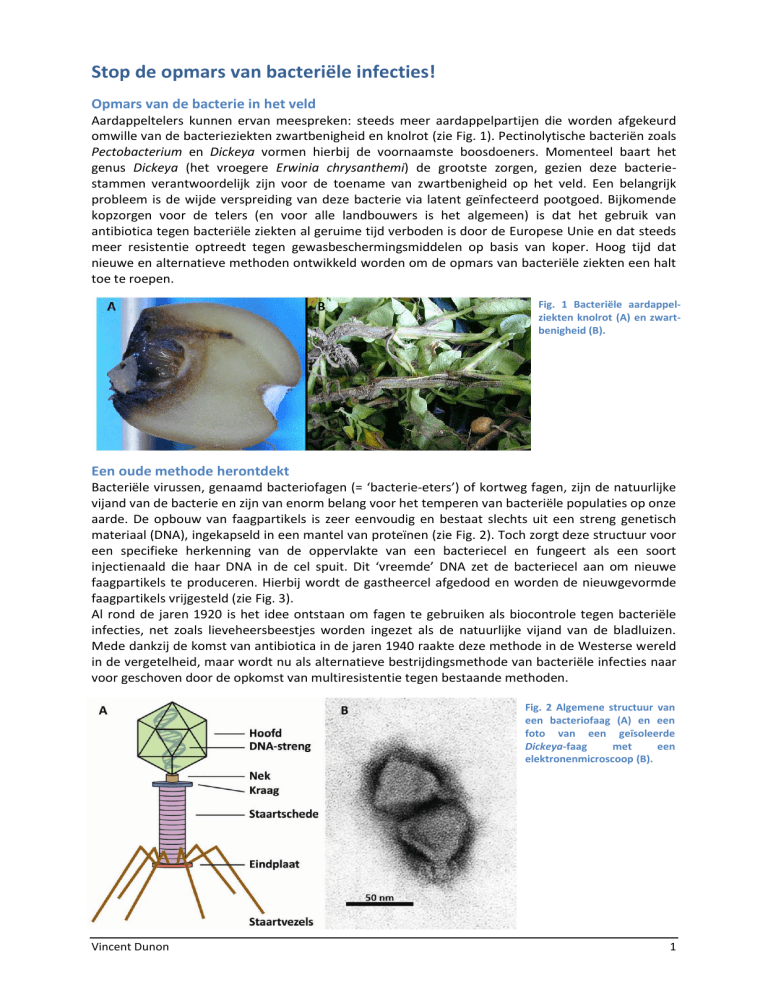
Aardappeltelers kunnen ervan meespreken: steeds meer aardappelpartijen die worden afgekeurd
omwille van de bacterieziekten zwartbenigheid en knolrot (zie Fig. 1). Pectinolytische bacteriën zoals
Pectobacterium en Dickeya vormen hierbij de voornaamste boosdoeners. Momenteel baart het
genus Dickeya (het vroegere Erwinia chrysanthemi) de grootste zorgen, gezien deze bacteriestammen verantwoordelijk zijn voor de toename van zwartbenigheid op het veld. Een belangrijk
probleem is de wijde verspreiding van deze bacterie via latent geïnfecteerd pootgoed. Bijkomende
kopzorgen voor de telers (en voor alle landbouwers is het algemeen) is dat het gebruik van
antibiotica tegen bacteriële ziekten al geruime tijd verboden is door de Europese Unie en dat steeds
meer resistentie optreedt tegen gewasbeschermingsmiddelen op basis van koper. Hoog tijd dat
nieuwe en alternatieve methoden ontwikkeld worden om de opmars van bacteriële ziekten een halt
toe te roepen.
Fig. 1 Bacteriële aardappelziekten knolrot (A) en zwartbenigheid (B).
Een oude methode herontdekt
Bacteriële virussen, genaamd bacteriofagen (= ‘bacterie-eters’) of kortweg fagen, zijn de natuurlijke
vijand van de bacterie en zijn van enorm belang voor het temperen van bacteriële populaties op onze
aarde. De opbouw van faagpartikels is zeer eenvoudig en bestaat slechts uit een streng genetisch
materiaal (DNA), ingekapseld in een mantel van proteïnen (zie Fig. 2). Toch zorgt deze structuur voor
een specifieke herkenning van de oppervlakte van een bacteriecel en fungeert als een soort
injectienaald die haar DNA in de cel spuit. Dit ‘vreemde’ DNA zet de bacteriecel aan om nieuwe
faagpartikels te produceren. Hierbij wordt de gastheercel afgedood en worden de nieuwgevormde
faagpartikels vrijgesteld (zie Fig. 3).
Al rond de jaren 1920 is het idee ontstaan om fagen te gebruiken als biocontrole tegen bacteriële
infecties, net zoals lieveheersbeestjes worden ingezet als de natuurlijke vijand van de bladluizen.
Mede dankzij de komst van antibiotica in de jaren 1940 raakte deze methode in de Westerse wereld
in de vergetelheid, maar wordt nu als alternatieve bestrijdingsmethode van bacteriële infecties naar
voor geschoven door de opkomst van multiresistentie tegen bestaande methoden.
Fig. 2 Algemene structuur van
een bacteriofaag (A) en een
foto van een geïsoleerde
Dickeya-faag
met
een
elektronenmicroscoop (B).
Vincent Dunon
1
Virussen!? Is dat wel veilig?
Fagen moeten nog steeds opboksen tegen de negatieve connotatie van het label ‘virus’ dat ze
opgeplakt krijgen. We denken al gauw aan het griepvirus of uitbraken van SARS, maar in
werkelijkheid verschillen dierlijke en bacteriële virussen als dag en nacht. Bacteriofagen zijn immers
zeer specifiek voor een welbepaalde bacteriële soort, laten de rest van de microbiële gemeenschap
intact en vormen zeker geen bedreiging voor dierlijke cellen (dierlijke cellen verschillen immers
fundamenteel van bacteriecellen zodat ze niet compatibel zijn).
Naast hun specificiteit bezit het gebruik van fagen nog voordelen. Het is als het ware een middel dat
zichzelf in stand houdt (en vermenigvuldigt), waardoor ze zelf reageren op de ernst van de bacteriële
infectie. Gezien hun opbouw bestaat uit natuurlijke componenten, zijn ze volledig biodegradeerbaar
en oefenen zo geen extra druk uit op het milieu zoals dit bij de tegenwoordige bestrijdingsmethoden
wel het geval is.
Door de voordelen en oplossingen die fagen bieden, vinden ze langzamerhand hun weg naar
industriële productieprocessen. Zo heeft het Amerikaanse federaal voedselagentschap (FDA) het licht
al op groen gezet voor het gebruik van fagen ter bestrijding van de menselijke pathogeen Listeria
monocytogenes in levensmiddelen, waaronder zachte kazen. I n de Europese Unie is momenteel
een evaluatie aan de gang van het gebruik van fagen op levensmiddelen door het Europese
voedselagentschap (EFSA) en daarnaast wordt er ook getracht een Europees wettelijk kader te
creëren die het gebruik mogelijk moet maken.
Fig. 3 Levenscyclus van fagen. (1) Fagen
en bacteriën zijn in de omgeving
aanwezig. (2) Bij herkenning van een
bepaalde bacteriecel hecht de faag zich
aan het oppervlak, (3) waarna het zijn
DNA-streng (rood) injecteert. (4) De
bacteriecel wordt op deze manier er
toe aangezet om nieuwe faagpartikels
te produceren. (5) Uiteindelijk wordt
de bacterie gedood en komen de
nieuwe faagpartikels vrij om nieuwe
bacteriecellen te infecteren.
Dickeya in het vizier
Om de strijd aan te binden met de aardappelpathogeen Dickeya spp. hebben onderzoekers van de
Katholieke Universiteit Leuven (departement Biosystemen) en het Instituut voor Landbouw- en
Visserijonderzoek (ILVO) de handen in elkaar geslagen om een faaggebaseerde bestrijdingsstrategie
op te stellen. Hierbij zal worden getracht om fagen te gebruiken als middel om verspreiding van de
bacterie naar gezond pootgoed te voorkomen tijdens de opslag. De eerste fase van dit project is
gestart, waar we er in geslaagd zijn specifieke fagen te isoleren tegen Dickeya, die hun infectiviteit
onder labocondities hebben bewezen. Drie verschillende types fagen werden uit bodemstalen
geïsoleerd en één hiervan werd onderworpen aan een grondige analyse op moleculair niveau door
de bepaling van de volledige DNA-sequentie (zie Fig. 2). Analyse van dit genoom toonde aan dat er
geen toxische genen aanwezig zijn. Naast deze cruciale ‘veiligheidsanalyse’ werden ook belangrijke
microbiële parameters bepaald die nodig zijn voor de ontwikkeling van deze bestrijdingsstrategie
tegen Dickeya bacteriën. In een volgende fase zal de effectiviteit van het gebruik van deze fagen op
pootgoed worden onderzocht. Ook voor andere economisch belangrijke gewassen kunnen
gelijkaardige studies en strategieën worden opgesteld.
Vincent Dunon
2












