Afbeelden van amyloïdplaques in de hersenen met PET
Rik Ossenkoppele, Nelleke Tolboom, Yolande A. Pijnenburg, Adriaan A. Lammertsma, Philip Scheltens en Bart N.M. van Berckel
De ziekte van Alzheimer wordt neuropathologisch gekenmerkt door de aanwezigheid van seniele plaques. Deze
plaques worden gevormd door accumulatie van het eiwit amyloïd-bèta (Aβ), een proces dat al decennia vóór de
manifestatie van de eerste symptomen begint. Met positronemissietomografie (PET) en de tracer 11C-PIB kunnen
deze seniele plaques gevisualiseerd worden. Dergelijke ‘amyloïdimaging’ kan een belangrijke rol gaan spelen bij
zowel vroegdiagnostiek als differentiaaldiagnostiek bij de ziekte van Alzheimer. In de toekomst kan amyloïd­
imaging eveneens helpen bij het selecteren van patiënten voor klinische trials en het kwantitatief evalueren van
de effecten van ziekte-modulerende middelen gericht tegen accumulatie van Aβ.
Bijdragen in de rubriek Nieuwe technieken gaan over technische
mogelijkheden binnen de geneeskunde, die nieuw zijn zodat er nog
niet veel bewijs is, maar waarbij de beschikbare feiten toch zo interessant zijn, dat lezers de informatie nuttig zullen vinden. Of de
beschreven technieken na verder onderzoek uiteindelijk tot de gangbare medische praktijk zullen gaan behoren, zal moeten blijken.
Welke techniek?
Met behulp van positronemissietomografie (PET) en de
PET-tracer ‘Pittsburgh compound-B’, gelabeld met koolstof-11 (11C-PIB), kunnen sinds kort de seniele plaques, die
kenmerkend zijn voor de ziekte van Alzheimer, gedurende
het leven zichtbaar gemaakt worden.1 PET is een nucleair
geneeskundige techniek waarbij een driedimensionale
afbeelding wordt gevormd van moleculaire of functionele
processen in het lichaam. PIB is een derivaat van thioflavine-T, een merkstof die gebruikt wordt voor ex-vivo
detectie van plaques. 11C-PIB wordt in tracerhoeveelheden
geïnjecteerd, passeert de bloed-hersenbarrière en bindt
vervolgens aan seniele plaques in het levende brein.
VU medisch centrum, Amsterdam.
Afd. Nucleaire Geneeskunde & PET Research:
R. Ossenkoppele, MSc, neuropsycholoogonderzoeker (tevens: Afd. Neurologie &
Alzheimercentrum); dr. N. Tolboom, nucleair
geneeskundige in opleiding;
prof.dr. A.A. Lammertsma, fysicus;
dr. B.N.M. van Berkel, nucleair geneeskundige.
Afd. Neurologie & Alzheimercentrum:
dr. Y.A. Pijnenburg, neuroloog;
prof.dr. P. Scheltens, neuroloog.
Contactpersoon: R. Ossenkoppele, Msc
([email protected]).
Waarom is er behoefte aan een nieuwe techniek?
De belangrijkste component van de seniele plaques is het
eiwit amyloïd-bèta (Aβ). Aβ-deposities ontstaan al vele
jaren vóór de manifestatie van de eerste symptomen van de
ziekte van Alzheimer. In de ‘amyloïd-cascade-hypothese’
speelt Aβ dan ook een centrale rol. Het in beeld brengen
van de pathologische stapeling van Aβ, en dus van de
moleculair-pathologische verschijnselen die ten grondslag
liggen aan de ziekte van Alzheimer, maakt het mogelijk de
ziekte veel eerder dan nu op het spoor te komen. Dit is
belangrijk omdat de diagnose, zolang deze niet pathologisch-anatomisch bevestigd is, alleen berust op klinische
criteria van de National Institute of Neurological and
NED TIJDSCHR GENEESKD. 2011;155:A2981
1
K L I NI SCH E PR AK TI JK
nieuwe technieken
K L I NI SCH E PR AK TI JK
Communicative Disorders and Stroke en de Alzheimer’s
Disease and Related Disorders Association, de zogenaamde
NINCDS-ADRDA-criteria. Met deze criteria kan de diagnose ‘ziekte van Alzheimer’ pas worden gesteld als er al
sprake is van dementie en niet al in de fase van de eerste
klachten. Niet alleen laat dit de patiënt en zijn of haar naasten lang in onzekerheid, ook voor de ontwikkeling en het
effectief gebruik van nieuwe geneesmiddelen is het vroegtijdig en accuraat stellen van de juiste diagnose belangrijk.
Daarnaast is er behoefte aan diagnostische hulpmiddelen
die kunnen helpen bij het differentiëren tussen de ziekte
van Alzheimer en andere vormen van dementie die qua
presentatie erg op elkaar kunnen lijken, maar duidelijk
verschillen in onderliggende neuropathologische veranderingen.
geringe 11C-PIB-binding wordt ook gezien bij patiënten
met een andere vorm van dementie (zoals frontotemporale
dementie, corticobasale degeneratie en vasculaire dementie) waarvan histopathologisch bekend is dat deze niet
gekenmerkt worden door abnormale amyloïdstapeling.
Bovenstaande maakt dat de sensitiviteit en de specificiteit
van 11C-PIB-PET voor de klinische diagnose ‘ziekte van
Alzheimer’ hoog zijn. Tevens zijn er meerdere onderzoeken
die aantonen dat een afwijkende 11C-PIB-scan een goede
voorspeller is voor progressie naar de ziekte van Alzheimer
bij patiënten met lichte cognitieve klachten.3 Verder is een
11
C-PIB-PET-scan gemakkelijk en betrouwbaar visueel te
beoordelen.4 De testkarakteristieken van 11C-PIB-PET binnen een ongeselecteerde patiëntenpopulatie afkomstig uit
een geheugenpolikliniek worden momenteel onderzocht.
Welke indicaties?
Toekomstverwachting
11
De verwachting is dat moleculaire beeldvorming van
Aβ-plaques met PET (ook wel ‘amyloïdimaging’ genoemd)
een belangrijke bijdrage kan leveren aan het identificeren
van de ziekte van Alzheimer in een prodromaal stadium en
aan differentiaaldiagnostische overwegingen wat betreft
het type dementie. Daarnaast kan amyloïdimaging met PET
in de toekomst een rol spelen bij het selecteren van geschikte
patiënten voor klinische trials en het kwantitatief evalueren
van de effectiviteit van experimentele therapieën.
C-PIB-PET kan ingezet worden bij vroegdiagnostiek en
bij differentiaaldiagnostiek bij patiënten met cognitieve
stoornissen.
Welk probleem wordt hiermee opgelost?
11
C-PIB-PET biedt mogelijkheden in specifieke situaties
waarin andere diagnostische hulpmiddelen ontoereikend
zijn. Bijvoorbeeld: bij patiënten met dementie komen frequent depressies, slaapstoornissen en afasie voor. Deze
factoren kunnen een forse invloed hebben op het neuropsychologisch onderzoek, een essentieel onderdeel van het
diagnostisch proces. Ook een hoog premorbide IQ of een
taalbarrière kan het stellen van de diagnose bemoeilijken.
De interpretatie van een 11C-PIB-PET-scan is niet gevoelig
voor deze factoren.
Verder is bekend dat pathologische stapeling van amyloïd
voorafgaat aan cognitieve achteruitgang en morfologische
veranderingen in de hersenen. 11C-PIB-PET kan informatie
verschaffen over moleculaire veranderingen tijdens vroege
stadia van de ziekte die met andere diagnostische hulpmiddelen niet te verkrijgen zijn. Aan het andere eind van het
spectrum is bij een gevorderde dementie de atrofie soms
dusdanig gegeneraliseerd over de hersengebieden, dat lastig te definiëren is bij welk type dementie het beeld op een
MRI-scan het beste past. 11C-PIB-PET kan bij dergelijke
patiënten bij de differentiaaldiagnostiek van waarde zijn
door de aanwezigheid van pathologische amyloïdstapeling
aan te tonen, dan wel uit te sluiten.
Wat is er bekend over effectiviteit?
Met behulp van 11C-PIB-PET kan goed onderscheid
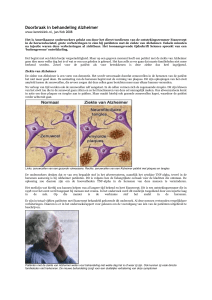
gemaakt worden tussen patiënten met de ziekte van Alzheimer en gezonde ouderen.2 Bij patiënten met de ziekte
van Alzheimer is er in vrijwel de gehele cortex verhoogde
binding van de tracer, terwijl er bij controlepersonen nagenoeg geen binding in de grijze stof is (figuur 1). Deze
2
Waar in Nederland?
De toepassing van 11C-PIB-PET wordt gecompliceerd door
de korte halfwaardetijd (circa 20 min) van het radionuclide
koolstof-11. Hierdoor is 11C-PIB alleen beschikbaar in PETcentra met een cyclotron en een radionuclidesynthesefaciliteit ter plaatse. Op dit moment is 11C-PIB daarom alleen
in het VU Medisch Centrum en in het Universitair Medisch
Centrum Groningen beschikbaar.
Recent zijn er echter een aantal vergelijkbare fluor-18-gelabelde PET-tracers ontwikkeld die vanwege de veel langere
halfwaardetijd van fluor-18 (circa 110 min) gemakkelijker
te distribueren zijn naar andere ziekenhuizen. De meest
veelbelovende tracers zijn 18F-flutemetamol, 18F-fluorbetapir en 18F-fluorbetaben. Fase III-studies met deze tracers
zijn momenteel in volle gang. De verwachting is dat deze
PET-tracers naar analogie van 18F-fluordeoxyglucose (FDG)
in de nabije toekomst getransporteerd kunnen worden
naar andere ziekenhuizen in Nederland en België, die wel
PET-camera’s, maar geen synthesefaciliteiten hebben. Dit
maakt amyloïdimaging bij patiënten met cognitieve stoornissen bereikbaar voor vrijwel alle geheugenpoliklinieken
in Nederland. Het ligt dan ook in de lijn der verwachting
dat deze techniek in de komende jaren een grote vlucht
gaat nemen.
NED TIJDSCHR GENEESKD. 2011;155:A2981
ziekte van Alzheimer
frontotemporale dementie
K L I NI SCH E PR AK TI JK
controle
11
C-PIB-PET
(sagittale doorsnede)
11
C-PIB-PET
(axiale doorsnede)
structurele MRI
(axiale doorsnede)
FIGUUR 11C-PIB-PET- en MRI-beelden van een gezonde vrijwilliger, een patiënt met de ziekte van Alzheimer en een patiënt met frontotemporale dementie. De
schaal bij de PET-scans geeft de mate van binding van 11C-PIB aan amyloïd in de hersenen weer, waarbij zwart/blauw staat voor weinig binding en geel/rood voor
veel binding. De 11C-PIB-PET-scan van de patiënt met de ziekte van Alzheimer laat duidelijk corticale binding zien, terwijl bij zowel de controlepersoon als bij de
patiënt met frontotemporale dementie alleen niet-specifieke binding in de witte stof zichtbaar is.
Belangenconflict: VUmc ontving voor A. Lammertsma en B. van Berckel
genodigde op wetenschappelijke congressen. Financiële ondersteuning: voor
financiële ondersteuning van: Internationale Stichting Alzheimer Onderzoek
dit artikel geen gemeld.
(ISAO), American Health Assistance Foundation. VUmc ontving voor B. van
Berckel tevens financiële ondersteuning van: Alzheimer association, Center for
Aanvaard op 6 april 2011
Translational Molecular Medicine. P. Scheltens is lid van de raad van toezicht
van de Hersenstichting en is consultant voor Elan-Pfizer, Lundbeck, Nutricia
en Genentech en gaf lezingen voor Quintiles; VUmc ontving hiervoor financiële ondersteuning. A.A. Lammertsma ontving financiële ondersteuning als
Citeer als: Ned Tijdschr Geneeskd. 2011;155:A2981
>Meer op www.ntvg.nl/nieuwetechniek
●
Literatuur
1
2
Klunk WE, Engler H, Nordberg A, et al. Imaging Brain Amyloid in
4
Tolboom N, Flier WM, Boverhoff J, Yaqub M, Wattjes MP, Raijmakers PG,
Alzheimer’s Disease with Pittsburgh Compound-B. Ann Neurol.
et al. Molecular imaging in the diagnosis of Alzheimer’s disease: visual
2004;55:306-19.
interpretation of [11C]PIB and [18F]FDDNP PET images. J Neurol
Ng S, Villemagne VL, Berlangieri S, Lee ST., Cherk M., Gong SJ et al. Visual
Neurosurg Psychiatry 2010;81:882-4 .
Assessment Versus Quantitative Assessment of 11C-PIB PET and 18F-FDG
PET for Detection of Alzheimer’s Disease. J Nucl Med. 2007;48:547-52.
3
Okello A, Koivunen J, Edison P, et al. Conversion of amyloid positive and
negative MCI to AD over 3 years: An 11C-PIB PET study. Neurology.
2009;73:754-60.
NED TIJDSCHR GENEESKD. 2011;155:A2981
3