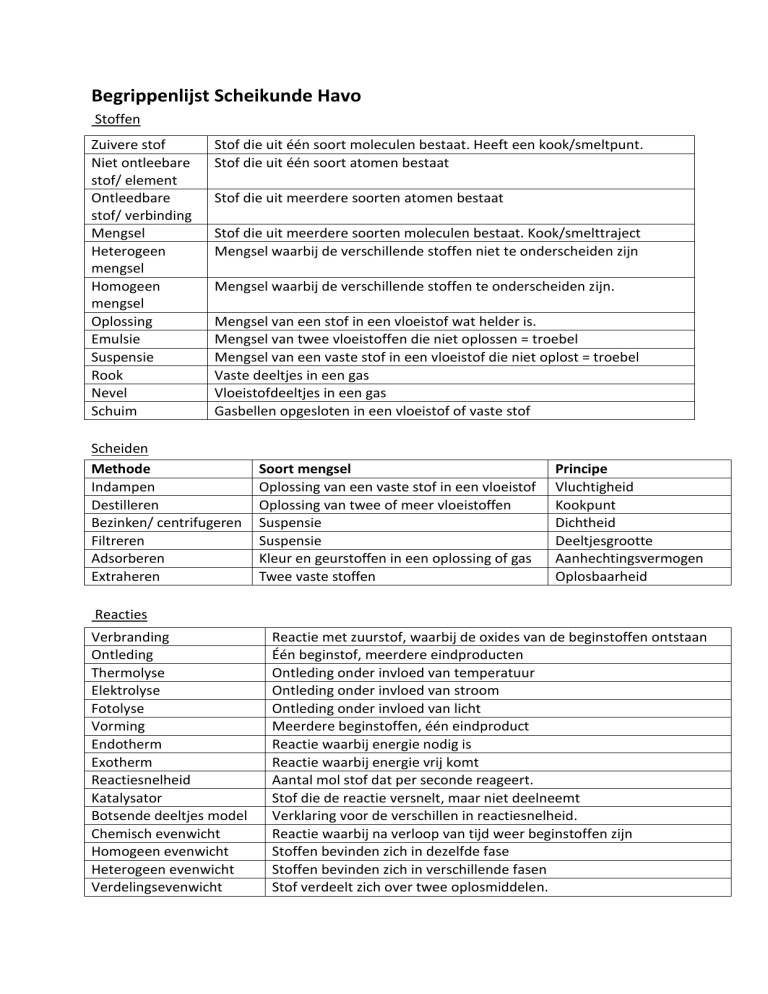
Begrippenlijst Scheikunde Havo
Stoffen
Zuivere stof
Niet ontleebare
stof/ element
Ontleedbare
stof/ verbinding
Mengsel
Heterogeen
mengsel
Homogeen
mengsel
Oplossing
Emulsie
Suspensie
Rook
Nevel
Schuim
Stof die uit één soort moleculen bestaat. Heeft een kook/smeltpunt.
Stof die uit één soort atomen bestaat
Stof die uit meerdere soorten atomen bestaat
Stof die uit meerdere soorten moleculen bestaat. Kook/smelttraject
Mengsel waarbij de verschillende stoffen niet te onderscheiden zijn
Mengsel waarbij de verschillende stoffen te onderscheiden zijn.
Mengsel van een stof in een vloeistof wat helder is.
Mengsel van twee vloeistoffen die niet oplossen = troebel
Mengsel van een vaste stof in een vloeistof die niet oplost = troebel
Vaste deeltjes in een gas
Vloeistofdeeltjes in een gas
Gasbellen opgesloten in een vloeistof of vaste stof
Scheiden
Methode
Indampen
Destilleren
Bezinken/ centrifugeren
Filtreren
Adsorberen
Extraheren
Soort mengsel
Oplossing van een vaste stof in een vloeistof
Oplossing van twee of meer vloeistoffen
Suspensie
Suspensie
Kleur en geurstoffen in een oplossing of gas
Twee vaste stoffen
Principe
Vluchtigheid
Kookpunt
Dichtheid
Deeltjesgrootte
Aanhechtingsvermogen
Oplosbaarheid
Reacties
Verbranding
Ontleding
Thermolyse
Elektrolyse
Fotolyse
Vorming
Endotherm
Exotherm
Reactiesnelheid
Katalysator
Botsende deeltjes model
Chemisch evenwicht
Homogeen evenwicht
Heterogeen evenwicht
Verdelingsevenwicht
Reactie met zuurstof, waarbij de oxides van de beginstoffen ontstaan
Één beginstof, meerdere eindproducten
Ontleding onder invloed van temperatuur
Ontleding onder invloed van stroom
Ontleding onder invloed van licht
Meerdere beginstoffen, één eindproduct
Reactie waarbij energie nodig is
Reactie waarbij energie vrij komt
Aantal mol stof dat per seconde reageert.
Stof die de reactie versnelt, maar niet deelneemt
Verklaring voor de verschillen in reactiesnelheid.
Reactie waarbij na verloop van tijd weer beginstoffen zijn
Stoffen bevinden zich in dezelfde fase
Stoffen bevinden zich in verschillende fasen
Stof verdeelt zich over twee oplosmiddelen.
Fasen
Gas
Vloeistof
Vaste stof
(g)
(l)
(s)
(aq)
Faseovergang
Stof die je niet kan zien en niet kan vastpakken
Stof die je wel kan zien en niet kan vastpakken
Stof die je wel kan zien en wel kan vastpakken
Gasvormig
Vloeibaar
Vast
Opgelost
Overgang van de ene in de andere fase waarbij
de molecuulbindingen verbroken worden
Atomen , Periodiek systeem
Atoomnummer
Atoommassa
Proton
Neutron
Elektron
Groep
Alkalimetalen
Halogenen
Edelgassen
Bepaalt de plaats in het periodiek systeem
Massa van het atoom
Positief kerndeeltje, massa 1 u, gelijk aan het atoomnummer
Neutraal kerndeeltje, massa 1 u, gelijk aan atoommassa-atoomnummer
Negatief deeltje om de kern heen, massa 0 u, bij atoom gelijk aan protonen
Rij van boven naar onder in het PS die dezelfde eigenschappen hebben.
Groep 1, makkelijk reageren, lading 1+
Groep 17, makkelijk reageren, lading 1Groep 18, reageren niet
Moleculen
Niet- metaal
Metaal
Zout
Molecuul
Covalentie
Molecuulformule
Structuurformule
Zouten
Ion
Cl, F, N, I, H, O, Br, P, S, C (B, Si, As, Te, At)
Alle overige elementen.
Metaal met een niet metaal
Atoomgroep met vaste samenstelling, bestaand uit niet metalen
Aantal bindingen dat een molecuul kan aangaan
Geeft het aantal atoomsoorten in een molecuul aan
Geeft de plaats van de atoomsoorten in een molecuul aan (tekening)
Geladen atoom, positief (te weinig elektronen) of negatief (Te veel
elektronen.
Zouthydraat
Zout dat kristalwater (H2O) bevat
Verhoudingsformule Geeft aan in welke verhouding de positieve en negatieve ionen
voorkomen.
Hydratatie
Omringing van een ion door watermoleculen.
Oplosbaarheid
Mate waarin een zout in water oplost
Neerslag
Ontstaan van onoplosbaar zout bij mengen van zoutoplossingen. Zie
BINAS 45A
Bindingen
Metaalbinding
Ionbinding
Atoombinding
Binding tussen de metaaldeeltjes door vrij bewegende elektronen.
Komt alleen voor in metalen
Binding tussen een metaal en een niet metaal, door aantrekking van de
positieve en de negatieve ionen
Binding ín een molecuul (= niet-metalen) door gemeenschappelijk
elektronenpaar
Binding waarbij geen ladingsverschil is tussen de atomen
Gewone
atoombinding
Polaire
Binding waarbij licht ladingsverschil is tussen de atomen, bv O-H of N-H
atoombinding
binding
Vanderwaalsbinding Binding tússen moleculen op basis van aantrekkingskracht. Hoe
zwaarder het molecuul, hoe sterker de binding
Waterstofbrug
Extra binding tussen polaire delen van moleculen (O-H of N-H groepen)
Hydrofiele of
Stof die waterstofbruggen kan vormen en daardoor goed oplost in
polaire stof
water
Hydrofobe of
Stof die geen waterstofbruggen kan vormen en daardoor slecht oplost
apolaire stof
in water.
Koolstofchemie
Alkaan
Alkeen
Stamnaam
Karakteristieke groep
Isomeer
Rekenen
Volume
Massa
Dichtheid
Mol
Verzadigde koolwaterstofketen, zonder dubbele bindingen
Onverzadigde koolwaterstofketen, met dubbele bindingen
Langste koolstofketen binnen een koolwaterstof
Alle atomen/atoomgroepen aan de koolstofketen keten m.u.v. de H
atomen
Dezelfde molecuulformule, andere structuurformule
Grootte van een stof in m3, L (=dm3) of mL (cm3)
Gewicht van een stof in g of kg
Aantal gram dat 1 cm3 weegt
Eenheid voor de hoeveelheid die je van een stof hebt. 1 mol = 6,022 x 10 23
Deeltjes = molecuulmassa in u.
Molverhouding Verhouding waarin de deeltjes in een reactie reageren
Molaire massa Massa van 1 mol stof met als eenheid gram per mol
Molairiteit/
Aantal mol in 1 L of aantal mmol in 1 L
concentratie
Massa%
Aantal gram stof per gram mengsel
Volume %
Aantal (m)L stof per (m)L mengsel
Zuren en Basen
Zuur
Base
Sterk zuur
Sterke base
Zwak zuur
Zwakke base
pH
pOH
Indicator
Zure oplossing
Basische oplossing
Neutralisatie
Titratie
Stof die een H+ afstaat
Stof die een H+ opneemt
Zuur die alle H+ afstaat
Base die alle H+ opnemen
Zuur die een deel van de H+ afstaat
Base die een deel van de H+ opneemt
Zuurgraad van een oplossing. –Log [H+]
Basegraad van een oplossing –Log [OH-]
Kleurstof waarvan de kleur afhangt van de pH
Stof waarbij de pH lager is dan 7
Stof waarbij de pH hoger is dan 7
Reactie waarbij het aantal mol OH- gelijk is aan het aantal mol H+
Kwantitatieve methode om de zuurgraad te bepalen.
Koolstofchemie- Reacties
Kraken
Ontledingsreactie waarbij een koolstofketen in twee of meer delen wordt gesplist
Additie
Toevoeging van een bepaalde stof aan een verzadigde koolstofketen, waarbij een
dubbele binding verdwijnt.
Verestering
Reactie met een zuur en een alcohol waarbij een ester en water ontstaan.
Hydrolyse
Reactie met water waarbij een molecuul splitst, omgekeerde van een verestering
Verzeping
Hydrolyse van een vet o.i.v. een base (OH-) warbij glycerol en zeep ontstaat
Vetharding
Additie van H2 aan een onverzadigde oliën, waarbij vetten ontstaan.
Polymerisatie Aan elkaar zetten van monomeer eenheden tot een lange keten.
Koolstofchemie & Polymeren
Monomeer
Klein molecuul die met zichzelf kan reageren tot polymeer
Dimeer
Twee monomeren aan elkaar
Polymeer
Lange keten van monomeerenheden
Polyalkaan
Polymeer van alkenen
Polyester
Polymeer met esterbindingen
Thermoharder Stof die bij verwarming niet vervormbaar is
Thermoplast
Stof die bij verwarming vervormbaar is
Aminozuren
Verbindingen met een NH2 groep en een COOH groep en 20 verschillende
zijgroepen.
Eiwitten
Polipeptiden, polymeer van aminozuren
Peptidebinding Binding in het eiwit tussen de aminozuren (N-C)
Koolhydraten
Polymeer van glucose
Enzym
Biologische katalysator
Fotosynthese
Vorming van glucose (C6H12O6) en O2 in planten uit CO2 en H2O
Vetzuur
Lange koolstofketen met een zuurgroep aan het eind
Vet
Ester van glycerol met drie vetzuurstaarten, waarvan minimaal één
onverzadigd
Olie
Ester van glycerol met drie vetzuurstaarten, die allemaal verzadigd zijn
Redox
Oxidator
Reductor
Halfreactie
Elektrochemische cel
Elektroden
Elektronenstroom
Ionenstroom
Elektrolyt
Membraan
Zoutbrug
Elektrolyse reactie
Stof die elektronen opneemt
Stof die elektronen afstaat
Reactie van of de reductor of de oxidator.
Batterij waarbij een redoxreactie de elektrische energie levert
Staven van metaal of koolstof die stroom geleiden
Richting waarin de elektronen zich bewegen, vanuit de oplossing naar
de elektrode of andersom.
Richting waarin de ionen zich bewegen, in het membraan of in de
zoutbrug
Geleidende vloeistof tussen de elektronen
Scheidingswand in een cel die de reactie tussen de halfcellen
voorkomt
Staaf met positieve en negatieve ionen die de stroomkring in een cel
gesloten maakt
Ontleding onder invloed van stroom, reactie in een stroombron
Glaswerk
Reageerbuis Reacties
uitvoeren, verdunningsreeksen maken, verwarmen
Bekerglas Mengen, opvangen
oplossen, reacties uitvoeren,
ruwe volumes afpassen,
verwarmen
Erlenmeyer Mengen, opvangen,
oplossen, reacties uitvoeren,
ruwe volumes afpassen, verwarmen
Trechter Gemakkelijk vullen van
glaswerk, filtreren
Maatcilinder Nauwkeurig
variabele volumes afpassen
Maatkolf Zéér nauwkeurig een vast volume
afpassen, voor het maken van oplossingen
Buret Nauwkeurig bepaalde
hoeveelheden vloeistof aftappen
een
Volumepipet Zéér nauwkeurig
een vast vloeistofvolume afpassen
Verdeelpipet Nauwkeurig
variabele volumes afpassen,
verdunningsreeksen maken
Gasmeetspuit Hoeveelheid
vrijgekomen gas meten
Koeler Condenseren van een gas
Rondbodemkolf Reservoir bij destillaties en
extracties.












