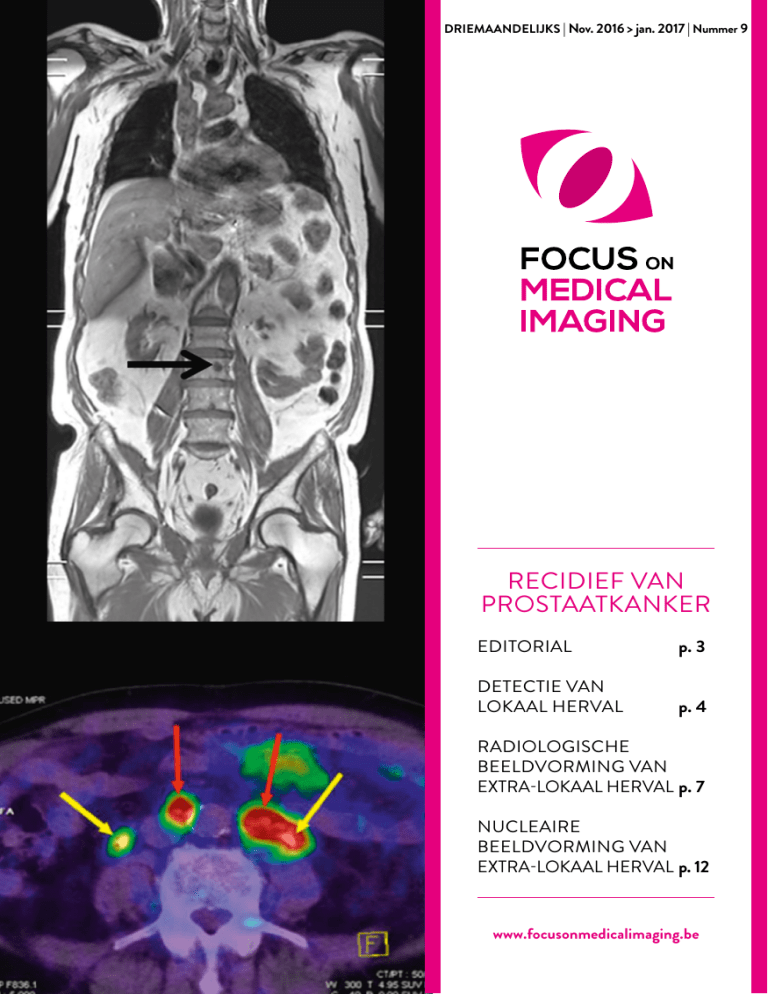
DRIEMAANDELIJKS | Nov. 2016 > jan. 2017 | Nummer 9
RECIDIEF VAN
PROSTAATKANKER
EDITORIAL
p. 3
DETECTIE VAN
LOKAAL HERVAL
p. 4
RADIOLOGISCHE
BEELDVORMING VAN
EXTRA-LOKAAL HERVALp. 7
NUCLEAIRE
BEELDVORMING VAN
EXTRA-LOKAAL HERVALp. 12
www.focusonmedicalimaging.be
EDITORIAL
Publicatie van de vzw. Focus on Medical Imaging
Hoofdzetel
c/o Service de Médecine Nucléaire
Avenue Hippocrate, 10
1200 Woluwé-St-Lambert
2
Redactiecomité
J. Verschakelen (hoofdredacteur)
P. Dieleman
A. Hendlisz
R. Hustinx
M. Keyaerts
M. Lambert
J. Pringot
P. Smeets
Contact
[email protected]
Verantwoordelijke uitgever
F. Jamar, 7, Virginie Plasstraat, 1140 Brussel
Graphic design
LN - Hélène Taquet - www.ln-graphics.be
Druk
AZ Print B-4460 Luik www.azprint.be
/ Cover page - kleur : A. Afshar-Oromieh et al.
EJNMMI, 2014 - Springer -
Prostaatkanker is de frequentste kanker bij
oudere mannen in West-Europa. Meer dan
de helft van de patiënten met prostaatkanker
wordt behandeld en moet nadien blijvend worden
opgevolgd. In een wereld waar de kosten en de
efficiëntie van gezondheidszorg almaar belangrijker worden, is de keuze voor de meest geschikte
follow-upmethode ook een economische keuze.
Op enkele uitzonderingen na meldt de patiënt
zich aan voor follow-up wegens een verhoogd
PSA-gehalte (PSA = prostaatspecifiek antigeen).
Maar op zich is dat geen voldoende reden om
verder onderzoek te starten. Beeldvormend
onderzoek is enkel geïndiceerd als er een redelijke kans bestaat dat er letsels zullen worden
gedetecteerd waarvoor een andere of nieuwe
behandeling nodig is. Of er een beeldvormend
onderzoek wordt aangevraagd, hangt dus niet
alleen af van de vraag of met dat onderzoek een
recidief kan worden opgespoord, maar ook van
de therapeutische gevolgen die dat zou hebben.
Een belangrijke overweging is ook of het gaat
om een recidief met kans op genezing, dan wel
of de setting palliatief is. Vaak zit de patiënt daar
ergens tussenin. Prostaatkanker wordt immers
almaar vaker een chronische ziekte, waarbij de
patiënten tijdens de follow-up sterven aan andere
oorzaken. Dat is toe te schrijven aan het feit dat
steeds vaker voor een behandeling wordt gekozen
die de progressie van de kanker tegengaat. In elk
geval is optimaal overleg tussen de arts die de
patiënt begeleidt, en de radioloog essentieel. Hoe
kan het medisch probleem worden aangepakt en
wat zijn de therapeutische consequenties van de
verschillende opties. Beeldvormend onderzoek
mag enkel worden aangevraagd voor een lokaal
of lokaal-regionaal recidief of een metastase op
afstand. Bij de planning van een beeldvormend
onderzoek moeten we ons afvragen wat het beste
onderzoek is. Hoe gevoelig en specifiek is het?
Dit nummer van Focus on Medical Imaging gaat
over die moeilijke vragen — vragen die niet alleen
radiologen, specialisten nucleaire geneeskunde,
oncologen en urologen aanbelangen, maar ook
huisartsen. Het is immers vaak de huisarts
die het PSA controleert bij patiënten met
prostaatkanker en ook al is het diagnostisch en
therapeutisch beleid uiteindelijk in handen van
het multidisciplinair team, is het goed dat ook de
huisarts op de hoogte is van de mogelijkheden,
beperkingen en indicaties van de verschillende
beeldvormende onderzoeken. De uitgever en
de auteurs van dit nummer verdienen alle lof
voor de inspanningen die ze hebben geleverd
om de plaats van beeldvorming bij recidief van
prostaatkanker te verhelderen.
Prof. em. Willem Oosterlinck,
Urologie, UZ Gent
Ontdek de
samenvattende
fiche op
focusonmedicalimaging.be
3
(zwart) kan worden onderscheiden. Toch geldt dit
vooral voor grotere recidieven (meer dan 2 cm);
de betrouwbaarheid van MRI bij kleinere letsels is
veel minder constant. Functionele MR-technieken
kunnen in dat geval soelaas bieden.
DETECTIE VAN LOKAAL
HERVAL NA BEHANDELING
VAN PROSTAATCARCINOOM
Prof. Dr. Geert Villeirs,
Dienst Radiologie en
Medische Beeldvorming, UZ Gent
4
Ruim dertig procent van de patiënten die behandeld worden voor prostaatkanker wordt binnen
de vijf jaar geconfronteerd met een verhoogd
serum-PSA (prostaatspecifiek antigeen). Dat
hoeft niet noodzakelijk op een lokaal of metastatisch ziekteherval te wijzen, maar het is toch
van belang om bij deze patiënten een tijdige en
correcte diagnose te stellen, zodat ze gerustgesteld
kunnen worden in afwezigheid van ziekte, of zodat
er snel met een behandeling gestart kan worden
wanneer er sprake is van herval.
Het is niet aangewezen om routinematig beeldvorming aan te vragen bij patiënten zonder verhoogd
PSA. De drempelwaarde voor verhoogd PSA
verschilt naargelang de voorafgaandelijke lokale
therapie zoals hieronder zal blijken. Grosso modo
geeft de snelheid waarmee het PSA toeneemt
aan waar het mogelijke herval zich zou kunnen
bevinden: een laat (meer dan 2 jaar na de lokale
behandeling) en traag oplopend PSA, met lange
PSA-verdubbelingstijd (meer dan 6 maanden)
duidt eerder op een lokaal herval, terwijl patiënten
met een vroege en snelle PSA-stijging en dus
korte verdubbelingstijd de meeste kans hebben
op metastasen op afstand.
Wanneer de PSA-drempelwaarde overschreden
wordt, is er sprake van een “biochemisch herval”.
Ook een afwijkend digitaal rectaal onderzoek of
botpijn kan een herval suggereren. In dergelijke
gevallen is het van belang om de locatie, grootte,
en omvang van een eventueel lokaal herval of van
metastase(n) op afstand nauwkeurig vast te stellen.
Daarbij speelt beeldvorming een belangrijke rol.
Herval na radicale prostatectomie
Na radicale prostatectomie zal het PSA geleidelijk
afnemen, om binnen zes à acht weken in principe
ondetecteerbaar te worden. PSA-bepalingen
vroeger dan dit tijdstip hebben dan ook weinig
zin. Wordt het PSA na de operatie niet ondetecteerbaar, of blijkt het PSA naderhand twee
keer na elkaar verhoogd te zijn (> 0.2 ng/mL),
dan is er sprake van een biochemisch herval en
is een zoektocht naar een mogelijk lokaal herval
of gemetastaseerde ziekte geïndiceerd.
De meeste lokale recidieven komen voor in de
regio van de vesico-urethrale anastomose, retrovesicaal of in de zaadblazen. Ze kunnen palpabel zijn
als harde knobbels bij digitaal rectaal onderzoek,
maar door postoperatieve fibrose is dit onderzoek
vaak onbetrouwbaar. Hoewel een transrectale
echografie de regio’s waar lokale recidieven het
vaakst voorkomen relatief goed in beeld kan
brengen, scoort dit onderzoek veel minder goed
voor het diagnosticeren van een lokaal recidief.
Ook het gebruik van kleur- of powerdoppler biedt
wat dat betreft weinig meerwaarde. Een CT-scan,
hoe nuttig ook voor de diagnose van metastasen op
afstand, scoort ondermaats voor het aantonen van
een lokaal herval. Dit hoeft niet te verwonderen:
/ Figure 1 : Een transversaal T2-gewogen beeld toont een
recidief (R) uitgaande van de vesicourethrale anastomose
na radicale prostatectomie, met invasie van de achterste
blaaswand. (EC = endorectale spoel)
een herval heeft veelal net dezelfde densiteit als
het omliggende weefsel, waardoor het er niet
van onderscheiden kan worden, zeker wanneer
het een klein herval betreft. Intraveneuze contrasttoediening kan dat euvel enigszins verhelpen,
zij het onvoldoende om routinematig ingezet te
kunnen worden in de zoektocht naar lokaal herval.
Magnetische resonantiebeeldvorming (MRI)
heeft zich de laatste jaren sterk ontwikkeld.
T2-gewogen beelden beschikken over een groot
weefselonderscheidend vermogen, waardoor het
contrast tussen normaal of fibrotisch weefsel en
een eventueel recidief groot is (in tegenstelling tot
de gelijkaardige densiteiten op CT). Na radicale
prostatectomie zakt de urineblaas in de prostaatloge en wordt de vesico-urethrale anastomose
zichtbaar als een brede fibreuze zone met laag
T2-signaal. Ook de zaadblaasloge verandert na
wegname van de zaadblazen in een dunne fibreuze
band, hoewel zaadblaasresten in ongeveer 20%
van de gevallen kunnen achterblijven.
De kans om een herval te vinden, stijgt met toenemend PSA: bij een PSA lager dan 0,20 ng/mL
is de kans kleiner dan 10%, bij een PSA hoger dan
0,75 ng/mL wordt de kans groter dan 40%. Een
lokaal herval vertoont doorgaans een licht tot matig
verhoogd T2-signaal (grijs), waardoor het goed
van het omliggende weefsel met laag T2-signaal
Diffusie-gewogen beeldvorming (DWI) brengt
de spontane diffusie van waterstofatomen in beeld.
Recidieven zijn immers doorgaans dicht opeengepakte celrijke haarden met talloze hydrofobe
celmembranen en met waterstofatomen die
opgesloten zitten in deze cellen of in een nauw
interstitium, waardoor spontane diffusie ervan
verhinderd wordt. Dit vertaalt zich dan in zones
met hoog signaal op beelden met hoge b-waarde
en laag signaal op zogenaamde ADC-beelden
(apparent diffusion coefficient). Zo worden ook
kleinere letsels betrouwbaarder opgespoord en
kan er zelfs een voorspelling over de agressiviteit
(gleasonscore) van het herval gedaan worden.
Dynamic contrast-enhanced MRI (DCE) heeft
tot op vandaag de beste resultaten voor het opsporen van lokaal herval kunnen voorleggen. Bij
deze techniek wordt een intraveneuze bolus van
gadoliniumhoudend contrastmiddel toegediend
en wordt de weefselaankleuring door middel van
snelle T1-beeldvorming (om de 7 à 12 seconden)
gemeten in het hele prostaatbed, zodat tumorale
neoangiogenese opgespoord en gekwantificeerd
kan worden. Recidieven, die doorgaans sterk
gevasculariseerd zijn, kleuren veel sneller en intenser aan dan het omliggende eerder vaatarme
weefsel en kunnen er daardoor gemakkelijk van
onderscheiden worden. De gevoeligheid en specificiteit van deze techniek, die altijd in combinatie
met T2-gewogen beelden wordt toegepast, loopt
respectievelijk op tot 80% en 90%.
Hoewel hybride technieken zoals choline-PET-CT,
fluorocholine-PET-CT en PSMA-PET-CT goede
resultaten voor het opsporen van metastasen op
afstand opleveren, is hun gebruik voor de detectie
van lokaal herval momenteel nog controversieel
en voorwerp van lopende studies. Ook de toepassing van deze tracers in PET-MR wordt daarbij
onderzocht.
Samenvattend kan dus gesteld worden dat voor
de detectie van lokaal tumorherval na radicale
prostatectomie de combinatie van T2-gewogen
beelden met DCE (contrast-MRI) op dit moment
de beste resultaten oplevert.
5
Herval na radiotherapie
Na radiotherapie (externe radiotherapie of
brachytherapie) zal het PSA afnemen, maar
niet noodzakelijk ondetecteerbaar worden omdat er nog PSA-producerend prostaatweefsel
achterblijft. De laagste PSA-waarde die na het
beëindigen van radiotherapie bereikt wordt,
wordt het PSA-nadir genoemd. Wanneer na
radiotherapie het PSA meer dan 2 ng/mL boven
het PSA-nadir uitstijgt, dan is er sprake van een
biochemisch herval.
In tegenstelling tot de toestand na radicale prostatectomie, blijft de prostaat na radiotherapie
aanwezig en zal hij de gevolgen van deze therapie
vertonen: de prostaat wordt kleiner, harder en
compacter door fibrose en atrofie, waardoor het
met digitaal rectaal onderzoek moeilijk wordt om
een lokaal herval op te sporen. Ook echografie
en CT scoren wat dat betreft slecht omdat een
herval nauwelijks te onderscheiden is van het
omliggende bestraalde (klier)weefsel.
6
Zelfs met T2-gewogen MRI is het niet gemakkelijk om een lokaal herval op te sporen. De kleinere
en compactere bestraalde prostaat vertoont
immers spontaan al een lagere signaalintensiteit
met verlies van de normale zonale anatomie,
waardoor het contrast met een eventueel herval
veel kleiner is dan in een niet-bestraalde prostaat.
Ook de multipele artefacten door ingeplante
radiotherapiezaadjes in geval van brachytherapie
maken het moeilijker om een eventueel herval
te detecteren.
Functionele beeldvormingstechnieken zoals diffusie-gewogen MRI en contrast-MRI (DCE) zijn
dan ook onontbeerlijk om lokale recidieven na een
radiotherapiebehandeling te kunnen opsporen. Deze
manifesteren zich doorgaans op dezelfde plaats als
de oorspronkelijke tumor en laten zich opmerken
als een zone met toegenomen signaal op beelden
met hoge b-waarde; als een zone met laag signaal op
zogenaamde ADC-beelden; en als zones van snelle
en sterke contrastcaptatie na intraveneuze toediening van gadoliniumhoudend contrastmiddel. Het
blijft op dit moment nog onduidelijk of de voorkeur
moet worden gegeven aan diffusie-gewogen MRI
of aan DCE, omdat beide technieken in combinatie
met T2-gewogen opnamen gelijkaardige resultaten
opleveren, met een gevoeligheid en specificiteit van
respectievelijk 80% en 75%.
Net zoals voor de detectie van herval na radicale
prostatectomie, is hybride beeldvorming (PETCT, PET-MR) ook veelbelovend in het geval van
herval na radiotherapie. Er lopen momenteel echter nog studies die de effecten verder bestuderen.
Samenvattend kan gesteld worden dat de combinatie van T2-gewogen beelden met diffusie-gewogen beelden en/of DCE (contrast-MRI) de
beste resultaten oplevert voor de detectie van
lokaal tumorherval na radiotherapie.
Herval na andere behandelingstechnieken
Technieken zoals HIFU (high-intensity focused
ultrasound) en cryotherapie beogen een coagulatienecrose van tumorweefsel, respectievelijk door
weefselopwarming en weefselbevriezing. Het effect op de prostaat is hetzelfde als na radiotherapie
van de prostaat (kleinere, hardere, compactere
prostaat). Ook de beeldvormingstechnieken die
het meest geschikt zijn om lokaal herval op te
sporen, zijn dezelfde.
Meest aangewezen beeldvormingsonderzoek
Beeldvorming voor het aantonen of uitsluiten van
lokaal herval na de behandeling van prostaatkanker
is als routineonderzoek niet geïndiceerd.
Enkel bij afwijkend PSA (de drempelwaarde
hiervoor verschilt naargelang de voorafgaandelijke
lokale therapie), bij afwijkend digitaal rectaal
onderzoek of bij botpijn is het nuttig om via
beeldvorming de plaats en uitgebreidheid van
een eventueel herval op te sporen.
De keuze van beeldvormingstechniek verschilt
naargelang een lokaal, dan wel metastatisch
recidief vermoed wordt. Dit onderscheid kan
grosso modo gemaakt worden aan de hand van de
PSA-kinetiek (snelle en vroege stijging wijst op
metastatisch herval, trage en late stijging eerder
op lokaal herval).
Voor de detectie van lokaal herval is de combinatie van T2-gewogen beelden met DCE (en/
of diffusie-gewogen MRI in geval van herval
na radiotherapie) op dit moment het meest
aangewezen onderzoek.
BEELDVORMEND
ONDERZOEK (BOT EN
LYMFEKLIEREN) VAN EEN
RECIDIEF VAN
PROSTAATKANKER
Prof. Frédéric Lecouvet,
Dienst Medische Beeldvorming
en Prof. Bertrand Tombal,
Dienst Urologie
Cliniques Universitaires Saint-Luc, Brussel
Inleiding
Sinds het bepalen van het prostaatspecifieke
antigeen (PSA) algemeen gebruikt wordt als
detectiemiddel van prostaatkankers, worden
de meeste prostaatkankers gediagnosticeerd
wanneer de tumor nog beperkt is tot de prostaat.
De behandeling van plaatselijke prostaatkanker
is goed gedocumenteerd en er staan nationale
richtlijnen voor goede praktijkvoering online.1 De
richtlijnen verdelen lokale prostaatkankers in drie
risicogroepen: laag, intermediair en hoog risico,
volgens de uitgebreidheid van de tumor (lokale
agressiviteit), de gleasonscore (histologische
agressiviteit) en het PSA-gehalte. Actieve opvolging geniet de voorkeur bij een kanker die een
laag risico inhoudt. Een lokale prostaatkanker die
gepaard gaat met een intermediair of een hoog
risico, wordt behandeld met een radicale prostatectomie (PR) en/of radiotherapie (RT) met
of zonder androgeendeprivatietherapie (ADT).
Hoewel de behandeling veel vooruitgang heeft
geboekt, doet zich bij meer dan 30% van de patiënten die worden behandeld met radiotherapie
en chirurgie, een biologisch recidief voor (met
een stijging van het PSA-gehalte).2 Dat is met
name het geval bij patiënten met een hoogrisicoprostaatkanker. Patiënten die dachten dat hun
kanker genezen was, schrikken als ze zien dat het
PSA-gehalte weer stijgt. Uiteindelijk zal echter
slechts een derde van de patiënten met een biologisch recidief metastasen ontwikkelen, vaak zeer
lang na de eerste tekenen van dat recidief. De
risicofactoren voor het optreden van metastasen
zijn bekend: optreden van een recidief binnen een
jaar na een radicale behandeling, gleasonscore ≥
8 en vooral een PSA-verdubbelingstijd (PSAdt)
korter dan één jaar.
In het geval van een biologisch recidief kan een
zogenaamde salvage (of “reddings”)-behandeling voorgeschreven worden of kan een hormoontherapie, namelijk een androgeendeprivatietherapie (ADT), worden gestart. Na een
7
radicale prostatectomie kan de prostaatloge
bestraald worden en na radiotherapie kan een
radicale prostatectomie, cryotherapie of HIFU
(zeer intense focale ultratonen) overwogen
worden. Maar omdat veel patiënten angstig
zijn, beslissen artsen soms om een ADT te starten nog voor er bewijzen van metastasen zijn.
Meerdere studies hebben echter aangetoond
dat vroege hormoontherapie slechts een zeer
beperkt effect heeft op de overleving van de
patiënten, maar wel enorm veel bijwerkingen
veroorzaakt.
Huidige technieken
8
Prostaatkanker metastaseert bij voorkeur naar de
lymfeklieren van het bekken en het abdomen en
naar het axiale skelet, hoofdzakelijk het bekken,
de wervelkolom, de ribben, de proximale humerus
en het proximale femur. Daarom worden al sinds
tientallen jaren de volgende beeldvormende
onderzoeken aangevraagd om metastasen op te
sporen: een CT-onderzoek van de thorax, het
abdomen en het bekken en een 99m-technetiumbotscintigrafie om respectievelijk lymfeklieren botmetastasen op te sporen (Figuur 1a en b).
Deze beeldvormende technieken blijven actueel
in de meeste richtlijnen.2-4 Het belangrijkste
criterium om ze aan te vragen is een PSAdt van
minder dan 6 maanden.
De auteurs die een dergelijk diagnostisch beleid
(met botscintigrafie en CT-scan) aanraden,
stellen echter zelf dat de genoemde onderzoeken
niet goed genoeg zijn om metastasen in een
vroeg stadium op te sporen. Meestal worden
lymfeklieren waarvan de kleinste diameter groter
is dan 10 mm als verdacht voor metastasering
gezien waardoor echter kleinere lymfekliermetastasen miskend kunnen worden maar ook
goedaardig vergrote lymfeklieren verkeerdelijk
als positief kunnen worden beschouwd. Een
botscintigrafie op zijn beurt detecteert metastasen pas in een laat stadium, wanneer de botcellen
geactiveerd zijn en de osteoblasten reageren
(wat we typisch zien bij prostaatkanker), maar
dat gebeurt pas maanden na infiltratie van de
kanker in het beenmerg.
De toekomst…
De meer recente beeldvormende technieken,
met name MRI en positronemissietomografie
(PET-scan), zijn gevoeliger en brengen een infiltratie van de tumor in het bot en de lymfeklieren
sneller in beeld. Een MRI toont botmetastasen bij
15-30% van de patiënten die een hoog risico op
metastasering lopen en bij wie de botscintigrafie
negatief is. Een scintigrafie is ook onvoldoende
specifiek. Het resultaat ervan is vaak niet eenduidig zodat toch nog een ander beeldvormend
onderzoek (röntgenfoto’s, CT …) moet worden
aangevraagd om goedaardige oorzaken van
hyperfixatie (degeneratief discuslijden, osteoporotische wervelindeuking, ziekte van Paget
…) te onderscheiden van echte metastasen.
Dat brengt kosten met zich mee, een extra
stralingsdosis en ongemak voor de patiënt. De
waarde van een botscintigrafie om de respons
van metastasen op de behandeling te evalueren,
is eveneens beperkt. Ook dat is een zwak punt
van het huidige algoritme, dat gebaseerd is op
een scintigrafie en een CT-scan.
Bij gebrek aan gevoeliger beeldvormende
technieken om een lokaal recidief of metastasen in het skelet en de lymfeklieren in beeld
te brengen, wordt gewoonlijk een salvage (of
“reddings”)-behandeling aanbevolen als de
scintigrafie en de CT-scan negatief zijn en als
het pathologisch-anatomische onderzoek en
de PSAdt wijzen op een niet agressieve tumor.
Als het pathologisch-anatomische onderzoek
en de PSAdt echter wijzen op een agressievere
kanker, wordt een ADT aanbevolen, ook als er
geen aantoonbare metastasen zijn.
Dankzij nieuwe beeldvormende technieken,
waarmee sneller een betrouwbare diagnose van
metastasering kan gesteld worden, wordt het nu
ook mogelijk om de salvage-behandeling beter
te richten en om de respons van de tumor op
de behandeling beter te evalueren. Een MRI
van het skelet (hetzij een MRI van het axiale
skelet met enkel onderzoek van de wervelkolom en het bekken, de predilectieplaatsen bij
metastasering van prostaatkanker, hetzij een
MRI van het hele lichaam) is veel gevoeliger dan
a
b
c
d
/ Figuur 1: Standaard-beeldvormingsonderzoeken bij een man van 71 jaar
met een biologisch recidief (PSA 27,2
ng/ml): botscintigrafie (a) en CT van
het abdomen en het bekken (b) tonen
meerdere botmetastasen (zwarte
pijltjes in a) en lymfekliermetastasen
(witte pijltjes in b). Alternatief in één
beeldvormingsonderzoek: MRI van
het hele lichaam met T1-gewogen
beelden (c, d) en diffusiebeelden (e)
toont botmetastasen (zwarte pijltjes)
en lymfekliermetastasen (witte pijltjes).
e
9
a
10
d
b
e
c
f
/ Figuur 2: Nut van een MRI van het
hele lichaam om metastasen op te
sporen en om de respons te evalueren
bij een patiënt die een hoog risico op
metastasen loopt. a) De botscintigrafie
toont geen afwijkingen. T1-gewogen
MRI-beelden (b) en diffusie MRI (c)
tonen botmetastasen (zwarte pijltjes).
d) Bij een nieuwe botscintigrafie na
3 maanden hormoontherapie (ADT)
zijn nog altijd geen afwijkingen te zien.
e-f) Bij een controle-MRI is het letsel
verdwenen.
een botscintigrafie.5 In studies bij patiënten met
een PSA-verdubbelingstijd < 1 jaar werden met
een MRI botmetastasen ontdekt bij 30% van de
patiënten met een negatieve of twijfelachtige
botscintigrafie (Figuur 2). Een MRI van het hele
lichaam kan ook lymfekliermetastasen in beeld
brengen dankzij een nieuwe MRI-sequentie, de
diffusie MRI, die metastasen in de beenderen en
de ingewanden detecteert op grond van afwijkingen van de bewegingen van watermoleculen in
het tumorweefsel (Figuur 1c, d, e; figuur 2). Een
MRI is het beste onderzoek om de inhoud van het
bekken en lokale recidieven te evalueren. Bij een
patiënt met een biologisch recidief kan met een
MRI van het hele lichaam immers in één keer de
prostaatloge, de lymfeklieren van het abdomen
en het bekken en het skelet onderzocht worden.
Tegen die achtergrond wordt een MRI van het
hele lichaam momenteel vergeleken met recente
nucleaire technieken: PET-CT-scan met choline
of PSMA (prostaatspecifiek membraanantigeen),
waarmee ook bot- en lymfekliermetastasen
opgespoord kunnen worden.
Met die moderne technieken kunnen niet alleen metastasen onderscheiden worden van
andere aandoeningen, maar kan men ook een
nieuwe categorie van patiënten herkennen met
beperkte metastasering, “oligometastatische
tumor” genoemd.6 Die patiënten kan men dan
een specifiekere behandeling geven. MRI en
PET-scan worden momenteel vooral gebruikt
voor onderzoeksdoeleinden, maar worden zeer
zeker voortreffelijke technieken om metastasen in
beeld te brengen. Of men voor deze technieken
zal kiezen zal afhangen van hun accuraatheid,
kosten, stralingsdosis en beschikbaarheid.
We kunnen besluiten dat botscintigrafie en CT
van de thorax, het abdomen en het bekken de
eerste keuze beeldvormende onderzoeken blijven
bij biologisch recidief van prostaatkanker bij een
patiënt met verhoogde risicofactoren (PSAdt <
6 maanden). Met de moderne beeldvormende
technieken, vooral MRI, volstaat één enkel onderzoek voor de stadiëring en kan vooral een beter
onderscheid gemaakt worden tussen patiënten die
een systemische behandeling vergen, en patiënten
die aandachtig moeten worden gevolgd.
Referenties
1. Tombal B, Desomer A, Jonckheer P, et al.
Recommandations nationales de bonne
pratique pour la prise en charge du cancer
localisé de la prostate: seconde partie In:
KCE reports. Good Clinical Practice (GCP).
Bruxelles; 2014.
2. Mottet N, Bellmunt J, Briers E, et al. EAU
- ESTRO - SIOG Guidelines on Prostate
Cancer. 2016. http://uroweb.org/wp-content/uploads/EAU-Guidelines-Prostate-Cancer-2016.pdf .
3. Network NCC. Prostate Cancer. 2015.
http://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf.
4. Gillessen S, Omlin A, Attard G, et al. Management of patients with advanced prostate
cancer: recommendations of the St Gallen
Advanced Prostate Cancer Consensus
Conference (APCCC) 2015. Ann Oncol
2015; 26(8): 1589-604.
5. Sartor O, Eisenberger M, Kattan MW,
Tombal B, Lecouvet F. Unmet needs in the
prediction and detection of metastases in
prostate cancer. The Oncologist 2013; 18:
549-57.
6. Ost P, Bossi A, Decaestecker K, et al.
Metastasis-directed Therapy of Regional
and Distant Recurrences After Curative
Treatment of Prostate Cancer: A Systematic Review of the Literature. Eur Urol
2015;67:852-63.
11
NUCLEAIRE BEELDVORMING
BIJ HERVAL VAN
PROSTAATKANKER
Karolien E. Goffin,
Christophe M. Deroose,
Dienst Nucleaire Geneeskunde,
UZ Leuven
12
Nucleair-geneeskundige beeldvormingstechnieken zoals botscintigrafie en PET-CT spelen
een belangrijke rol bij staging en herstaging van
prostaatkanker, hebben een significante impact
op het diagnostisch beleid en kunnen therapiekeuzes bepalen. Bij patiënten met intermediair- en
hoogrisicoprostaatkanker blijft de botscintigrafie
een belangrijk onderzoek ter detectie van botmetastasen bij staging en herstaging, dankzij
zijn grote sensitiviteit, lage kosten en wijdverspreide beschikbaarheid. De implementatie van
hybride SPECT-CT-toestellen verbetert de
specificiteit van deze beeldvormingsmodaliteit en
vermindert het aantal aanvullende onderzoeken
ten gevolge van niet-conclusieve bevindingen.
Choline-PET-CT is een nuttige beeldvormingstechniek bij patiënten met biochemisch recidief, waar het de keuze van salvage (of “reddings”)-behandelingen bepaalt. In deze setting is
PSMA-PET-beeldvorming echter superieur aan
choline-beeldvorming en heeft de techniek een
grotere impact op het beleid. Studies met grote
homogene patiëntengroepen en histologische
validatie ontbreken voorlopig echter.
Botscintigrafie
De botscintigrafie is de meest gebruikte nucleair-geneeskundige beeldvormingstechniek
voor het opsporen van botmetastasen van prostaatkanker. Met een botscintigrafie kan worden
nagegaan of er botmetastasen zijn, wat hun aantal
is en welk patroon ze volgen, wat essentieel is
om de correcte therapie te bepalen. Ook stelt
botscintigrafie ons in staat om de tumorrespons te
onderzoeken De techniek is gebaseerd op de intraveneuze toediening van botzoekende agentia, zoals
Technetium-99m (99mTc)-gelabelde fosfonaten
(bijvoorbeeld 99mTc-MDP), die zich opstapelen
in het skelet in functie van de hoeveelheid osteoblastische activiteit. De osteoblastische natuur
van botmetastasen van prostaatkanker maakt van
de botscintigrafie een sensitieve techniek voor
M-staging met een gemiddelde sensitiviteit voor
planaire botscintigrafie van 79% met een range
van 51% tot 97%. Botscintigrafie heeft echter een
relatief lage specificiteit (gemiddelde specificiteit
van 59%, range van 39% tot 82%) [1], aangezien
ook een groot aantal goedaardige letsels - zoals
breuken en degeneratieve bot- en gewrichtsaandoeningen - een verhoogde tracer-opname
vertonen. De specificiteit van de botscintigrafie
kan echter sterk verbeterd worden door het
gecombineerd opnemen van 3D-functionele
informatie via SPECT (single photon emission
computed tomography) en anatomische informatie
met behulp van CT (computed tomography). Figuur
1 toont een voorbeeld van de toegevoegde waarde
van SPECT-CT bij de differentiële diagnose van
botmetastasen.
Hybride SPECT-CT-systemen zijn de voorbije jaren geïmplementeerd in de meeste afdelingen nucleaire geneeskunde, waardoor
SPECT-CT-beeldvorming op grote schaal beschikbaar is en gemakkelijk toegankelijk voor de
meerderheid van de patiënten. Het is de facto
de nieuwe standaard voor scintigrafische beeldvorming. De detectieratio van de botscintigrafie
wordt significant beïnvloed door de PSA-waarde,
het klinisch stadium en de gleasonscore (GS). Bij
patiënten met een laag-risico-prostaatkanker is
minder dan 1% van de botscintigrafieën positief
a
b
c
/ Figuur 1. Botscintigrafie bij een 74-jarige patiënt met prostaatkanker. SPECT-CT (a, b) en CT (c) tonen botmetastasen
in het rechter os ilium. Het letsel in wervel L5 (kruis) is een degeneratieve verandering in het rechter facetgewricht. Deze
beelden tonen dat de uitgebreidheid van metastatische ziekte accurater kan worden bepaald met SPECT-CT dan door planaire
whole-body scintigrafie, doordat maligne en benigne letsels beter van elkaar kunnen worden onderscheiden.
en dit verhoogt tot 7 à 38% bij PSA-waarden
van 20 tot 50 ng/ml. Een hogere detectiegraad
wordt eveneens gerapporteerd bij patiënten met
stadium > T3 [2] en GS > 8. In de richtlijnen van
de European Association of Urology (EAU)
wordt een botscintigrafie voor het opsporen van
botmetastasen dan ook voorgeschreven bij patiënten met intermediair-risico-prostaatkanker
met overwegend GS 4 en bij patiënten met een
hoog-risico-, gelokaliseerde of lokaal gevorderde
prostaatkanker [2]. Botscintigrafieën moeten
eveneens uitgevoerd worden bij symptomatische
patiënten, onafhankelijk van de PSA-waarde, de
GS of het klinische stadium.
Na een in opzet curatieve behandeling (radicale
prostatectomie (RP) of radiotherapie (RT))
ontwikkelen 27% tot 53% van de patiënten
een PSA-only of ‹biochemisch› recidief [2]. De
standaard work-up naar uitzaaiingen omvat in dat
geval botscintigrafie en CT van het abdomen en
het bekken. De diagnostische waarde van deze
onderzoeken is echter vaak zeer beperkt bij
asymptomatische patiënten, waarschijnlijk door
een zeer kleine tumorbelasting. De waarschijnlijkheid van een positieve botscintigrafie bij patiënten met biochemisch recidief is afhankelijk van
de PSA-waarde en -kinetiek. EAU-richtlijnen
stellen daarom dat bij patiënten met biochemisch
recidief een botscintigrafie enkel uitgevoerd
moet worden indien hun PSA > 10 ng/ml of bij
snelle PSA-kinetiek (PSA-verdubbelingtijd <
6 maanden of PSA velocity > 0.5 ng/ml/md),
alsook bij patiënten met symptomen die wijzen
op botmetastasen [2].
Positron Emissie Tomografie (PET)
F-fluorodeoxyglucose (FDG)- PET-beeldvorming is een gevestigde beeldvormingsmodaliteit
18
bij diagnose, stadiëring en therapie-opvolging van
meerdere tumortypes. Prostaatkanker is echter
een tumortype zonder grote FDG-aviditeit, waardoor 18F-FDG-PET niet nuttig is en de ontwikkeling en implementatie van alternatieve metabole
of moleculaire tracers, zoals PET-tracers op basis
van choline of PSMA (prostaatspecifiek membraanantigeen), veel aandacht krijgt. Verhoogde
choline-opname in prostaatkankercellen wordt
veroorzaakt door een verhoogde celproliferatie
en opregulatie van choline-kinase in kankercellen.
De opname van radioactief gemerkt choline in
prostaatkanker weerspiegelt dus de snelheid
van tumorcelproliferatie. De detectieratio van
choline-PET-CT bedroeg 62% in een recente
meta-analyse met meer dan 2000 patiënten.
Lokaal recidief werd gedetecteerd bij 27% van
de patiënten, lymfekliermetastasen bij 36%
en botmetastasen bij 25%. Figuur 2 toont een
voorbeeld van een positieve choline-PET-CT
bij een patiënt met biochemisch recidief na
RP. Het is echter bekend dat choline-PET-CT
micrometastatische haarden zoals kleine lymfekliermetastasen van recidiverende prostaatkanker
nauwelijks kan detecteren. Er is daarnaast ook
uitgebreid aangetoond dat de detectieratio
van choline-PET-CT sterk afhankelijk is van de
PSA-waarde op het moment van de PET-scan
en van de PSA-kinetiek: bij PSA-waarden boven
2 ng/ml bedraagt de detectieratio meer dan
50%, terwijl ze minder dan 30% bedraagt bij
PSA-waarden onder 1 ng/ml. Onafhankelijk van
de PSA-waarde is de detectieratio hoger bij een
hoge PSA-velocity (> 5 ng/ml/jaar) en een korte
PSA-verdubbelingstijd (< 2-3 maand). Daarnaast
zijn ook het klinische stadium bij de primaire
diagnose van prostaatkanker en androgeendeprivatietherapie (ADT) belangrijke voorspellers
van positieve choline-PET-CT. Vanwege de
hoge kosten en de beperkte beschikbaarheid
13
a
wordt choline-PET-CT niet aanbevolen bij alle
patiënten met biochemisch recidief. Na radicale
prostatectomie bedraagt de optimale PSA- cutoff
2 ng/ml [2]. Na radiotherapie is de optimale
PSA-cutoff onduidelijk. Dat komt doordat er
een gebrek aan adequate gegevens is en doordat
het PSA moeilijker te interpreteren is, aangezien
de resterende niet-tumorale prostaat nog PSA
produceert [2]. Ondanks deze beperkingen heeft
choline-PET-CT een belangrijke impact op de
behandeling van patiënten met biochemisch
recidief en kan het de therapiekeuze sturen bij
een subgroep van patiënten: de patiënten bij wie
een klein aantal metastasen gedetecteerd wordt,
d.w.z. patiënten met een oligometastatische ziekte.
14
PSMA (prostaatspecifiek membraanantigeen) is
een transmembraan-glycoproteïne dat voornamelijk tot expressie wordt gebracht in normaal
prostaatepitheel, maar dat opgereguleerd is bij
prostaatkanker, in het bijzonder bij metastatische
ziekte. Daardoor is het een aantrekkelijk doelwit
voor diagnose en behandeling van deze ziekte.
Recent zijn dan ook nieuwe PSMA-gerichte
speurstoffen ontwikkeld. 68Ga-PSMA-PET-CT,
meestal met 68Ga-PSMA-11 (ook gekend als
HBED-CC) als radiotracer, werd in snel tempo
ingevoerd in vele Europese diensten nucleaire ge-
neeskunde, waar het onderzoek choline-PET-CT
vervangt bij patiënten met biochemisch recidief.
In 2015 beschreven twee grote retrospectieve
studies detectieratio’s van 80 tot 90% voor
68
Ga-PSMA-PET-CT bij patiënten met biochemisch recidief [3,4]. De detectieratio was
positief gecorreleerd met de PSA-waarde: detectieratio’s bedroegen om en bij de 50% en 58%
voor PSA-waarden onder 0,5 ng/ml en 58% en
73% voor PSA-waarden tussen 0,5 en 1 ng/ml.
Vergeleken met choline–PET-CT werden hogere
detectieratio’s beschreven in alle ranges van PSA
(totaal 66% versus 32%), waarbij het verschil het
grootst was bij PSA-waarden onder 0,5 ng/ml
(50% versus 12%). Daarenboven had PSMAPET-CT een grotere impact op de therapiekeuze
van de patiënt. Een voorbeeld van de superieure
nauwkeurigheid van PSMA-PET-CT in vergelijking met choline-PET-CT is te zien in figuur 3.
Ook in vergelijking met 3D-volumetrische CT is
PSMA-PET duidelijk superieur: twee derde van de
patiënten met metastatische lymfeklieren op PET
waren negatief op contrast-enhanced CT. Hoewel
de resultaten van deze studies veelbelovend zijn,
ontbreekt systematische histologische bevestiging
nog. Desondanks heeft er een snelle verspreiding
van deze nieuwe technologie plaatsgevonden in
landen waar de toepassing van PSMA-liganden
/ Figuur 2. Choline-PET-CT bij een 67-jarige patiënt met een voorgeschiedenis van prostaatkanker (T2bN0Mx). Biochemisch
recidief 4 jaar na RP. PSA = 3,8 ng/ml op het moment van de choline-PET-CT. Choline-PET-CT detecteerde positieve
lymfekliermetastasen presacraal rechts (kruis; a, b, c) en in de linker iliaca communis-keten (kruis; d, e, f). (a-d) zijn choline-PET-beelden, (b-e) fusie-beelden van choline-PET-CT en (c-f) CT-beelden na toediening van oraal en intraveneus contrast.
a
b
c
d
e
f
voor beeldvorming toegelaten is en heeft de
techniek daar cholinebeeldvorming bij patiënten
met biochemisch recidief vervangen. Op dit
moment is PSMA-gebaseerde beeldvorming
echter niet algemeen beschikbaar, vooral als
gevolg van regelgeving.
Referenties
1. Evangelista L, Bertoldo F, Boccardo F, Conti
G, Menchi I, Mungai F, et al. Diagnostic
imaging to detect and evaluate response to
therapy in bone metastases from prostate
cancer: current modalities and new horizons.
European journal of nuclear medicine and
molecular imaging. 2016.
2. Mottet N, Bellmunt J, Briers E, van den
Bergh RCN, Bolla M, van Casteren NJ, et
al. Guidelines on Prostate Cancer. EAU
Guidelines: European Association of Urology; 2015. p. 1-137.
3. Afshar-Oromieh A, Avtzi E, Giesel FL,
Holland-Letz T, Linhart HG, Eder M, et al.
The diagnostic value of PET/CT imaging with
the (68)Ga-labelled PSMA ligand HBEDCC in the diagnosis of recurrent prostate
cancer. European journal of nuclear medicine
and molecular imaging. 2015;42:197-209.
4. Eiber M, Maurer T, Souvatzoglou M, Beer
AJ, Ruffani A, Haller B, et al. Evaluation of
Hybrid 68Ga-PSMA Ligand PET/CT in 248
Patients with Biochemical Recurrence After
Radical Prostatectomy. Journal of nuclear
medicine. 2015;56:668-74.
5. Afshar-Oromieh A, Zechmann CM, Malcher A, Eder M, Eisenhut M, Linhart HG,
et al. Comparison of PET imaging with a
(68)Ga-labelled PSMA ligand and (18)
F-choline-based PET/CT for the diagnosis
of recurrent prostate cancer. European
journal of nuclear medicine and molecular
imaging. 2014;41:11-20.
/ Figuur 3. Patiënt 1 (a, b) en patiënt 2 (c, d). Rode pijlen wijzen
naar een nodulaire bekkenwandmetastase (a, b, histologisch
bevestigd) en naar kleine lymfeklieren (c, d) die duidelijk
pathologische traceropname vertonen op 68Ga-PSMAPET-CT (b en d). Gele pijlen wijzen naar beide ureters (c, d).
Patiënt 1 presenteerde zich met een zeer lage PSA-waarde
(0,01 ng/ml) ondanks zichtbare tumorale letsels. (a+c) zijn
fusiebeelden van 18F-fluoromethylcholine-PET-CT, (b+d)
fusiebeelden van 68Ga-PSMA-PET-CT. Overgenomen uit
Afshar-Oromieh et al. [5]
b
15
c
d
MEDISCHE BEELDEN ZIJN GEEN
VAKANTIEKIEKJES
WEES ER ZUINIG MEE
Volg ons ook op de website van de FOD Volksgezondheid!
www.zuinigmetstraling.be
Waarschuwing : De inhoud van deze brochure is louter informatief. Neem geen belangrijke beslissingen
die uitsluitend gebaseerd zijn op deze informatie. Aarzel niet gespecialiseerd advies in te winnen bij de specialist medische beeldvorming. De vzw. Focus on Medical Imaging kan niet aansprakelijk gesteld worden
voor medische beslissingen of praktijken die zich uitsluitend baseren op de hierin aangeboden informatie,
zonder advies van de specialist medische beeldvorming betreffende de gestelde problematiek.