studiewijzer
leerjaar
klas
periode
stof
: natuurkunde 1
: 2007/2008
:6
: tot SE1
: N1.3 H1-H3; N2.2 H1-H2
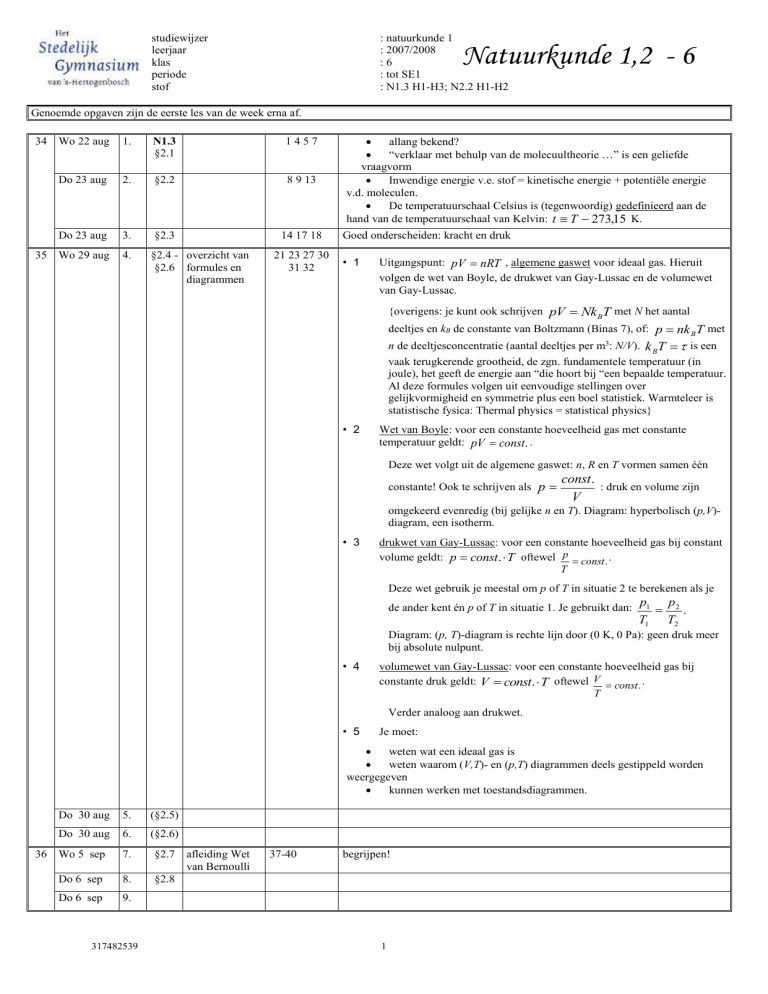
Natuurkunde 1,2 - 6
Genoemde opgaven zijn de eerste les van de week erna af.
34 Wo 22 aug
1.
N1.3
§2.1
1457
Do 23 aug
2.
§2.2
8 9 13
Do 23 aug
3.
§2.3
14 17 18
35 Wo 29 aug
4.
§2.4 - overzicht van
§2.6 formules en
diagrammen
21 23 27 30
31 32
allang bekend?
“verklaar met behulp van de molecuultheorie …” is een geliefde
vraagvorm
Inwendige energie v.e. stof = kinetische energie + potentiële energie
v.d. moleculen.
De temperatuurschaal Celsius is (tegenwoordig) gedefinieerd aan de
hand van de temperatuurschaal van Kelvin: t T 273,15 K.
Goed onderscheiden: kracht en druk
• 1
Uitgangspunt: pV nRT , algemene gaswet voor ideaal gas. Hieruit
volgen de wet van Boyle, de drukwet van Gay-Lussac en de volumewet
van Gay-Lussac.
{overigens: je kunt ook schrijven pV Nk BT met N het aantal
deeltjes en kB de constante van Boltzmann (Binas 7), of: p nk BT met
n de deeltjesconcentratie (aantal deeltjes per m3: N/V). k BT is een
vaak terugkerende grootheid, de zgn. fundamentele temperatuur (in
joule), het geeft de energie aan “die hoort bij “een bepaalde temperatuur.
Al deze formules volgen uit eenvoudige stellingen over
gelijkvormigheid en symmetrie plus een boel statistiek. Warmteleer is
statistische fysica: Thermal physics = statistical physics}
• 2
Wet van Boyle: voor een constante hoeveelheid gas met constante
temperatuur geldt: pV const. .
Deze wet volgt uit de algemene gaswet: n, R en T vormen samen één
constante! Ook te schrijven als
p
const .
: druk en volume zijn
V
omgekeerd evenredig (bij gelijke n en T). Diagram: hyperbolisch (p,V)diagram, een isotherm.
• 3
drukwet van Gay-Lussac: voor een constante hoeveelheid gas bij constant
volume geldt: p const . T oftewel p const . .
T
Deze wet gebruik je meestal om p of T in situatie 2 te berekenen als je
de ander kent èn p of T in situatie 1. Je gebruikt dan: p1 p 2 .
T1
T2
Diagram: (p, T)-diagram is rechte lijn door (0 K, 0 Pa): geen druk meer
bij absolute nulpunt.
• 4
volumewet van Gay-Lussac: voor een constante hoeveelheid gas bij
constante druk geldt: V const. T oftewel V const . .
T
Verder analoog aan drukwet.
• 5
Je moet:
weten wat een ideaal gas is
weten waarom (V,T)- en (p,T) diagrammen deels gestippeld worden
weergegeven
kunnen werken met toestandsdiagrammen.
Do 30 aug
5.
(§2.5)
Do 30 aug
6.
(§2.6)
36 Wo 5 sep
7.
§2.7
Do 6 sep
8.
§2.8
Do 6 sep
9.
317482539
afleiding Wet
van Bernoulli
37-40
begrijpen!
1
37 Wo 12 sep
10.
Do 13 sep
11.
§1.1
§1.2
1-5
zie
opmerkingen
6 7 11-13
Weinig nieuws in de tekst. De opgaven bevatten wèl veel belangrijke
nieuwigheden. Verder goed om te testen of je de juiste kennis hebt.
Zeer belangrijk: begrijpen Binas tabel 25.
Toevoeging tabel 2 p 21:
E E k ( 24 He ) staat vast per isotoop
E E k ,max ( 10 e)
maximum per isotoop
E (h f ) e.m. straling
Do 13 sep
12.
§1.3
38 Wo 19 sep
13.
§1.4
Do 20 sep
14.
§1.5
bespreking
GM-telbuis
15
18-20
zie opmerking
23 25 26 28
, hele waaier aan mogelijke waarden, alleen
samen met α- of β-straling
“α- en β- straling zijn geen straling”
ioniserend en doordringend vermogen: “wet van behoud van ellende”.
Belangrijk: werking GM-telbuis. Verder vooral leerwerk.
Wat je vlekkeloos moet kunnen:
reactievergelijkingen opstellen
Diagrammen à la 1.19 1.20 en 1.21 kunnen lezen èn kunnen
opstellen.
Niet verwarren:
A(t) activiteit v/e monster: aantal kernen dat per seconde vervalt
[becquerel, Bq]
N(t) aantal radioactieve kernen aanwezig in monster [geen eenheid]
A(t) is minus de afgeleide van N(t) naar de tijd (de afname van het aantal kernen).
Het verband tussen beide wordt gegeven door de halfwaardetijd of t1/2. Omdat
N(t) exponentieel verloopt, verloopt A(t) ook exponentieel, ze gaan gelijk op!
t
N (t ) N 0 ( 12 ) , na een bepaalde tijd t = (= t1/2) (de halveringstijd, eigenschap
van het radioactieve isotoop, op te zoeken) is
N
gezakt van
N0
tot
1
2
N0
.
(vul maar in!).
Hetzelfde geldt voor A(t). Differentieer N(t):
t
A(t ) N ' (t ) N 0 ( 12 ) ln( 12 ) 1
met A0
A(t )
Do 20 sep
15.
§1.6
39 Wo 26 sep 16.
§1.7
Do 27 sep
17.
opgave 28
check samenv.
§1.6
N2.2 uitleg
§1.1 schillenmodel
33-36
37 39
1-4
6-8
§1.2
ln 2
18.
§1.3
uitleg fotocel
9-12
40 Wo 3 okt
19.
§1.4
Vervolg uiteg
fotocel
14-16 18
Do 4 okt
20.
Do 4 okt
21.
§1.5- inleiding
§1.6 Kwantumfysica
N2.2
§2.1
317482539
20 22 24
28 30
1345
t
t
N 0 ( 12 ) A0 ( 12 ) ,
N 0 , het verband tussen A(0) en N(0), en dus ook:
N (t ) . Kortom: At N t , met
ln 2
OPGAVE 28 is pittig!
Denk eraan: alle cursief gedrukte begrippen moet je kennen! Maak een
samenvatting met gray, sievert, activiteit, stralingsdosis, weegfactor,
dosisequivalent…
Halveringsdikte: simpel, vooral wiskunde B1 (?!) uit klas 5.
OPGAVEN: typisch examenvragen: veel tekst.
OPGAVE 37: examenvraag
Je moet:
energieniveaudiagrammen kunnen verbinden met spectra;
perfect energie (in J en eV), golflengte, frequentie in elkaar kunnen
omzetten;
kunnen werken met E f h f En Em (koppelen niveauschema’s
Do 27 sep
ln 2
ln 2
en fotonenergieën).
Bestudeer Binas 20, 21A en 22.
Een simpel apparaatje met pittige natuurkunde, niet voor niets twee paragrafen.
diagrammen te lezen en met natuurkundige blik met formules te stoeien.
Zorg dat je goed begrijpt:
hoe je Urem (Bremsspannung) bepaalt (opstelling + grafiek);
hoe je vervolgens h bepaalt (opstelling + formule + grafiek).
Bestudeer Binas 24.
Bestudeer Binas 23A en 23B. Zie verder het examenprogramma-extract hieronder.
Deze paragraaf bevat veel informatie, even aanpoten. Om die reden: vergeet niet
al de opgegeven sommetjes te maken.
Zoals je als het goed is weet (zie ook volgende paragraaf): er bestaat ook β+verval, hierbij wordt een positron (of positon) uitgezonden, het antideeltje van een
elektron, met lading +e.
2
41 Wo 10 okt
22.
§2.2
68
Do 11 okt
23.
§2.3
9 11-14
Do 11 okt
24.
§2.4Uitleg
§2.6 bindingsenergie
; Oefenopgave
17 18 20 22
24 25 27 29
31 32
Probeer je steeds goed voor te stellen wat er gebeurt.
Samenvatting kennen, plus de vergelijkingen. Bestudeer Binas 25.
Zorg dat je vertrouwd raakt met de diverse notaties.
Oefenopdracht zie hieronder:
Na 1224 Mg (natuurlijk radioactief verval)
24
11
2
1
235
H 13 H 24 He 01n E (kernfusie)
U 01n 94 Sr 140 Xe 2 01n E (kernsplijting)
Er wordt massa in (kinetische) energie omgezet. Hoe groot is die massa, en met
hoeveel energie komt dat overeen?
E m c [kg m2/s2 = J = joule]
Vul je in: m = 1 u = 1,66054 · 10-27 kg (binas 7) en reken je het resultaat (in joule)
om in eV, dan vind je:
E (1 u) = 931,48 MeV (zie ook binas 7).
2
figuur 2.14: vanaf links bergop: kernfusie, vanaf rechts bergop kernsplijting.
42 Wo 17 okt
25.
Do 18 okt
26.
Do 18 okt
27.
44 Wo 31 okt
28.
§2.7§2.9
N1.3
§3.1
33 35 38 39
41-43
inleiding
thermodyamica
§2.2
doorlezen
3
Bij kernsplijting, begrijpen: kritische massa en vermenigvuldigingsfactor.
“Wij bestaan uit sterrenstof!” Alle materie waaruit we zijn opgebouwd is gevormd
in sterren, de zwaardere elementen zoals kool-, zuur- en stikstof al bij een
implosie van een ster vóór de vorming van de zon.
De cycli zijn natuurlijk prettige handvaten voor berekeningsvragen.
Over definities van warmte en temperatuur
De temperatuur van een stof is rechtevenredig met de gemiddelde kinetische
energie ( E kin 12 mv 2 ) van de moleculen van die stof.
De evenredigheidsconstante bevat de constante van Boltzmann:
k 1,38066 10 23 J/K (te vinden in binas 7).
9 11 14 16
§3.2
Voor een éénatomig gas: Ekin 32 kT (de bovenstreep staat voor
“gemiddeld”);
o Hoe hard gaat een He-atoom gemiddeld bij
kamertemperatuur?
Omgekeerd is dit één van de manieren waarop temperatuur wordt
gedefinieerd: T 23 k 1 Ekin .
Opmerking: die factor
3
2
is niet in de constante van Boltzmann gestopt omdat
deze verder in de theorie mooi wegvalt. Je kunt namelijk vrij eenvoudig laten zien
dat voor een éénatomig gas van N moleculen met druk p en volume V geldt:
p V 23 N Ekin . Dan volgt : p V 23 N 32 kT NkT , de bekende
ideale-gasformule ( pV nRT , want R k N A ) zonder de breuk!
De temperatuur van een voorwerp wordt dus bepaald door de gemiddelde
kinetische energie van de moleculen waaruit het voorwerp is samengesteld. Als
twee voorwerpen van temperatuur verschillen (A is warmer dan B), dan zal
(indien mogelijk) energie van A naar B gaan totdat de temperaturen gelijk zijn.
Deze overdracht van energie noemen we het afstaan en opnemen van warmte.
Warmte Q is de energie (in joule) die wordt overgedragen (via stroming, straling
of geleiding) van een voorwerp met hogere naar een voorwerp met lagere
temperatuur.
Do 1 nov
29.
20 22 23 25
§3.3
Do 1 nov
30.
§3.4
45 Wo 7 nov
31.
§3.5
27 28 29
31
32 33
Do 8 nov
32.
§3.6
40 43
317482539
Q m c T , oftewel c
Q
, daaruit lees je: soortelijke warmte
m T
is de nodige warmte per kg, per graad Celcius temperatuurstijging.
Een voorwerp heeft een warmtecapaciteit (grote) C, die aangeeft hoeveel
warmte je moet toevoeren om de temperatuur één graad te laten stijgen:
Q C T . Een hoeveelheid (massa m) van een bepaalde stof kun je ook als
een voorwerp beschouwen. Voor C vul je dan C m c in , met kleine c, de
soortelijke warmte van de stof.
Bestudeer binas 28 A-C en 55.
Bestudeer de voorbeelden goed.
Belangrijk: samenvatting p. 142.
3
Do 8 nov
33.
46 Wo 14 nov
34.
SE
§3.7
48-50
Toets 5A
317482539
Radioactiviteit (N1.3 H1); gassen en vloeistoffen (N1.3 H2); energie en warmte
(N1.3 H3) atoomfysica (N2.2 H1); kernfysica (N2.2 H2)
4
studiewijzer
leerjaar
klas
periode
: natuurkunde 1,2
: 2007/2008
:6
: tot kerst
stof
48 Wo 28 nov 35.
§5.1
Do 29 nov
§5.2
36.
Natuurkunde 1,2 - 6
: N2.1 H5 & H6
Uitleg flux en
inductie
123
7 9 10
In plaats van Bn A kun je schrijven: B A sin ( B, A) , je bepaalt
eerst de component van B loodrecht op A en vermenigvuldigt dan met A.
“Aantal veldlijnen” is vaag begrip, vooral bedoeld om je er een gevoel voor te
laten krijgen, maar dat gold sowieso voor de beschrijving van het magnetisch veld
met behulp van veldlijnen.
Inductiewet van Faraday: U ind N
d
. Het gaat om de afgeleide van de flux.
dt
Minteken: de spanning is zo, dat aan de wet van Lenz wordt voldaan (paragraaf
5.3: als er een inductiestroom zou lopen, zou deze een magnetisch veld opwekken
dat de fluxverandering tegenwerkt).
§5.3
Do 29 nov
37.
§5.4
12 14 15 16
Demo dynamo
en trafo
18 19 21 22
49 Wo 5 dec
38.
§5.5
24 25 26
Do 6 dec
39.
§5.6
30-33
Do 6 dec
40.
§5.7
35 37 38
50 Wo 12 dec
41.
§5.8
42-44
Do 13 dec
42.
§5.9
45 47 49 50
Do 13 dec
43.
H6
§6.1
51 Wo 19 dec
44.
Practicum
koffie (zie
handleiding)
+ overige
opdrachten
Moeilijk om niet te verwarren, al die wisselwerkingen tussen elektrische en
magnetische stromen (lorentzkrachten, magneetveld van spoel of draad, enz..) Nú
gaat het om een spanning (en dus E-veld) die ontstaat t.g.v. een veranderend
magnetisch veld in een spoel.
(Wee degene die nu nog komt aanzetten met de noordpool van een elektrisch
veld..)
Een inductiespanning kan ook ontstaan als de stroomkring met de spoel niet
gesloten is. Als de kring wèl gesloten is, gaat er een inductiestroom lopen (grootte
natuurlijk afhankelijk van de grootte van de totale weerstand van de kring incl.
spoel, wet van Ohm).
Mooi om te zien hoe fysici de natuur weer een wil proberen op te leggen, het
lijken wel biologen (vgl. bijv. osmose en evolutie). De .. zal proberen om …
Subdomein: Inductie en wisselstromen
De kandidaat kan
*13 het principe van elektromagnetische inductie kwalitatief toepassen:
•
bewegende magneet in een spoel;
•
draaiend draadraam in homogeen magneetveld;
•
dynamo;
•
in- en uitschakelverschijnselen.
*14 stroom door en spanning over de spoelen van een transformator berekenen:
•
formules voor de ideale transformator;
•
creëren van zeer hoge spanningen of stromen;
•
energietransport over lange afstand;
•
scheiden van circuits met het oog op veiligheid en ontkoppeling.
practicum raket
Inleiding Numerieke Natuurkunde:
Vallend voorwerp met luchtwrijving die afhangt van de snelheid: Fw kv , met
2
richting tegengesteld aan richting v . Voor de resulterende kracht geldt:
Fr Fz Fw a
H6
2
d y
dt
Do 20 dec
45.
Do 20 dec
46.
317482539
2
k dy
Fr
m
mg kv
m
2
g
k
v
2
m
2
g 0
m dt
Rest een pittige kwadratische differentiaalvergelijking in y voor een eenvoudig
natuurkundig probleem. Niet zo simpel om hieruit een formule voor de
verplaatsing y af te leiden. Het kan eenvoudiger numeriek met de computer:
Alleen basisformules gebruiken en stap voor stap laten uitrekenen:
MODEL
STARTWAARDEN
t := t + dt
t=0
Fr = (mg – kv^2)
dt = 0,01
a = (Fr)/m
m=1
dv = a*dt
g = 9,8
v : = v +dv
k=2
dy = v*dt
v = 0 ‘beginsnelheid is nul
y := y + dy
y= 0 ‘valhoogte nemen we als nulpunt
Groot voordeel: je kunt diverse andere krachten zonder veel problemen
doorvoeren, bijvoorbeeld de component van de wrijvingskracht die rechtevenredig
is met de derde macht van de snelheid.
5
02 Ma 7 jan
47.
Di 8 jan
48.
Wo 9 jan
49.
H Beweging
H Kracht en Moment
Do 10 jan
03 Ma 14 jan
50.
Di 15 jan
51.
Wo 16 jan
Do 17 jan
52.
04 Ma 21 jan
53.
Di 22 jan
54.
Wo 23 jan
55.
Do 24 jan
05 Ma 28 jan
H Kracht en Impuls
H Kracht en Beweging
H Licht
40-min.
56.
Di 29 jan
57.
Wo 30jan
58.
40-min.
H Werking v/h Oog
Do 31 jan
07 Ma 11 feb
59.
H Arbeid & Energie
Di 12 feb
60.
Wo 13 feb
61.
H Elektrische Stroom
08 Ma 18 feb
Di 19 feb
62.
63.
H Trilling en Golf
Wo 20 feb
64.
Do 14 feb
Do 21 feb
09 Ma 25 feb
65.
Di 26 feb
66.
Wo 27 feb
67.
H Geluid
H Signaalverwerking
Do 28 feb
10 Ma 3 mrt
68.
Di 4 mrt
69.
Wo 5 mrt
70.
H Elektromagnetisch Spectrum
Do 6 mrt
11 SEII
Toets II
13 Di 25 mrt
Wo 26 mrt
Beweging (N1.1 H2); kracht en moment (N1.1 H3); arbeid en energie (N1.1 H4);
licht (N1.1 H5); de werking van het oog (N1.1 H6); trilling, golf en geluid (N1.2
H1-H2); Elektromagnetisch spectrum (N1.2 H3 par. 1-2); Signaalverwerking
(N1.2 H4); Inductie & wisselstromen (N2.1 H5); Numerieke Natuurkunde
(N2.1 H6)
71.
72.
Do 27 mrt
14 Ma 31 mrt
73.
Di 1 apr
74.
40-min.
Wo 2 apr
75.
40-min.
Do 3 apr
15 Ma 7 apr
76.
Di 8 apr
77.
Wo 9 apr
78.
Do 10 apr
317482539
6
16 Ma 14 apr
79.
Di 15 apr
80.
Wo 16 apr
81.
I/H geen les
Do 17 apr
17 Ma 21 apr
82.
Di 22 apr
83.
Wo 23 apr
84.
40-min. rooster
Do 24 apr
20 Di 13 mei
Facultatief
Wo 14 mei
Facultatief
Do 15 mei
Facultatief
21 Di 20 mei
317482539
CE Na
7