Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
HOOFDSTUK 8 : REPRODUCTIEFYSIOLOGIE BIJ DE HUISDIEREN.
8.1. Geslachtsdeterminatie en -differentiatie.
8.1.1. Definities van geslacht. (Tab.8.1-8.2)
8.1.2. Geslachtsdeterminatie.
° bij de zoogdieren leidt de aanwezigheid van twee X-chromosomen, of beter gezegd : de
afwezigheid van een Y-chromosoom, tot de differentiatie van de in aanvang indifferente gonaden
tot ovaria en tot de ontwikkeling van de vrouwelijke geslachtskenmerken. Is slechts één Xchromosoom aanwezig, dan ontstaat ofwel een nog functioneel ovarium (bvb. muis XO), ofwel
een ovariële dysgenese (bvb. humaan XO = syndroom van Turner bij meisjes). In beide gevallen
zijn de genitaliën fenotypisch vrouwelijk.
° XY en het chromosomaal afwijkende XXY geeft mannelijke individuen : het Y-chromosoom is
dus noodzakelijk voor de vorming van functionele testes en de ontwikkeling van mannelijke
genitaliën. Bij de humane foetus gebeurt de sexuele differentiatie op de leeftijd van 7 tot 8 weken :
in aanwezigheid van een Y-chromosoom differentiëren de indifferente gonaden zich dan tot testes.
Eens de testes gevormd zijn, starten ze met de productie van mannelijke geslachtshormonen die op
hun beurt verantwoordelijk zijn voor de ontwikkeling van het mannelijk fenotype. Zo zal het
hormoon testosteron, geproduceerd door de foetale Leydigcellen, zorgen voor een proliferatie van
het embryonale kanaal van Wolff (afvoerwegen van de testes nl. ductuli efferentes, ductus
epididymidis, ductus deferens en eventueel zaadblaasjes). Een Müllerse inhibitorische substantie
(MIS), geproduceerd door de Sertolicellen, veroorzaakt de regressie van het kanaal van Müller, dat
zich anders zou ontwikkelen tot de afvoerwegen van de ovaria (nl. oviduct, uterus, cervix en
craniaal deel van de vagina).
8.1.2.1. Primaire controle bij vertebraten.
karakteristieken van het primaire geslachtsdeterminerende gen (TDF = testis differentiation
factor):
3
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° behouden gebleven in de loop van de evolutie
° expressie gebeurt zeer vroeg in de embryonale ontwikkeling, op het ogenblik van de
testisdifferentiatie
° expressie enkel bij het mannelijk individu
° expressie blijft beperkt tot de gonaden
° enkele humane pathologieën die verband houden met geslachtsbepaling kunnen worden
teruggebracht tot mutaties van het TDF
(Tabel ? : model van geslachtsbepaling in de loop der evolutie)
8.1.2.2. Het Y-chromosoom. (Fig.8.18.3)
° de mens heeft 46 chromosomen, waaronder de geslachtschromosomen X en Y. Het genetisch
geslacht wordt bepaald door de chromosoominhoud van de zygote na de bevruchting : 46, XX
voor vrouwelijke en 46, XY voor mannelijke individuen. Genetische controle door het Ychromosoom is dominant : XY, XXY of XXXY zijn mannelijk, terwijl XO, XX, XXX of XXXX
fenotypisch vrouwelijk zijn. Hiermee wordt aangetoond dat één of meerdere genen op het Ychromosoom verantwoordelijk zijn voor de differentiatie van de primitieve embryonale gonadale
kam tot de testes.
° tijdens de meiose bij het mannelijk individu schikken het X- en Y-chromosoom zich
paarsgewijze (de korte armen van beide chromosomen vormen tijdens het pachytene stadium van
de meiotische profase een synaptonemaal complex) en een éénmalige “crossing-over” vindt plaats.
Deze koppelvorming tussen het X- en het Y-chromosoom suggereert dat er op beide
chromosomen een homologe regio aanwezig is. Die regio krijgt de term “pseudo-autosomaal”,
aangezien de genen hier gaan recombineren. De loci uit deze regio zijn in min of meerdere mate
geslachtsgebonden : loci distaal van de grenszone van het pseudo-autosomaal gebied recombineren
(tussen X en Y) met een frequentie van 50%, terwijl loci in de buurt van deze grenszone veel
minder frequent (2,5%) recombineren.
Naast de pseudo-autosomale regio zijn er nog verschillende andere homologe regio’s tussen X- en
Y-chromosoom.
Opmerking : op grond van bovenstaande vaststelling werd de hypothese aangevoerd (Ohno, 1964)
dat X- en Y-chromosomen bij de zoogdieren een gemeenschappelijke oorsprong zouden hebben :
het zouden ooit homologe chromosomen geweest zijn, net als de autosomen, met een eenvoudig
allelsysteem voor de geslachtsbepaling.
4
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° het Y-chromosoom is onderverdeeld in verschillende subregio’s : op de korte arm en
vertrekkend van het telomeer vindt men de pseudo-autosomale regio, gevolgd door de
pericentrische regio die de geslachtsbepalende locus bevat. De lange arm kan in twee zones
onderverdeeld worden : de euchromatische regio, die vermoedelijk de genen bevat die betrokken
zijn bij de spermatogenese, en de heterochromatine-regio, die repetitieve DNA-sequenties bevat en
ongeveer de helft van het ganse chromosoom uitmaakt.
Net zoals bij de andere chromosomen kunnen zich bij het Y-chromosoom verschillende
afwijkingen voordoen : duplicatie, deletie, translocatie, enz…
° op het Y-chromosoom werden nog maar weinige genen of loci in kaart gebracht. Enkele zijn
hieronder beschreven :
(1) op de korte arm en vertrekkend van het telomeer :
-
gen
dat
codeert
voor
de
GM-CSF(granulocyt-macrofaag-kolonisatiestimulerende
factor)receptor-subunit. GM-CSF is een hemopoïetische groeifactor die de proliferatie en
functionele activatie van granulocyten en macrofagen stimuleert.
-
locus XGR reguleert vermoedelijk de expressie van MIC2 (zie verder) en de Xgbloedgroeplocus.
-
gen MIC2 codeert voor een bloed-antigen : de expressie ervan op de rode bloedlichaampjes
wordt gereguleerd door het XGR-gen ; MIC2 komt zowel op het X- als op het Y-chromosoom
voor.
-
gen SRY (sex determining region) codeert voor een proteïne met een vermeende DNAbindende functie. Vermoedelijk codeert het gen voor de testis-determinerende factor. (zie ook :
8.1.2.3.)
-
gen ZFY (zinc finger, Y) codeert voor een transcriptie-regulerend proteïne Het heeft een
homoloog op het X-chromosoom, dat aan inactivatie door het X-chromosoom ontsnapt (zie
ook : 8.1.2.3.)
-
gen TSPY (transcript spermatid specific, Y) codeert voor een proteïne dat tot expressie komt
in het spermatide-stadium van de spermatogenese.
(2) op de lange arm en vertrekkend van het centromeer :
-
locus AZF (azoöspermy factor) : deletie in deze regio leidt tot azoöspermie bij mannelijke
individuen met dit chromosomaal gebrek. Vermoedelijk bevat dit locus dus één of meerdere
genen die betrokken zijn bij het proces van spermatogenese.
-
gen H-Y codeert voor een antigen van het “minor histocompatibility complex” dat specifiek is
voor cellen van het mannelijk individu.
5
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° pathologieën die zich voordoen bij de geslachtsdeterminatie : een hele reeks gevallen werden
reeds beschreven waarbij het genetisch geslacht (aan- of afwezigheid van een Y-chromosoom) niet
overeenkomt met het gonadale geslacht (aan- of afwezigheid van testes of ovaria). De
belangrijkste ervan bij de mens zijn in tabel ? weergegeven.
° moleculaire analyse van de geslachtschromosomen bij 46, XX mannelijke en 46, XY
vrouwelijke individuen toonde aan dat de meerderheid van de XX mannen (70 tot 80%) een
wisselende hoeveelheid Y-materiaal in hun genoom hadden en dat 20% van de XY vrouwen een
deletie vertoonden voor ditzelfde Y-materiaal. Aanwezigheid van Y-materiaal op het paternale Xchromosoom is te wijten aan een abnormale terminale transfer van DNA van de Yp-regio naar de
Xp-regio tijdens de meiose bij het mannelijk individu.
Door het bestuderen van mannelijkeXX individuen die drager zijn van Y-materiaal en van steriele
XY mannen of vrouwen met deletie van het Y-materiaal kon een gedetaileerde map van het Ychromosoom opgesteld worden. Hierop werden de TDF en de regio’s noodzakelijk voor een
normale spermatogenese gelokaliseerd.
8.1.2.3. Model voor geslachtsbepaling en kandidaat-genen hiervoor. (Fig.8.4)
° bestudering van mannelijke XX individuen met Y-materiaal op het X-chromosoom, vrouwelijke
XY individuen met deletie van het Y-materiaal en vrouwen met Y(autosoom translocatie liet toe
een deletiekaart van het Y-chromosoom op te stellen. Er werd bepaald dat het interval 1 (het meest
distale interval van de korte arm, grenzend aan de pseudo-autosomale regio), en meer bepaald de
regio 1A2, de TDF bevatte. Onderzoek van dit interval op DNA-sequenties resulteerde in de
isolatie van een gen dat codeert voor een proteïne met 13 zinkvinger-domeinen : het ZFY. Toch
kon dit ZFY niet vereenzelvigd worden met TDF en wel om volgende redenen :
-
een homoloog van ZFY, het ZFX, is terug te vinden op het X-chromosoom (ontsnapt aan
inactivatie) en transcriptie ervan gebeurt volop
-
bij de marsupialia wordt het geslacht eveneens door het Y-chromosoom bepaald, maar hier
wordt ZFY niet door het Y-chromosoom maar wel door een autosoom gedragen
-
bij muizen is de expressie van Zfy-1 en Zfy-2 (twee homologen van ZFY) afhankelijk van de
aanwezigheid van kiemcellen, maar toch kunnen de testes zich ontwikkelen in de afwezigheid
van kiemcellen
° onderzoek bij enkele XX mannen en een XX hermafrodiet bij wie het ZFY ontbrak, toonde wel
de aanwezigheid van enkele Y-sequenties (regio 1A1) in de buurt van de pseudo-autosomale regio
: deze vertegenwoordigen de minimale hoeveelheid Y-materiaal die aanwezig moet zijn om een
6
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
mannelijk fenotype bij de mens te bekomen. Er zijn harde bewijzen dat deze 1A1 regio (ook :
SRY) geïdentificeerd mag worden met TDF :
-
bij muizen is het Sry (homoloog van SRY) een primair signaal in de determinatie van de
testes. Sry komt tot expressie op dag 10,5 tot 12,5 postcoïtum, dit is rond het tijdstip dat de
testes gevormd worden.
-
geslachtsomkering van XX muizenembryo’s kon worden bekomen door een klein DNAfragment, dat Sry als transgen bevat, bij deze dieren in te bouwen.
-
ongeveer 15 tot 20% van de XY vrouwelijke individuen blijken de novo mutaties in de SRYregio te hebben
8.1.2.4. Keuze van geslacht. (Fig.8.58.10 ; Tab.8.3-8.4)
° scheiden van spermatozoa die X of Y bevatten : hiervoor moeten er fysicochemische of
biologische verschillen bestaan tussen beide soorten spermatozoa. De enige techniek die op dit
vlak veelbelovende resultaten geeft is de “flow cytometrie” : het verschil in DNA-inhoud tussen
X- en Y-cellen is speciesafhankelijk en bedraagt 1,5 tot 5%. Bij flow cytometrie wordt het DNA
gekleurd en de fluorescentie die door ieder chromosoom wordt uitgestraald is evenredig met de
chromosomale afmeting. Daardoor zullen spermatozoa die een X-chromosoom bevatten een groter
signaal geven dan deze met een Y-chromosoom.
Toepassing van deze techniek bij het bevruchten van konijnen leverde een vrouwelijk nageslacht
in 94% van de gevallen en een mannelijk in 81% van de gevallen. Toch zijn er een aantal
beperkingen : het kleine aantal spermatozoa dat door flow cytometrie geselecteerd kan worden
(3,5 x 105 spermatozoa per uur), de geringe overlevingskansen van de nakomelingen (28% in
plaats van 80%) en de geringe nestgrootte (3,9 in plaats van 6 tot 8 jongen per nest).
° “sexing” van de embryo’s : de verschillende methodes die hiervoor gebruikt worden moeten
aan een aantal criteria voldoen : zo weinig mogelijk schade berokkenen aan het embryo,
compatiebel zijn met dat specifieke ontwikkelingsstadium gedurende hetwelk de embryo’s bij
voorkeur ingevroren en getransplanteerd worden, volledig betrouwbaar en reproduceerbaar zijn, en
eenvoudig, snel en efficiënt uit te voeren zijn op een groot aantal embryo’s. De weinige technieken
die aan al deze criteria voldoen zijn in tabel 8.4 samengevat.
-
cytogenetische analyse : aan de basis van geslachtsbepaling door karyotypering ligt het
bestaan van een dimorfisme tussen de geslachtschromosomen. Deze methode wordt het meest
toegepast, aangezien de resultaten 100% betrouwbaar zijn.
7
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
H-Yantigen detectie : bij deze methode wordt getracht antilichamen te produceren tegen het
H-Y antigen (door vrouwelijke individuen te immunizeren met mannelijke cellen afkomstig uit
verschillende weefsels).
-
in situ hybridisatie : hierbij worden gelabelde probes rechtstreeks op gefixeerde cellen
gehybridiseerd. De aanwezigheid van de probe wordt aangetoond door een immunocytochemische
reactie (en signaalvisualistaie onder lichtmicroscoop).
-
polymerase chain reaction (PCR) : hierbij wordt een specifieke DNA-sequentie (afkomstig
van één enkele cel) met gebruik van een DNA-polymerase exponentieel vermenigvuldigd. Deze
methode wordt momenteel op commerciële schaal gebruikt voor het sexen van runderembryo’s.
-
enzymdosering : sommige enzymen (glucose-6-fosfaat-dehydrogenase, galactosidase,…)
worden gecodeerd door genen die zich op het X-chromosoom bevinden. Tijdens de ontwikkeling
van het embryo zal de expressiegraad van deze enzymen dan ook dubbel zo groot zijn bij het
vrouwelijk (XX) individu dan bij het mannelijk (XY) dier. Door bepaling van de enzymactiviteit
kan het geslacht van het embryo bepaald worden.
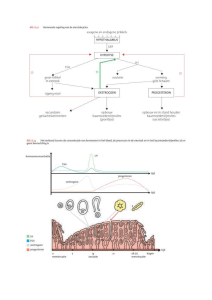
8.1.3. Geslachtsdifferentiatie. (Fig.8.118.19 en 8.69 ; Tab.8.5)
8.1.3.1. Indifferente stadia.
° mesonefros en kanaal van Wolff : de mesonefros (of : oernier, lichaam van Wolff) is bij
sommige species (mens, rund) goed ontwikkeld, bij andere (rat, muis) blijven de nefronen
rudimentair en zonder duidelijke glomeruli. De nefronen monden uit in het mesonefrische
(urinaire) kanaal (of : kanaal van Wolff) : dit verloopt in craniocaudale richting onder de
toekomstige blaas door tot in de urogenitale sinus.
° ongedifferentieerde gonaden : deze omvatten vnl. twee types cellen : somatische cellen van de
mesonefros en kiemcellen (afkomstig van het caudale deel van de darm en migrerend via het
dorsale mesenterium naar de gonade). De ongedifferentieerde gonade bestaat uit een oppervlakteepitheel en een onderliggend blasteem dat uit bovenvernoemde cellen is opgebouwd. Ook
bloedcapillairen zijn aanwezig.
° kanaal van Müller : bij de aanvang van de sexuele differentiatie ontwikkelt zich een tweede
kanaal, het kanaal van Müller, langsheen het kanaal van Wolff. Het verschijnt aanvankelijk als een
blind eindigende trechter in het coeloomepitheel ter hoogte van de mesonefros. Het uiteinde van de
trechter begint te prolifereren en vormt geleidelijk aan een streng van cellen langsheen de
8
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
mesonefros. Tenslotte bereikt het kanaal van Müller de urogenitale sinus (behalve bij sommige
species).
° urogenitale sinus en genitale tuberkel : de urogenitale sinus is de gemeenschappelijke
uitmonding voor de voortplantingskanalen en urinaire afvoerwegen. Deze sinus strekt zich uit
vanaf de blaas tot aan het perineum, onder de genitale tuberkel. De verdere ontwikkeling van deze
sinus is erg complex en differentieert tot prostaat en mannelijke urethra/vagina en vrouwelijke
urethra. De ongedifferentieerde genitale tuberkel is identiek bij beide geslachten en verschijnt als
een verdikking ter hoogte van het perineum. Het oppervlak vertoont een urethrale groeve, die bij
het vrouwelijk individu open blijft en de vulva gaat vormen, bij het mannelijk dier sluit en het
penisdeel van de urethra wordt.
8.1.3.2. Differentiatie van de genitale tractus.
(1) differentiatie tot mannelijk individu :
-
eerste stap hierbij is de differentiatie van de gonaden tot testes. Dit vangt aan met de vorming
van zgn. “seminifere celstrengen” als voorlopers van de latere tubuli seminiferi (lett. :
zaaddragende buisjes d.w.z. waar de spermatozoïden gevormd worden). Ze bestaan uit
groepjes somatische cellen (primordiale Sertolicellen) die de kiemcellen omsluiten. Cellen
aan de oppervlakte van de gonade krijgen een mesenchymaal uitzicht : ze zullen de latere
tunica albuginea (testiskapsel) vormen.
-
tweede stap is de differentiatie van de interstitiële cellen of Leydigcellen. Deze ontwikkelen
zich uit de mesenchymale cellen die aanwezig zijn tussen de seminifere celstrengen. De
differentiatie gebeurt niet onder invloed van hypofysaire hormonen, kort daarop echter zal de
activiteit van de Leydigcellen wel afhankelijk worden van een gonadotrope stimulatie.
-
na het differentiatiestadium zullen bij de meeste zoogdieren de testes verplaatst worden van
de buikholte naar het scrotum via een afdaling doorheen het inguinaalkanaal. Deze afdaling is
het gevolg van een tractie, uitgeoefend door het gubernaculum testis (fibreuze band die
bilateraal opgespannen is tussen testis en onderste buikwand) op de testis. Het precieze
mechanisme van deze migratie is nog niet volledig opgehelderd : vermoedelijk spelen
androgenen een rol bij de transinguinale (maar niet bij de transabdominale) migratiefase.
-
masculinisatie van de afvoerwegen. Deze fase omvat opnieuw twee stappen : (1) regressie
van de kanalen van Müller : verdwijning van dit kanaal is vermoedelijk het gevolg van een
dedifferentiatie van de epitheliale cellen die het kanaal vormden tot mesenchymale cellen (die
zich dan gaan voegen bij de mesenchymcellen rond het kanaal van Wolff), en niet door
9
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
celdood ; (2) de mesonefros en het proximale deel van het kanaal van Wolff vormen de
epididymis, het rete testis, de ductuli efferentes en de ductus epididymidis, het distale deel
van het kanaal van Wolff vormt de ductus deferens en de zaadblaasjes.
-
de urogenitale sinus vormt de urethra en een aantal accessoire klieren zoals de prostaat.
Tijdens de masculinisatie van de uitwendige geslachtsdelen zal de urethra pars prostata
verlengd worden met het deel van de urethra dat in de penis loopt (urethra pars penis). Dit
laatste deel wordt gevormd door het sluiten van de urethrale groeve (zie hoger : 8.1.3.1.).
(2) differentiatie tot vrouwelijk individu :
-
eerste stap is de differentiatie van de gonaden tot ovaria. Bij sommige zoogdieren(schaap, rat,
cavia,…) vertonen de nog indifferente ovaria-in-wording een voorbijgaande endocriene
activiteit en produceren ze oestradiol (vermoedelijk van invloed op de ontwikkeling van de
kanalen
van
Müller).
Een
eerstvolgende
belangrijke
stap
is
de
uitgesproken
vermenigvuldiging van de vrouwelijke kiemcellen of oögoniën : in tegenstelling tot de
mannelijke kiemcellen (die geïmmobiliseerd waren binnenin de seminifere strengen) kunnen
deze vrouwelijke kiemcellen zich vrij bewegen tussen de omringende somatische cellen. Op
een bepaald ogenblik treden de cellen (al of niet gelijktijdig) in het profase-stadium van de
meiosedeling. Ze bereiken het pachyteen of diploteen stadium en blijven hierin geblokkeerd.
Op dit ogenblik neemt het aantal oöcyten niet meer toe, maar gaan integendeel de meeste
onder hen degenereren en verdwijnen. De resterende oöcyten zijn deze die omgeven zijn door
folliculaire cellen (homologen van de Sertolicellen bij het mannelijk dier) ter vorming van de
primordiale follikels. Pas bij het volwassen dier, op het ogenblik van de ovulatie, zal de
meiose afgewerkt worden. Het vroegtijdig aanvangen van de meiose bij de vrouwelijke
kiemcellen is waarschijnlijk karakteristiek voor het ovarium m.a.w. de mannelijke kiemcellen
worden door de testes verhinderd in meiose te gaan. Kiemcellen die verkeerdelijk
extragonadaal terechtkomen (bvb. in de bijnieren) zullen, ongeacht het geslacht, de meiose
aanvangen en het vrouwelijk ontwikkelingspatroon volgen.
-
feminisatie van de geslachtskanalen : de kanalen van Müller differentiëren tot oviduct en
uterushoorns (opm : bij sommige zoogdieren zoals de primaten kunnen beide hoorns
versmelten tot één uterus simplex). Mesonefros en kanalen van Wolff verdwijnen
grotendeels, op enkele restanten na zoals het rete ovarii ter hoogte van de hilus van het
ovarium.
-
urogenitale sinus en uitwendige geslachtsorganen : op de plaats waar de kanalen van Müller
de urogenitale sinus bereiken wordt de vagina gevormd. Hierbij zijn er grote
10
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
speciesverschillen : (vb.1) bij het konijn wordt de vagina gevormd door de fusie van de
distale delen van beide kanalen van Müller – deze “Müllerse vagina” mondt uit in het craniale
deel van de urogenitale sinus – dit laatste zal differentiëren tot de (lange) urethra ; (vb.2) bij
de muis gaat de vagina zich geleidelijk afsplitsen van de rest van de urogenitale sinus en met
een afzonderlijke opening uitmonden aan het lichaamsoppervlak. De genitale tuberkel en de
urethrale groeve zullen bij de meeste species slechts weinig veranderingen ondergaan.
8.1.3.3. Rol van de testes bij de sexuele differentiatie.
Onderzoek toonde aan dat de rol van de foetale testes bij de differentiatie van de geslachtstractus
tweëerlei is :
-
regressie van de kanalen van Müller
-
ontwikkeling van de mannelijke geslachtstractus en masculinisatie van de urogenitale sinus
en genitale tuberkel
Wanneer testosteron (of andere androgenen) wordt toegediend aan gecastreerde mannelijke of aan
vrouwelijke foetussen, zullen alle mannelijke delen zich ontwikkelen maar zullen de kanalen van
Müller niet in regressie gaan. Worden daarentegen foetale testes getransplanteerd bij deze dieren,
dan zullen beide effecten zich voordoen. Dit bewijst dat er in de testes een bijkomende factor
(verschillend van de androgenen) aanwezig moet zijn die specifiek de regressie van de Müllerse
kanalen induceert.
° androgenen : testosteron en androsteendion worden geproduceerd in foetale testes vnl. vanuit
pregnenolon. Bij deze synthese zijn vijf enzymen/enzymcomplexen betrokken : is één ervan
afwezig of deficiënt, dan zal geen normale masculinisatie plaatsvinden. Opm : onder normale
omstandigheden zijn de maternale androgenen die de foetus bereiken ontoereikend om
masculinisatie te veroorzaken – in geval van een masculiniserende tumor bij het moederdier of bij
het toedienen van androgenen tijdens de dracht kan toch een virilisatie van (genetisch) vrouwelijke
foeti optreden (ook wanneer de foetus zelf abnormaal hoge hoeveelheden androgenen produceert
bvb. door een enzymdeficiëntie ter hoogte van de bijnier)
° effect van androgenen op de doelorganen : dit gebeurt op het niveau van de gentranscriptie. Op
sommige organen werkt testosteron in als hormoon, op andere als prohormoon en moet het ter
hoogte van de targetcellen eerst omgezet worden tot dihydrotestosteron (DHT), een reactie die
gekatalyseerd wordt door het 5(-reductasecomplex. Nochthans zou de receptor die de hormonale
boodschap op DNA-niveau vertaalt, dezelfde zijn voor zowel testosteron als DHT.
11
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Afwezigheid van androgeenreceptoren verhindert de masculinisatie van genetisch mannelijke
individuen, ondanks de aanwezigheid van normale testes (bvb. “testicular feminisation”syndroom :
individuen met vrouwelijk uiterlijk, aanwezigheid van testes en afwezigheid van Müllerse kanalen,
aangezien deze in de embryonale periode gaan regresseren o.i.v. factoren uit de testes).
Deficiëntie van het 5(-reductase veroorzaakt onvolledige masculinisatie van de uitwendige
geslachtsdelen : enkel de effecten waarvoor DHT verantwoordelijk is, blijven uit (“pseudovaginale
perinoscrotale hypospadie”).
Welke precies de targetcellen zijn van testosteron en DHT is nog niet helemaal geweten :
vermoedelijk gaat het hoofdzakelijk om mesenchymale cellen.
° Müllerse inhibitor (of ook : “hormone inhibitrice des canaux de Müller”, “Müllerian inhibitor”,
“anti-Müllerian hormone, AMH”, “Müllerian inhibiting substance, MIS”) : factor gesecreteerd
door de Sertolicellen. Het gaat om een dimeer glycoproteïne (140 kD), opgebouwd uit zo’n 575
(bo) tot 560 (humaan) AZ. Bij de mens bestaat een vorm van pseudohermafrodie waarbij mannen
met normale uitwendige geslachtsorganen eveneens een baarmoeder en eileiders bezitten. Oorzaak
is een afwezigheid van MIS of een defect van de receptoren voor deze factor.
° de ovaria zijn niet essentieel voor de somatische feminisatie. Bij mannelijke individuen met een
gonadale agenese, een afwezigheid van testosteron of een ongevoeligheid voor de werking van
androgenen, verdwijnen de kanalen van Wolff, ontwikkelen de kanalen van Müller zich en zullen
de urogenitale sinus en de uitwendige geslachtsdelen feminisatie ondergaan. Feminisatie is dus
niet afhankelijk van de aanwezigheid van oestrogenen, noch van foetale, noch van maternale
oorsprong.
° eerder werd reeds vermeld dat het (de) gen(en) op het Y-chromosoom dat noodzakelijk is (zijn)
voor de geslachtsdeterminatie, ook TDF (humaan) of TDy (muis) genoemd, waarschijnlijk de
DNA-sequentie SRY is. Door het op gang brengen van testiculaire differentiatie drukt TDF een
mannelijke stempel op het ganse lichaam. In afwezigheid ervan ontwikkelen gonadale primordia
en somatische geslachtskenmerken zich in vrouwelijke richting.
Men vermoedt dat TDF ondermeer tot expressie komt als het AMH (anti-Müllerse hormoon) : dit
wordt immers zeer vroeg in de loop van de testiculaire differentiatie geproduceerd en speelt een
sleutelrol in het masculinisatieproces. In de toekomst zullen nog andere moleculen, die een rol
spelen in de cascade van differentiatiestadia die zich voordoen in de loop van de testiculaire
organogenese, geïdentificeerd moeten worden.
Opm : “freemartinisme” bij de vrouwelijke helft van een kalvertweeling : via anastomosen tussen
de chorionbloedvaten van de vrouwelijke en de mannelijke vrucht komt een bepaalde factor,
vermoedelijk AMH, terecht bij het genetisch vrouwelijk kalf. Op het ogenblik dat de kanalen van
12
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Müller bij het mannelijk kalf in regressie gaan, merkt men ook ovariële atrofie en inhibitie van de
ontwikkeling van de Müllerse kanalen bij het vrouwelijk dier. Ongeveer twee maanden later
verschijnen structuren gelijkend op seminifere celstrengen in de onderontwikkelde ovaria, met
mogelijk zelfs differentiatie van Leydigcellen.
13
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.2. Mannelijke reproductiefysiologie.
8.2.1. Anatomie en histologie van het mannelijk voortplantingsstelsel. (Fig.8.208.25 en 8.51
- 8.80)
8.2.1.1. De testes.
° kapsel : dik fibreus bindweefselkapsel rond het testisweefsel, ook tunica albuginea genoemd.
Aan de buitenzijde ligt hier een uitstulping van het buikvlies, de tunica vaginalis, tegenaan, aan de
binnenzijde een bloedvatrijke tunica vasculosa. De tunica albuginea bevat collageenvezels en
fibroblasten en bij sommige species (eq, ca, fe, su, konijn en mens) ook gladde spiercellen. Het
kapsel is in staat tot spontane ritmische contracties die waarschijnlijk een belangrijke rol spelen bij
het transporteren van de spermatozoïden naar de bijbal of epididymis. Behalve bij de rodentia is
het testisweefsel verdeeld in lobuli door bindweefselsepta. Ter hoogte van het caudale uiteinde van
elke testis bevindt zich een verdikking in de tunica albuginea, het mediastinum testis, dat
doorboord wordt door de talrijke kanaaltjes van het rete testis en door bloedvaatjes.
° tubuli seminiferi : lange, sterk gekronkelde, cylindervormige buisjes die beiderzijds uitmonden
in de tubuli recti. Het epitheel bestaat uit spermatogene cellen (spermatogonie, spermatocyt,
spermatide) en ertussenin gelegen Sertolicellen. Het epitheel rust op een lamina basalis
(opgebouwd uit laminine, collageen type IV, heparaan-sulfaat en entactine), omgeven door een
laagje myoïede cellen. Deze laatste contraheren ritmisch, waardoor de geproduceerde
spermatozoïden uit het lumen van de zaadbuisjes gestuwd wordt. In het epitheel zijn de kiemcellen
geordend in groepjes waarbinnen de verschillende cellen in nauw verband met elkaar staan.
Binnen elk groepje merkt men een voortdurende chronologische evolutie van de cellen =
seminifere epitheel-cyclus. Bij de meeste zoogdieren vindt men tevens een stricte ordening van de
verschillende celgroepjes over de ganse lengte van de zaadbuisjes = seminifere golf (Eng. :
seminiferous wave).
° interstitiële ruimtes : bevat los collageen bindweefsel met talrijke bloed- en lymfevaten,
zenuwen, groepjes Leydigcellen en losse cellen (fibroblasten, macrofagen, lymfocyten en
mastcellen). De groepjes Leydigcellen liggen verspreid in het interstitieel bindweefsel, omring
door de interstitiële vloeistof.
° tubuli recti : verzamelen de verschillende tubuli seminiferi en vertakken zelf in een netwerk van
anastomoserende kanaaltjes, het rete testis. De buisjes van het rete testis zijn afgelijnd door een
14
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
afgeplat tot kubisch epitheel waarvan de meeste cellen één enkel cilium dragen (voortbeweging
van de nog immobiele spermatozoa).
° bloedvatencomplex : de testes zijn opgehangen in het scrotum door middel van een zaadstreng.
Deze bestaat uit een testiculaire arterie en testiculaire en epididymale venen en lymfevaten. Het
geheel is omgeven door een bindweefselschede waartegen aan één zijde de m.cremaster
(cremasterspier : temperatuurgevoelig !) gelegen is. De arterie splitst zich ter hoogte van de
caudale pool van de testis en verloopt een tijdje net onder het kapsel vooraleer ze de interlobulaire
septa binnendringt. Ter hoogte van de dorsale pool van de testis vertakken de venen zich en
vormen de plexus pampiniformis (lett. : zoals een wijnrank (die zich kronkelt omheen een stok))
rondom de arterie. Langsheen de testiculaire bloed- en lymfevaten, in een aparte plooi van het
peritoneum, zijn de ductus deferens en geassocieerde bloedvaten gelegen.
Het testiculaire veneuze bloed is relatief zuurstofarm (slechts de helft van het arteriële
zuurstofgehalte) en bevat veel testosteron en gesulfateerde steroïden. Ook de lymfevaten zijn een
belangrijke transportweg voor steroïden.
° bezenuwing : zenuwvezels lopen langsheen de arteria testicularis naar de testes. In het
interstitium vindt men adrenerge vezels in associatie met bloedvaatjes waarvan ze de tonus
controleren. Ze bezenuwen eveneens de peritubulaire gladde spiercellen en bij sommige
diersoorten ook de Leydigcellen. Cholinerge vezels zijn aanwezig in het kapsel bij verschillende
species. Efferente motorische en afferente sensorische vezels zijn eveneens aanwezig en zijn
vermoedelijk verantwoordelijk voor de gewaarwording van pijn bij testiculair trauma.
° vloeistoffen in de verschillende compartimenten van de testes : tubuli seminiferi en interstitiële
cellen zijn omringd door een interstitiële vloeistof die een belangrijke rol speelt in de modulatie
van de endo- en paracriene activiteit van de testes.
In het lumen van de tubuli seminiferi bevindt zich een vloeistof die de spermatozoa vervoert. Deze
vloeistof bevat ongeveer tien maal méér kalium dan het bloedplasma. Ook magnesium- en totaal
fosforgehalte zijn hoger, terwijl de concentraties aan calciumchloride en sulfaat ongeveer gelijk
zijn aan deze van het bloedplasma. De concentratie aan proteïnen is lager dan in bloedplasma en
interstitiële vloeistof, maar er zijn een aantal specifieke proteïnen aanwezig en de concentratie aan
androgeenbindend-proteïne (ABP) is hoog.
In het rete testis bevindt zich een verdunde suspensie van onbeweeglijke spermatozoïden
(concentratie gaande van 30 miljoen/ml (rat, konijn) tot 300 miljoen/ml (ov, su, aap)). Het bevat
weinige proteïnen (waaronder relatief veel 2-macroglobuline) en peptiden zoals ABP, inhibine en
anti-Müllerse hormoon.
15
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° ligging van de testes bij de verschillende (landbouw)huisdieren : hoog tussen de achterbenen
(lengte-as van testes horizontaal) bij de hengst, laag tussen de achterpoten (lengte-as van testes
verticaal) bij stier en ram, in de perineumstreek (onder de staart) bij de beer (zie figuur ?).
8.2.1.2. Accessoire geslachtsorganen. (Fig.8.20-8.21-8.23)
A.
Epididymis.
° oorsprong : de excretorische kanaaltjes van de mesonefros, die uitmonden in het kanaal van
Wolff, worden de ductuli efferentes van de foetale testis. Het meest craniale deel van het kanaal
van Wolff verdwijnt, het middendeel neemt in lengte toe en verloopt sterk gekronkeld =
epididymis. Het caudale deel vormt de ductus deferens. Hieruit differentiëren zich de accessoire
klieren.
° morfologie : de epididymis of bijbal bestaat uit de sterk gekronkelde ductus epididymidis en
omvat drie delen : de kop (caput), het lichaam (corpus) en de staart (cauda : hier worden de
spermatozoa opgeslagen). Het geheel is ingedeeld in lobuli door middel van bindweefselsepta. De
bijbal is met bindweefsel op de testis vastgehecht. Ductuli efferentes en epididymiskanaal zijn
omgeven door een circulaire laag glad spierweefsel die naar caudaal toe steeds dikker wordt en
zich verderzet ter hoogte van het vas deferens (waar er een longitudinale laag glad spierweefsel
aan toegevoegd wordt). Om de 6 tot 20 seconden doet zich een peristaltische contractie voor die de
spermatozoa in de richting van het vas deferens voortstuwt. Innervatie : noradrenerge zenuwvezels
(-receptor) zijn afkomstig van ganglia die afferente vezels van n.hypogastricus en nn.pelvici
ontvangen ; ook cholinerge en peptiderge innervatie is aanwezig (zie tabel). Vooral het distale deel
van het epididymiskanaal is sterk geïnnerveerd door sympathische zenuwvezels (vrijstelling
oxytocine en vasopressine): tijdens de ejaculatie worden hierdoor sterke contracties van de caudale
epididymis opgewekt.
° histologie : pseudotweelagig cylindrisch epitheel met hoofd- en basale cellen ; de hoofdcellen
dragen stereociliën (microvilli met actinefilamenten) en staan in voor resorptie en secretie.
° de epididymis is androgeen-afhankelijk : na castratie volgt involutie van de epididymis.
Testiculaire androgenen bereiken de bijbal via drie wegen : rete testis vloeistof, bloed en lymfe.
Ter hoogte van de bijbal wordt testosteron door een 5-reductase omgezet in DHT, dat daarna op
kernreceptoren gaat binden.
° functie : hoofdzakelijk opslag, maturatie en transport van spermatozoa (zie verder : 8.2.2.5.)
16
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Tijdens de ejaculatie wordt het sperma uit het vas deferens verdund door toevoeging van secreties
uit accessoire geslachtsklieren (ongeveer 2/3e van het zaadplasma is afkomstig van deze klieren).
Groei en secretorische activiteit van deze klieren staat onder invloed van testosteron, dat lokaal
wordt omgezet in het actieve (5-)DHT. Mogelijk nemen ook andere hormonen (onrechtstreeks)
deel aan de regulatie van de kliersecretie bvb. prolactine heeft positief effect op
testosteronstimulatie van prostaat en zaadblaasjes.
Op zich schijnen de secreties uit de accessoire geslachtsklieren van weinig of geen invloed op het
bevruchtingsvermogen van het sperma : voor fertilisatie in vitro is het zelfs noodzakelijk de
kliersecretie-fractie te verwijderen. Ook in vivo gaat het grootste deel van deze fractie verloren ter
hoogte van cervix en uterus. Vermoedelijk dienen de kliersecreties bij natuurlijke paring ter
bescherming van de spermatozoa tegen het vijandig milieu (vagina, uterus) waarin ze gedeponeerd
worden.
Innervatie van de accessoire geslachtsklieren is afkomstig van ganglia gelegen in (de buurt van) de
effectoren (zie tabel).
De verschillende accessoire geslachtsklieren worden hieronder opgesomd :
B.
Zaadblaasjes.
° twee kliertjes bestaande uit talrijke lobuli – monden uit in het bekkendeel van de urethra of in het
terminale deel van het vas deferens (mens) – belangrijkste component van de vloeistof hier is de
energiebron fructose, een voorkeursubstraat voor de spermatozoa – bevat ook veel kalium en
produceert méér prostaglandines dan de prostaat zelf
C.
Prostaat.
° grote bilobaire (of diffuse : ov, cap) klier die het halsdeel van de urineblaas en het proximale deel
van de urethra omvat
° opgebouwd uit lobuli die het klierweefsel (acini met hun afvoerkanaaltjes) omsluiten – de grotere
afvoerwegen monden uit in de urethra
° het klierepitheel is een secretorisch cylindrisch epitheel dat voortdurend geregenereerd wordt
(overmatige celvermenigvuldiging kan leiden tot prostaathyperplasie) – de cellen van het
klierepitheel zijn androgeen-afhankelijk
° prostaatvocht bevat ondermeer een poly-amine, het spermine, fosfatasen en Zn++ionen
(bactericide en spermanucleoproteïne-stabiliserende eigenschappen)
17
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° opmerking : bij de rodentia vormen de craniale delen van de prostaat de “coagulatieklier”: deze
produceert een transglutaminase dat, na ejaculatie, coagulatie van een proteïne uit de zaadblaasjes
veroorzaakt, zodat een vaginale plug gevormd wordt die terugvloei van het sperma verhindert –
ook bij de mens treedt gelificatie op van zaadblaasjesproteïnen door stollingsenzymen uit de
prostaat
D. Cowperklieren (of bulbo-urethrale klieren).
° vnl. goed ontwikkeld bij de beer
° secreteren het sialomucine : in het ejaculaat gaat dit coaguleren tot kleine, doorschijnende,
gelatineuze bolletjes (cfr. tapioca in soep) – functie ervan is onbekend
E. Klieren van Littré (of urethrale klieren).
° kleine klieren langsheen het penisdeel van de urethra gelegen
° secreteren bij sexuele opwinding
F. Klieren van Tyson (of preputiale klieren).
° bevat bij sommige species (rat, muis, varken) feromonen, die een rol spelen bij het lokken van
een sexuele partner
(Tabel 8.6 : densiteit van aminerge en peptiderge bezenuwing van de mannelijke geslachtstractus)
8.2.2. Spermatogenese en spermiogenese. (Fig.8.268.37 ; Tab.8.78.9)
8.2.2.1. Spermatogenese.
° vangt aan bij aanvang van de puberteit
° is het proces waarbij stamcellen worden omgevormd tot spermatiden
° men onderscheidt hierbij drie stadia met hun overeenkomstig celtype :
(1) spermatogonie of kiemcel (stamcel) : terug te vinden in de basale laag van het epitheel in de
tubuli seminiferi, tussen de Sertolicellen – zijn onderling verbonden door cytoplasmatische
brugjes, zodat de verschillende cellen die tot eenzelfde generatie behoren steeds samenblijven
18
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
door
mitosedelingen
vormen
zij
ofwel
nieuwe
stamcel-spermatogoniën,
ofwel
spermatogoniën die de meiose zullen aanvatten
(2) spermatocyt : primaire spermatocyten (type I) zijn grote, ronde cellen met grote kernen met
duidelijk zichtbaar kernmateriaal (in klompen of fijne draadjes) – ze ondergaan een eerste
meiotische deling en hierbij doen zich volgende bijzonderheden voor :
-
in het pachyteen stadium worden de geslachtschromosomen ruimtelijk gescheiden van de
autosomen
-
in het diploteen stadium gebeurt uitwisseling van chromosomaal materiaal door “crossingover”
Op het einde van deze eerste deling zijn de homologe chromosomen uit elkaar geweken en
zijn kleinere secundaire spermatocyten (type II) gevormd. Deze ondergaan een snelle tweede
meiotische deling, waarbij de twee chromatiden, waaruit elk homoloog chromosoom is
opgebouwd, uit elkaar wijken. Op die manier worden de haploïde spermatiden (3) gevormd.
8.2.2.2. Spermiogenese.
° is het proces waarbij spermatiden omgevormd worden tot spermatozoa (spermatozoïden)
° omvat verschillende stappen :
-
nucleaire reorganisatie : acrosomale pool van de lateraal afgeplatte kern richt zich naar de
basaalmembraan van de tubuli seminiferi – kernmateriaal condenseert – verdere elongatie van
de kern
-
ontwikkeling van het acrosomaal complex : het Golgi-complex migreert naar de apicale pool
van de kern – samensmeltende vesikels van het Golgi-complex vormen de “proacrosomale
vesikel” die zich op de acrosomale pool van de kern vestigt als “acrosomale kopkap”
-
vorming van de staart : de beide centriolen migreren naar de anti-acrosomale pool – de
centriool die parallel aan de lengte-as van de kern gericht is, wordt langer en vormt op die
manier de microtubuli van het axonema = staartstuk (flagellum) – het cytoplasma verzamelt
zich rond het bovenste deel van de staart, zodat hier ook talrijke mitochondriën bevinden
(mitochondriënschede) – distaal wordt dit deel afgescheiden van het middendeel door een
ringvormige structuur (anulus) – het middendeel bevat het axonemaal complex, omgeven
door een fibreuze schede – het terminale deel bevat enkel nog het axonema, omgeven door de
plasmamembraan
° bouw van de spermatozoa : zie figuur. Het acrosoom bevat verscheidene hydrolyserende
enzymen zoals neuraminidase, hyaluronidase, zure fosfatase en het acrosine, dat een rol speelt bij
19
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
de bevruchting (zie verder). Het axonema is essentieel voor de motiliteit van de spermatozoa
(energiebron = ATP).
Opmerking : in sommige handboeken worden de termen spermatogenese en spermiogenese als
synoniemen gebruikt.
8.2.2.3. Genoomexpressie tijdens spermiogenese.
° bij de muis vindt gedurende haast alle stadia van de spermatogenese proteïnesynthese plaats,
met een piek in de productie tijdens het mid-pachytene stadium van de spermatocyten
° SDS-oplosbare proteïnen van plasmamembraan, acrosoom, mitochondriale matrix en cristae
worden hoofdzakelijk tijdens de meiose en vroege spermiogenese geproduceerd, terwijl SDSonoplosbare proteïnen van de kop- en staartregio voornamelijk tijdens de spermiogenese worden
gevormd
° tijdens de spermiogenese worden chromosomale proteïnen vervangen door nieuwe proteïnen,
rijk aan arginine en cysteïne (belangrijk in verband met verdere condensatie van het chromatine
door vorming van disulfidebruggen tussen cysteïneresidu’s)
° verschillende nieuwe proteïnen kunnen teruggevonden worden in het cytoplasma van de
spermatiden : sperma-specifieke antigenen in het acrosoom, isozymen van acrosomale enzymen
(hyaluronidase, N-acetyl--galactosidase,…), niet-acrosomaal isozyme van fosfoglyceraatkinase.
De activiteit van een aantal andere metabole enzymen (-glycerofosfaat dehydrogenase,
fosfatidase) neemt toe in een latere fase van de spermiogenese. Ook het aantal oppervlakteantigenen neemt sterk toe bij rijpe spermatiden.
8.2.2.4. Spermatogene cyclus en cyclusduur.
° de voortdurende productie van spermatozoa vereist tevens een continue vermenigvuldiging van
de spermatogoniën, die ofwel nieuwe stamcellen worden (“reserve-stamcellen”), ofwel nieuwe
spermatogoniën die door deling en differentiatie tenslotte tot spermatiden omgevormd worden
(“vernieuwende stamcellen”).
° spermatogene cyclus = temporele sequentie van de opeenvolgende differentiatie-stadia van één
bepaalde kiemcelgeneratie in één bepaalde regio van het zaaddragend epitheel. De duur van deze
cycli is speciesspecifiek (zie tabel). Ook elk stadium binnen deze cycli heeft een constante duur
20
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
(bvb. mens : levensduur van spermatogonie = 16 – 18 dagen, van primaire spermatocyt = 23
dagen, van secundaire spermatocyt = 1 dag en van spermatide = 22,5 – 23 dagen).
° cyclus van het zaaddragend epitheel : uitgaande van de spermatogoniën begint met vaste
tussenperiodes telkens een nieuwe spermatogene cyclus (bvb. om de 16 dagen bij de mens).
Telkens zijn een aantal spermatogoniën door cytoplasmabruggetjes onderling verbonden, zodat ze
een groepje cellen vormen waarvan elk lid in het zelfde cyclusstadium zit. Deze
cytoplasmabruggen blijven bestaan tot op het einde van de spermiogenese. Op die manier
doorlopen clusters van kiemcellen, “generaties” genoemd, de ganse spermatogene cyclus op
synchrone wijze.
Op histologisch niveau ziet men dat het zaaddragend epitheel opgebouwd is uit vier tot vijf
generaties (kiem)cellagen. De jongste generaties bevinden zich nog vlakbij de basaalmembraan,
terwijl de rijpere reeds dicht bij het lumen van de tubuli seminiferi liggen. Deze “stratificatie” is
het gevolg van het hoger vermelde feit dat de verschillende cyclusstadia voor alle cellen van elke
generatie een welbepaalde duur hebben en van het feit dat de spermatogoniën met vast
tijdsinterval steeds opnieuw de aanzet zijn tot de vorming van een nieuwe generatie.
De verschillende generaties kiemcellen vormen cellulaire associaties die in een vast patroon
geordend zijn. Elk van die typische associaties definieert een stadium. Het aantal stadia (tussen 6
en 14) en de relatieve duur van elk stadium is speciesspecifiek. Op een welbepaald punt in het
zaadbuisje verschijnen alle opeenvolgende stadia op vaste tijdstippen en geven zo aanleiding tot
een geordende sequentie van stadia, de zgn. “cyclus van het zaaddragend epitheel”. Ook over de
ganse lengte van de zaadbuisjes kan men deze opeenvolgende reeksen van celassociaties
terugvinden : zij vormen de zgn. “seminifere golf” (functionele betekenis echter onbekend).
De duur van elke “cyclus van het zaaddragend epitheel” is gelijk aan de duur van het (hoger
vermelde) vaste tijdsinterval waarop een spermatogonie telkens aanvat met een nieuwe generatie.
Voor elke spermatogonie worden er, in de periode dat deze cel nodig heeft om te differentiëren
tot rijpe spermtozoïde, zo’n vier tot vijf cycli aangevat.
° noch de duur van de spermatogene cyclus, noch die van de cyclus van het zaaddragend epitheel
schijnen hormonaal geregeld te worden
° dagelijkse spermaproductie : dit is het aantal spermatozoa geproduceerd per dag en per gram
testisparenchym (zie tabel). De afname in productie van fertiel sperma met toenemende leeftijd is
van vergelijkbare grootte bij mens en andere zoogdieren, maar heeft wel een veel grotere impact
op de vruchtbaarheid bij de mens als gevolg van het relatief lage spermaproductiepeil hier. Dit
laatste is vermoedelijk het gevolg van de lange duur van de spermatogene cyclus, het laaag aantal
spermatogonie-delingen en het hoog aantal degenererende kiemcellen.
21
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° van het oppervlak van het zaaddragend epitheel worden voortdurend rijpe spermatozoa
vrijgelaten : deze zijn zelf onbeweeglijk en worden door de secreties van de Sertolicellen en door
tubulaire contracties in de richting van de ductuli efferentes en het begindeel van de epididymis
gestuwd. In de ductuli efferentes worden ze vooruitgeholpen door ciliën, ter hoogte van de
epididymis is het transport hoofdzakelijk het gevolg van ritmische tubulaire contracties. De lengte
van de totale transittijd is speciesspecifiek. Het transport doorheen caput en corpus van de bijbal
is niet afhankelijk van de ejaculatie-frequentie, de duur van het verblijf ter hoogte van de cauda
daarentegen (spermareservoir !) hangt wel af van de sexuele activiteit (zie tabel).
8.2.2.5. Rol van de accessoire klieren.(Tab..8.108.14 en 8.16-8.19 ; Fig.8.388.44)
A. Epididymis.
-
ter hoogte van de cauda kan het sperma, bij uitblijven van een ejaculatie, ruim drie weken
overleven
-
epididymale vloeistof : ondergaat drie veranderingen wanneer spermatozoa in de bijbal
arriveren nl. (1) resorptie van ionen en water en daardoor concentrering van het sperma ; (2)
vorming van een medium dat sterk verschilt van bloedplasma, zodat sperma erin kan
overleven en geïmmobiliseerd blijven : osmotische druk tot 400 mOsm, pH tot 6,5,
concentraties aan Na+, Cl- en HCO3- en concentraties aan K+ en HPO4- sterk –
onbeweeglijkheid is vermoedelijk het gevolg van de lage pH, de lage temperatuur (extraabdominaal !), een verminderde aanvoer van zuurstof en eventueel (rat, hamster) de
aanwezigheid van een visceus proteïne immobiline ; (3) synthese van bijbal-specifieke
proteïnen door de hoofdcellen en o.i.v. testosteron – deze proteïnen binden op specifieke
delen van kop- en staartregio van de spermatozoa
-
spermadifferentiatie : (1) ter hoogte van de epididymis ondergaat het chromatine uit de kern
van de spermatozoa een condensatiereactie (toename van het aantal disulfidebindingen van
cysteïne), vermoedelijk ter bescherming van de zaadcelkern en , door verhoging van de
rigiditeit van de zaadcelkop, om het penetreren van de zona pellucida rond de oöcyt te
vergemakkelijken ; (2) de plasmamembraan ondergaat een moleculaire herstructurering (en
dit wat betreft alle componenten nl. lipiden, proteïnen en glycosideresiduen op deze beide
componenten) waardoor ze andere antigene eigenschappen verwerft.
22
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Al
deze
veranderingen
zijn
noodzakelijk voor
het
verkrijgen
van
een
potentieel
bevruchtingsvermogen en voor het resistentievermogen tegen moeilijke transport- en
opslagomstandigheden.
De
functionele
veranderingen
die
het
sperma
ondergaat
om
een
potentieel
bevruchtingsvermogen te verwerven zijn :
(1) Progressieve (voorwaardse) motiliteit :
Ter hoogte van het caput van de bijbal zijn de spermatozoïden nog onbeweeglijk (enkel vibraties
van staart), eens in het corpus aangekomen zijn ze reeds in staat tot lineaire bewegingen. In het
caput worden bepaalde proteïnen, de “forward motility” proteïnen (FMP), gesecreteerd die
noodzakelijk blijken te zijn om deze beweeglijkheid te verkrijgen. Toch blijven de
spermatozoïden ter hoogte van het cauda van de bijbal, hoewel potentieel beweeglijk, nog steeds
onbeweeglijk en dit ten gevolge van de eigenschappen van de bijbalsecreties (zie hoger).
(2) Zona pellucida-bindingsvermogen :
Bepaalde intrinsieke componenten (glycoproteïnen) van de sperma-plasmamembraan mediëren
de species-specifieke binding tussen spermakop en zona pellucida van de eicel. Het sperma
verwerft deze eigenschap pas als het het caput en het begindeel van het corpus gepasseerd is,
omdat hier specifieke secretieproducten aanwezig zijn die een rol spelen bij het verwerven van dit
bindingsvermogen. De plasmamembraancomponenten zijn dus membraanproteïnen van
testiculaire oorsprong die eerst als proreceptoren op de membraan verschijnen en die functioneel
worden ter hoogte van de bijbal door het afzetten van androgeenafhankelijke proteïnen op de
spermamembraan. De manier waarop deze receptoren nadien differentiëren en hun
speciesspecificiteit verwerven is nog onbekend.
Opmerking : na castratie verliezen de spermatozoïden geleidelijk aan hun bindingsvermogen en
dit ten gevolge van het dalend testosterongehalte in het bloed.
Wanneer de receptoren op de spermatozoa functioneel worden, worden ze terzelfdertijd ook
“beschermd” (bvb. de spermareceptor galactosyltransferase bij de muis wordt geïnhibeerd door
een lactoglycaan en het -lactalbumine).
Voortbewegings- en bindingsvermogen van het sperma zijn onafhankelijk van elkaar, aangezien
ook onbeweeglijk sperma aan de zona pellucida kan binden.
(3) Bevruchtingsvermogen en overleving van het embryo :
23
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Ter hoogte van de bijbal verwerft het sperma twee potentiële eigenschappen nl. de mogelijkheid
tot bevruchting en de mogelijkheid tot het opstarten van de embryonale ontwikkeling. Enkel het
sperma dat reeds de cauda van de bijbal bereikt heeft bezit beide eigenschappen en deze werden
progressief en onafhankelijk van elkaar verworven in de loop van de passage door het
bijbalkanaal. Zo zal schapensperma uit het middendeel van het corpus van de bijbal wel
gedeeltelijk fertiel zijn, doch na bevruchting van de eicel zullen verdere delingen slechts met
vertraging plaatsvinden en zal uiteindelijk geen embryo tot ontwikkeling komen. Alleen bij de
mens en het zijde-aapje heeft ook sperma uit het caput van de epididymis bevruchtingsvermogen.
(Tabel 8.16 : bevruchtingsvermogen van sperma, gepreleveerd op verschillende plaatsen van de
epididymis bij de mens)
B. Overige geslachtsklieren.
De secreties van deze klieren op zich lijken niet noodzakelijk voor het bevruchtingsvermogen van
het sperma, aangezien de bevruchtingspercentages in vitro nagenoeg gelijk zijn voor spermatozoa
uit de cauda epididymis en voor geëjaculeerd sperma. Ook in vivo zal het grootste deel van het
seminaal plasma verloren gaan ter hoogte van cervix en uterus, en zal het sperma ter hoogte van
de eileiders opnieuw in suspensie gebracht worden (secreties van oviductcellen). Vermoedelijk
dienen de secreties van deze geslachtsklieren ter bescherming van het sperma tegen het vijandig
milieu waarin de spermatozoïden gedeponeerd worden.
8.2.2.6. Capacitatie. (Fig.8.458.49 ; Tab.8.15)
° Sperma uit de cauda van de epididymis en geëjaculeerd sperma is potentieel fertiel, maar toch is
een verblijf van enkele uren in de vrouwelijke geslachtstractus noodzakelijk om effectief
bevruchtingsvermogen te verwerven. De veranderingen die gedurende deze periode plaatsvinden
werden samengevat onder de term “capacitatie”:
-
capacitatie gebeurt enkel in de vrouwelijke geslachtstractus, maar is niet species-specifiek
t.t.z. sperma van bvb. een stier kan ook in de tractus van een ooi of een zeug capacitatie
ondergaan. Niet enkel het sperma dat reeds de ampulla van de eileider (waar de bevruchting
plaatsvindt) heeft bereikt is gecapaciteerd, ook sperma gepreleveerd van op andere plaatsen
van de vrouwelijke geslachtstractus (zelfs de vagina) heeft reeds capacitatie ondergaan. In
vivo is de tijd nodig voor capacitatie afhankelijk van de oestradiol/progesteron-ratio :
24
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
capacitatie gaat het snelst op het einde van het ovulatieproces. In de uterus vindt geen
capacitatie plaats tijdens de luteale fase.
-
vermoedelijk
is
capacitatie
van
het
sperma
een
onmisbare
vereiste
om
ook
bevruchtingsvermogen te verwerven. Dat neemt niet weg dat de tijd nodig voor capacitatie
zeer kort kan zijn.
(Tabel 8.15 : in vivo en in vitro capacitatietijden voor sperma uit cauda epididymis of ejaculaat)
-
vermoedelijk is slechts een deel van de, overigens sterk heterogene, spermapopulatie
capaciteerbaar (nl. deze die in de ampulla terechtkomen en in staat zijn tot bevruchting van de
oöcyt) : waarschijnlijk gebeurt de selectie van deze spermatozoa uit de ganse populatie in de
loop van de passage doorheen de geslachtstractus
-
biologische en moleculaire veranderingen die optreden in de loop van het capacitatieproces :
(1) verwijdering van het seminaal plasma : uit onderzoek in vitro is gebleken dat dit een
conditio sine qua non is om capacitatie te kunnen ondergaan. Immers, tijdens de
ejaculatie gaan componenten uit geslachtskliersecreties binden aan de spermamembraan
en zo de expressie van de bevruchtingscapaciteit van het sperma verhinderen.
Spermatozoa uit de epididymis daarentegen (bvb. kater) kunnen onmiddellijk een oöcyt
bevruchten.
Ook andere componenten uit het seminaal plasma kunnen interfereren met het
capacitatieproces :
-
Zn++ inhibeert het fosfolipase A2
-
een bepaalde component uit de zaadblaasjes inhibeert de acrosine-activiteit (bij muis,
rammelaar, stier, beer en man)
-
een proteïne uit diezelfde zaadblaasjes reguleert de spermamotiliteit door te interfereren
met de functie van de dyneïne-armen (via een dyneïne-ATPase)
(2) veranderingen ter hoogte van de plasmamembraan tijdens het capacitatieproces :
-
proteïneveranderingen : proteïnen die op niet-covalente wijze gebonden zijn, gaan
verloren ; sommige structurele of pas later geïncorporeerde proteïnen vertonen een daling
in moleculair gewicht ; sommige proteïnen migreren, hetzij over korte afstand (bvb.
migratie van antigen van kop-apexregio naar postacrosomale regio bij humaan sperma),
hetzij binnen een kleine regio (op die manier worden in de plasmamembraan
“partikelvrije” zones gecreëerd, waar later membraanfusie zal optreden)
25
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
lipidenveranderingen : de plasmamembraan van geëjaculeerd sperma bevat een relatief
hoog aandeel cholesterol en sterolsulfaten. Tijdens het capacitatieproces gaan vrije en
geconjugeerde sterolen verloren. Dit resulteert in een toegenomen “vloeibaarheid” van de
membraan (cholesterol verhindert flexie van lipide-koolstofketens). Ook methylering van
fosfatidylethanolamine, met vorming van lysofosfatidylcholine (LPC), draagt bij tot het
destabiliseren van de plasmamembraan.
(3) veranderingen in bewegingskarakteristieken : vóór het ondergaan van capacitatie is rijp
sperma in staat tot een “voorwaartse” of “progressieve” motiliteit : in feite gaat het om
een lichtjes afbuigende progressie, en dit afwisselend naar rechts en naar links ten
gevolge van een rotatie van de spermakop over 180°. Tijdens het capacitatieproces treden
twee veranderingen op wat de beweging van de spermatozoa betreft :
-
staartslagamplitude neemt toe (“whiplash”) als gevolg van een grotere flexibiliteit van de
staart (meer bepaald van het middenstuk) : kop en staart gaan hierdoor lichtjes in
appositie tot elkaar bewegen
-
rotatie van de kop stopt, zodat voortbeweging in een kringetje gebeurt
Deze manier van bewegen wordt doorgaans als “hyperactiviteit” bestempeld, hoewel de
spermatozoa nu net minder goed vooruitkomen. De precieze mechanismen voor boven
beschreven veranderingen zijn nog niet volledig opgehelderd : het vrijstellen van
bepaalde “coating”proteïnen en van cholesterolmoleculen uit de plasmamembraan laat
toe dat calciumkanalen opengaan – tijdens het capacitatieproces is er een geleidelijke
toename in intracellulair Ca++ en in cAMP-gehalte – het verband tussen
(hyper)fosforylatie en hyperactiviteit van de spermatozoa is echter niet gekend.
(4) metabole veranderingen : intracellulaire pH stijgt (ionenuitwisseling, proton-efflux),
intracellulair K+ daalt, membraanpotentiaal stijgt
° Verband tussen bovenvermelde veranderingen en bevruchtingsvermogen van de spermatozoa :
(1) specifieke herkenning tussen sperma en zona pellucida :
-
door het verlies en/of het verplaatsen van structurele membraanproteïnen kunnen
spermareceptoren voor zona-proteïnen functioneel worden
-
toename in lipidenmotiliteit kan het contact tussen spermareceptor en zona-proteïnen
faciliteren
(2) ruptuur van het acrosoom : op bepaalde plaatsen in de plasmamembraan moeten partikelvrije
zones gecreëerd worden opdat fusie kan plaatsvinden tussen de buitenste acrosomale
26
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
membraan en de peri-acrosomale plasmamembraan. In vivo wordt deze fusie geïnduceerd
door interactie tussen zona-proteïnen en spermareceptoren.
(3) passage tussen cumuluscellen en doorheen de zona pellucida : de “hyperactiviteitsfase” die de
spermatozoa doormaken speelt geen rol bij het passeren van de cumuluscellaag rondom de
oöcyt, maar is wel nodig om door de zona pellucida te dringen : hiertoe wordt, door de
laterale bewegingen van de spermakopjes, een spleetvormige opening in de buitenste laag van
de zona gemaakt
(4) mogelijkheid om fusie aan te gaan met de plasmamembraan van de oöcyt : dit is enkel
mogelijk nadat het sperma eerst gecapaciteerd werd en tevens een acrosoom-reactie (zie
verder : 8.4.) heeft ondergaan
° Passage van sperma doorheen vrouwelijke geslachtstractus :
De capacitatietijd is maximaal 6 – 8 uren, terwijl sperma verschillende dagen (teef, vrouw,…) tot
zelfs weken (haas, spitsmuis) ter hoogte van de uterotubaire junctie of de isthmus kan overleven
(evt. in gespecialiseerde structuren). Uterus en isthmus vervullen dus een tweevoudige functie nl.
capacitatie en bevorderen van het overleven van sperma :
-
capacitatie : rond het ovulatietijdstip is het uterien milieu bij uitstek geschikt om capacitatie
te induceren : lage pH (6,0), lage proteïneconcentratie, proteolytische en glycosidaseactiviteit, aanwezigheid van cholesterolacceptoren zoals albumine en lipoproteïnen.
-
overleving van het sperma : hierbij is het sperma geïmmobiliseerd in een geschikt milieu
d.w.z. met een hoge kaliumconcentratie, een hoge glycineconcentratie (AZ dat celademhaling
in stand houdt), de aanwezigheid van specifieke, door endometrium en oviductmucosa
gesecreteerde, proteïnen (zetten zich af op de spermamembraan ter bescherming ervan) en
met de mogelijkheid tot uitwisseling met epitheelcellen in de oviduct
8.2.3. Sertoli- en Leydigcellen.
8.2.3.1. Sertolicellen : structuur en functie. (Fig.8.50 en 8.528.56 en 8.60)
° grote pyramidale cel die zich uitstrekt vanop de basaalmembraan tot aan de vrije luminale zijde
van het seminifere epitheel – hierbij vult ze alle smalle open ruimten die tussen de cellen van de
spermatogene cyclus in gelegen zijn – de aflijning van het cytoplasma van de Sertolicel is dus
zeer onregelmatig en verandert voortdurend om toe te laten dat de zich ontwikkelende cellen van
de spermatogene cyclus zich naar het lumen toe kunnen bewegen
27
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° basaal ligt de ovale kern – daarnaast bevat het cytoplasma een beperkt aantal mitochondriën en
ook het Golgi-apparaat en het ruw endoplasmatisch reticulum zijn slechts zwak uitgebouwd – het
glad endoplasmatisch reticulum daarentegen is sterk ontwikkeld : het bestaat uit een aantal
concentrische lagen van sacculae die in de nabijheid van de spermatidenkoppen liggen – het
cytoplasma bevat ook de talrijke lipideninclusies, die bij sommige species, zoals de herkauwers,
omgeven zijn door een aantal concentrische lagen glad endoplasmatisch reticulum
° in de basale regio van het epitheel zijn de Sertolicellen onderling verbonden door “tight
junctions”. Op die manier wordt het epitheel in twee anatomisch en functioneel verschillende
compartimenten ingedeeld :
-
een basaal compartiment (onder de tight junction), dat de spermatogoniën en de
spermatocyten (preleptoteen stadium) bevat
-
een adluminaal compartiment (boven de tight junction), dat de latere primaire, de secundaire
spermatocyten en de ronde spermatiden bevat
° ook tussen de Sertolicellen enerzijds en de kiemcellen anderzijds zijn er verschillende types van
celjuncties aanwezig : desmosoom-achtige juncties, “gap junctions” en zgn. tubulobulbaire
complexen,
waarbij
cytoplasmatische
protrusies
van
rijpe
spermatiden
instulpen
in
overeenkomstige invaginaties van het cytoplasma van de Sertolicellen
° in het cytoplasma bevindt zich het cytoskelet, opgebouwd uit microtubuli en een dens netwerk
van actine microfilamenten en intermediaire filamenten : het geheel zorgt voor behoud van de
celvorm en laten actieve beweging van het cytoplasma toe (nodig om ontwikkelende kiemcellen
op weg naar het lumen door te laten)
° in de basale regio van de Sertolicellen bevinden zich lysosomen, multivesiculaire lichaampjes
en heterofage vacuolen, die allen een rol spelen bij de resorptie van residuele lichaampjes
(overtollig cytoplasma, afkomstig van de spermatiden) en van degenererende kiemcellen
° Sertolicellen vervullen verscheidene functies :
-
ze spelen een rol bij de secundaire immuunreacties in aanwezigheid van kiemcellen die
bepaalde antigenen aanbieden
-
ze controleren de rijping en migratie van de kiemcellen
-
ze fagocyteren degenererende kiemcellen
-
ze zijn betrokken bij de synthese van (60-tal !) proteïnen en steroïden
-
ze spelen een rol bij de “two-way flow” van secreties tussen het interstitieel en het tubulair
compartiment (tubaire vloeistof vloeit van de top van de Sertolicellen naar het lumen toe en
vervoert aldus de spermasuspensie in de richting van het rete testis – interstitiële vloeistof
28
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
passeert door de basale regio en wordt geresorbeerd door bloed- en lymfecapillairen – ook
parahormonen (zie verder : 8.3.4.) worden op dergelijke wijze getransporteerd)
° synthese van testis-specifieke proteïnen :
-
inhibine – activine : inhibine is een glycoproteïne dat de secretie van FSH (o.i.v. GnRH)
inhibeert – het bestaat in twee biologisch actieve vormen, A en B, en is opgebouwd uit twee
subunits, en - zijn de twee -subunits gelinked, dan ontstaat het activine (ook : FSH
releasing protein, FRP), dat de secretie van FSH door de hypofyse stimuleert (echter geen
invloed op LH-secretie)
-
androgeen-bindend proteïne (ABP) : proteïne dat testosteron en dihydrotestosteron bindt,
waardoor beide moleculen hun oplosbaarheidsproduct kunnen overschrijden – ABP wordt
gesecreteerd o.i.v. FSH en testosteron – ABP stimuleert het zaaddragend epitheel en
transporteert de androgenen in de richting van de bijbal
-
GnRH-like peptide : (enkel bij de rat) vermindert het aantal LH-receptoren op de
Leydigcellen en inhibeert de steroïdogenese (ook toediening van GnRH-analogen bij deze
diersoort leidt tot rechtstreekse testiculaire inhibitie van de spermatogenese)
° synthese van niet-specifieke proteïnen :
-
plasminogeen activator (PA): secretie van dit protease wordt gestimuleerd door FSH en
geïnhibeerd door testosteron – het is een enzyme, betrokken bij de spermatocyttranslocatie
(en mogelijk bij de spermiogenese en de resorptie van residuele lichaampjes)
-
transferrine : wordt geproduceerd o.i.v. FSH, insuline en retinol – precieze functie is
onbekend (er bestaat wel een duidelijke positieve correlatie tussen het gehalte aan transferrine
in het seminaal plasma en het aantal spermatozoa in het ejaculaat)
-
insulin-like growth factor (ook : somatomedine, IGF1): gesynthetiseerd o.i.v. FSH – bindt
aan spermatocyten (pachyteen stadium) en stimuleert hun differentiatie
-
mitogene substanties (ondermeer : “seminiferous growth factor, SGF”): stimuleren deling
(mitose) van de spermatogoniën
8.2.3.2. Leydigcellen : structuur en functie. (Fig.8.748.77)
° polygonale cel met vaste afmetingen (bvb. 10 m lengte bij man, 30 m bij beer) –
belangrijkste celtype in het interstitieel bindweefsel tussen de tubuli seminiferi – ze liggen apart
of in groepjes in nauw contact met de talrijke bloed- en lymfecapillairplexussen rond de tubuli
29
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° het eosinofiele cytoplasma bevat talrijke lipidenvacuoles, weinig mitochondriën en talrijke
cisternae van het glad endoplasmatisch reticulum (bij de man vindt men in het cytoplasma ook
langwerpige kristallen (van Reinke), waarvan de functie onbekend is)
° het intracellulair microtubulair systeem speelt vermoedelijk een rol bij de steroïdogenese
° functies :
-
synthese van androgenen : deze zijn verantwoordelijk voor de differentiatie van de
mannelijke geslachtstractus, en nadien voor het verschijnen van de secundaire mannelijke
geslachtskenmerken en het mannelijk gedrag – Leydigcellen synthetiseren deze androgenen
vanuit cholesterol of zelfs vanuit acetaat - 95% van het testosteron in de bloedbaan is van
testiculaire oorsprong, het overige is afkomstig van de bijnieren en van de perifere omzetting
van androsteendion ; de andere androgenen in de bloedbaan, nl. dihydrotestosteron, dehydroepi-androsteron en androsteendion, zijn afkomstig van de testes voor resp. 20%, 30% en 50%
- LH (en hCG) (zie ook : opmerking) stimuleert testosteronproductie door binding op de
membraanreceptoren van
de
Leydigcellen : in afwezigheid van
LH stopt de
testosteronproductie – FSH doet het aantal LH-receptoren op de Leydigcellen toenemen
(waarschijnlijk via een parahormoon) en heeft zo een indirect stimulerend effect op de
testosteronproductie – prolactine stimuleert de vorming en het behoud van LH-receptoren op
de membraan – ook groeihormoon en insuline hebben een dergelijk effect ; oestrogenen en
glucocorticoïden inhiberen de testosteronsynthese via hun uitwerking op 17-hydroxylase en
17-20-desmolase – ook EGF (epidermal growth factor), AVT (arginine-vasotocine) en GnRH
(enkel bij rat) hebben een dergelijk effect
-
andere hormonen en neuromediatoren : Leydigcellen synthetiseren en secreteren IGF1 en zijn
bindend proteïne (IGF1-BP), oxytocine (Ot) en vasopressine en opioïde peptiden
(prodynorfine en pro-opio-melanocortine, POMC : deze worden in zeer geringe hoeveelheden
gesecreteerd – stimulatie van hun productie gebeurt door LH); Leydigcellen hebben
receptoren voor oxytocine, vasopressine en IGF1, maar hun autocriene functie is onbekend –
het effect van deze factoren op andere elementen van het testiculair weefsel is wel gekend :
zo veroorzaken Ot en vasopressine een contractie van myoidcellen (onder de
basaalmembraan van de tubuli seminiferi) en van de tunica albuginea
-
opmerking : in geval van het mannelijk dier vervangt men de term “luteïniserend hormoon,
LH” ook wel door “interstitiële cel stimulerend hormoon, ICSH”
8.2.3.3. Bloed-testisbarrière.
30
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° verschillende elementen maken deel uit van deze barrière :
-
tight junctions tussen aan elkaar palende Sertolicellen
-
endotheel en basaalmembraan van de bloedcapillairen
-
myoidcellen van het peritubulaire weefsel (smalle openingen tussen de myoidcellen laten
kleine moleculen door die dan in de tubuli kunnen binnendringen)
° dankzij deze barrière kunnen verschillende moleculen, zoals albumine, inositol, inuline,
creatinine en sucrose, niet doorheen het zaaddragend epitheel passeren ; het binnendringen van de
meeste ionen gebeurt traag en staat onder de controle van de Sertolicellen ; sommige stoffen,
zoals testosteron, worden door het proces van gefaciliteerde diffusie over het epitheel
getransporteerd
° rol van de bloed-testisbarrière :
-
structurele wijzigingen tijdens de meiose : bij het verplaatsen van de preleptotene en
leptotene primaire spermatocyten van het basale naar het adluminale compartiment moeten
eerst de tight junctions boven deze cellen gedissocieerd en nadien nieuwe tight junctions
onder deze cellen gevormd worden (opm. : ook de spermatocyten in het zygoteen stadium
zijn door tight junctions in een apart compartiment ondergebracht – de precieze reden
hiervoor is onbekend)
-
regulatie van het hormoontransport : het zorgt ervoor dat een hoge concentratie aan inhibine
in het tubuluslumen bestaat, terwijl de penetratie van FSH en LH tot in de tubulaire vloeistof
verhinderd wordt – inhibine wordt vermoedelijk via het basaal cytoplasma van de
Sertolicellen naar de lymfecapuillairen afgevoerd (en zo via de bloedbaan naar de hypofyse) ABP heeft geen zichtbaar effect op transport en opstapeling van androgenen in de tubuli
seminiferi, maar zorgt vermoedelijk voor een vermindering van de concentratie aan vrije
steroïden rond de kiemcellen
-
immuunprotectie : met behulp van de bloed-testisbarrière kan het immuunsysteem van het
lichaam de specifieke proteïnen die op het oppervlak van de kiemcellen verschijnen pas vanaf
het mid-pachytene stadium gaan herkennen – ook ter hoogte van het rete testis bestaat een
dergelijke immuunbarrière, maar deze is minder compleet
8.2.3.4.
Interactie
tussen
Sertoli-,
Leydig-
en
peritubulaire
cellen
en
testiculaire
functies.(Fig.8.618.73 en 8.78-8.79)
31
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° de functie van de verschillende celpopulaties in de testes is afhankelijk van hormonen zoals
FSH, LH en PRL, maar ook van een aantal parahormonen (bvb. groeifactoren : zie tabel) die
betrokken zijn bij paracriene en autocriene regulatiemechanismen
Tabel 8.18 : belangrijkste groeihormonen betrokken bij regulatie van testisfunctie :
groeifactor
oorsprong
doelwitcellen
SGF
Sertolicellen
kiemcellen
werking
(?), proliferatie
somatische cellen
bFGF
IGF1
TGF
TGF
IL1(achtig)
testes
Sertolicellen,
celdeling,
Leydigcellen,
plasminogeenactivator
kiemcellen (?)
, steroïdogenese (?)
Sertolicellen,
Sertolicellen,
DNAsynthese,
geconditioneerd
Leydigcellen,
steroïdogenese
medium
kiemcellen
Sertolicellen,
Sertolicellen,
peritubulaire cellen
Leydigcellen, peritub. kolonisatievorming,
proliferatie
en
cellen
steroïdogenese
Sertolicellen,
Sertolicellen,
kolonisatievorming,
peritubulaire cellen
Leydigcellen,
hCG-
peritubulaire cellen
testosteronreceptoren
Leydigcellen,
Sertolicellen,
steroïdogenese,
macrofagen,
Leydigcellen
proliferatie
(Sertolicel bij volw
en
van
kiemcellen
rat)
NGF
spermatocyten,
Sertolicellen
?
spermatiden, seminaal
plasma
EGF
afwezigheid
genexpressie
in
van Leydigcellen,
steroïdogenese,
de Sertolicellen
lactaatproductie
gonaden
GHRH
Leydigcellen,
en
aromatase-activiteit
?
?
?
?
seminaal plasma
GRP
Leydigcellen
32
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
waarbij :
SGF=seminiferous growth factor
bFGF=basic fibroblast growth factor
IGF1=insulin-like growth factor
TGF=transforming growth factor
IL1-achtig(like)=interleukin 1-(like)
NGF=nerve growth factor
GHRH=growth hormone releasing factor
GRP=gastrin releasing peptide (bombesine)
EGF=epidermal growth factor
° specifieke secreties van de testes en hun paracriene functie :
-
Sertolicellen controleren de spermatogenese via paracriene secreties en metabole substraten –
de synthese-activiteit van deze cellen is nauw verbonden met het stadium waarin het
seminifere epitheel zich bevindt en staat onder invloed van FSH (opgelet ! FSH is wel
continu aanwezig maar is enkel actief op die ogenblikken waarbij het aantal FSH-receptoren
op de Sertolicellen maximaal is) – Sertolicellen stimuleren tevens de synthese van DNA en
RNA door de kiemcellen - via de Sertolicellen gaat FSH de groei en differentiatie van
Leydigcellen stimuleren, het aantal LH-receptoren erop doen toenemen en aldus indirect de
testosteronsecretie stimuleren
-
Leydigcellen synthetiseren verschillende parahormonen die inwerken op andere Leydig- of
Sertolicellen, of op het bloedvatendotheel
-
kiemcellen stimuleren (via bepaalde mediatoren) de secretie van ABP en transferrine door de
Sertolicellen – spermatiden inhiberen dan weer de secretie van inhibine
8.2.3.5. Gonadotrope controle van testiculaire functies.
° controle door FSH en LH : LH (bij de rat : FSH) is essentieel voor de initiatie van de
spermatogenese, en FSH heeft hierbij een belangrijke ondersteunende rol (noch FSH, noch
testosteron alléén kunnen dus zorgen voor een normale spermatogenese)
° prolactine en andere hormonen : PRL zorgt voor een stijging van het aantal LH-receptoren en
tevens voor de binding van LH aan deze receptoren, wat gevolgd wordt door een toename in
synthese en secretie van testosteron – opmerkelijk is wel dat dit effect niet altijd geobserveerd
wordt : bij lage concentraties werkt PRL zelfs inhibitorisch ; vele andere hormonen interfereren
33
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
met testisfuncties : cortisol doet de testosteronplasmaspiegel dalen , terwijl insuline
steroïdogenese stimuleert
° testosteron en zijn androgene en oestrogene metabolieten spelen een rol bij de regulatie van de
hypothalamo-hypofysaire gonadotrope functie : ze inhiberen nl. de spontane release van GnRH
(negatieve feedback controle !)(opm. : de plasmaspiegels van LH zijn volledig androgeenafhankelijk, deze van FSH worden zowel door testosteron als door inhibine geregeld)
° opm.: transport van zaadcellen doorheen vrouwelijke geslachtstractus : zie Fig.8.184
8.2.4. Specifieke topics. (Fig.8.818.83 ; Tab.8.208.23)
8.2.4.1. Abnormale morfologie van zaadcellen.
° de morfologie van de spermatozoa kan bestudeerd worden onder lichtmicroscoop met behulp
van een aantal kleuringstechnieken zoals Nigrosine(5%)-Eosine(1%) (= supravitaalkleuring :
geeft tevens een beeld van het aantal levende/aantal dode spermatozoa, vermits zaadcellen met
een intacte membraan geen eosine doorlaten en dus ongekleurd blijven) of Oost-Indische inkt
° de meest belangrijke defecten die zich kunnen voordoen zijn (uit Cursus Voortplanting –
Prof.Dr.A.deKruif):
a) primaire afwijkingen : vinden hun oorsprong in de testes. Primaire storingen die ontstaan zijn
tijdens de meiose worden meestal niet in het ejaculaat teruggevonden omdat ze gewoonlijk
leiden tot volledig celverval (zeer lage spermaconcentratie kan wel een indicatie zijn).
Primaire storingen tijdens de spermiogenese (differentiatie) resulteren in misvormingen van
de kop (abnormale kopvorm, acrosoomafwijkingen, “cysten” van de kern) en soms ook tot
staartafwijkingen (multipele staarten, afwijking aan de mitochondriale schede, staartstomp).
b) secundaire afwijkingen : ontstaan ter hoogte van de epididymis. Meest voorkomend zijn losse
koppen, protoplasmadruppels en abnormale staarten.
c) tertiaire afwijkingen : ontstaan tijdens of na het opvangen van het ejaculaat bvb. door
koudeshock of onoordeelkundig gemaakte uitstrijkjes, waardoor o.a. afgebroken staarten
kunnen voorkomen.
8.2.4.2. KI en verdunners : zie verder : 8.4.1.addendum.
8.2.4.3. Beregeur als afgeleide van de steroïdogenese.
34
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
In regel worden mannelijke vleesvarkens gecastreerd, alhoewel intacte mannelijke dieren sneller
groeien, een efficiënter voederverbruik hebben en karkassen opleveren met een groter aandeel
(mager) vlees dan de gecastreerde varkens. Vlees van intacte beren is echter voor de consument
onaanvaardbaar doordat het bij opwarming een sterke urine-achtige geur verspreid (berengeur,
Eng.: boar odor, boar taint, male sex odor). Hoewel nog niet alle chemische componenten die
deze geur veroorzaken gekend zijn, neemt men aan dat een familie van 16-onverzadigde steroïden
(C19-16-steroïden) ervoor verantwoordelijk is. Deze steroïden worden in de eerste plaats gevormd
ter hoogte van de berentestes (precursor is het pregnenolon), en worden via de vena spermatica in
de bloedbaan vrijgesteld. Langs deze weg komen ze terecht in het vetweefsel, waar ze opgeslagen
worden. Het 5-androst-16-en-3-one is het meest lipofiele van alle C19-16-steroïden en komt
daardoor het meest voor ter hoogte van de opslagplaatsen. Na castratie daalt het gehalte aan 5androst-16-en-3-one in het vetweefsel. Bij sexuele opwinding worden C19-16-steroïden in de
bloedbaan vrijgesteld voor transport naar de speekselklieren : hier worden ze gemetaboliseerd tot
5-androst-16-en-3-one, 5-androst-16-en-3-ol en 5-androst-16-en-3-ol. Berenspeeksel speelt
een belangrijke rol bij het sexuele gedrag van zowel beer als zeug : de geur van de C19-16steroïden wordt door de zeug waargenomen en hun werking als feromonen veroorzaakt bij de
zeug de “sta-reflex”tijdens de oestrus, zodat de beer haar kan bestijgen en copulatie kan
plaatsvinden. Opm.: berengeur komt voornamelijk voor bij niet-gecastreerde mannelijke varkens,
maar ook bij bargen, zeugen en cryptorchen.
35
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.3. Vrouwelijke reproductiefysiologie.
8.3.1. Structuur en functie van ovaria en geslachtskanalen. (Fig.8.848.89)
8.3.1.1. Ligging en uitzicht van de ovaria.
° de ovaria zijn de organen waar de opslag en ontwikkeling van oöcyten plaatsvindt. Van de bulk
aan groeiende follikels die voorhanden is , zal slechts een minderheid het stadium van rijpheid,
met daaropvolgende ovulatie, bereiken, terwijl de meeste follikels zullen degenereren. De ovaria
zorgen er tevens voor dat de uterus voorbereid wordt op het ontvangen van een bevruchte eicel
(omvorming van ovulatoire follikel in geel lichaam of corpus luteum (CL)). Indien geen
bevruchting plaatsvindt, gaat het CL in regressie en kan een (aantal) nieuwe follikel(s) rijpen.
° het uitzicht van de ovaria hangt dus samen met de leeftijd (prepubertaal en pubertaal stadium)en
de sexuele cyclus van het dier en met het stadium van de folliculogenese waarin het ovarium zich
bevindt (zie verder : 8.3.1.3.); de controle over follikelgroei en ovulatie gebeurt door
gonadotropines en/of door steroïden en lokaal gesynthetiseerde ovariële proteïnen
° histologie :
-
het ovarium is omgeven door een kapsel van dicht collageen bindweefsel, de tunica
albuginea, waarop een dun laagje kiemepitheel ligt
-
in het ovarium kunnen twee zones onderscheiden worden : een centrale zona vasculosa
(medulla : zeer rijk aan bloedvaten) en een perifere zona parenchymatosa (cortex : bevat de
follikels in verschillende ontwikkelingsstadia) (opm.: paard : bij het geslachtsrijpe dier komt
de zona parenchymatosa centraal te liggen en zullen de rijpe follikels ovuleren in de zgn.
ovariële groeve)
° ligging van de ovaria bij de verschillende diersoorten :
-
zeug en merrie : buikholte , halfweg tussen nieren en bekkeningang, ongeveer ventraal van
het tuber coxae
-
koe : buikholte, meer caudoventraal dan bij zeug en merrie, craniaal van de ossa pubis
-
bij het nog niet geslachtsrijpe dier liggen de ovaria binnen de bekkenholte
-
bij het drachtige dier worden de ovaria door de graviede uterus naar craniaal en ventraal
getrokken
36
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.3.1.2. Ligging en uitzicht van de geslachtstractus.
° de vagina en het vestibulum : strikt gesproken is de vagina het deel tussen de cervixopening en
de externe uitmonding van de urineleider, terwijl het vestibulum het deel is vanaf de urethraopening tot aan de vulva – bij de meeste maagdelijke dieren zijn beide delen gescheiden door een
(maagden)vlies of hymen. De vagina is afgelijnd door een meerlagig plavei-epitheel dat
longitudinale plooien vertoont. Zowel in het craniale deel van de vagina als in het vestibulum zijn
klieren aanwezig – tijdens de oestrus bevatten de secreties van de vestibulaire klieren feromonen
(aantrekken van sexuele partner)
° de cervix (baarmoederhals): bezit een dikke wand met een relatief smal lumen. Bij sommige
diersoorten (ooi, koe) vormen dwarse plooien in de cervixwand een aantal “cul-de-sacs”, waarin
het sperma kan vastlopen. Het epitheel van de cervix bevat bij deze dieren meer secretorische
cellen dan gecilieerde cellen, zodat vooral gedurende de oestrus slierten cervixslijm in de richting
van de vagina afvloeien. In de wand van de cervix liggen bundels gladde spiercellen, ingebed in
collageen bindweefsel : het geheel vormt een stevige elastische structuur rondom het
cervixkanaal.
° de uterus (baarmoeder):
de vorm is speciesafhankelijk :
-
uterus duplex : bestaat uit twee bijna volledig (rat) of volledig (konijn) gescheiden
uterushoorns, die zich verderzetten in twee afzonderlijke cervixkanalen – deze laatsten
monden elk met een eigen opening uit in de vagina – bij sommige diersoorten (cavia, muis)
kunnen beide cervixkanalen in hun distaal deel versmelten en aldus met één enkele opening
in de vagina uitmonden
-
uterus bicornis (“tweehoornige baarmoeder” bij de meeste huiszoogdieren): beide
uterushoorns versmelten voor een klein (5% bij teef en zeug) of een groot stuk (merrie) ter
vorming van het corpus uteri – in de uterus bipartitus bestaat deze fusie voor de helft van de
lengte van de hoorns, maar inwendig blijven ze nog gescheiden door een centraal septum
(herkauwers) – het corpus uteri mondt via één cervixopening in de vagina uit
-
uterus simplex : bestaat uit een corpus uteri (één holte) dat via één cervixkanaal met de
vagina in verbinding staat (primaten)
histologie : de wand van de uterus bestaat uit drie lagen : het endometrium (bindweefsellaag
bedekt met een éénlagig cylindrisch epitheel, talrijke tubulaire klieren), het myometrium (sterk
uitgebouwde laag glad spierweefsel) en het perimetrium (visceraal peritoneum)
37
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° de oviduct (eileider) : staat via het trechtervormige en dunwandige infundibulum in open
verbinding met de buikholte – de vrije rand van het infundibulum is afgelijnd met talrijke
draadvormige uitlopers, de fimbriae, die het ovarium omsluiten : ze vangen de eicel op na
ovulatie en voeren het naar de volgende delen van de eileider (ampulla en isthmus). De wand van
de oviduct bestaat uit een mucosalaag met een sterk doorbloede bindweefsellaag en een min of
meer sterk geplooid (afhankelijk van segment, diersoort en cyclusstadium) éénlagig cylindrisch
epitheel dat talrijke gecilieerde cellen en niet-gecilieerde secretorische cellen bevat, een laag
gladde spiercellen en een sereuze laag (visceraal peritoneum). In de oviduct gebeurt de eventuele
bevruchting, de voltooiing van de rijpingsdeling van de oöcyt en de eerste embryonale delingen.
° innervatie van de geslachtstractus : zowel parasympathisch (via nn.pelvici – ACh) als
sympathisch (via n.hypogastricus – noradrenaline, vasoactief intestinaal peptide en neuropeptide
Y) (zie tabel x)
8.3.1.3. Folliculogenese. (Fig.8.908.110)
Bij de zoogdieren vervullen de ovaria verschillende functies :
-
groei van een deel van de follikels, atresie van de kleine follikels
-
regeling van de groei van ovulatoire follikels
-
follikelruptuur ten tijde van de ovulatie
-
vorming van een geel lichaam (corpus luteum, CL) en CL-functie
Controle over folliculaire groei en ovulatie kan gebeuren via beïnvloeding door gonadotropines
en/of door steroïden en lokale proteïnen die door de ovaria zelf aangemaakt worden.
° de term folliculogenese omvat de groei van een follikel, vanaf het ogenblik dat hij vrijkomt uit
de reserve aan follikels die tijdens de embryonale periode werd aangelegd, tot het moment dat hij
ofwel ovuleert, ofwel atretisch wordt. Het is een continu proces, waarbij dagelijks follikels uit de
reserve vrijkomen.
° morfologische aspecten :
-
de kleinst mogelijke follikel is de primordiale follikel, gevormd door een oöcyt die omgeven
is door afgeplatte granulosacellen
-
naarmate de granulosacellen kubisch worden spreekt men van een intermediaire, en tenslotte
(als de oöcyt volledig omgeven is door één cellaag van kubische granulosacellen ) van een
primaire follikel
38
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
bij het verschijnen van een tweede laag kubische granulosacellen, spreekt men van een
secundaire follikel (inmiddels groeit ook de oöcyt zelf)
Bovengenoemde follikels vormen dat deel van de reserve aan follikels dat tijdens het latere
geslachtsrijpe leven aangesproken zal worden. Zij bevinden zich in de periferie van de
ovariumcortex, waar zij ongeveer 95% van alle aanwezige follikels uitmaken.
-
in de grootste secundaire follikels verschijnt een zgn. zona pellucida tussen de oöcyt en de
granulosacellen : dit is een laagje glycoproteïnen dat door de oöcyt zelf geproduceerd wordt
-
cellen uit het bindweefselstroma rondom de follikels gaan afplatten en een georganiseerde
laag rondom de follikel vormen (theca)
-
de granulosacellaag is nu meerdere rijen dik, de theca heeft zich georganiseerd in twee
onderscheiden lagen : theca interna en theca externa
-
de secundaire follikel wordt een “antrale” follikel wanneer in het centrum, tussen de
granulosacellen, een ruimte verschijnt die gevuld wordt met folliculair vocht ; op dat
ogenblik heeft ook de oöcyt ongeveer zijn mature afmetingen bereikt en komt ze excentrisch
te liggen, omgeven door een krans van granulosacellen, de cumulus oöphorus (lett. :
zaaddragend heuveltje). De thecacellen en granulosacellen zijn onderling verbonden door
“gap junctions”. Dezelfde intercellulaire verbindingen bestaan tussen de granulosacellen van
de cumulus en de oöcyt.
° follikelatresie : de meeste follikels ondergaan atresie. Bij primordiale en intermediaire follikels
is nog niet uit te maken of zij al dan niet atresie zullen ondergaan. Bij grotere follikels kunnen
volgende veranderingen opgemerkt worden :
-
vroegtijdige disruptie van de oöcyt
-
retractie en verdwijnen van de granulosacellen, dissociatie van de cumulus
-
hypertrofie van de thecacellen, omvorming van thecacellen tot interstitieel weefsel
-
verschijnen van pycnotische lichaampjes (gecondenseerd nucleair materiaal, wijzend op
celverval)
-
laatste stadium van atresie : invasie van de folliculaire holte door fibroblasten en verdwijnen
van het interstitieel weefsel
De gedegenereerde oöcyt en/of de zona pellucida zijn tenslotte nog de laatste structuren die resten
van een follikel in het laatste stadium van atresie.
° dynamica van follikelgroei : het aantal reservefollikels dat tijdens de oögenese wordt
aangelegd is species- en individu-afhankelijk (oorzaken hiervoor onbekend) bvb. het ovarium van
een volwassen “Ile-de-France”schaap kan tussen 20.000 en 86.000 follikels bevatten.
39
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
leeftijdsgebonden factoren : in tegenstelling tot de situatie bij de mens, wordt bij
verouderende zoogdieren haast geen vermindering van het aantal follikels in elk van de
hogerbeschreven groeistadia waargenomen (behalve in vergelijking met zeer jonge dieren).
Vooral opmerkelijk is de stabiliteit van het aantal antrale follikels.
-
kinetica van de follikelgroei : de mitotische index van de granulosacellen verandert met de
diameter van de follikel (zie figuur x). Ook hangen veranderingen in de snelheid waarmee
follikels groeien samen met het oestrusstadium waarin het dier zich bevindt
-
duur van folliculaire groeifasen : voor elk groeistadium kan de tijd die nodig is om het
stadium te doorlopen berekend worden uit (a) het aantal granulosacellen aan het begin en aan
het eind van elk afzonderlijk stadium en (b) de proliferatie-index (ook : mitotische index of
“labelling” index). Bvb. bij het schaap heeft een follikel 6 maanden nodig om, vanaf het
ogenblik dat hij uit de reserve vrijkomt, uit te groeien tot een ovulatoire follikel. De laatste 45
dagen daarvan zijn nodig om uit te groeien van antrale tot ovulatoire follikel.
° regulatie van de follikelgroei :
(1) basale follikelgroei : de groei van follikels tot aan een speciesspecifiek “drempel”stadium
(bvb. schaap : follikels kleiner dan 2 mm) gebeurt nagenoeg onafhankelijk van de invloed van
gonadotropines. Vermoedelijk hebben de gonadotropines tot op dat stadium voornamelijk een
invloed op de rijping van de granulosa- en thecacellen, veeleer dan op de groei zelf van de
follikel.
(2) groei van ovulatoire follikels : ovulatoire follikels zijn deze die de terminale fase van groei en
rijping bereikt hebben, en het vermogen hebben verworven om te ovuleren in antwoord op
een ovulatoire hormoonpiek (gonadotropinen, of toediening van LH/hCG):
-
morfologische kenmerken van de ovulatoire follikel : heeft de maximum haalbare diameter
bereikt (0,6 mm bij rat, 8 mm bij ooi, 16-20 mm bij mens); bezit een maximum aantal
granulosacellen (3-5x106 bij ooi); lage mitotische activiteit ter hoogte van theca- en
granulosacellen (mitotische index < 1); frequent optreden van atresie bij kleinere follikels
-
fysiologische kenmerken van de ovulatoire follikel : hoge oestrogenen/androgenen en hoge
oestrogenen/progesteron-verhouding in het follikelvocht (de andere grote niet-ovulatoire
follikels hebben lege verhoudingen, aangezien atresie gepaard gaat met verlies van
aromatase-activiteit door de granulosacellen); aanwezigheid van LH-receptoren op de
granulosacellen (deze receptoren zijn afwezig of niet functioneel bij atretische follikels); hoge
inhibine-productie ; sterke doorbloeding
-
tijdstip van voorkomen van de ovulatoire follikel : in tegenstelling tot de rat en de mens, bij
wie de ovulatoire follikel enkel verschijnt tijdens de preovulatoire periode, is er bij schaap,
40
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
rund en paard een continue vernieuwing van de populatie aan ovulatoire follikels doorheen de
ganse cyclus. Dit verloopt in zgn. groei”golven” : bij het rund duurt een gemiddelde golf 6 tot
10 dagen en per cyclus treden zo’n 2 tot 3 golven op. De follikels die tijdens een dergelijke
golf groeien zijn morfologisch identiek aan een ovulatoire follikel aan het einde van de
folliculaire fase. Zo vertonen ze ook receptoren voor LH.
De sleutelwoorden in verband met de controle over het aantal ovulatoire follikels zijn :
recrutering, selectie en dominantie :
-
recrutering : is het binnentreden van een groep follikels in een gonadotropine-afhankelijk
stadium (maximale afmeting die een follikel kan bereiken in afwezigheid van GnRH =
minimale afmeting die de follikel moet hebben om voor recrutering in aanmerking te komen)
bvb. bij het schaap gaat het om follikels van min. 2 mm. Al de gerecruteerde follikels zijn
potentieel ovulatoir, maar toch is het aantal gerecruteerde follikels twee- tot driemaal hoger
dan het aantal ovulerende follikels. De keuze van de follikel(s) die uiteindelijk zal (zullen)
ovuleren is volledig at random.
-
selectie : de ovulatoire follikel treedt naar voren uit de groep gerecruteerde follikels en kan
geïdentificeerd worden (tenminste bij rat en mens ; bij het schaap is dit veel moeilijker omdat
er gelijktijdig een regressie is van de grootste follikel van de secundaire golf en een
recrutering van follikels uit de tertiaire golf : op dat ogenblik is geen enkele follikel
opmerkelijk groter dan de rest).
-
dominantie : tesamen met de aanwezigheid van een dominante follikel treedt atresie op van
de overige gerecruteerde follikels en wordt verdere recrutering geblokkeerd.
Factoren betrokken bij de controle over de groei van de ovulatoire follikels : de gonadotropines
FSH en LH spelen een zeer belangrijke rol in dit verband : in hun afwezigheid zijn er geen
ovulatoire follikels.
-
controle over recrutering : recrutering van follikels wordt geïnduceerd door FSH. Dit is
vooral duidelijk bij rat en mens, die een menstruele FSH-piek vertonen. Bij schaap en rund
treedt dit niet op, maar vindt mogelijk een lokale amplificatie van het FSH-signaal door
ovariële factoren plaats. Bij sommige diersoorten (schaap) is tevens een basale LH-spiegel
vereist.
-
controle over selectie : de groei en ontwikkeling van de talrijke gerecruteerde follikels
veroorzaakt een stijging in de oestradiolproductie, tesamen met een toename van de inhibineproductie. Het negatieve feedback-effect van beide hormonen op FSH veroorzaakt een
41
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
geleidelijke daling in de FSH-concentratie. Wanneer de FSH-concentratie onder een bepaalde
drempelwaarde zakt, stopt de verdere recrutering en gaan de overtollige follikels uit de
gerecruteerde groep in atresie. Bij species waar een strenge controle doorgevoerd wordt (nl.
deze waarbij slechts één follikel/cyclus tot ovulatie komt), speelt waarschijnlijk nog een
bijkomend controlemechanisme : daarbij zou de grootste follikel een component secreteren
die een paracriene inhibitorische werking zou hebben op de andere gerecruteerde follikels
van beide ovaria. Verder onderzoek hieromtrent moet nog gebeuren.
-
controle over dominantie : ondanks een daling in de FSH-concentratie zal de dominante
follikel toch blijven groeien en heeft hij een verminderde behoefte aan FSH. Vermoedelijk is
dit het gevolg van twee elementen : (1) verschijning van LH-receptoren op de granulosacellen
en actieve LH-secretie op het einde van de folliculaire fase : dit zorgt voor het behoud een
hoge cAMP-spiegel in de cellen van de dominante follikel, wat het effect van een dalend
FSH-gehalte zou tegengaan ; (2) amplificatie van de folliculaire respons op FSH via IGF1
(bij schaap en mens) of via oestradiol (rat) : IGF stimuleert aromatisering (terwijl oestradiol
de productie van, en de granulosacelreceptiviteit voor IGF stimuleert) zodat de dominante
follikel hoge hoeveelheden oestradiol kan produceren.
Controle over pulsatiele GnRH- en LH-vrijstelling :
Een puls is een korte, maar intense periode tijdens dewelke een hormoon wordt vrijgesteld (ook :
piek). De amplitude van de puls is de maximale hoeveelheid van het hormoon die gemeten kan
worden (van deze waarde wordt gewoonlijk de “basale” waarde, dit is de waarde gemeten tussen
twee opeenvolgende pulsen in, afgetrokken). Zowel GnRH als LH kennen een pulsatiele
vrijstelling.
-
relatie tussen LH- en GnRH-secretie : GnRH, in pulsen vrijgesteld door de hypothalamus in
het hypofyseaal portaal bloed, bindt op specifieke receptoren van de gonadotrope cellen van
de hypofyse en induceert zo de synthese (via verschillende “second messenger” systemen) en
vrijstelling van LH. Bij zeer hoge GnRH-pulsfrequentie verloopt de LH-vrijstelling minder
uitgesproken of niet meer in pieken, doordat de basale waarden van het hormoon gestegen
zijn.
-
rol van pulsfrequentie : vermoedelijk gebeurt de vrijstelling van GnRH in pieken om te
verhinderen dat continue (hyper)secretie van dit releasing-hormoon zou leiden tot inhibitie
van de gonadotropine-secretie en dit ten gevolge van een progressieve daling van de
hypofysaire respons (desensitisatie). Dit laatste is dan weer het gevolg van een daling van het
aantal GnRH-receptoren op de membraan van de hypofysaire gonadotrope cellen. Dankzij de
42
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
pulsatiele secretie beschikt het reproductiestelsel over een systeem dat een continue doch
regelbare invloed kan uitoefenen op de diverse functies die ermee in verband staan.
-
oorsprong van pulsatiliteit : elke GnRH-piek bestaat uit de som van kleine hoeveelheden van
het hormoon, vrijgesteld door de afzonderlijke GnRH-neuronen. Het pulsatiel karakter is het
gevolg van de interactie tussen een “pacemaker” (die een endogeen ritme oplegt) en de
synchronisatie tussen de verschillende GnRH-neuronen. Vermoedelijk fungeren de
verschillende GnRH-neuronen zelf als afzonderlijke pacemakers. Hoe de synchronisatie
tussen deze verschillende pacemakers gebeurt is nog niet duidelijk (voorgestelde hypothesen :
zie figuur).
-
regeling van de secretie van GnRH en LH : GnRH is een boodschapper van het CZS, die de
gonadotrope functie regelt. De boodschapper komt tot stand na integratie van alle nuttige
informatie die het CZS bereikt. Een deel van deze informatie komt van de reproductie-as zelf,
een ander deel van extern d.w.z. vanuit een ander lichaamsonderdeel of vanuit de
buitenwereld (invloed van omgevingsfactoren):
(1) feedback door gonadale steroïden : in eerste instantie gaan oestradiol, progesteron en
testosteron de GnRH-pulsfrequentie doen afnemen – in tweede instantie zal oestrogeen,
tijdens de laat-folliculaire fase van de cyclus, een sterke stijging van GnRH-secretie
veroorzaken, wat leidt tot een pre-ovulatoire LH-piek
(2) hypofysaire feedback : ter hoogte van het hypofysair portaal systeem werd het bestaan
van een retrograde bloedvloei aangetoond. Vandaar de hypothese dat er een “shortloop”feedbacksysteem zou bestaan tussen hypofyse en hypothalamus, waarbij LH de
secretie van GnRH zou controleren : dit werd evenwel ontkracht door de bevinding dat
noch een blokkering van de LH-secretie, noch een sterke stijging van het LH in het
plasma door externe toediening van het hormoon een invloed hebben op de GnRHsecretie.
(3) hypothalamische feedback : ter hoogte van de hypothalamus zelf bestaat een zeker
autoregulatiemechanisme waarbij GnRH via een “ultra-short-loop”feedbacksysteem zijn
eigen secretie beïnvloedt – het belang van dit mechanisme onder normale fysiologische
omstandigheden is nog niet helemaal duidelijk
(4) feedback door externe factoren : de meeste vitale lichaamsfuncties hebben een invloed op
de frequentie van de GnRH- en LH-pulsen (bvb. stressactivatie corticotrope
asinhibitie reproductieve functies ; ondervoeding en groeivertraging hebben hetzelfde
effect) ; olfactorische stimulatie kan de GnRH- en LH-secretiefrequentie wijzigen (bvb.
bij een ooi die de geur van een ram waarneemt stijgt de LH-pulsfrequentie binnen de tien
43
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
minuten = ram-effect) ; bij dieren met een seizoensgebonden reproductiecyclus staat de
GnRH-pulsfrequentie in verband met de daglengte
Addendum : neuronale beïnvloeding van de GnRH-neuronen :
De regeling van de activiteit van de GnRH-neuronen gebeurt voor een belangrijk deel door de
gonadale steroïden : nochtans bezitten deze neuronen zelf geen receptoren voor steroïden. De
feedback gebeurt dus via andere (aminerge en peptiderge) (afferente) neuronen, die wel
steroïdreceptoren bezitten :
-
mono-aminerge afferenten : de neurotransmittors zijn de catecholaminen dopamine en
noradrenaline, en het indolamine serotonine. Deze afferenten maken contact met de
cellichamen van GnRH-neuronen ter hoogte van het preoptisch gebied en de eminentia
mediana. De afferente dopaminerge vezels vinden hun oorsprong in het diencephalon, de
noradrenerge en serotoninerge vezels ontspringen in de hersenstam.
-
peptiderge afferenten : het gaat ondermeer om volgende peptide-neurotransmittors :
neuropeptide Y, substance P, neurotensine, VIP,…Ook het bestaan van een GnRH-neuronaalnetwerk (GnRH-bevattende zenuwuiteinden die contact maken met perikarya en dendrieten
van GnRH-vezels) wordt vermoed.
-
GABA-bevattende afferenten : maken contact met GnRH-vezels ter hoogte van het
preoptisch gebied – de oorsprong van de vezels is onbekend
8.3.1.4. Ovulatie. (Fig.8.1118.119 en 8.1218.129 en 8.132-8.133 ; Tab.8.258.27)
Op het einde van zijn groeifase zal de dominante follikel, in antwoord op een
gonadotropinenpiek, uitgesproken structurele en functionele veranderingen ondergaan en de
oöcyt vrijgeven.
° morfologische en cytologische veranderingen :
-
kort na de ovulatoire piek treedt hyperemie op (o.i.v. histamine en PGE2). De theca externa
wordt oedemateus door lekkage van plasma.
-
de cumuluscellen produceren hyaluronzuur (o.i.v. LH/FSH) en daardoor wordt water
aangetrokken in de antrale holte. De volumetoename die hiervan het gevolg is wordt mede
ondersteund door een dissociatie van de collageenvezels die de follikel omringen onder
invloed van collagenase en plasmine (plasmine verschijnt nadat plasminogeen-activator
geproduceerd is door de granulosacellen en de cumuluscellen).
44
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
de granulosacellen die tegen de basaalmembraan aan liggen en deze die de cumulus vormen
komen los van elkaar (verdwijnen van de gap-junctions), verliezen hun cylindrische vorm en
stoppen met hun celdelingen. De enige plaats waar de gap-junctions weinig of niet
veranderen is ter hoogte van de junctie tussen oöcyt en corona radiata.
-
net vóór de ovulatie verdwijnt de basaalmembraan en gaan bloedvaten, tesamen met
thecacellen, de follikel binnendringen
-
ter hoogte van de apex-zijde van de follikel treedt lokale ischemie op met afsterven van de
ovariële epitheelcellen. De afstervende cellen produceren hydrolasen die de onderliggende
cellagen gaan hydrolyseren. Dit leidt tenslotte tot desintegratie van de follikelapex en zo tot
follikelruptuur (opgelet ! hier komt dus geen stijging van de intrafolliculaire druk noch
follikelcontractie aan te pas).
-
door ruptuur van de follikel daalt de hydrostatische druk. Dit heeft voor gevolg dat de follikel
zal contraheren en daardoor de oöcyt + corona radiata uitstoten. Opm. : ritmische contracties
van het ovarium en de theca-externacellen (bevatten actine- en myosinevezels) gebeurt door
prikkeling van -adrenerge receptoren.
° metabole veranderingen :
-
steroïden : na de gonadotropinenpiek stijgt de secretie van progesteron, terwijl deze van
oestradiol en androgenen daalt (gewoonlijk is er voorafgaandelijk een tijdelijke stijging van
de totale steroïdproductie) : deze verandering speelt een rol bij de rijping van het cytooplasma
van de oöcyt.
-
prostaglandines, histamine en bradykinine : na de gonadotropinen-piek treedt een stijging in
prostaglandinensecretie op (PGF2 en PGE2). Ze worden voornamelijk geproduceerd door de
granulosacellen. Het PGF2 induceert vermoedelijk de vrijstelling van de hydrolasen door de
ovariële epitheelcellen. Bradykinine stimuleert de synthese van PGE2 en PGI2 (via fosfolipase
A2). Histamine veroorzaakt follikelruptuur. FSH en LH induceren de rijping van de oöcyt en
de ruptuur van de follikel. (Opm.: synthese van prostaglandines : Fig.8.258)
De gonadotropinenpiek (FSH/LH-piek) heeft dus een uitgesproken effect op structuur en functie
van de dominante follikel : de mediator van deze werking is het cAMP. Opmerkelijk hierbij is
wel dat in vivo ovulatie-inductie ook kan gebeuren door LH alleen of door FSH alleen ! Dit levert
het bewijs dat de belangrijkste vereiste voor het doen ovuleren van een rijpe oöcyt een hoge
cAMP-spiegel is. Deze cAMP-spiegel induceert als het ware een lokale ontstekingsreactie :
immers alle cellulaire ontstekingsmediatoren die ook tijdens ontstekingsreacties verschijnen
45
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
kunnen in de follikel teruggevonden worden. Progesteron zou dan instaan voor het beperken van
die ontstekingsreactie, zodat de geruptureerde follikel zich kan omvormen tot functioneel CL.
8.3.1.5. Luteale fase.
Vorming van het corpus luteum :
° na ovulatie verdwijnt de basaalmembraan tussen de theca- en de granulosa-cellaag – onder
invloed van de angiogene eigenschappen van het follikelvocht vindt een snelle vascularisatie van
de oorspronkelijke granulosacellagen plaats – samen met de bloedvaten worden ook de
thecacellen tot in de granulosacellaag gebracht en vermengen beide celtypes (vorming van een
min of meer homogeen weefsel) – de centrale bloedklonter wordt geresorbeerd
° tesamen met het luteïnisatieproces vindt een sterke stijging van de progesteronsecretie plaats,
en een onderdrukking (behalve bij primaten !) van de androgeen- en oestrogeensecretie : het
progesteron wordt geproduceerd door de voormalige theca- en granulosacellen, die nu alle
morfologische kenmerken van steroïdogene cellen vertonen (veel glad endoplasmatisch
reticulum, mitochondriën met tubulaire cristae, lipidedruppels in het cytoplasma) en in hun
cytoplasma een heldergeel pigment bevatten (vandaar de naam “geel lichaam, corpus luteum”) –
naast de steroïdogene cellen bestaat het CL ook nog uit fibroblasten en bloedvaten
° de levensduur van het CL is speciesspecifiek en varieert tussen 12 en 21 dagen – de groei en het
behoud of de regressie van het CL wordt gereflecteerd door de veranderingen in de
plasmprogesteronspiegel
Voor een verdere bespreking van het CL wordt een onderscheid gemaakt tussen een cyclisch CL
en een drachtigheidsCL :
Controle over het cyclisch CL :
dit gebeurt door hypofysaire luteotrope hormonen (LH en prolactine) en door de luteotrope
substantie PGF2 (bij het konijn is oestradiol nog een bijkomende luteotrope factor) :
-
LH : na binding aan de membraanreceptoren veroorzaakt LH een activatie van het
adenylaatcyclase en een stijging van het cAMP, met als gevolg een toename van de
steroïdsynthese binnen enkele minuten (dit ten gevolge van een versnelde omzetting van
(vrij) cholesterol naar pregnenolon ter hoogte van de mitochondriën)
46
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
prolactine : zorgt voor een verhoging van de voorraad aan (veresterd) cholesterol en voor een
toename in de omzetting van veresterd naar vrij cholesterol – bovendien zorgt het voor de
inductie en het behoud van LH-receptoren op de luteale cellen
-
PGF2 : wordt gesynthetiseerd door de uterus en bereikt de ovaria via een counter-current
transfermechanisme dat bestaat tussen de utero-ovariële vene en de aanpalende ovariële
arterie – het veroorzaakt luteolyse, vermoedelijk via een vermindering van de doorbloeding
van het CL, een daling van de LH-geïnduceerde synthese van cAMP en een inhibitie van de
steroïdogene werking van cAMP (opm. : bij de zoogdieren secreteert de uterus ook PGE’s,
die een luteotroop effect hebben) – controle over de PGF2-secretie gebeurt vermoedelijk
door oestrogenen (injectie van oestradiol in de midluteale fase veroorzaakt secretie van
PGF2 door de uterus en bijgevolg luteolyse, terwijl onderdrukking van de grootste ovariële
follikels het tegenovergestelde effect heeft nl. behoud van het CL) en door oxytocine
(gesynthetiseerd in de hypothalamus en door het CL zelf – aan het einde van de luteale fase
neemt het aantal oxytocine-receptoren op de uterus snel toe, met als gevolg een toenemende
secretie van uterien PGF2 - dit leidt dan weer tot verhoogde vrijstelling va ovarieel
oxytocine, enzovoort = “dubbel wederkerig positief feedbackmechanisme” tussen uterus en
ovaria)
Opm. : bij de primaten heeft hysterectomie (d.i. het verwijderen van de baarmoeder en daarmee
ook van het uterien PGF2) geen effect op de levensduur van het CL. Toch bezit het CL
receptoren voor PGF2 : dit laatste wordt gesynthetiseerd door de ovaria zelf en heeft hier
vermoedelijk een autocrien of paracrien luteolytisch effect. Hetzelfde wordt vermoed in verband
met oxytocine, dat slechts in zeer beperkte mate door de ovaria wordt gesynthetiseerd. Men
neemt aan dat bij deze species beide hormonen betrokken zijn bij een soort “zelfdestructiefenomeen” van het CL.
Controle over het drachtigheidsCL :
Tegengaan van luteolyse en behoud van hormonale luteotrope stimuli zijn twee vereisten bij de
omvorming van het cyclisch CL tot een drachtigheidsCL. Bij de primaten worden beide acties
vervuld door één enkel hormoon, het chorion gonadotropine (CG), dat door de vrucht zelf
geproduceerd wordt. Bij de andere zoogdieren staan beide acties los van elkaar.
(1) primaten : CG, gesynthetiseerd door de foetale syncytiotrofoblast, zorgt voor het behoud van
luteale functie en dus een onderhoud van de progesteronproductie (tot de placenta deze
progesteronsynthese overneemt)
47
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
(2) ruminantia : samengaan van twee factoren nl. een embryonale factor die de luteolytische
werking van de uterus tegengaat, en een maternale hypofysaire factor die luteotroop werkt :
de embryonale factor is het trofoblastine (TP), dat enkel gesynthetiseerd wordt tijdens de preimplantatieperiode – het leidt tot een vermindering in de grootte en frequentie van de PGF2pulsen door het endometrium, en bovendien is er (vermoedelijk) een daling van de
uterusreceptiviteit voor oxytocine : bijgevolg is de opeenvolging van positieve feedbacks
tussen uterien PGF2 en luteaal oxytocine doorbroken – het behoud van de secretie van
progesteron doet de gevoeligheid van het myometrium voor oxytocine afnemen, wat
eveneens leidt tot een daling van de PGF2-secretie en dus bijdraagt tot een langdurige
inhibitie van het luteolytisch proces ; ook hypofysair prolactine en LH zijn noodzakelijk voor
het behoud van het CL (tot op het ogenblik dat de placenta zelf voldoende placentaal
lactogeen hormoon kan produceren om de functie van de hypofyse hierin over te nemen)
(3) carnivoren : wordt de eicel na de paring niet bevrucht, dan kan het cyclisch CL langdurig in
stand gehouden worden (CL persistens), met schijndracht (Eng. : pseudopregnancy) tot
gevolg – het CL kan daarbij zelfs zolang blijven bestaan als de normale drachtduur maternaal LH en prolactine controleren bij deze dieren de activiteit van het CL, terwijl de
vrucht zelf er geen significante invloed op heeft – behalve bij de kat produceert de placenta
ook geen progesteron of gonadotropinen
(4) andere diersoorten die schijndracht kunnen ontwikkelen : bij rat, hamster en muis zorgt
steriele paring ervoor dat het CL gedurende 10 tot 12 dagen productief blijft (hierna wordt
luteolyse enkel tegngehouden door de aanwezigheid van een levende vrucht : deciduale
cellen inhiberen luteolyse via de secretie van een luteotrope substantie, het PGE 2) – ook
hypofysair en placentaal prolacxtine, en het placentaal chorion gonadotropine, spelen een rol
bij het behoud van het CL
(5) konijn : oestradiol is luteotroop en veroorzaakt groei van en progesteronsecretie door het CL
(6) zeug : oestradiol gesecreteerd door de vrucht zorgt voor een inversie van de richting waarin
het uterien PGF2 getransporteerd wordt d.w.z. het PGF2 wordt in het uteruslumen
gesecreteerd in plaats van in de utero-ovariële vene
(7) marsupialia (buideldieren) : de drachtigheidsduur is korter dan de levensduur van het cyclisch
CL : bijgevolg speelt het prolactine de paradoxale rol van luteolytische factor, terwijl het ook
een lactogene functie heeft (daarnaast zorgt het ook voor een wijziging in de uteriene
secreties, wat de aanleiding is voor de migratie van de embryo’s naar de buidel)
48
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Andere factoren gesecreteerd door het cyclisch of het drachtigheidsCL :
-
relaxine : wordt soms door het CL gesecreteerd, vnl. tijdens de dracht
-
inhibine : is aanwezig in de follikelvloeistof – bij de mens bereikt het maximumwaarden
tijdens de luteale fase : vermoedelijk heeft het samen met oestradiol een inhiberende werking
op FSH-secretie tijdens deze fase
-
prorenine : inactieve precursor van renine, wordt geproduceerd door de ovaria bij rat, konijn,
koe en mens – de concentratie ervan verdubbelt in de periode rond de ovulatie en men
vermoedt dat het zorgt voor de lokale aanmaak van angiotensine II – dit Ang II speelt
mogelijk een rol bij de vorming van het bloedvatensysteem in het CL
-
epidermale groeifactor : EGF komt voor in het humaan CL en stimuleert in vitro de
progesteronsynthese door de geluteïniseerde cellen van het CL
-
andere peptiden : enkephaline (endorfine) en arginine vasopressine zijn aangetoond in het CL
-
potentiële luteolytische peptiden : substanties die een paracriene werking vertonen die
synergistisch is met PGF2 tijdens de luteolyse
8.3.2. Oestrale cycli bij verschillende diersoorten.(Fig.8.120-8.130-8.131 en 8.1348.148 ;
Tab.8.28-8.29)
8.3.2.1. Cyclus van het schaap als typevoorbeeld.
° cycluskenmerken :
duur (dagen) : 17 (14 – 20)
folliculaire fase (dagen) : 2 (2 – 3)
luteale fase (dagen) : 15 (14 – 16)
oestrusduur (uren/dag) : 20 – 36
ovulatietijdstip (uren na aanvang oestrus) : 18 – 36
° het begin van de oestrus is gekenmerkt door een gonadotropinenpiek, ogenblik waarop de
ovulatie plaatsvindt, de folliculaire fase eindigt en de luteale fase begint
° hormonenconcentraties in de loop van de cyclus :
-
aan het begin van de folliculaire (dag 14 – 15) zijn oestradiolconcentraties laag en zijn het
aantal LH-pulsen beperkt
-
tussen dag 15 en 17 treedt een vijfvoudige stijging in oestradiolproductie op, wat de rijping
van de ovulatoire follikel weerspiegelt (toename van het aantal LH-pulsen veroorzaakt
uitgesproken androgeensecretie door de thecacellen) - ook inhibinesecretie neemt toe
49
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
aan het eind van de folliculaire fase daalt de FSH-secretie door de gecombineerde negatieve
feedback door oestradiol en inhibine
-
daarentegen gaan de hoge oestradiolconcentraties via positieve feedback een ovulatoire
gonadotropinenpiek (LH/FSH) uitlokken, wat 24 tot 28 uur later tot een ovulatie leidt
-
na de ovulatie, wanneer het CL functioneel wordt, treedt een tweede FSH-piek op
-
het CL produceert vnl. progesteron, dat zijn hoogste waarden bereikt rond dag 8 – tijdens de
luteale fase blijven zich LH-pulsen (met lage frequentie en hoge amplitude) voordoen, terwijl
FSH-secretie fluctueert
-
aan het eind van de luteale fase begint het endometrium PGF2 te secreteren, met een
maximale secretie tussen dag 14 en 16, wat regressie van het CL gaat induceren
-
tenslotte start een nieuwe folliculaire fase
8.3.2.2. Vergelijking tussen oestrale cycli bij verschillende diersoorten.
Species
Leeftijd bij puberteit
Cyclustype
Rund
12 (4-18) mnd
poly-oestrisch,
Cyclusduur (dagen)
hele 21 (17-25)
jaar
Paard
18 (10-24) mnd
seizoensgeb.
poly- 21 (16-30)
oestr. (vanaf vroege
lente)
Varken
7 (4-9) mnd
poly-oestrisch,
hele 21 (18-24)
jaar
Hond
5-24 mnd
mono-oestrisch
Rat
37-67 dagen
poly-oestrisch,
3,5-13 mnd
hele 4-5
jaar
Mens
(geen
oestrus,
wel 28 (24-35)
menstruatie !)
50
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Species
Luteale
fase Folliculaire fase Oestrusduur
(dgn)
(dgn)
(uren)
Ovulatietijdstip
(uren na begin
of
einde
van
oestrus)
Rund
17 (15-19)
4 (2-5)
12-30
12-15 na einde
Paard
14 (12-15)
7 (4-15)
6 (2-14) dagen
6 (2-14) dgn na
begin
Varken
14
6
40-60
35-40
Rat
1-2
3
9
8-10
Mens
14 (12-17)
14 (12-18)
geen !
midcyclus
Opmerking : geïnduceerde ovulatie.
° komt voor bij Camelidae (Camelus Dromedarius, Llama,…) en bij kat, konijn en haas
° treedt geen paring op, dan vertonen de oestradiolconcentraties een golfpatroon naargelang de
follikels groeien of regresseren ; zijn de oestradiolconcentraties in het bloed hoog, dan treedt ook
(zichtbare) oestrus op
° paring (coïtus) induceert een LH-piek binnen de 2 tot 10 uren , LH-waarden blijven een achttal
uren hoog
° progesteron begint te stijgen drie dagen na de paring en concentraties blijven hoog tot dag 12
van de cyclus
Opmerking : gelijkenissen en verschillen tussen oestrale en menstruele cyclus.
° gelijkenissen :
-
oestradiol en inhibine reduceren FSH-concentraties via negatief feedbackmechanisme
-
oestradiol uit de ovulatoire follikel induceert ovulatoire gonadotropinenpiek en dit via
toenemende hypothalamische GnRH-secretie en een toenemende respons van de hypofyse op
dit GnRH
-
progesteron vermindert de frequentie van de LH-pulsen
-
een functioneel CL blijft 12 tot 15 dagen bestaan
° verschillen :
-
duur van de folliculaire fase : varieert sterk tussen de twee cyclustypes (enkele dagen bij
dieren, twee weken bij primaten): dit hangt samen met het feit dat grote ovulatoire follikels
bij schapen en runderen tijdens elk stadium voorkomen, terwijl dit bij primaten beperkt blijft
tot de laat-folliculaire fase
51
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
tijdens de luteale fase secreteert het CL bij de primaten progesteron, oestradiol en inhibine,
bij de meeste andere zoogdieren echter enkel progesteron. Bij de primaten is daarom ook de
follikelgroei tijdens de luteale fase zeer beperkt
-
de controle over het proces van luteolyse en de manier van recrutering van follikels uit de
cohorte verschillen tussen primaten en schapen (zo is er bij de mens een duidelijke
menstruele FSH-piek die de recrutering inzet, terwijl dit bij het schaap niet bestaat)
8.3.2.3. Seizoensgebonden voortplanting en fotoreceptie. (Fig.8.1498.178)
De meeste zoogdieren vertonen een jaarlijkse reproductiecyclus die gekenmerkt is door het
voorkomen van één of meerdere fasen van sexuele activiteit (meestal slechts gedurende een korte
periode van het jaar), gevolgd door een periode van sexuele rust die gepaard gaat met een
onderdrukking van de gonadale activiteit. Een dergelijk patroon is het gevolg van de aanpassing
van de verschillende diersoorten aan de jaarlijkse variaties wat klimaatomstandigheden en
voederbeschikbaarheid betreft. Licht speelt een sleutelrol bij deze seizoensgebonden
aanpassingen van de voortplantingscyclus.
a) Circadiane ritmes :
°
verschillende
fysiologische
processen
en
gedragingen
(lokomotorische
activiteit,
lichaamstemperatuur, slaap-waakcyclus, hormoonsecreties) vertonen een dag-nacht-patroon (LDcyclus van 24 uur), maar in feite is hun oorsprong endogeen d.w.z. dat ze min of meer hetzelfde
24 u-patroon blijven aanhouden, ook al worden de omgevingsfactoren kunstmatig veranderd
(bvb. constant licht of constant donker): men spreekt van circadiane ritmes (Eng. ook : freerunning rhythms). Onder normale omstandigheden worden ze gesynchroniseerd door de gewone
24u-LD-cyclus, maar ze kunnen ook kunstmatig gesynchroniseerd worden door een zgn.
“Zeitgeber” zoals bvb. een cyclus verschillend van de normale 24u-LD, voedering op
vastgestelde tijdstippen, …
° het voorgaande veronderstelt de aanwezigheid van een endogene “klok” waarbij via bepaalde
banen de fotoperiodische informatie doorgestuurd wordt vanuit de retina naar die klok. Bij de
zoogdieren is deze klok gesitueerd in de nucleus suprachiasmaticus (Eng. : suprachiasmatic
nucleus, SCN) in de hypothalamus, bij vogels en lagere gewervelde dieren ligt ze ter hoogte van
de epifyse en/of de retina zelf.
52
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
b) Neuro-endocriene mechanismen betrokken bij fotoperiodiciteit : de epifyse (ook : pineaalklier)
en melatonine :
° de epifyse is een uitstulping van het dak van het diencephalon en maakt deel uit van het
fotoneuro-endocrien systeem. In de loop van de evolutie is het orgaantje geëvolueerd van een
hoofdzakelijk fotoreceptief orgaan (bij lagere vertebraten) tot een neuro-endocrien orgaan
waarvan de werking afhankelijk is van de lichtperceptie door de retina. Bij de zoogdieren is de
retina dus de enige fotoreceptor (synthetiseert eveneens melatonine).
° neurale informatie bereikt de epifyse via de volgende banen :
(fotoreceptie)
retina : ganglioncellen
(transmissie signaal)
monosynaptische tractus retino-hypothalamicus
(endogene circadiane klok)
nucleus suprachiasmaticus (hypothalamus)
(polysynaptische baan) ganglion cervicale superior (sympathicus)
(melatonine-synthese)
epifyse
vrijstelling melatonine in de bloedbaan
° melatonine (gesynthetiseerd uit tryptofaan) wordt enkel gesecreteerd tijdens de donkere periode
van de 24-uren cyclus
° de epifyse brengt de fotoperiodische signalen over op het hypothalamo-hypofysair systeem.
Belangrijk hierbij is de duur van de nocturnale melatonine-piek.
° werkingsmechanisme : melatonine werkt vermoedelijk bij uitstek in op het CZS, eerder dan op
de hypofyse of de gonaden. Het voorste deel van de hypothalamus is betrokken bij de
fotoperiodische controle van de voortplanting (bvb. destructie van deze regio verhindert
testisregressie bij hamsters onder invloed van korter wordende daglengte). Aangezien melatonine
geen invloed heeft op de basale LH-secretie, de PRL-secretie of de respons op GnRH, neemt men
aan dat het hormoon niet werkt op hypofysair niveau. Toch zijn melatonine-receptoren
teruggevonden in de pars tuberalis van de hypofyse (functie onbekend!).
53
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
c) Vergelijking hamster – schaap – paard :
° melatonine beïnvloedt de voortplantingscyclus op een verschillende manier bij het paard en het
schaap. Beide diersoorten zijn seizoensgebonden poly-oestrisch, maar wel op verschillende
tijdstippen van het jaar : het paard maakt enkele cycli door tijdens de lente (lange fotoperiode),
het schaap tijdens de herfst (korte fotoperiode). Dit hangt samen met het feit dat de mogelijke
nakomelingen dan ter wereld komen in een periode tijdens dewelke de omstandigheden qua
klimaat en voederaanbod optimaal zijn voor groei en overleving van de jongen (gemiddelde
drachtduur paard : 330 dagen, schaap : 145 dagen).
° de hamster is poly-oestrisch en dit gedurende het ganse jaar. Bij deze dieren treedt met
regelmatige intervals een LH-piek op, telkens gevolgd door een ovulatie (cyclusduur 4-5 dagen,
ovulatie 8-12 uur na begin van oestrus d.i. tijdens de nacht). De timing van de LH-piek staat
onder invloed van de circadiane klok (zo zal bij hamsters die blootgesteld worden aan een LDritme van 24u, 23,5u en 21,5u de duur van de cyclus telkens een viervoud zijn van de duur van de
LD-periode).
° van belang is dus de lengte van de fotoperiode, maar ook de richting waarin de fotoperiode
verandert (langer of korter worden): zo zal een toename van het testisgewicht (en dus ook de
testisactiviteit) en van de FSH-plasmaspiegel geïnduceerd worden door fotoperiodes van 12u30
of langer. Hetzelfde gebeurt wanneer men een hamster overbrengt van een 8u- naar een 12ufotoperiode, terwijl testisgewicht en FSH-plasmaconcentratie afnemen bij een hamster die van
een 16u- naar een 12u-fotoperiode wordt overgebracht! Testisgewicht en FSH-spiegel zijn het
hoogst bij deze dieren die aan een toenemende fotoperiode werden onderworpen.
° tenslotte maakt ook de controle uitgeoefend door het hypothalamo-hypofysair systeem op de
gonaden deel uit van geheel van mechanismen waarmee de fotoperiode de gonaden beïnvloedt :
indien voortplanting beperkt is tot een specifieke periode van het jaar, dan is dat een gevolg van
het (rechtstreeks) effect van licht op de endogene klok en van de wisselende gevoeligheid van de
hypothalamus voor hormonale (steroïd)feedback (onrechtstreeks effect). Zo zal bij mannelijke
hamsters tijdens korte fotoperiodes een daling in de secretie van gonadotrope hormonen optreden
die deels het gevolg is van een toenemende gevoeligheid van de hypothalamus voor de negatieve
feedback door testosteron.
54
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
d) Seizoensinvloeden bij het rund, een niet-seizoensgebonden voortplanter.
° het rund vertoont in principe een poly-oestrische cyclus het ganse jaar door. Is het vrouwelijk
dier niet bevrucht tijdens de eerste oestrus, dan zullen nieuwe cycli met spontane ovulaties elkaar
opvolgen.
° vindt bevruchting plaats dan volgt een dracht van gemiddeld 280 dagen en bijgevolg treedt dat
jaar geen nieuwe reproductiecyclus op
° de invloed van het voeder op de oestruscycli is het duidelijkst bij het bereiken van de
geslachtsrijpheid (“puberteit”) en bij het terug op gang komen van de oestrus na een periode van
dracht-parturitie-lactatie. In beide gevallen kan het optreden van een cyclus uitgesteld worden
indien het dier door slechte voedering in een negatief metabool evenwicht verkeert.
55
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.3.3. Reproductiefysiologie bij de vogels. (Fig.av.8.1av.8.12)
A. Vrouwelijk dier.
1. Anatomie van het voortplantingsstelsel.
° in het embryonale stadium beschikken alle vogels over een linker- en rechterovarium en een
linker- en rechteroviduct, maar vanaf dag 4 van de incubatie treedt een asymmetrie op wat betreft
de verdeling van de primordiale kiemcellen over de ovaria ; vanaf dag 10 gaat het rechterovarium
in regressie (o.i.v. een Müllerse inhiberende substantie) : de Galliformes beschikken enkel over
een linkerovarium en –oviduct (in zeldzame gevallen kan toch een functioneel rechterovarium en
–oviduct aanwezig zijn), bij de Falconiformes en de bruine kiwi zijn doorgaans beide ovaria en
oviducten aanwezig en functioneel (soms asymmetrisch in grootte), bij de mus en de duif bezitten
ongeveer 5% twee ontwikkelde ovaria
° het linkerovarium is vastgehecht met een ligament (mesovarium) aan het craniale uiteinde van
de linkernier en bevat op het tijdstip van het uitkippen ongeveer 480.000 eicellen : hiervan zullen
er, bij gedomesticeerde vogelsoorten, slechts zo’n 250 tot 500 rijpen en ovuleren
° op elk ogenblik vindt men op het mature kippenovarium een hiërarchie van follikels in
ontwikkeling : gewoonlijk zijn er vier tot zes grote met dooier gevulde follikels (F1 tot F5 =
“hiërarchische follikels” = diameter 2 - 4 cm), een aantal kleinere follikels (“prehiërarchische
follikels” = diameter 6 – 12 mm) waarin de dooierafzet reeds gestart is en tenslotte een groot
aantal kleine witte follikels (diameter < 6mm)
° de postovulatoire follikel (p.o.f.) omvat de granulosa- en de thecacellagen en heeft een
metabole activiteit die in dalende lijn gaat : het heeft een functie bij het bepalen van het tijdstip
voor ovipositie en zou ook een invloed hebben op nestgedrag ; de p.o.f. is geen functioneel
analoog van het gele lichaam (corpus luteum) bij de zoogdieren ! De reproductiecycli bij de kip
worden dan ook gekarakteriseerd door opeenvolgende ovulatiecycli en niet door oestrale
(menstruele) cycli. Totale resorptie van de p.o.f. gebeurt na 8 tot 10 dagen (idem voor atretische
follikels).
° vorming van dooierproteïnen (de precursoren vittelogenine (VTG = fosfoglycoproteïne) en
“very low density lipoproteïne” (VLDL = hoofdzakelijk transportstof voor triglyceriden,
fosfolipiden en cholesterol)) vindt plaats in de lever onder invloed van gonadotropine en
steroïdhormonen. Na transport via de bloedbaan tot aan de ovariële follikels dringen ze doorheen
de basaalmembraan en de granulosacellaag tot bij de plasmamembraan van de oöcyt : transport
56
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
over deze membraan vindt plaats door binding op specifieke receptoren. De precursoren komen
terecht in de dooierkernen waar ze door proteolytische enzymen worden omgezet in verschillende
lipiden en proteïnen (fosvitine, lipovitelline, triglyceriden, cholesterol en fosfolipiden).
Gedurende het grootste deel van de groei van de dooier bestaat deze uit ongeveer 50% eiwit en
50% vet, maar gezien de uiteindelijke samenstelling (32,6% vet in de droge stof , tegenover
16,6% eiwit) moet in de laatste fase van de groei proportioneel méér vet worden opgeslagen (=
snelle groeifase). Vermoedelijk is de afzet van dooier voltooid 24 uur vóór ovulatie.
° aan de oviduct, die zich ontwikkelt uit het embryonale linkerkanaal van Müller, kan men
duidelijk vijf delen onderscheiden :
-
infundibulum : vangt de geovuleerde eicel op ; eventuele bevruchting vindt hier plaats ; eerste
laag albumine wordt afgezet ; verblijfsduur : 15 – 30 minuten
-
magnum : het grootste deel van het albumine wordt hier gevormd en afgezet ; verblijfsduur :
2 – 3 uur
-
isthmus : vorming van beide schaalmembranen en mogelijk ook begin van schaalvorming in
het distale deel ; verblijfsduur : 1 – 2 uur
-
schaalklier (of uterus) : vooraleer de schaal gevormd wordt neemt het reeds gevormde ei
zouten en vocht op in zijn albuminelaag (Eng. “plumping”) : het vocht bevat ondermeer zure
fosfatase, koolzuuranhydrase, bicarbonaat en een reeks ionen ; schaalvorming wordt
geïnitieerd door ovulatie en door bepaalde neuro-endocriene factoren die zowel ovulatie als
calciumsecretie controleren (van geen invloed zijn de distentie van de uterus door het ei, noch
de autonome innervatie van de schaalklier !); calcificatie begint traag, verloopt dan steeds
sneller tot een maximale afzet van 300 mg calcium/uur (gedurende 15 uren) en neemt daarna
weer geleidelijk af ; verblijfsduur : 18 – 26 uur
-
vagina : speelt geen rol meer bij de vorming van het ei maar wel bij de expulsie ; sommige
vogelsoorten beschikken over speciale structuren in de uterovaginale regio, waarin het
sperma voor korte tijd kan opgeslagen worden (7 tot 14 dagen bij de kip, tot 21 dagen en
langer bij de kalkoen !)
Transport van het ei doorheen de oviduct gebeurt door contracties van de spierwand na prikkeling
van de strekreceptoren door het passerend ei. Over de ganse lengte van de eileider zijn - en adrenerge receptoren aanwezig, die de motiliteit kunnen beïnvloeden.
57
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
2. Ovulatie – ovipositie cycli.
° de ovulatie-ovipositie cyclus = periode van ovuleren van het ovum tot leggen van het ei :
bedraagt bij de gedomesticeerde kip ongeveer 24 – 28 uur ; eieren worden gelegd gedurende een
aantal opeenvolgende dagen (= sequentie), waarna een korte pauze van één of enkele dagen
wordt ingelast ; hoe langer de sequentie, hoe korter de ovulatie-ovipositie cyclusduur ; de periode
tussen de opeenvolgende ovulaties binnen één sequentie (Eng. “lag”) varieert en is voornamelijk
het gevolg van wisselende intervals tussen een ovipositie en een daaropvolgende ovulatie : toch is
er een algemene tendens tot het steeds later op de dag leggen van het ei in de loop van een
sequentie
° Opmerking 1 : ovulatieritme : dit wordt mede genetisch bepaald (evenals het ritme van
follikelgroei en –rijping), zodat hierop geselecteerd kan worden. Dit heeft een belangrijke
bijdrage geleverd tot de productiviteitsstijging in de leghennensector.
° Opmerking 2 : parthenogenese : de ontwikkeling van een individu uit een onbevruchte eicel,
komt frequent voor bij de kalkoen. In ongeveer 32 – 49% van de onbevruchte eieren ontwikkelen
zich embryo’s, maar het merendeel daarvan sterft voortijdig af. Een deel ontwikkelt zich tot
leefbare (homozygote, diploïde) mannelijke dieren die vaak ook vruchtbaar zijn. Oorzaak is het
uitblijven van een mitose na de meiose-fase van de oöcyt (en dus handhaving van het diploïde
stadium). Bij de kip komt parthenogenese veel minder vaak voor.
2. Ovariële hormonen.
° hiërarchische follikels : steroïdproductie vindt plaats in de granulosa- en thecacellagen :
-
granulosacellen : produceren hoofdzakelijk progesteron, dat dient als precursor voor de
synthese van androsteendion en testosteron door de thecacellen (en in mindere mate ook door
de granulosacellen)
-
theca interna-cellen : produceren hoofdzakelijk androsteendion
-
theca externa-cellen : produceren hoofdzakelijk oestrogenen
De hormoonsynthese staat hoofdzakelijk onder invloed van LH en gebeurt via het
adenylaatcyclase-cAMP-second messenger-systeem.
Daarentegen zal activatie van het diacylglycerol-proteïnekinase C-second messenger-systeem de
LH-geïnduceerde synthese van steroïdhormonen afremmen : dit vindt plaats o.a. in de F1follikels. Factoren die verantwoordelijk zijn voor deze activatie zijn o.a. groeifactoren (bvb.
TGF = transforming growth factor, EGF = epidermal growth factor) en prostaglandines. In de
58
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
F1-follikels gaat bovendien de LH-geïnduceerde omzetting van progesteron in androsteendion
door de thecacellen zeer sterk afnemen. Hierdoor wordt een maximale progesteronsecretie
bekomen op het ogenblik van de preovulatoire LH-piek.
Arachidonzuur kan optreden als bijkomende hormoon-geïnduceerde second messenger : het
inhibeert de LH-geïnduceerde productie van progesteron door de granulosacellen van de F1follikel.
Tenslotte zijn een aantal ionen (bvb. Ca2+, Na+, K+ en Cl-) en ionkanalen noodzakelijk om
steroïdproductie door de granulosacellen mogelijk te maken.
° prehiërarchische follikels en ovarieel stroma : steroïdproductie vindt plaats in de thecacellaag
van prehiërarchische follikels en in het ovarieel stroma van zowel prepuberale als geslachtsrijpe
kippen. De granulosacellen van deze follikels daarentegen zijn niet in staat progesteron te
synthetiseren. De hormoonsynthese staat hoofdzakelijk onder invloed van FSH.
° postovulatoire en atretische follikels : gedurende de eerste 15 uren na ovulatie daalt het
progesterongehalte van de postovulatoire follikel geleidelijk, hoewel het adenylaatcyclase nog
minstens 24 uur na ovulatie in de follikel aantoonbaar blijft.
° niet-steroïdale hormonen en groeifactoren :
-
prostaglandines E en F werden aangetoond in pre- en postovulatoire follikels (hoewel
prostaglandine-synthese in vitro niet gestimuleerd wordt door gonadotropines)
-
noradrenaline (of norepinefrine, NE) en in mindere mate adrenaline (of epinefrine, E) en
dopamine worden hoofdzakelijk teruggevonden in de thecacellaag van preovulatoire follikels
(weefselspiegel bereikt piekwaarde ongeveer 6 – 9 uur vóór ovulatie)
-
vaso-intestinaal peptide (VIP) bevindt zich in de zenuwuiteinden ter hoogte van de
thecacellaag : vermoedelijk heeft het een invloed op de granulosacellaag via het
adenylaatcyclase-cAMP-second messengersysteem : zo stimuleert het de steroidogenese en
de plasminogeenactivator-activiteit in granulosa- en thecacellen van de F1-follikel. Daarnaast
stimuleert het de differentiatie en onderdrukt het de atresie (via apoptose) van
prehiërarchische follikels.
-
arginine vasotocine en mesotocine worden gesynthetiseerd in theca- en granulosacellen van
hiërarchische follikels
-
verschillende lokaal geproduceerde groeifactoren en hun receptoren spelen (via paracrien
effect) een rol bij het regelen van de werking van de ovaria : TGF en zijn receptor, TGF,
EGF-receptor, NGF (nerve growth factor) en zijn (p75)receptor, stamcelfactor en zijn
receptor, IGF-I (insulinlike growth factor),…
59
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
4. Beïnvloeding van ovulatie door hormonale en fysiologische factoren.
° in de periode tussen het uitkomen uit het ei en de eerste leg treedt een vroege LH-piek op aan
de leeftijd van ongeveer 1 week. Vanaf 15 weken ouderdom start de prepuberale LH-stijging : dit
hormoon bereikt zijn hoogste waarde 3 weken vóór de geslachtsrijpheid. Op dag 3,5 van de
incubatie kan reeds ovariële steroidogenese worden aangetoond. Plasma-oestrogeenconcentraties
nemen toe van 100 pg/ml op 6 weken vóór de leg tot piekwaarden van 350 pg/ml op 2 – 3 weken
vóór de leg : op het ogenblik van de eerste leg zijn is de concentratie weer gedaald tot zijn basale
waarde (100 – 150 pg/ml). Plasma-progesteronconcentraties blijven laag (0,1 – 0,5 ng/ml) tot
ongeveer één week vóór de eerste leg, dan stijgen de concentraties tot 0,4 – 0,6 ng/ml. Tot de
ouderdom van 16 – 18 weken reageert het ovarium van de kip niet op stimulatie met zoogdiergonadotropines of hypofysaire extracten. Bij het aanbreken van de geslachtsrijpheid wordt de
hypofyse ook minder gevoelig voor LH-RH, waarschijnlijk ten gevolge van een negatieve
feedback door de toenemende ovariële steroidproductie.
° bij het geslachtsrijpe dier in leg vindt ovulatie plaats binnen de 15 tot 75 minuten na ovipositie
(dit geldt uiteraard niet voor de eerste ovulatie van een sequentie) : uitgestelde of vervroegde
ovipositie heeft geen invloed op dit tijdsinterval! Ovulatie treedt op door ruptuur ter hoogte van
het folliculair stigma : macroscopisch is dit een bleke band van 2 – 3 mm breed, die weinig of
geen bloedvaten bevat. Bij dit proces zijn verschillende factoren, zoals proteolytische enzymen
(bvb. collagenase, plasminogeen activator) en vasoactieve substanties, betrokken.
° beïnvloeding door hormonen :
-
LH-releasing hormoon : hiervan bestaan bij vogels twee vormen (LH-RH-I en LH-RH-II),
maar waarschijnlijk is enkel het LH-RH-I betrokken bij de secretie van LH
-
LH : de plasmaspiegel van dit hormoon bereikt piekwaarden 4 tot 6 uur vóór ovulatie.
Daarnaast treedt ook een bijkomende LH-piek op bij het inzetten van de duisternis (Eng.
“crepuscular peak”) : dit gebeurt om de 24 uur en geeft waarschijnlijk het signaal voor de
daaropvolgende preovulatoire LH-piek. De respons van het ovarium na injectie van LH bij
kippen in de leg is afhankelijk van het stadium in de sequentie : gebeurt het 14 tot 11 uur vóór
de eerste ovulatie in een sequentie dan treedt premature ovulatie op ; LH-injectie juist vóór
een midsequentiële ovulatie resulteert in atresie van de follikel en dus geblokkeerde ovulatie
-
FSH : de plasmaspiegel van dit hormoon stijgt 15 uur vóór ovulatie, terwijl gelijktijdig een
verhoogde binding van dit hormoon op het ovarieel weefsel plaatsneemt. Het speelt een rol
60
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
bij de differentiatie van de granulosacellen en het induceert steroidogenese in granulosacellen
van prehiërarchische follikels (zie hoger)
-
progesteron : 6 tot 4 uur vóór de ovulatie bereikt de plasmaspiegel van progesteron zijn
hoogste waarde : dit valt samen met de preovulatoire LH-piek (tussen beide hormonen bestaat
een positief feedbackmechanisme) en is voornamelijk het gevolg van de sterk gestegen
progesteronproductie door de grootste preovulatoire follikel (F1). Progesteron circuleert in de
bloedbaan gebonden aan proteïnen zoals het albumine of andere -globulinen. Het bindt op
specifieke receptoren die teruggevonden worden ter hoogte van de hypothalamus, de
hypofyse, de oviduct (rol van progesteron bij productie van avidine, contractie van het
myometrium en schaalvorming !) en de preovulatoire follikel. Het voorkomen van
progesteronreceptoren in de nabijheid van het stigma op de preovulatoire follikel doet
vermoeden dat het hormoon een direct effect op de ovulatie heeft.
-
androgenen : piekwaarden in de testosteronspiegel treden op 10 tot 6 uur vóór ovulatie en dit
ten gevolge van secretie van dit hormoon door de (vier) grootste preovulatoire follikels. Zijn
rol bij de ovulatie is nog niet helemaal opgehelderd, aangezien ovulatie ook kan optreden
zonder een preovulatoire stijging van het plasmatestosteron. Behandeling met testosteron
induceert ovulatie in vitro maar niet in vivo (tenzij in abnormaal hoge concentraties
toegediend), terwijl toediening van antitestosteronserum in vivo wel de ovulatie blokkeert.
Androgeenreceptoren komen voor op de granulosa- en thecacellen van prehiërarchische en
hiërarchische follikels : de androgenen spelen hier een rol bij de steroidogenese en de
plasminogeenactivator-activiteit via een paracrien-autocrien effect. Net als bij het mannelijk
dier zijn de androgenen verantwoordelijk voor de groei en verkleuring van de kam en de
lellen bij geslachtsrijpheid en induceren ze, samen met de oestrogenen, de ossificatie ter
hoogte van de mergzone van de beenderen.
-
oestrogenen : zowel 17-oestradiol als oestron bereiken plasma-piekconcentraties 6 tot 4 uur
vóór de ovulatie, terwijl een kleinere stijging in de oestrogeenspiegel plaatsneemt 23 tot 18
uur vóór de ovulatie. De grootste oestrogeenpiek is het gevolg van een stijging in
oestrogeensecretie door de vier grootste preovulatoire follikels en voornamelijk door de
prehiërarchale follikels. evenmin als testosteron heeft oestrogeen een direct effect op de LHsecretie of de ovulatie : ovulatie kan immers optreden zonder voorafgaande oestrogeenpiek.
Wel zijn oestrogenen (esamen met progesteron) nodig om hypothalamus en hypofyse voor te
bereiden, zodat progesteron de vrijstelling van LH kan induceren. Daarnaast spelen ze ook
een rol bij een hele reeks andere processen in verband met reproductie : regulatie van het
calciummetabolisme voor de schaalvorming ; inductie van progesteronreceptoren ter hoogte
61
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
van ovarium en voortplantingstractus ; inductie van synthese van ovalbumine, conalbumine,
ovomucoid en lysozyme in de oviduct ; inductie van de synthese van vitellogenine in de lever
; controle over kleur en vorm van pluimage ; controle over sexueel gedrag en beïnvloeding
van de sexuele differentiatie van de hersenen.
-
corticosteron : plasmaconcentraties van dit hormoon vertonen zowel een circadisch
(fotoperiodisch) ritme als een piekwaarde tijdens ovipositie. De invloed ervan op de ovariële
processen is echter nog niet helemaal opgehelderd, aangezien zowel faciliterende als
inhiberende werkingen werden vastgesteld.
-
prolactine : secretie van dit hormoon door de hypofysevoorkwab staat hoofdzakelijk onder
de stimulerende controle van het VIP. Tijdens de ovulatie-ovipositiecyclus van de kip in leg
bereikt prolactine zijn hoogste waarde 10 uur vóór, en zijn laagste waarde 6 uur vóór, de
ovulatie. Toch speelt dit hormoon waarschijnlijk geen rol bij het ovulatieproces zelf. Wel
heeft het een invloed op ouderlijk gedrag en vermoedelijk is het betrokken bij de
osmoregulatie (voornamelijk bij mariene vogelsoorten). Receptoren voor prolactine worden
teruggevonden ter hoogte van de mucosa van de krop, de lever, de hersenen, het ovarium en
de oviduct. Langdurig verhoogde prolactinespiegels, zoals die optreden bij het moederdier
tijdens incubatie, hebben een antisteroidogeen effect op het ovarium, doen de
hypothalamische GnRH-spiegels dalen en inhiberen LH-secretie.
-
andere factoren : (1) prostaglandinen : de secretie van PGF2 door de F1-follikels bereikt
een piekwaarde
rond het
tijdstip van
ovulatie
–
PGE1 en
PGE2 stimuleren
plasminogeenactivator-activiteit in de follikels : mogelijk spelen ze aldus een rol bij de
enzymatische ruptuur van het stigma, maar noodzakelijk voor het optreden van ovulatie zijn
ze niet ; (2) serotonine : toediening blokkeert ovulatie waarschijnlijk via een inhibitie van de
LH-release ; (3) catecholaminen : spelen vermoedelijk een rol bij het ovulatieproces,
aangezien
intrafolliculaire
injectie
van
een
catecholamine-synthese-inhibitor
(-
methylmetatyrosine) of van een -adrenerge blocker (fentolamine, dibenzyline) de ovulatie
inhibeert
° beïnvloeding door licht : ovariële ontwikkeling en eileg worden schijnbaar het meest
gestimuleerd door een fotoperiode van steeds toenemende lengte (bvb. lente in het noordelijk
halfrond) : toepassing van een steeds langere fotoperiode vanaf het ogenblik van uitkomen uit het
ei tot de leeftijd van 18 weken vervroegt het tijdstip van de eerste eileg met 2 tot 3 weken,
vergeleken met vogels waarbij een fotoperiode van constante lengte werd toegepast. Maximale
fotostimulatie treedt doorgaans op bij een fotoperiode van 12 tot 14 uur licht, hoewel de
gedomesticeerde kip ook bij constante duisternis zal blijven leggen (weliswaar meer sporadisch).
62
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
(zie ook : Belichtingsschema’s voor mestkuikens.)
° fotorefractorische periode : na beëindiging van de seizoensgebonden reproductieperiode komt
een mechanisme op gang dat ervoor zorgt dat de pas uitgekomen jongen onder optimale condities
kunnen opgroeien. Tijdens deze periode reageert het voortplantingsstelsel niet meer op het,
normaal stimulerend, effect van toenemende daglengte. Gewoonlijk wordt deze periode ingeleid
door een aantal dagen waarop het lang licht blijft. Vermoedelijk is de hypothalamus
verantwoordelijk voor het optreden van een fotorefractorische periode : er werd aangetoond dat
de gevoeligheid van de hypothalamus voor de negatieve feedback-effecten van de
geslachtssteroïden toeneemt naarmate het broedseizoen vordert, terwijl de concentratie aan LHRH daalt.
° rui : deze periode gaat gepaard met een volledige regressie van de voortplantingsorganen en het
stopzetten van de leg. Bij de gedomesticeerde kip treedt rui op na ongeveer 1 jaar eileg. De
fysiologische mechanismen die verantwoordelijk zijn voor het optreden van rui zijn nog niet
helemaal opgehelderd, maar waarschijnlijk spelen de hypofyse, de bijnieren en voornamelijk de
schildklieren er een rol in (inductie van rui door injectie van thyroxine). Plasmaconcentraties van
prolactine, groeihormoon, LH en ovariële steroïden zijn lager bij het dier in rui dan bij het
leggende dier. Plasmaconcentraties van corticosteron, testosteron en triiodothyronine (T3)
daarentegen stijgen in de loop van de ruiperiode.
5. Ovipositie.
De expulsie van een ei (eileg of ovipositie) vereist de relaxatie van de buikspieren en van de
sfincter tussen schaalklier en vagina, tesamen met een contractie van de spierwand van de
schaalklier. Verschillende factoren spelen hierbij een rol :
-
neurohypofysaire hormonen : oxytocine en arginine vasotocine (wordt ook door het
ovarium zelf geproduceerd) veroorzaken premature ovipositie bij de kip. Beide hormonen
voeren deze werking waarschijnlijk uit via prostaglandines.
-
prostaglandines : exogene toediening van PGF2 stimuleert de contractiliteit van de
schaalklier, relaxeert de vagina en induceert premature ovipositie. Ook PGE 1 induceert
voortijdige eileg, terwijl toediening van een PGE1-antiserum de ovipositie uitstelt.
Prostaglandines mediëren vermoedelijk de activiteit van arginine-vasotocine (arg-vasotocine
stimuleert de synthese en vrijstelling van PG’s door de schaalklier). In de grootste
preovulatoire follikel stijgen de concentraties aan PGE en PGF vanaf 6 – 4 uur vóór de
verwachte ovulatie ; de concentratie aan PGF stijgt postovulatoir tot een 100-voudige waarde
63
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
en bereikt deze 2 uur vóór de volgende ovulatie. Zoals eerder vermeld behoren TGF en
TGF tot de factoren die de PG-productie door de granulosacellen regelen. Op de
membranen van de gladde spiercellen in de wand van de schaalklier werden specifieke
receptoren teruggevonden voor het binden van PGF2 en arginine vasotocine.
-
postovulatoire(p.o.) follikel : verwijdering van de meest recente p.o.follikel resulteert in een
uitgestelde ovipositie en dit met één tot zeven dagen. Vermoedelijk ligt een verwijdering van
bepaalde factoren die door de granulosacellaag geproduceerd werden (mogelijk peptiden die
analoog of identiek zijn aan de neurohypofysaire hormonen of aan de PG’s) aan de basis
hiervan.
-
pre-ovulatoire(pr.o.) follikel : verwijdering van de meest rijpe pr.o.follikel resulteert in een
uitgestelde ovipositie van het ei dat zich in de schaalklier bevindt (dit uitstel is wel minder
lang dan na verwijdering van de p.o.follikel).
-
andere factoren : (1) corticosteron : plasmaspiegel stijgt zeer sterk op het ogenblik van de
ovipositie, en deze piek vindt steeds plaats op hetzelfde tijdstip zelfs indien de ovipositie
voortijdig geïnduceerd (d.m.v. vasopressine) of uitgesteld (d.m.v. verwijdering van de
p.o.follikel) wordt – toch toont dit nog onvoldoende het bestaan van een causaal verband
tussen corticosteronsecretie en ovipositie-inductie aan ; (2) adrenaline en noradrenaline :
beïnvloeden de contractiliteit van de schaalklier, maar hun invloed op het ovipositie-tijdstip is
nog onduidelijk ; (3) acetylcholine, histamine, pentobarbital, lithium,… induceren premature
ovipositie, maar de mechanismen hiervoor zijn nog niet opgehelderd.
Broedsheid en nestgedrag : onder de term “broedsheid” wordt begrepen het stoppen van de
eiproductie, de incubatie van het (de) gelegde ei(eren) en de zorg voor het (de) jong(en). Bij
aanvang van deze periode treedt, onder invloed van prolactine, een regressie op van het ovarium
en van de secundaire geslachtsorganen en –kenmerken zoals oviduct en kam. In de moderne
industrie komt broedsheid bij leghennen haast niet meer voor, maar het wordt wel nog opgemerkt
bij Bantam kippen en mestkuikenmoederdieren, terwijl het bij de kalkoen zelfs een frequent
verschijnsel is. Broedsheid gaat gewoonlijk gepaard met het ontwikkelen van een broedvlek
(Eng.”incubation patch” of “brood patch”) d.i. een huidvlek vooraan op de borst met uitgesproken
doorbloeding, oedeem en verdikking van de epidermis en dit onder invloed van oestrogenen en
prolactine. Op hormonaal niveau stijgt de plasmaspiegel aan prolactine en daalt de spiegel aan
LH, progesteron, testosteron en oestradiol tijdens de broedsheid, terwijl de concentratie aan
groeihormoon enkel lager is in de periode waarbinnen er voor de jongen gezorgd wordt. Bij
64
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
vogelsoorten waar het mannetjesdier de predominante rol speelt bij het uitbroeden van de eieren
is de prolactine-concentratie hoger bij het mannetje dan bij het vrouwtje.
Opmerking : factoren die de instaan voor de controle over de prolactine-spiegel : deze omvatten
zowel externe (fotoperiode, omgevingstemperatuur, aanwezigheid van nest, eieren en/of jongen)
als interne (hormonale) factoren :
° In de moderne leghennenindustrie worden externe factoren zoveel mogelijk uitgeschakeld, maar
toch kan dit het optreden van broedsheid niet volledig uitsluiten. Gedurende de legperiode stijgt
de plasma-prolactinespiegel geleidelijk en kan mogelijk een kritieke drempelwaarde bereiken
waarbij de ovariële functie onderdrukt wordt. Op het einde van de legperiode dalen de
prolactinespiegels opnieuw, vermoedelijk ten gevolge van het dalend aantal snel groeiende
follikels en daardoor een daling van de oestrogeenproductie (wegvallen van de faciliterende
werking van oestrogenen op de vrijstelling van prolactine). Het is nog niet opgehelderd of het
optreden van broedsheid een rechtstreekse respons is op de prolactinetoename, of dat dit eerder
een gevolg is van een progressieve verlaging van een prolactine-afhankelijke neurale drempel
voor een waaier aan stimuli (zijnde omgevingsfactoren die het optreden van broedsheid
stimuleren).
° Bij de hormonale controle zijn twee neuropeptiden, thyrotropine-releasing hormoon (TRH) en
vasoactief intestinaal polypeptide (VIP), en twee neurotransmittors, dopamine (DA) en serotonine
(5TH), betrokken. VIP, TRH en 5HT hebben een stimulerend effect, DA kan zowel stimulerend
als inhiberend zijn. DA werkt vermoedelijk rechtstreeks op de hypofyse, TRH en 5HT
daarentegen oefenen hun invloed waarschijnlijk uit via het moduleren van de VIP-vrijstelling
door de hypothalamus. In vitro-studies toonden aan dat dit VIP een krachtige “releaser” was van
prolactine door de hypofysevoorkwabcellen bij kalkoenen.
° Eens gestart is met het uitbroeden van de eieren wordt verdere prolactinesecretie hierdoor
gestimuleerd, wat op zijn beurt weer leidt tot een versterking van het broedgedrag (= positieve
feedback!). Hoge prolactineconcentraties onderdrukken de voederopname en de vrijstelling van
gonadotropines (o.a. van progesteron : op die manier wordt ook de positieve feedback van
progesteron op de vrijstelling van LH onderdrukt).
° Onderbreking en/of preventie van broedsheid : in de leghennenindustrie worden kippen die op
het punt staan broeds te worden afgezonderd in kooien met draadbodem, waar ze ruime toegang
tot voeder en water krijgen en een hoge lichtintensiteit toegepast wordt, dit alles met het oog op
een verminderen van de prolactinesecretie. Ook een farmacologische behandeling is mogelijk :
(1) behandeling van broedende kalkoenen met 5HT-synthese-inhibitor roept een halt toe aan het
65
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
nestgedrag en doet de eileg hervatten ; (2) behandeling met pimozide, een dopaminereceptorblocker, heeft hetzelfde effect als (1), terwijl behandeling met bromocriptine, een dopamineagonist, de broedsheid stimuleert.
6. Vorming en samenstelling van dooier, albumen, organische matrix en eischaal.
° eidooier :
-
voert de lipiden en (een deel van de) proteïnen aan die noodzakelijk zijn voor de groei van het
embryo in ovo (d.w.z. in het ei). Bij de kip is de samenstelling als volgt : 48% water, 33%
lipiden, 17% proteïnen, 0,2% koolhydraten en 1% anorganische componenten. De lipiden
omvatten (ongeveer) 70% triacylglycerolen, 25% fosfolipiden en 5% cholesterol(esters). De
dooier wordt gewoonlijk in concentrische lagen afgezet als gevolg van de schommelingen in
dagelijkse voederopname.
-
de dooier is omgeven door een zeer dun acellulair vlies, de vitelliene membraan. Deze bestaat
eigenlijk uit vier laagjes, waarvan de twee binnenste nog van ovariële oorsprong zijn (zona
radiata en perivitelliene laag). De twee buitenste laagjes worden toegevoegd na de ovulatie.
Op het oppervlak van de dooier bevindt zich een klein bleek vlekje (blastodiscus) : hier treedt
deling op van de embryonale cellen wanneer het ei bevrucht werd.
° albumen (eiwit) :
-
opgelet : er is geen stapeling van eiwitten, maar wel een intense synthese die hoofdzakelijk
onder controle van steroïdhormonen staat !
-
in het albumen kunnen vier lagen onderscheiden worden : de chalazifere laag of binnenste
dikke laag (vastgehecht aan de dooier : komt overeen met de twee buitenste laagjes van de
vitelliene membraan), de binnenste dunne vloeibare laag, de buitenste dikke laag en de
buitenste dunne vloeibare laag. Functie van de albumenlaag is het beschermen van de dooier
tegen indringen van micro-organismen en het aanvoeren van de noodzakelijke elementen
(water, proteïnen en mineralen) voor de ontwikkeling van het embryo. Een aparte structuur
binnen het albumen zijn de chalazae : dit zijn twee vezelachtige strengen beiderzijds van de
eidooier die een wel beperkte rotatie maar haast geen laterale verplaatsing van de eidooier
binnen het ei toelaten.
-
de eerste lagen van het albumen bij de kip worden reeds gevormd in het caudale deel van het
infundibulum, maar het overgrote deel van de eiwitproteïnen is afkomstig van de tubulaire
kliercellen van het magnum (uitz. : avidine wordt geproduceerd door slijmbekercellen in het
magnum). Ook binnen de afzonderlijke albumenlagen kunnen min of meer duidelijke
66
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
concentrische lagen onderscheiden worden : dit is het gevolg van (1) het afzetten van de
verschillende lagen door opeenvolgende regio’s van het magnum of van (2) het optreden van
veranderingen tijdens het “plumping”proces in de schaalklier (zie verder) en tijdens de
passage van het ei doorheen de oviduct.
-
de belangrijkste proteïnen in het albumen zijn : (1) ovalbumine : 54%, bron van AZ voor het
embryo, vermoedelijk ook onderdrukker van enzymactiviteit in het ei ; (2) ovotransferrine (of
conalbumine) : 13%, ijzerchelator d.w.z. bindt ijzer en verhindert daardoor bacteriële groei in
het ei ; (3) ovomucoïd : 11%, belangrijkste inhibitor van protease-activiteit in het ei –
targetenzymen zijn o.a. enzymen geproduceerd door binnendringende micro-organismen ; (4)
ovoglobulines : 8% ; (5) lysozyme : 3,5%, belangrijkste functie is de lytische activiteit tegen
de wand van Gram-negatieve bacteriën ; (6) - en -ovomucine : 1,5 – 3%, onoplosbare
fibreuze proteïnen die aan het eiwit (voornamelijke de dikke lagen) zijn gelachtige
eigenschappen verlenen, tevens verhinderen zij het binnendringen van micro-organismen en
hebben ze mogelijk een antivirale werking. Andere karakterisitieke eiwitproteïnen komen in
kleinere concentraties voor : avidine, proteïnen die flavoproteïne en thiamine binden,
ovomacroglobuline en cystatine. Verschillende proteïnen binden specifieke substraten bvb.
ovotransferrine bindt ijzer, koper en zink ; flavoproteïne bindt riboflavine ; avidine bindt
biotine. Andere proteïnen treden op als protease-inhibitoren bvb. ovomucoïd, ovoinhibitor,
cystatine en ovomacroglobuline.
° schaalmembranen : een binnenste (50 – 70 m dik) en een buitenste (15 – 25 m dik)
membraan worden gevormd door de isthmus. Beide membranen liggen tegen elkaar aan, behalve
ter hoogte van de stompe pool van het ei, waar ze uiteenwijken om de luchtkamer te vormen. Dit
gebeurt pas na de leg, ten gevolge van de afkoeling van het ei met bijgevolg een lichte inkrimping
van de ei-inhoud. De schaalmembranen bestaan uit een vlechtwerk van proteïnevezels die
onderling ondermeer door disulfidebruggen met elkaar verbonden zijn. Op de vezels bevinden
zich kleine fibreuze knobbeltjes waarvan de functie onduidelijk is. De membranen zijn
semipermeabel en laten de passage van water, gassen en cristalloïden toe (niet van albumen).
° eischaal : bestaat uit een basisstructuur van proteïnevezels (= organische component van de
eischaal) waarbinnen zich de calciumcarbonaatkristallen (= minerale component van de eischaal)
gaan ontwikkelen. Beide componenten van de eischaal staan uiteraard in superpositie. De
minerale lagen staan in voor de mechanische sterkte van de eischaal en bestaan voor ongeveer
97% uit anorganisch materiaal : calcium is hierbij het meest voorkomende kation, maar ook
magnesium is in belangrijke mate vertegenwoordigd onder vorm van magnesiumcarbonaat.
67
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Mangaan tenslotte komt vnl. voor ter hoogte van de mamillae (zie verder), gezien zijn rol in de
synthese van mucopolysacchariden.
-
organische component : hier onderscheidt men drie delen : (1) de mamillaire laag :
opgebouwd uit konische protuberanties (mamillae) waarvan de brede basissen aan elkaar
raken en waarvan de punten bestaan uit vezels die sterk verweven zijn met de vezels van de
buitenste eischaalmembraan – bestaan grotendeels uit proteïnen, maar bevatten ook
koolhydraten en mucopolysacchariden – in het centrum van elke mamilla bevindt zich een
proteïnekern, de mamillaire kern (Eng. “mamillary core”) : dit is het punt waarop de
calcificatie van de schaal van start gaat (vorming van een mamillaire knobbellaag : zie
verder) ; (2) de spongieuze laag : opgebouwd uit collageenachtige vezels die parallel aan het
oppervlak van het ei gerangschikt zijn en waartussen later de calciumzoutkristallen zullen
neerslaan (vorming van een palissadelaag : zie verder) ; (3) de cuticula : wasachtige laag,
opgebouwd uit proteïnen, mucopolysacchariden en lipiden – functie is het verhinderen van
verdamping van water uit het ei en het beschermen van het ei tegen invasie door microorganismen.
-
minerale component : hier onderscheidt men eveneens drie delen : (1) de mamillaire
knobbellaag (Eng. “mamillary knob layer”) : wordt gevormd in de schaalklier tijdens de
eerste vijf uren van de calcificatiefase - ontstaat door afzetting van kristallen rondom de
mamillaire kernen – een deel van deze kristallen groeit radiair naar de buitenste
schaalmembraan toe en penetreert deze laatste, de kristallen die lateraal groeien kunnen
eventueel met elkaar versmelten en deze die in externe richting groeien kunnen het
schaaloppervlak bereiken – op sommige plaatsen versmelten de kristallen niet en laten ze
poriën open (zie verder) ; (2) de palissadelaag : wordt gevormd 5 tot 6 uur na aankomst van
het ei in de schaalklier – bestaat hoofdzakelijk uit calciumcarbonaatkristallen (calciet) die
zuilvormig gerangschikt zijn, met als basis de mamillaire knobbels – deze laag
vertegenwoordigt het grootste deel van de eischaal (dikte : 200 m) ; (3) oppervlaktekristallaag : dunne laag met een densere kristalstructuur dan de palissadelaag (dikte : 3 tot 8
m).
° eischaalporiën : diameter 0,3 tot 0,9 m ; tunnelvormige openingen die verlopen van de
oppervlakte van de eischaal tot aan de mamillaire knobbellaag (vertonen eventueel
zijvertakkingen, echter niet bij de kip). Hun aantal staat doorgaans in relatie tot de metabole
vereiste van het embryo in de periode vóór de ademhaling via het longen-luchtzaksysteem in ovo
(gemiddeld 7000 – 15.000, dichtheid 70 – 200/cm2, aantal het grootst ter hoogte van de stompe
pool en dit in verband met de vorming van de luchtkamer). Ze laten gasuitwisseling toe tussen het
68
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
embryo en het externe milieu : de uitwisseling van waterdamp, zuurstof en koolstofdioxide
gebeurt voornamelijk via passieve diffusie (bvb. kalkoenei wisselt een equivalent van 27 liter gas
uit tijdens de 28 dagen durende incubatieperiode) – de beide schaalmembranen spelen slechts een
ondergeschikte rol bij het beperken van deze gasuitwisseling, de grootste weerstand bevindt zich
ter hoogte van het interne uiteinde van de poriën. Aan het schaaloppervlak zijn de poriën overdekt
door de cuticula – na verloop van tijd (na de leg) verschijnen barsten in deze beschermlaag, zodat
gasuitwisseling kan plaatsvinden (gevaar van het reinigen van bevuilde eieren : hierbij wordt ook
de beschermende cuticula verwijderd !).
° calciummetabolisme : de schaalklier transporteert 2 tot 2,5 g calcium in de periode van 15 uren
die nodig zijn voor de calcificatie van de schaal van één ei. Aangezien de totale bloedhoeveelheid
ongeveer 25 mg calcium bedraagt, betekent dit dat per uur vijf- tot zesmaal de totale
bloedhoeveelheid aan calcium in de schaal wordt afgezet! Een hen die in één productiejaar 280
eieren legt heeft op die manier een hoeveelheid calcium verbruikt die overeenkomt met 30 maal
de calciuminhoud van het ganse lichaam.
-
bronnen van calcium voor de eischaal : calcium wordt opgenomen uit de bloedbaan na
absorptie vanuit het intestinum (duodenum en voorste deel van het jejunum) of na resorptie
vanuit de beenderen (hfdz. medullair been, maar ook corticaal been in periodes van
calciumgebrek). Calciumresorptie vanuit de beenderen wordt geregeld via het parathormoon
en 1,25-dihydroxyvitamine D3, terwijl ook de intestinale absorptie gefaciliteerd wordt door
1,25-(OH)2D3. Het relatieve belang van beide calciumbronnen is afhankelijk van het aanbod
aan calcium in het dieet. Kippen nemen ongeveer 25% méér voeder op tijdens de periode van
eischaalvorming dan op andere dagen. Bij een concentratie van 3,6% calcium of meer in het
voeder komt het grootste deel van het calcium uit het intestinum, bij een concentratie van 2%
leveren de beenderen 30 tot 40% van het calcium voor de eischaalvorming en bij een
calciumvrij dieet is het beenderige skelet de hoofdbron van calcium. Men moet er evenwel
rekening mee houden dat deze verhoudingen variëren naargelang het tijdstip van de dag : het
grootste deel van de eischaal wordt immers gevormd gedurende de nacht, wanneer geen
voeder wordt opgenomen – het medullaire been vormt dan de hoofdbron van calcium
(ongeacht de calciumconcentratie in het voeder). In het bloed circuleert het calcium onder
twee vormen : het niet-diffundeerbare proteïne-gebonden calcium (d.w.z. gebonden aan
vitellogenine of albumine) en het diffundeerbare geïoniseerde calcium. Een aantal weken
vóór de aanvang van de leg stijgt het totaal plasmacalcium, en dit ten gevolge van een
toename van het proteïne-gebonden calcium. Tijdens de ovulatie-ovipositie-cyclus zelf treedt
69
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
weinig schommeling op in de totale calciumconcentratie in het plasma. Het toedienen van een
voeder dat arm is aan calcium veroorzaakt een significante daling van de plasmaconcentraties
aan geïoniseerd calcium, een significante daling of zelfs een volledig stopzetten van de leg en
een regressie van het ovarium binnen 6 tot 9 dagen. Onderzoek heeft evenwel aangetoond dat
ook bij deze dieren de synthese en vrijstelling van LH door de hypofyse en het vermogen van
het ovarium om te reageren op gonadotropines intact blijft : zo zullen kippen op een
calciumarm dieet die hypofysaire extracten toegediend krijgen toch blijven leggen. Wanneer
een kip in leg de vrije keuze krijgt tussen een calciumarm (1,0% calcium) en een calciumrijk
dieet, zal ze bij voorkeur het calciumrijke voeder opnemen tijdens de periode dat het ei-inwording zich in de schaalklier bevindt.
-
vitamine D-metabolisme : 25-hydroxyvitamine D3 wordt ter hoogte van de nieren door een 1hydroxylase omgezet in het metabolisch actieve 1,25-(OH)2-D3 : deze omzetting staat onder
de hormonale controle van oestradiol en PTH. De activiteit van dit renale hydroxylase stijgt
vóór de aanvang van de leg en op het ogenblik van de ovulatie in elke ovulatie-ovipositiecyclus, zodat de concentraties aan 1,25-(OH)2-D3 in de bloedbaan verhoogd zijn rond het
tijdstip van de eischaalvorming.
-
calciummobilisatie vanuit medullair been : het calcium dat in de eischaal wordt afgezet is
nooit enkel vanuit het voeder afkomstig. Gedurende periodes van intense calcificatie is de kip
immers niet in staat vlug genoeg calcium uit het intestinum te absorberen om aan de hoge
vraag te voldoen. Bij kippen die geslachtsrijp worden, vormt zich daarom (onder invloed van
oestrogenen en androgenen) tien tot veertien dagen vóór het leggen van het eerste ei een
bijzondere beendervorm in de mergholte van vnl. de lange beenderen (bvb. femur, tibia,
ribben, bekkenbeenderen) : het medullair been. De dagelijkse cyclus van calciummobilisatie
vanuit dit been is het gevolg van een regelmatige wijziging in activiteit van de verschillende
celpopulaties hier : (1) de osteoclasten, die instaan voor de beenafbraak, zijn het meest actief
tijdens de periode van schaalvorming, en (2) de osteoblasten, die been opbouwen, zijn actief
in de tussenliggende periodes. In de loop van de ovulatie-ovipositie-cyclus wisselen periodes
van intense beenvorming en periodes van uitgesproken beendepletie elkaar af. Dit wordt
mogelijk gemaakt door het patroon van hormonale veranderingen dat optreedt tijdens iedere
legcyclus. Zelfs wanneer de hoeveelheid calcium in het voeder toereikend is, gebeurt er een
calciummobilisatie vanuit het medullair been, maar deze mobilisatie is wel omgekeerd
evenredig met de calciuminhoud in het intestinum.
-
calciumabsorptie en –secretie door de schaalklier : het mechanisme dat de transfer van
calcium ter hoogte van het intestinum en de schaalklier regelt is nog niet volledig
70
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
opgehelderd. Zoals hoger vermeld speelt 1,25-(OH)2-D3 er een rol in, net als het
calciumbindend proteïne Calbindine-D28K. Dit laatste proteïne wordt teruggevonden in het
distale deel van de isthmus en in de tubulaire kliercellen van de schaalklier. Calciumsecretie
door de schaalklier neemt toe 7 uur na de ovulatie en bereikt een maximum tijdens de
eischaalvorming ( transportsnelheid : 140 mg/u). Nadien daalt de secretie weer en bereikt zijn
basale waarde nog vóór het ei uitgedreven is. Waarschijnlijk is de aanwezigheid van een ei in
de schaalklier niet de belangrijkste stimulus voor het op gang brengen van de calciumsecretie,
maar staat dit laatste eerder in verband met de ovulatie. Ook het verwijderen van het ei uit de
schaalklier is niet de aanzet tot de afname van de calciumsecretie, vermits die reeds inzet
ruim twee uren vóór het ei gelegd wordt. Het transport van calcium ter hoogte van de
schaalklier gebeurt zowel door diffusie als door actief transport en vereist energie.
-
vorming en afzetting van carbonaat : de eischaal bevat 97 – 98% calciumcarbonaat en
daarnaast nog magnesiumcarbonaat en tricalciumfosfaat. Het carbonaat is in geringe mate
afkomstig van het plasmabicarbonaat : het wordt hoofdzakelijk ter plaatse (in oviduct en
eischaal) gesynthetiseerd door carbo-anhydrase vanuit in het bloed opgelost CO2. Opmerking
: dit verklaart waarom bij zeer warm weer de eischaal onmiddellijk veel brozer wordt en
daardoor het aantal breukeieren toeneemt. Bovendien maakt dit duidelijk dat niet alle
schaalproblemen te verhelpen zijn door een overmaat aan calcium in het voeder. De
hoeveelheid calcium die in het lumen van de schaalklier gesecreteerd wordt is functioneel
gekoppeld aan de productie en de concentratie van HCO3- aldaar.
Opmerking : de hormonaal geregelde cyclische wijzigingen in de calciumabsorptiecapaciteit
leidde tot de zgn. “split-voederprogramma’s”: dit wil zeggen dat de hennen de keuze hebben
tussen twee of meer voeders tegelijkertijd. Het idee hierachter is dat de dieren hun voederkeuze
zullen aanpassen aan hun specifieke behoefte in relatie tot de schaalvorming. Door bovendien de
voeders zo samen te stellen dat een laag calciumgehalte gekoppeld is aan een hoog energie- en
proteïnegehalte en omgekeerd, kan men tijdelijke overconsumptie (nl. op ogenblikken van hoge
calciumbehoefte) onderdrukken. Uit experimenten met dergelijke keuzediëten bleek een betere
voederconversie (7% minder voeropname, 7% minder proteïnen, 9% minder energie in
vergelijking met een standaarddieet) doch een 14% hogere calciumopname en dit voor eenzelfde
eiproductie met een hoger gewicht per ei. Uiteraard is hiervoor een dubbele voederinstallatie
noodzakelijk en zullen dus ook economische overwegingen een rol spelen bij het al of niet
toepassen van dit systeem.
71
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
B. MANNELIJK DIER.
1. Anatomie van het voortplantingsstelsel.
° gepaarde testes (en hun afvoerwegen) liggen tegen de dorsale lichaamswand ; elke testis bestaat
uit een groot aantal anastomoserende zaadbuisjes (tubuli seminiferi) met daartussen interstitieel
weefsel (dit bevat bloed- en lymfevaten en de testosteronproducerende Leydigcellen). Bij
geslachtsrijpe dieren bevat het zaaddragend epitheel de zaadcellen-in-wording in verschillende
stadia van hun ontwikkeling. Deze stadia zijn sequentieel gerangschikt in een helix die zich
voortzet over de ganse lengte van de zaadbuisjes.
° de epididymis ligt tegen de dorsomediale zijde van de testis en omvat achtereenvolgens het rete
testis, de ducti efferentes, de verzamelbuisjes en tenslotte de ductus epididymidis (die op zijn
beurt uitmondt in de ductus deferens). Het laatste deel van de afvoerweg, de ductus deferens,
mondt uit op de top van een papilla in de urodeum-regio van de cloaca, vlak onder de uitmonding
van de ureter.
° accessoire organen : omvatten de paracloacale vasculaire lichaampjes, de dorsale
proctodeumklier en de lymfeplooien.
° tijdens de copulatie wordt een niet-intromittente fallus gevormd door eversie van opzwellend
lymfeweefsel doorheen de cloacale spleet.
° ontogenese van de voortplantingstractus : de ductus deferens ontwikkelt zich uit het embryonale
kanaal van Wolff. Rond dag 6,5 – 7 van de incubatie treedt differentiatie van de tot dan toe
indifferente gonaden op (dit gebeurt vóór de ontwikkeling van de hypofyse-gonaden-as, rond dag
13,5 van de incubatie !). Eens de testes gevormd , treedt regressie van de Müllerse kanalen op.
(zie ook : literatuuroverzicht voortplantingsfysiologie bij vogels)
2. Testiculaire ontwikkeling en begin van spermatogenese.
° gedurende de prepuberale groeifase nemen de testes weinig in omvang maar des te meer in
gewicht toe. De ongedifferentieerde Sertolicellen prolifereren en er wordt een groeiend aantal
spermatocyten type I geproduceerd, die echter degenereren na het zygoteen stadium.
° bij de start van de puberale fase nemen de testes zeer snel in omvang toe (groeisnelheid
proportioneel aan de derde macht van de somatische groeisnelheid). Onderzoek toonde aan dat bij
hemicastratie (wegnemen van één testis) de overblijvende testis een compensatoire groei
72
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
ondergaat zodat het uiteindelijke gewicht ervan even groot is als het gezamelijk gewicht van
beide testes bij de controledieren. Deze compensatoire groei is minder uitgesproken naarmate de
castratie op latere leeftijd plaatsgrijpt. Waarschijnlijk heeft dit te maken met de rijpingsgraad van
de Sertolicellen : deze zijn niet meer in staat tot mitosedelingen eens zij volledig gedifferentieerd
zijn (het proces van differentiatie zet niet bij alle Sertolicellen tegelijk in, maar verloopt gradueel
over de ganse lengte van het seminifere epitheel)
° in de tweede helft van de puberale fase wordt de spermatogene activiteit veel groter en worden
de eerste spermatiden en spermatozoa geproduceerd (en dit op die plaatsen van het epitheel waar
de Sertolicellen reeds volledig gedifferentieerd zijn). Het aantal actieve kiemcellen groeit snel en
bereikt een maximum op het einde van de testiculaire groeifase.
3. Rijping van de spermatozoa.
° dit proces vertoont belangrijke verschillen met het rijpingsproces van de spermatozoa bij de
zoogdieren :
-
de epididymis is niet gekronkeld noch opgedeeld zoals bij de zoogdieren
-
de ductus deferens fungeert als reservoir voor het geproduceerde sperma (bij de zoogdieren :
epididymis); er zijn geen accessoire geslachtsklieren (bij de zoogdieren zijn één of meerdere
van de volgende klieren aanwezig : bulbourethrale klieren of Cowperklieren, zaadblaasjes,
prostaat en urethrale klieren): het zaadvocht bestaat uit de secreties van het epitheel van de
ganse voortplantingstractus (vanaf het seminifere epitheel in de testes tot het distale uiteinde
van de ductus deferens)
-
enkele verschillen tussen bloedplasma en seminaal plasma van haan en kalkoense haan
werden in onderstaande tabel weergegeven :
bloedplasma
seminaal
plasma seminaal
plasma
haan
kalkoense haan
proteïnen (g/l)
50
8
22 – 27
glucose (mmol/l)
10
0,19
-
glutamaat (mmol/l)
0,2
75
81 – 88
Cl- (mmol/l)
121
46
23 – 31
K+ (mmol/l)
6
13
17 – 27
Na+ (mmol/l)
145
145
136 – 144
73
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
de gevormde spermatozoa bereiken hun maximale bewegingscapaciteit pas ter hoogte van de
ductus deferens
-
testiculaire spermatozoa zijn onvruchtbaar wanneer ze intravaginaal ingebracht worden, maar
wel vruchtbaar wanneer ze rechtstreeks in het magnum worden geïnsemineerd ; bovendien
zijn zowel spermatozoa uit de epididymis als uit de ductus deferens fertiel (bij de zoogdieren
: sperma genomen uit testes of proximaal deel van de epididymis is sterk infertiel) :
vermoedelijk kunnen de spermatozoa bij de vogels zelfs na de ejaculatie nog het stadium van
functionele maturiteit bereiken, wanneer ze zich reeds in de vrouwelijke geslachtstractus
bevinden
4. Spermatogenese : hormonale controle, productiesnelheid.
° de precieze hormonale mechanismen die betrokken zijn bij de spermatogenese bij de haan zijn
nog niet volledig gekend, maar men neemt aan dat :
-
FSH instaat voor de controle over groei en differentiatie van de tubuli seminiferi
-
LH de Leydigcellen beïnvloedt : deze cellen produceren de steroïdhormonen, vnl. testosteron
en androsteendion (LH-concentraties bij de haan bedragen op de leeftijd van 3 tot 5 weken 5
– 6 ng/ml, dalen daarna tot 3 ng/ml op de leeftijd van 8 tot 10 weken en stijgen tijdens de
puberale fase weer tot 5 – 10 ng/ml)
-
testosteron- en androsteendionconcentraties gestegen zijn in de laatste stadia van de
spermatogenese en bij de aanvang van de zaadproductie ; de stijgende testosteronspiegel
stabiliseert zich pas op de leeftijd van 35 – 36 weken
-
het jonge dier méér gevoelig is voor de negatieve feedback uitgeoefend door testosteron op
de LH-secretie dan de volwassen haan (Eng. “gonadostat hypothesis” : geleidelijke
verandering in gevoeligheid van de hypothalamus voor negatieve feedbacks in de loop van de
ontwikkeling tot geslachtsrijpheid)
° de dagelijkse spermaproductie (Eng. “DSP”= daily sperm production) is het totaal aantal
spermatozoa geproduceerd per dag door beide testes ; de dagelijkse sperma-output (Eng. “DSO”=
daily sperm output) is het totaal aantal spermatozoa dat gecollecteerd wordt binnen een bepaalde
periode en nadien als hoeveelheid/dag uitgedrukt wordt. Deze laatste telmethode is niet alleen
afhankelijk van het werkelijk geproduceerde aantal spermatozoa, maar ook van bepaalde
technische factoren (bvb. handelingen uitgevoerd bij het verzamelen van het sperma, frequentie
waarmee zaad gecollecteerd wordt enz…), die geen verband houden met het dier zelf.
74
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° semenvolume + concentratie van spermatozoa (geteld met o.a. hemocytometer of coulter
counter) = aantal spermatozoa per ejaculaat
° schattingen van DSP tonen aan dat er een sterke correlatie bestaat met het testiculair gewicht en
met het aantal Sertolicellen in het testisweefsel. Deze staan op hun beurt in verband met de
hormonale status tijdens de groei en ontwikkeling van het dier tot het stadium van
geslachtsrijpheid.
5. Spermatransport in de vrouwelijke geslachtstractus.
° motiliteit, overleving en opslaan van sperma : voor de spermatozoa betekent de uterovaginale
junctie een belangrijke barrière op hun weg naar de oviduct. Bepaalde factoren uit de vagina of de
uterovaginale junctie kunnen de spermamotiliteit rechtstreeks beïnvloeden , of kunnen de
spermatozoa laten agglutineren via bvb. een immunologische reactie, waarbij “herkenning” van
bepaalde oppervlaktefactoren meespeelt. Om dit te ontwijken wordt het sperma opgeslagen in
zgn. spermareservoirs (Eng. “sperm storage tubules”) die zich ter hoogte van de uterovaginale
junctie of in het infundibulum bevinden. Bij de spermatozoa die in deze reservoirs terechtkomen
kan geen immuunrespons worden aangetoond, ofwel omdat ze zelf niet antigeen zijn, ofwel
omdat de tubuli immunologisch incompetent zijn.
Enkel fertiel sperma krijgt toegang tot de zaad-opslagbuisjes. Oppervlaktefactoren schijnen geen
rol te spelen bij het al of niet toegelaten worden tot de reservoirs, maar zouden wel bepalend zijn
voor het al of niet ter plaatse mogen blijven. Bovendien blijken ze een significant effect te hebben
op het transport van de spermatozoa over de uterovaginale barrière heen : verwijdering van de
oppervlaktefactoren blijkt immers geen effect te hebben op de fertiliteit van het sperma wanneer
dit voorbij de uterovaginale junctie ingebracht wordt. De oppervlaktefactoren schijnen dus ook
niet betrokken te zijn bij verschillende fenomenen zoals capacitatie of sperma-eicel-binding, zoals
bij de zoogdieren wel het geval is.
Bij de spermatozoa die in de reservoirs terechtkomen kan geen immuunrespons worden
aangetoond, ofwel omdat ze niet antigeen zijn, ofwel omdat de tubuli immunologisch
incompetent zijn.
Het opslaan van sperma in de zaadreservoirs is er de oorzaak van dat de kip nog tot tien dagen (en
de kalkoense hen nog tot 30 – 40 dagen) na een éénmalige inseminatie bevruchte eieren kan
leggen.
° capacitatie (d.i. ontwikkelen van de capaciteit om eicellen te bevruchten) : bij de zoogdieren is
een verblijf van verscheidene uren binnen de vrouwelijke tractus (of in een aangepast in vitro-
75
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
milieu) noodzakelijk om capacitatie van de spermatozoa toe te laten. Een dergelijk proces beperkt
evenwel de levensduur van het sperma, wat strijdig is met het feit dat bij vogels het sperma dat in
de zaadreservoirs wordt opgenomen langere tijd moet kunnen overleven. Toch vermoedt men dat
capacitatie ook bij vogelsperma optreedt : onderzoek toonde immers aan dat spermatozoa in de
zaadreservoirs geen gewijzigde oppervlaktetopografie vertonen, terwijl dit wel het geval is voor
spermatozoa die de vitelliene membraan van de oöcyt bereikt hebben.
° fertilisatie : aviaire spermatozoa bezitten, net zoals deze bij de zoogdieren, een acrosoom en de
proteolytische werking ervan is vereist om de binnenste perivitelliene membraan te kunnen
penetreren. De spermatozoa agglutineren bij voorkeur ter hoogte van de kiemschijf (Eng.
“germinal disc”), waar het oölemma plaatselijk microvilli vertoont. Deze zouden mogelijk een rol
spelen bij het vasthouden, oriënteren en binnenleiden van de spermatozoa in de oöcyt. De eicel
zelf blijftna de ovulatie nog 15 tot 20 minuten vruchtbaar (d.i. gedurende de periode dat ze in het
infundibulum verblijft).
Fysiologische polyspermie is een frequent verschijnsel, alhoewel uiteindelijk slechts één
spermatozoïde met de eicelkern zal versmelten. Uitgesproken polyspermie (bvb. na intramagnale
inseminatie) doet embryonale mortaliteit toenemen ten gevolge van abnormaal vroegtijdige
ontwikkeling van de blastodiscus.
6. Artificiële inseminatie.
het proces van de kunstmatige bevruchting omvat verschillende stappen :
-
spermacollectie : via een zachte massage van het abdomen, die gepaard gaat met het
gelijktijdig strelen van de onderrug en staartveren, kan een opzwellen van de fallus uitgelokt
worden. Op dat ogenblik wordt een zachte druk uitgeoefend op de cloaca en wordt het
geëjaculeerde sperma opgevangen in een droog en zuiver proefbuisje. Op die manier kan bij
de haan twee- tot driemaal per week zaad gecollecteerd worden, zonder dat hierdoor het
spermavolume of de –concentratie nadelig beïnvloed worden.
-
kwaliteitsbeoordeling van het opgevangen sperma : omvat volgende stappen :
macroscopisch onderzoek van kleur, volume en consistentie van het sperma
microscopisch onderzoek van massa, individuele motiliteit, abnormaliteiten, % levende
spermatozoa,…
fluorimetrische evaluatie (bepaalt indirect de spermaconcentratie en het aantal levende en
dode spermatozoïden)
biochemische evaluatie (bepaling metabole activiteit)
76
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
stress-testen : testen van sperma op weerstandsvermogen tegen koudeshock en transport
bepalen van het effect van veroudering op zaadproductie en correlatie tussen leeftijd en
zaadkwaliteit
-
bewaren en verdunnen van sperma : in tegenstelling tot de zoogdieren, waar het sperma
relatief lang in de mannelijke geslachtstractus opgeslagen blijft en slechts korte tijd in de
vrouwelijke tractus doorbrengt, verblijft sperma bij de haan tot 32 dagen en bij de kalkoense
haan zelfs tot 70 dagen in de zaadreservoirs van de vrouwelijke geslachtstractus aanwezig.
Bijgevolg zullen de technieken voor het bewaren en verdunnen van aviair sperma in
belangrijke mate verschillen van deze die bij de zoogdieren gebruikelijk zijn. Bewaren van
sperma voor korte periodes aan temperaturen boven 0°C werd reeds uitvoerig bestudeerd (bvb.
kalkoensperma bewaard gedurende 6u aan 15°C heeft nog een fertiliteitsgraad van 92% ;
kalkoensperma bewaard gedurende 24u aan 10°C heeft een fertiliteitsgraad van 81%). Verder
onderzoek moet nog gebeuren wat langdurige bewaring betreft. Voor het verdunnen van
sperma staan verschillende verdunningsmedia ter beschikking, elk met zijn eigen specifieke
karakteristieken. Vast staat dat seminaal plasma zelf niet gebruikt mag worden voor het
bewaren of verdunnen van sperma vanwege het toxisch effect op de spermatozoa.
-
inseminatie : door druk op de cloaca wordt de vaginamond naar buiten gestulpt. Het sperma
wordt op een diepte van 4 tot 5 cm ingebracht. Wanneer de druk op de cloaca verminderd
wordt, herneemt de vagina opnieuw haar normale positie. Gewoonlijk worden 100 – 150 x 106
verse spermatozoïden geïnsemineerd, maar wanneer gebruikt wordt gemaakt van verdund
sperma dat bovendien enige tijd bewaard werd, moeten minstens 250 x 106 spermatozoïden
ingebracht worden.
77
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.4. Fertilizatie, embryogenese, implantatie, placentatie en parturitie. (Fig.8.1858.8.201 ;
Tab.8.328.40)
8.4.1. Fertilizatie.
° betekent : de veranderingen die plaatsvinden in de oöcyt na interactie met een spermatozoön,
waarbij het maternaal en het paternaal pakket aan haploïde chromosomen bij elkaar gevoegd
worden.
° omvat de volgende stappen :
a) penetratie van het sperma door de cumulus oöphorus : bij de meeste zoogdieren (echter
niet bij rund, schaap, geit) is de geovuleerde eicel nog omgeven door een “cumulus”
bestaande uit cellen en een acellulaire matrix met hoog hyaluronzuurgehalte. Enkel
gecapaciteerd sperma kan deze cumulus penetreren (in tegenstelling tot wat vroeger
aangenomen werd is hyaluronidase hierbij niet vereist m.a.w. het sperma hoeft geen
acrosoomreactie te hebben ondergaan).
b) sperma-zona interactie : eerst treedt een binding op tussen beide structuren ten gevolge van
de interactie tussen componenten van de zona (glycoproteïnen) en oppervlaktemoleculen van
het sperma. Eens de spermatozoa gebonden, kunnen ze een acrosoomreactie ondergaan (zie
verder) waarbij de binnenste acrosomale membraan blootgesteld wordt. Er vindt nu binding
plaats tussen zonacomponenten en receptoren op de binnenste acrosomale spermamembraan
(met tussenkomst van het enzyme acrosine).De inductie van de acrosoomreactie : deze reactie
houdt in dat er multipele fusies optreden tussen de sperma-plasmamembraan en de buitenste
acrosomale membraan, zodat een gefenestreerde membraan (bestaande uit kleine
membraanvesikeltjes) gevormd wordt. De inhoud van het acrosoom wordt gehydrolyseerd en
vrijgesteld doorheen de fenestraties in de spermamembraan. De membraanvesikeltjes worden
afgeworpen en interactie tussen de binnenste acrosomale membraan en de zona pellucida kan
plaatsvinden. Het precieze mechanisme is bij de zoogdieren nog steeds niet helemaal
opgehelderd, maar zeker is dat de reactie Ca++-afhankelijk is. Bij sommige zoogdieren (muis,
hamster, varken, rund en mens) kan de polypeptide-keten van de zona-glycoproteïnen de
acrosoomreactie induceren. Bij het penetreren van de zona is het sperma in een toestand van
hyperactiviteit, wat suggereert dat veeleer mechanische dan wel enzymatische processen
hierbij een rol spelen. Bepaalde enzymen zoals hyaluronidase (vertering van hyaluronzuur)
en acrosine (gedeeltelijke hydrolyse van bepaalde zona-glycoproteïne) blijven gebonden aan
78
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
de binnenste acrosomale membraan van het sperma tijdens de zona-pentratie en kunnen
hierbij dus mogelijk een rol spelen.
c) fusie tussen spermatozoön en oöcyt : na penetratie van de zona komt de spermatozoïde in
de perivitelliene ruimte terecht en maakt dan contact met de eicel. Hierbij verliest het sperma
zijn beweeglijkheid. Fusie treedt op tussen de plasmamembraan van de eicel en de membraan
ter hoogte van het equatoriaal segment van de spermatozoïde. De spermaplasmamembraan
wordt opgenomen in de eicelmembraan, de binnenste acrosomale membraan komt samen met
de spermakern in het eicelcytoplasma terecht.
d) eicelactivatie : het mechanisme is nog niet volledig opgehelderd, maar omvat zeker volgende
stappen :
-
verandering in membraanpotentiaal en mobilisatie van calciumionen : Ca++ wordt na
activatie vrijgesteld vanuit intracellulaire opslagplaatsen – als gevolg hiervan stijgt de
membraanpermeabiliteit voor K+, wat een reeks van negatieve hyperpolarisatie-reacties
teweegbrengt – tegelijk vindt een geleidelijke daling van de rustmembraanpotentiaal van –20
mV tot –40 mV plaats
-
corticale granulaire exocytose : de corticale granules die zich bij de rijpe oöcyt onder de
plasmamembraan bevinden, ondergaan bij tijdens het fertilisatieproces een exocytose, zodat
ze in de perivitelliene ruimte terechtkomen. Hierbij komen hydrolytische enzymen vrij, die
op hun beurt de fysicochemische eigenschappen van de zona gaan wijzigen. Gevolg hiervan
is dat de zona nu niet langer gepenetreerd kan worden door andere spermatozoa, zodat
polyspermie (bevruchting van één eicel door meerdere zaadcellen) vermeden wordt.
Eenzelfde blokkering kan plaatsvinden ter hoogte van de eicelmembraan zelf (bvb. bij het
konijn, waar de zona-blokkering eerder zwak is).
-
beëindiging van de tweede meiotische deling en afstoting van het tweede polaire lichaampje :
deling van de rijpe oöcyt werd stopgezet vlak vóór de tweede meiotische deling – na activatie
door de zaadcel wordt de meiose afgewerkt, waarbij één set van het chromatine in de eicel
blijft terwijl de andere set zich afzondert in een (tweede) polair lichaampje
e) vorming van een pronucleus, ontwikkeling en migratie : de spermakern in het
eicelcytoplasma moet een reeks reacties ondergaan, zoals decondenstaie van het chromatine.
In de cortexzone van de eicel worden de mannelijke en vrouwelijke pronuclei gevormd : het
chromatine wordt omgeven door een nucleaire envelop en ondergaat dan een snelle
decondensatie. Mannelijke pronucleusvorming stat onder de controle van bepaalde
cytoplasmatische factoren, de MPGF’s (Male Pronucleus Growth Factor), die voor korte tijd
aanwezig zijn in de rijpe oöcyt na activatie. Beide pronuclei moeten ook migreren naar het
79
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
centrum van de eicel, wat de voorwaarde is opdat de mannelijke en vrouwelijke
chromosomen zich binnen de spoelfiguur zouden kunnen schikken. Op het einde van de
eerste celcyclus ondergaan de mannelijke en vrouwelijke chromatine-complementen opnieuw
condenstaie binnen de intacte pronuclei. Na het verdwijnen van de pronucleusmembraan
schikken de gevormde chromosomen zich in het metafasevlak van de spoelfiguur.
f) in vitro fertilisatie (IVF): de eerste IVF werd reeds in 1954 met succes uitgevoerd bij het
konijn (inseminatie van geovuleerde oöcyten met sperma dat in utero gecapaciteerd was) –
vijf jaar later werden de eerste IVF-jongen geboren – nadien werd IVF uitgevoerd met in
vitro gecapaciteerd sperma (in 1969 bij de mens) – tenslotte werd de methode ook toegepast
op in vitro gerijpte eicellen. Vermits de mechanismen die betrokken zijn bij
spermacapacitatie nog niet helemaal opgehelderd zijn, werden verschillende technieken voor
het in vitro capaciteren van sperma ontwikkeld (zie : voorbeelden van sperma-media).
Incomplete capacitatie kan verschillende problemen met zich meebrengen :
-
vermits het percentage volledig gecapaciteerd sperma in een populatie van in vitro
gecapaciteerd sperma niet gekend is (maar wschl. laag is !), worden relatief hoge
concentraties aan spermatozoa gebruikt bij de inseminatie. Bijgevolg ligt het percentage
polyspermie in vitro veel hoger dan in vivo (mens : 5% ; rund : 10-20% ; varken : 50%
tegenover 1% in vivo).
-
is het sperma niet volledig gecapaciteerd wanneer het aan de oöcyten wordt toegevoegd, dan
wordt de bevruchting voor enige tijd (verscheidene uren) uitgesteld. Dit betekent dat ook de
eicel veroudering ondergaat vóór ze bevrucht wordt, wat mogelijke afwijkingen en een
gestoorde verdere ontwikkeling met zich mee kan brengen.
Ook bepaalde fysische factoren zoals temperatuur zijn bijzonder belangrijk : zo is 37°
optimaal voor fertilisatie van humane eicellen, terwijl voor huiszoogdieren 38-39° vereist is.
Belangrijk ook is het feit dat, ondanks fertilisatiepercentages van 80% en meer dankzij de
IVF-techniek, de overleving van het embryo en het à terme brengen van de dracht daarmee
niet gewaarborgd is.
Addendum (uit : Voortplanting van de huisdieren – Prof.Dr.A.de Kruif) (Fig.8.1798.183 ;
Tab.8.30-8.31)
1. Bewaren en verdunnen van sperma : een goede verdunner moet
-
de zaadcel beschermen tegen de gevolgen van vlugge afkoeling : daarom voegt men meestal
eidooier of melk toe – hun bescherming tijdens de afkloeling van lichaams- naar
80
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
koelkasttemperatuur (+5°C) berust op hun gehalte aan fosfolipiden, die een beschermende en
stabiliserende laag vormen rond de celmembraan. Ze bevatten tevens voedingsstoffen voor
het aërobe metobolisme van de zaadcellen.
-
de zaadcel beschermen tijdens eventueel diepvriezen : bewaren in koolzuurijs (-79°C) of in
vloeibare stikstof (-196°C) vraagt extra cryoprotectoren zoals glycerol, dimethylsulfoxide of
suiker. Deze stoffen worden door de zaadcellen opgenomen en moeten dus enige uren vóór
het invriezen aan de verdunner worden toegevoegd (equilibratietijd). De cryoprotectoren
hebben een sterk waterbindend vermogen en verhinderen aldus dat de zaadcellen tijdens het
invriezen gaan uitdrogen.
-
voedingsstoffen bevatten die door de zaadcel gemetaboliseerd kunnen worden en een goede
bufferwerking bezitten om de vorming van melkzuur op te vangen : meestal gaat het om
suikers bvb. glucose of lactose
-
instaan voor de juiste osmolariteit en electrolytenbalans : de meest gebruikte buffers zijn de
citraat-, fosfaat- of Tris(hydroxymethyl)aminomethaan-buffers (opm. : sperma is isoosmotisch met andere lichaamsvloeistoffen zoals bloed en melk = 300 mOsm)
-
de kiemgroei remmen : aan de verdunner worden daarom antibiotica toegevoegd die niet
toxisch zijn voor de zaadcellen bvb. penicilline, streptomycine, neomycine, polymyxineB of
gentamycine
-
het volume van het ejaculaat vergroten zodat meerdere doses aangemaakt kunnen worden
(bvb. bij het rund geldt als richtlijn voor het verdunnen dat minstens 10 miljoen levende
zaadcellen per ml inseminatiedosis aanwezig moeten zijn)
2. Drachtigheidspercentages na eerste kunstmatige inseminatie bij koe :
-
bij het begin van de oestrus : 40%
-
in het midden van de oestrus : 73%
-
aan het einde van de oestrus : 75%
-
6 uur na het einde vd oestrus : 62%
-
12 uur na het einde vd oestrus : 52%
-
18 uur na het einde vd oestrus : 28%
-
24 uur na het einde vd oestrus : 12%
-
48 uur na het einde vd oestrus : 0%
81
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.4.2. Embryogenese vóór implantatie. (Fig.8.2028.204 en 8.207 ; Tab.8.41-8.42)
8.4.2.1. Morfologische kenmerken van de bevruchte eicel vóór de implantatie.
° fertilisatie van de oöcyt is het startsein voor de aanvang van de “embryonale periode”: deze is
gekenmerkt is door een reeks celdelingen, het optreden van celdifferentiatie (vanaf het blastocyststadium) en het uitbreken uit de zona pellucida. Opm. : de bevruchte eicel wordt ook aangeduid
met de term “zygote”, maar voor de volledige periode vanaf de bevruchting tot het verschijnen
van de eerste karakteristieke vorm van de foetus zal de naam “embryo” gebruikt worden.
° de eerste celdeling (aanloop tot tweecellig stadium) vindt plaats 11 tot 20 uur na de bevruchting
(ongeacht de diersoort) en verdeelt de eicel in twee blastomeren die nagenoeg even groot zijn.
° vanaf een bepaald aantal cellen (8 bij muis, 16-32 bij rund) treedt ruimtegebrek op binnen de
zona pellucida en worden de cellen daardoor enigszins afgeplat. De celgrenzen tussen de
blastomeren worden minder duidelijk en door toename van het contact tussen de
plasmamembranen wordt de vorming van celjuncties vergemakkelijkt.
° in de loop van de pre-implantatieperiode ontwikkelen de blastomeren een polariteit : celdeling
in het vlak van de polaire as resulteert in twee identieke dochtercellen, terwijl deling in het vlak
dat loodrecht staat op de polaire as twee verschillende dochtercellen oplevert : deze die ontstaan
is uit de basolaterale sectie van het moedercelcytoplasma is een niet-polaire dochtercel, deze die
de rest van het moedercelcytoplasma bevat is de polaire dochtercel. Het aantal delingen dat
volgens de polaire as gebeurt bepaalt dus het aantal polaire en niet-polaire cellen dat tijdens de
volgende delingsstadia zal ontstaan.
° vanaf een bepaald aantal cellen (32 bij muis, 80-100 bij rund) verzamelt zich vloeistof vanuit de
polaire cellen in de intercellulaire ruimten – verschillende kleine ruimten gaan samenvloeien en
een holle vesikel (blastocoele) vormen, dit stadium krijgt de term blastocyst. Op datzelfde
ogenblik treedt de eerste celdifferentiatie op en vindt men twee onderscheiden celtypes in het
embryo terug : epitheliale cellen vormen zich aan het oppervlak van het embryo (bij voorkeur
afkomstig van de polaire cellen, kunnen op actieve wijze vloeistof transporteren vormen het
latere trofo-ectoderm) – binnenin het embryo vormen de niet-polaire cellen een binnenste
celmassa (voorlopig niet-gespecialiseerde cellen vormen het embryo zelf). De plaats die de
cellen innemen binnen het embryo is bepalend voor hun latere ontwikkeling : zo zullen de cellen
van de binnenste celmassa in de blastocyst die grenzen aan de holle vesikel het primitieve
endoderm gaan vormen, de overigen worden het primitieve ectoderm.
82
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.4.2.2. Differentiële expressie van embryonale genen tijdens de pre-implantatieperiode.
In de loop van de pre-implantatieperiode neemt de transcriptie-activiteit van het embryo snel toe
(vnl. van actine en ). In tabel 8.41 zijn de belangrijkste proteïnen weergegeven die
teruggevonden kunnen worden in het muizenembryo vóór de implantatie (o.a. groeifactoren). De
meeste van deze proteïnen blijven steeds aanwezig, zowel bij het embryo als later bij het
volwassen dier : ze vervullen een essentiële rol bij basisfuncties van de cel (Eng. : housekeeping
functions) en bij het vormen van intercellulaire contacten (belangrijk bij blastocyst-vorming).
Andere proteïnen komen overeen met genen die pas tot expressie komen na de activatie van het
embryonaal genoom bvb. de groeifactor TGF1, die een rol speelt bij celmigratie en –proliferatie.
Opmerking : de vroege embryonale ontwikkeling kan in feite opgedeeld worden in twee fasen nl.
een eerste die voonamelijk afhankelijk is van moleculen (RNA en proteïnen) die reeds
opgeslagen liggen in de oöcyt (= maternaal overgeërfd materiaal) en een tweede die afhangt van
de activiteit van het nieuwgevormde genoom (= samengesteld uit beide parentale genomen).
8.4.2.3. Complementaire werking van het parentaal genoom.
In tegenstelling tot bepaalde klassen van gewervelden waar parthenogenese een leefbaar individu
kan voortbrengen, is bij de zoogdieren zowel het maternaal als het paternaal genoom
noodzakelijk voor de vorming van een volwaardig embryo. Dit werd bewezen aan de hand van
experimenten waarbij onderlinge kruisingen worden uitgevoerd met muizencellijnen die drager
zijn van bepaalde vormen van chromosoomtranslocaties. Hieruit kunnen abnormale gameten
bekomen worden : sommigen bezitten twee copies van een (deel van een) chromosoom, terwijl
bij anderen diezelfde regio volledig afwezig is ten gevolge van een meiotische non-dysjunctie.
Uiteindelijk worden embryo’s gevormd die wel een complete set chromosomenparen hebben
maar waarbij sommige (delen van) chromosomen slechts van één van beide ouderdieren
afkomstig is (zie figuur 8.204). De chromosomenmap op de figuur toont de chromosoomregio’s
waarvan de genen een verschillende activiteit hebben tijdens de embryonale ontwikkeling en dit
naargelang zij van het vader- of van het moederdier afkomstig zijn. In het geval van chromosoom
6 is maternale duplicatie in combinatie met paternale deficiëntie letaal, terwijl de omgekeerde
combinatie wel leefbaar is. Bij chromosoom 17 is de duplicatie van het proximale deel van het
paternaal chromosoom en de daarmee samengaande afwezigheid van diezelfde regio bij het
maternaal chromosoom een letale combinatie. Muizen die twee maternale chromosomen 11
83
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
overerfden bleken bij geboorte zeer klein en stierven na enkele dagen, terwijl deze die de beide
paternale chromosomen 11 kregen evenmin leefbaar waren maar wel groter dan normaal bij de
geboorte. Dit bewijst dat bepaald regio’s van het genoom die essentieel zijn voor de embryonale
ontwikkeling, enkel actief zijn wanneer zij (afhankelijk van het geval) afkomstig zijn van het
vaderdier of van het moederdier.
8.4.3. Blastocystontwikkeling en implantatie.
Implantatie vindt plaats op het ogenblik dat het embryo het blastocyst-stadium heeft bereikt.
Zoals hoger vermeld bestaat deze blastocyst uit een centrale holte of blastocoele, een trofoectoderm (betrokken bij de interactie tussen embryo en uterus, wat resulteert in implantatie) en
een binnenste celmassa (Eng. : inner cell mass, ICM ; hieruit ontstaat het embryo zelf en al de
embryonale cellagen nl. ectoderm, endoderm en mesoderm). De interactie en associatie tussen, en
de ontwikkeling van al deze cellagen resulteert in de differentiatie van de weefsels en organen
van de foetus en in de vorming van de extra-embryonale (foetale) membranen.
8.4.3.1. Blastocystontwikkeling.
° contact tussen de trofo-ectoderm en het uterusepitheel is noodzakelijk voor het initiëren van de
implantatie. Het belangrijkste kenmerk van de cellen van de trofo-ectoderm is dat ze van
epitheliale aard zijn en een polariteit bezitten. Bewijzen voor deze polariteit vindt men aan de
oppervlakte van de trofo-ectodermcellen, waar verschillende “membraanregio’s” onderscheiden
kunnen worden :
-
ter hoogte van de apicale membraan bevinden zich de microvilli
-
de laterale plasmamembraan vormt verschillende types van celjuncties en interdigitaties
-
de basale plasmamembraan bezit cytoplasmatische projecties en rust op een basale lamina die
op haar beurt de scheiding vormt tussen trofo-ectoderm en onderliggend endoderm
Ook in het celcytoplasma vindt men aanduidingen voor deze polariteit : het apicale cytoplasma is
zeer rijk aan “coated pits” of coated endocytotische vesikels, terwijl endoplasmatisch reticulum
en Golgi-apparaat voornamelijk in de supranucleaire regio terug te vinden zijn.
° in het cytoplasma van jonge blastocysten is reservemateriaal opgeslagen (“dooier, Eng. : yolk”),
zoals lipidendruppels en fibreuze (eiwitachtige) inclusies. Polyribosomen (organellen waar
proteïnesynthese plaatsvindt) liggen verspreid in het cytoplasma en in de buurt van de cisternae
van het glad endoplasmatisch reticulum liggen vaak mitochondriën.
84
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
° vanaf het ogenblik waarop de blastocyst gevormd is , kan men reeds een onderscheid maken
tussen een polaire trofo-ectoderm (= bedekt de ICM) en een parietale trofo-ectoderm (=
omringt de blastocoele). De verdere ontwikkeling van de polaire trofo-ectodermcellen is
speciesafhankelijk : bij ruminantia, equidae en suidae zal deze laag (ook : laag van Rauben)
verdwijnen, bij muis en primaten daarentegen zal de polaire trofo-ectoderm prolifereren en de
parietale laag zich omvormen tot een laag bestaande uit polyploïde primaire reuzencellen
(doordat celdeling stopt maar celgroei doorgaat). Bij de muis zullen de polaire trofoectodermcellen zich uiteindelijk ook omvormen tot perifere polyploïde cellen, terwijl bij de
primaten de cellen van de polaire trofo-ectoderm door fusie een syncytium zullen vormen op het
ogenblik van de implantatie.
° rol van de trofo-ectoderm : nadat tussen de cellen van de trofo-ectoderm apicale tight junctions
zijn gevormd, gaat de blastocoele uitzetten ten gevolge van een vloeistofophoping. De trofoectoderm is in toenemende mate in staat materiaal vanuit het uterusmedium op te nemen door
fagocytose en endocytose (rol bij voeding van het embryo is voornamelijk belangrijk bij die
species waarbij implantatie laattijdig plaatsvindt en uteriene secretie-activiteit hoog): grote
hoeveelheden reservemateriaal (glycogeenpartikels, proteïnekristallen) worden dan ook
teruggevonden, opgeslagen in secundaire lysosomen en residuele lichaampjes. De trofo-ectoderm
is dus een continue en ondoordringbare laag die een rol speelt bij het voeden van het embryo, de
bescherming van het embryonale medium en de expansie van de blastocoele. De trofoectoderm komt dus tussen in alle materno-embryonale uitwisselingen.
° cellen uit de ICM : deze zijn aanvankelijk niet-polair (rond of kubisch van vorm) en zijn
omgeven door (cytoplasmatische projecties van de ) trofo-ectoderm. De ICM-cellen gelegen aan
de blastocoel-zijde vormen het
primaire endoderm. Daarna wordt een embryonale discus
gevormd die groter wordt door mitosen en waarvan de buitenste laag het ectoderm wordt (cellen
van deze laag zijn gepolariseerd en hebben apicale microvilli). Van de binnenzijde van de
embryonale discus migreren de mesodermcellen.
-
samen met de trofo-ectoderm vormt het primitieve endoderm de wand van de groter
wordende blastocoele
-
het primitieve endoderm differentieert in een visceraal en een parietaal endoderm : de cellen
van beide lagen blijven gepolariseerd en epitheliaal van aard, met apicale microvilli gericht
naar de blastocoele ; cellen van beide cellagen kunnen endocytotische vesikels vormen ; in
het ruw endoplasmatisch reticulum worden de proteïnen van de extracellulaire matrix
gesynthetiseerd (zal de scheiding vormen tussen trofo-ectoderm en endoderm)
85
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
de trofo-ectoderm is via receptoren (integrinen) gefixeerd aan de extracellulaire matrix : deze
laatste is vermoedelijk verantwoordelijk voor de polariteit en de differentiatie van de trofoectodermcellen
° vorming van foetale membranen vanuit extra-embryonale cellagen :
-
het mesoderm, gelegen tussen trofo-ectoderm en endoderm, wordt uitgehold = exocoeloom
-
de buitenste laag vormt samen met de trofo-ectoderm het chorion
-
de binnenste laag vormt samen met het endoderm de dooierzakwand
-
uit de caudale regio van de primitieve darm ontstaat de allantoïs, die bestaat uit endoderm
omgeven door mesoderm
-
de oorsprong van het amnion is speciesafhankelijk : bij dieren waarbij de embryonale discus
aan de oppervlakte ligt (bvb. varken) wordt deze omgeven door plooien uitgaande van trofoectoderm en mesoderm een deel van deze laag wordt het amnion ; bij dieren zoals muis en
cavia en bij de mens ontstaat een amnionholte binnen het ectoderm
In grote lijnen kan men de zoogdierembryo’s in twee grote groepen indelen :
1. blastocyst blijft lange tijd “vrij” en ondergaat een belangrijke toename in lengte of diameter –
de discus komt aan de buitenzijde te liggen – het amnion wordt gevormd door plooiing –
extra-embryonale membranen en foetus zelf worden reeds gevormd vóór de implantatie,
zodat men spreekt van een “conceptus”
2. blastocyst wordt snel geïmplanteerd (vooraleer expansie optreedt) – er vindt inversie plaats –
het amnion wordt gevormd door uitholling – de trofo-ectoderm is polyploïd en invasief – de
extra-embryonale organen worden pas gevormd na de implantatie
8.4.3.2. Implantatie. (Fig.8.208-8.209 ; Tab.8.43-8.44)
Dit omvat een reeks interacties tussen twee weefsels, het uterusendometrium en de embryonale
trofo-ectoderm, met als resultaat de vorming van placentale structuren.
° de implantatieplaats is speciesafhankelijk, alhoewel het endometrium bij alle diersoorten
dezelfde kenmerken vertoont nl. een éénlagig of pseudomeerlagig epitheel op een lamina basalis,
epitheelcellen die microvilli of ciliën dragen en een sterk gevasculariseerd stroma met
endometriumklieren
° implantatiefasen :
-
afstoten van de zona pellucida : gebeurt langere of korte tijd vóór de implantatie
86
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
pre-contactfase met oriëntatie van de blastocyst : de positie van de blastocyst in de
uterusholte is speciesafhankelijk (zie figuur, bvb. lateraal bij vrouw, antimesometriaal bij
konijn, rat en muis d.w.z. aan de zijde tegenover deze waaraan de ophangband van de uterus
bevestigd is)
-
appositiefase : tijdens deze fase worden weliswaar losse maar wel echte cellulaire contacten
gevormd tussen embryonale en uteriene cellen, waarbij tevens het aantal microvilli op de
apicale membraan van de trofoblastcellen gaat verminderen (onder invloed van ovariële
steroïden)
-
adhesiefase : trofoblastcellen en uteriene cellen komen nog dichter in contact met elkaar –
fixatie gebeurt door interdigitatie tussen uteriene microvilli en de membraan van de
trofoblastcellen – eventueel worden ook gespecialiseerde celjuncties gevormd (desmosomen
bij rodentia en de mens). Opm. : bij dieren met een epithelio-choriale placentatie (varken,
paard) is de adhesiefase de laatste fase van de implantatie.
-
endometriale invasie-fase : de trofoblast heeft invasieve eigenschappen en penetreert de
lamina basalis (onder het epitheel) van het endometrium, waarna het de bloedvaten in het
endometriumstroma omgeeft (= placenta endothelio-chorialis bvb. carnivoren) of invadeert (=
placenta haemo-chorialis bvb. primaten, rodentia). Wanneer het endometriumepitheel zich
opnieuw sluit over de conceptus heen (ter vorming van de zgn. decidua reflexa), spreekt men
van een interstitiële implantatie (bvb. vrouw, cavia, rat en muis). Het endometrium wordt in
mindere of meerdere mate geïnvadeerd :
-
“indringings-invasie (Eng. : intrusive invasion)”: de trofoblast dringt de endometriale
intercellulaire ruimten binnen zonder cellyse te veroorzaken (bvb. cavia, fret)
-
“vervangings-invasie (Eng. : displacement invasion)”: de trofoblast fagocyteert de
uteriene cellen (bvb. rat, muis, hamster)
-
“fusie-invasie (Eng. : fusion invasion)”: de (syncytio)trofoblast fuseert met de
uteruscellen ter vorming van een syncytium dat maternale en trofoblastische kernen bevat
Bij de ruminantia blijft de invasie van de trofoblast beperkt tot een aantal bijzondere cellen :
de dubbelkernige cellen van de trofoblast (= syncytiële cellen) gaan een fusie aan met een
aantal uteruscellen en vormen zo een syncytium dat verspreid ligt tussen het gewone
uterusepitheel (= incomplete syndesmo-choriale placenta). Ook bij de equidae zijn een aantal
trofoblastcellen in staat het uterusstroma te invaderen : cellen van de choriongordel fuseren
met uteruscellen, waarna ze migreren naar het uterusstroma ter vorming van “endometriale
cups” (secreteren het PMSG = pregnant mare serum gonadotropine). De cellen van deze cups
worden rond dag 80-90 van de dracht geëlimineerd door leucocyten (zie ook verder : 8.4.4.).
87
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.4.3.3. Hormonale controle.
Implantatie vereist bij alle diersoorten volgend hormonaal (basis)patroon :
-
pre-ovulatoire oestrogenenpiek, gesecreteerd door de groeiende ovariële follikels : deze
bereiden de rijping van het endometrium voor
-
luteale progesteronsecretie op het ogenblik van de implantatie (in sommige gevallen tevens
secretie van oestrogenen)
Ditzelfde geldt ook voor species waarbij “uitgestelde implantatie” plaatsvindt : de implantatie
wordt voorafgegaan door een zgn. embryonale “diapauze” bvb. bij de das (Eng. : badger) wordt
het einde van de embryonale diapauze gekenmerkt door een progesteronpiek (evenwel zonder
veranderingen in de oestrogeenproductie).
Embryonale signalen : deze worden reeds vóór de implantatie door het embryo “uitgezonden”
en door het moederdier herkend. Het betreft ondermeer de “Platelet Activating Factor (PAF)”, die
een lokale vasodilatatie veroorzaakt en vermoedelijk ook een autocriene en paracriene rol speelt
bij het implantatieproces. Andere signaal-moleculen zijn o.a. histamine, prostaglandines en
bepaalde glycoproteïnen. Bij diersoorten waarvan het CL geen oestrogenen produceert kan het
embryo zelf deze stoffen secreteren op het ogenblik van de implantatie (precieze rol van deze
oestrogenen bij het implantatieproces is nog niet volledig opgehelderd).
Uterusreceptiviteit en blastocystactivatie : implantatie is het resultaat van het afstemmen van
twee vormen van cellulaire differentiatie op elkaar nl. enerzijds de trofoblast en anderzijds het
receptieve endometrium. Het endometrium zal, onder controle van de ovariële steroïden, volgens
een vastgelegd patroon prolifereren en differentiëren : volgt geen bevruchting, dan treedt celdood
op in min of meerdere mate (bvb. uitgesproken celdood bij mens en sommige hogere primaten =
menstruatie). Volgt daarentegen de implanting van een blastocyst, dan vangt een nieuwe
differentiatiefase aan met de vorming van deciduaal weefsel als “innestelingsplaats” voor het
vruchtje. Hoewel embryo en maternaal endometrium in staat zijn bepaalde signalen met elkaar uit
te wisselen, kennen beide toch een relatief onafhankelijke ontwikkeling tijdens de preimplantatieperiode : ontwikkeling van het embryo kan gebeuren in vitro in afwezigheid van
uteriene factoren, terwijl endometriumpreparatie experimenteel na te bootsen is in afwezigheid
van een embryo. Voor embryotransplantatie is synchronisatie tussen embryo en endometrium een
absolute vereiste. Wel is het embryo in staat zich in zekere mate aan te passen aan een lichte
desynchronisatie nl. door de eigen ontwikkeling wat uit te stellen of juist te versnellen. Het
88
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
endometrium is minder flexibel en is slechts receptief tijdens een zgn. overgangsperiode (deze is
zeer strict bij de Muridae nl. ongeveer 15 uren, maar ruimer bij andere species bvb. bij de vrouw
kan de blastocyst zich aan het endometrium hechten tussen dag 20 en dag 23 van de cyclus).
8.4.4. Placentatie. (Fig.8.205-8.206 en 8.2108.222)
De placenta speelt een rol bij min of meer selectieve foeto-maternale uitwisselingsprocessen,
zoals het transport van gassen en nutriënten, en staat in voor de bescherming van de foetus tegen
bacteriële en toxische substanties. De placenta heeft ook een zekere endocriene activiteit en is
(gedeeltelijk) verantwoordelijk voor het hormonaal evenwicht gedurende de dracht.
8.4.4.1. Verschillende placentatypes.
Indeling kan gebeuren op basis van de morfologie of van de structuur :
-
morfologie : diffusa (eq, su), cotyledonaria (Ru), zonalia (carniv), discoidalis (rod, primaten)
-
structuur : afhankelijk van het aantal placenta-cellagen dat de scheiding vormt tussen de
maternale en de foetale bloedcirculatie spreekt men van een placenta epithelio-chorialis (eq,
su, Ru), endothelio-chorialis (carn) of haemo-chorialis (rod, primaten : in dit geval “baden”
de chorion-villi in het maternale bloed)
8.4.4.2. Uitwisselingsfuncties van de placenta.
° uitwisselingsfuncties van de placenta :
-
maternale en foetale bloedcirculatie : de chorionvilli vertegenwoordigen een zeer grote
oppervlakte (bvb. mens : 14 m2) waarlangs zuurstof en koolstofdioxide uitgewisseld kunnen
worden. Zuurstof opgelost in het maternale bloed gaat direct over in het foetale bloed, terwijl
koolstofdioxide vanuit het foetale bloed in het maternale bloed diffundeert (zie ook : foetale
circulatie in hoofdstuk 3 : 3.1.1.).
-
uitwisselingsmechanismen :
-
eenvoudige diffusie : gas- en watermoleculen passeren van een gebied van hoge
concentratie naar een gebied van lage concentratie tot een evenwichtstoestand is bereikt
(bvb. iodium passeert vlot de placenta-barrière vanaf week 12 van de zwangerschap bij
de mens)
89
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
actief transport : doorheen celmembranen vereist energie bvb. transport van Na+/K+ en
Ca++ is gekoppeld aan de hydrolyse van ATP door een adenosinetrifosfatase
-
gefaciliteerde ionendiffusie : dit transportproces maakt geen gebruik van ATPasen, maar
wordt gemedieerd door ionenfluxen bvb. glucose (of ook AZ) en natriumionen binden
aan hetzelfde proteïne om samen de celmembraan te passeren
-
endocytose : microvilli op de trofoblastcellen kunnen bepaalde macromoleculen
opnemen, waarna de geabsorbeerde substanties (evt. na enzymatische degradatie) ter
beschikking staan van placenta en foetus. Receptoren op het oppervlak van de
trofoblastcellen kunnen zorgen voor een versneld transport van ijzer en cholesterol van
moeder naar foetus.
-
“lekkage” van foetale erythrocyten in het maternale bloed : kan gebeuren op het ogenblik
van de geboorte (pathologie van de foeto-maternale iso-immunisatie)
° placenta als selectief transfersysteem :
-
proteïnen en AZ : maternale proteïnen passeren de placentabarrière niet (behalve IgG bij
species met een haemo- of endothelio-choriale placenta) – de foetus synthetiseert zijn eigen
proteïnen uitgaande van maternale AZ
-
glucose : zeer belangrijke nutriënt voor de foetus – bij verschillende species wordt door de
placenta glycogeen gesynthetiseerd en opgeslagen in de trofoblast
-
lipiden : passert de humane placenta niet – triglyceriden en fosfolipiden worden afgebroken
en de placenta synthetiseert nieuwe lipidenmoleculen voor foetaal gebruik
-
vitaminen : afhankelijk van hun vet (A,D,E en K)- of wateroplosbaar (B,C) karakter passeren
ze min of meer vlot de placentabarrière
-
hormonen : polypeptide hormonen (TSH, ACTH, groeihormoon, insuline en glucagon)
passeren de placenta niet, in tegenstelling tot de kleinere steroïdhormonen thyroxine en
adrenaline
° transplacentale passage van toxische, pathogene en medicinale substanties : bepaalde toxische
stoffen kunnen de placentabarrière vlot passeren bvb. alcohol, lood, fosfor, kwik, opiaten en
verschillende medicinale stoffen (barbituraten, antibiotica, diuretica,…). Een aantal hiervan zijn
sterk teratogeen (= misvormingen aan de foetus veroorzakend bvb. LSD, amfetaminen,
diethylstilbestrol (DES) en thalidomide (Softenon), lithium). De permeabiliteit van de placenta
voor organische substanties is grotendeels afhankelijk van hun moleculair gewicht : de grens ligt
hierbij rond 600 – 1000 dalton. Ook sommige pathogene micro-organismen kunnen de
placentabarrière passeren : dit is ondermeer het geval bij syfilis, toxoplasmose en malaria.
90
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
Hetzelfde geldt voor bepaalde virussen, waarbij ernstige embryonale of foetale aandoeningen
kunnen veroorzaakt worden bvb. mazelen, herpes, HIV en hepatitis.
8.4.4.3. Endocriene functies van de placenta. (Fig.8.2238.241 ; Tab.8.458.47)
° Steroïdhormonen :
-
progesteron : diffundeert in het maternaal myometrium ter hoogte van de placentale
insertieplaatsen – speelt een rol bij het “rustig houden” van het uterusmyometrium.
Progesteron is essentieel bij het tot stand komen van een dracht. Bij een aantal species wordt
de functie van het CL als progesteronproducent na korte of langere tijd overgenomen door de
placenta (ovariectomie na dit tijdstip veroorzaakt geen abortus meer). Biosynthese van
progesteron : bij de mens wordt het hormoon gesecreteerd door de cytotrofoblast en de
syncytiotrofoblast, terwijl bij het rund de dubbelkernige chorioncellen instaan voor de
progesteronsynthese. Bij de meeste zoogdieren wordt het gesynthetiseerd vanuit acetaat, bij
de mens wordt het gevormd uitgaande van maternaal cholesterol (gebonden aan LDL = low
density lipoproteïns).
-
oestrogenen : speelt een belangrijke rol bij de implantatie, maar ook bij de ontwikkeling van
de melkklier en bij de vrijstelling van prolactine bij de partus en de start van de lactatie. Een
voorbijgaande aromatase-activiteit treedt op in de trofoblastcellen rond het tijdstip van de
implantatie, met als gevolg een omzetting van androgenen in oestrogenen. In de tweede helft
van de dracht stijgt de oestrogeenconcentratie in het plasma geleidelijk, met een snelle
stijging vlak vóór de partus. Vermits de placenta geen pregnenolon of progesteron kan
omzetten in oestrogenen of androgenen, moeten de foetale en/of maternale bijnieren instaan
voor de levering van androgenen (DHAsulfaat). Schema van de biosynthese van oestrogenen
bij de vrouw : zie figuur 8.239.
° polypeptide-hormonen :
-
choriongonadotropinen : bij de vrouw is het humaan chorion gonadotropine (hCG),
gesecreteerd door de syncytiotrofoblast, detecteerbaar in het perifere bloed vanaf dag 8-10
van de zwangerschap (implantatie rond dag 6-7). De hCG-waarde stijgt geleidelijk en bereikt
een maximum rond maand 2,5 van de zwangerschap. Daarna vindt weer een daling plaats (tot
20 IU/ml, en dit tot het einde van de zwangerschap). De functie van hCG, dat biologisch
gelijkaardig is aan het LH, is het ondersteunen van het CL zelf en van de transformatie tot
zwangerschapsCL. Daarnaast speelt hCG vermoedelijk een rol bij de stimulatie van de foetale
bijniercortex en testes, en bij de regulatie van het placentair progesteron en de
91
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
immunotolerantie van de conceptus. Tenslotte heeft hCG ook een stimulerend effect op de
placentaire oestrogeenproductie (omzetting vanuit foetale androgenen). Belangrijkste
klinische
toepassingen
met
betrekking
tot
detectie
van
hCG
zijn
:
vroege
zwangerschapsdiagnose, voorspellen van abortus, diagnose van ectopische zwangerschap,
detectie van tumoren van de trofoblast (mola, choriocarcinoma). Choriongonadotropinen
komen ook voor bij andere zoogdieren zoals grote aapsoorten (chimpanzee, gorilla, oerangoetan). Bij het paard vindt men het “pregnant mare serum gonadotropine” (PMSG ; ook :
equine chorion gonadotropine, eCG) vanaf dag 35 van de dracht : eCG is niet betrokken bij
het behoud van het drachtigheidsCL, maar wel bij de immunoregulatie van de implantatie.
-
placentale lactogenen (PL ; ook : chorion somatotropinen, CS): komt voor bij mens en
andere primaten, bij ruminantia en bij rodentia. Het humaan PL is een enkelvoudige
polypeptideketen die zeer sterk gelijkt op het hGH(groeihormoon : vermoedelijk stammen
beide, samen met het hPRL, af van een gemeenschappelijk voorouder-gen). Het wordt
gesynthetiseerd in de syncytiotrofoblast en is detecteerbaar in de maternale circulatie vanaf
week 5 van de zwangerschap (tot einde). Het ovien PL heeft een grotere overeenkomst met
oPRL dan met oGH. Het wordt voornamelijk gesecreteerd door de epithelio-choriale cellen
van de cotyledonen van de placenta en is detecteerbaar in de circulatie vanaf dag 40-50 van
de dracht. De secretie van oPL is recht evenredig met de placentamassa en het aantal
foetussen. Vlak vóór departus, tesamen met de regressie van de cotyledonen, daalt de oPLconcentratie. Biologische werkingen van PL zijn :
-
mammogenese en lactogenese
-
groei van de foetus
-
maternaal intermediair metabolisme : hPL stimuleert insuline-secretie en heeft een
lipolytische activiteit (cfr. GH). Bij energiegebrek (vasten) levert PL vrije vetzuren als
energiebron voor het moederdier, zodat het glucose gespaard wordt en beschikbaar blijft
voor de foetus. Bij normale voedertoestand maakt PL de weefsels (vetweefsel, lever)
gevoeliger voor de werking van insuline, zodat energiereserves aangelegd worden. Pl
speelt tevens een rol bij het proteïne-anabolisme door beïnvloeding van de
stikstofretentie.
° “pregnancy-associated” proteïnen :
-
trofoblast-interferon (trofoblastine) en endometriaal interferon : ovien trofoblastine is
antiluteolytisch en speelt ondermeer een rol bij de vroege immunotolerantie van de conceptus
door het moederdier
92
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
serumproteïnen die gebruikt worden bij de vroege detectie van dracht (zwangerschap) : “early
pregnancy factor (EPF)”, “schwangerschafts protein-1 (SP1)”, “pregnancy specific proteins
(PSP)” bij ruminantia
-
andere : placentale proteïnen (PP), uteroglobine, -fetoproteïne (afkomstig uit foetale lever
en dooierzak, speelt een rol bij de rijping van het embryonaal en foetaal zenuwstelsel ; bij de
vrouw worden hoge AFP-concentraties geassocieerd met afwijkingen aan het foetaal CZS
zoals spina biffida en anencephalie), renine (wordt ook gesynthetiseerd door de humane
chorion : het renine-angiotensinesysteem speelt een rol bij de implantatie en bij de vasculaire
veranderingen die tijdens de zwangerschap optreden), relaxine (geproduceerd door het CL
(vrouw, su, bo, rat) en door de placenta (cavia, eq); inhibeert uteruscontracties tijdens de
dracht en speelt een belangrijke rol bij de partus), deciduaal prolactine (cfr. hypofysair PRL,
speelt vermoedelijk een rol bij osmoregulatieprocessen ter hoogte van de placenta),
verscheidene groeifactoren en cytokinen.
8.4.5. Parturitie. (Fig.8.2428.257 ; Tab.8.48)
Parturitie betekent het uitdrijven van de foetus en de foetale membranen door gecoördineerde en
ritmische contracties van het uterusmyometrium. Het is het gevolg van een reeks complexe
interacties tussen neurale en endocriene factoren van de zijde van het moederdier (alhoewel bij
sommige species de eerste signalen uitgaan van de foetus).
Drie stadia kunnen onderscheiden worden :
-
uteruscontracties : vertrekken vanuit een “pacemaker” en verspreiden zich over de ganse
uterus + “rijping” (verweking) van de cervix : de baarmoederhals ondergaat structurele en
biochemische veranderingen waardoor hij zacht en soepel wordt en dilateert
-
expulsie van de foetus : na volledige dilatatie van de cervix nemen de contracties toe en
wordt de foetus relatief snel uitgedreven
-
expulsie van de foetale membranen : scheiding tussen placenta en decidua wordt
vergemakkelijkt door degeneratie van de placenta en door lokale uteruscontracties
8.4.5.1. Hormonale veranderingen aan het eind van de dracht.
° progesteron/oestradiol-ratio :
-
speciesspecifieke wijzigingen : dracht gaat steeds gepaard met een dominantie van
progesteron (= “zwangerschapshormoon”) boven oestradiol-17. Bij de meeste zoogdieren
93
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
(niet bij mens!) treedt aan het eind van de dracht een plotse daling in het plasma-progesteron
op, terwijl het oestradiolgehalte gaat stijgen (P4/E2 daalt in plasma en myometrium). Het
myometrium , dat door de aanwezigheid van progesteron “in rust” werd gehouden, is door de
aanwezigheid van oestradiol meer vatbaar voor contracties. De veranderingen die optreden in
de ratio P4/E2 zijn essentieel voor het op gang brengen van de partus, op voorwaarde dat ze
goed gecoördineerd verlopen : te vroege of te late stijging van het oestradiolgehalte
veroorzaakt steeds moeilijkheden bij de partus. Eén van de belangrijkste gevolgen van het
verwijderen van de progesteron-block en van de daling in P4/E2-ratio is dat het myometrium
meer gevoelig is voor de werking van stimulatoren van de myometriumcontractie. Opm. : bij
de primaten treedt geen verandering in de plasma-steroïdconcentratie op als voorbode van
een nakende partus : de plasma-progesteronconcentratie is hier op haar hoogst (hoewel de
P4/E2-ratio in het myometrium wel met 40% gedaald is!) op het ogenblik van de partus.
-
effect van steroïden op myometriumcontractiliteit : membraanpotentiaal van de
myometriumcellen stijgt geleidelijk (van –70 mV tot –55 mV aan het eind van de dracht) –
tegelijk neemt het aantal calciumkanalen toe en vindt een massieve influx van calciumionen
in de myometriumcellen plaats (Ca++-calmoduline-complex noodzakelijk voor activatie van
het myosine light-chain kinase) – de synthese van proteïnen betrokken bij spiercelcontractie
(actomyosine) neemt toe – tenslotte stijgt ook het aantal “gap junctions” (staan in voor de
voortgeleiding van de electrische signalen over het ganse myometrium en voor de
synchronisatie van de contractiegolven)
-
effect van steroïden op de cervix : aan het eind van de zwangerschap veroorzaakt een lokale
toediening van oestradiol-17 bij de vrouw een snellere dilatatie van de cervix : vermoedelijk
gebeurt dit via een wijziging van de gevoeligheid van de cervix voor prostaglandines.
° prostaglandines :
De effecten van de PG’s zijn moeilijk na te onderzoeken, aangezien ze verschillen naargelang de
diersoort, de toestand van de uterus (gravied of niet), de wijze van toediening (systemisch of
lokaal) en het onderzochte deel van de uterus. De effecten van PGF en van PGE op het
myometrium zijn vaak antagonistisch omdat ze werken via een verschillend membraanreceptorsecond messenger systeem (PGE-binding leidt tot stijging van intracellulair cAMP, terwijl PGF2
de Ca++-concentratie in de cytosol doet stijgen). Het aantal en de affiniteit van de PGF 2receptoren verandert niet in de loop van de dracht, deze voor PGE nemen geleidelijk aan af.
-
prostaglandine-productie aan het einde van de dracht : PG’s zijn vnl. afkomstig van het
endometrium, maar ook van het myometrium, de placenta, de decidua en de foetale
94
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
membranen (bij de vrouw is het amnion haast de enige productieplaats!) : van hieruit
diffundeert het PGE2 naar het myometrium en induceert daar de contracties. De PG-secretie
stijgt snel naar het einde van de dracht toe (afhankelijk van het stimulerend effect van
oestradiol op fosfolipase A2, dat op zijn beurt leidt tot de vrijstelling van arachidonzuur, een
gemeenschappelijke precursor van alle PG’s ; ook oxytocine activeert de productie van PG’s
aan het einde van de dracht).
-
effecten van PG’s : versnelling van de luteolyse en daarmee opheffing van de progesteronblock – verhoging van de uterusgevoeligheid voor oxytocine – stimulatie van de Ca++influx in
de cellen van het myometrium (en dus van contracties) – stimulatie van cervixverweking
° oxytocine (Ot):
Dilatatie van de cervix is het startsein in een neuro-endocriene reflex, Ferguson’s reflex genoemd,
waarbij het oxytocine (dat in de hypofyse-achterkwab ligt opgeslagen) vrijgesteld wordt, zodat de
plasmaconcentratie aan dit hormoon een plotse en snelle stijging kent. De hoogste waarden
worden opgemeten tijdens de expulsie van de foetus (vermoedelijk is het Ot ook voor een deel
afkomstig van de foetale hypofyse, en mogelijk ook van de placenta). Aan het eind van de dracht
neemt ook het aantal Ot-receptoren toe (onder stimulatie van oestradiol). Effect van Ot op
myometriumcontractiliteit : Ot doet de frequentie, duur en amplitude van de actiepotentialen
toenemen, met als gevolg een toename in kracht en frequentie van de fasische uteruscontracties.
Dit gebeurt via een toename van het intracellulair calciumgehalte in de gladde spiercellen van het
myometrium.
° relaxine :
Polypeptide-hormoon dat gesynthetiseerd wordt door het drachtigheidsCL (Ru, su, rat, vrouw) en
door het endometrium (eq, konijn) en de placenta (cavia, vrouw). Het relaxeert de gladde
spiercellen van het myometrium via de productie van cAMP (daling van de fosforylatie van de
myosine light-chains). Zowel de concentratie aan relaxine zelf als aan relaxine-receptoren is laag
op het einde van de dracht, zodat uteriene contracties hervat kunnen worden. Ter hoogte van de
cervix heeft het hormoon een collagenolytische activiteit.
8.4.5.2. Het perifeer zenuwstelsel en zijn mediatoren.
De uterus (en de uterusbloedvaten) worden bezenuwd door sympathicus en parasympathicus via
cholinerge pre- en postganglionaire neuronen en via noradrenerge postganglionaire neuronen. Ok
95
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
werd recent een ATP-erge en peptiderge innervatie ontdekt, met VIP (vaso-intestinaal peptide),
substance P, NPY (neuropeptide Y) en CGRP (calcitonine gen-related peptide) als
neurotransmittors.
Effect op het myometrium : de daling in progesteronconcentratie ten gevolge van luteolyse
veroorzaakt een daling in adrenaline-concentraties in de uterus (stijging in activiteit van katabole
enzymen) en een daling van het aantal hoge-affiniteit -adrenerge receptoren : in de plaats van
het relaxerend effect van adrenaline op deze -adrenerge receptoren komt een dominantie van de
1-adrenerge receptoren, met bijgevolg een stimulatie van de uteruscontracties. De
hogervermelde neuropeptiden spelen vermoedelijk een rol bij de controle over de uteriene
doorbloeding (en langs deze weg de contractiliteit van de uterusspieren).
8.4.5.3. Hypothalamo-hypofyse-bijnieras van de foetus.
Bij ov, cap, bo, eq, su en konijn is het de (activatie van de) hypothalamo-hypofyse-bijnieras die
de duur van de dracht en het tijdstip van de partus bepaalt. ACTH- en cortisolconcentraties stijgen
aanzienlijk in het foetaal plasma tijdens de laatste dagen vóór de partus, vermoedelijk ten gevolge
van een geleidelijke toename in productie van PGE2 door de foetale trofoblast. Foetaal cortisol
doet de activiteit van steroïd-17-hydroxylase en steroïd-C-17,20-lyase (en vermoedelijk ook van
aromatase en steroïdsulfatase) toenemen, waardoor de secretie van progesteron afneemt en deze
van oestradiol stijgt (initiatie van de verandering in P4/E2-ratio!). De activatie van de bijnieren bij
de foetus is het gevolg van een auto-amplificatieproces : op het einde van de dracht heeft foetaal
cortisol een positief feedback-effect op de hypofyse, waardoor het stimulerend effect van CRF
(corticotropine-releasing factor) of van vasopressine op de secretie van ACTH versterkt wordt.
Ook de cellen van de bijniercortex worden, onder invloed van cortisol, gevoeliger voor de
werking van ACTH.
Bij rodentia en primaten daarentegen kan cortisol niet beschouwd worden als het primair signaal
ter inductie van de partus. Rijping van de foetale hypothalamo-hypofyse-bijnieras is bij deze
soorten wel essentieel voor de normale ontwikkeling van de foetus (groei en differentiatie van de
organen) en van de pasgeborene (o.a. synthese van pulmonair surfactant).
Effect van stress : stress (bvb. angst) activeert de opiaat-innervatie van de bijnier, wat een sterke
inhibitie van de oxytocine-secretie met zich meebrengt. Ook het gehalte aan -endorfines (hoog
bij vrouwen met langdurige bevalling, laag bij vrouwen met vlotte bevalling zonder complicaties)
speelt hierin een rol.
96
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
8.4.5.4. Uitstel en inductie van partus bij mens en dier.
° tocolytica (= stoffen die de uterus relaxeren) bij de vrouw :
-
adrenerge agonisten : -mimetica (bij voorkeur met 2-werking) zijn de enige stoffen die
voorlopig voorhanden zijn bij de behandeling van vrouwen met risico op premature
bevalling. De bruikbaarheid in geval van vergevorderde cervixdilatatie of bij ruptuur van de
foetale membranen is twijfelachtig, en bovendien zijn er veel nevenwerkingen aan het
langdurig gebruik ervan verbonden.
-
progestativa : toediening ervan gaat gepaard met een daling in oestrogeengehalte en
vermindert de activiteit van de uterus. In acute gevallen is gelijktijdige toediening van lage
doses -mimetica vereist.
-
non-steroïdale anti-inflammatoire stoffen (NSAID’s, bvb. indomethacine, acetylsalicylzuur =
aspirine): inhibitoren van de PG-synthese onderdrukken de contractiliteit van het
myometrium en stellen op die manier de partus uit. Ze zijn evenwel minder efficiënt ter
voorkoming van dreigende vroeggeboorte dan de -mimetica.
-
anti-oxitocica : verscheidenen antagonisten van oxytocine werden synthetisch aangemaakt.
Een aantal daarvan (bvb. 1-deamino 2-D-Tyr-(O-ethyl) 4-Thr 8-Orn-oxytocine) bleken ook in
vivo werkzaam, met gedeeltelijke of volledige onderdrukking van de uteruscontracties.
-
inhibitoren van de calciumkanalen (bvb. nicarpidine, nifedipine): worden bij voorkeur
gebruikt in combinatie met -mimetica, zodat de dosis van deze laatsten verminderd kan
worden
° opwekken van weëen :
-
oxytocica (bvb. syntocinon): kan weëen opwekken bij een zwangerschap à terme, op
voorwaarde dat de cervix gedilateerd is. Is dat niet het geval, dan geeft men de voorkeur aan
PG’s.
-
prostaglandines : spelen zowel een rol bij rijping van de cervix als bij inductie van
uteruscontracties. Bij de meeste landbouwhuisdieren (bo, su, cap, eq ; niet bij ov!) evenals bij
de vrouw kan de partus opgewekt worden door toediening van PGF2, hoewel het
mechanisme in beide gevallen verschilt : rechtstreekse inductie van myometriumactiviteit en
cervixveranderingen bij de vrouw, onrechtstreekse inductie via luteolyse bij de andere
species. Lokale applicatie van PGE2 onder de vorm van een intracervicale gel wordt
toegepast om de cervix te doen rijpen, met bijgevolg een opwekking van de weëen.
97
Hoofdstuk 8
Reproductiefysiologie
______________________________________________________________________________________
-
oestrogenen : bij ooien kan intramusculaire toediening van oestradiolbenzoaat aan het einde
van de dracht de partus op gang brengen binnen de 24 uur (positieve correlatie tussen plasmaoestrogeengehalte en uterusactiviteit).
-
corticosteroïden : bij ooien kan intramusculaire injectie van synthetische corticosteroïden
(bvb. dexamethasone) de partus induceren. Hetzelfde geldt voor geit en rund, terwijl de
methode bij paard en zeug minder effectief blijkt. Bij het rund treedt hierbij vaak “retentio
secundinarum” (= achterblijven van de placenta) op, zodat een gelijktijdige toediening van
relaxine aangewezen is.
-
anti-progestativa (bvb. trilostaan): inhibitor van de progesteronsynthese die bij de ooi de
partus kan induceren (ook bij mens in geval van foetaal overlijden).
98