Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
■■
■■
7
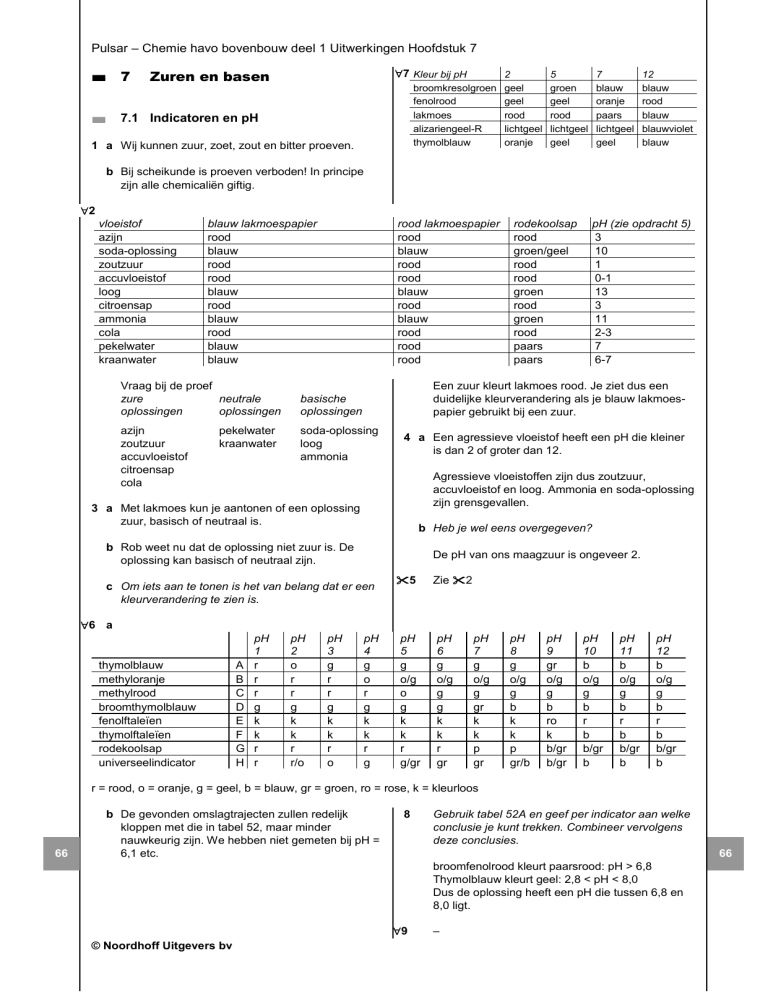
7 Kleur bij pH
Zuren en basen
broomkresolgroen
fenolrood
lakmoes
alizariengeel-R
thymolblauw
7.1 Indicatoren en pH
1 a Wij kunnen zuur, zoet, zout en bitter proeven.
2
geel
geel
rood
lichtgeel
oranje
5
groen
geel
rood
lichtgeel
geel
7
blauw
oranje
paars
lichtgeel
geel
12
blauw
rood
blauw
blauwviolet
blauw
b Bij scheikunde is proeven verboden! In principe
zijn alle chemicaliën giftig.
2
vloeistof
azijn
soda-oplossing
zoutzuur
accuvloeistof
loog
citroensap
ammonia
cola
pekelwater
kraanwater
blauw lakmoespapier
rood
blauw
rood
rood
blauw
rood
blauw
rood
blauw
blauw
Vraag bij de proef
zure
neutrale
oplossingen
oplossingen
azijn
zoutzuur
accuvloeistof
citroensap
cola
pekelwater
kraanwater
rood lakmoespapier
rood
blauw
rood
rood
blauw
rood
blauw
rood
rood
rood
rodekoolsap
rood
groen/geel
rood
rood
groen
rood
groen
rood
paars
paars
pH (zie opdracht 5)
3
10
1
0-1
13
3
11
2-3
7
6-7
Een zuur kleurt lakmoes rood. Je ziet dus een
duidelijke kleurverandering als je blauw lakmoespapier gebruikt bij een zuur.
basische
oplossingen
soda-oplossing
loog
ammonia
4 a Een agressieve vloeistof heeft een pH die kleiner
is dan 2 of groter dan 12.
Agressieve vloeistoffen zijn dus zoutzuur,
accuvloeistof en loog. Ammonia en soda-oplossing
zijn grensgevallen.
3 a Met lakmoes kun je aantonen of een oplossing
zuur, basisch of neutraal is.
b Heb je wel eens overgegeven?
b Rob weet nu dat de oplossing niet zuur is. De
oplossing kan basisch of neutraal zijn.
De pH van ons maagzuur is ongeveer 2.
c Om iets aan te tonen is het van belang dat er een
kleurverandering te zien is.
5
Zie 2
6 a
thymolblauw
methyloranje
methylrood
broomthymolblauw
fenolftaleïen
thymolftaleïen
rodekoolsap
universeelindicator
A
B
C
D
E
F
G
H
pH
1
r
r
r
g
k
k
r
r
pH
2
o
r
r
g
k
k
r
r/o
pH
3
g
r
r
g
k
k
r
o
pH
4
g
o
r
g
k
k
r
g
pH
5
g
o/g
o
g
k
k
r
g/gr
pH
6
g
o/g
g
g
k
k
r
gr
pH
7
g
o/g
g
gr
k
k
p
gr
pH
8
g
o/g
g
b
k
k
p
gr/b
pH
9
gr
o/g
g
b
ro
k
b/gr
b/gr
pH
10
b
o/g
g
b
r
b
b/gr
b
pH
11
b
o/g
g
b
r
b
b/gr
b
pH
12
b
o/g
g
b
r
b
b/gr
b
r = rood, o = oranje, g = geel, b = blauw, gr = groen, ro = rose, k = kleurloos
b De gevonden omslagtrajecten zullen redelijk
kloppen met die in tabel 52, maar minder
nauwkeurig zijn. We hebben niet gemeten bij pH =
6,1 etc.
66
8
66
7
broomfenolrood kleurt paarsrood: pH > 6,8
Thymolblauw kleurt geel: 2,8 < pH < 8,0
Dus de oplossing heeft een pH die tussen 6,8 en
8,0 ligt.
9
© Noordhoff Uitgevers bv
Gebruik tabel 52A en geef per indicator aan welke
conclusie je kunt trekken. Combineer vervolgens
deze conclusies.
–
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
10 Bij verdunning van een zure oplossing stijgt de pH.
Bij verdunning van een basische oplossing daalt
de pH.
11 a Zie proef 10.
Als je een basische oplossing verdunt, wordt de
pH kleiner.
b Waarmee verdun je altijd? Wat is daarvan de pH?
Om te verdunnen voeg je water toe. Dat heeft een
pH = 7. Hoe meer water je toevoegt, hoe meer de
pH in de buurt van 7 komt.
als een oplossing
van zilvernitraat
wordt
toegevoegd?
Wat gebeurt er
als een stukje
magnesiumlint
wordt
toegevoegd?
Welke smaak
zullen de
oplossingen
hebben?
wit neerslag.
wit neerslag.
Er zijn belletjes te
zien: een
gasontwikkeling.
Er gebeurt niets
zichtbaars.
Zuur
Zout
Vragen bij de proef
12
13
Het rodekoolsap kleurt groen met het afwassopje.
Blijkbaar is afwasmiddel een basische oplossing.
Zoek twee indicatoren uit tabel 52A op.
Op grond van de eerste indicator kun je
concluderen: de pH is groter dan ...
Op grond van de tweede indicator kun je
concluderen: de pH is lager dan ...
Ernst kan gebruik gemaakt hebben van
broomthymolblauw en van thymolblauw. Met
broomthymolblauw is de kleur blauw; de conclusie
is dan: de pH is groter dan 7,6.
Met thymolblauw is de kleur geel; de conclusie is
dan: de pH is lager dan 8,0.
Dit levert samen de conclusie op dat de pH tussen
7,6 en 8,0 ligt.
14
Kijk nog eens goed naar opdracht 2.
Bij een neutrale oplossing blijft rood lakmoespapier rood en blijft blauw lakmoespapier blauw.
Je moet dus beide soorten papier gebruiken.
15
1 Oplossingen met een pH<7 zijn zuur. Zoutzuur
is dus zuur.
2 Het moet zilverchloride zijn: Ag+(aq) + Cl-(aq)
Ag+Cl-(s)
3 Beide oplossingen geleiden de stroom en
bevatten dus vrije ionen.
Beide oplossingen bevatten o.a. chloride-ionen,
omdat zilverchloride neerslaat.
4 Het gas ontstaat alleen in de oplossing van
waterstofchloride. Het gas is kleurloos en stinkt
niet. Bij verder onderzoek blijkt dat het
brandbaar is. Het moet dus wel waterstof, H2(g)
zijn.
b In de zoutoplossing is het positieve ion Na+. In het
zoutzuur moet ook een positief ion aanwezig zijn.
Aangezien bij de reactie tussen zoutzuur en
magnesium waterstof ontstaat, kan het positieve
ion een waterstofion, H+, zijn. Dat ion moet dan
verantwoordelijk zijn voor de zure eigenschappen.
Gebruik de resultaten van proef 6.
18 a Kijk goed naar de formules in bron 8.
Bij lage pH gaat universeelindicator van rood via
oranje naar geel. Dat doet thymolblauw ook.
Broomkresolgroen en broomthymolblauw gaan
van geel via groen naar blauw. Zij kunnen dus
voor het geel/groene gedeelte zorgen. Bij hogere
pH worden al deze indicatoren blauw.
16
■■
–
7.2 Zuren en zure oplossingen
17 Welke eigenschappen heeft een zure oplossing?
proef
oplossing van
waterstofchloride
(zoutzuur)
Hoe groot is de
pH?
1–2
Geleidt de
oplossing de
stroom?
Wat gebeurt er
Ja
oplossing van
natriumchloride
(keukenzoutoplos
sing)
7
Volgens opdracht 17 moeten alle zure oplossingen
H+ ionen bevatten. Dus moeten in alle formules
één of meer H’s voorkomen.
b Volgens tabel 103A is azijnzuur de triviale naam
van ethaanzuur.
19 a Blijkbaar leveren zuren, net als zouten, ionen als
ze worden opgelost in water. Noteer de reactie
dus net zo als bij het oplossen van een zout in
water.
salpeterzuur waterstofionen + nitraationen
HNO3(l)
H+(aq) + NO3-(aq)
b Kijk goed naar de formules van de zuren.
De formule van zwavelzuur is H2SO4. Dit kan
splitsen in twee H+ ionen en sulfaationen.
Ja
c De formule van fosforzuur is H3PO4. Dit kan
splitsen in drie H+ ionen en fosfaationen.
Er ontstaat een
Er ontstaat een
20 a Na+Cl-(s)
© Noordhoff Uitgevers bv
67
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
b Na+(aq) + Cl-(aq)
2 Welke van deze oplossingen zijn basisch?
ammonia; en oplossingen van natriumoxide,
natriumhydroxide, natriumcarbonaat,
natriumethanoaat en
natriumwaterstofcarbonaat.
c De notatie bij b geeft weer welke ionen in welke
verhouding voorkomen, maar niet de hoeveelheid.
21
Pak het net zo aan als bij zouten. Als het een
oplossing is, moet je de ionen weergeven.
a
b
c
d
e
H2SO4(l)
2 H+(aq) + SO42-(aq)
2 H+(aq) + SO42-(aq)
3 H+(aq) + PO43-(aq)
H+(aq) + CH3COO-(aq)
b NH3, O2- , OH- , CO32-, CH3COO27
22
–
23
Zuiver zwavelzuur kun je (voorzichtig) mengen
met water.
Veel zwavelzuur en weinig water: geconcentreerd
zwavelzuur.
Weinig zwavelzuur en veel water: verdund
zwavelzuur.
24
Blijkbaar leveren zuren, net als zouten, ionen als
ze worden opgelost in water. Noteer de reactie
dus net zo als bij het oplossen van een zout in
water.
a HI (g)
H+(aq) + I(־aq)
b CH3COOH (l)
c H3PO4(l)
25
■■
H+(aq) + CH3COO(־aq)
Let op de definitie van basen.
Basen kunnen H+ ionen opnemen. Deze H+ ionen
worden vanwege hun lading aangetrokken door
negatieve ionen.
28 a In de oplossing van kaliumchloride komen K+
ionen voor. De pH van de oplossing is 7. De
oplossing is dus niet basisch, K+ is geen base.
b De kaliumhydroxide-oplossing heeft een pH = 12
en is dus basisch. De oplossing bevat K+ ionen en
OH ־ionen. K+ ionen zijn niet basisch (zie a). Dus
moet OH ־een base zijn.
29 a Let op de reactie in bron 11. Wat moet er
gebeuren om natriumoxide te schrijven in plaats
van
O2-?
Bron 11: O2- + H2O → 2 OH־
De formule van natriumoxide is Na+2O2-(s). Er zijn
dus twee Na+ ionen extra.
Dus Na+2O2-(s) + H2O → 2 Na+(aq) + 2 OH(־aq)
3 H+(aq) + PO43-(aq)
Roest reageert blijkbaar met zure oplossingen
zoals cola en maagsap. Maagsap heeft een pH
van 2 en is dus een zure vloeistof. Hierin zal roest
ook verdwijnen.
b De oplossing bevat Na+ en OH־. Het is dus een
oplossing van natriumhydroxide.
7.3 Basen en basische oplossingen
c Het oxide is zo slecht oplosbaar, dat er geen
reactie met water kan optreden.
26 Welke kleur lakmoespapier gebruik je?
Je wilt een base aantonen. Basen kleuren rood
lakmoespapier blauw. Je moet dus rood
lakmoespapier gebruiken.
68
a Na+ is geen base, omdat diverse oplossingen met
Na+ erin rood lakmoes niet blauw kleuren.
ammonia
natriumnitraatoplossing
natriumoxide-oplossing
natriumsulfaatoplossing
natriumhydroxide-oplossing
natriumcarbonaatoplossing
natriumchloride-oplossing
natriumethanoaatoplossing
natriumwaterstofcarbonaato
plossing
kleur lakmoespapier
blauw
rood
blauw
rood
blauw
blauw
rood
blauw
paars/blauw
Vragen bij de proef
1 Welke eigenschap heeft een basische
oplossing?
Een basische oplossing kleurt rood lakmoes
blauw.
© Noordhoff Uitgevers bv
30 a Het gaat in alle gevallen om zouten. Je moet het
dus net zo noteren als je bij zouten geleerd hebt.
Denk aan de juiste verhoudingen tussen de
ionsoorten.
– 2 K+(aq) + CO32-(aq)
– kalkwater is een oplossing van
calciumhydroxide: Ca2+(aq) +2 OH(־aq)
– Ba2+(aq) + 2 CH3COO(־aq)
– K+(aq) + Cl(־aq)
b Kijk nog eens goed in bron 10.
De eerste drie oplossingen zijn basisch. De
oplossing van kaliumchloride is niet basisch.
31
Kijk nog eens goed in bron 10.
68
De basen zijn CO32-(aq), OH(־aq) en
CH3COO(־aq).
32
Er zijn drie mogelijkheden: zuur, basisch of
neutraal. Hoe kun je zuren en basen aantonen?
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
a Na+(aq) + Cl(־aq); Na+(aq) + CH3COO(־aq); H+(aq)
+ NO3(־aq)
b aantal mol H+
1,0
aantal mL
1000
Hieruit bereken je
b Je kunt van de drie oplossingen de pH meten,
bijvoorbeeld met universeelindicator-papier. De
eerste oplossing is neutraal (pH = 7, kleur
geelgroen). De tweede oplossing is basisch (pH =
9, kleur groenblauw).
De derde oplossing is zuur. (pH < 3, kleur
rood/oranje).
33
Dus [H+] = 1,0 x 10-4 mol H+
c Er is dus 1,0 x 10-4 mol H+ aanwezig per liter
oplossing. (het volume van die twee druppels mag
je verwaarlozen: 1000 + 0,10 = 1000).
d pH = -log (1,0 x 10-4) = 4,0
Let op de gegevens in tabel 45A en in bron 11.
e De pH daalt dus van 7,0 naar 4,0: een daling van
3,0.
a Calciumhydroxide is een zout, dat matig oplost in
water.
Ca2+(OH)־2(s)
39
Ca2+(aq) + 2 OH(־aq)
b Ca2+O2-(s) + H2O → Ca2+(aq) + 2 OH(־aq)
34
b De exponent is -5, dus -pH = -5,0 → pH = 5,0
In de ontstane oplossing komen hydroxide-ionen
voor, OH(־aq). Deze ionen zijn basen.
aantal mol H+
aantal L
….
1,00
0,25
0,250
Met het kruisproduct bereken je:
b aantal mol H+
aantal L
1,3 x 10-4
0,015
= 1,00
....
1,00
= 8,66 x 10-3
als bij a
Dus [H+] = 8,66 x 10-3 mol L-1
pH = -log 8,66 x 10-3 = 2,06
aantal mol H+
aantal L
als bij a
2,0
1,5
....
1,0
= 1,33
Dus [H+] = 1,33 mol L-1
pH = -log 1,33 = -0,12
37
Om de pH te berekenen moet je uitrekenen
hoeveel -log[H+] is.
[H+] = 0,60 → pH = -log[H+] = -log 0,60 = 0,22
38 a De pH van gedestilleerd water is 7,0
© Noordhoff Uitgevers bv
Algemeen geldt dus: als de pH = a, dan is [H+] =
10-a.
a [H+] = 10-2,30 Omgerekend [H+] = 5,0 x 10-3 mol L-1
b [H+] = 10-4,20 Omgerekend [H+] = 6,3 x 10-3 mol L-1
c [H+] = 10-(-0,70) = 100,70 Omgerekend [H+] = 5,0 mol
L-1
41
Als je het volume a x zo groot maakt, heb je de
oplossing a x verdund.
Het volume wordt 2 x zo groot. Kees heeft de
oplossing dus 2 x verdund.
Dus [H+] = 1,00 mol L-1
pH = -log1,00 =0,00
c
40
7.4 De pH van zure oplossingen
35/36 Er zitten dus twee stappen in de berekening:
1) bereken [H+]: hoeveel mol H+ is aanwezig per
liter?
2) bereken de pH: -log[H+]
a
Eigenlijk staat hier dat de exponent direct de
waarde van de pH oplevert.
a De exponent is -3, dus -pH = -3,0 → pH = 3,0
Let op bron 11.
■■
….
0,10
= 1,0 x 10-4
42 Vragen bij de proef
1) Bereken eerst [H+] van de beginoplossing.
Hieruit kun je [H+] van de verdunde oplossingen
A, B en C berekenen. Daarna kun je de pH van
de oplossingen A, B en C berekenen.
pH = 0,0 → [H+] = 10-0,0 = 1,0 mol L-1
Om de oplossingen A, B en C te maken, wordt de
eerste oplossing 10, respectievelijk 100 en 1000
maal verdund. Dus in oplossing A is [H+] = 0,10 →
pH = -log 0,10 = 1,0.
In oplossing B is [H+] = 0,010 → pH = -log 0,010 =
2,0
In oplossing C is [H+] = 0,0010 → pH = -log 0,0010
= 3,0
2) Om een oplossing 10 x te verdunnen moet je
het volume 10 x zo groot maken. Dus bijv. 1,0
mL oplossing + 9,0 mL water.
3) Om een oplossing 100 x te verdunnen werk je
meestal in twee stappen: de eerste oplossing
10 x verdunnen, waarna je de ontstane
oplossing nog eens 10 x verdunt.
Een oplossing 1000 x verdunnen kan het best in
drie stappen: 10x verdunnen; de ontstane
oplossing weer 10 x verdunnen, waarna je deze
oplossing nogmaals 10 x verdunt.
69
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
4) Er kunnen diverse oorzaken zijn:
onnauwkeurigheden bij het verdunnen, water
dat niet helemaal zuiver is,
temperatuurschommelingen.
b [H+] = 1,5 x 10-3 mol L-1 → pH = -log 1,5 x 10-3 =
2,8
■■
7.5 De pH van basische oplossingen
49
De aanpak van berekeningen met [OH ]־en de
pOH verlopen precies zo als die met [H+] en de
pH.
a Zie vraag 2 bij de proef.
b Zie vraag 3 bij de proef.
c Zie vraag 3 bij de proef.
a [OH = ]־2,4 x 10-3 mol L-1 → pOH = -log 2,4 x 10-3
= 2,6
43 a Wat is de pH van de vloeistof waarmee je
verdunt?
Water heeft een pH van ongeveer 7. De pH van
een zure oplossing gaat bij verdunnen in de
richting van pH = 7. De pH zal dus stijgen.
b [OH = ]־1,0 mol L-1 → pOH = -log 1,0 = 0,0
c [OH = ]־2,7 mol L-1 → pOH = -log 2,7 = -0,4
50
b pH = 3,3 → [H+] = 10-3,3 Omgerekend [H+] = 5,0 x
10-4 mol L-1
Bereken eerst [OH ]־en vervolgens de pOH.
Er is 2,4 x 10-3 mol OH ־per 0,50 liter.
Dus er is 4,8 x 10-3 mol OH- per liter. [OH-] =
4,8 x 10-3 mol L-1
pOH = -log 4,8 x 10-3 = 2,3.
c Als je 100 x verdunt, wordt het volume 100 x zo
groot en [H+] 100 x zo klein.
51
[H+] = 5,0 x 10-4 : 100 = 5,0 x 10-6 mol L-1
Werk in stappen: bereken eerst [OH ]־en
vervolgens de pOH.
Zie ook opdracht 50.
pH = -log (5,0 x 10-6) = 5,3
44
Er is 0,20 mol OH ־per 50 mL. Dus 4,0 mol OH־
per liter.
pOH = -log 4,0 = -0,6
Als je het volume a x zo groot maakt, heb je de
oplossing a x verdund.
a Als hij 5 x wil verdunnen, moet hij het volume 5 x
zo groot maken. Het volume is 100 mL en het
moet 500 mL worden. Pim moet dus 400 mL water
toevoegen.
b Er zijn drie stappen nodig:
1) Bereken [H+] van het zoutzuur met pH = 2,5.
2) Bereken [H+] van het zoutzuur na het
verdunnen.
3) Bereken de pH van het verdunde zoutzuur.
52
a pH = 14,00 – 2,6 = 11,4
b pH = 14,00 – 0,0 = 14,0
c pH = 14,00 – (-0,4) = 14,4
53 a Ga eerst na wat er gebeurt als calciumhydroxide
wordt opgelost.
0,20 mol Ca2+(OH)־2 levert bij oplossen 0,40 mol
OH־.
Er is dus 0,40 mol OH ־per 2,5 liter.
Dus [OH = ]־0,40 / 2,5 mol L-1 = 0,16 mol L-1.
1) pH = 2,5 → [H+] = 10-2,5 mol L-1 Omgerekend
[H+] = 3,2 x 10-3 mol L-1
2) Na verdunnen is [H+] 5 x zo klein: [H+] = 6,4 x
10-4 mol L-1
3) pH = -log 6,4 x 10-4 = 3,2
45
b Bereken altijd eerst pOH. Bereken daarna de pH
met de regel
pH + pOH = 14,00.
Je moet [H+] weten. Als die niet gegeven is, moet
je weten hoeveel gram of hoeveel mol van een
bepaald zuur per liter is opgelost.
pOH = -log 0,16 = 0,8 → pH = 14,00 – 0,8 = 13,2
54
46
70
Als de pH = -2,0 dan is [H+] = 1,0 x 102 mol L-1.
Het lukt niet om 100 mol van een zuur op te lossen
in 1,0 liter water. Zulke hoge concentraties zijn niet
haalbaar.
47 a Het blijkt dat verschillende zuren met dezelfde [H+]
een verschillende zure smaak hebben. Blijkbaar is
[H+] niet als enige verantwoordelijk voor de zure
smaak.
b Zoutzuur smaakt het zuurst.
48 a Sommige opgeloste stoffen maken regen zuur.
Van nature zit er al koolstofdioxide in. Een stof als
zwaveldioxide leidt tot de vorming van zwavelzuur.
Hierdoor wordt regenwater nog zuurder.
© Noordhoff Uitgevers bv
Gebruik de regel: pH + pOH = 14,00
Als je het volume a x zo groot maakt, heb je de
oplossing a x verdund.
De concentraties van de opgeloste stoffen worden
a x zo klein.
a Het volume wordt 2 x zo groot. De oplossing is dus
2 x verdund.
b [OH ]־wordt 2 x zo klein: dus na verdunnen is [OH]־
= 0,22 : 2 = 0,11 mol L-1.
c Bereken altijd eerst pOH. Bereken daarna de pH
met de regel
pH + pOH = 14,00.
pOH = -log 0,11 = 0,96 → pH = 14,00 – 0,96 =
13,04
d Wat is de pH van het water waarmee je verdunt?
70
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
[OH= ]־0,1 mol L-1. De pOH = -log 0,1 = 1,0 →
pH = 14,0 – 1,0 = 13,0.
De pH gaat bij verdunnen altijd in de richting van
de pH van water: 7,0. De oplossing wordt minder
basisch. De pH van een basische oplossing daalt
dus bij verdunnen.
55
c Na 100 x verdunnen is [OH = ]־0,01 mol L-1.
De pOH = -log 0,01 = 2,0 → pH = 14,0 – 2,0 = 12,0
Na 1000 x verdunnen is [OH = ]־0,001 mol L-1.
De pOH = -log 0,001 = 3,0 → pH = 14,0 – 3,0 =
11,0
Bereken eerst de pOH, daarna [OH-].
a pOH = 14,00 -12,6 = 1,4 → [OH = ]־10-1,4
Omgerekend [OH = ]־4,0 x 10-2 mol L-1
59
Je kunt nooit rechtstreeks met de pH zelf
berekeningen doen. Omdat pH > 7 is het een
basische oplossing. Daarom moet je de pH eerst
omrekenen in pOH en [OH]־.
b pOH = 14,0 – 8,7 = 5.3 → [OH = ]־10-5,3
Omgerekend [OH = ]־5,0 x 10-6 mol L-1
c pOH = 14,0 -14,3 = -0,3 → [OH = ]־100,3
Omgerekend [OH = ]־2,0 mol L-1
56 a Kijk in tabel 45B. Hoeveel mol NaOH kun je
oplossen in 1,0 liter water?
Volg dezelfde aanpak als in opdracht 55. Dan
geldt dus: pOH = 14,00 – 15,0 = – 1,0.
Dan is [OH = ]־101,0 = 10 mol L-1. Volgens tabel
45A kan er iets meer dan 10 mol NaOH oplossen
per liter water. Deze hoge concentratie is vrijwel
het maximum.
Een pH van 15,0 is dus mogelijk.
Als pH = 16,0 → pOH = -2,0 → [OH = ]־10-(-2,0) =
100 mol L-1
Zo’n hoge concentratie is niet mogelijk. De pH kan
niet gelijk zijn aan 16,0.
b In de praktijk werken we meestal met verdunde
oplossingen en dan ligt de pH inderdaad tussen 0
en 14. Pas bij zeer geconcentreerde (en dan ook
gevaarlijke) oplossingen komt de pH onder de 0 of
boven de 14.
57
58
Martijn vergeet dat water ook H+ bevat. Water
heeft een pH = 7, dus [H+] =
1,0 x 10-7 mol L-1. Dit getal, dat veel groter is dan
1,0 x 10-11 laat Martijn helemaal buiten
beschouwing.
Bovendien moet je in een basische oplossing altijd
rekenen aan OH-.
Martijn moet het als volgt aanpakken: Als de
pH = 10,0 → pOH = 4,0.
Dus [OH = ]־1,0 x 10-4. Dit is ten opzichte van
1,0 x 10-7 een groot getal. Nu mag Martijn rustig
zeggen: Na verdunnen is [OH = ]־1,0 x 10-5 →
pOH = 5,0 en pH = 9,0
Verder hoort de pH van een basische oplossing
natuurlijk te dalen bij verdunnen.
Anders zou de oplossing bij verdunnen steeds
basischer worden met een steeds hogere pH. Dat
kan natuurlijk niet.
Wat is de pH van het water waarmee je verdunt?
Bereken bij basische oplossingen altijd eerst
[OH]־, dan de pOH en dan de pH.
a Als je een basische oplossing verdunt, daalt de
pH.
b In de oorspronkelijke oplossing is [OH= ]־
1 mol L-1. Na tienmaal verdunnen is
© Noordhoff Uitgevers bv
a pH =12,60 → pOH = 14,00 – 12,60 = 1,40 → [OH]־
= 10-1,40 = 4,0 x 10-2 mol L-1.
b pH = 11,30 → pOH = 14,00 – 11,30 = 2,70 →
[OH = ]־10-2,70 = 2,0 x 10-3 mol L-1.
c Je moet uitrekenen hoeveel maal de oplossing is
verdund. Daarvoor moet je de [OH ]־in beide
oplossingen met elkaar vergelijken.
De [OH ]־in de eerste oplossing is 4,0 x 10-2 : 2,0 x
10-3 = 20 x zo geconcentreerd als de tweede
oplossing. Fred moet de eerste oplossing dus 20 x
verdunnen. Het volume moet dus 20 x zo groot
worden. Bij 1,0 mL natronloog moet dus 19 mL
water. Het volume wordt dan 1,0 + 19 = 20 mL.
60 a Er zijn twee stappen: 1) pH omrekenen in pOH. 2)
pOH omrekenen in [OH]־.
pOH = 14,00 – 12,70 = 1,30 → [OH = ]־10-1,30 =
5,0 x 10-2 mol L-1.
b aantal mol OH־
aantal mL crème
5,0 x 10-2
1000
Hieruit bereken je
....
60
= 3,0 x 10-3 mol.
c De crème heeft een hoge pH en zal daarom niet
zo gunstig zijn voor de huid. De meeste crèmes
moeten na vrij korte tijd zorgvuldig worden
afgespoeld om huidbeschadiging te voorkomen.
■■
7.6 Zuur-base reacties
61 a waterstofchloride(g) + ammoniak(g) → ammoniumchloride(s)
HCl(g) + NH3(g) → NH4+Cl(־s)
b Links van de pijl staat HCl, rechts van de pijl staat
Cl־. De HCl moleculen hebben dus een H+ ion
afgestaan.
Links van de pijl staat NH3, rechts van de pijl staat
NH4+. De NH3 moleculen hebben een H+ ion
opgenomen.
62 a Bekijk bron 8 en 9 nog eens.
H+(aq) + Cl(־aq)
b zoutzuur
c NH3(aq)
71
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
d ammonia
e Geef de vergelijking eerst in woorden. Wat staat er
in tabel 45 over ammoniumchloride?
Ammonia + zoutzuur → oplossing van ammoniumchloride
NH3(aq) + H+(aq) + Cl(־aq) → NH4+(aq) + Cl(־aq)
Je moet dit nog vereenvoudigen: NH3(aq) + H+(aq)
→ NH4+(aq)
1 Een soda-oplossing met fenolftaleïen is
paarsrood.
2 De pH van de soda-oplossing is dus groter dan
10,0.
3 Bij het toevoegen van de schoonmaakazijn
wordt de oplossing kleurloos. Verder zijn er
belletjes te zien: gasontwikkeling.
63 a stap 1 kaliloog = oplossing van KOH; salpeterzuur is HNO3.
stap 2 kaliloog: K+(aq) + OH(־aq)
salpeterzuuroplossing: H+(aq) + NO3(־aq)
stap 3 Het zuur is H+(aq); de base is OH(־aq). De
base kan 1 H+ opnemen.
stap 4 H+(aq) + OH(־aq) → H2O(l)
b stap 1 ethaanzuur = CH3COOH;
natriumcarbonaat = Na+2CO32-.
stap 2 H+(aq) + CH3COO(־aq) ; Na+(aq) + CO32(aq)
stap 3 Het zuur is H+(aq); de base is CO32-(aq).
De base kan 2 H+ opnemen.
stap 4 2 H+(aq) + CO32-(aq) → H2CO3(aq)
De soda-oplossing bevat Na+(aq) en CO32-(aq).
Schoonmaakazijn bevat H+(aq) en CH3COO(־aq).
2 H+(aq) + CO32-(aq) → H2CO3(aq)
De gasontwikkeling is met deze reactievergelijking
niet te verklaren.
e Soda is ook een schoonmaakmiddel. Het is dus
niet slim om schoonmaakazijn en soda te mengen,
omdat beide oplossingen met elkaar reageren en
beide schoonmaakmiddelen verdwijnen.
a
b
c
d
67
64 a Bij neutraliseren reageren een zuur en een base
met elkaar, waarbij een neutrale oplossing
ontstaat.
b Raadpleeg tabel 52A. Welke pH hoort bij een
neutrale oplossing?
Het moet een indicator zijn, die een omslagtraject
heeft rondom pH = 7.
Voorbeelden: broomfenolrood, broomthymolblauw.
c Om een basische oplossing te neutraliseren moet
je een zuur toevoegen. Daarbij daalt de pH. Je
moet stoppen als de pH 7 wordt.
d Je kunt broomthymolblauw gebruiken. Zolang de
pH boven de 7,6 is, blijft de oplossing blauw. Als
de oplossing groen wordt, ligt de pH in de buurt
van de 7.
65 Vragen bij de proef
1 Zoutzuur met broomthymolblauw is geel.
2 De pH van zoutzuur is dus kleiner dan 6,0.
3 Bij een groene kleur is: 6,0 < pH < 7,6.
4 Bij het indampen ontstaat een witte vaste stof.
5 In de oplossing zitten Na+ ionen en Cl ־ionen. Er
ontstaat dus Na+Cl(־s).
6 Met een extra portie natronloog wordt de
oplossing blauw.
7 De pH van deze oplossing is nu hoger dan 7,6.
b stap 1 salpeterzuur: HNO3(l)
bariumhydroxide: Ba2+(OH)־2.
stap 2 zuiver salpeterzuur bevat HNO3;
bariumhydroxide-oplossing: Ba2+(aq) en
OH(־aq)
stap 3 het zuur is HNO3; de base is OH(־aq).
stap 4 HNO3(l) + OH(־aq) → H2O(l) + NO3(־aq).
68 a Raadpleeg tabel 52A.
kleur voor het neutraliseren: geel.
kleur na het neutraliseren: oranje.
b Gebruik weer de aanpak van bron 24.
stap 1 kaliloog is een oplossing van KOH;
zwavelzuur: H2SO4.
stap 2 kaliloog K+(aq) en OH(־aq); verdund
zwavelzuur: H+(aq) en SO42-(aq)
stap 3 Het zuur is H+(aq), de base is OH(־aq).
stap 4 H+(aq) + OH(־aq) → H2O(l)
69 a Brandend maagzuur is blijkbaar zuurder en heeft
dus een lagere pH dan gewoon maagzuur.
b Om het maagzuur te binden moeten Rennies een
base bevatten.
70
a Zoutzuur bevat de ionen H+(aq) en Cl(־aq).
b Natronloog bevat de ionen Na+(aq) en OH(־aq).
c Bij de reactie verandert de pH. Welke ionen
reageren dus met elkaar?
72
H+(aq) + OH(־aq) → H2O(l)
d Welke ionen hebben niet gereageerd? Wat
gebeurt er bij indampen?
De oplossing bevat in ieder geval Na+ ionen en de
Cl ־ionen.
66 Vragen bij de proef
© Noordhoff Uitgevers bv
Gebruik weer de aanpak van bron 24.
a stap 1 ammonia: NH3(aq)
zwavelzuur: H2SO4
stap 2 ammonia bevat NH3(aq); verdund
zwavelzuur: H+(aq) en SO42-(aq)
stap 3 Het zuur is H+(aq), de base is NH3(aq).
stap 4 H+(aq) + NH3(aq) → NH4+(aq)
Koolzuur, H2CO3, ontleedt in water en koolstofdioxide. Het koolstofdioxide ontsnapt en zorgt voor
een gasontwikkeling.
71 a Zoutzuur bevat H+(aq) en Cl(־aq). Notatie: H+(aq) +
Cl(־aq).
b Het zuur is H+(aq); de base is O2-, die aanwezig is
in calciumoxide, Ca2+O2-(s).
c De base O2- kan 2 H+ opnemen.
d 2 H+(aq) + Ca2+O2-(s) → H2O(l) + Ca2+(aq)
e Ook zwavelzuur bevat H+ ionen, die met
calciumoxide zullen reageren.
f 2 H+(aq) + Ca2+O2-(s) → H2O(l) + Ca2+(aq)
Ca2+(aq) + SO42-(aq) → Ca2+SO42-(s)
72
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
Oplossing III bevat Na+(aq) en NO3(־aq). Deze
ionen hebben geen zure of basische
eigenschappen. Oplossing III is dus neutraal.
b pH = 3,0 → [H+] = 10-3,0 Omgerekend [H+] =
1,0 x 10-3 mol L-1
c Bij basische oplossingen moet je de pH eerst
omrekenen in pOH. Daarna kun je [OH]־
berekenen.
g De witte vaste stof moet wel calciumsulfaat,
Ca2+SO42-(s), zijn, dat matig oplosbaar is in water.
h Eigenlijk is er sprake van twee reacties: 1) de
zuur-base reactie 2) de neerslagreactie. Je moet
beide reacties combineren:
2 H+(aq) + SO42-(aq) + Ca2+O2-(s) → H2O(l) +
Ca2+SO42-(s)
72 a Het zuur is natuurlijk H+(aq). De base is CO32-,
“verstopt” in calciumcarbonaat.
b Wat is er over calciumcarbonaat te vinden in tabel
45A?
pH = 10,0 → pOH = 14,00 -10,0 = 4,0 → [OH= ]־
10-4,0 = 1,0 x 10-4 mol L-1
8
Calciumcarbonaat is een zout, dat slecht
oplosbaar is in water. Een oplossing van
calciumcarbonaat, met losse ionen, bestaat dus
niet.
c Elk carbonaation kan 2 H+ ionen binden. Dus
carbonaat en H+ reageren in de verhouding 1 : 2.
d Als carbonaat reageert met H+, dan ontstaat
koolzuur, H2CO3. Dat ontleedt in water en
koolstofdioxide. Het koolstofdioxide ontsnapt en
zorgt voor een gasontwikkeling.
Fenolrood geel: pH < 6,6
Fenolftaleïen kleurloos: pH < 8,2
Congorood oranjerood: pH > 5,0
Totale conclusie: 5,0 < pH < 6,6
9 a Na+(aq) + OH(־aq)
b Raadpleeg ook tabel 45A. Je moet natuurlijk wel
een natriumzout nemen. Welk natriumzout
reageert met water?
■■ Op weg naar het proefwerk
1
Zoek eerst tabel 52A op en kijk nog eens goed wat
daarin staat.
a In tabel 52A is te vinden bij welke pH een indicator
van kleur verandert. De kleuren van de indicator
zijn ook gegeven. Er zijn drie belangrijke
gebieden: de pH is lager dan die van het
omslagtraject, de pH valt binnen het omslagtraject
of de pH is hoger dan die van het omslagtraject.
Natriumoxide, Na+2O2-(s), reageert met water.
Daarbij ontstaat natronloog.
c Natriumoxide + water → natronloog
Na+2O2-(s) + H2O(l) → 2 Na+(aq) + 2 OH(־aq)
10 a Zie ook tabel 103A.
Zoutzuur is een oplossing waarin de ionen H+(aq)
en Cl(־aq) voorkomen.
b Het gaat in het artikel om een wolk
waterstofchloride, HCl(g). Pas bij contact met
water ontstaat zoutzuur.
c Titaantetrachloride wordt pas bij 136°C een gas.
Van die hoge temperatuur was geen sprake bij het
ongeval.
d Doe dit soort onbekende reacties eerst in
woorden, daarna in formules. Vergeet niet om de
vergelijking kloppend te maken. Bij de proef
ontstaat ook titaan(IV)oxide.
b Lakmoes is in zuur milieu rood, in neutraal milieu
paars en in een basische oplossing is lakmoes
blauw.
2
–
3
De deeltjes die ontstaan zijn: H2O, OH-, HCO3-.
4
–
5
–
6
Er zijn drie groepen stoffen. Tot welke groep
behoort ethaanzuur?
Ethaanzuur is een moleculaire stof. Moleculaire
stoffen geleiden zelf niet de stroom. Pas als
ethaanzuur wordt opgelost in water, ontstaan de
ionen die nodig zijn voor stroomgeleiding.
7
Ga na welke deeltjes aanwezig zijn in de drie
oplossingen. Welke deeltjes heb je leren kennen
als zuur of als base?
a Oplossing I bevat H+(aq) en Cl(־aq). H+(aq) is
kenmerkend voor zure oplossingen. Oplossing I is
dus zuur.
Oplossing II bevat Na+(aq) en CO32-(aq). CO32- is
een base. Het kan twee H+ ionen binden.
Oplossing II is dus basisch.
© Noordhoff Uitgevers bv
Gebruik tabel 52A en trek per indicator je
conclusie.
titaantetrachloride + water → waterstofchloride +
titaan(IV)oxide
TiCl4(l) + 2 H2O(l) → 4 HCl(g) + Ti4+O2-2(s)
e Er ontstaat helemaal geen chloor. Waarschijnlijk
bedoelt de journalist waterstofchloride.
f De symbolen voor corrosief/bijtend en voor
irriterend zijn van toepassing.
11
Je moet van beide oplossingen [OH ]־berekenen
en nagaan hoeveel maal zo groot de ene
concentratie is als de andere. Je weet dan hoeveel
je moet verdunnen.
Verder gaat het om basische oplossingen. Je moet
dus rekenen met behulp van pOH en [OH]־.
a pH = 11,50 → pOH = 14,00 – 11,50 =
2,50 → [OH = ]־10-2,50 = 3,2 x 10-3 mol L-1
b De beschikbare natronloog heeft een pH =
13,00 → pOH = 14,00 – 13,00 = 1,00 → [OH= ]־
0,10 mol L-1.
Deze loog is 0,10 : 3,2 x 10-3 maal = 31 x zo
geconcentreerd als de gewenste oplossing. Pieter
73
Pulsar – Chemie havo bovenbouw deel 1 Uitwerkingen Hoofdstuk 7
moet dus 31 maal verdunnen. Dat wil zeggen dat
hij een hoeveelheid geconcentreerde loog moet
nemen die 31 maal zo klein is als de 200 mL die
hij nodig heeft. Pieter moet dus beginnen met
200 : 31 = 6,5 mL loog met pH = 13,00.
Vervolgens moet hij 200 – 6,5 = 193,5 mL water
toevoegen.
12 a pH = -log[H+] = -log14,29 = -1,16
b Vergelijk het eindvolume met het beginvolume.
Hoeveel maal zo groot is het eindvolume als het
beginvolume?
Begin: 10,0 mL Eind: 10,0 + 990 = 1000 mL. Het
volume is dus 1000 : 10 = 100 x zo groot
geworden. Je hebt dus 100 x verdund.
c [H+] is door het verdunnen 100 x zo klein
geworden. Dus [H+] = 0,1429 mol L-1.
pH = -log 0,1429 = 0,84
nr
zout
1
13 a De notatie van zoutzuur is H+(aq) + Cl(־aq).
b In bariumcarbonaat zit de base carbonaat, CO32-.
Bariumcarbonaat kan daarom reageren met
zoutzuur. Daarbij ontstaat stoffen die oplosbaar
zijn in water.
c Als carbonaat reageert met H+, dan ontstaat
koolzuur, H2CO3. Dat ontleedt in water en koolstofdioxide. Het koolstofdioxide ontsnapt en zorgt voor
een gasontwikkeling.
d Gebruik tabel 45A om te zien of de stof oplost in
water of niet. Als de stof carbonaat bevat, kan de
stof reageren met zoutzuur. Er ontstaat dan een
gas, koolstofdioxide. Denk eraan dat zoutzuur ook
chloride-ionen bevat. Soms kunnen de chlorideionen een neerslag veroorzaken.
NaNO3(s)
na schudden met water is er
een
heldere vloeistof
na schudden met
zoutzuur is er een
heldere vloeistof
overige waarnemingen na
toevoegen van zoutzuur
niets
2
Na2CO3(s)
heldere vloeistof
heldere vloeistof
reukloos gas
3
AgNO3(s)
heldere vloeistof
troebele vloeistof
wit neerslag
4
Ag2CO3(s)
troebele vloeistof
troebele vloeistof
reukloos gas en wit neerslag
5
BaCO3(s)
troebele vloeistof
heldere vloeistof
reukloos gas
6
BaSO4(s)
troebele vloeistof
troebele vloeistof
wit neerslag
74
74
© Noordhoff Uitgevers bv












