casuïstische mededelingen
Histiocytaire necrotiserende lymfadenitis van Kikuchi: een benigne
aandoening – niet te verwarren met maligne lymfoom
M.van Gelder en F.J.Bot
Bij een 26-jarige vrouw bij wie achteraf bleek dat zij de zeldzaam voorkomende, histiocytaire necrotiserende lymfadenitis van Kikuchi had, werd ten onrechte 2 maal de diagnose ‘maligne T-cellymfoom’
gesteld. Zij werd behandeld met standaardchemotherapie, terwijl de ziekte van Kikuchi een zelflimiterend beloop heeft. De angst voor recidieflymfoom beïnvloedde het leven van patiënte ingrijpend, tot
uiteindelijk de juiste diagnose werd gesteld. Dit gebeurde nadat patiënte zelf in haar dossier had gezien
dat destijds 2 pathologen van het geconsulteerde regionale lymfoompanel de ziekte van Kikuchi hadden geopperd, maar dat deze uiteindelijk was verworpen door het lymfoompanel na externe consultatie.
Ned Tijdschr Geneeskd. 2006;150:2099-103
Histiocytaire necrotiserende lymfadenitis van Kikuchi is een
zeldzame benigne aandoening, die voor het laatst door
Muntendam en Balk in 1991 in het Tijdschrift werd beschreven.1 Ondanks de vrij specifieke histologische en klinische
kenmerken wordt deze aandoening veelvuldig verward met
een maligne T-cellymfoom. Bekendheid met de kenmerken
van de ziekte van Kikuchi moet voorkómen dat ten onrechte
de diagnose ‘maligne lymfoom’ wordt gesteld. Gebeurt dit
toch, dan heeft dat verstrekkende gevolgen voor de patiënt,
zoals de volgende casus illustreert.
ziektegeschiedenis
Patiënt A, een 26-jarige vrouw, werd begin jaren negentig
van de vorige eeuw door haar huisarts verwezen naar een internist elders wegens een zwelling in de rechter mamma.
Een histologisch biopt van de tumor toonde het beeld van
een centraal geïnfarceerde lymfeklier met een grote haard
van atypische lymfoïde cellen, vaak grootcellig van aard,
met vrij veel cytoplasma en veel mitosefiguren. Immunohistochemisch kleurden de lymfoïde cellen aan voor de antigenen CD45 en CD30 en, deels zwak, voor CD3. Het vermoeden van een maligne T-cel-non-hodgkinlymfoom ontstond
en deze diagnose werd door de meeste leden van het regionale lymfoompanel overgenomen. Twee pathologen opperden echter de mogelijkheid van histiocytaire necrotiserende
lymfadenitis van Kikuchi.
Omdat het lymfoompanel geen consensus bereikte, werd
de casus voorgelegd aan een hematopatholoog in een onco-
Academisch Ziekenhuis Maastricht, Postbus 5800, 6202 AZ Maastricht.
Afd. Interne Geneeskunde, werkgroep Hematologie en Oncologie: hr.dr.
M.van Gelder, internist-hematoloog.
Laboratorium voor Pathologie: hr.dr.F.J.Bot, patholoog.
Correspondentieadres: hr.dr.M.van Gelder ([email protected]).
logisch centrum elders in het land, waarbij het achteraf niet
duidelijk is of deze op de hoogte werd gesteld van de alternatieve diagnose. Ook hij kwam tot de diagnose ‘maligne
T-cellymfoom’. Een classificerende diagnose werd niet gegeven, maar het lymfoompanel zal een perifeer T-cellymfoom ‘niet nader gespecificeerd’ en grootcellig van aard volgens de destijds gebruikte ‘Revised European-American
lymphoma’(REAL)-classificatie hebben bedoeld. Intussen
bleek bij patiënte ook een klier van 3 × 3 cm in de rechter
oksel aanwezig. Stageringsonderzoek met CT en botbiopsie
toonde geen andere lokalisaties van de ziekte. B-symptomen (koorts, nachtzweten of gewichtsverlies met meer dan
10%) waren afwezig; de serumactiviteit van lactaatdehydrogenase (LDH) bedroeg 726 U/l (referentiewaarden: 200500); IgM-antistoffen tegen epstein-barrvirus, Cytomegalovirus en Toxoplasma werden niet gevonden. Patiënte werd vervolgens behandeld met 6 polychemotherapiekuren bestaande uit cyclofosfamide, doxorubicine, vincristine en prednison (CHOP), waarop complete remissie ontstond.
Twee jaar later constateerde patiënte enkele vergrote
lymfeklieren van maximaal 2 × 2 cm, nu achter de linker
M. sternocleidomastoideus. Histologisch onderzoek toonde een identiek beeld als in 1994, zodat werd geconcludeerd
dat zij een recidief had van het T-cellymfoom. Besloten werd
tot een expectatief beleid toen bleek dat de halsklieren gaandeweg spontaan in grootte afnamen.
Daarop verzocht patiënte om een tweede beoordeling
van haar casus in een ander oncologisch centrum. De daar
werkzame hematopatholoog bevestigde de diagnose en het
recidief van het maligne T-cellymfoom. In deze periode
besloot patiënte de verdere controles in ons ziekenhuis te
laten plaatsvinden. Sindsdien had zij recidiverende passagère lymfadenopathie in de hals.
Ruim 10 jaar na de eerste presentatie had patiënte opnieuw een lymfoom in de linker oksel. Zij legde toen aan
Ned Tijdschr Geneeskd. 2006 23 september;150(38)
2099
haar nieuwe polikliniekarts, na bestudering van het door
haar opgevraagde dossier inclusief de lymfoompanelverslagen, de vraag voor of zij wellicht de ziekte van Kikuchi
zou kunnen hebben. Deze ziekte was immers destijds door
2 van de pathologen van het lymfoompanel geopperd. Daarop werden de eerste biopten en de biopten van 2 jaar later
gereviseerd (figuur a en b). Het eerste biopt bestond uit een
omkapselde hoeveelheid lymfoïd materiaal, waaraan deels
nog mammaweefsel zichtbaar was. Het beeld werd gedomineerd door necrose, omgeven door een wal van histiocyten
en lymfoïde cellen met forse, onregelmatige kernen met nucleolus. Zeer opvallend was de grote hoeveelheid kernpuin
en apoptotische elementen, met daarbij een zeer gering
aantal granulocyten. De beschreven gebieden werden afgewisseld door gebieden waarin meer lymfoïde cellen te zien
waren in de vorm van kleine, niet-atypische lymfocyten, afgewisseld door regelmatig voorkomende grote blasten met
meerdere nucleoli. Bij immunohistochemisch onderzoek
bleken de gebieden met necrose en de gebieden daaromheen grotendeels te bestaan uit CD68-positieve macrofagen
en CD8-positieve lymfoïde cellen. Het aantal CD4-positieve
cellen was sterk in de minderheid. In de niet-necrotische
gebieden met de kleine lymfoïde cellen werden veel meer
B-lymfocyten gezien. De klier van 2 jaar later toonde een
identiek beeld.
Bij onderzoek met PCR op het herschikkingspatroon van
het T-celreceptor-γ-ketengen op het aanvankelijke weefsel
en dat van 2 jaar later werd een beeld gezien dat paste bij dat
van een polyklonale T-celpopulatie. Geconcludeerd werd
dat patiënte zowel op grond van de klinische bevindingen
als van het histopathologisch onderzoek leed aan histiocytaire necrotiserende lymfadenitis van Kikuchi.
Wij bespraken deze uitslag met patiënte en haar partner
alsmede de moeilijkheid van het diagnosticeren van deze
zeldzame aandoening. Dat de onjuiste diagnose grote nadelige consequenties had gehad was duidelijk. Destijds was
patiënte behandeld met chemotherapie, terwijl de aandoening ook spontaan zou zijn hersteld. Daarnaast had patiënte door de altijd bestaande vrees voor recidief zwangerschap
al die tijd uitgesteld en kon zij verzekeringen alleen tegen
fors hogere premies afsluiten. Patiënte en haar partner reageerden opgelucht. Binnen enkele maanden werd zij zwanger en later beviel zij van een gezonde dochter.
beschouwing
Kliniek. De histiocytaire necrotiserende lymfadenitis van
Kikuchi werd voor het eerst in 1972 door Kikuchi2 en Fujimoto3 beschreven; recent verscheen een uitgebreid overzicht.4 De eerste publicaties betroffen vooral jonge Aziatische vrouwen, maar de aandoening blijkt wel degelijk ook
bij niet-Aziaten voor te komen.5 In een groep van 25 naar
Manchester, Verenigd Koninkrijk, verwezen patiënten ble-
2100
ken er 13 blank.6 De man-vrouwverhouding is ongeveer 1:4
en de gemiddelde leeftijd 30 jaar. In totaal zijn in de literatuur enkele honderden patiënten beschreven.
De aandoening wordt gekenmerkt door unilaterale halskliervergroting, waarbij de klier of klieren tot wel 4 cm of
meer in omvang kunnen toenemen. Mediastinale, abdominale of extranodale lokalisaties zijn ongebruikelijk, maar
wel beschreven.5 Koorts en andere systemische verschijnselen kunnen voorkomen, alsmede een verscheidenheid van
huidafwijkingen. Van de patiënten heeft 30-50% lichte
temperatuurverhoging met tekenen van een bovensteluchtweginfectie. Geringe leukopenie komt bij 25-60% van de
patiënten voor en bij 20-30% kunnen atypische lymfocyten
in het bloeduitstrijkje worden aangetroffen. Stijging van de
LDH-activiteit en van de leverenzymwaarden kan eveneens
voorkomen. De verschijnselen kunnen maanden aanhouden en verdwijnen spontaan. Recidieven komen bij minder
dan 5% van de patiënten voor, meestal kort na de eerste
episode, maar soms vele jaren later.5-7
De oorzaak van de ziekte van Kikuchi is tot op heden niet
opgehelderd.
Histopathologische bevindingen. De histologische bevindingen zijn zeer kenmerkend,2 3 5 met name de paracorticale lymfekliernecrose, omgeven door grote aantallen histiocytaire cellen. De mate van necrose kan per individu aanzienlijk verschillen en soms zelfs afwezig zijn. Kleine en
grote lymfocyten en immunoblasten omgeven en infiltreren
de necrotische gebieden. Atypie in de immunoblastaire cellen is niet ongewoon en daarom kan men, zeker bij afwezigheid van necrose, denken aan maligne T-cellymfoom ‘niet
nader gespecificeerd’. Ondanks de necrose zijn granulocyten opvallend afwezig. Bij circa 50% van de patiënten kunnen tevens reactieve lymfefollikels gevonden worden en bij
10% kan folliculaire hyperplasie aanwezig zijn.
De infiltrerende lymfocyten zijn voor het overgrote deel
CD3-positief, evenals de immunoblastaire component; het
aantal CD8-positieve cellen is meestal groter of gelijk aan
het aantal CD4-positieve.8 Het aantal B-cellen in de betrokken gebieden is zeer gering.
Onderzoek naar herschikking in het T-celreceptorgen. Onderzoek op monoklonaliteit door middel van PCR op T-celreceptorgen-herschikking heeft een plaats bij het differentiëren tussen maligne lymfoom en reactieve aandoeningen.
In grotere groepen patiënten blijkt, wanneer de status van
de herschikking van het γ-ketengen wordt beschouwd met
PCR of DNA-‘blotting’, voor het maligne T-cellymfoom de
sensitiviteit te variëren tussen 65-98%,9-16 en de specificiteit
tussen 71-91%.10 11 13 14 Dit is sterk afhankelijk van de aard
van het oorspronkelijke materiaal en de gebruikte methode.
De in ons en vele andere Nederlandse ziekenhuizen gebruikte PCR-techniek, waarbij van meerdere familiespecifieke primers gebruik wordt gemaakt, samen met detectie
met behulp van hogeresolutie-gelelektroforese en frag-
Ned Tijdschr Geneeskd. 2006 23 september;150(38)
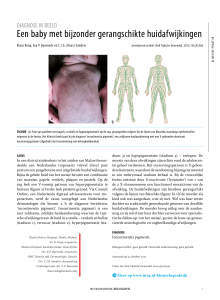
histiocytaire cellen, lymfocyten
necrose
en immunoblasten
a
immunoblasten
b
immunoblasten
(a) Microscopisch preparaat van een lymfeklier van patiënt A; op deze overzichtsopname ligt centraal in de coupe een groot necrotisch
gebied, direct omgeven door histiocytaire cellen waartussen en waaromheen een bonte verzameling van lymfocyten en immunoblasten
zichtbaar is (HE-kleuring, circa 20 maal vergroot); (b) op een detailopname van een meer of minder necrotisch gebied zijn vele histiocytaire cellen te zien alsmede een lymfocytenrijk gebied inclusief atypische immunoblasten, bij een opvallende afwezigheid van granulocyten (HE-kleuring, circa 40 maal vergroot).
mentanalyse, staat garant voor een hoge sensitiviteit, maar
heeft een matige specificiteit.17 Dit betekent dat men bij afwezigheid van een monoklonale herschikking van het T-celreceptorgen met de genoemde techniek met voldoende mate
van zekerheid maligne T-cellymfoom kan uitsluiten.
In een groep van 55 patiënten met histiocytaire necrotiserende lymfadenitis van Kikuchi kon bij geen van de
betrokkenen de bedoelde monoklonaliteit worden aangetoond.18
Differentiaaldiagnose. Wanneer zowel patiëntenkenmerken (leeftijd en lokalisatie van de lymfadenopathie) als de
bovengenoemde kenmerkende histologische bevindingen
samen beschouwd worden, wordt het aantal te overwegen
diagnosen kleiner: ziekte van Kikuchi, met lupus erythematodes disseminatus (SLE) samenhangende lymfadenopathie en maligne T-cellymfoom. Zeker wanneer de mate van
necrotisering beperkt is, kan verwarring ontstaan met
‘T-cellymfoom niet nader gespecificeerd’, met name de
Ned Tijdschr Geneeskd. 2006 23 september;150(38)
2101
lymfo-epithelioïde celvariant (of ‘lennertlymfoom’), zoals
die in de nieuwe WHO-classificatie is opgenomen; T-cellymfomen staan immers bekend om hun grote morfologische diversiteit.19 In een groep van 108 Amerikaanse patiënten met de ziekte van Kikuchi was door de verwijzend patholoog bij 35 maligne lymfoom gediagnosticeerd.5 In een
Britse groep van 25 patiënten was bij 17 in eerste instantie
de diagnose ‘maligne lymfoom’ gesteld.6
Discriminerend tussen maligne lymfoom en histiocytaire
necrotiserende lymfadenitis van Kikuchi is de aanwezigheid
van voornamelijk CD8-positieve T-cellen bij de ziekte van
Kikuchi, terwijl bij het T-cellymfoom ‘niet nader gespecificeerd’ de maligne cellen voornamelijk CD4-positief zijn.19
Het angio-immunoblastair T-cellymfoom kent wel een mengeling van CD4- en CD8-positieve T-cellen, maar wordt gekenmerkt door een toename van folliculaire dendritische
cellen en hoog-endotheliale venulen en door afwezigheid
van necrose en toename van histiocytaire cellen.19 Derhalve
moet de patholoog, indien CD8-positieve T-cellen in grote
mate aanwezig zijn, en ook als er geringe of zelfs afwezige
necrose is, naast een T-cellymfoom ‘niet nader gespecificeerd’ ook de ziekte van Kikuchi in de differentiaaldiagnose
opnemen. Afwezigheid van monoklonaliteit bij gebruik van
de bovengenoemde adequate techniek voor onderzoek van
herschikking van het T-celreceptorgen sluit T-cellymfoom
dan vrijwel zeker uit, gezien de hoge sensitiviteit voor T-cellymfoom.17 Monoklonaliteit komt bij de ziekte van Kikuchi
niet voor.18 Andersom geldt aanwezigheid van monoklonaliteit, gezien de lagere specificiteit, niet als bewijs voor
maligne T-cellymfoom.
Op histologische gronden kan de histiocytaire necrotiserende lymfadenitis van Kikuchi soms moeilijk onderscheiden worden van aan SLE gerelateerde lymfadenopathie.
Serologisch onderzoek kan dan nuttig zijn. Ondanks meerdere casuïstische mededelingen waarin het samen of opeenvolgend vóórkomen van de ziekte van Kikuchi en SLE
wordt beschreven, is in de genoemde grote Amerikaanse
patiëntengroep de incidentie van SLE bij patiënten met de
ziekte van Kikuchi slechts 2/108.5
epicrise
Bij de beschreven patiënte met histiocytaire necrotiserende
lymfadenitis van Kikuchi werd bij herhaling de diagnose
‘maligne T-cellymfoom’ gesteld. Dit ondanks het beroep op
regionale lymfoompanels, waarmee de kans op een onjuiste
diagnose juist wordt verkleind.20 Deze lymfoompanels, die
zijn samengesteld uit één of meerdere hematopathologen
uit academische of grotere centra, alsmede uit regionale pathologen met affiniteit voor lymfomen, werken op basis van
consensus; bij het ontbreken hiervan wordt een externe
hematopatholoog gevraagd de casus mede te beoordelen.
Natuurlijk kan deze zich een enkele maal vergissen; geen
2102
enkel diagnostisch traject kan immers volledig waterdicht
zijn. De kans op vergissing is tegenwoordig door de mogelijkheid om met moleculaire technieken monoklonaliteit
uit te sluiten aanmerkelijk kleiner geworden. Toen patiënte
zich voor het eerst meldde, was deze techniek nog niet
beschikbaar voor de standaard klinische praktijk.
De casus illustreert ook dat geneeskundig handelen altijd
dient te geschieden op basis van een goede oordeelsvorming door de behandelend arts. Destijds voerde deze bij het
‘recidief ’ terecht een expectatief beleid toen hij vaststelde
dat de lymfadenopathie spontaan herstelde.
Tenslotte is het opmerkelijk dat het patiënte zelf was die
haar latere behandelaar op het goede spoor zette nadat zij
inzage in haar medisch dossier had gevraagd. Daardoor
kreeg zij weer de regie over haar leven. Een zo letterlijke
invulling van het klinische aforisme ‘Luister, de patiënt
vertelt je de diagnose’ komt maar zelden voor.
Dr.D.de Jong, patholoog in het Antoni van Leeuwenhoek Ziekenhuis te
Amsterdam, was medebeoordelaar van de beschreven casus.
Belangenconflict: geen gemeld. Financiële ondersteuning: geen gemeld.
Aanvaard op 3 juli 2006
Literatuur
1
Muntendam H, Balk AG. Histiocytaire necrotiserende lymfadenitis;
de ziekte van Kikuchi. Ned Tijdschr Geneeskd. 1991;135:572-4.
2 Kikuchi M. Lymphadenitis showing focal reticulum cell hyperplasia
with nuclear debris and phagocytes: a clinicopathological study. Acta
Hematol Jpn. 1972;35:379-80.
3 Fujimoto Y, Kojima Y, Yamaguchi K. Cervical subacute necrotizing
lymphadenitis. Nakai. 1972;30:920-7.
4 Bosch X, Guilabert A, Miquel R, Campo E. Enigmatic Kikuchi-Fujimoto disease: a comprehensive review. Am J Clin Pathol. 2004;122:
141-52.
5 Dorfman RF, Berry GJ. Kikuchi’s histiocytic necrotizing lymphadenitis: an analysis of 108 cases with emphasis on differential diagnosis.
Semin Diagn Pathol. 1988;5:329-45.
6 Menasce LP, Banerjee SS, Edmondson D, Harris M. Histiocytic necrotizing lymphadenitis (Kikuchi-Fujimoto disease): continuing diagnostic difficulties. Histopathology. 1998;33:248-54.
7 Famularo G, Giustiniani MC, Marasco A, Minisola G, Nicotra GC, De
Simone C. Kikuchi Fujimoto lymphadenitis: case report and literature
review. Am J Hematol. 2003;74:60-3.
8 Kikuchi M, Takeshita M, Tashiro K, Mitsui T, Eimoto T, Okamura S.
Immunohistological study of histiocytic necrotizing lymphadenitis.
Virchows Arch A Pathol Anat Histopathol. 1986;409:299-311.
9 Garcia MJ, Martinez-Delgado B, Granizo JJ, Benitez J, Rivas C. IgH,
TCR-gamma, and TCR-beta gene rearrangement in 80 B- and T-cell
non-Hodgkin’s lymphomas: study of the association between proliferation and the so-called ‘aberrant’ patterns. Diagn Mol Pathol.
2001;10:69-77.
10 Sadek I, Greer W, Foyle A. Diagnosis of lymphoproliferative disorders: experience of a single institution in the long-term follow-up
of discordant cases. Clin Invest Med. 2000;23:366-75.
11 Tai YC, Peh SC. Feasibility of T-cell receptor gamma (TCRgamma)
gene rearrangement on formalin-fixed, paraffin-embedded tissues by
PCR assays. Singapore Med J. 2003;44:250-5.
Ned Tijdschr Geneeskd. 2006 23 september;150(38)
12 Luo V, Lessin SR, Wilson RB, Rennert H, Tozer C, Benoit B, et al.
Detection of clonal T-cell receptor gamma gene rearrangements
using fluorescent-based PCR and automated high-resolution capillary electrophoresis. Mol Diagn. 2001;6:169-79.
13 Arber DA, Braziel RM, Bagg A, Bijwaard KE. Evaluation of T cell
receptor testing in lymphoid neoplasms: results of a multicenter
study of 29 extracted DNA and paraffin-embedded samples. J Mol
Diagn. 2001;3:133-40.
14 Vega F, Medeiros LJ, Jones D, Abruzzo LV, Lai R, Manning J, et al. A
novel four-color PCR assay to assess T-cell receptor gamma gene
rearrangements in lymphoproliferative lesions. Am J Clin Pathol. 2001;
116:17-24.
15 Theriault C, Galoin S, Valmary S, Selves J, Lamant L, Roda D, et al.
PCR analysis of immunoglobulin heavy chain (IgH) and TcR-gamma
chain gene rearrangements in the diagnosis of lymphoproliferative
disorders: results of a study of 525 cases. Mod Pathol. 2000;13:
1269-79.
16 Assaf C, Hummel M, Dippel E, Goerdt S, Muller HH, Anagnostopoulos I, et al. High detection rate of T-cell receptor beta chain rearrangements in T-cell lymphoproliferations by family specific polymerase
chain reaction in combination with the GeneScan technique and DNA
sequencing. Blood. 2000;96:640-6.
17 Dongen JJM van, Langerak AW, Bruggemann M, Evans PAS, Hummel
M, Lavender FL, et al. Design and standardization of PCR primers and
protocols for detection of clonal immunoglobulin and T-cell receptor
gene recombinations in suspect lymphoproliferations: report of the
BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia. 2003;17:
2257-317.
18 Lin CW, Chang CL, Li CC, Chen YH, Lee VM, Hsu SM. Spontaneous
regression of Kikuchi lymphadenopathy with oligoclonal T-cell populations favors a benign immune reaction over a T-cell lymphoma. Am
J Clin Pathol. 2002;117:627-35.
19 Jaffe ES, Harris NL, Stein H, Vardiman JW. Tumours of haematopoietic and lymphoid tissues. World Health Organization of Tumours.
Tumours & genetics. Lyon: IARC Press; 2001.
20 Lester JF, Dojcinov SD, Attanoos RL, O’Brien CJ, Maughan TS, Toy ET,
et al. The clinical impact of expert pathological review on lymphoma
management: a regional experience. Br J Haematol. 2003;123:463-8.
Abstract
Kikuchi’s histiocytic necrotising lymphadenitis: a benign disorder – not
to be confused with malignant lymphoma. – A 26-year-old woman who
later turned out to have the rarely seen histiocytic necrotising lymphadenitis of Kikuchi was twice diagnosed incorrectly with malignant T-cell
lymphoma. She was treated with standard chemotherapy, whereas Kikuchi’s disease has a self-limiting course. Fear for recurrent lymphoma
greatly affected the patient’s life until the proper diagnosis was ultimately made. This occurred after the patient herself had seen in her dossier
that the diagnosis ‘Kikuchi’s histiocytic lymphadenitis’ had been proposed by two pathologists of the consulted regional lymphoma board in
the past, but had been rejected by the board after external consultation.
Ned Tijdschr Geneeskd. 2006;150:2099-103
Ned Tijdschr Geneeskd. 2006 23 september;150(38)
2103