Vroege ontdekking van slokdarm-,
alvleesklier- en eierstokkanker
Kansen en knelpunten bij tumoren met een
slechte prognose
Signaleringscommissie Kanker van KWF Kankerbestrijding
KWF Kankerbestrijding heeft als ideaal een wereld waarin
niemand meer sterft aan kanker. We willen dat minder mensen
kanker krijgen, meer mensen genezen en dat de kwaliteit van
leven van de patiënt zo goed mogelijk is, tijdens en na de ziekte.
Daarom financieren en faciliteren we wetenschappelijk
onderzoek, beïnvloeden we beleid en delen we kennis over
kanker en de behandeling ervan.
Om dit mogelijk te maken werven we fondsen en verbinden we
ons met andere partijen die bijdragen aan kankerbestrijding,
nationaal en internationaal.
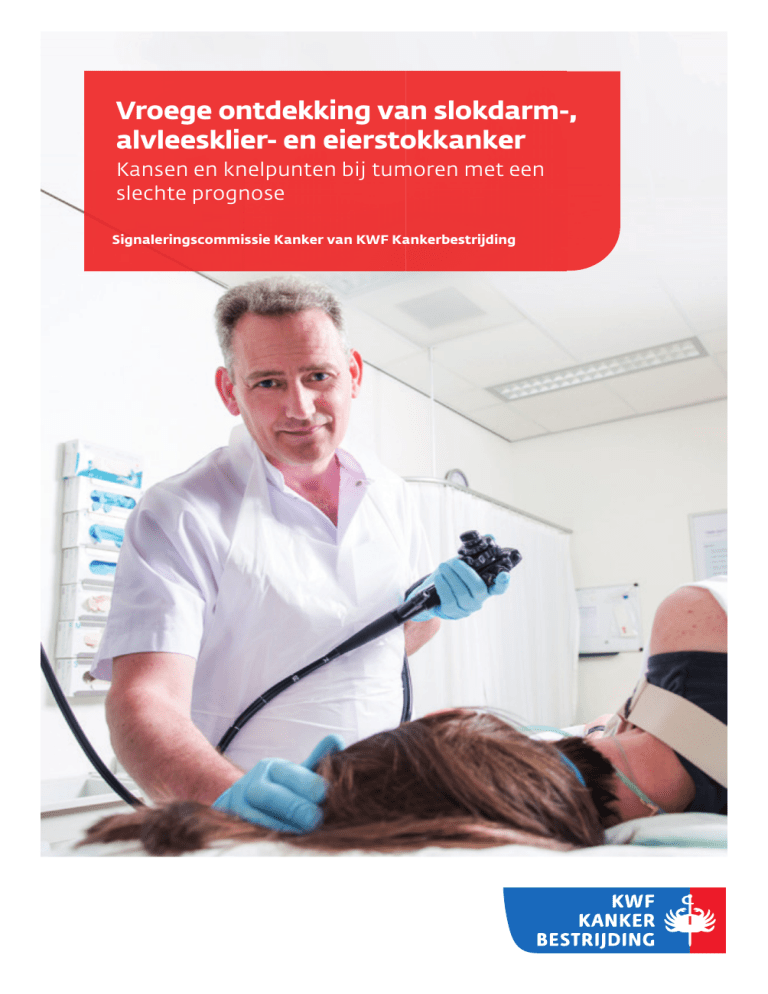
Op de cover: Prof.dr. M.J. Bruno gebruikt een speciale
videoendoscoop met ultrasone echoprobe t.b.v. surveillance
van patiënten met een verhoogd risico op het ontwikkelen van
alvleesklierkanker.
Vroege ontdekking van
slokdarm-, alvleesklieren eierstokkanker
Kansen en knelpunten bij tumoren met een slechte prognose
Colofon
Dit rapport is een uitgave van de Signaleringscommissie Kanker van KWF
Kankerbestrijding
November 2014
© KWF Kankerbestrijding
Tekst
Rapporttekst: prof.dr. H. J. de Koning, dr. J.F.A.M. Wijffels en dr. H.M.E van Agt
Eindredactie: H. Boersma
Projectredactie: H. Karssen
Ontwerp
Theo Nijsse
Fotografie
Photography and Images, Levien Willemse (portret voorzitter)
Opmaak
Inno van den Heuvel/VDB Almedeon bv, Oisterwijk
Druk en productie
VDB almedeon bv, Oisterwijk
ISBN
978-90-71229-26-8
Bestelcode KWF
H31
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Inhoudsopgave
Voorwoord
7
Verantwoording en samenstelling van de werkgroep
9
Samenvatting
11
Leeswijzer
19
Aanleiding van de studie
21
1
1.1
1.2
1.2.1
1.2.2 1.2.3
1.3
Algemene inleiding
Vóórkomen, kans, sterfte en overleving
Methoden vroege ontdekking van kanker Screening
Surveillance bij (hoog)risicogroepen
Alertheid bij klachten en symptomen
Referenties
25
25
28
28
32
33
36
2
2.1
2.2
2.2.1
2.2.2
2.3
Doelstelling en werkwijze
Doelstellingen
Werkwijze
Fase 1: Procedure voor de keuze van tumoren
Fase 2: Analyse van de tumorsoorten
Referenties
39
39
39
29
40
52
3
Vroege ontdekking van adenocarcinoom van de slokdarm
3.1
Inleiding
3.2
Ontstaan en ontwikkeling van slokdarmkanker
3.2.1 Barrett-slokdarm
3.2.2
Adenocarcinoom 3.3
Casuïstiek van een patiënt
3.4
Vóórkomen van Barrett-slokdarm en slokdarmkanker
3.4.1
Vóórkomen van slokdarmkanker
3.4.2 Vóórkomen van Barrett-slokdarm
3.5
Stadiumverdeling bij diagnose in relatie tot behandeling en overleving
3.5.1
Stadium en diagnostiek
3.5.2
Stadium en behandeling
3.5.3
Slokdarmkanker en overleving
3.6
Stand van zaken m.b.t. verschillende invalshoeken van vroege ontdekking
3.6.1
Risicofactoren
3.6.1.1Risicofactoren voor de ontwikkeling van Barrett-slokdarm en
slokdarmkanker
3.6.1.2Risicofactoren voor het ontwikkelen van slokdarmkanker vanuit
Barrett-slokdarm 3.6.2
Klachten en symptomen
Inhoudsopgave
55
55
58
58
58
59
60
60
60
61
61
62
63
64
65
65
67
69
3
3.6.3
3.6.4
3.6.4.1
3.6.4.2
3.6.4.3
3.7
3.8
3.8.1
3.8.2
3.8.3
3.8.4
3.8.5
3.9
Patient en doctor’s delay
Screening en surveillance
Screening op Barrett-slokdarm
Surveillance van Barrett-slokdarmpatiënten
Kosteneffectiviteit
Wat zit er in de pijplijn?
Conclusies, implicaties voor praktijk en onderzoek, en aanbevelingen
Conclusie m.b.t. vroege ontdekking
Implicaties voor de praktijk
Implicaties voor onderzoek
Eindconclusie
Aanbevelingen Referenties
4
Vroege ontdekking van adenocarcinoom van de alvleesklier 4.1
Inleiding
4.2
Ontstaan en ontwikkeling van alvleesklierkanker
4.2.1 Precursorlaesies
4.2.2 Progressie
4.3
Casuïstiek van een patiënt
4.4
Vóórkomen van alvleesklierkanker
4.5
Stadiumverdeling bij diagnose in relatie tot behandeling en overleving
4.5.1
Stadium en diagnostiek
4.5.2 Stadium en behandeling
4.5.3 Stadium en overleving
4.6
Stand van zaken m.b.t. verschillende invalshoeken van vroege ontdekking
4.6.1 Risicofactoren
4.6.2 Klachten en symptomen
4.6.3 Patient en doctor’s delay
4.6.4 Screening
4.6.4.1 Screening in de algemene populatie
4.6.4.2 Screening in hoogrisicogroepen
4.6.4.3 Surveillance bij patiënten met pancreascystes (IPNM en MCN)
4.6.4.4 Te verwachten gezondheidswinst en kosteneffectiviteit van screening
4.7
Wat zit er in de pijplijn?
4.8
Conclusies en implicaties voor praktijk en onderzoek, en aanbevelingen
4.8.1 Conclusie m.b.t. vroegontdekking
4.8.2 Implicaties voor de praktijk
4.8.3 Implicaties voor onderzoek
4.8.4 Eindconclusie
4.8.5 Aanbevelingen
4.9
Referenties
5
Vroege ontdekking van epitheliale eierstokkanker
5.1
Inleiding
5.2
Ontstaan en ontwikkeling van eierstokkanker
5.2.1
Ontstaan van eierstokkanker
5.2.2Aannames m.b.t. natuurlijk beloop en consequenties voor
vroege ontdekking
4
71
72
72
73
74
76
77
77
79
79
79
80
80
85
85
87
87
88
89
89
90
90
91
92
94
94
96
98
99
99
100
101
104
106
108
108
109
110
110
111
111
117
117
118
118
119
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
5.3
5.4
5.5
5.5.1
5.5.2
5.5.3
5.6
5.6.1
5.6.2
5.6.3
5.6.4
5.6.4.1
5.6.4.2
5.7
5.8
5.8.1
5.8.2
5.8.3
5.8.4
5.8.5
5.9
Casuïstiek van een patiënt
Vóórkomen van eierstokkanker
Stadiumverdeling bij diagnose in relatie tot behandeling en overleving Stadium en diagnostiek
Stadium en behandeling
Stadium en overleving
Stand van zaken m.b.t. verschillende invalshoeken van vroege ontdekking
Risicofactoren voor eierstokkanker in de algemene populatie
Klachten en symptomen
Patient en doctor’s delay
Screening
Screening in de algemene populatie
Screening in hoogrisicogroepen
Wat zit er in de pijplijn?
Conclusies, implicaties voor praktijk en onderzoek, en aanbevelingen
Conclusie m.b.t. vroegontdekking
Implicaties voor de praktijk
Implicaties voor onderzoek
Eindconclusie
Aanbevelingen
Referenties
120
121
122
122
122
124
127
127
128
130
131
131
137
141
143
143
144
144
144
145
146
6
6.1 6.1.1 6.1.2 6.1.3 6.2 6.3 6.4 6.4.1 6.4.2
6.4.3
6.5 6.6 6.7 6.8 6.9 Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
Knelpunten bij de bestudeerde aspecten van vroege ontdekking
Vroege ontdekking op basis van klachten, symptomen en risicofactoren
Vermijdbare patient en doctor’s delay
Screening en surveillance en geschatte gezondheidswinst
Kansen met betrekking tot screening en surveillance
Implicaties voor de voorlichting
Implicaties voor de klinische praktijk
Patiëntengroepen die extra aandacht vragen
Adviezen uit richtlijnen m.b.t. surveillance en screening
Aandacht voor hoogrisicogroepen voor het ontwikkelen van kanker
Implicaties voor onderzoek
Huidige infrastructuur voor onderzoek en samenwerking
Belangrijkste conclusies uit dit rapport
Beleidsaanbevelingen
Referenties
151
152
152
155
155
158
160
160
160
161
162
162
163
164
165
167
Begrippenlijst
171
Bijlage
175
Inhoudsopgave
Informatie over de SCK en haar werkgroepen
Appendix 1.1 Criteria van Wilson & Jungner
177
Appendix 1.2 Stand van zaken (proef-)bevolkingsonderzoeken in Nederland 181
Appendix 2.1 Zoekstrategieën per vraagstelling en kankersoort
184
Appendix 2.2 Stadiumverdeling naar TNM-classificatie 188
5
Voorwoord
Vroege ontdekking en behandeling van kanker kan een belangrijke invloed hebben
op de prognose van de ziekte. Als kanker wordt ontdekt in een vroeg stadium en
voordat deze is uitgezaaid naar omliggende weefsels en andere organen, wordt
de kans op succesvolle behandeling vergroot en is er meer kans op langduriger
overleving. In haar beleidsvisie 2011-2014 geeft KWF Kankerbestrijding aan dat
de perspectieven voor patiënten met bijvoorbeeld borstkanker of kinderen met
kanker sterk zijn verbeterd, maar dat de prognose voor patiënten met bijvoorbeeld
longkanker en alvleesklierkanker nog steeds zeer slecht is en hier in de afgelopen
periode nauwelijks verbetering in is opgetreden. KWF Kankerbestrijding wil deze
patiënten meer perspectief kunnen bieden.
Aansluitend hierbij heeft zij de Signaleringscommissie Kanker van KWF
Kankerbestrijding de opdracht gegeven om een inventarisatie uit te voeren van de
huidige kennis van vroege ontdekking bij tumorsoorten die relatief veel voorkomen,
een (zeer) slechte 5-jaarsoverleving hebben en vaak in een laat stadium ontdekt
worden. Het doel van deze inventarisatie is inzicht te krijgen in aspecten die
vroege ontdekking van deze kankersoorten belemmeren en in de wijze waarop
beleid zou kunnen worden ingezet om vroege ontdekking te verbeteren. De studie
werd verricht onder de werktitel ‘Veel voorkomende moeilijke tumoren; toch
gezondheidswinst te behalen door eerdere ontdekking?’.
In het huidige rapport wordt de stand van zaken beschreven voor slokdarmkanker,
alvleesklierkanker en eierstokkanker, waar jaarlijks in Nederland ruim 5300
personen aan overlijden, veelal omdat ze in een relatief laat stadium worden
ontdekt. Een systematische analyse van de literatuur, aangevuld door specifieke
expertise van vakspecialisten geeft een beeld van mogelijkheden en belemmeringen
om deze tumoren eerder te ontdekken en te behandelen en aandachtspunten voor
actie en beleid. Moeilijke tumoren blijken helaas niet voor niets zo genoemd te
worden: aangrijpingspunten zijn niet gemakkelijk voorhanden, maar door ‘in te
zoomen’ per kankersoort menen we kleine specifieke lichtpunten te zien, die spoedig
moeten worden aangepakt om ook bij deze moeilijke tumoren een verbetering te
kunnen bewerkstelligen in de prognose van de patiënten.
Wij hopen uiteindelijk ook dat de conclusies en aanbevelingen recht doen aan het
gedachtegoed van dr. Els Borst, die met haar bevlogenheid en kennis zeer betrokken
was in onze werkgroep.
Prof.dr. Harry J. de Koning, arts-epidemioloog
Hoogleraar Maatschappelijke GezondheidsZorg
en Evaluatie van vroegopsporing van ziekten
Erasmus MC
Voorwoord
7
Verantwoording en samenstelling
van de werkgroep
In het eerste kwartaal van 2012 kreeg de Signaleringscommissie Kanker (SCK) van
KWF Kankerbestrijding de opdracht om een studie te verrichten naar de stand van
zaken m.b.t. vroege ontdekking bij tumorsoorten die relatief veel voorkomen, een
zeer slechte 5-jaarsoverleving hebben en vaak in een laat stadium ontdekt worden.
Het betrof een gevraagd advies vanuit het Team Preventie en Patiëntenondersteuning
van KWF Kankerbestrijding. Indien mogelijk zou KWF Kankerbestrijding ook op het
gebied van deze tumoren beleid willen inzetten gericht op vroege ontdekking.
De SCK heeft voor deze opdracht in eerste instantie vier van haar leden met expertise
relevant voor vroege ontdekking gevraagd. Zij hadden tot taak tumorsoorten
te selecteren die in aanmerking zouden moeten komen voor deze studie. De
uiteindelijke werkgroep is na deze fase aangevuld met twee leden die vanuit hun
werkterrein een belangrijke bijdrage aan de studie konden leveren (dr. S. Siesling en
dr. A. Spijkerman). De voltallige werkgroep was verantwoordelijk voor de uitvoering
van de studie en de totstandkoming van het rapport. De werkgroep hanteerde
daarbij een werkwijze waarbij per geselecteerde tumorsoort een tumorspecifieke
begeleidingsgroep werd ingesteld. Voor deze begeleidingsgroepen werden experts
betrokken op het gebied van vroege ontdekking van de geselecteerde tumorsoorten.
De werkgroep heeft haar werkzaamheden als contractresearch uitbesteed aan
de afdeling Maatschappelijke GezondheidsZorg van het Erasmus MC, onder eind­
verantwoordelijkheid van prof.dr. H.J. de Koning (systematische literatuurstudie) en
het Integraal Kankercentrum Nederland (IKNL), onder eindverantwoordelijkheid van
dr. Sabine Siesling (analyses van gegevens van de Nederlandse Kankerregistratie).
De tekst van het rapport is geschreven door dr. Heleen van Agt, dr. Suzie Otto en drs.
Sonja Kroep in nauwe samenwerking met dr. Josien Wijffels, secretaris, en prof.dr.
H.J. De Koning, voorzitter van de werkgroep. De regie en coördinatie van de uit­
voering van de studie en de totstandkoming van het rapport lag bij dr. Josien Wijffels.
Nadere informatie over de SCK en haar werkgroepen vindt u in de bijlage.
Leden SCK werkgroep
Dr. E. (Els) Borst-EilersOud-voorzitter Nederlandse Federatie voor
Kankerpatiëntenorganisaties, Utrecht; tevens
SCK-lid († februari 2014)
Prof.dr. H.J. (Harry) de KoningArts-epidemioloog; tevens SCK-lid (voorzitter
werkgroep)
Prof.dr. C.J.L.M. (Chris) Meijer Patholoog (emeritus), VUmc; tevens SCK-lid
Prof.dr. J.W.M. (Jean) Muris
Huisarts, MUMC; tevens SCK-lid
Dr. S. (Sabine) SieslingSenior onderzoeker, IKNL/Universiteit Twente
Dr. A.M.W. (Annemieke) Spijkerman Senior onderzoeker, RIVM
Prof.dr. J. (Jaap) Stoker
Radioloog, AMC; tevens SCK-lid
Dr. J.F.A.M. (Josien) WijffelsBeleidsmedewerker Strategie,
KWF Kankerbestrijding (secretaris)
Verantwoording en samenstelling van de werkgroep
9
Leden tumorspecifieke begeleidingsgroepen
Slokdarmkanker
Prof.dr. J.J.G.H.M. (Jacques) Bergman
Prof.dr. P.D. (Peter) Siersema
Dr. B. P.L. (Bas) Wijnhoven
MDL-arts, AMC
MDL-arts, UMCU
Chirurg, Erasmus MC
Alvleesklierkanker
Prof.dr. M.J. (Marco) Bruno
MDL-arts, Erasmus MC
Prof.dr. O. R.C. (Olivier) Busch
HPB-chirurg, AMC
Dr. B. (Bas) Groot KoerkampHPB-chirurg en Epidemioloog, Memorial
Sloan-Kettering Cancer Center, New York, USA
Eierstokkanker
Dr. T. (Toon) van Gorp
Prof.dr. M.J.E. (Marian) Mourits
Prof.dr. R.H.M. (Rene) Verheijen
Prof.dr. A.G.J. (Ate) van der Zee Gynaecoloog-oncoloog, MUMC+
Gynaecoloog-oncoloog, UMCG
Gynaecoloog-oncoloog, UMCU
Gynaecoloog-oncoloog, UMCG; voorzitter SCK
Betrokken medewerkers vanuit KWF Kankerbestrijding
Mevr. M. (Maaike) Op de Coul Programmacoördinator Vroege ontdekking,
KWF Kankerbestrijding (tot juni 2013)
Drs. B. (Bas) Koster Beleidsmedewerker Vroege ontdekking,
Team Preventie KWF Kankerbestrijding (vanaf
september 2013)
Uitvoering contractresearch
Systematische literatuurstudie (afdeling Maatschappelijke GezondheidsZorg, Erasmus MC):
Dr. H.M.E. (Heleen) van Agt (slokdarmkanker, alvleesklierkanker en eierstokkanker)
Dr. S.J. (Suzie) Otto (slokdarmkanker, alvleesklierkanker en eierstokkanker)
Drs. S. (Sonja) Kroep (slokdarmkanker)
Drs. M. (Marija) Glisic (eierstokkanker)
Analyse van gegevens van de NKR
(uitgevoerd binnen IKNL):
Drs. L.G.M. (Lydia) van der Geest (alvleesklierkanker)
Dr. J. (Jessie) Steevens (slokdarmkanker)
Dr. J. (Janneke) Verloop (eierstokkanker)
10
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Samenvatting
Slokdarm-, alvleesklier- en eierstokkanker zijn vormen van kanker die relatief
vaak voorkomen. Jaarlijks wordt bij ruim 2.400 personen slokdarmkanker, bij
ruim 2.300 personen alvleesklierkanker en bijna 1.300 personen eierstokkanker
gediagnosticeerd. Vergeleken met veel andere vormen van kanker hebben deze
tumorsoorten een (heel) slechte prognose, omdat ze vaak pas in een laat stadium
worden ontdekt. In Nederland bestaan voor deze tumoren geen specifieke
programma’s voor vroege ontdekking.
De keuze om in dit rapport juist deze drie kankersoorten verder te onderzoeken op
mogelijkheden van vroege ontdekking was gebaseerd op hun relatief grote aandeel
in de kankersterfte (totaal 12%) in Nederland en op aanwijzingen uit een eerste
search in de literatuur dat er een test is die eerdere ontdekking mogelijk maakt.
Dit rapport geeft de huidige stand weer van de wetenschap en praktijk van de
mogelijkheden tot vroege ontdekking voor deze tumorsoorten. Het rapport beperkt
zich hierbij tot het meest voorkomende type van alvleesklierkanker, slokdarm­
kanker en eierstokkanker, namelijk het adenocarcinoom van de slokdarm en van de
alvleesklier en epitheliale eierstokkanker. Er is een analyse verricht met gegevens van
de Nederlandse Kankerregistratie (NKR) om inzicht te krijgen in de behandelingsmogelijkheden en de prognose van deze tumorsoorten naar stadium en daarmee
de mogelijke winst van ontdekking in een eerder stadium. In een systematische
literatuurstudie is bij deze drie tumorsoorten gezocht naar verschillende aspecten die
van belang kunnen zijn voor de vroege opsporing van kanker, te weten: identificatie
van risicofactoren en personen met een verhoogd risico op de kanker, identificatie
van klachten en symptomen die kunnen wijzen op (vroege stadia van) de kanker,
aanwijzingen voor vermijdbare patient of doctor’s delay die de prognose negatief
beïnvloeden en de beschikbaarheid van een geschikte test of techniek voor screening.
Ten slotte is nagegaan of een eventueel beschikbare screeningstest leidt tot een daling
van de sterfte aan kanker en of er dus sprake is van gezondheidswinst.
De in dit rapport uitgevoerde inventarisatie had tot doel de knelpunten bij vroege
ontdekking van slokdarm-, alvleesklier- en eierstokkanker in kaart te brengen
en oplossingen hiervoor aan te dragen om zo beleid voor de klinische praktijk,
voorlichting en onderzoek te kunnen formuleren. Het rapport geeft tevens inzicht
in de kansen en uitdagingen die er liggen op het gebied van vroege ontdekking van
deze drie tumorsoorten en waarmee gezondheidswinst gerealiseerd kan worden. De
volgende conclusies kunnen getrokken worden:
1. E
r zijn geen duidelijk onderscheidende klachten en symptomen die in een
vroeg stadium van slokdarm-, alvleesklier- of eierstokkanker herkenbaar
optreden.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker op basis van
specifieke klachten of symptomen, eventueel in combinatie met risicofactoren,
blijkt niet mogelijk. Weliswaar zijn er verschillende symptomen met een sterke
associatie met slokdarm-, alvleesklier- en eierstokkanker, maar veel van deze
Samenvatting
11
symptomen komen ook bij andere ziektes voor. Zo zijn de veel voorkomende
refluxklachten (brandend maagzuur, zuur oprispen) bij slokdarmkanker niet
specifiek genoeg en doen passageproblemen, keelpijn, hese stem of aanhoudend
hoesten zich pas in een laat stadium voor. Ook alvleesklierkankerpatiënten
hebben vaak al langere tijd last van vage en aspecifieke klachten zoals een naar
gevoel in de bovenbuik, misselijkheid, pijnklachten (in bovenbuik en/of rug)
en gewichtsverlies zonder duidelijke reden. Meer specifieke symptomen als
geelzucht treden vaak pas op als de tumor al in een vergevorderd stadium is. De
klachten en symptomen bij eierstokkanker, zoals een vol gevoel in de buik, vage
pijnklachten, dikker wordende buik en gewichtsverlies, zijn niet alleen aspecifiek,
maar treden vaak ook pas in een laat stadium op.
2. R
isicofactoren, voorstadia en hoogrisicogroepen bieden
aangrijpingspunten voor verbetering van vroege ontdekking.
Een Barrett-slokdarm is het gevolg van langdurige refluxklachten, waarbij
het maagzuur terugvloeit naar de slokdarm. Het is het enige bekende
voorstadium van het adenocarcinoom van de slokdarm. Naar schatting
heeft 1-2% van de Nederlandse bevolking een Barrett-slokdarm. Lang niet alle
Barrett-slokdarmpatiënten worden ontdekt (naar schatting wordt 27% van alle
Barrett-slokdarmpatiënten gediagnosticeerd, terwijl 40% van de personen met
zo’n slokdarm geen reflux­klachten ervaart). Naast Barrett-slokdarmpatiënten
behoren ook personen met een familiegeschiedenis van slokdarmkanker en/
of Barrett-slokdarm tot een hoogrisicogroep van slokdarmkanker. Andere
risicofactoren voor slokdarmkanker zijn onder meer refluxklachten, roken en
obesitas.
Bij alvleesklierkanker spelen familiaire en erfelijke factoren een belangrijke
rol. Daarnaast hebben ook personen met chronische pancreatitis (ontsteking
aan de alvleesklier) en (toevallig vastgestelde) alvleeskliercystes een verhoogd
risico op alvleesklierkanker. Het life-time risico op alvleesklierkanker in
deze hoogrisicogroepen varieert tussen de 3,6% en 40%. Roken, diabetes
en het drinken van veel alcohol leiden tevens tot een verhoogd risico op
alvleesklierkanker. Er zijn verschillende premaligne afwijkingen in de pancreas
geïdentificeerd, namelijk pancreatische intra-epitheliale neoplasie (PanIN),
alvleeskliercystes (intraductale papillaire mucineuze neoplasmata (IPMN)) en
mucineuze cystische neoplasmata (MCN). De tijd tussen het ontstaan van PanINleasies en de ontwikkeling van alvleesklierkanker wordt geschat op elf jaar,
hetgeen wijst op een grote ‘window of opportunity’ voor vroege ontdekking.
Een duidelijk verhoogd risico op eierstokkanker hangt samen met bepaalde
genetische profielen, waarvan de belangrijkste BRCA1 en BRCA2 zijn. Het lifetime risico op het krijgen van eierstokkanker voor vrouwen met BRCA1 en BRCA2
mutaties is respectievelijk 59% en 35%.
3. E
r zijn geen aanwijzingen voor vermijdbare vertraging in de
diagnosestelling bij deze drie kankersoorten.
Op basis van de bestudeerde literatuur lijken er geen aanwijzingen te
zijn voor vertraging tussen het herkennen van de eerste symptomen en
hulp zoeken (patient delay) en voor vertraging in verwijzing voor nader
12
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
diagnostisch onderzoek (doctor’s delay) bij de drie kankersoorten. Omdat
mogelijke symptomen van alvleesklierkanker kunnen worden toegeschreven
aan pancreatitis, is het volgens deskundigen echter wel aannemelijk dat er
diagnosevertraging kan optreden bij pancreatitispatiënten. Dit des te meer
omdat veranderingen in de alvleesklier die zijn opgetreden als gevolg van de
lang bestaande onderliggende ontsteking, het detecteren van een tumor met
beeldvormende technieken bemoeilijkt.
4. E
r zijn geen screeningstesten die slokdarm-, alvleesklier- of eierstokkanker,
in een populatie met gemiddeld risico, dusdanig vroegtijdig kunnen
vaststellen dat er gezondheidswinst optreedt.
Een screeningsprogramma is effectief als het leidt tot minder sterfte en/of
minder ziektelast in de gescreende populatie (gezondheidswinst). Momenteel
vindt onderzoek naar screening op slokdarmkanker in de algehele populatie
nog niet plaats. Screening op Barrett-slokdarm wordt wel onderzocht, terwijl
surveillance (periodieke controle) van Barrett-slokdarmpatiënten door velen
wordt geadviseerd.
Screening op alvleesklierkanker in de algemene populatie m.b.v. beeldvormende
technieken of biomarker CA 19-9 is niet zinvol, vanwege een lage detectiegraad
en een lage positief voorspellende waarde.
Er is nog geen uitsluitsel of screening op eierstokkanker in de algemene
populatie leidt tot een sterftereductie. In een grootschalige Amerikaanse trial
(PLCO-trial) bleek screening op eierstokkanker met transvaginale echografie
(TVE) en de serumtest CA-125 niet te leiden tot een reductie in de kankersterfte
of tot een substantiële stadiumverschuiving: het merendeel (72%) van de
door screening ontdekte tumoren bevond zich in een gevorderd stadium (III
of IV). De grootste nog lopende trial in het Verenigd Koninkrijk (UKCTOCS)
evalueert twee screeningsstrategieën, namelijk screening met alleen TVE en
een twee-stapsscreening, waarbij het risico op eierstokkanker aan de hand
van veranderingen van het CA-125 niveau over de tijd en per leeftijd wordt
vastgesteld, gevolgd door TVE bij vrouwen met een hoog niveau van CA-125.
Beide screeningsstrategieën leidden er toe dat de helft van de via screening
ontdekte tumoren in een vroeg stadium (I/II) werd gediagnosticeerd.
Rapportage over het effect van de screening op de sterfte wordt in 2015
verwacht.
5.Risicostratificatie en nieuwe diagnostische methoden kunnen de
haalbaarheid van surveillance en screening op (het voorstadium van)
slokdarmkanker in de algemene populatie vergroten.
Na de diagnose Barrett-slokdarm wordt patiënten meestal geadviseerd deel te
nemen aan een surveillanceprogramma. De jaarlijkse kans op slokdarmkanker
bij Barrett-slokdarmpatiënten is 0,4-0,7%, terwijl de kosten van een surveillance­
programma hoog zijn. Hoewel er aanwijzingen zijn dat surveillance van Barrettslokdarmpatiënten kan leiden tot sterftedaling, is dit nog niet vastgesteld in
onderzoek. Uit modelleerstudies blijkt dat de kosteneffectiviteit van surveillance
van Barrett-slokdarmpatiënten afhankelijk is van de surveillancestrategie,
het moment waarop behandeling plaatsvindt en het type behandeling. De
kosteneffectiviteit van surveillance van Barrett-slokdarmpatiënten wordt
verder beïnvloed door de kans op progressie naar hooggradige dysplasie
Samenvatting
13
(ernstig veranderde structuur van het weefsel) en slokdarmadenocarcinoom.
(Laaggradige) dysplasie, endoscopisch zichtbare afwijkingen (nodulariteit),
de lengte van het Barrett-segment en oesophagitis (slokdarmontsteking)
lijken hiervoor belangrijke voorspellers te zijn. Ook een aantal moleculaire
biomarkers heeft een hoge voorspellende waarde voor de ontwikkeling van
slokdarmadenocarcinoom.
Dysplasiegradering is op dit moment de meest gebruikte marker voor progressie.
Maar vaststelling van dysplasie is moeilijk, omdat die onderhevig is aan zowel
variabele interpretatie door pathologen als aan sampling error. Behalve voor
dysplasie is de bruikbaarheid van geen van bovengenoemde factoren (alleen of
in combinatie) voor maligne ontaarding van de Barrett- slokdarm gevalideerd.
Onderzoek moet vaststellen welke Barrett-slokdarmpatiënten opgenomen
moeten worden in een surveillanceprogramma, o.a. door analyse van biomarkers
en van risicofactoren van voorloperstadia.
De diagnose van Barrett-slokdarm vindt momenteel plaats met behulp van
endoscopie, een belastend onderzoek voor de patiënt en niet geschikt voor
screening in de algemene populatie. Er zijn op dit moment nieuwe diagnostische
methoden beschikbaar zoals string-capsule endoscopie (sensitiever), ultrathin
endoscopie (goedkoper) en de cytosponge (minder invasief), maar nader
onderzoek moet de bruikbaarheid van deze technieken voor screening op
(voorstadia van) slokdarmkanker nog aantonen.
6.Screening biedt mogelijk perspectief voor families met een verhoogde kans
op alvleesklierkanker, maar niet voor families met een verhoogde kans op
eierstokkanker.
Screening in hoogrisicogroepen kan tot vroege ontdekking van alvlees­klier­
kanker leiden, maar het is nog onbekend of en bij welke groepen dit leidt tot
reductie van de kankersterfte. Er is desondanks internationaal consensus
bereikt over het beleid ten aanzien van patiënten met een verhoogd risico op
familiaire alvleesklierkanker: eerstegraads familieleden van patiënten met
familiaire pancreatitis en patiënten met bepaalde erfelijke syndromen komen
in aanmerking voor screening met EUS (echografie) en/of MRCP (magnetic
resonance cholangiopancreatography). Aanbevolen wordt om in Nederland een
eenduidige richtlijn voor het beleid voor patiënten met een verhoogd risico op
familiaire alvleesklierkanker te ontwikkelen en uit te dragen.
Onderzoek moet vaststellen wat de te behalen gezondheidswinst (minder sterfte
en/of morbiditeitsreductie) van screening in hoogrisicogroepen is en voor welke
hoogrisicopatiënten de nadelen van intensieve follow-up opwegen tegen de
voordelen van screening, o.a. door het uitvoeren van modelleerstudies.
Screening in hoogrisicogroepen voor eierstokkanker is niet effectief gebleken
in het verlagen van de sterfte aan eierstokkanker. Er vond door screening geen
significante verschuiving naar een eerder stadium van de ziekte plaats en
derhalve is overlevingswinst niet te verwachten. Jaarlijkse screening met CA-125
en TVE onder BRCA1/2-dragers heeft ook niet geleid tot een betere overleving. Op
dit moment wordt BRCA1/2-mutatiedragers derhalve geadviseerd om preventief
de eierstokken en eileiders te laten verwijderen. Deze ingreep is, mits tijdig
14
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
aangeboden, zeer effectief in het verlagen van de kans op het ontwikkelen van de
meest agressieve vorm van eierstokkanker, het sereus type II.
7. F
ollow-up van alvleeskliercystes wordt bemoeilijkt door onduidelijkheid
over het maligniteitsrisico van deze cysten en het optimale tijdstip voor
een pancreasresectie.
Alvleeskliercystes komen voor bij 2,4%-20% van de bevolking en veroorzaken
meestal geen symptomen. Hoewel het life-time risico op alvleesklierkanker bij
alvleeskliercystes niet goed bekend is, worden patiënten met alvleeskliercystes
wel gerekend tot de hoogrisicogroepen. Bij ontdekking, meestal bij toeval,
wordt surveillance met MRI of EUS (Endoscopische UltraSonografie) elke zes of
twaalf maanden aanbevolen. Bestaande criteria op basis van beeldvorming en
analyse van cystevloeistof zijn nog onvoldoende voor selectie van patiënten die
in aanmerking moeten komen voor een operatie. Er is tevens nog onvoldoende
onderzoek verricht om betrouwbaar te kunnen inschatten welke cysten
maligne ontaarden. Onderzoek hiernaar, evenals onderzoek gericht op het
identificeren van biomarkers in cystes en andere lichaamsweefsels, kan worden
geïntensiveerd door middel van systematische inclusie van patiënten in lopende
wetenschappelijke cohorten.
8. D
e overlevingswinst bij eierstokkanker is het grootst wanneer de
Type-II-tumoren in een vroeg stadium kunnen worden ontdekt.
Epitheliale eierstokkanker is niet één ziekte, maar bestaat uit histologisch
verschillende typen met elk een eigen moleculair-genetisch profiel die zich
ontwikkelen volgens een eigen moleculaire pathway. Type-I-tumoren (laaggradig
sereuze, laaggradig endometrioid, mucineuze en clear-cell-tumoren) groeien
over het algemeen langzaam, worden vaak in een vroeg stadium ontdekt en
hebben een betere prognose dan type-II-tumoren. Vanwege hun langzame groei
kunnen ze soms met beeldvormende technieken vroegtijdig worden ontdekt.
Type-II-tumoren zijn snel groeiende tumoren, die daardoor bijna altijd in een
laat stadium worden ontdekt (hooggradig sereuze en endometrioide tumoren
en carcinosarcoom). Deze tumoren brengen meer CA-125 tot expressie dan
type-I-tumoren, waardoor CA-125 als biomarker mogelijk beter bruikbaar is voor
type-II-tumoren. Tegenwoordig veronderstelt men dat dit type eierstokkanker in
de distale eileider (tuba) ontstaat. Zo’n 75% van alle epitheliale tumoren is van het
hooggradig sereustype. De overlevings­winst is het grootst wanneer het mogelijk
is om de type-II-tumoren, bijvoorbeeld met een screeningstest, in een vroeg
stadium (I of II) te ontdekken.
9.De huidige screeningstrials moeten geanalyseerd worden in relatie tot het
natuurlijk beloop van eierstokkanker om strategieën voor vroegdetectie te
kunnen ontwikkelen.
De uitkomsten van de Engelse grootschalige screeningstudie (UKCTOCS)
worden afgewacht en zijn cruciaal. In een Amerikaanse grootschalige studie
(PLCO-trial) werd geen sterftereductie gevonden. Modelleerstudies kunnen
wellicht een verklaring geven voor mogelijke discrepanties in de uitkomsten
van verschillende screeningstudies. Aanbevolen wordt om op korte termijn de
klinische data uit de twee grote screeningsstudies te integreren en in relatie
te brengen tot het natuurlijk beloop van de histologisch verschillende types
Samenvatting
15
eierstokkanker. Dit is nodig om de vraag te kunnen beantwoorden of en zo ja
hoeveel gezondheidswinst er met welke screeningstrategie in Nederland te
behalen is. Mocht er ook in de UKCTOCS-trial geen sterftereductie worden
gevonden, dan kan er ook een eenduidig antwoord gegeven worden op de vraag
waarom de huidige screeningstesten falen. Een dergelijke aanpak heeft bij
borst-, baarmoederhals-, dikke darm-, long- en prostaatkankerscreening goede
inzichten gegeven.
Aanbevelingen
Het rapport maakt duidelijk dat zowel binnen de zorg als binnen het onderzoek
de nodige inspanningen verricht moeten worden om slokdarm-, alvleesklier- en
eierstokkanker eerder te kunnen ontdekken en de prognose van patiënten met deze
kankersoorten te verbeteren. In de tumorspecifieke hoofdstukken 3, 4 en 5 wordt
hier gedetailleerd op ingegaan. De geïnventariseerde knelpunten en kansen geven
ook aan waar toekomstig onderzoek zich op zou moeten richten. De volgende
beleidsaanbevelingen worden gedaan:
Aanbevelingen m.b.t. voorlichtingsbeleid
• A anbevolen wordt om de bevindingen van de huidige inventarisatie geschikt te
maken voor algemene publiek en patiënten, met specifieke aandacht voor:
-het feit dat klachten en symptomen van slokdarm-, alvleesklier en eierstok­
kanker late signalen zijn en dat patiënten zich niet schuldig hoeven te voelen
over het feit dat ze lang hebben gewacht om met dergelijke signalen naar de
dokter te gaan.
-de reden waarom screening en/of bevolkingsonderzoek bij slokdarmkanker-,
alvleesklier- en eierstokkanker op dit moment nog niet tot de mogelijkheden
behoren.
Aanbevelingen ten aanzien van de klinische praktijk
• Zolang klachten en symptomen weinig onderscheidend zijn, moet de indicatie
voor het verrichten van nadere diagnostiek op kanker worden afgewogen in het
licht van een individuele patiëntprofilering, waarbij zowel de familiaire belasting,
leefomstandigheden en gewoonten, medische geschiedenis als bijkomende
klachten en symptomen van belang zijn.
•Er moet meer aandacht komen voor groepen met een verhoogd risico op het
ontwikkelen van kanker. Zowel kennis van geïdentificeerde risicogroepen als
kennis van de mogelijkheden voor surveillance is van belang.
• Het is van belang om personen met een verhoogd risico op slokdarm- en
alvleesklierkanker te includeren in lopende en nieuw te starten cohorten gericht
op surveillance, om meer kennis te verwerven over het carcinogeneseproces en
het daadwerkelijke risico op kanker in deze hoogrisicogroepen. Voor het trekken
van conclusies zijn groepen van voldoende omvang in deze cohorten van belang.
Aanbevelingen m.b.t. onderzoek
• Langetermijninvesteringen zijn juist nodig bij kankersoorten waar nog weinig
inzicht bestaat in de carcinogenese, zoals slokdarm-, alvleesklier- en eierstok­
kanker. Dit om vooruitgang te kunnen boeken m.b.t. de prognose van deze
patiënten, zowel op het gebied van vroege ontdekking als van behandeling.
Dit vraagt om langetermijnonderzoeksbeleid van financiers van onderzoek, zoals
16
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
KWF Kankerbestrijding en ZonMW. Daarnaast kunnen andere partijen, zoals
zorgverzekeraars, bij de financiering van multicenter, prospectief (cohort)
onderzoek en de daarbij behorende registraties en weefselopslag een rol spelen.
• De huidige inventarisatie laat zien dat er mogelijkheden op het gebied van
vroege ontdekking bij de bestudeerde tumorsoorten bestaan (grote ‘window
of opportunity’, identificatie van hoogrisicogroepen, ontwikkeling van minder
invasieve en patiëntvriendelijke tests voor surveillance en screening).
Nader onderzoek is nodig om dit te bevestigen.
-Onderzoek gericht op het identificeren van groepen met een verhoogd
risico op het ontwikkelen van kanker en de follow-up daarvan in
onderzoekscohorten moet worden gestimuleerd.
-Binnen deze cohorten is weefselopslag in biobanken en goede
registratie van belang om meer inzicht te kunnen verwerven in het
carcinogeneseproces, de voorstadia en de kans op maligne ontaarding
van deze voorstadia.
-Vragenlijsten gericht op het in kaart brengen van klachten, symptomen
en risicofactoren zouden structureel onderdeel moeten uitmaken
van deze onderzoeksprotocollen, om eventueel frequent optredende
patronen hierin te herkennen.
-Onderzoek gericht op risicostratificatie binnen hoogrisicogroepen, zoals
modelleerstudies, moet worden gestimuleerd om de (kosten)effectiviteit van
surveillance en/of screening te vergroten (t.a.v. sterftereductie, verlaging van
de ziektelast en kosteneffectieve benadering).
-Onderzoek gericht op het ontwikkelen en valideren van innovatieve
detectiemethoden t.b.v. screening moet worden gestimuleerd.
-Onderzoek gericht op het ontwikkelen van patiëntvriendelijke en
kosteneffectieve surveillancestrategiën bij hoogrisicogroepen is van belang
om de haalbaarheid van surveillance te vergroten.
-De aanwezigheid van een grote ‘window of opportunity’ voor vroege
ontdekking biedt mogelijkheden om met de inzet van de nieuwe omicstechnieken en met de analyse van andere weefselbronnen dan alleen serum,
relevante biomarkers voor vroege stadia te identificeren, in eerste instantie
met name bij hoogrisicogroepen.
• In Nederland worden bij het opzetten en uitvoeren van onderzoek gericht op
het ontdekken van premaligne of vroege stadia van kanker en bij het bestuderen
van de kans op maligne ontaarding van deze stadia, knelpunten ervaren. De
huidige wet- en regelgeving voor opslag van lichaamsmateriaal, primair gericht
op de bescherming van het individu, bemoeilijkt niet alleen de uitvoering van
dit type onderzoek in Nederland, maar ook de internationale uitwisseling
van patiëntenmaterialen en daardoor de internationale samenwerking op
dit gebied. Dit terwijl grootschalig internationaal multicenter onderzoek
naar de detectie van premaligne en vroege stadia en het bestuderen van de
kans op maligne ontaarding juist van belang is. Diverse partijen (zoals KWF
Kankerbestrijding, ZonMW, maar ook de beroepsgroep en de zorgverzekeraars)
zouden onderzoekers kunnen ondersteunen bij de langdurige en administratief
belastende processen van goedkeuring door Medisch Ethische Commissies of
het verkrijgen van een breder geldend informed consent. Ook zouden ze deze
problematiek (inter)nationaal kunnen agenderen.
Samenvatting
17
18
Tumorspecifieke aanbevelingen m.b.t. infrastructuur en samenwerking
• Er moet een nationale database voor Barrett-slokdarmpatiënten komen. De
beroepsgroep kan een rol spelen bij het onderbrengen van patiëntengegevens
in de database. Vastgesteld moet worden welke karakteristieken bij
Barrett-slokdarm in deze database geregistreerd moeten worden. Voor de
karakterisering van Barrett-slokdarmpatiënten (met name dysplasiegraad)
moet een expertpanel worden opgezet. Dit moet leiden tot minder variatie in
beoordeling en kwaliteitsbevordering van de karakterisering. De nieuwe Barrettrichtlijn geeft advies m.b.t. behandeling bij Barrett-slokdarmpatiënten (bij
welke groepen behandeling aangewezen is). De acht in Nederland vastgestelde
expertisecentra moeten ziekenhuizen adviseren over klinisch beleid bij Barrettslokdarm.
• Het is van belang om screening onder nieuw geïdentificeerde hoogrisicogroepen
voor het ontwikkelen van alvleesklierkanker gestructureerd op te zetten.
Als voorbeeld hiervoor dient de screening zoals die in Nederland plaatsvindt
voor familiair belaste personen met een hoog risico op het ontwikkelen van
pancreaskanker. Hier ligt een taak voor de beroepsgroep.
• Er is in Nederland behoefte aan overzicht c.q. coördinatie van het onderzoek
naar vroege ontdekking van eierstokkanker en de eventuele hieraan gekoppelde
weefselopslag. Hier ligt een taak voor de beroepsgroep.
Voor overige tumorspecifieke aanbevelingen wordt verwezen naar de laatste
paragraaf van hoofdstuk 3 voor slokdarmkanker, hoofdstuk 4 voor alvleesklierkanker
en hoofdstuk 5 voor eierstokkanker.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Leeswijzer
Dit rapport is bedoeld voor diverse partijen en organisaties die actief zijn op het
gebied van (secundaire) preventie, zoals de overheid en andere beleidsmakers,
zorgprofessionals, onderzoekers en patiëntenorganisaties. Deze leeswijzer heeft tot
doel de verschillende doelgroepen te helpen de voor hen relevante informatie uit dit
rapport te halen.
Het rapport vangt aan met een beschrijving van de Aanleiding van de studie en de
opdracht aan de werkgroep.
Hoofdstuk 1 (Algemene inleiding van het rapport) is bedoeld voor niet-ingewijden
in vroege ontdekking van kanker. In dit hoofdstuk wordt het belang van vroege
ontdekking bij kanker in perspectief geplaatst en inzicht gegeven in de meest
recente cijfers (2011) over het voorkomen van, de kans op, de sterfte aan en de
5-jaarsoverleving van tumorsoorten met de grootste ziektelast.
Hoofdstuk 2 (Doelstellingen en werkwijze) beschrijft de doelstellingen van
de twee onderzoeksfasen, te weten 1) identificatie van tumorsoorten waarbij
er aanwijzingen zijn voor aangrijpingspunten voor het verbeteren van vroege
ontdekking en 2) inventarisatie van de huidige stand van de wetenschap en klinische
praktijk met betrekking tot de mogelijkheden van vroege ontdekking bij deze
tumorsoorten.
De eerste fase heeft geleid tot de selectie van de drie tumorsoorten, waar dit rapport
nader op in gaat. De inventarisatie heeft zich toegespitst op vier verschillende
aspecten van vroege ontdekking, namelijk 1) risicofactoren, klachten en symptomen,
2) terugdringing van patient en/of doctor’s delay, 3) screening en surveillance en 4)
mogelijke gezondheidswinst door vroege ontdekking.
De uitkomst van de inventarisatiefase staat beschreven in hoofdstuk 3 (Adeno­
carcinoom van de slokdarm), hoofdstuk 4 (Adenocarcinoom van de alvleesklier)
en hoofdstuk 5 (Epitheliale eierstokkanker). Deze hoofdstukken zijn als
volgt opgebouwd: aan de hand van een casus worden de dilemma’s m.b.t. de
vroegdiagnostiek van de tumorsoort geïllustreerd. Vervolgens wordt op basis van een
analyse van gegevens uit de Nederlandse Kankerregistratie (NKR) specifiek ingegaan
op het voorkomen van de tumorsoort en wordt het stadium bij diagnose in relatie
tot zowel behandelings­mogelijkheden als overleving gepresenteerd. Deze inleidende
paragrafen (paragraaf 1 t/m 5) onderstrepen het belang van het ontdekken van deze
tumorsoorten in een eerder stadium. Indien men uitsluitend geïnteresseerd is in de
stand van zaken van de wetenschappelijke kennis en klinische praktijk van vroege
ontdekking bij de drie tumorsoorten is het tweede deel van deze hoofdstukken
relevant (vanaf paragraaf 6). Naast de meest recente kennis m.b.t. het natuurlijk
verloop (biologisch gedrag) van deze tumorsoorten wordt het resultaat van de
analyse van verschillende aspecten van vroege ontdekking (risicofactoren, klachten
en symptomen, terugdringen van patient en doctor’s delay, screening en surveillance)
beschreven evenals een kort overzicht van lopende (inter)nationale projecten.
De hoofdstukken eindigen met een paragraaf met conclusies en aanbevelingen.
Leeswijzer
19
In deze paragraaf worden tevens de implicaties voor de klinische praktijk en
onderzoek, maar ook de knelpunten en kansen t.a.v. vroege ontdekking bij deze
tumorsoorten in kaart gebracht.
In hoofdstuk 6 (Beschouwing, belangrijkste conclusies en beleidsaanbevelingen)
worden de resultaten van de studie naar knelpunten en kansen voor vroege
ontdekking van slokdarmkanker, alvleesklierkanker en eierstokkanker in samenhang
besproken en wordt de boodschap van het rapport gepresenteerd. Het hoofdstuk
sluit af met de belangrijkste conclusies van het rapport en beleidsaanbevelingen
m.b.t. voorlichting, de klinische praktijk en onderzoek.
Wie de boodschap van dit rapport snel wil oppikken, wordt geadviseerd om
de Samenvatting en hoofdstuk 6 te lezen. Alsmede de paragraaf ‘Conclusies,
implicaties voor praktijk en onderzoek, en aanbevelingen’ achter in de hoofdstukken
3, 4 en 5. In deze paragraaf worden ook de kansen en knelpunten m.b.t. vroege
ontdekking per tumorsoort benoemd.
20
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Aanleiding van de studie
Vroege ontdekking van kanker of voorstadia daarvan, spelen een cruciale rol in het
verbeteren van de overlevingskansen van mensen met kanker. Behandeling in een
vroeger stadium is veelal effectiever dan behandeling in een laat stadium.
Er zijn verschillende manieren om kanker eerder op te sporen en een daarvan
is via screening. Het primaire doel van screening op kanker is om bij een nader
gedefinieerde groep personen die geen symptomen hebben en zich (meestal) niet
ziek voelen, de kanker in een dusdanig vroeger stadium te ontdekken dat er betere
behandelingsmogelijkheden zijn. Screening kan dan resulteren in een effectievere,
vaak minder mutilerende behandeling, met minder risico op complicaties en
een zowel klinisch als wat betreft kwaliteit van leven gunstigere uitkomst
(gezondheidswinst).
Naast screening spelen zowel de kennis van risicofactoren en het onderkennen
van klachten en symptomen als tijdig medische hulp zoeken een belangrijke rol bij
vroege ontdekking van kanker. Hierbij ligt de focus op het terugdringen van een
mogelijk tijdsverlies (delay) bij symptomatische patiënten. Met delay wordt hierbij
gedoeld op vermijdbare late behandeling door een vertraging in het vaststellen van
de diagnose en/of een vertraging tussen de diagnose en de start van behandeling.
Tijdsverlies kan worden veroorzaakt door de patiënt, zorgverlener of zorgsysteem
(Van Hees en Spijkerman 2010), onder andere door onbekendheid met duidelijke
risicofactoren voor kanker.
Op het gebied van screening op kanker, voorlichting over risicofactoren en
herkennen van klachten en symptomen die op kanker kunnen wijzen wordt
al veel gedaan in Nederland. Momenteel wordt vanuit de overheid screening
aangeboden (bevolkingsonderzoeken) voor de vroege opsporing van borstkanker,
baarmoederhalskanker en darmkanker.
In de afgelopen jaren heeft KWF Kankerbestrijding binnen haar preventiebeleid
verschillende instrumenten ingezet gericht op vroege ontdekking, o.a. voorlichting,
de kanker-risicotest (2012), de campagne ‘Ken de 9 signalen’ (2007-2010), de
webmodule ‘Klachtadvies’ (2007-2014), lobby met betrekking tot de invoering van
bevolkingsonderzoek naar darmkanker, het uitdragen van standpunten over o.a.
zelftesten op kanker en de total bodyscan en financiering van wetenschappelijk
onderzoek. Op het gebied van onderzoek en beleid is er nationaal en internationaal
veel aandacht voor vroege ontdekking van kanker, echter deze lijkt zich te
concentreren rond tumorsoorten waar reeds nationaal en internationaal het
gunstige effect van vroegopsporing is bewezen. KWF Kankerbestrijding vindt het
van belang dat er ook aandacht is voor tumorsoorten met een slechte prognose,
waarin de afgelopen periode weinig vooruitgang is geboekt. Op dit moment
ontbreekt kennis over knelpunten en aangrijpingspunten voor verbetering op het
gebied van vroege ontdekking bij deze tumorsoorten. Dit rapport is een (eerste)
aanzet daartoe.
Aanleiding van de studie
21
Opdracht
De werkgroep ‘Vroege ontdekking’ van de Signaleringscommissie Kanker van KWF
Kankerbestrijding heeft de opdracht gekregen om een inventarisatie uit te voeren
van de huidige kennis van vroege ontdekking bij tumorsoorten die relatief veel
voorkomen, een (zeer) slechte 5-jaarsoverleving hebben en vaak in een laat stadium
ontdekt worden. Het doel van deze inventarisatie is inzicht te krijgen in aspecten
die vroege ontdekking van deze kankersoorten belemmeren en in de wijze waarop
beleid zou kunnen worden ingezet om vroege ontdekking te verbeteren.
De doelstellingen van de opdracht zijn:
1.Identificeer bij welke tumorsoorten er aanwijzingen zijn voor
aangrijpingspunten voor het verbeteren van vroege ontdekking.
2.Inventariseer bij deze tumorsoorten de huidige stand van de wetenschap en
klinische praktijk met betrekking tot de mogelijkheden van vroege ontdekking,
kijkend naar de volgende aspecten: risicofactoren, klachten en symptomen,
terugdringing van patient en doctor’s delay, mogelijkheden tot screening en
surveillance en de mogelijke gezondheidswinst na vroegontdekking.
In dit rapport zal op drie tumorsoorten worden ingegaan, te weten slokdarmkanker,
alvleesklierkanker en eierstokkanker. De inventarisatie moet een leidraad zijn voor
beantwoording van de volgende KWF-beleidsvragen:
•Wat zijn de knelpunten met betrekking tot vroege ontdekking bij deze
tumorsoorten en hoe kunnen deze worden aangepakt?
•Welke kansen zijn er op het gebied van screening en surveillance, de (klinische)
praktijk, onderzoek en voorlichting om vroege ontdekking bij deze tumorsoorten
te bevorderen?
•Welk rol kunnen KWF Kankerbestrijding en andere organisaties spelen bij het
bevorderen van vroege ontdekking bij deze tumorsoorten?
Referentie
Van Hees, F en Spijkerman, AMW (2010) ‘Diagnostic delay’ bij kanker en diabetes.
Een verkenning van begrippen en kennislacunes. Bilthoven, RIVM. RIVM rapport
260221001.
22
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
1
Algemene inleiding
In deze inleiding wordt ingegaan op methoden van vroege ontdekking en wordt
het belang van vroege ontdekking bij kanker in perspectief geplaatst. Tevens wordt
inzicht gegeven in de ziektelast door kanker aan de hand van de meest recente cijfers
(2012) over het voorkomen, de kans op, de sterfte aan en de 5-jaarsoverleving van
tumorsoorten met de grootste ziektelast.
1.1
Vóórkomen, kans, sterfte en overleving
Volgens de cijfers van de Nederlandse Kankerregistratie kregen in Nederland in 2012
101.210 mensen (52.735 mannen en 48.475 vrouwen) de diagnose kanker. Dat is bijna een
verdubbeling van het aantal sinds de start van de kankerregistratie in 1989 (periode
van 23 jaar), toen er 55.781 nieuwe kankergevallen werden geregistreerd. In de meeste
gevallen betrof het een diagnose van huid-, borst-, long-, darm- of prostaatkanker.
Tabel 1.1 geeft een overzicht van de 15 meest voorkomende kankersoorten bij mannen
en vrouwen in 2012. Gecorrigeerd voor de leeftijdsopbouw was er een stijging van
376,60 per 100.000 in 1989 naar 460,90 per 100.000 in 2012. Bij mannen was er een
stijging in de incidentie van 444,05 naar 498,62 per 100.000 en bij vrouwen van
309,16 naar 423,17 per 100.000 (IKNL geraadpleegd juni 2014; Cijferoverkanker.nl).
Tabel 1.1: Vijftien meest voorkomende nieuwe kankerdiagnoses bij mannen en
vrouwen in 2012 (als percentage van het totaal aantal kwaadaardige tumoren
naar geslacht).
Prostaat
21,2%
Borst
29,5%
Huid
14,6%
Huid
14,1%
Darm
13,9%
Darm
12,5%
Luchtpijp & long
13,2%
Luchtpijp & long
10,2%
Non-Hodgkinlymfoom
4,3%
Baarmoederlichaam
3,9%
Blaas
4,3%
Non-Hodgkinlymfoom
3,4%
Hoofd & hals*
3,8%
Eierstok
2,7%
Slokdarm & cardia
3,6%
Alvleesklier
2,4%
Nier
2,7%
Hoofd & hals*
2,1%
Alvleesklier
2,2%
Nier
1,7%
Maag (excl. cardia)
1,7%
Blaas
1,5%
Zaadbal
1,4%
Baarmoederhals
1,5%
Hersenen
1,3%
Slokdarm & cardia
1,3%
Plasmaceltumoren
1,2%
Maag (excl. cardia)
1,2%
Mesothelioom
0,9%
Plasmaceltumoren
1,1%
Cursief: bij deze kankersoorten vindt (proef)bevolkingsonderzoek in Nederland plaats.
*Inclusief mondholte, strottenhoofd, keelholte, lip, speekselklieren en neusholte,
middenoor & neusbijholten.
Bron: IKNL © (geraadpleegd juni 2014).
Algemene inleiding
25
De kans om gedurende het leven gediagnosticeerd te worden met kanker wordt
geschat op 49% voor mannen (1 op de 2,2) en 43% voor vrouwen (1 op de 2,7) in Nederland
(figuur 1.1) (IKNL geraadpleegd juni 2014; Cijfersoverkanker.nl) De kans om kanker
te krijgen vóór het 65ste levensjaar is 14% voor mannen en 17% voor vrouwen, wat de
invloed van leeftijd op het ontwikkelen van kanker benadrukt. Het stijgen van de
levensverwachting zal naar verwachting gepaard gaan met een stijging van het aantal
nieuwe gevallen van kanker.
In tabel 1.2 wordt voor mannen en vrouwen de kans vanaf de geboorte weergegeven
om ooit gediagnosticeerd te worden met een van de meest voorkomende vormen
van kanker (cijfers zijn gebaseerd op de periode 2005-2009 (IKNL geraadpleegd juni
2014; Cijfersoverkanker.nl)).
50
45
kans op kanker (%)
40
35
30
25
20
15
10
5
0
5
10
15
20
25
30
35
40 45
50
55
60 65
70
75
80 85 90 95 95+
leeftijd (jaar)
vrouw
man
Figuur 1.1: Kans (%) vanaf de geboorte op het krijgen van kanker voor een bepaalde
leeftijd, voor mannen en vrouwen.
Sinds 2008 is kanker de belangrijkste doodsoorzaak in Nederland en overlijden meer
mensen aan kanker dan aan hart- en vaatziekten. In 2012 overleden 43.666 personen
aan de gevolgen van kanker. Het merendeel van de kankergerelateerde sterfte
werd veroorzaakt door longkanker, darmkanker, borstkanker, pancreaskanker en
prostaatkanker (CBS Statline). Figuur 1.2 geeft de kankerspecifieke sterfte weer van
de 15 meest voorkomende kankersoorten in 2012.
26
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 1.2: Kans (%) vanaf de geboorte om ooit gediagnosticeerd te worden met een
van de vijftien meest voorkomende kankersoorten bij mannen en vrouwen.
Prostaat
12,2%
Borst
13,3%
Luchtpijp & long
8,5%
Dikke darm
4,7%
Dikke darm
5,1%
Luchtpijp & long
4,2%
Huid
4,9%
Huid, incl. scrotum
3,4%
Blaas
4,2%
Huid, melanoom
2,2%
Endeldarm
2,4%
Baarmoederlichaam
2,1%
Huid, melanoom
1,8%
Endeldarm
1,6%
Maag
1,6%
Eierstok
1,3%
Slokdarm
1,5%
Blaas
1,2%
Nier
1,4%
Alvleesklier
1,1%
Alvleesklier
1,2%
Maag
0,9%
Non-Hodgkinlymfoom
1,1%
Nier
0,9%
Strottenhoofd
0,7%
Non-Hodgkinlymfoom
0,9%
Plasmaceltumoren
0,7%
Baarmoederhals
0,7%
Hersenen
0,7%
Slokdarm
0,6%
Zaadbal
0,6%
Hersenen
0,5%
Cursief: bij deze kankersoorten vindt (proef)bevolkingsonderzoek in Nederland plaats.
Bron: IKNL © (geraadpleegd juni 2014).
percentage van totale kankersterfte (%)
25
20
15
10
5
hoofd & hals
huid
nier
eierstok
hersenen
blaas
leukemie
maag
slokdarm
prostaat
alvleesklier
man
non-Hodgkin lymfoom
vrouw
borst
darm
luchtpijp & long
0
Figuur 1.2: Vijftien meest voorkomende kankergerelateerde doodsoorzaken in 2012
(als percentage van totale kankersterfte).
Algemene inleiding
27
In de periode 1989-2012 is er een daling waar te nemen in het voor leeftijd
gestandaardiseerde sterftecijfer door kanker, van 234,28 per 100.000 in 1989 naar
187,53 per 100.000 in 2012. Deze daling was groter bij mannen dan bij vrouwen,
respectievelijk van 304,06 naar 219,75 per 100.000 en van 164,49 naar 155,32 per
100.000 (IKNL geraadpleegd juni 2014; cijfersoverkanker.nl). In de afgelopen jaren
is er ook een verbetering waargenomen in de relatieve 5-jaarsoverleving van kanker
van 47% in de periode 1989-1994 naar 60% in de periode 2005-2010. Veel mensen
leven langer nadat zij zijn gediagnosticeerd met kanker. De kans op overleving
hangt sterk af van het stadium waarin de kanker wordt gediagnosticeerd en de
behandelingsmogelijkheden. De vorm van kanker speelt ook een belangrijke rol
hierbij. Voor de meeste kankersoorten is er vooruitgang geboekt in de relatieve
5-jaarsoverleving, maar voor een aantal kankersoorten geldt dat nog steeds minder
dan een kwart van de patiënten 5 jaar na diagnose nog in leven is (tabel 1.3).
Tabel 1.3: Tumoren met een 5-jaarsoverleving lager dan 25% (periode 2006-2010).
Tumortype
5-jaarsoverleving
Alvleesklier
6%
Mesothelioom
6%
Lever & intrahepatische galwegen
14%
Long
16%
Galblaas
17%
Slokdarm
17%
Acute Myeloïde Leukemie
18%
Hersenen
21%
Maag
21%
Bron:
IKNL© (geraadpleegd
juni 2014).
1.2
Methoden vroege ontdekking van kanker
1.2.1
Screening
Screening is gericht op mensen die geen gezondheidsklachten hebben en heeft tot
doel om in de ‘asymptomatische fase’ kanker door middel van een test of techniek
eerder te ontdekken. Screening is effectief als het resultaat van de behandeling na
detectie in deze asymptomatische fase meer gezondheidswinst, dat wil zeggen
minder sterfte en/of ziektelast, oplevert dan behandeling na klinische diagnose.
Screeningstest
De test of techniek die wordt toegepast voor screening moet betrouwbaar
(reproduceerbaar) en voldoende sensitief en specifiek zijn om de kanker of de
voorstadia ervan in deze asymptomatische fase te detecteren dan wel uit te sluiten.
Voor toepassing in de algemene bevolking is ook de voorspellende waarde van een
positieve of negatieve uitslag van de screeningstest van belang.
28
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Sensitiviteit zegt iets over de gevoeligheid van een diagnostische test of techniek om alle personen
met de gezochte ziekte te identificeren. De sensitiviteit van een test is te berekenen door het
aantal terechtpositieven te delen door de som van het aantal terechtpositieven en het aantal
foutnegatieven. Dit wordt uitgedrukt in een percentage dat kan variëren tussen de 0 en de 100%.
Een hoge sensitiviteit bijvoorbeeld, betekent dat weinig kwaadaardige tumoren door de test
gemist worden. De sensitiviteit van een test wordt dus voornamelijk bepaald door het aantal fout
negatieve testen (aantal ‘gemiste tumoren’).
Specificiteit zegt iets over het onderscheidend vermogen van een diagnostische test of techniek
om alle niet-zieke personen als zodanig te identificeren. De specificiteit van een diagnostische
test is te berekenen door het aantal terechtnegatieven te delen door de som van het aantal
terechtnegatieven en het aantal foutpositieven. Dit wordt uitgedrukt in een percentage dat kan
variëren tussen de 0 en de 100%. Een lage specificiteit bijvoorbeeld, betekent dat veel goedaardige
afwijkingen door de test voor kanker worden aangezien. De specificiteit van een diagnostische test
wordt dus voornamelijk bepaald door het aantal foutpositieve testen (aantal keren ‘vals alarm’).
Positief voorspellende waarde zegt iets over de voorspellende waarde van een bepaalde test
of techniek bij een positieve testuitslag. Dit wordt berekend door het aantal terechtpositieven
te delen door de som van het aantal terechtpositieven en het aantal foutpositieven. Dit wordt
uitgedrukt in een percentage dat kan variëren tussen de 0 en de 100%. Een test met een hoge
positief voorspellende waarde geeft aan dat als de test een verdenking op kanker aangeeft de kans
groot is dat er inderdaad kanker wordt aangetroffen. Een test met een lage positief voorspellende
waarde geeft aan dat als de test een verdenking op kanker aangeeft de kans slechts gering is dat er
inderdaad kanker wordt aangetroffen.
Negatief voorspellende waarde zegt iets over de voorspellende waarde van een bepaalde
diagnostische test of techniek bij een negatieve testuitslag. Dit wordt berekend door het aantal
terechtnegatieven te delen door de som van het aantal terechtnegatieven en het aantal fout­
negatieven. Een test met een hoge negatief voorspellende waarde geeft aan dat als de test geen
verdenking op kanker aangeeft de kans groot is dat er inderdaad geen kanker wordt aangetroffen.
Een test met een lage negatief voorspellende waarde geeft aan dat als de test geen verdenking op
kanker aangeeft de kans relatief hoog is dat er toch kanker wordt aangetroffen. Vaak zoekt men
naar testen met een hoge negatief voorspellende waarde.
http://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen/
Achtergrondinformatie/Screening_de_theorie/Uitslagen_en_testeigenschappen
Algemene inleiding
Evaluatie van screeningseffect
Wanneer er screening op kanker plaatsvindt, lijkt de prognose beter voor de via
screening opgespoorde gevallen. Als een bepaalde aandoening door middel van een
test met bevolkingsonderzoek eerder wordt opgespoord, is de overlevingsduur na
diagnose altijd groter dan zonder bevolkingsonderzoek het geval zou zijn (figuur 1.3).
De diagnose is immers vroeger gesteld. Dit zou hypothetisch ook het geval zijn
wanneer de diagnose kanker eerder gesteld wordt door alertheid op klachten en
symptomen. Maar eerder ontdekken van kanker bij een individu hoeft niet altijd te
leiden tot langer leven van het individu. De begrippen lead time bias en length time
bias zijn hierbij van belang.
29
In figuur 1.3 wordt dit in een theoretisch model geïllustreerd. In deze figuur wordt voor
de verschillende scenario’s van diagnose, resp. gebruikelijke zorg, alertheid op klachten
en symptomen door de patiënt of de (huis)arts, en screening het effect op overleving
(levensverwachting) en uitkomst van zorg (ernstige gevolgen, zoals complicaties als
gevolg van de behandeling, functieverlies en kwaliteit van leven) weergegeven.
screening
alertheid op
klachten
gebruikelijke
diagnose
start behandeling
levensverwachting
sterfte
detecteerbaar
ernstige gevolgen ziekte
lead
time
eerdere diagnose en behandelingsopties
start behandeling
levensverwachting
sterfte
ernstige gevolgen ziekte
lead time
eerdere diagnose en behandelingsopties
start behandeling
levensverwachting
sterfte
ernstige gevolgen ziekte
ziekte is detecteerbaar met een screeningstest of door eerdere alertheid op klachten en symptomen
tijd tussen het gebruikelijke moment van diagnosestelling en het moment waarmee screening of
grotere alertheid de diagnosestelling vervroegt
mate van ernstige gevolgen van ziekte aangegeven in de dikte van de balk.
levensverwachting (in tijd) aangegeven met de lengte van de balk.
Figuur 1.3: Schematische weergave van het te verwachten effect van vervroeging van
diagnose en behandeling (door alertheid op klachten, of door screening) op de levensverwachting en mate van ernstige gevolgen van de ziekte.
30
Lead time bias
Lead time (‘diagnosevervroeging’) is de periode tussen het moment van eerder
opsporen door bijvoorbeeld bevolkingsonderzoek en het moment waarop bij grotere
alertheid van klachten en symptomen bij de patiënt of de (huis)arts de diagnose zou
zijn gesteld (zie oranje pijlen in figuur 1.3). Wanneer bij een bevolkingsonderzoek de
lead time bijvoorbeeld 3 jaar is en vervolgens blijkt dat patiënten die via bevolkings­
onderzoek worden ontdekt, gemiddeld 3 jaar langer leven na diagnose (dus geen
verandering in tijdstip van overlijden), dan heeft het bevolkingsonderzoek geen
winst opgeleverd in termen van werkelijke levensduur, terwijl de betrokkene wel drie
jaar langer op de hoogte was van de diagnose (De Koning en Van der Maas, 2012).
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Length time bias
Daarnaast kan het zo zijn dat met screening een aantal zeer langzaam groeiende
tumoren wordt ontdekt, die bij een natuurlijk beloop slechts na lange tijd of zelfs in
het geheel niet tot klachten of ziekte zou hebben geleid. Deze gevallen zullen een
vertekend beeld geven van de gemiddelde overlevingsduur van tumoren ontdekt via
screening. Dit wordt length time bias genoemd (De Koning en Van der Maas 2012).
De enige methode om niet-vertekende evidentie over de gezondheidseffecten van
vroegopsporing te verkrijgen is gerandomiseerd onderzoek (randomized controlled
trial; RCT), waarin deze typen bias kunnen worden uitgesloten. In een RCT wordt
de doelgroep voor het bevolkingsonderzoek door loting ingedeeld in twee groepen,
waarvan de ene wel bevolkingsonderzoek krijgt aangeboden en de andere niet.
Aan een goede opzet, uitvoering en interpretatie van een RCT voor screening zitten
veel haken en ogen, maar het is bijna onmogelijk om zonder RCT de basisvraag naar
de omvang van de positieve en negatieve effecten van screening betrouwbaar te
beantwoorden (De Koning en Van der Maas 2012).
Criteria bij de besluitvorming over invoering van screening
In Nederland zijn alle vormen van screening op kanker vergunningsplichtig volgens
de Wet op het bevolkingsonderzoek. Om screening op kanker in een populatie
van (‘schijnbare’) gezonde, asymptomatische individuen te rechtvaardigen, moet
aan een aantal criteria worden voldaan. Lang werden hiervoor de criteria van
Wilson & Jungner toegepast (zie appendix 1.1). Tegenwoordig vormen, zoals ook
beschreven door de Gezondheidsraad (Gezondheidsraad 2008), de criteria genoemd
in onderstaand kader de uitgangspunten van het beoordelingskader voor het
aanbieden van screening.
Criteria bij de besluitvorming over invoering van screeningsprogramma’s
•Screening moet gericht zijn op een belangrijk gezondheidsprobleem. Bij kanker wordt de
ziektelast veelal gemeten met behulp van de incidentie, sterfte en verlies van kwaliteit van
leven.
•Nut: het moet vaststaan dat vroege opsporing van de desbetreffende ziekte(n) of aandoening(en)
(dan wel detectie van gezondheidsgerelateerde condities zoals dragerschap of risicofactoren)
bij de doelgroep in kwestie kan leiden tot een significante vermindering van ziektelast, of tot
andere voor de deelnemers zinvolle uitkomsten in verband met het gezondheidsprobleem
waarop de screening is gericht; die voordelen moeten duidelijk opwegen tegen de nadelen die
screening (voor henzelf of voor anderen) altijd ook kan hebben.
•Betrouwbaar en valide instrument: de screeningsmethode moet wetenschappelijk zijn
onderbouwd en de kwaliteit van de diverse onderdelen van het screeningsproces moet zijn
gewaarborgd.
•Respect voor autonomie: deelname aan screening en vervolgonderzoek moet zijn gebaseerd
op een geïnformeerde en vrijwillige keuze; aanbod en uitvoering moet in overeenstemming
zijn met patiëntenrechten (bij een aanbod buiten het gezondheidszorgsysteem:
consumentenrechten).
•Doelmatig gebruik van middelen: met het programma gemoeide (en daardoor veroorzaakte)
inzet van voor de gezondheidszorg beschikbare middelen vergt expliciete verantwoording in
termen van kosteneffectiviteit en rechtvaardigheid.
Algemene inleiding
31
Momenteel worden in Nederland 3 bevolkingsonderzoeken naar kanker vanuit de
overheid aangeboden (borstkanker, baarmoederhalskanker en darmkanker) en
worden er 3 proefbevolkingsonderzoeken aangeboden die tevens wetenschappelijke
gerandomiseerde onderzoeken naar de haalbaarheid en effectiviteit van vroege
opsporing zijn (van prostaatkanker, longkanker en blaaskanker). In appendix 1.2 staat
een overzicht van de stand van zaken van deze (proef-)bevolkingsonderzoeken.
Voor- en nadelen van screening
Bij screening gaat het altijd om een balans tussen positieve en negatieve
gezondheidseffecten op populatieniveau. Onderstaand kader geeft een overzicht
van de voor- en nadelen van screening of vervroeging van de diagnose in het
algemeen. Dit algemene overzicht dient voor screening naar specifieke ziekten te
worden gespecificeerd.
Belangrijkste voor- en nadelen van effectieve screening of vroegdetectie
Voordelen:
•Daling in de ongunstige uitkomst van de ziekte (bijv. kankersterfte) en daarmee winst in
gezonde levensjaren.
•Minder behandelingen voor vergevorderde stadia van de ziekte.
•Minder intensieve of mutilerende primaire behandelingen (bijvoorbeeld meer borstsparende
behandeling dan borstresectie).
•Efficiëntere diagnostiek in de zin van hoger percentage terechtpositieven t.o.v. diagnostische
test bij klinische manifestatie.
Nadelen:
•Foutpositieven.
•Op een eerder tijdstip op de hoogte van de diagnose, ook wanneer er geen verbetering van de
prognose optreedt.
•Eerder en over een langere periode de bijwerkingen van primaire behandeling(en).
•Extra ontdekken van ziekte (overdiagnose) en overbehandeling.
•Risico’s van de screeningsmethode, risico’s van extra vervolgdiagnostiek en onbedoelde detectie
van andere ziektes.
•Mogelijk onterechte geruststelling (gemiste tumor): de aandoening wordt later ontdekt dan
gebruikelijk door onterecht uitstelgedrag.
•Gunstige uitslag mogelijke ‘trigger’ voor ongezond gedrag.
Bron: KWF Kankerbestrijding (2007-2010).
1.2.2
32
Surveillance bij (hoog)risicogroepen
Naast screening wordt ook surveillance (ofwel periodieke controle) ingezet om
kanker eerder te kunnen ontdekken. Evenals bij screening is het doel van surveillance
het opsporen van kanker voordat het symptomatisch wordt, zodat de behandeling
effectiever is. De test die wordt toegepast voor surveillance dient voldoende sensitief
en specifiek te zijn.
Screening wordt in een nader gedefinieerde groep (meestal op basis van leeftijd
en geslacht) in de algemene bevolking uitgevoerd (‘gemiddeld risico’), terwijl
surveillance wordt uitgevoerd bij individuen met een reeds vastgesteld (sterk)
verhoogd risico op het ontwikkelen van kanker. Een verhoogd risico wordt meestal
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
gedefinieerd op basis van erfelijkheid of familiegeschiedenis, maar ook op basis
van een diagnose van voorstadia van kanker bij personen met een gemiddeld risico.
Surveillance wordt bijvoorbeeld geadviseerd aan personen die een verhoogd risico
op darmkanker hebben, omdat ze (een) eerstegraads familielid/-leden hebben met
erfelijke non-polyposis dikkedarmkanker of omdat er dikkedarmkanker in hun
familie voorkomt. Maar ook personen met gemiddeld risico bij wie poliepen zijn
verwijderd, komen in aanmerking voor surveillance. (Signaleringscommissie Kanker
van KWF Kankerbestrijding 2004).
Screening: vroege opsporing bij een nader gedefinieerde groep personen, die geen symptomen
hebben en zich niet ziek voelen, om een bepaalde ziekte of aandoening in een dusdanig vroeger
stadium te ontdekken dat er betere en effectievere behandelingsmogelijkheden zijn.
Surveillance: periodieke controle van individuen met een reeds vastgesteld (sterk) verhoogd risico
op het ontwikkelen van een bepaalde ziekte of aandoening (hoogrisicogroepen).
1.2.3
Alertheid bij klachten en symptomen
Sensitiviteit, specificiteit en voorspellende waarde
Over het algemeen worden klachten en symptomen gezien als late signalen.
Bovendien zijn klachten en symptomen vaak weinig sensitief en specifiek voor een
bepaalde tumorsoort. Deze beperkte sensitiviteit en specificiteit van klachten en
symptomen beïnvloeden de voorspellende waarde daarvan ongunstig. Verwijzing op
grond van klachten, symptomen en/of risicofactoren die niet specifiek genoeg zijn,
kan leiden tot te grote verwijspercentages, waardoor een onevenredig groot aantal
mensen onnodig nader, mogelijk belastend, diagnostisch onderzoek zal ondergaan.
Algemene symptomen die op kanker kunnen wijzen, zoals vermoeidheid,
verminderde eetlust en gewichtsverlies, zijn niet specifiek voor een bepaalde vorm
van kanker (Bosman en Van Krieken 2005). Hierdoor is de positief voorspellende
waarde van deze symptomen voor (een bepaalde vorm van) kanker laag. Zo hebben
bijvoorbeeld Jones et al. (2009) in een cohort patiënten uit 129 huisartsenpraktijken
in het Verenigd Koninkrijk aangetoond dat de positief voorspellende waarde van
bloed in de urine bij vrouwen 14,3% (95% betrouwbaarheidsinterval (BI) 13,3 – 15,3%)
is voor diagnose van urineweginfectie binnen 90 dagen na presentatie, maar slechts
1,7% (95% BI 1,3 – 2,1%) voor kanker van de urinewegen. De positief voorspellende
waarde voor bloed in de urine is bovendien sterk afhankelijk van de leeftijd: bij
vrouwen jonger dan 45 jaar is die 0,2% (0,1 – 0,6%), terwijl het 8,5% (5,6 – 12,3%) bij
vrouwen van 85 jaar en ouder is (Jones, Latinovic et al. 2007).
Algemene inleiding
Voorkomen van vertraging in diagnosestelling (delay)
Met delay wordt vermijdbare late behandeling door een vertraging in het vaststellen
van de diagnose en/of een vertraging tussen de diagnose en de start van behandeling
bedoeld. Vertraging in de diagnosestelling (diagnostic delay) kan veroorzaakt
worden door vertraging in de verschillende fases van het traject vanaf de start van
eerste symptomen tot de uiteindelijke diagnosestelling. Tijdsverlies kan worden
veroorzaakt door de patiënt (patient delay) of zorgverlener (doctor’s delay) (Van Hees
en Spijkerman 2010). Onbekendheid met duidelijke risicofactoren voor kanker kan
hierbij een rol spelen.
33
Patient delay
De tijd die verloopt tussen het hebben van klachten en het presenteren van deze
klachten aan de huisarts wordt patient delay genoemd. Deze vertraging (delay)
treedt op wanneer de patiënt het zoeken van medische hulp uitstelt bij het
ontdekken van klachten en symptomen. In het patient delay model van Andersen
en Cacioppo (1995) worden vier soorten delay beschreven die kunnen optreden
in het proces van medische hulp zoeken door de patiënt. Dit model onderscheidt
vertraging wanneer een symptoom niet met ziekte wordt geassocieerd (1. appraisal
delay), wanneer er geen beslissing wordt genomen met betrekking tot het zoeken
van medische hulp (2. illness delay), wanneer het maken van een afspraak wordt
uitgesteld (3. behavioural delay) en wanneer moet worden gewacht op de afspraak
(4. scheduling delay).
Het niet onderkennen van symptomen en demografische en psychologische factoren
worden gezien als belangrijkste factoren voor het niet tijdig zoeken van medische
hulp. Vooral vage of aspecifieke symptomen worden vaak pas laat gezien als een
mogelijk waarschuwingssignaal van kanker. Indien deze wel worden herkend,
worden ze meestal toegeschreven aan bijvoorbeeld een storing in de spijsvertering,
stress, huidproblemen, menopauze of veroudering (Smith, Pope et al. 2005; National
Patient Safety Agency 2010). Oudere patiënten willen vaak niet als lastig overkomen
en wachten daardoor langer voordat ze met klachten naar de huisarts gaan.
Daarnaast wordt angst beschouwd als een belangrijke barrière om hulp te zoeken,
zowel angst voor kanker als angst om gezien te worden als neuroot of hypochonder
(Smith, Pope et al. 2005).
In 2007 heeft KWF Kankerbestrijding de campagne ‘Ken de 9 signalen’ gelanceerd over
de meest herkenbare signalen die kunnen wijzen op kanker met als doel de kennis en
het bewustzijn van deze symptomen in de bevolking te vergroten (zie kader).
Campagne: ‘Ken de 9 signalen’
Op deze signalen moet men letten:
1. Blijvende heesheid of hoest; bloed in opgehoest slijm.
2. Slikklachten; als slikken pijn doet of als het eten in de slokdarm niet goed zakt.
3. Moedervlekken en huidplekjes die veranderen, of die nieuw zijn.
4. Een plekje dat schilfert, of een bobbeltje op de huid.
5. Een verdikking of bobbeltje ergens in het lichaam.
6.Vrouw: ongewoon vaginaal bloedverlies, abnormale afscheiding buiten de menstruatieperiode.
Man: pijn of veranderingen aan de zaadballen zoals zwelling of verharding.
7.Blijvende verandering in de ontlasting zonder duidelijke aanleiding; bloedverlies en/of slijm bij
de ontlasting.
8.Veranderingen bij het plassen: moeilijker kunnen plassen, vaker moeten plassen, pijn bij het
plassen of bloed in de urine.
9Gewichtsverlies zonder aanleiding.
Bron: KWF Kankerbestrijding (2007-2010).
34
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Doctor’s delay
Voor de huisarts zijn klachten en symptomen van de patiënt en anamnestische
gegevens (bijv. navraag van risicofactoren) het uitgangspunt voor haar/zijn
verder handelen en beleid. Het kennen en herkennen van klachten, symptomen en
risicofactoren die kunnen duiden op (een hoog risico op) (specifieke) kanker is een
belangrijk aspect. Gezien de vaak lage positief voorspellende waarde van klachten
en symptomen, is het voor (huis)artsen niet eenvoudig om op basis van klachten
of symptomen die een patiënt meldt, onderscheid te maken tussen patiënten voor
wie verder onderzoek gerechtvaardigd is en degenen voor wie geruststelling of
een afwachtend beleid kan volstaan (Hippisley-Cox and Coupland 2013). Daarnaast
zijn er veel kankersoorten die, in tegenstelling tot de 4 meest voorkomende
kankersoorten (borst-, long-, prostaat- en darmkanker), weinig voorkomen in de
huisartsenpraktijk. Een huisarts komt bijvoorbeeld maar 1 keer per 5 jaar een nieuw
geval van eierstokkanker tegen in zijn praktijk en ziet gemiddeld eens in de 3-4 jaar
1 nieuwe patiënt met slokdarmkanker en 1 nieuwe patiënt met alvleesklierkanker
(Hamilton 2009). Door de geringe ervaring van huisartsen met deze kankersoorten
kan vertraging optreden in het diagnostisch traject, bijvoorbeeld in het tijdstip
van doorverwijzen bij algemene en niet kankerspecifieke klachten en symptomen
(Hamilton 2009). Uit onderzoek is gebleken dat voor veel voorkomende
kankersoorten als longkanker, blaaskanker en kanker van slokdarm/maag, vaak
drie consulten nodig zijn voor de diagnosestelling op basis van een voorspellend
symptoom (respectievelijk bloed ophoesten, bloed in de urine en slikproblemen)
(Dregan, Moller et al. 2013). Uit een systematische review van de literatuur is
gebleken dat patiëntkenmerken, zoals leeftijd en geslacht ook een rol kunnen
spelen bij mogelijke doctor’s delay (Macleod, Mitchell et al. 2009). Oudere patiënten
werden sneller doorverwezen voor symptomen van borstkanker, slokdarm/maagen dikkedarmkanker, terwijl jongere patiënten sneller werden doorverwezen voor
symptomen gerelateerd aan longkanker of urologische kanker.
Delay: vermijdbare late behandeling door een vertraging in het vaststellen van de diagnose en/of
een vertraging tussen de diagnose en de start van behandeling.
Patient delay: de tijd die verloopt tussen het hebben van klachten en het presenteren van deze
klachten aan de huisarts.
Doctor’s delay: de tijd die verloopt tussen het presenteren van symptomen door de patiënt en het
vast stellen van de diagnose.
Algemene inleiding
Risicofactoren
Kennis van risicofactoren van (bepaalde soorten) kanker bij huisartsen en het
algemene publiek is belangrijk, maar is niet voldoende. Individuen moeten ook
inzicht hebben in hun eigen risicogedrag. Ze moeten weten wanneer ze met
welke symptomen en klachten naar de huisarts moeten gaan en deze bij zichzelf
kunnen onderkennen. Voorlichting door de beroepsgroep kan hierin voorzien.
Patiënten moeten vervolgens het belang inzien van een bezoek aan de huisarts en
dat daadwerkelijk ook (kunnen) doen (voorkomen van patient delay). (Huis)artsen
35
moeten weten wanneer nader onderzoek of verwijzing nodig is en deze zo snel
mogelijk uitvoeren (voorkomen van doctor’s delay). De tijd tussen het tijdstip dat
belangrijke voorspellende symptomen of klachten zich voor het eerst voordoen
en het tijdstip waarop uiteindelijk de diagnose wordt vastgesteld en vervolgens
behandeling kan worden ingezet, moet idealiter zo kort mogelijk zijn, omdat
vertraging in de diagnosestelling effect kan hebben op de prognose van de patiënt.
Het is belangrijk vast te stellen of er sprake is van vermijdbare diagnostic delay.
Voor dit rapport zijn drie tumorsoorten geïdentificeerd waarvoor verbetering van
vroege ontdekking mogelijk lijkt. De mogelijkheden van risicofactoren, klachten
en symptomen, voorkomen van delay en screening (en/of surveillance) worden
geanalyseerd evenals de te behalen gezondheidswinst door vroege ontdekking.
1.3
Referenties
Andersen BL and Cacioppo JT (1995) Delay in seeking a cancer diagnosis: delay stages
and psychophysiological comparison processes. Br J Soc Psychol 34 ( Pt 1): 33-52.
Bosman FT en Van Krieken JHJM (2005) Fundamentele aspecten van kanker. Oncologie.
C. J. H. van de Velde et al. Houten Bohn Stafleu van Loghum. 7e herziene druk.
De Koning HJ en Van der Maas PJ (2012. Secundaire preventie. Volksgezondheid en
gezondheidszorg. J. P. Mackenbach and K. Stronks. Amsterdam reed Business.
Dregan A et al. (2013) Are alarm symptoms predictive of cancer survival?: populationbased cohort study. Br J Gen Pract 63(617): e807-812.
Gezondheidsraad (2008). Screening: tussen hoop en hype. Den Haag
Gezondheidsraad. publicatienr. 2008/05.
Hamilton W (2009) The CAPER studies: five case-control studies aimed at identifying
and quantifying the risk of cancer in symptomatic primary care patients. Br J
Cancer 101 Suppl 2: S80-86.
Hippisley-Cox J and Coupland C (2013) Symptoms and risk factors to identify women
with suspected cancer in primary care: derivation and validation of an algorithm.
Br J Gen Pract 63(606): e11-21.
IKNL (2012) Nederlandse Kankerregistratie. Retrieved december 2013 from
http://www.cijfersoverkanker.nl/.
Jones RJ et al. (2009) Alarm symptoms and identification of non-cancer diagnoses in
primary care: cohort study. BMJ 339: b3094.
Jones R et al. (2007) Alarm symptoms in early diagnosis of cancer in primary care:
cohort study using General Practice Research Database. BMJ 334(7602): 1040.
Macleod U et al. (2009) Risk factors for delayed presentation and referral of
symptomatic cancer: evidence for common cancers. Br J Cancer 101 Suppl 2:
S92-S101.
National Patient Safety Agency (2010) Delayed diagnosis of cancer: Thematic review.
NHS. London National Patient Safety Agency.
Signaleringscommissie Kanker van KWF Kankerbestrijding (2004) Vroege opsporing
van dikkedarmkanker. Minder sterfte door bevolkingsonderzoek. Oisterwijk KWF
Kankerbestrijding.
Smith LK et al. (2005) Patients’ help-seeking experiences and delay in cancer
presentation: a qualitative synthesis. Lancet 366(9488): 825-831.
36
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Van Hees F en Spijkerman AMW (2010) ‘Diagnostic delay’ bij kanker en diabetes. Een
verkenning van begrippen en kennislacunes. Bilthoven RIVM. RIVM rapport
260221001.
Walthouwer M et al. (2012) Kennis van kankersymptomen en de rol van psychosociale
factoren bij tijdig medisch hulpzoekgedrag. TSG 90(1): 36-44.
Algemene inleiding
37
‘Risicostratificatie en nieuwe
diagnostische methoden kunnen de
haalbaarheid van surveillance en
screening op (het voorstadium van)
slokdarmkanker vergroten.’
Prof. dr. Peter Siersema
2
Doelstelling en werkwijze
2.1
Doelstellingen
Voor de inventarisatie van de huidige kennis van vroege ontdekking bij tumor­soorten
die relatief veel voorkomen, een (zeer) slechte 5-jaarsoverleving hebben en vaak
ontdekt worden in een laat stadium, waren de volgende doelstellingen geformuleerd:
1.Identificeer bij welke tumorsoorten er aanwijzingen zijn voor aangrijpings­
punten voor het verbeteren van vroege ontdekking.
2.Inventariseer de huidige stand van de wetenschap en klinische praktijk met
betrekking tot de mogelijkheden van vroege ontdekking voor deze tumor­
soorten, kijkend naar verschillende aspecten, namelijk risicofactoren, klachten
en symptomen, terugdringing van patient/doctor’s delay en screening.
2.2
Werkwijze
In deze paragraaf wordt beschreven op welke wijze deze doelstellingen zijn gereali­
seerd. De werkwijze bestond uit twee fasen. De eerste fase heeft geleid tot de selectie
van de tumorsoorten waar dit rapport nader op in gaat. De tweede fase betrof een
inventarisatie van de huidige kennis van vroege ontdekking middels een systematische
review van de literatuur, een analyse van tumor­specifieke gegevens van de Nederlandse
Kanker Registratie (NKR) en het raadplegen van experts. De SCK-werkgroep heeft
voor de raadpleging van experts tumorspecifieke begeleidingsgroepen ingesteld (zie
verantwoording en samen­stelling van de werkgroep). Deze zijn geconsulteerd voor
de beoordeling van het literatuuronderzoek, voor inhoudelijke input met betrekking
tot het biologisch gedrag en de pathogenese van de kankersoorten, voor de klinische
praktijk en voor feedback op de eindrapportage van de werkgroep.
2.2.1
Fase 1: Procedure voor de keuze van tumoren
De procedure die leidde tot de keuze van de te analyseren tumorsoorten bestond uit drie
stappen, waarin achtereenvolgens de volgende criteria voor selectie werden gebruikt:
Stap 1: Aandeel in de sterfte en ziektelast in de bevolking
In deze stap werd uit de lijst van 38 kankersoorten (website van KWF, maart 2012) een
selectie gemaakt aan de hand van Nederlandse gegevens over:
• A antallen sterfgevallen: er is hiervan een schatting gemaakt door het aantal
nieuwe gediagnosticeerde patiënten te vermenigvuldigen met de proportie van
de gediagnosticeerde patiënten die sterft aan de betreffende kanker (1-jaarsminus 10-jaarsoverleving).
• De 5-jaarsoverleving.
• A andeel op het aantal te winnen levensjaren door vroege ontdekking: als maat
hiervoor is de gemiddelde leeftijd bij diagnose gekozen.
• Criteria voor inclusie waren: hoog aantal sterfgevallen, 5-jaarsoverleving lager
dan 60% en gemiddelde leeftijd bij diagnose lager dan 65 jaar. Uitgesloten voor
inclusie waren de kankersoorten waarop al wordt gescreend via georganiseerd
(proef-)bevolkingsonderzoek (appendix 1.2). Uiteindelijk kwamen 14 kankers in
aanmerking voor inclusie in de eerste stap (zie tabellen 2.3 t/m 2.5).
Doelstelling en werkwijze
39
Stap 2: Potentiële mogelijkheden voor verbetering van vroege ontdekking
Voor de 14 geselecteerde kankersoorten uit stap 1 zijn vervolgens de potentiële
mogelijkheden voor verbeteringen op het gebied van vroege ontdekking grofweg
geïnventariseerd, aan de hand van de volgende aspecten:
• Pathogenese; aanwezigheid van een detecteerbaar preklinisch stadium.
• Mogelijk herkenbare klachten en symptomen en risicofactoren.
• Mogelijke aanwijzingen voor delay (patient en doctor’s).
• Beschikbare screeningstesten.
• Geschatte gezondheidswinst na vroege ontdekking.
We maakten hiervoor gebruik van gegevens van (systematische) reviews van
de laatste 2-3 jaar en de originele artikelen die in de afgelopen twee jaar zijn
gepubliceerd. De tabellen 2.3 t/m 2.5 tonen de gegevens over deze aspecten van
vroege opsporing voor deze 14 kankersoorten.
Stap 3: Oordeel van experts
Op basis van consensus in de SCK werkgroep Vroege ontdekking werden de 14
kanker­soorten aan de hand van het uit stap 2 resulterende overzicht beoordeeld en
ingedeeld in drie categorieën:
1.Tumorsoorten die geselecteerd zijn voor het huidige onderzoek, te weten
slokdarmkanker, pancreaskanker en eierstokkanker (tabel 2.3).
Voornaamste criteria voor deze keuze waren aandeel van de kanker in de
algemene sterfte, waarvoor een gecombineerde maat van incidentie en survival
werd gehanteerd (incidentieaantallen x (1-jaars- minus 10-jaarsoverleving)) en
aanwijzingen voor een beschikbare screeningstest.
2.Tumorsoorten die niet in het huidige onderzoek, maar mogelijk wel in de
toekomst zouden moeten worden onderzocht (tabel 2.4).
Blaaskanker behoorde aanvankelijk tot de groep tumoren die geselecteerd
was voor het huidige onderzoek, maar kon wegens tijdgebrek niet worden
onderzocht. Op dit moment vindt echter een proefbevolkingsonderzoek op
blaas­k anker plaats (zie appendix 1.2), waardoor deze tumor niet meer binnen het
kader van onze studie past, omdat kankersoorten waarop al wordt gescreend via
georganiseerd (proef-)bevolkingsonderzoek werden uitgesloten voor inclusie.
Voor de andere kankersoorten in deze categorie is het aandeel op de algemene
sterfte relatief minder hoog en/of is geen bruikbare screeningstest beschikbaar,
maar zijn er wellicht andere mogelijkheden voor verbetering van vroege ontdekking, in de vorm van specifieke/eenvoudig te meten klachten en symptomen
(bijv. mond- en keelholte) of grote delay (multipel myeloom ofwel ziekte van
Kahler).
3.Tumorsoorten die buiten het kader van dit rapport vallen (tabel 2.5).
Redenen zijn de mogelijk grotere winst die kan worden bereikt bij de
behandeling in plaats van vroege ontdekking (non-Hodgkin, acute leukemie),
relatief weinig delay in diagnose (acute leukemie) of de relatief gunstigere
uitgangssituatie (incidentie x survival) (melanoom, baarmoederkanker,
chronische leukemie, neuro-endocriene tumoren).
2.2.2
Fase 2: Analyse van de tumorsoorten
In de tweede fase is gebruik gemaakt van literatuuronderzoek en tumorspecifieke
gegevens uit de Nederlandse Kankerregistratie om tot een analyse te komen van de
geselecteerde tumorsoorten: slokdarm-, alvleesklier- en eierstokkanker.
40
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Literatuuronderzoek
Voor elke kankersoort zijn de volgende vraagstellingen onderzocht in het
literatuuronderzoek:
1.Zijn er duidelijke voorspellende klachten en symptomen of risicofactoren die
gecommuniceerd zouden moeten worden?
2.Is vroegere ontdekking van deze kankersoorten mogelijk door middel van
maatregelen die patient en/of doctor’s delay verminderen?
3.Is vroege ontdekking van deze specifieke kankersoorten mogelijk door middel
van screening?
4.Wat is bij deze kankersoorten de geschatte gezondheidswinst na vroege
ontdekking?
In het literatuuronderzoek wordt gebruik gemaakt van de klassieke systematische
reviewmethode. Hierbij wordt op systematische wijze naar wetenschappelijke
publicaties gezocht in de databank PubMed (periode 2002-2013) aan de hand van een
expliciete vraagstelling (zie tabel 2.1) en zoekstrategie (zie appendix 2.1). Minstens
twee onderzoekers beoordeelden onafhankelijk van elkaar de gevonden publicaties
op relevantie en kwaliteit, aan de hand van de volgende vooraf bepaalde inclusie- en
exclusiecriteria:
• Inclusie:
- Onderzochte kankersoort is primaire kanker.
- Populatie: algemene populatie; klinische populatie.
- Type studies: review, RCT, case-control, cohortstudie, expert opinion.
- Taal: Engels, Nederlands, Duits, Frans, Spaans, Italiaans, Portugees.
• E xclusie:
- Andere kanker/ziekte.
- Onderzochte kankersoort als belangrijke comorbiditeit bij andere ziektes.
- Comorbiditeit bij de onderzochte kankersoort.
- Populatie: kinderen (< 18 jaar), dieren.
-Type studie: case reports, laboratorium experimenten (in-vitro-, in-vivostudies).
- Taal: andere taal dan bovengenoemde.
(Zie tabel 2.1 voor de specifieke inclusie- en exclusiecriteria per vraagstelling).
De eerste selectie vond plaats op basis van de samenvatting van het artikel en de
tweede op basis van de volledige tekst. Een extra selectie van artikelen vond plaats
op basis van referenties van relevante artikelen (zie voor aantallen publicaties per
selectiestap het kader). Gegevens over de karakteristieken en uitkomsten van de
geïncludeerde publicaties werden samengevat in een data-extractietabel. Tenslotte
werden de geïncludeerde publicaties beoordeeld op kwaliteit. Hiervoor gebruikten
we EBRO-(Evidence-Based Richtlijn Ontwikkeling)-formulieren, afhankelijk van het
type onderzoek. Uiteindelijk zijn er voor deze inventarisatie alleen originele studies
(RCTs, cohortstudies en case-controlstudies) uit de data- extractietabel geselecteerd
die een goede beoordeling en een voldoende grote steekproef (minstens 100
individuen) hadden. In de rapportage van de bevindingen wordt over het algemeen
meer gewicht toegekend aan resultaten uit studies met een goed onderzoeksdesign,
waarbij een RCT het beste onderzoeksdesign heeft, gevolgd door prospectieve
cohortstudies, retrospectieve cohortstudies en case-controlstudies.
Doelstelling en werkwijze
41
Selectie van geïncludeerde artikels
Selectiestappen
Slokdarmkanker
Alvleesklierkanker
Eierstokkanker
Aantal gevonden in PubMed (incl. dubbele)
1307
936
1379
Aantal gelezen samenvattingen
1115
172
1008
Aantal gelezen volledige artikelteksten
197
136
333
Aantal geïncludeerde artikels
51
48
54
Aantal geïncludeerde artikels op basis
van referentielijsten uit stap 4
7
2
0
Analyse tumorspecifieke gegevens Nederlandse Kankerregistratie
Om het belang van vroege ontdekking bij slokdarmkanker, alvleesklierkanker en
eierstokkanker te benadrukken is IKNL gevraagd een analyse uit te voeren m.b.v.
gegevens van de Nederlandse kankerregistratie (NKR). De analyse had tot doel
inzicht te krijgen in de winst van ontdekking in een eerder stadium (in termen
van meer kans op genezing, verbetering van de overleving, sterftereductie en het
uitvoeren van minder ingrijpende behandelingen). De analyse is uitgevoerd op basis
van de vraag wat de relatie is tussen het stadium bij de diagnose en de uitkomst van
zorg (5-jaarsoverleving). De onderzoeksvragen waren als volgt:
1.Welke vormen van kanker kunnen bij de genoemde tumorsoorten worden
onderscheiden en hoe is de procentuele verdeling hiervan?
2.Wat zijn de meest recente gegevens met betrekking tot incidentie, prevalentie en
sterfte van de betreffende kankersoort, uitgezet voor verschillende geslachten
en leeftijdscategorieën?
3.Wat waren de patiëntkenmerken en stadiumverdeling bij diagnose (gegevens
betreffende registratieperiode 2003-2005, 2006-2008 en 2009-2011).
4.Wat is de relatie tussen het stadium bij diagnose en de behandeling? Dit om te
laten zien dat er bij een vroeg stadium (stadium I en II) bij diagnose (mogelijk)
betere behandelopties zijn dan bij een laat stadium (stadium III en IV).
5.Wat is de relatie tussen het stadium bij diagnose en de 5-jaarsoverleving, uitgezet
voor verschillende leeftijdscategorieën?
Analyses voor onderzoeksvragen 3 en 4 werden voor mannen en vrouwen gecombineerd
gedaan. Als er aanleiding toe was, werden de seksen apart geanalyseerd.
De stadiumverdeling naar TNM-classificatie verschilt per tumorsoort. In appendix 2.2
staat dit aangegeven voor slokdarm-, alvleesklier- en eierstokkanker.
42
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 2.1: Vraagstellingen, zoekvragen, en inclusie- en exclusiecriteria.
Vraagstelling
Zoekvragen
Specifieke inclusie- en exclusiecriteria
Vraagstelling I:
Is vroege ontdekking
van [slokdarmkanker]
[alvleesklierkanker]
[eierstokkanker]
mogelijk aan de
hand van klachten
en symptomen (en
risicofactoren)?
•Zijn er klachten en
symptomen die
(vroege stadia van)
[slokdarmkanker]
[alvleesklierkanker]
[eierstokkanker] kunnen
voorspellen? (search 1)
•Welke methoden bestaan
er om klachten en
symptomen bij patiënten
te monitoren?
Inclusie:
Studies gericht op klachten en symptomen; voorspellende
factoren; hoogrisicogroepen.
Vraagstelling II:
Is vroege ontdekking
van [slokdarmkanker]
[alvleesklierkanker]
[eierstokkanker]
mogelijk door middel
van maatregelen die
doctor en/of patient
delay verminderen?
•Is er sprake van
doctor’s en/of patient
delay bij de diagnose
van [slokdarmkanker]
[alvleesklierkanker]
[eierstokkanker]? (search 2)
•Welke factoren spelen
hierbij een rol?
Inclusie:
Studies gericht op: ‘delayed presentation of patient’;
‘delayed referral’; ‘delayed diagnosis’.
Vraagstelling III:
Is vroege ontdekking
van [slokdarmkanker]
[alvleesklierkanker]
[eierstokkanker]
mogelijk door middel
van screening?
•Is er een detecteerbaar
preklinisch stadium?
(search 3)
•Welke screenings­
methoden zijn beschikbaar? (search 4)
•Wat zijn de testeigen­
schappen? (search 5)
Inclusie:
Studies gericht op: screening, vroege opsporing; vroege
diagnostiek.
Screeningsmethode: biomarkers; beeldvormende
technieken.
Vraagstelling IV:
Wat is de geschatte
winst na vroege
ontdekking? (search 6)
-
Inclusie- en exclusiecriteria zijn dezelfde als voor
vraagstelling III.
Algemene inclusieen exclusiecriteria
Inclusie:
•Onderzochte kankersoort is primaire kanker
•Populatie: algemene populatie; klinische populatie
•Type studie: review, RCT, case-control, cohortstudie, expert opinion
•Taal: Engels, Nederlands, Duits, Frans, Spaans, Italiaans, Portugees
Exclusie:
Studies uitsluitend gericht op screening, behandeling of
richtlijnen voor behandeling; prognostische factoren voor
ziekteprogressie/metastasen en survival; epidemiologie
(algemene studie over (trends in) incidentie, sterfte);
etiologie (beschrijving van de mechanismes die een rol
spelen bij het ontstaan van slokdarmkanker/alvleesklierkanker/
eierstokkanker).
Exclusie:
Studies uitsluitend gericht op systematische screening,
screeningstesten; complicaties als gevolg van diagnostiek;
behandeling of richtlijnen voor behandeling; prognostische
factoren voor ziekteprogressie/metastasen en survival;
epidemiologie (algemene studie over (trends in) incidentie,
sterfte).
Exclusie:
Studies uitsluitend gericht op behandeling of richtlijnen
voor behandeling; prognostische factoren voor
ziekteprogressie/metastasen en survival; epidemiologie
(algemene studies over (trends in) incidentie, sterfte).
Exclusie:
•Andere kankersoort/ziekte
•Gericht op onderzochte kankersoort als belangrijke comorbiditeit bij andere ziektes
•Gericht op comorbiditeit bij de onderzochte kankersoort
•Populatie: kinderen (< 18 jaar), dieren
•Type studie: case reports, laboratoriumexperimenten (in-vitro-, in-vivostudies)
•Taal: andere taal dan bovengenoemde
Doelstelling en werkwijze
43
Tabel 2.2: Aanvullende vraagstellingen voor slokdarmkanker gesteld door de experts
uit de begeleidingsgroep.
Vraagstelling
Zoekvragen
Specifieke inclusie- en exclusiecriteria
Vraagstelling: is vroege ontdekking van
slokdarmkanker mogelijk door middel
van screening of surveillance?
•Is er een detecteerbaar
pre­klinisch stadium?
(search 1)
•Welke screeningsmethoden
zijn beschikbaar? (search 2)
•Wat zijn de testeigenschappen? (search 3)
Inclusie:
Studies gericht op screening, vroege
opsporing; vroege diagnostiek;
screeningmethode; biomarkers;
beeldvormende technieken.
A.Welke factoren (demografisch,
omgevings-, genetisch, moleculair)
dragen bij aan de progressie naar
hooggradige dysplasie en slokdarmkanker (adenocarcinoom) bij
Barrett-slokdarm?
B.Is er een techniek die kan worden
gebruikt in de algemene populatie
voor het identificeren van personen
met een hoog risico op slokdarm­
kanker (adenocarcinoom)?
Exclusie:
Studies uitsluitend gericht op behandeling of richtlijnen voor behandeling;
prognostische factoren voor ziekte­
progressie/metastasen en survival;
epidemiologie (algemene studie over
(trends in) incidentie, sterfte).
Tabel 2.3: Tumorsoorten die geselecteerd zijn voor het huidige onderzoek.
Kankersoort
Slokdarm
Alvleesklier
Eierstok
Incidentie
2350
2200
1400
5-jaarsoverleving
15%
5%
38%
Jaarlijkse sterfte,
gemiddeld aantal in
komende 5 jaar
(Incidentie x (1 - 5-jaarsoverleving))
1998
2090
868
10-jaarsoverleving
9%
Onderzocht
aspect vroege
ontwikkeling
Maat
Ernst van de
kanker
Klachten en
symptomen (incl.
risicofactoren)
44
3%
29%
Jaarlijkse sterfte,
2139
gemiddeld aantal in
komende 10 jaar
(Incidentie
x (1 - 10-jaarsoverleving))
2134
994
Leeftijd diagnose
> 60 jaar
> 50 jaar
Klachten en symptomen Moeite/pijn bij
slikken,
passageklachten,
klachten tijdens/na
eten (hoesten,
opgeven voedsel, hik),
pijn achter borstbeen
of hoog in de rug,
gewichtsverlies,
verminderde eetlust,
heesheid
> 50 jaar
Buik- en/of rugpijn,
verstoord ontlastingspatroon, verminderde
eetlust, gewichts­
verlies.
Onregelmatig
bloedverlies na
menopauze, buikpijn,
obstipatie, verlies
eetlust, gewichts­
verlies, opgezette
onderbuik, opgezette
onderbuik(gevoel),
vaker plassen
Risicofactoren
Familiegeschiedenis,
genetische aanleg,
roken, diabetes
Barrett-slokdarm,
roken, overmatig
alcohol, zuurbranden,
overgewicht, weinig
groente en fruit
Bij afgesloten
galwegen: vermoeidheid, lusteloosheid,
donkere urine, dunne
en lichtgekleurde
faeces, geelzucht,
misselijkheid,
overgeven
Familiegeschiedenis,
genetische aanleg
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Kankersoort
Slokdarm
Alvleesklier
Eierstok
14%
10%
13%
8
Doctor’s;
lager nummer is langere
b
delay
2
5
Biomarkers,
sensitiviteit, specificiteit, positief voorspellende waarde
Geen sensitieve/
specifieke biomarkers
voor vroege ontdekking
Bloedtest CA-125, .89,
.99, .43 (Menon et al.
2009)
Onderzocht
aspect vroege
ontwikkeling
Maat
Delay
Patient;
% lange tijd met
symptomena
Beschikbare
screeningstest(en)
Geen
(Chakraborty et al.
2011; Stoita et al. 2011)
Winst?
Beeldvormende
technieken,
sensitiviteit, specificiteit, positief voorspellende waarde
Endoscopie
EUS, .84, .97
Echografie, .85, .98,
.05 (Menon et al.
2009)
Detecteerbaar
preklinisch stadium?
Barrett-slokdarm (van
Sandick et al. 1998)
In hoogrisicogroepen
(Stoita et al. 2011)
Mogelijk wel
Leidt screening tot
gezondheidswinst?
Massascreening in
westerse landen niet
kosteneffectief. Twijfel
bij kosteneffectiviteit
van screening van
patiënten met een
Barrett-slokdarm
(Hirst et al. 2011)
Screening in
hoogrisicogroepen
lijkt kosteneffectief
(Stoita et al. 2011)
Screening in de
algemene populatie
wordt onderzocht in
o.m. de VS en het VK in
grootschalige trials
Geschatte verbetering
prognose na vroeg­
detectiec
40%
10%; 5-jaarsoverleving 52%
stadium I 58% (Stoita
et al. 2011), dus hoger
dan geschat door van
Hees and Spijkerman
(2010a)
aSymptomen die twee maanden of langer aanwezig waren bij de patiënt vóór het eerste consult bij de huisarts
(patiënt interval) (RCGP 2011).
bOrdening van lage naar hoge kans op doorverwijzing naar een specialist bij 3 of meer consulten bij de huisarts
(Lyratzopoulos et al. 2012).
cGeschatte verschil in 5-jaarsoverleving tussen tumoren ontdekt in stadium I-II versus stadium III-IV (Van Hees
and Spijkerman 2010a).
Bron: incidentie- en overlevingsgegevens: IKNL, geraadpleegd maart 2012: cijferoverkanker.nl; Doodsoorzaken,
CBS (2009).
Bron: gegevens klachten en symptomen: Van Hees and Spijkerman, 2010.
Doelstelling en werkwijze
45
Tabel 2.4: Tumorsoorten die mogelijk in de toekomst verder moeten worden
ondergezocht.
Tabel
2: Tumorsoorten
Tumorsoorten
die mogelijk
mogelijk in
in de
de toekomst
toekomst verder
verder moeten
moeten worden
worden ondergezocht.
ondergezocht.
Tabel 2:
die
Kankersoort
Kankersoort
Onderzocht
Onderzocht
aspect vroege
vroege
aspect
ontdekking
ontwikkeling
ontdekking
Ernst
Ernst van
van de
de
Ernstvande
kanker
kanker
kanker
Klachten en
Klachtenen
symptomen
Klachten en
symptomen
(incl.
risicosymptomen
(incl.risicofactoren)
(sign &
factoren)
symptoms)
incl.
risicofactoren
Delay
Delay
Delay
46
46
Blaas
Blaas
Blaas
Monden
keelholte
Monden
enkeelholte
keelholte
Mond-
Multiple
myeloom
Multipelmyeloom
myeloom*
Multiple
(ziekte van
van Kahler)
Kahler)
(ziekte
Incidentie
Incidentie
Incidentie
5200
5200
5200
1850
1850
1850
880
880
880
5-jaarsoverleving
5-jaarssurvival
5-jaarsoverleving
72%72%
(Thomson
and
(Thomson
72%
(Thomson
and
Forman
2009) 2009)
and Forman
Forman
2009)
(Thomson 2009)
1456
1456
1456
60%
(Mond)
60%
(Mond)
60%
(Mond)
35%
(Thomson
and
35%(Thomson
(Thomsonand
and
35%
Forman
2009)
Forman2009)
2009)
Forman
572
572
572
Maat
Maat
Maat
Jaarlijkse sterfte,
sterfte,
740
Jaarlijkse
740
gemiddeld
aantal in
in
Jaarlijkse sterfte,
740
gemiddeld
aantal
komende
5 jaar
jaar
gemiddeld
aantal in
komende
5
(Incidentie
x jaar
(1 -- 5-jaars
5-jaars
komende 5x
(Incidentie
(1
survival))
(Incidentie x (1 –
survival))
5-jaarssurvival)
10-jaarsoverleving
44%
10-jaarsoverleving
??
44%
10-jaarssurvival
?
44%
1036
Jaarlijkse sterfte,
sterfte,
Jaarlijkse
??
1036
gemiddeld
aantal in
in
Jaarlijkse sterfte,
?
1036
gemiddeld
aantal
komende
10 aantal
jaar in
gemiddeld
komende
10
jaar
(Incidentie
x (1
(1jaar
komende 10
(Incidentie
x
-10-jaarsoverleving))
(Incidentie x (1 – 10-jaars
10-jaarsoverleving))
survival))
Leeftijd
diagnose
65 jaar
jaar
50 jaar
jaar
Leeftijd
diagnose
>> 65
>> 50
Leeftijd en
diagnose
70 >in
65jr
> 50jr
Klachten
symptoBloed
urine,
Witte/rode
plekken in
in
Klachten en
symptoBloed
in urine,
Witte/rode
plekken
men
vaker
moeten
plassen, de
dewitte/rode
mond,
Klachten en
Bloed
in urine,
plekken in
men
vaker
moeten
plassen,
mond,
dysurie;
maar
nietplassen,zweer/blaasje
zweer/blaasje
in mond
mond
symptomen
vaker maar
moeten
de mond, in
dysurie;
niet
geassocieerd
metniet
hoger dat
dat
niet geneest,
geneest,
dysuria; maar
zweer/blaasje
geassocieerd
met
hoger
niet
risico
(Force 2012)
2012)met
mondbloeden,
geassocieerd
in mond die
risico
(Force
mondbloeden,
losse
tanden,
hoger risico ] (Force losse
niettanden,
geneest,
moeite/pijn
met
2012)
mondbloeden,
moeite/pijn
met
slikken/openen
mond,
losse tanden, moeite/
slikken/openen
mond,
heesheid,
pijn met slikken/
heesheid,
veranderde
spraak,
openen mond,
veranderde
spraak,
pijn
in keel/halsgebied,
keel/halsgebied,
heesheid,
pijn
in
niet
meer passende
passende
veranderde
spraak,
niet
meer
gebitsprothese,
pijn in keel/
gebitsprothese,
verlies
gevoel, gezicht/
gezicht/
halsgebied
verlies
gevoel,
mond,
eenzijdige
niet meer
passende
mond,
eenzijdige
neusverstopping/
gebitsprothese,
neusverstopping/
bloeding
of doofheid,
doofheid,
verlies gevoel
bloeding
of
dubbelzien,
gezicht/mond,
dubbelzien,
zwelling
gehemelte
eenzijdige
zwelling
gehemelte
neusverstopping/
Risicofactoren
Roken,
Zware
rokers
en
Risico
Roken,
Zware rokers en
bloeding
of doofheid,
blootstelling
drinkers
(combinatie
is
blootstelling
drinkers
(combinatie
is
dubbelzien,
carcinogenen,
versterkend)
carcinogenen,
versterkend)
zwelling gehemelte
mannelijk geslacht,
geslacht,
mannelijk
hogere
leeftijd,
Risicofactoren
roken,
zware rokers en
hogere
leeftijd,
infecties,
bepaalde
blootstelling
drinkers (combinatie
infecties,
bepaalde
parasieten,
carcinogenen,
is versterkend),
parasieten,
familiegeschiedenis
Mannen,
familiegeschiedenis
Hogere leeftijd,
infecties bepaalde
parasieten,
familiegeschiedenis 21%
8%
Patient;
Patient;
8%
21%
% lange
lange tijd
tijd met
met
%
a
symptomena
symptomen
Patient;
8%
21%
11
Aanwezig
(van der
der
Doctor’s;
Doctor’s;
11
Aanwezig
(van
% lange
tijd met
Waal et
et al.
al. 2011)
2011)
lager
nummer
is
lager
nummer
is
Waal
a
b
symptomen
langere delay
delayb
langere
Dokter;
11
Aanwezig (Van der
lager nr is langere
Waal et al. 2011)
delayb
??
?
??
?
60 jaar
jaar
>> 60
> 60jr
Gewrichtspijn,
Gewrichtspijn,
botbreuken,
gewrichtspijn,
botbreuken,
grote
vermoeidheid,
botbreuken,
grote
vermoeidheid,
grote
dorst,
grotedorst,
vermoeidheid,
grote
infecties/koorts,
grote dorst,
infecties/koorts,
gewichts-verlies,
infecties/ koorts,
gewichts-verlies,
misselijkheid,
gewichtsverlies,
misselijkheid,
constipatie,
misselijkheid,
constipatie,
vaak
plassen
constipatie,
vaak
plassen
vaak plassen
11%
11%
11%
11
1
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Nier
Nier
Maag
Maag
Non-Hodgkin
Non-Hodgkin
Hersenen
Hersenen
Acute leukemie
leukemie
Acute
2115
2115
1600
1600
3860
3860
1200
1200
800
800
- 200lymfatisch
lymfatischen
(200
- 600myeloïde)
myeloïde
600
58%
58%
22%22%
67%
67%
22%
22%
48% (lymfatisch)
(lymfatisch)
48%
(myeloïde)
16% (myeloïde)
888
888
1248
1248
1274
1274
936
936
608
608
44%
17%
47%
13%
44%
1184
1184
17%
1328
1328
47%
2046
2046
13%
1044
1044
30% (lymfatisch)
30%(myeloïde)
(lymfatisch)
11%
11% (myeloïde)
674
674
55-75 jaar
> 60 jaar
> 45 jaar
55-75jr
> 60jr
> 45jr
Bloed in urine,
Gewichtsverlies,
LymfeklierBloed
Gewichtsverlies
62%
Lymfeklier­
pijn
inin
deurine,
zij,
pijn bovenbuik,
zwellingen,
pijn in deinzij,
Pijnmisselijkheid,
bovenbuik 52%
zwellingen,
knobbel
de zij,
koorts,
knobbel in de zij,
Misselijkheid
34%eetlust, nachtzweten,
koorts,
gewichtsverlies,
vermindering
gewichtsverlies,
eetlust 32% vermoeidheid,
nachtzweten,
grote
vermoeidheid, Vermindering
slikklachten,
26%
vermoeidheid,
koorts,
aanhoudende
koorts,Slikklachten
bloedverlies,
gewichtsverlies
grote
Bloedverlies
gewichts­verlies
nachtzweten,
vol gevoel20%
na
vermoeidheid,
Volmaaltijd,
gevoel na maaltijd 18%
verlies
eetlust
aanhoudende
vermoeidheid
en
vermoeidheid,
koorts,
duizeligheid
(RCGP 2011)
duizeligheid
nachtzweten,
verlies eetlust
Overgewicht,
roken,
erfelijkheid (2%)
> 40 jaar
> 40jr
Hoofdpijn,
hoofdpijn,
misselijk/
misselijk
heid/
overgeven, verandeovergeven,
ringen spraak, zien
veranderingen
of horen,
problemen
spraak,
zien
of horen,
met evenwicht,
problemen
met
stemmingsevenwicht,
veranderingen,
stemmingsgeheugenproblemen,
veranderingen,
gedragsproblemen,
geheugeninsult,
problemen,
tintelingen armen/
gedragsproblemen,
benen tintelingen
insult,
armen/benen
Helicobacter pylori,
voeding,
roken, overmatig
alcohol,
Helicobacter
pylori,
familiegeschiedenis,
voeding,
aanwezigheid
roken,
bepaalde
overmatig
alcohol,
adenomateuze
familiehistorie,
maagpoliepen,
aanwezigheid
bepaalde
partiële resectie
van
adenomateuze
de maag
maagpoliepen,
10%
partiële resectie van de
maag
Immuno-deficiëntie,
(auto)immuunziekte,
chronische infecties,
Immunodeficiëntie,
specifieke
(auto)
pathogenen,
immuunziekte,
blootstelling
chronische
specifieke
infecties specifieke
bestrijdingspathogenen,
middelen,
haarverf
blootstelling
specifieke
?
10%
bestrijdings­
middelen, haarverf
7%
7
10%
3
6
7
3
Overgewicht,
Roken
Erfelijkheid (2%)
7%
Doelstelling en werkwijze
Doelstelling en werkwijze
Jonge leeftijd (lymf)
Jonge leeftijd (lymf)
Vermoeidheid,
moeheid,
bleekheid,
bleekheid, of niet
terugkerende
terugkerende
of niet
genezende
infecties,
genezende
koorts
en infecties,
koorts en
nachtzweten,
nachtzweten,
snel
bloeden of
snel bloeden of
kneuzen,
kneuzen,
bot- of gewrichtspijn,
bot- of gewrichtspijn,
zwelling
tandvlees
zwelling tandvlees
Laag en hoog
geboortegewicht
Laag en hoog
geboortegewicht
7%
?
10%
?
7% (alle)
9
6
?
9
47
47
Tabel 2.4 (vervolg): Tumorsoorten die mogelijk in de toekomst verder moeten Tabel
4: Tumorsoorten
die mogelijk in de toekomst verder moeten worden ondergezocht.
worden
ondergezocht.
Kankersoort
Onderzocht
aspect vroege
ontdekking
Blaas
Mond- en keelholte
Multiple myeloom
(ziekte van Kahler)
Urine onderzoek,
NMP22
.45, .86, .11(Chou
NMP22.45,.86,.11
(Chou
and2010)
Dana 2010)
and Dana
Geen
Geen
Visuele inspectie
Geen
Maat
Beschikbare
Beschikbare
Biomarkers,
screeningstesten
screeningssensitiviteit,
methoden
specificiteit, positief
voorspellende waarde
Beeldvormende
technieken,
sensitiviteit,
specificiteit, positief
voorspellende waarde
Winst?
Detecteer­baar
baar­
Detecteer
pre­klinisch
klinisch stadium?
pre
Mogelijk wel, meerdere Mogelijk wel
veelbelovende
biomarkers
Leidt screening tot
gezondheidswinst?
Inadequate evidentie
(Force 2012)
Population-based
screening niet
kosteneffectief;
mogelijk wel in
hoogrisico groepen
(Van der Waal et al.
2011)
Geschatte verbetering
prognose na
vroegdetectiec (Van
Hees and Spijkerman
2010a)
40%
22-34%
a Symptomen die twee maanden of langer aanwezig waren bij de patiënt vóór het eerste cons ult bij de huisarts
a
(patiënt interval) (RCGP 2011).
b Ordening van lage naar hoge kans op doorverwijzing naar een specialist bij drie of meer consulten bij de huisarts
b
(Lyratzopoulos et al. 2012).
2012)
c
Geschatte verschil in 5-jaarsoverleving tussen tumoren ontdekt in stadium I-II versus stadium III-IV (Van Hees
and Spijkerman 2010a).
Bron incidentie- en survivalgegevens: KWF Kankerbestrijding en Cijfersoverkanker.nl (maart 2012); Doodsoorzaken,
CBS (2009).
Bron gegevens klachten en symptomen: Van Hees and Spijkerman, 2010.
48
50
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Nier
Maag
Non-Hodgkin
Hersenen
Acute leukemie
Geen
Potentiële
biomarkers:
serumpepsinogeen,
anti-Heliobacterpylori-antilichaam,
gastrin (Agreus et al.
2012)
Geen
Geen
Geen
Geen
Geen
Geen
Geen
Periodieke
endoscopie (Gonzalez
and Agudo 2012)
47%
41%
Vroege opsporing
d.m.v. periodieke
endoscopie leidde in
Japan tot sterke
verbetering van
5-jaarsoverleving
(96%)(Gonzalez and
Agudo 2012)
cGeschatte verschil in 5-jaarsoverleving tussen tumoren ontdekt in stadium I-II versus stadium III-IV (Van Hees
and Spijkerman 2010a).
Bron: incidentie- en survivalgegevens: KWF Kankerbestrijding en IKNL geraadpleegd maart 2012:
cijferoverkanker.nl; Doodsoorzaken, CBS (2009).
Bron: gegevens klachten en symptomen: Van Hees and Spijkerman, 2010.
Doelstelling en werkwijze
Doelstelling en werkwijze
49
51
Tabel 2.5: Tumorsoorten die buiten het kader van dit rapport vallen.
Kankersoort
Huid/melanoom
Baarmoeder
Chronische leukemie
36.000/3500
1900
950 (150 lymfatisch en
800 myeloïde)
5-jaarsoverleving
87%
79%
70%
Jaarlijkse sterfte,
gemiddeld aantal in
komende 5 jaar
(Incidentie x (1 5-jaarsoverleving)
455
399
285
10-jaarsoverleving
82%
0,76
37%
Jaarlijkse sterfte,
gemiddeld aantal in
komende 10 jaar
(Incidentie x (1 10-jaarsoverlevingl))
630
456
599
Aspect vroege
opsporing
Maat
Ernst van de
kanker
Incidentie
Klachten en
symptomen
(incl. risico­
factoren)
Delay
50
Leeftijd diagnose
30-60 jaar
55-80 jaar
> 50-60 jaar
Klachten en symptomen
Moedervlek: asymmetrisch, onregel­
matige randen,
verschillende kleuren,
veranderde vorm of
grootte
Abnormale vaginale
bloeding (zwaardere
bloeding, spotting of
vloeien buiten
menstruatie­periode, na
geslachtsgemeenschap
of na de menopauze),
veelvuldig pijn of
moeite bij het legen
van de blaas, pijn bij
het vrijen, pijn in het
bekkengebied,
overmatige afscheiding
vagina
Opgezette lymfeklieren
zonder klachten (met
name in de nek of
oksel), koorts of
nachtzweten,
regelmatige infecties,
vermoeidheid en zwak
gevoel, gebrek aan
eetlust, vol gevoel,
gewichtsverlies,
kortademigheid bij
inspanning, bleekheid,
gemakkelijk ontstaan
van bloeduitstortingen
Risicofactoren
Overmatig zonlicht
(vooral op jonge
leeftijd),
lichte huid, > 65 jaar,
atypische moedervlekken, > 50 moedervlekken
Abnormale groei van
het endometrium,
obesitas, reproductieve
en menstruatiekenmerken (menstruatie voor 12e levensjaar,
kinderloosheid, late
menopauze (> 55 jaar))
Patient;
% lange tijd met
symptomena
11%
?
7% (alle)
Doctor’s;
lager nr is langere
delayb
13
12
9
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Kankersoort
Huid/melanoom
Baarmoeder
Chronische leukemie
Biomarkers
Sensitiviteit,
specificiteit, positief
voorspellende waarde
Geen
Geen
Geen
Beeldvormende
technieken,
sensitiviteit,
specificiteit, positief
voorspellende waarde
Inspectie huid
.42, .100, .98 (Force
2009)
Echografie (dikte
endometrium), .80, .86
(Jacobs et al. 2011)
Geen
Detecteerbaar
preklinisch stadium?
Redelijk bewijs (Force
2009)
Mogelijk wel
Leidt screening tot
gezondheidswinst?
Gebrek aan studies
(Force 2009)
Geschatte verbetering
prognose na
vroegdetectiec
51%
Aspect vroege
opsporing
Maat
Beschikbare
screeningstest(en)
Winst?
54%
aSymptomen die twee maanden of langer aanwezig waren bij de patiënt vóór het eerste consult bij de huisarts
(patiënt interval) (RCGP 2011).
bOrdening van lage naar hoge kans op doorverwijzing naar een specialist bij 3 of meer consulten bij de huisarts
(Lyratzopoulos et al. 2012).
cGeschatte verschil in 5-jaarsoverleving tussen tumoren ontdekt in stadium I-II versus stadium III-IV (Van Hees
and Spijkerman, 2010a).
Bron incidentie- en overlevingsgegevens: KWF Kankerbestrijding en IKNL, geraadpleegd maart 2012:
cijferoverkanker.nl; Doodsoorzaken, CBS (2009).
Bron gegevens klachten en symptomen: Van Hees and Spijkerman, 2010.
Doelstelling en werkwijze
51
2.3
Referenties
Agreus L et al. (2012) Rationale in diagnosis and screening of atrophic gastritis with
stomach-specific plasma biomarkers. Scand J Gastroenterol 47: 136-47
Chakraborty S (2011) Current status of molecular markers for early detection of
sporadic pancreatic cancer. Biochim Biophys Acta 1815: 44-64
Chou R and Dana T (2010) Screening adults for bladder cancer: a review of the
evidence for the U.S. preventive services task force. Ann Intern Med 153: 461-8
Force USPST (2009) Screening for skin cancer: U.S. Preventive Services Task Force
recommendation statement. Ann Intern Med 150: 188-93
Force USPST (2012) Screening for bladder cancer: recommendation statement. Am
Fam Physician 85: 397-9
Gonzalez CA and Agudo A (2012) Carcinogenesis, prevention and early detection of
gastric cancer: where we are and where we should go. Int J Cancer 130: 745-53
Hirst NG et al.(2011) Is endoscopic surveillance for non-dysplastic Barrett’s
esophagus cost-effective? Review of economic evaluations. J Gastroenterol
Hepatol 26: 247-54
Jacobs I et al. (2011) Sensitivity of transvaginal ultrasound screening for endometrial
cancer in postmenopausal women: a case-control study within the UKCTOCS
cohort. Lancet Oncol 12: 38-48
Lotan Y et al. (2009) Impact of clinical factors, including a point-of-care nuclear matrix
protein-22 assay and cytology, on bladder cancer detection. BJU Int 103: 1368-74
Lyratzopoulos G et al. (2012) Variation in number of general practitioner
consultations before hospital referral for cancer: findings from the 2010
National Cancer Patient Experience Survey in England. Lancet Oncol 13: 353-65
Menon U et al. (2009) Sensitivity and specificity of multimodal and ultrasound
screening for ovarian cancer, and stage distribution of detected cancers:
results of the prevalence screen of the UK Collaborative Trial of Ovarian Cancer
Screening (UKCTOCS). Lancet Oncol 10: 327-40
RCGP (2011) National Audit of Cancer Diagnosis in Primary Care. Royal College of
General Practitioners
Stoita A et al. (2011) Review of screening for pancreatic cancer in high risk
individuals. World J Gastroenterol 17: 2365-71
Thomson CS and Forman D (2009) Cancer survival in England and the influence of
early diagnosis: what can we learn from recent EUROCARE results? Br J Cancer
101 Suppl 2: S102-9
Van der Waal I et al. (2011) Early diagnosis in primary oral cancer: is it possible? Med
Oral Patol Oral Cir Bucal 16: e300-5
Van Hees F en Spijkerman AMW (2010a) Diagnostic delay’ bij kanker en diabetes.
Een verkenning van begrippen en kennislacunes. RIVM, Bilthoven. RIVM
rapport 260221001.
Van Hees F en Spijkerman AMW (2010b) Screening naar kanker. Blaas-, maag-,
slokdarm-, en eierstokkanker. RIVM, Bilthoven. RIVM rapport 260221003.
Van Sandick JW et al. (1998) Impact of endoscopic biopsy surveillance of Barrett’s
oesophagus on pathological stage and clinical outcome of Barrett’s carcinoma.
Gut 43: 216-22
52
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
‘Door tijdige detectie en adequate
behandeling van Barrett-slokdarmpatiënten kan de incidentie van het
adenocarcinoom van de slokdarm
met tenminste 50% dalen.’
Prof. dr. Peter Siersema
3
roege ontdekking van V
adenocarcinoom van de slokdarm
3.1
Inleiding
Slokdarmkanker neemt de 8e positie in van meest voorkomende kankers over de
gehele wereld. Adenocarcinoom en plaveiselcelcarcinoom zijn de twee belangrijkste
histologische types. In West-Europa en de Verenigde Staten is de incidentie van
het adenocarcinoom vanaf de jaren zeventig verzesvoudigd (van 0,40 in 1975 naar
2,58 in 2009 per 100.000 inwoners in de VS (Hur et al. 2013)), terwijl de incidentie
van het plaveiselcelcarcinoom van de slokdarm in dezelfde periode gelijk bleef. De
incidentie van het adenocarcinoom omvat hierdoor nu in Nederland tweederde van
de slokdarmtumoren (IKNL geraadpleegd 2013; cijfersoverkanker.nl).
In Nederland staat slokdarmkanker wat betreft voorkomen op de 8e plaats bij mannen
en op de 13e plaats bij vrouwen (samen 2,5% van alle kankerdiagnoses in 2012). Door de
slechte prognose staat de slokdarmkankersterfte op de 7e plaats van alle kankersterfte
bij mannen en op de 10e plaats bij vrouwen in Nederland (CBS). Het aandeel van de
sterfte aan slokdarmkanker is 4% van de totale kankersterfte in Nederland.
Ook in Nederland is in de afgelopen 20 jaar het aantal mensen met slokdarm­
kanker gestegen, namelijk van 1.100 (1989) naar 2.463 (2012) patiënten per jaar (IKNL
geraadpleegd 2013; cijfersoverkanker.nl). Deze stijging is deels een gevolg van een
vergrijzing van de Nederlandse bevolking, maar kan niet volledig hierdoor verklaard
worden. Mogelijk wordt de stijging ook veroorzaakt door een veranderd voorkomen
van risicofactoren. Adenocarcinoom komt het vaakste voor (1.823 gevallen in 2012),
voornamelijk bij mannen (IKNL geraadpleegd 2013; cijfersoverkanker.nl).
Passageproblemen zijn vaak de eerste symptomen van slokdarmadenocarcinoom.
Doordat het adenocarcinoom het lumen van de slokdarm vernauwt, ontstaan
klachten van een gestoorde voedselpassage of pijn achter het borstbeen tijdens het
eten. Als slokdarmkanker in het onderste deel van de slokdarm zit op de overgang
naar de maag kan dit de werking van de onderste slokdarmkringspier beïnvloeden
met hikken of overmatig boeren tot gevolg. Een gezwel van de slokdarm kan gepaard
gaan met een ontsteking (zweren) en aanleiding geven tot bloedverlies. Andere
symptomen die kunnen voorkomen zijn onder meer refluxklachten, keelpijn, hese
stem, aanhoudend hoesten en gewichtsverlies.
Over het algemeen presenteren patiënten zich met uitgebreide ziekte (ingroei
in omgeving en/of metastasen) omdat de tumor relatief lang kan groeien zonder
specifieke klachten te veroorzaken. Hierdoor wordt het adenocarcinoom vaak laat
gediagnosticeerd en is behandeling gericht op genezing zelden mogelijk. Ongeveer
30 tot 40% van alle patiënten komt in aanmerking voor een operatie of andere
behandeling met uitzicht op genezing. Ten tijde van de diagnose is bij ca. 60% van
de patiënten sprake van een niet te genezen ziekte. Slechts 15% van de patiënten is
na 5 jaar nog in leven. Vroege vormen van slokdarmkanker (beperkt tot de meest
oppervlakkige lagen van de slokdarmwand zonder uitzaaiingen in lymfklieren) zijn
tevens vaak asymptomatisch en wordt meestal bij toeval gediagnosticeerd of tijdens
Vroege ontdekking van adenocarcinoom van de slokdarm
55
Wekelijkse GERDsymptomen 2.6M
(20% van
Gehele Nederlandse
Nederlandse
bevolking > 20 jaar
bevolking > 20 jaar)
13 M in 2013
Diagnose Barrett-slokdarm
prevalentie
35.000-55.000
Jaarlijks 135 nieuwe
adenocarcinomen met
diagnose Barrett-slokdarm
Niet gediagnosticeerde
Barrett-slokdarm
prevalentie 95.000-205.000
Jaarlijks 1.665 nieuwe
adenocarcinomen zonder
diagnose Barrett-slokdarm
Totale Barrett-slokdarm
prevalentie in de bevolking:
geschat op 130.000-260.000
(1%-2%); jaarlijks 2500
nieuwe Barrett-slokdarm
diagnoses
Totale slokdarm
adenocarcinoom
prevalentie in de
bevolking: 3.000
(0,023%)
Figuur 3.1: Geschatte prevalentie van Barrett-slokdarm en slokdarmadenocarcinoom
in Nederland.
Bron: Populatie: CBS 2013; Barrett-slokdarmdiagnoses: Post et al. 2007, de Jonge et al., 2010; Barrett-slokdarm
prevalentie: Gilbert et al. 2011, experts uit de begeleidingsgroep slokdarmkanker; Adenocarcinomen bij
gediagnosticeerde Barrett-slokdarm patiënten: Hvid-Jensen et al. 2011; Totaal adenocarcinomen, 5-jaarsprevalentie
2012: cijfersoverkanker.nl; GERD: Gastro-oesofageale refluxziekte
een scopie voor bovenbuikklachten of zuurbranden. De prognose van deze laatste
groep is uitstekend na veelal endoscopische behandeling.
Het adenocarcinoom ontstaat uit cilindrisch epitheel (onderste gedeelte van
de slokdarm) en het plaveiselcarcinoom uit plaveiselcellen (vooral bovenin de
slokdarm). Hoewel beide typen een slechte prognose hebben, richt dit hoofdstuk
zich op het adenocarcinoom, de meest voorkomende en snelst toenemende vorm
van slokdarmkanker in Nederland. Een ander type adenocarcinoom dat veel op het
adenocarcinoom van de slokdarm lijkt, is het adenocarcinoom van de cardia, een
tumor op de overgang van de slokdarm in de maag. In dit hoofdstuk wordt dit type
kanker niet besproken.
Een Barrett-slokdarm, waarbij het normale plaveiselepitheel van de slokdarm
vervangen is door cilinderepitheel met intestinale metaplasie, is het enige bekende
voorstadium van het adenocarcinoom (Dias Pereira et al. 2007). Een Barrett-slokdarm
of Barrett’s esophagus (BE) is het gevolg van langdurige gastro-oesofageale reflux
56
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
(gastroesophageal reflux disease: GERD). Bij deze aandoening vloeit het maagzuur
terug in de slokdarm. De belangrijkste symptomen van GERD zijn brandend maagzuur
en zure oprispingen. De prevalentie van Barrett-slokdarm in de algemene bevolking
wordt geschat tussen 1,6% en 6,8% (Gilbert et al. 2011). Om vroege stadia van
adenocarcinoom te kunnen ontdekken ten behoeve van tijdige behandeling, wordt in
alle internationale richtlijnen surveillance-endoscopie van Barrett-slokdarmpatiënten
geadviseerd (Wang et al. 2008b), hoewel er nog geen bewijs is dat surveillance tot
sterftedaling leidt. De Nederlandse richtlijn is nog in ontwikkeling, maar lijkt dit
advies te volgen. De jaarlijkse incidentie van het slokdarmadenocarcinoom bij Barrettslokdarm wordt geschat op 0,5% (Dias Pereira et al. 2007). Er zijn zelfs studies die
wijzen op een nog lagere incidentie, namelijk 0,12-0,14% (Bhat et al. 2011; De Jonge et
al. 2010; Kaneshiro et al. 2011). Door de lage incidentie van kanker bij patiënten met
Barrett-slokdarm en de hoge kosten van surveillance is het de vraag of surveillance van
Barrett-slokdarmpatiënten kosteneffectief is.
Momenteel wordt slechts een klein deel van de adenocarcinomen ontdekt in een
Barrett-slokdarm surveillanceprogramma (ca. 7,6% van alle adenocarcinomen)
(Kaneshiro et al. 2011). Het overgrote deel van adenocarcinomen wordt dus
gediagnosticeerd als de kanker al ver ontwikkeld is. Aan de andere kant, lang niet
alle patiënten met een Barrett-slokdarm ontwikkelen adenocarcinoom (6 –11% van de
patiënten bij wie Barrett-slokdarm is gediagnosticeerd (Den Hoed et al. 2011; Hage et
al. 2004). Er is daarom behoefte aan risicostratificatie bij Barrett-slokdarmpatiënten
om daarmee de kosteneffectiviteit van surveillance bij Barrett-slokdarm te
verhogen. Ook is de vraag of adenocarcinoom van de slokdarm, indien er geen sprake
is van gediagnosticeerde Barrett-slokdarm, eerder ontdekt kan worden.
Leeswijzer hoofdstuk
Dit hoofdstuk is als volgt opgebouwd: Allereerst wordt de huidige kennis m.b.t.
het ontstaan en de ontwikkeling van slokdarmkanker beschreven. Aan de hand van
een casus worden de dilemma’s m.b.t. de vroegdiagnostiek van deze tumorsoort
geïllustreerd. Vervolgens wordt op basis van een analyse van gegevens uit de
Nederlandse Kankerregistratie (NKR) specifiek ingegaan op het voorkomen van de
tumorsoort en wordt het stadium bij diagnose in relatie tot zowel behandelings­
mogelijkheden als overleving gepresenteerd. Deze inleidende paragrafen (paragraaf
1 t/m 5) onderstrepen het belang van het ontdekken van deze tumorsoorten in een
eerder stadium. Indien men uitsluitend geïnteresseerd is in de stand van zaken van
de wetenschappelijke kennis en klinische praktijk van vroege ontdekking bij het
adenocarcinoom van de slokdarm, is het tweede deel van dit hoofdstuk relevant (vanaf
paragraaf 6). Hierin wordt het resultaat van de analyse van verschillende aspecten van
vroege ontdekking (risicofactoren, klachten en symptomen, terugdringen van patient
en doctor’s delay, screening en surveillance en de mogelijke gezondheidswinst na
vroege ontdekking) beschreven en een kort (niet uitputtend) overzicht van voor dit
rapport relevante lopende (inter)nationale projecten gepresenteerd. Het hoofdstuk
sluit af met een paragraaf met conclusies en aanbevelingen (paragraaf 8).
Hierin wordt ingegaan op de implicaties voor de klinische praktijk en voor onderzoek,
maar ook op de knelpunten en kansen t.a.v. vroege ontdekking bij deze tumorsoort.
Het hoofdstuk wordt afgesloten met tumorspecifieke aanbevelingen.
Vroege ontdekking van adenocarcinoom van de slokdarm
57
3.2
Ontstaan en ontwikkeling van
slokdarmkanker
3.2.1
Barrett-slokdarm
Bij een Barrett-slokdarm, het voorstadium van adenocarcinoom van de slokdarm,
is het normale plaveiselcelepitheel van het slijmvlies van de slokdarm veranderd
in afwijkend cilindrisch epitheel, meestal in het onderste deel van de slokdarm
dichtbij de maag (de gastro-oesofageale overgang). Dit wordt veroorzaakt
door overmatige blootstelling aan maagzuur. Histologisch worden drie typen
metaplastisch cilindrisch epitheel onderscheiden: maagfundustype, maagcardiatype
en intestinale type metaplasie. Men gaat er van uit dat alleen dit laatste type kan
ontaarden in maligne afwijkingen. Recent is er meer opheldering ontstaan over het
mechanisme dat ten grondslag ligt aan de ontwikkeling van een Barrett-slokdarm
naar een adenocarcinoom (Prasad et al. 2010). Er is sprake van een multifactorieel
proces. Naast bovengenoemde histologische veranderingen (dysplasie), spelen
chromosomale afwijkingen, genetische en epigenetische veranderingen een rol.
Figuur 3.2: Barrett-slokdarm met leasie
3.2.2
58
Adenocarcinoom
De ontwikkeling van adenocarcinoom vanuit een Barrett-slokdarm is een
stapsgewijs proces dat naar men aanneemt volgens een vast patroon verloopt,
namelijk achtereenvolgens van geen dysplasie, via laaggradige dysplasie naar
hooggradige dysplasie en tenslotte slokdarmadenocarcinoom (Prasad et al. 2010).
Het risico op de ontwikkeling van maligniteit in Barrett-slokdarm neemt toe met de
toename van dysplasiegraad.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Of er sprake is van toenemende dysplasie wordt echter niet altijd gezien. Verklaring
hiervoor is variabiliteit in pathologische interpretatie van de biopten en sampling
error. Variabiliteit in pathologische interpretatie komt doordat dysplastisch weefsel
endoscopisch niet of nauwelijks te onderscheiden is van normaal cilinderepitheel en
doordat de histologische gradering van de ernst van de dysplasie onderhevig is aan
een hoge mate van subjectiviteit (Kruyt et al. 1997). Daarnaast komt sampling error bij
het nemen van biopten nog steeds voor, waardoor de kans bestaat dat (pre)maligne
weefsel bij het nemen van biopten wordt gemist.
3.3
Casuïstiek van een patiënt
Onderstaande casussen illustreren dat het adenocarcinoom van de slokdarm vaak
laat klachten geeft en niet eenvoudig te diagnosticeren is.
Casus 1
Een 64-jarige man heeft sedert een aantal weken last van een gestoorde voedselpassage. Bij het eten
van vast voedsel heeft hij het gevoel dat het blijft hangen ter hoogte van het borstbeen; dit geeft een
oncomfortabel, enigszins pijnlijke sensatie. Hij is de laatste 2 maanden ca. 5 kilogram afgevallen.
Hij heeft momenteel geen andere klachten. Hij was een roker tot vijftien jaar geleden. Alcohol
gebruikt hij sporadisch. Patiënt heeft een hoge bloeddruk en gestoord lipidenspectrum waarvoor hij
medicijnen slikt. Slokdarmkanker komt niet in zijn familie voor. Bij lichamelijk onderzoek is er sprake
van enige centrale adipositas (BMI van 29). Bij bloedonderzoek zijn er geen afwijkingen gevonden.
Bij gastroscopie is een circulair groeiende tumor zichtbaar in het onderste deel van de slokdarm net
voor de maagingang. Microscopische beoordeling van de afgenomen biopten laat het beeld zien van
klierbuisvormende, kwaadaardige cellen (adenocarcinoom). Patiënt wordt geïnformeerd over de
diagnose en er worden nieuwe onderzoeken ingepland om het stadium van de ziekte vast te stellen.
Het behandelplan wordt opgesteld na overleg in het multidisciplinair team.
Casus 2
Een 41-jarige, gezonde man heeft al ruim 10 jaar last van zuurbranden waarvoor hij zuurremmende
medicijnen gebruikt. De laatste 2 jaar lijken de klachten minder geworden te zijn, maar hij wordt
(mede op verzoek van patiënt) door de huisarts verwezen naar het ziekenhuis voor een gastroscopie.
De man wil graag weten of een operatie voor het maagzuur zinvol is, want hij wil niet levenslang
medicijnen slikken. De MDL-arts in het ziekenhuis verricht een gastroscopie en ziet het typisch beeld
van een zogenaamde Barrett-slokdarm. Het slijmvlies van het onderste deel van de slokdarm heeft
over een afstand van ca. 3 cm een afwijkend aspect (lang segment). Het is zalmroze in plaats van
parelmoer-grijs. Er worden biopten afgenomen van het hele traject en in het bijzonder van enkele
verhevenheden. De patholoog belt de MDL-arts en zegt dat er sprake is van hooggradige dysplasie.
Het betreft dus een voorstadium van slokdarmkanker. Een nieuwe scopie wordt verricht en het
verdachte slijmvlies wordt endoscopisch verwijderd, een zogenaamde endomucosale resectie. De
patholoog beoordeelt het weefsel en de uitslag luidt: carcinoom zich beperkend tot de mucosa, de
oppervlakkige laag van het slijmvlies. De patiënt wordt besproken in het wekelijkse multidisciplinair
overleg en de consensus is dat het veilig is om het resterende traject van de Barrett te behandelen in
de vorm van ablatie. Een slokdarmoperatie is niet geïndiceerd. Patiënt zal onder controle blijven van
de MDL-arts en wordt geadviseerd om zuurremmende medicijnen te blijven gebruiken.
Vroege ontdekking van adenocarcinoom van de slokdarm
59
3.4
Vóórkomen van Barrett-slokdarm en
slokdarmkanker
3.4.1
Vóórkomen van slokdarmkanker
De kans op het krijgen van slokdarmkanker voor de leeftijd van 65 jaar is in de
algemene Nederlandse populatie 0,5% en 1,2% voor de leeftijd van 80 jaar (IKNL
geraadpleegd 2013; cijfersoverkanker.nl).
Slokdarmkanker komt vaker voor bij mannen. De mediane en gemiddelde leeftijd
bij diagnose ligt rond de 68 jaar en 30% van de patiënten is ten tijde van de diagnose
75 jaar of ouder. Het overgrote deel (71%) van de tumoren bevindt zich in de distale
(onderste deel) slokdarm en dit aandeel is in de afgelopen 10 jaar licht gestegen. In
tweederde van de gevallen van slokdarmkanker is er sprake van een adenocarcinoom
en dit aandeel is in de afgelopen 10 jaar groter geworden (tabel 3.1).
Tabel 3.1: Patiënt- en tumorkenmerken van patiënten met slokdarmcarcinoom, naar periode.
Totaal 2002-2005
2002-2011 N (%) N (%)
2006-2009
N (%)
2010-2011
N (%)
Aantal patiënten in deze periode
Gemiddeld aantal patiënten per jaar
16586
1659
5846
1462
7016
1754
3724
1862
Geslacht
Man
Vrouw
12068 (73)
4518 (27)
4216 (72)
1630 (28)
5121 (73)
1895 (27)
2731 (73)
993 (27)
Leeftijd
18-60 jaar
60-74 jaar
≥ 75 jaar
4216 (25)
7332 (44)
5038 (30)
1633 (28)
2409 (41)
1804 (31)
1699 (24)
3191 (45)
2126 (30)
884 (24)
1732 (47)
1108 (30)
Sublocalisatie*
Proximale slokdarm
Distale slokdarm
Overlappend/onbekend
3848 (23)
11694 (71)
1044 (6)
1455 (25)
4035 (69)
356 (6)
1606 (23)
4974 (71)
436 (6)
787 (21)
2685 (72)
252 (7)
Histologie
Adenocarcinoom
Plaveiselcelcarcinoom
Overig/ongespecificeerd
10292 (62)
5390 (33)
904 (5)
3490 (60)
2035 (35)
321 (5)
4380 (62)
2231 (32)
405 (6)
2422 (65)
1124 (30)
178 (5)
p-waarde
0,36
<0,001
0,001
<0,001
* Proximale slokdarm: cervicale slokdarm, bovenste 1/3 deel van de slokdarm en middelste 1/3 deel van de slokdarm.
Bron: IKNL© 2013.
3.4.2
60
Vóórkomen van Barrett-slokdarm
Er zijn verschillende schattingen voor de prevalentie van Barrett-slokdarm in de
algemene bevolking. Omdat niet alle mensen met een Barrett-slokdarm symptomen
hebben is een groot deel van de patiënten met deze aandoening onbekend. Een
plausibele schatting van de prevalentie van Barrett-slokdarm is 1 tot 2% van de
volwassen bevolking. Het aantal Barrett-slokdarmdiagnoses is gestegen in de
afgelopen jaren. Nederlandse studies geven aan dat het aantal diagnoses bij mannen
met 41% steeg tussen 1992 en 2003 (Post et al. 2007). Gecorrigeerd voor het aantal
endoscopische onderzoeken rapporteerde Van Soest et al. (2005) een stijging van 19,8
in 1997 naar 40,5 diagnoses in 2002 per 1.000 endoscopieën. Recenter onderzoek in
Verenigd Koninkrijk suggereert dat deze stijging tot 2003 significant was, maar dat
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
100
90
80
70
60
50
40
30
20
10
0
100
90
80
percentage
70
60
50
40
30
20
10
0
’02-’05
’06-’09
’10-’11
adenocarcinoom
’02-’05
’06-’09
’10-’11
plaveiselcelcarcinoom
stadium:
I
IV
II
onbekend
III
Figuur 3.3: Stadiumverdeling naar periode en histologie.
het aantal Barrett-slokdarmdiagnoses tussen 2003 en 2012 gelijk bleef (UEGW 2013
Abstract, G.W.Masclee). Verklaringen voor de stijging van Barrett-slokdarm diagnoses
in de populatie is de verandering van de definitie van Barrett-slokdarm rond de jaren
90, waardoor korte Barrett-slokdarmsegmenten opgenomen werden in de definitie.
Daarnaast wordt er een steeds groter deel van de endoscopieën uitgevoerd vanwege
GERD-symptomen, wat de kans op het vinden van Barrett-slokdarm vergroot.
3.5
Stadiumverdeling bij diagnose in relatie
tot behandeling en overleving
3.5.1
Stadium en diagnostiek
In figuur 3.3 is de verdeling van patiënten naar klinisch TNM-stadium (voor deze
indeling zie Appendix 2.2) weergegeven. Uit deze figuur blijkt dat het aandeel
patiënten dat gediagnosticeerd is in stadium II is toegenomen tussen 2002 en
2009. Dit lijkt in de laatste periode weer te zijn afgenomen, maar dit wordt (deels)
verklaard door de wijziging van de TNM-stadiumindeling (volgens TNM 7 worden
patiënten met een T2N0M0-tumor geclassificeerd als stadium I, terwijl zij eerder
als stadium IIA werden geclassificeerd). Wanneer de TNM-7-definitie voor stadiumI-tumoren wordt toegepast op de gehele periode, blijkt dat het aandeel stadium-Ipatiënten juist licht is toegenomen van 7% in 2002 naar 10% in 2011.
Het aandeel stadium-III-tumoren is lager en het aandeel stadium-IV-tumoren is
Vroege ontdekking van adenocarcinoom van de slokdarm
61
hoger voor patiënten met adenocarcinoom vergeleken met plaveiselcelcarcinoom.
Deze trend in stadiumverdeling door de jaren heen is voor beide tumortypen
ongewijzigd. Het slokdarmadenocarcinoom wordt dus vaker in stadium IV dan in één
van de eerdere stadia ontdekt.
3.5.2
Stadium en behandeling
Patiënten met stadium-I-slokdarmkanker worden in toenemende mate lokaal
behandeld (27% in 2010-2011, figuur 3.4 en 3.5). Deze lokale behandeling betreft
voornamelijk tumorresecties (bijv. endoscopische mucosale resectie (EMR),
endoscopische submucosale dissectie (ESD) of - in mindere mate - een vorm van
tumordestructie (bijv. laser of radiofrequente ablatie (RFA)). Een combinatie van
behandelingen komt ook voor. Mucosale tumoren zonder metastasering (T1aN0M0
volgens TNM 7) zijn geschikt voor endoscopische therapie. Van de patiënten die
op deze manier lokaal behandeld worden, ondergaat 15% na de lokale behandeling
toch nog een slokdarmresectie vanwege een hogere stadiëring door endoscopische
resectie.
Patiënten met een T1-3N0-3M0-slokdarmcarcinoom (dit betreft TNM-7-stadium I-,
II- en een deel van de stadium-III-patiënten) komen in principe in aanmerking voor
een in opzet curatieve resectie. Echter, niet alle patiënten ondergaan daadwerkelijk
een resectie, onder andere door comorbiditeit of een slechte fysieke gesteldheid.
100
90
80
percentage
70
60
50
40
30
20
10
0
I
II
III
IV
onbekend
stadium
alleen lokale behandeling
chemo- en/of radiotherapie
resectie
geen/overig
neoadjuvante c(r)t + resectie
Figuur 3.4: Behandeling van patiënten met slokdarmcarcinoom, naar TNM-7-stadium, in de periode 2010-2011.
62
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
100
90
80
70
60
50
40
30
100
90
80
percentage
70
60
50
40
30
20
10
0
’02-’05
’06-’09
’10-’11
’02-’05
stadium I/II
’06-’09
’10-’11
stadium III/IV
alleen lokale behandeling
neoadjuvante c(r)t + resectie
resectie al dan niet
chemo- en/of radiotherapie
na lokale behandeling.
geen/overig
100
90
80
70
60
50
40
30
20
10
0
Figuur 3.5: Behandeling van patiënten met slokdarmcarcinoom in de tijd, naar TNM-stadium, in de periode 2002-2011.
Patiënten met stadium I-II ondergingen veel vaker een resectie dan patiënten in
stadium III-IV (figuur 3.5).
3.5.3
Slokdarmkanker en overleving
Een jaar na diagnose is iets minder dan de helft van alle patiënten met slokdarm­
kanker nog in leven (44%, tabel 3.2). Specifiek voor adenocarcinoom is 46% een jaar
na diagnose nog in leven. Na 5 jaar is slechts 1 op de 8 adenocarcinoompatiënten
nog in leven (13%) (IKNL, geraadpleegd 2013; cijfersoverkanker.nl). De relatieve
5-jaarsoverleving van patiënten met slokdarmkanker (benadering van de ziekte­
specifieke overleving) is in ca. 20 jaar weliswaar gestegen van 10% (1989-1994) naar
17% (2006-2010), maar is nog steeds laag.
Tabel 3.2 laat zien dat de overleving is toegenomen in de periode 2002-2011. Oudere
patiënten (75 jaar of ouder) en patiënten met een hoog stadium van slokdarmkanker
hebben een beduidend slechtere (absolute) overleving.
Patiënten met een adenocarcinoom hebben een iets betere overleving in vergelijking
met patiënten met een plaveiselcelcarcinoom. Ondanks een curatieve intentie van
behandelmogelijkheden voor patiënten met stadium -I-slokdarmadenocarcinoom is
de 5-jaarsoverleving maar 59%.
Vroege ontdekking van adenocarcinoom van de slokdarm
63
Tabel 3.2: 1-, 3-, en 5-jaarsoverleving (%) van patiënten met
slokdarmcarcinoom naar stadium, periode, leeftijd en histologie.
N
1-jaar (%)
3-jaar (%)
Stadium
AC, PC, Ov
16586
44
19
5-jaar (%)
14
Alle
AC
10292
46
21
15
Alle
PC
5390
41
18
13
Alle
Ov
904
28
10
7
I
AC, PC, Ov
817
83
61
54
II
AC, PC, Ov
2472
70
37
26
III
AC, PC, Ov
3429
56
25
18
IV
AC, PC, Ov
5965
22
4
3
Onbekend
AC, PC, Ov
3903
41
18
13
I
AC
622
86
67
59
II
AC
1631
73
39
27
III
AC
1817
62
28
20
IV
AC
3887
22
4
3
Onbekend
AC
2335
46
20
13
2002-2005
AC, PC, Ov
5846
40
16
11
2006-2009
AC, PC, Ov
7016
45
20
15
2010-2011
AC, PC, Ov
3724
49
-
-
< 60 jaar
AC, PC, Ov
4216
53
26
20
60-74 jaar
AC, PC, Ov
7332
47
22
16
≥ 75 jaar
AC, PC, Ov
5038
32
9
6
AC = adenocarcinoom, PC = plaveiselcelcarcinoom, Ov = overig/ongespecificeerd.
Bron: IKNL© 2013.
Barrett-slokdarm en overleving
Hoewel het risico bij een Barrett-slokdarm om te sterven aan slokdarmkanker
verhoogd is ten opzichte van de algemene bevolking, blijkt uit epidemiologisch
onderzoek dat slechts 4,7% van de Barrett-slokdarmpatiënten sterft als gevolg van
slokdarmkanker (Richtlijn Barrett’s Oesophagus Nederlands, In Progress, 2013). Dit
kan verklaard worden uit het kleine percentage patiënten met Barrett-slokdarm dat
gedurende hun leven en adenocarcinoom van de slokdarm ontwikkelt.
3.6
Stand van zaken m.b.t. verschillende
invalshoeken van vroege ontdekking
In totaal werden op basis van de zoektermen gebaseerd op de onderzoeksvragen
(zie hoofdstuk 2) 1.307 artikelen in de systematische literatuurstudie gevonden
(vanaf 2002 tot 2013), waarvan 197 artikelen beoordeeld werden (Appendix 3).
Uiteindelijk bleken 58 artikelen empirische studies te betreffen (waarvan sommige
meta-analyses van oorspronkelijke studies) die van toepassing waren op onze 4
vraagstellingen.
Dit hoofdstuk richt zich op adenocarcinoom van de slokdarm. In verband met de
leesbaarheid zal veelal de aanduiding ‘slokdarmkanker’ gebruikt worden.
64
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
3.6.1
Risicofactoren
In deze paragraaf komen eerst de risicofactoren voor het ontwikkelen van Barrettslokdarm en slokdarmkanker aan de orde. Daarna worden de risicofactoren voor het
ontwikkelen van slokdarmkanker vanuit Barrett-slokdarm besproken.
3.6.1.1
Risicofactoren voor de ontwikkeling van Barrett-slokdarm en slokdarmkanker
De risicofactoren voor Barrett-slokdarm zijn alleen onderzocht in symptomatische
populaties (tabel 3.3), namelijk bij personen met GERD en personen met oesophagitis
(ontsteking van de slokdarm). De aanwezigheid van bepaalde genvariaties
(polymorfismen) van interleukine-1-cytokines vormde zowel voor Barrett-slokdarm
als slokdarmkanker een hoog risico (tabel 3.3 en 3.4). Kanttekening is dat niet
gecorrigeerd was voor leeftijd, geslacht, etniciteit en andere factoren, waardoor
het verband sterker of zwakker kan lijken dan het in werkelijk is. De aanwezigheid
van de betreffende genetische polymorfismes bleek in een Nederlandse studie niet
geassocieerd te zijn met Barrett-slokdarm of slokdarmkanker, terwijl een ander
cytokinepolymorfisme dat wel was, namelijk IL-10 1082 genotype 2/2 (Moons et
al. 2005). De auteurs concluderen dat identificatie van cytokinepolymorfismen
bruikbaar kan zijn voor de surveillance van Barrett-slokdarm patiënten en inzicht
kan geven in het ontstaan van slokdarmkanker bij Barrett-slokdarmpatiënten.
Mannen en personen waarbij de verhouding tussen taille- en heupomvang is
verhoogd hebben een matig verhoogd risico op Barrett-slokdarm (tabel 3.3).
Over het algemeen waren de associaties met Barrett-slokdarm sterker naarmate het
Barrett-segment van de slokdarm langer was.
Tabel 3.3: Risicofactoren voor de ontwikkeling van Barrett-slokdarm.
Referentiegroep
Uitkomst
OR (95% BI)
Studie
Demografische factoren
Mannelijk geslacht
Leeftijd
GERD
SSBO
2,7 (1,6 – 4,5)1
Edelstein et al. (2009)
GERD
LSBO
3,9 (1,9 – 8,1)1
Edelstein et al. (2009)
1,6)1
Edelstein et al. (2009)
GERD
SSBO
1,4 (1,1 –
GERD
LSBO
1,5 (1,2 – 1,9)1
Edelstein et al. (2009)
GERD
SSBO
1,9 (1,0 – 3,5)1
Edelstein et al. (2009)
GERD
LSBO
4,1 (1,5 – 11,4)1
Edelstein et al. (2009)
IL-1 Ra + 2018 genotype 2/2 met ≥ 1
kopie van allel 2 -in IL-1β 511
Oesophagitis
BO ND
9,5 (1,19-75,93)2
Gough et al. (2005)
IL-1 Ra + 2018 genotype 2/2
Oesophagitis
BO ND
3,04 (0,81-11,47)2
Gough et al. (2005)
IL-1 Ra + 2018 genotype 2/2
Oesophagitis
BO
1,2 (0,9-1,7)
Moons et al. (2005)
IL-10 1082 genotype 2/2
Oesophagitis
BO ND
1,84 (1,04-3,28)2
Gough et al. (2005)
Leefstijlfactoren
Verhoogde taille: heupverhouding*
Genetische en moleculaire factoren
1
Gecorrigeerd voor confounding factoren (w.o. leeftijd, geslacht).
2 Niet gecorrigeerd voor confounding factoren, hierdoor kan de OR hoger of lager zijn dan die in werkelijkheid is.
* Definitie verhoogde taille: heupverhouding mannen ≥ 0.9, vrouwen ≥ 0.8.
Odds ratio > 5 betekent een relevant risico.
Oesophagitis: ontsteking van de slokdarm.
GERD = gastro-oesofageale refluxziekte, SSBO = short segment Barrett oesophagus, LSBO = long segment Barrett
oesophagus, BO = Barrett oesophagus, ND = non-dysplastic, OR = odds ratio.
Vroege ontdekking van adenocarcinoom van de slokdarm
65
In een aantal studies waren de risicofactoren op het ontwikkelen van een Barrettslokdarm en slokdarmkanker onderzocht zonder onderscheid te maken tussen het
ontwikkelen van Barrett-slokdarm of slokdarmkanker (tabel 3.4).
Naast de hiervoor genoemde aanwezigheid van bepaalde genvariaties, laten deze
studies ook hier zien dat mannen een verhoogd risico op Barrett-slokdarm en
slokdarm­k anker hebben. Een minder sterk verband is te zien voor de overige factoren
(tabel 3.4). Deze studies hadden niet gecorrigeerd voor andere factoren, waardoor
het verband sterker of zwakker kan lijken dan het in werkelijk is.
Weer andere studies onderzochten alleen de risicofactoren voor het ontwikkelen
van slokdarmkanker, ongeacht of een Barrett-slokdarm was gediagnosticeerd.
De belangrijkste risicofactoren voor het ontwikkelen van slokdarmkanker zijn
iemands familiegeschiedenis en, specifiek bij rokers, de aanwezigheid van bepaalde
Tabel 3.4: Risicofactoren voor de ontwikkeling van Barrett-slokdarm en
slokdarmkanker samen (als uitkomstmaat).
Referentiegroep
Uitkomst
OR (95% BI)
Opmerking
Studie
Mannelijk geslacht
Asymptomatisch
& symptomatisch
GERD
BO en AC
6,56 (3,46-12,44)
Crude
Nason et al. (2011)
Blank ras
Asymptomatisch
& symptomatisch
GERD
BO en AC
3,36 (1,03-10,95)
Crude
Nason et al. (2011)
Leeftijd
Asymptomatisch
& symptomatisch
GERD
BO en AC
1,03 (1,02-1,05)
Crude
Nason et al. (2011)
Gebruik van
proton­pomp­­remmers
(PPI)
Asymptomatisch
& symptomatisch
GERD
BO en AC
2,41 (1,55-3,72)
Crude
Nason et al. (2011)
Middenrifbreuk
(hiatushernia)
Asymptomatisch
& symptomatisch
GERD
BO en AC
3,36 (2,36-5,57)
Crude
Nason et al. (2011)
BO LGD, HGD
en AC
6,29 (0,75-52,89)
Crude
Gough et al. (2005)
BO en AC
7,89 (1,03-60,30)
Crude
BO LGD, HGD
en AC
3,7 (1,02-13,61)
Crude
Demografische factoren
Klinische factoren
Genetische en moleculaire factoren
IL-1 Ra +2018 genotype 2/2 Oesophagitis
met ≥ 1 kopie van
allel 2 -in IL-1β 511
Oesophagitis
IL-1 Ra +2018 genotype 2/2 Oesophagitis
IL-10 1082 genotype 2/2
Oesophagitis
BO en AC
3,4 (0,99-11,56)
Crude
Oesophagitis
BO LGD, HGD
en AC
2,05 (1,15-3,62)
Crude
Oesophagitis
BO en AC
1,94(1,16-3,25)
Crude
Gough et al. (2005)
Gough et al. (2005)
Crude ratio: in deze studie is niet gecorrigeerd voor confounding factoren, hierdoor kan de OR hoger of lager zijn dan
die in werkelijkheid is.
Oesophagitis: ontsteking van de slokdarm.
BO = Barrett oesophagus, AC = adenocarcinoom, LGD = laaggradige dysplasie, HGD = hooggradige dysplasie,
OR = odds ratio.
66
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 3.5: Risicofactoren voor de ontwikkeling van slokdarmadenocarcinoom.
Referentiegroep
Uitkomst
OR (95% BI)1
Familiegeschiedenis
GERD-populatie
AC
12,23 (3,34-44,76) Chak et al. (2002)
Genetische polymorfismen:
Actieve GSTM1 in rokers
Actieve GSTT1 in rokers
Asymptomatisch &
symptomatisch GERD
AC
Studie
Genetische factoren
Casson et al. (2005)
7,9 (1,14-54,76)
3,2 (1,23-8,35)
Demografische factoren
Mannelijk geslacht
GERD-populatie
AC
1,74 (1,10-2,75)
Chak et al. (2002)
Leeftijd
GERD-populatie
AC
1,05 (1,02-1,09)
Chak et al. (2002)
Leefstijlfactoren
Alcoholconsumptie
GERD-populatie
AC
1,72 (1,09-2,69)
Chak et al. (2002)
Obesitas (10 jaar geleden)
GERD-populatie
AC
3,32 (1,37-8,05)
Chak et al. (2002)
Roken*
Asymptomatische
populatie
AC
1,75 (1,29-2,38)
Pandeya et al. (2008)
Roken
Asymptomatisch &
symptomatisch GERD
AC
3,44 (1,30-9,08)
Casson et al. (2006)
Roken: duur (per 10 jaar)
Asymptomatische
populatie
AC
1,20 (1,06-1,36)
Pandeya et al.( 2008)
Roken: pakjaren ( > 30)
Asymptomatisch &
symptomatisch GERD
AC
6,11 (2,2-17,32)
Casson et al. (2006)
Roken*: tijd sinds stoppen (per 10 jaar)
Asymptomatische
populatie
AC
0,82 (0,71-0,94)
Pandeya et al. (2008)
1
Gecorrigeerd voor confounding factoren (waaronder leeftijd en geslacht).
* Bij rokengerelateerde risicofactoren is de odds ratio berekend voor rokers ten opzichte van nooit-rokers.
GERD = gastro-oesofageale refluxziekte; AC = adenocarcinoom , OR = odds ratio.
genetische polymorfismen (tabel 3.5). Ook roken an sich geeft een verhoogd risico,
voornamelijk het aantal pakjaren dat iemand rookt of heeft gerookt. Iedere 10 jaar
dat iemand is gestopt met roken lijkt het risico op slokdarmkanker te verlagen.
Daarnaast geven obesitas, mannelijk geslacht, alcoholconsumptie en leeftijd een
verhoogd risico op slokdarmkanker, zij het minder sterk dan roken (tabel 3.5).
3.6.1.2
isicofactoren voor het ontwikkelen van slokdarmkanker vanuit R
Barrett-slokdarm
Voor de stand van zaken van de kennis over de voorspellende waarde van factoren
voor de ontwikkeling van slokdarmkanker vanuit Barrett-slokdarm is gebruik
gemaakt van grootschalige cohortstudies en twee reviews (Prasad et al. 2010; Wang
and Canto 2010).
Demografische, leefstijl- en klinische factoren
Endoscopisch zichtbare laesies en dysplasie hebben een voorspellende waarde
voor de ontwikkeling van hooggradige dysplasie en slokdarmkanker bij Barrettslokdarmpatiënten, zoals bleek uit een aantal grootschalige prospectieve
cohortstudies (tabel 3.6 en 3.7). Ook de lengte van het Barrett-slokdarmsegment,
oesophagitis en lengte van hiatus hernia lijken deze ontwikkeling te kunnen
voorspellen. Factoren waarvoor wisselende resultaten werden gerapporteerd of
waarvoor het verrichte onderzoek nog onvoldoende was waren: mannelijk geslacht,
Vroege ontdekking van adenocarcinoom van de slokdarm
67
leeftijd, overgewicht, roken en refluxsymptomen. Alcohol en Helicobacter pylori
(H.Pylori) blijken geen voorspellende waarde te hebben. Volgens een Nederlandse
studie (Sikkema et al. 2011) zijn de aanwezigheid van dysplasie, de lengte van het
Barrett-slokdarmsegment en oesophagitis de drie belangrijkste factoren voor de
voorspelling van maligne ontwikkeling vanuit een Barrett-slokdarm.
Tabel 3.6: Geschat risico van de ontwikkeling van slokdarmkanker vanuit Barrettslokdarm en de mate van dysplasie.
Karakteristiek van Barrett-slokdarm Meta-analyses
Populatiegebaseerde studies
Jaarlijkse kans op AC (range)
Jaarlijkse kans op
Jaarlijkse kans op HGD of AC* (range) OAC (range)
Totaal
0,41-0,7%
0,9-1,2%
Zonder dysplasie
0,33-0,60%
Met laaggradige dysplasie (LGD)
1,7%
Met hooggradige dysplasie (HGD)
6,6%
0,12-0,14%
* Dit cijfer is de jaarlijkse kans van iemand met een Barrett-slokdarm op het ontwikkelen van hooggradige dysplasie
of slokdarmkanker.
AC = oesophagus adenocarcinoom, HGD = hooggradige dysplasie.
Bron: De Jonge et al. (2013).
Tabel 3.7: Overzicht van de voorspellende waarde van demografische en klinische
factoren op progressie naar EAC bij Barrett-slokdarmpatiënten.
Risicofactor
Uitkomst
OR (95% BI)1
Studie #
Progressie naar HGD/AC
-
Rugge et al. (2012)
Progressie naar HGD/AC
1,1 (0,4 - 3,3)
Sikkema et al. (2011)
Progressie naar HGD/AC
-
Rugge et al. (2012)
Progressie naar HGD/AC
0,99 (0,96 - 1,04)
Sikkema et al. (2011)
Rugge et al. (2012)
Demografische factoren
Mannelijk geslacht
Leeftijd
Klinische factoren
Endoscopisch zichtbare afwijking
Progressie naar HGD/AC
7,70 (2,63 - 21,98)
Progressie naar HGD/AC
2,0 (0,6 - 6,6)
Sikkema et al. (2011)
Dysplasiegradering LGD
Progressie naar HGD/AC
3,74(1,22 - 11,43)
Rugge et al. (2012)
Progressie naar HGD/AC
9,7 (4,4 - 21,5)
Sikkema et al. (2011)
Dysplasiegradering SIM^
Progressie naar AC/GCC
3,54, (2,09 - 6,0)
Bhat et al. (2011)
Rugge et al. (2012)
Lengte van BO-segment
Oesophagitis
1Gecorrigeerd
Progressie naar HGD/AC
1,16 (1,03 - 1,30)
Progressie naar HGD/AC
1,11 (1,01 - 1,2)
Sikkema et al. (2011)
Progressie naar HGD/AC
3,5 (1,3 - 9,5)
Sikkema et al. (2011)
voor confounding factoren (waaronder leeftijd en geslacht).
^SIM = Specialized Intestinal Metaplasia. In de meeste landen (Nederland, Verenigde Staten ) is het vinden van SIM
een vereiste voor de diagnose van Barrett-slokdarm, in het Verenigd Koninkrijk is dit echter niet het geval.
#Tabel bevat enkel de gevonden prospectieve cohortstudies met een cohort groter dan 700 patiënten.
Odds ratio > 5 betekent een relevant risico.
AC = adenocarcinoom, GCC = gastric cardia carcinoom (cardia maagkanker), LGD = laaggradige dysplasie,
HGD = hooggradige dysplasie, BO = Barrett oesophagus, OR = odds ratio.
68
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Genetische factoren
Een aantal moleculaire biomarkers blijken goede voorspellers te zijn voor de
ontwikkeling van maligniteit bij Barrett-slokdarmpatiënten (Wang 2010). Op dit
moment bevinden markers voor chromosomale abnormaliteiten zoals aneuploïdie
en tetraploïde, p53 LOH, p53 overexpressie (hoewel met wisselende resultaten)
en leukocyttelomeerlengte zich in fase-4-onderzoek, de laatste fase voordat
de biomarkers uiteindelijk getest kunnen worden in klinisch gerandomiseerd
onderzoek. In fase-4-biomarkeronderzoek worden de functionele eigenschappen van
de biomarker-screeningstest onderzocht in de relevante populatie, waaronder de
detectierate, het stadium waarin de kanker kan worden ontdekt door de biomarker
en het aantal valspositieven (Pepe et al. 2001).
Andere biomarkers bevinden zich in fase-3-onderzoek en zijn mogelijk voorspellend
voor de ontwikkeling van maligniteit. In fase-3-onderzoek vindt evaluatie plaats
van het vermogen van de biomarker om preklinische stadia te ontdekken en worden
criteria vastgesteld voor een ongunstige testuitslag (Pepe et al. 2001). Het gaat hier om
methylatie van verschillende genen, waarvan de methylatie van p16 het meest bekend
is. Methylatie kan er toe leiden dat genen die betrokken zijn bij het onderdrukken
van tumoren niet tot expressie komen. Andere genen die door methylatie maligne
ontwikkeling lijken te voorspellen zijn RUNX3, HPP1, APC, TIMP3 en TERT (Wang and
Canto 2010). Methylatie van de biomarkercombinatie p16, RUNX3, HPP1, NELL1, TAC1,
SST, AKAP12 en CDH13 kon de helft van de Barrett-slokdarmpatiënten die maligne
ontwikkeling vertoonden, ontdekken, bij een 90% specificiteit (Jin et al. 2009).
Ook proliferatiemarkers, zoals Cyclin A en Mcm2, lijken een voorspellende waarde
voor maligne ontwikkeling te hebben. Ook deze markers moeten verder worden
onderzocht in fase-3-studies (Wang 2010).
De voorspelling van maligne ontwikkeling vanuit Barrett-slokdarm is dus voor geen
van de bovengenoemde factoren (alleen of in combinatie) nog gevalideerd. Dat
betekent dat de bruikbaarheid van een test op basis van deze biomarkers nog moet
worden vastgesteld in verder onderzoek.
Beide reviews concluderen dat het niet aannemelijk is dat een individuele factor
(demografisch, leefstijl-, klinisch) voldoende voorspellende waarde heeft en dat
daarom inspanningen gericht moeten zijn op de ontwikkeling van een risicoscore
gebaseerd op een combinatie van verschillende factoren (Prasad et al. 2010; Wang
and Canto 2010). Voor de ontwikkeling van een dergelijke risicoscore is echter
grootschalig prospectief onderzoek nodig. Omdat het aantal patiënten met
progressie naar hooggradige dysplasie of slokdarmadenocarcinoom echter klein
is, moet voor het verkrijgen van voldoende grote aantallen dergelijk onderzoek
vermoedelijk op basis van multicenter samenwerkingsverbanden gebeuren (Prasad
et al. 2010). Vervolgens is gerandomiseerd onderzoek nodig om vast te stellen of
identificatie van hoogrisico-individuen op basis van een dergelijke risicoscore leidt
tot eerdere behandeling en sterftereductie (fase-5-onderzoek).
3.6.2
1
Klachten en symptomen
De vraag is of er specifieke klachten en/of symptomen zijn die kunnen wijzen op
slokdarmkanker in een vroeg stadium. In de literatuur gaan de meeste studies uit
van een bewezen associatie tussen gastro-oesofageale reflux (GERD)-symptomen1
Onder GERD klachten/symptomen wordt verstaan: zuur oprisping en/of brandend maagzuur
Vroege ontdekking van adenocarcinoom van de slokdarm
69
Tabel 3.8: GERD-symptomen en de associatie met slokdarmkanker.
Frequentie
OR (95% BI)
Dagelijks (vs. < wekelijks of geen) GERD-symptomen
7,40 (4,94 –11,10)
Wekelijks (vs. minder of geen) GERD-symptomen
4,92 (3,90 –6,22)
Duur
OR (95% BI)
> 20 jaar GERD-symptomen (vs. geen)
5,41 (2,45 –11,90)
< 10-15 jaar GERD -symptomen (vs. geen)
3,05 (1,51–6,08)
OR = odds ratio, BI = betrouwbaarheidsinterval.
Bron: Rubenstein and Taylor, 2010.
en slokdarmkanker (Lagergren et al. 1999). In de studies die we vonden was het
onderzoek vooral gericht op de associatie tussen slokdarmkanker en de duur,
frequentie en de aard van de aanwezige GERD-klachten. In een meta-analyse (met
een totaal cohort van 5.855 patiënten) was het risico op slokdarmkanker significant
hoger bij een hoge frequentie en langere duur van GERD-symptomen (tabel 3.8)
(Rubenstein and Taylor 2010).
In een prospectieve cohort studie (Hippisley-Cox and Coupland 2011) werd een
algoritme ontwikkeld op basis van klachten, symptomen en risicofactoren
(leeftijd, rookstatus en de symptomen slikstoornis (dysfagie), bloedbraken
(haematemesis), buikpijn, verlies van eetlust, gewichtsverlies en anemie) om
te voorspellen welke personen een hoog risico hebben op gastro-oesofageale
kanker (maag- en slokdarmkanker) in de komende twee jaar. Dit algoritme werd
onderzocht en gevalideerd onder meer dan 1,2 miljoen asymptomatische patiënten
uit huisartsenpraktijken. De toepassing van het algoritme, bij 10% verwijzingen
voor nader onderzoek, leidde tot een sensitiviteit van 77%, specificiteit van 91%, en
PVW van 1,2%. Dit betekent dat er veel personen een foutpositieve uitslag kregen,
waardoor een groot aantal individuen onnodig diagnostisch onderzoek moesten
ondergaan. Ook inclusie van de veel voorkomende GERD-symptomen in het algoritme
leidde niet tot verbetering van de positief voorspellende waarde (Hippisley-Cox en
Coupland 2011; 2012a; b). Bovendien waren er geen gegevens over het stadium van
slokdarmkanker beschikbaar. Het is dus niet duidelijk of met dit algoritme ook vroege
stadia kunnen worden ontdekt. Omdat het zeer aannemelijk is dat factoren als
passageklachten (dysfagie), gewichtsverlies en bloedbraken late symptomen zijn, is
het onwaarschijnlijk dat het algoritme tot vroegere detectie leidt.
70
Conclusies
•Familiegeschiedenis, mannelijk geslacht, roken en de duur (> 10 jaar) en
frequentie (dagelijks tot wekelijks) van GERD-symptomen verhogen het risico op
slokdarmkanker.
•De belangrijkste hoogrisicogroep vormen de Barrett-slokdarmpatiënten.
Daarnaast zijn mogelijk hoogrisicogroepen aan te wijzen op basis van een
combinatie van risicofactoren, bijvoorbeeld bij ouderen mannen met GERDsymptomen en familiegeschiedenis.
•Bij familiegeschiedenis en oudere mannen met GERD-symptomen kan worden
besloten om de patiënt te onderzoeken op Barrett-slokdarm.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
•Prospectief onderzoek is nodig om te bepalen of screening op bepaalde
polymorfismen bij refluxpatiënten die roken en/of oesophagitis hebben een
voorspellende waarde heeft voor het vinden van slokdarmkanker in een vroeg
stadium.
•Laaggradige dysplasie, endoscopisch zichtbare afwijkingen (nodulariteit), de
lengte van het Barrett-segment en oesophagitis zijn risicofactoren die kunnen
bijdragen aan de voorspelling van de ontwikkeling naar hooggradige dysplasie en
slokdarmkanker bij Barrett-slokdarmpatiënten.
•Het is aangetoond dat een aantal moleculaire biomarkers, zoals chromosomale
abnormaliteiten, p53 LOH en leukocyttelomeerlengte een hoge voorspellende
waarde voor de ontwikkeling naar hooggradige dysplasie en slokdarmkanker bij
Barrett-slokdarmpatiënten hebben. Deze worden momenteel verder onderzocht
in fase-4-onderzoek.
•Geen van de van de tot nu toe bestudeerde biomarkers voor de voorspelling van
maligne ontwikkeling vanuit Barrett-slokdarm hebben alle noodzakelijke fases
van onderzoek al doorlopen. Dat betekent dat de bruikbaarheid van een test op
basis van deze biomarkers nog moet worden vastgesteld in verder onderzoek.
•Voor de ontwikkeling van een risicoscore gebaseerd op een combinatie van
factoren, zoals een set van biomarkers, demografische, klinische en mogelijk
andere factoren, is grootschalig prospectief onderzoek nodig.
•Vroege ontdekking van slokdarmkanker aan de hand van klachten, symptomen
en risicofactoren is vrijwel niet mogelijk. Toepassing van een algoritme op
basis hiervan in een huisartspatiëntenpopulatie leidt tot veel foutpositieven,
waardoor een groot aantal individuen onnodig diagnostisch onderzoek moet
ondergaan. Verschillende klachten en symptomen, zoals passageklachten,
gewichtsverlies en bloedbraken treden pas op in een laat stadium.
3.6.3
Patient en doctor’s delay
In de literatuur is weinig gepubliceerd over patient en doctor’s delay met betrekking
tot de diagnose slokdarmkanker. Van de 4 gevonden studies was er slechts 1 een
prospectieve studie met een steekproef groter dan 100 patiënten. De kleinere studies
waren bovendien retrospectief van opzet. In deze studies is onderzocht:
•Tijdsduur van eerste symptomen tot aan behandeling (T1-T4)
•Tijdsduur eerste symptomen tot aan de definitieve diagnose (T1-T3)
De geschatte mediane tijd van eerste symptomen tot aan behandeling (T1-T4)
varieerde tussen 15-20 weken. De geschatte mediane tijd tussen eerste symptomen
tot aan de definitieve diagnose (T1-T3) varieerde in de studies tussen de 6-17 weken.
De hogere schattingen zijn afkomstig van de grootste studie en kunnen als het
betrouwbaarst worden beschouwd (Grotenhuis et al. 2010).
Het effect van de tijdsduur op de stadiumverdeling is in twee studies onderzocht
(Martin et al. 1997; Wang et al. 2008a). Zowel voor de tijdsduur T1-T4 (eerste
symptomen en behandeling) als tijdsduur T1-T3 (eerste symptomen en diagnose)
werd een significante langere duur gevonden bij patiënten met een laat stadium
(III of IV) ten opzichte van patiënten met vroeg stadium (I of II). Belangrijk is echter
om na te gaan of een langere tijdsduur effect heeft op de overleving. Dit was in deze
studies niet onderzocht.
Het effect van de tijdsduur op de overleving was wel in de grotere studie onderzocht
(Grotenhuis et al. 2010). Het bleek dat een termijn van 3 maanden of langer
Vroege ontdekking van adenocarcinoom van de slokdarm
71
tussen eerste symptomen en diagnose geen significant effect had op de (overall)
5-jaarsoverleving. De lengte van de tijdsduur tussen diagnose en behandeling had
eveneens geen significant effect op de 5-jaarsoverleving.
Conclusies
•De lengte van de tijdsduur tussen eerste symptomen en behandeling lijkt geen
effect te hebben op de overleving van slokdarmkanker, maar deze bevinding
is gebaseerd op slechts één studie. Het huidige gepubliceerde onderzoek is
onvoldoende om definitieve conclusies te trekken over het mogelijke effect van
diagnostic delay op de stadiumverdeling en overleving.
•Aangezien de specifieke symptomen van slokdarmkanker geassocieerd zijn met
een vergevorderd stadium van het adenocarcinoom lijkt de winst die te behalen
is door verkorting van patient en/of doctor’s delay gering. Echter, alertheid bij
symptomen blijft van belang.
3.6.4
Screening en surveillance
Vroege ontdekking van slokdarmkanker gebeurt momenteel door patiënten
met een Barrett-slokdarm op te nemen in een surveillanceprogramma met als
doel patiënten met premaligne afwijkingen in een vroeg stadium te behandelen.
Dysplasiegradering bij Barrett-slokdarmpatiënten is de meest gebruikte marker
voor ontwikkeling naar hooggradige dysplasie en slokdarmkanker. Bij hooggradige
dysplasie kan er radiofrequentie ablatie of endoscopische therapie worden
toegepast. Bij stadium I zijn mucosale tumoren zonder metastasering geschikt voor
endoscopische therapie. Deze aandoeningen vormen de target voor surveillance.
Momenteel wordt er in Nederland niet gescreend op Barrett-slokdarm in de
algemene populatie, maar worden sommige patiënten met refluxsymptomen
en/of verdenking van Barrett-slokdarm doorverwezen naar de MDL-arts. Op dit
moment worden de meeste Barrett-slokdarmpatiënten tussen hun 60ste en 65ste
gediagnosticeerd. Mogelijk levert de set van biomarkers die mogelijk voortkomt
uit lopend onderzoek naar risicostratificatie bij Barrett-slokdarmsurveillance een
zinvolle screeningstest op. Bij voorkeur als deze op een niet-endoscopische wijze
kan worden toegepast, bijvoorbeeld met een bloedtest, een spons, een camerapil of
andere vorm van niet-invasieve beeldvorming.
3.6.4.1
Screening op Barrett-slokdarm
Er wordt momenteel geen screening op Barrett-slokdarm uitgevoerd in de algemene
populatie. De huidige methode voor het diagnosticeren van een Barrett-slokdarm
is endoscopie. Bij verdenking van Barrett-slokdarm worden biopten genomen voor
histologische confirmatie. Deze methode leent zich minder goed voor grootschalige
toepassing in de algemene populatie, omdat deze vrij belastend is voor de patiënt.
Ook is endoscopisch onderzoek duur, vooral als ook nog histologisch onderzoek van
biopten wordt verricht.
De afgelopen jaren zijn er nieuwe diagnostische methoden ontwikkeld die goedkoper,
patiëntvriendelijker en gemakkelijker uit te voeren zijn. Zo hoeft met ultrathin endoscopie en string-capsule endoscopie (camerapil) geen sedatie te worden gebruikt. Een
niet-endoscopische methode voor de diagnose van Barrett-slokdarm is de cytosponge.
Met de cytosponge kan biomarkermateriaal worden verzameld. De patiënt slikt een
sponsje verbonden aan een draad in. Na een paar minuten kan het sponsje worden
verwijderd en wordt deze geanalyseerd op de aanwezigheid van Barrett-slokdarm.
72
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Deze nieuwe methoden zijn ook goedkoper dan standaard endoscopie.
Er waren twee studies die het diagnostisch vermogen van deze nieuwe methoden
onderzochten. Eén hiervan was een prospectieve studie waarin het diagnostisch
vermogen van de cytosponge was onderzocht onder 504 huisartspatiënten die (meer
dan drie maanden) zuurremmers waren voorgeschreven. Voor het diagnosticeren
van Barrett-slokdarm (bij Barrett-segment van 1 cm of meer) bleek de cytosponge
een sensitiviteit van 73,3%, specificiteit van 93,8% en een positief voorspellende
waarde van 26,8% te hebben, bij het gebruik van gastroscopie als referentiecriterium
(gouden standaard) (Kadri et al. 2010). Ramirez et al. (2008) onderzochten het
diagnostisch vermogen van de string-capsule bij 100 refluxpatiënten die in verband
met hun klachten waren verwezen voor een endoscopie. Bij gebruik van histologie
als referentiecriterium was de sensitiviteit van de string-capsule endoscopie hoger
dan die van standaard endoscopie (93,5% vs. 87,1%), evenals de specificiteit (78,7% vs.
68,9%). De resultaten van beide studies zijn veelbelovend, maar moeten bevestigd
worden in grotere cohorten.
3.6.4.2
Surveillance van Barrett-slokdarmpatiënten
De vraag is of surveillance van Barrett-slokdarmpatiënten er toe leidt dat deelnemers
aan een surveillanceprogramma een grotere kans op overleving hebben dan Barrettslokdarmpatiënten die niet in surveillanceprogramma zijn opgenomen.
Drie cohortstudies, waarvan slechts één grootschalige, lijken aanwijzingen te
geven dat surveillance van Barrett-slokdarm gezondheidswinst oplevert (Cooper
et al. 2009; Ferguson and Durkin 2002; Roberts et al. 2010) (tabel 3.9). Twee
hiervan hebben onderzocht in welke mate surveillance/vroegere ontdekking
Tabel 3.9: Studies naar het effect op de overleving van surveillance van Barrett-slokdarmpatiënten.
Studie
Doelgroep
Inclusie
Surveillance­
methode
Aantal
deel­
nemers
Overleving
HGD/slokdarmkanker in
surveillance
Overleving
HGD/slokdarmkanker buiten
surveillance
Prospectief
cohort,
Roberts 2010
Barrett- slokdarm
patiënten met
metaplasie
1994-2001
Jaarlijkse
endoscopie met
quadrantic
biopsies per 2 cm
302
50% (overall
5-jaarsover­
leving)
2,7% (overall
5-jaarsover­
leving)
1994-2002
Endoscopie
gehad (3 jaar tot
6 maanden vóór
de diagnose
slokdarmkanker)
2754
Endoscopie was geassocieerd
met langere
mediane
overlevingsduur
(in maanden)
(HR 0,66;
95% BI 0,47-0,99)
80
84% (overall
5-jaarsover­
leving)
Retrospectief Nieuw gediagnosticohort,
ceerde patiënten
Cooper 2009 met slokdarmkanker
> 68 jaar
Retrospectief
cohort,
Ferguson
2001
Barrett-slokdarm
1980-2000 ≥ 4 maanden
onder endoscopipatiënten die
resectie ondergingen
sche surveillance
wegens slokdarmvoor Barrettkanker
slokdarm (ten
tijde van
diagnose
slokdarmkanker)
19% (overall
5-jaarsover­
leving)
HR = hazard ratio, BI = betrouwbaarheidsinterval.
Vroege ontdekking van adenocarcinoom van de slokdarm
73
Tabel 3.10: Modelleerstudies van screening op Barrett-slokdarm (na de diagnose
Barrett-slokdarm kwamen patiënten in een surveillanceprogramma).
Studie
Doelgroep
Screenings­­methode
Surveillance­methode
Rubenstein and
Inadomi (2006)
50-jarige
kaukasische
mannen met
GERD
a) Geen screening
b) Eénmalige endoscopie
a) Geen surveillance
b) ND elke 3 jaar, LGD elke 6 maanden, HGD elke 3 maanden
Gupta et al. (2011)
50-jarige
mannen die
colonoscopie
screening
ondergingen
a) Geen screening
b) Eénmalige endoscopie
c) Eénmalige endoscopie
d) Eénmalige endoscopie
a) Geen surveillance
b) Geen surveillance
c) ND elke 3 jaar, LGD elk jaar, HGD
elke 3 maanden
d) N
D elke 3 jaar, LGD elk jaar, HGD
elke 3 maanden
Inadomi et al.
(2003)
50-jarige blanke
mannen met
GERD
a) Geen screening
b) Eénmalige endoscopie
c) Eénmalige endoscopie
a) Geen surveillance
b) ND geen surveillance, LGD elke 6
maanden, HGD elke 3 maanden
c) ND surveillance elke 5 jaar, LGD
elke 6 maanden, HGD elke 3
maanden
Sonnenberg et al.
(2002)
60-jarige
Barrett-slokdarm
patiënten
Benaglia et al.
(2013)
50-jarige
kaukasische
mannen met
GERD
a) Geen screening
b) Eénmalige endoscopie
c) Eénmalige cytosponge
a) Geen surveillance
b) ND elke 3 jaar, LGD elke 6
maanden, HGD ET
c) ND elke 3 jaar, LGD elke 6 maanden, HGD ET
Nietert et al.
(2003)
50-jarige
kaukasische
mannen met
GERD
a) Geen screening
b) Eénmalige standaard endoscopie
c) Eénmalige ultrathin endoscopie
a) G
een surveillance
b) ND, LGD elke 2 jaar, HGD
slokdarmresectie
c) ND, LGD elke 2 jaar, HGD
slokdarmresectie
*
a) G
een surveillance
b) Alle BE elke 2 jaar
Vergeleken met geen screening en geen surveillance.
** Surveillance van enkel dysplastische BO patiënten vergeleken met geen screening en geen surveillance.
van voorstadia van HGD/slokdarmkanker, een significante voorspeller is voor
een grotere overlevingskans ten opzichte van maligne diagnose bij de eerste
endoscopie. In beide studies blijkt dat Barrett-slokdarmdiagnose ruim voor de HGD/
slokdarmadenocarcinoomdiagnose een significante voorspeller is voor verbetering
van de overlevingskans. Geen van deze studies had echter een gerandomiseerd
design waarbij een goed vergelijkbare controlegroep wordt gehanteerd, waardoor
de effectiviteit van screening en/of surveillance van Barrett-slokdarm in termen van
daling van morbiditeit en mortaliteit niet onomstotelijk kon worden aangetoond.
3.6.4.3
74
Kosteneffectiviteit
In hoeverre screening op Barrett-slokdarm gevolgd door surveillance bij ontdekking
van een Barrett-slokdarm kosteneffectief is, was onderzocht in zes modelleerstudies
(tabel 3.10). Ten opzichte van geen screening leverde gebruik van standaard
endoscopie meer quality adjusted life years (QALY) op (Gupta et al. 2011; Inadomi et
al. 2003; Rubenstein and Inadomi 2006; Sonnenberg et al. 2002). Dit betekent dat
met dergelijke screening gezondheidswinst kan worden behaald. Deze studie
wees echter uit dat screening met standaard endoscopie wel gepaard gaat met
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Opmerking
QALYs
Gemiddelde kosten per patiënt ICER/QALY
a) 16,466
b) 16,637
a) $ 104
b) $ 2443
a) b) $ 13.721*
c) Deel volgt surveillancerichtlijnen,
deel van HGD/mucosal AC
patienten krijgt ET
d) I edereen volgt surveillancerichtlijnen, alle HGD/mucosal AC
patienten krijgen ET
a) 18,0789
b) 18,0828
c) 18,0839
d) 18,0849
a) $ 479,90
b) $ 933,40
c) $ 960,70
d) $ 957,00
a) b) $ 115.664*
c) $ 95.559*
d) $ 79.882*
c) ND surveillance: meerdere
scenario’s zijn beschikbaar
a) 16,466
b) 16,624
c) 16,624
a) $ 104
b) $ 1748
c) $ 2053
a) b) $ 10.440**
c) $ 12.336*
-
a) $ 7829
b) $ 12257
a) –
b) $ 16.965*/UALY
a) 17,964
b) 17,977
c) 17,979
a) $ 132
b) $ 431
c) $ 373
a) –
b) $ 22.167*
c) $ 15.724*
a) 19,3266
b) 19,3329
c) 19,3366
a) $ 11785
b) $ 12332
c) $ 12119
a) –
b) $ 86.833*
c) $ 55.764*
ICER = incremental cost-effectiveness ratio, QALY = quality adjusted life year, UALY = unadjusted life years,
GERD = gastro-oesofageale refluxziekte, ND = niet dysplastische Barrett-slokdarm, LGD = laaggradige dysplasie,
HGD = hooggradige dysplasia, ET = endotherapie, AC = adenocarinoom.
hogere kosten ten opzichte van geen screening. Betere uitvoering van de richtlijnen
met betrekking tot de surveillance-intervallen en het verhogen van het aantal
endotherapieën bij patiënten met hooggradige dysplasie kan leiden tot gunstigere
kosten (Gupta et al. 2011). Surveillance van patiënten zonder dysplasie leverde geen
extra QALY’s op ten opzichte van surveillance van patiënten met dysplasie (Inadomi
et al. 2003). Ook is surveillance beperkt tot dysplastische patiënten kosteneffectiever
dan surveillance bij alle Barrett-slokdarmpatiënten. Ook de review van Hirst et
al. (2011) concludeert dat het niet waarschijnlijk is dat surveillance van Barrettslokdarmpatiënten zonder dysplasie kosteneffectief is. Screening met de cytosponge
resulteerde in een hoger aantal QALY’s in combinatie met lagere kosten ten opzichte
van de standaard endoscopie (Benaglia et al. 2013). De cytosponge is daarmee
kosteneffectiever dan standaard endoscopie. Nietert et al. (2003) evalueerde het
gebruik van de ultrathin endoscopie ten opzichte van de standaard endoscopie. Het
bleek dat ook ultrathin endoscopie kosteneffectiever is dan standaard endoscopie.
In deze kostenevaluaties van verschillende screening- en surveillancescenario’s
van Barrett-slokdarm valt op dat de incremental cost-effectiveness ratios (ICER) sterk
Vroege ontdekking van adenocarcinoom van de slokdarm
75
uiteenlopen. Elk model is uiteraard afhankelijk van bepaalde aannames voor de
invoerwaarden. De grote verschillen in ICERs kunnen verklaard worden uit de
verschillende strategieën voor het surveillanceprogramma dat na de screening
wordt ingezet. Daarnaast is ook het moment van behandeling en soort behandeling
van grote invloed. In Nietert et al. (2003) wordt bijvoorbeeld een slokdarmresectie
toegepast bij hooggradige dysplasie en slokdarmkanker, terwijl hooggradige
dysplasie in andere modellen met recentere, goedkopere en minder invasieve
methoden wordt behandeld of zelfs helemaal niet wordt behandeld.
De kosteneffectiviteit van de screening gevolgd door surveillance bleek het meest
beïnvloedbaar door de parameter voor de kans op slokdarmadenocarcinoom in
Barrett-slokdarm, terwijl de schatting hiervoor zeer onzeker is. De effectiviteit van
een screening- en surveillanceprogramma kan te gunstig uitpakken als het aantal
slokdarmtumoren dat zich bij Barrett-slokdarmpatiënten zal ontwikkelen te groot
wordt ingeschat.
Conclusies
•Gezondheidswinst, dat wil zeggen sterftereductie en betere kwaliteit van
leven, door vroege opsporing van slokdarmkanker middels surveillance van
Barrett-slokdarmpatiënten lijkt mogelijk. Maar voor definitieve conclusies is
gerandomiseerd onderzoek nodig. Alle internationale richtlijnen adviseren
echter endoscopische surveillance van Barrett-slokdarmpatiënten.
•Uit modelleerstudies blijkt dat de aantallen levensjaren, aangepast voor kwaliteit
van leven, in scenario’s met screening en/of surveillance groter zijn dan in scenario’s
zonder screening of surveillance. De kans op progressie van Barrett-slokdarm naar
HGD/slokdarmadenocarcinoom is een bepalende factor voor de kosteneffectiviteit.
Surveillance van Barrett-slokdarmpatiënten met dysplasie is meer kosteneffectief
dan surveillance van Barrett-slokdarmpatiënten zonder dysplasie. Risicostratificatie
naar dysplasiegraad is daarom een mogelijke oplossing.
•String-capsule endoscopie en de cytosponge zijn mogelijk een alternatief voor
standaard endoscopie voor screening op Barrett-slokdarm
•Momenteel is er onvoldoende bewijs voor het nut van endoscopische screening
op Barrett-slokdarm op populatieniveau.
3.7
Wat zit er in de pijplijn?
De belangrijkste Nederlandse prospectieve studie, uitgevoerd door het
ErasmusMC en AMC, is gericht op het gebruik van de FISH-test (Fluorescentie-InSitu-Hybridisatie) en cytologieborstels (oesophageal brushes) ten behoeve van
betere risicostratificatie en identificatie van patiënten met de hoogste kans op
kwaadaardige veranderingen van de slokdarm. In het UMC Utrecht start binnenkort
een multicenter prospectief onderzoek naar de potentie van een panel van
microRNA’s in bloed voor de detectie van Barrett-slokdarm.
Tabel 3.11 geeft de voor dit rapport relevante internationale lopende onderzoeken
weer. Nederlandse cohorten zijn aangesloten bij de internationale initiatieven. Het
ErasmusMC, het AMC en het UMC Utrecht leveren een van de grootste bijdragen aan
patiëntgegevens aan het Esophageal Adenocarcinoma Genetics Consortium (o.l.v.
prof. Janusz Jankowski, Oxford) in het Verenigd Koninkrijk.
76
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 3.11: Lopende internationale initiatieven.
Onderzocht aspect
Initiatief(nemer)
Doel
Aanvullende informatie
Risicofactoren voor
de ontwikkeling van
slokdarmkanker
vanuit Barrettslokdarm
Fitzgerald, RC; UK
Relatie tussen Barretts
metaplasie en carcino­genese;
identificeren van
hoogrisicogroepen voor de
ontwikkeling van AC (met
nieuwe screenings­methode op
basis van biomarkers) en
inzicht in de moleculaire
pathogenese van AC
Trial
Screening met de
cytosponge
BEST2,
http://public.ukcrn.org.
uk/search/StudyDetail.
aspx?StudyID=9461
Vaststellen of een nieuwe
methode, nl. de cytosponge
gekoppeld aan een moleculaire
test, een geschikt alternatief
biedt voor het ontdekken van
Barrett-slokdarm in de
algemene populatie
500-700 cases and
500-700 controls
Studieduur; 3 jaar in 4
ziekenhuizen (UK) met
expertise m.b.t. Barrettslokdarm
Surveillance van
Barrettslokdarmpatiënten
BOSS studie (Barrett’s
Oesophagus Surveillance
Study), Barr, H; UK
Effectiviteit van surveillance
RCT; Randomisatie van 2500
van Barrett-slokdarmpatiënten Barrett-slokdarmpatiënten
onder surveillance die elke 2
jaar een endoscopie
ondergaan
http://www.erasmusmc.nl/
gastrolab/areas/oesophagus/
Chemopreventie
ASPECT; Jankowski, J; UK
Fase 3 studie, RCT van aspirine
en esoprazole chemopreventie
bij Barretts metaplasie
Deze loopt nog 4-5 jaar. Zie:
http://www.octo-oxford.org.
uk/alltrials/infollowup/
aspect.html
AC= adenocarcinoom van de slokdarm.
3.8
Conclusies, implicaties voor praktijk en
onderzoek, en aanbevelingen
3.8.1
Conclusie m.b.t. vroege ontdekking
Klachten en symptomen
•Vroege ontdekking aan de hand van (combinaties van) klachten en symptomen
is vrijwel niet mogelijk. Verschillende klachten en symptomen, zoals passage­
klachten, gewichtsverlies en bloedbraken treden pas op in een laat stadium. De
frequentie en duur van gastro-oesofageale refluxsymptomen verhogen het risico
op slokdarmkanker, maar de bruikbaarheid voor vroege ontdekking is laag omdat
deze symptomen vaak voorkomen.
Risicofactoren voor slokdarmkanker
•Patiënten met een Barrett-slokdarmdiagnose hebben een verhoogd risico op
slokdarmkanker, evenals individuen met slokdarmkanker in de familie en mensen
met overgewicht. Ook rokers en mannen lopen meer risico op slokdarmkanker.
•De aanwezigheid van genetische polymorfismen bij rokers, namelijk actieve
GSTM1 en GSTT1, lijken eveneens het risico op slokdarmkanker sterker te verhogen.
Vroege ontdekking van adenocarcinoom van de slokdarm
77
Risicofactoren voor Barrett-slokdarm
•Mannen en personen met een verhoogde taille-heupverhouding hebben een
matig verhoogd risico op het ontwikkelen van Barrett-slokdarm, maar de
bruikbaarheid van deze risicofactoren voor vroege ontdekking van Barrettslokdarm lijkt niet hoog.
Risicofactoren bij Barrett-slokdarmpatiënten
•De aanwezigheid van dysplasie, endoscopisch zichtbare afwijkingen, oesophagitis
en een (langere) lengte van het Barrett-slokdarmsegment zijn voorspellend voor
de ontwikkeling van slokdarmkanker bij Barrett-slokdarm­patiënten en mogelijk
bruikbaar voor risicostratificatie binnen Barrett-slokdarm­patiënten.
•Er zijn aanwijzingen dat een aantal moleculaire biomarkers (waaronder
chromosomale abnormaliteit, p53 LOH en leukocyttelomeerlengte) een
voorspellende waarde hebben voor de ontwikkeling van slokdarmkanker bij
Barrett-slokdarmpatiënten. Deze biomarkers zijn daarom mogelijk bruikbaar
voor risicostratificatie.
Delay
•Er is te weinig onderzoek beschikbaar om antwoord te geven op de vraag of
een vertraging in de diagnosestelling leidt tot een slechtere prognose van
slokdarmkanker. Specifieke symptomen van slokdarmkanker zijn waarschijnlijk
geassocieerd met een vergevorderd stadium, waardoor de gezondheidswinst
die te behalen is door verkorting van delay (de tijd tussen mogelijk klachten en
symptomen en onderzoek en diagnose) mogelijk gering is.
Screening en surveillance
Screening
•Er zijn geen bruikbare biomarkers voor het ontdekken van Barrett-slokdarm of
slokdarmkanker in de algemene populatie.
•Er is onvoldoende bewijs voor de effectiviteit van endoscopische screening
op Barrett-slokdarm in de algemene populatie, dat wil zeggen of dergelijke
screening leidt tot een reductie van de sterfte.
•De kosteneffectiviteit van screening op Barrett-slokdarm van 50-jarige mannen
met gastro-oesofageale refluxsymptomen (gevolgd door surveillance na
ontdekking van Barrett-slokdarm) is alleen in modelleerstudies onderzocht. Uit
deze modelleerstudies blijkt dat er meer levensjaren, aangepast voor kwaliteit
van leven (quality adjusted life-years), worden gewonnen in scenario’s met
screening en/of surveillance dan in scenario’s zonder screening of surveillance.
•String-capsule endoscopie, ultrathin endoscopie en de cytosponge zijn mogelijk
alternatieven voor de huidige conventionele endoscopie voor screening op
Barrett-slokdarm bij refluxpatiënten.
Surveillance
•Gezondheidswinst door vroege opsporing van slokdarmkanker lijkt mogelijk,
door middel van surveillance van Barrett-slokdarmpatiënten. Echter, voor
definitieve conclusies is gerandomiseerd onderzoek nodig. Internationale
richtlijnen adviseren op dit moment al endoscopische surveillance van Barrettslokdarmpatiënten.
78
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
ffect van screening en/of surveillance op sterfte reductie en/of verbeterde
E
overleving
•De kans op progressie van Barrett-slokdarm naar hooggradige dysplasie of
slokdarm­­kanker is een bepalende factor voor de kosteneffectiviteit van surveillance. Surveillance van Barrett-slokdarm patiënten met dysplasie is meer kosteneffectief dan surveillance van Barrett-slokdarmpatiënten zonder dysplasie.
3.8.2
Implicaties voor de praktijk
•Er is behoefte aan om het enige bekende voorstadium van slokdarmkanker,
Barrett-slokdarm, beter te kunnen diagnosticeren, maar er zijn hiervoor nog
weinig mogelijkheden op basis van risicofactoren en klachten en symptomen.
Wel stelt een Nederlandse richtlijn (in ontwikkeling) dat het aanvragen van
aanvullende diagnostiek (gastroscopie) vanuit de eerste lijn, gericht op het
stellen van de diagnose Barrett-slokdarm, overwogen kan worden bij blanke
mannen ouder dan 50 jaar met langdurige (>5 jaar) ernstige (dagelijkse)
refluxklachten en bij personen met een familiegeschiedenis van slokdarmkanker.
•Risicostratificatie naar dysplasiegraad binnen Barrett-slokdarmpatiënten wordt
aanbevolen. Er is bij pathologen behoefte aan een objectieve methode voor de
vaststelling van de dysplasiegraad, aan de hand van morfologische kenmerken
en/of biomarkers.
•Dysplasie in combinatie met de lengte van Barrett-segment, oesophagitis en
endoscopisch zichtbare afwijkingen kunnen als voorspellende set voor risico­
stratificatie bruikbaar zijn.
3.8.3
Implicaties voor onderzoek
•Er moet een objectieve methode worden ontwikkeld voor de vaststelling van de
dysplasiegraad (morfologische kenmerken).
•Onderzocht moet worden of screening op Barrett-slokdarm in de algemene
populatie wel effectief kan zijn bij gebruik van de eerder genoemde nieuwe
screeningstechniek en een combinatie van hoogrisicofactoren zoals GERDsymptomen, familiegeschiedenis, mannelijk geslacht en roken of een set van
genetische polymorfismen.
•In prospectief onderzoek moet onderzocht moet worden of biomarkers die
de progressie van Barrett-slokdarm naar slokdarmkanker lijken te kunnen
voorspellen, daadwerkelijk ingezet kunnen worden als screeningstest om
slokdarmkanker in een vroeger stadium te kunnen ontdekken.
•Voor de ontwikkeling van een voorspellende set van biomarkers en demografische,
klinische en mogelijk andere factoren is grootschalig prospectief onderzoek nodig,
vermoedelijk op basis van multicenter samenwerkingsverbanden.
3.8.4
Eindconclusie
Winst te behalen
•Zolang er geen bruikbare screeningstesten voor de identificatie van Barrett-slok­
darm­patiënten in de algemene populatie beschikbaar zijn en er geen andere
hoogrisicogroepen dan Barrett-slokdarmpatiënten bekend zijn, is er alleen winst
te verwachten door middel van surveillance van Barrett-slokdarmpatiënten met
dysplasie en risicostratificatie op basis van in nader onderzoek vast te stellen
factoren/biomarkers.
Vroege ontdekking van adenocarcinoom van de slokdarm
79
Knelpunten
•Barrett-slokdarmpatiënten zijn vaak asymptomatisch. Er is nog geen
kosteneffectieve methode om Barrett-slokdarmpatiënten door middel van en
patiëntvriendelijke en geaccepteerde screeningsmethode in de algemene populatie
op te sporen. Grove schattingen geven aan dat een groot percentage (tussen de
92-98%) van de patiënten met Barrett-slokdarm niet tijdig wordt gediagnosticeerd.
•Op dit moment zijn patiënten met Barrett-slokdarm de enige hoogrisicogroep
waarin vroege opsporing van slokdarmkanker mogelijk is.
•De kosten van een surveillance- en/of screeningsprogramma zijn relatief hoog
doordat slechts een klein deel van de Barrett-slokdarmpatiënten hooggradige
dysplasie of slokdarmkanker ontwikkelt.
•In onderzoek bestaat variabiliteit in pathologische interpretatie doordat
dysplastisch weefsel endoscopisch niet of nauwelijks te onderscheiden is van
normaal cilinderepitheel en de histologische gradering van de ernst van de
dysplasie onderhevig is aan een hoge mate van subjectiviteit. Daarnaast komt
sampling error bij het nemen van biopten voor.
Kansen
•String-capsule endoscopie (sensitiever), ultrathin endoscopie (goedkoper) en
de cytosponge (minder invasief) zijn mogelijk alternatieven voor de huidige
conventionele endoscopie voor screening op Barrett-slokdarm.
3.8.5
Aanbevelingen
• Onderzoek moet vast stellen welke Barrett-slokdarmpatiënten met risico
op het ontwikkelen van slokdarmkanker opgenomen moeten worden in een
surveillanceprogramma, o.a. door analyse van risicofactoren voor en biomarkers
bij kanker- en voorloperstadia.
•Voor het opsporen van patiënten met een Barrett-slokdarm waarvoor
surveillance nodig is, is onderzoek nodig gericht op de ontwikkeling van een
patiëntvriendelijkere methode.
•Onderzoek moet vaststellen welke surveillancestrategie moet worden gevolgd
voor Barrett-slokdarmpatiënten at risk voor slokdarmkanker.
•Onderzoek gericht op de ontwikkeling van een objectieve methode voor het
definiëren van dysplasie, op basis van met name morfologische kenmerken, moet
worden bevorderd.
•Onderzoek moet vaststellen welke behandelingen noodzakelijk zijn voor
Barrett-slokdarmpatiënten, rekening houdend met de aanwezigheid en ernst van
dysplasie in de Barrett-slokdarm.
•Van belang hiervoor is dat alle gediagnosticeerde Barrett-slokdarmpatiënten
worden opgenomen in de nu lopende onderzoekscohorten in Nederland.
3.9
Referenties
Benaglia T et al. (2013) Health benefits and cost effectiveness of endoscopic and
nonendoscopic cytosponge screening for Barrett’s esophagus. Gastroenterology
144: 62-73 e6
Bhat S et al. (2011) Risk of malignant progression in Barrett’s esophagus patients:
results from a large population-based study. J Natl Cancer Inst 103: 1049-57
80
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Casson AG et al. (2005) Polymorphisms in DNA repair genes in the molecular
pathogenesis of esophageal (Barrett) adenocarcinoma. Carcinogenesis 26: 1536-41
Casson AG et al. (2006) Genetic polymorphisms of microsomal epoxide hydroxylase
and glutathione S-transferases M1, T1 and P1, interactions with smoking, and risk
for esophageal (Barrett) adenocarcinoma. Cancer Detect Prev 30: 423-31
Chak A et al. (2002) Familial aggregation of Barrett’s oesophagus, oesophageal
adenocarcinoma, and oesophagogastric junctional adenocarcinoma in
Caucasian adults. Gut 51: 323-8
Cooper GS et al. (2009) Receipt of previous diagnoses and endoscopy and outcome
from esophageal adenocarcinoma: a population-based study with temporal
trends. Am J Gastroenterol 104: 1356-62
De Jonge PJ et al. (2013) Barrett’s oesophagus: epidemiology, cancer risk and
implications for management. Gut
De Jonge PJ et al. (2010) Risk of malignant progression in patients with Barrett’s
oesophagus: a Dutch nationwide cohort study. Gut 59: 1030-6
Den Hoed CM et al. (2011) The minimal incubation period from the onset of Barrett’s
oesophagus to symptomatic adenocarcinoma. Br J Cancer 105: 200-5
Dias Pereira A et al. (2007) Cancer risk in Barrett’s oesophagus. Eur J Gastroenterol
Hepatol 19: 915-8
Edelstein ZR et al. (2009) Risk factors for Barrett’s esophagus among patients with
gastroesophageal reflux disease: a community clinic-based case-control study.
Am J Gastroenterol 104: 834-42
Ferguson MK and Durkin A (2002) Long-term survival after esophagectomy for
Barrett’s adenocarcinoma in endoscopically surveyed and nonsurveyed patients.
J Gastrointest Surg 6: 29-35; discussion 36
Gilbert EW et al. (2011) Barrett’s esophagus: a review of the literature. J Gastrointest
Surg 15: 708-18
Gough MD et al. (2005) Prediction of malignant potential in reflux disease: are
cytokine polymorphisms important? Am J Gastroenterol 100: 1012-8
Grotenhuis BA et al. (2010) Delay in diagnostic workup and treatment of esophageal
cancer. J Gastrointest Surg 14: 476-83
Gupta N et al. (2011) Endoscopy for upper GI cancer screening in the general
population: a cost-utility analysis. Gastrointest Endosc 74: 610-624 e2
Hage M et al. (2004) Oesophageal cancer incidence and mortality in patients with
long-segment Barrett’s oesophagus after a mean follow-up of 12.7 years. Scand J
Gastroenterol 39: 1175-9
Hippisley-Cox J and Coupland C (2011) Identifying patients with suspected gastrooesophageal cancer in primary care: derivation and validation of an algorithm. Br
J Gen Pract 61: e707-14
Hippisley-Cox J and Coupland C (2012a) Identifying patients with suspected
pancreatic cancer in primary care: derivation and validation of an algorithm. Br J
Gen Pract 62: e38-45
Hippisley-Cox J and Coupland C (2012b) Identifying women with suspected ovarian
cancer in primary care: derivation and validation of algorithm. BMJ 344: d8009
Hirst NG et al. (2011) Is endoscopic surveillance for non-dysplastic Barrett’s esophagus
cost-effective? Review of economic evaluations. J Gastroenterol Hepatol 26: 247-54
Hur C et al. (2013) Trends in esophageal adenocarcinoma incidence and mortality.
Cancer 119: 1149-58
IKNL (2011) Nederlandse Kankerregistratie. IKNL
Vroege ontdekking van adenocarcinoom van de slokdarm
81
IKNL (2012) Nederlandse Kankerregistratie. IKNL
Inadomi JM et al. (2003) Screening and surveillance for Barrett esophagus in high-risk
groups: a cost-utility analysis. Ann Intern Med 138: 176-86
Jin Z et al. (2009) A multicenter, double-blinded validation study of methylation
biomarkers for progression prediction in Barrett’s esophagus. Cancer Res 69:
4112-5
Kadri SR et al. (2010) Acceptability and accuracy of a non-endoscopic screening test
for Barrett’s oesophagus in primary care: cohort study. BMJ 341: c4372
Kaneshiro DK et al. (2011) Clinical significance of the duplicated muscularis
mucosae in Barrett esophagus-related superficial adenocarcinoma. Am J Surg
Pathol 35: 697-700
Kruyt PM et al. (1997) Barrett-oesophagus en Barretcarcinoom. NTvG 141: 869-73
Martin IG et al. (1997) Delays in the diagnosis of oesophagogastric cancer: a
consecutive case series. Bmj 314: 467-70
Moons LM et al. (2005) IL-1 RN polymorphism is not associated with Barrett’s
esophagus and esophageal adenocarcinoma. Am J Gastroenterol 100: 2818
Nason KS et al. (2011) Gastroesophageal reflux disease symptom severity, proton
pump inhibitor use, and esophageal carcinogenesis. Arch Surg 146: 851-8
Nietert PJ et al. (2003) Cost-effectiveness of screening a population with chronic
gastroesophageal reflux. Gastrointest Endosc 57: 311-8
Pandeya N et al. (2008) Associations of duration, intensity, and quantity of smoking
with adenocarcinoma and squamous cell carcinoma of the esophagus. Am J
Epidemiol 168: 105-14
Pepe MS et al. (2001) Phases of biomarker development for early detection of cancer.
J Natl Cancer Inst 93: 1054-61
Post PN et al. (2007) Rising incidence of clinically evident Barrett’s oesophagus in
The Netherlands: a nation-wide registry of pathology reports. Scand J
Gastroenterol 42: 17-22
Prasad GA et al. (2010) Predictors of progression in Barrett’s esophagus: current
knowledge and future directions. Am J Gastroenterol 105: 1490-1502
Ramirez FC et al. (2008) Screening of Barrett’s esophagus with string-capsule
endoscopy: a prospective blinded study of 100 consecutive patients using
histology as the criterion standard. Gastrointest Endosc 68: 25-31
Roberts KJ et al. (2010) Long-term survival and cost analysis of an annual Barrett’s
surveillance programme. Eur J Gastroenterol Hepatol 22: 399-403
Rubenstein JH and Inadomi JM (2006) Defining a clinically significant adverse impact
of diagnosing Barrett’s esophagus. J Clin Gastroenterol 40: 109-15
Rubenstein JH and Taylor JB (2010) Meta-analysis: the association of oesophageal
adenocarcinoma with symptoms of gastro-oesophageal reflux. Aliment
Pharmacol Ther 32: 1222-7
Rugge M et al. (2012) Barrett’s esophagus and adenocarcinoma risk: the experience of
the North-Eastern Italian Registry (EBRA). Ann Surg 256: 788-94; discussion 794-5
Sikkema M et al. (2011) Predictors for neoplastic progression in patients with Barrett’s
Esophagus: a prospective cohort study. Am J Gastroenterol 106: 1231-8
Sonnenberg A et al. (2002) Medical decision analysis of endoscopic surveillance
of Barrett’s oesophagus to prevent oesophageal adenocarcinoma. Aliment
Pharmacol Ther 16: 41-50
Van Soest EM et al. (2005) Increasing incidence of Barrett’s oesophagus in the
general population. Gut 54: 1062-6
82
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Wang J et al. (2008a) The symptom-to-treatment delay and stage at the time of
treatment in cancer of esophagus. Jpn J Clin Oncol 38: 87-91
Wang JS and Canto MI (2010) Predicting Neoplastic Progression in Barrett’s
Esophagus. Ann Gastroentol Hepatol 1: 1-10
Wang KK and Sampliner RE, Practice Parameters Committee of the American College
of G (2008b) Updated guidelines 2008 for the diagnosis, surveillance and therapy
of Barrett’s esophagus. Am J Gastroenterol 103: 788-97
Vroege ontdekking van adenocarcinoom van de slokdarm
83
‘De unieke samenwerking in
Nederland op het gebied van vroege
ontdekking van alvleesklierkanker
gaat een schat aan informatie
opleveren, die gaat helpen bij het
voorspellen van het risico op het
ontwikkelen van kanker en de
behandeling van voorstadia bij
hoogrisicopatiënten.’
Prof. dr. Marco Bruno
4
roege ontdekking van
V
adenocarcinoom van de alvleesklier
4.1
Inleiding
In Nederland is 2% van alle nieuw gediagnostiseerde kankergevallen het gevolg van
alvleesklierkanker. In 2012 waren er 2.318 nieuwe gevallen van alvleesklierkanker.
Alvleesklierkanker neemt de 10e plaats bij mannen en de 8e plaats bij vrouwen in van
meest voorkomende tumorsoorten in Nederland. Alvleesklierkanker is daarentegen
wel de vierde doodsoorzaak als gevolg van kanker, verantwoordelijk voor 6% van
alle sterfgevallen door kanker (IKNL, geraadpleegd 2013; cijfersoverkanker.nl). Het
absoluut aantal sterfgevallen neemt jaarlijks toe en bedroeg 2.568 overledenen in
2012. Deze trend is waarneembaar bij zowel mannen als vrouwen (CBS Statline).
De prognose voor patiënten met alvleesklierkanker is slecht: de 5-jaarsoverleving
van alvleesklierkanker (inclusief de niet-adenocarcinomen) bedroeg in 2006-2010 6%
(vergeleken met 86% voor borstkanker) (IKNL geraadpleegd 2013; cijfersoverkanker.nl),
vanwege het late stadium van de ziekte bij de diagnose. Het blijkt dat patiënten bij
wie alvleesklierkanker bij toeval is ontdekt een langere mediane overleving hebben
dan patiënten bij wie alvleesklierkanker is gediagnosticeerd na het ontstaan van
klachten (Winter, Cameron et al. 2006). Deze gegevens ondersteunen het belang
van detectie en behandeling van premaligne afwijkingen of kleine asymptomatische
alvleeskliertumoren, zodat maligne progressie voorkomen kan worden of de kans op
genezing groter is.
Alvleesklierkanker omvat verschillende typen tumoren. Deze tumoren verschillen in
het weefsel waaruit ze ontstaan. Dit hoofdstuk richt zich op het adenocarcinoom,
het meest voorkomende (ca. 90%) type kanker van de alvleesklier, dat ontstaat
in de buisjes die de spijsverteringsenzymen afvoeren. Voor de leesbaarheid
wordt alvleesklierkanker i.p.v. ductaal adenocarcinoom van de alvleesklier
gebruikt. Histologisch kunnen verschillende voorstadia van het adenocarcinoom
van de alvleesklier worden onderscheiden, nl. pancreatische intra-epitheliale
neoplasie (PanIN), intraductale papillaire mucineuze neoplasmata (IPMN) en
mucineuze cystische neoplasmata (MCN). Afhankelijk van hun grootte zijn deze
afwijkingen, vooral de cysteuze afwijkingen, in meer of mindere mate zichtbaar
met beeldvormende detectietechnieken (bijvoorbeeld endosonografie, computer
tomografie (CT), MRI) (De Jong et al. 2012). Recent DNA-onderzoek in tumoren
wijst uit dat de periode tussen het ontstaan van PanIN en ontwikkeling van
ductaal adenocarcinoom van de alvleesklierkanker 11,7 jaar kan beslaan (Yachida
et al. 2010). Er bestaat een grote ‘window of opportunity’ voor het detecteren van
alvleesklierkanker in een beter behandelbaar stadium (Poruk et al. 2013).
Het overgrote deel van de alvleesklierkankerpatiënten presenteert zich bij de MDLarts met geelzucht. Pijn is een laat symptoom dat wijst op ingroei in het netwerk
van zenuwen en bloedvaten (plexus) en dus lokale tumoruitbreiding, waardoor de
kans op genezing kleiner is. Slechts een klein deel van de patiënten presenteert zich
Vroege ontdekking van adenocarcinoom van de alvleesklier
85
zonder geelzucht, maar bij deze patiënten is de tumor vaak al uitgebreid (ingroei
in bloedvaten en/of metastasen) omdat deze relatief lang kon groeien zonder
specifieke symptomen te veroorzaken. De waarschijnlijkheidsdiagnose wordt
gesteld met behulp van beeldvorming, bijvoorbeeld een CT-scan. Bij 95% van de
patiënten met gediagnosticeerde alvleesklierkanker is al sprake van uitzaaiing.
De definitieve diagnose wordt gesteld op basis van een cytologische of histologische
punctie uit de primaire tumor of een voor metastase verdachte afwijking.
Ondanks decennialange inspanningen (tijd en geld) om de behandeling en
prognose van patiënten met resectabele en niet resectabele alvleesklierkanker
te verbeteren, is er geen tot nauwelijks winst geboekt in overleving. Dit betekent
dat voor het bereiken van prognoseverbetering ook andere strategieën moeten
worden geëxploreerd, zoals secundaire preventie gericht op het ontdekken van
alvleesklierkanker in een vroeg stadium of mogelijke voorstadia van alvleesklier­
kanker (Poruk et al. 2013). Gezien de lage incidentie van alvleesklierkanker in de
algemene bevolking, zijn de inspanningen vooral gericht op screening van individuen
met een verhoogd risico op het krijgen van alvleesklierkanker (Canto et al. 2013).
De uitdaging is om bij deze hoogrisicogroepen biomarkers te vinden (bijv. in urine
of bloed) die sensitief en met name specifiek genoeg zijn voor het ontdekken van
voorstadia (m.n. PanIN en IPMN), al dan niet in combinatie met beeldvormende
technieken. Biomarkers of beeldvormende technieken die van waarde blijken te zijn
in hoogrisicogroepen kunnen vervolgens worden geëvalueerd in populaties met een
lagere incidentie.
86
Leeswijzer hoofdstuk
Dit hoofdstuk is als volgt opgebouwd: Allereerst wordt de huidige kennis m.b.t.
het ontstaan en de ontwikkeling van alvleesklierkanker beschreven. Aan de
hand van een casus worden de dilemma’s m.b.t de vroegdiagnostiek van deze
tumorsoort geïllustreerd. Vervolgens wordt op basis van een analyse van
gegevens uit de Nederlandse Kankerregistratie (NKR) specifiek ingegaan op het
voorkomen van deze tumorsoort en wordt het stadium bij diagnose in relatie tot
zowel behandelingsmogelijkheden als overleving gepresenteerd. Deze inleidende
paragrafen (paragraaf 1 t/m 5) onderstrepen het belang van het ontdekken van deze
tumorsoort in een eerder stadium. Indien men uitsluitend geïnteresseerd is in de
stand van zaken van de wetenschappelijke kennis en klinische praktijk van vroege
ontdekking bij het adenocarcinoom van de alvleesklier is het tweede deel van dit
hoofdstuk relevant (vanaf paragraaf 6). Hierin wordt het resultaat van de analyse
van verschillende aspecten van vroege ontdekking (risicofactoren, klachten en
symptomen, terugdringen van patient en doctor’s delay, screening en surveillance
en de mogelijke gezondheidswinst na vroege ontdekking) beschreven en een
kort (niet uitputtend) overzicht van voor dit rapport relevante lopende (inter)
nationale projecten gepresenteerd. Het hoofdstuk sluit af met een paragraaf met
conclusies en aanbevelingen (paragraaf 8). Hierin wordt ingegaan op de implicaties
voor de praktijk en voor onderzoek, maar ook op de knelpunten en kansen t.a.v.
vroege ontdekking bij deze tumorsoort. Het hoofdstuk wordt afgesloten met
tumorspecifieke aanbevelingen.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
4.2.
Ontstaan en ontwikkeling van
alvleesklierkanker
4.2.1
Precursorlaesies
Circa 90% van de alvleeskliertumoren ontstaat in de alvleesklierbuis, waarvan 80 tot
90% adenocarcinomen zijn (‘ductaal adenocarcinoma’) (Chakraborty et al. 2011). Er
zijn drie verschillende precursorlaesies van alvleesklierkanker beschreven, namelijk
PanIN, IPMN en MCN. Het merendeel van de alvleeskliertumoren ontstaat uit de
PanINs, wat vaak microscopisch kleine laesies zijn. Hoewel minder frequent, kunnen
alvleeskliertumoren ook ontstaan uit cysteuze nieuwvormingen (IPMN en MCN)
die enkele millimeters tot centimeters groot zijn. IPMN en MCN zijn daardoor beter
detecteerbaar met (conventionele) beeldvormende technieken dan PanINs.
Pancreatic intraductal neoplasia (PanIN)
PanINs zijn (meestal) microscopisch kleine laesies die ontstaan in de kleine
alvleesklierbuisjes. Ze worden meestal aangetroffen in de kop van de alvleesklier.
PanINs worden afhankelijk van hun toenemende graad van afwijkende morfologie
ingedeeld in: PanIN-1 (PanIN-1A en PanIN-1B), PanIN-2 en PanIN-3 (carcinoma in situ)
(figuur 4.1). PanINs zijn de meest voorkomende premaligne laesies in de alvleesklier.
PanINs worden het vaakst gevonden bij een invasieve tumor van de alvleesklier (82%),
maar komen in mindere mate ook voor bij chronische pancreatitis (60%) en gezonde
mensen (16%) (Hruban et al. 2007; Hruban et al. 2008).
Intraductal papillary mucinous neoplasms (IPMN)
IPMNs zijn goed zichtbare slijmvormende cysteuze laesies. De meeste van deze
laesies zijn minstens 1 centimeter groot (Hruban, Maitra et al. 2007). Ze ontstaan
in de hoofdalvleesklierbuis (main-duct IPNMs), of in een van de vertakkingen
hiervan (branch-duct IPMNs), waar ze dilatatie (verwijding) van de alvleesklierbuis
veroorzaken door de intraductale groei van de laesies en overvloedige slijmvorming.
Ze komen meestal voor in de kop van de alvleesklier en iets vaker bij mannen dan bij
vrouwen, in een verhouding van 3:2 (Hruban et al. 2007). IPMNs kunnen histologisch
worden onderverdeeld in adenoom (laaggradige dysplasie), borderline (matige
dysplasie) en carcinoma in situ (hooggradige dysplasie) (Hruban et al. 2007). Een
invasief adenocarcinoom wordt in ca. 30% van de chirurgisch verwijderde IPMNs
aangetroffen, waarbij het risico op progressie tot invasieve tumoren veel groter is bij
de main-duct IPMNs dan bij de branch-duct IPMN (Tanaka et al. 2012).
Mucinous cystic neoplasms (MCN)
De MCNs komen minder vaak voor dan de andere precursorlaesies. Ze zijn evenals
IPMNs mucine-producerende laesies, die cystes van ca. 1-3 cm in diameter kunnen
vormen in de alvleesklier. In tegenstelling tot IPMNs, staan MCNs niet in verbinding
met de alvleesklierbuis en worden vaak omgeven door ovarieel stroma. MCNs
worden voornamelijk aangetroffen in het lichaam of staart van de alvleesklier. MCNs
komen veel vaker voor bij vrouwen dan bij mannen (20:1 verhouding), voornamelijk
premenopauzale vrouwen (Roggin et al 2010). Niet-invasieve MCNs worden naar de
mate van epitheliale dysplasie ook ingedeeld in adenoma, borderline en carcinoma
in situ en hebben een goede prognose. In 6-27% van de MCNs wordt invasieve
carcinoom aangetroffen (Tanaka et al. 2012).
Vroege ontdekking van adenocarcinoom van de alvleesklier
87
4.2.2
Progressie
PanINs
De carcinogenese van de alvleesklier is het best beschreven voor PanINs. Er is een
model voorgesteld dat beschrijft welke reeks van genetische veranderingen zich
achtereenvolgens voordoen en de verschillende daarbij behorende morfologischhistologische veranderingen (figuur 4.1). De carcinogenese van de alvleesklier
verloopt in stappen, namelijk verkorting van telomeren en activatie van mutaties in
het KRAS-gen (PanIN1), inactivatie van het p16/CDKN2A-gen (PanIN2) en inactivatie
van de genen TP53, SMAD4 (DPC4) en BRCA2 (PanIN3) (Hruban, Goggins et al.
2000). Daarnaast zijn nog een aantal genen beschreven die een minimale rol bij de
carcinogenese spelen (de zgn. candidate cancer genes, CAN genes). Geschat wordt dat
slechts 1% van alle PanINs zich verder ontwikkeld tot een adenocarcinoom (Hruban et
al. 2008).
Op basis van gegevens uit het Genome Project en studies over o.a.
proliferatiesnelheid van normale en neoplastische cellen en genmutaties, werden
schattingen gemaakt (Yachida et al. 2010) van de verschillende tijdsintervallen in
de stapsgewijze ontwikkeling van alvleesklierkanker. De duur van de premaligne
fase van PanINs, vanaf de eerste initiatie in een normale ductaal epitheelcel tot de
overgang van PanIN3 naar een invasieve tumor, wordt geschat op ongeveer 12 jaar
en de duur van invasieve tumor naar metastasering op ongeveer 7 jaar (Yachida
et al. 2010). De tijd tussen metastasering en sterfte van de patiënt wordt op basis
van dit model geschat op ongeveer 3 jaar. Helaas worden de meeste patiënten pas
gediagnosticeerd aan het einde van de meer dan 20 jaar durende periode waarin
alvleesklierkanker tot ontwikkeling komt, hetgeen waarschijnlijk de slechte
prognose verklaart. Dit model biedt dus aanwijzingen dat er een ‘window of
opportunity’ voor vroege ontdekking en behandeling van alvleesklierkanker bestaat.
De uitdaging voor de toekomst ligt in het ontwikkelen van methoden voor het
ontdekken van alvleesklierkanker in het nog operabele PanIN-stadium (IacobuzioDonahue 2012; Yachida and Iacobuzio-Donahue 2013).
Normale
alvleesklierbuis
PanIN-1
PanIN-2
PanIN-3
Invasieve
tumor
Figuur 4.1: Progressie model van PanINs.
Reprinted with permission from: Macgregor-Das and Iacobuzio-Donahue (2013) Molecular pathways in pancreatic
carcinogenesis. J Surg Oncol 107(1): 8-14.
88
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
IPMN en MCN
De genetische veranderingen die ten grondslag liggen aan de ontwikkeling en
progressie van IPMN en MCN zijn minder bekend. Mutaties in KRAS en TP53
zijn gerapporteerd, echter in lagere frequenties dan in PanIN. Inactivatie van
SMAD4 wordt in deze laesies alleen gevonden als er sprake is van invasieve kanker
(Macgregor-Das and Iacobuzio-Donahue 2013). Ook bij deze laesies veronderstelt
men dat progressie verloopt van laaggradige naar hooggradige dysplasie en
vervolgens naar invasief adenocarcinoom, maar de duur van de periode tussen deze
stadia is onbekend en er zijn geen modelleerstudies bekend waarin schattingen van
deze duur zijn gemaakt.
4.3
Casuïstiek van een patiënt
Onderstaande casus illustreert dat het adenocarcinoom van de alvleesklier vaak laat
klachten geeft en daardoor meestal in een laat stadium wordt gediagnosticeerd.
Casus
Een 67-jarige man is volgens zijn vrouw de afgelopen week langzaam geel geworden. Bij navraag
had hij de laatste twee maanden minder zin in eten en is hij ongeveer 7 kilogram afgevallen. Sinds
een paar dagen heeft zijn urine de kleur van cola en zijn ontlasting de kleur van stopverf. Afgezien
van wat jeuk heeft hij verder nergens last van, met name heeft hij geen buikpijn, rugpijn of
misselijkheid.
Hij was een forse roker tot twee jaar geleden toen hij een hartinfarct kreeg en met spoed moest
worden gedotterd. Daarnaast heeft hij COPD. Hij heeft niet eerder geelzucht gehad en nooit een
pancreatitis gehad. Alvleesklierkanker komt niet in zijn familie voor. Hij is 7 jaar geleden met
vervroegd pensioen gegaan. Hij woont samen met zijn vrouw. Hij doet niet aan sport, maar kan
zonder problemen een paar kilometer wandelen, of een paar trappen oplopen. Bij lichamelijk
onderzoek valt met name de geelzucht op, evenals enige vermagering. Bij bloedonderzoek is zijn
bilirubine fors verhoogd.
Op een CT-scan van de buik worden verwijde galwegen gezien in de lever en ook de galweg buiten
de lever is verwijd tot aan de kop van de alvleesklier. Ook de buis in de alvleesklier is verwijd. In
de kop van de alvleesklier is een tumor van ongeveer 3 cm te zien. De grote bloedvaten rondom de
alvleesklier lijken niet te zijn betrokken bij de tumor. Ook worden er op de scan geen uitzaaiingen in
de lever gezien.
4.4
Vóórkomen van alvleesklierkanker
Alvleesklierkanker wordt vooral aangetroffen bij ouderen; de mediane en
gemiddelde leeftijd bij diagnose ligt rond de 70 jaar en 36% (periode 2009-2011)
van de patiënten is ten tijde van de diagnose 75 jaar of ouder. De tumor wordt het
meest ontdekt in de alvleesklierkop en het meest voorkomende type is het ductale
adenocarcinoom van de alvleesklier (tabel 4.1). Bij erfelijke vormen van alvleesklier­
kanker ligt de gemiddelde leeftijd waarop de ziekte zich openbaart 10 jaar jonger.
In de afgelopen 20 jaar is het aantal patiënten met de diagnose alvleesklierkanker
toegenomen van ruim 1.300 naar ruim 2.000 patiënten per jaar. Deze stijging is
vooral een gevolg van de vergrijzing van de Nederlandse bevolking (IKNL 2013).
Vroege ontdekking van adenocarcinoom van de alvleesklier
89
Tabel 4.1: Patiënt- en tumorkenmerken van patiënten met alvleesklierkanker, naar periode.
Totaal
N=16.262 (%)
2003-2005
N=4.812 (%)
2006-2008
N=5.378 (%)
2009-2011
N=6.072 (%)
Man
8111 (50)
2382 (50)
2684 (50)
3045 (50)
Vrouw
8151 (50)
2430 (50)
2694 (50)
3027 (50)
< 60 jaar
3083 (19)
956 (20)
1063 (20)
1064 (18)
60-74 jaar
7182 (44)
2013 (42)
2371 (44)
2798 (46)
≥ 75 jaar
5997 (37)
1843 (38)
1944 (36)
2210 (36)
Alvleesklierkop
10369 (64)
3252 (68)
3451 (64)
3666 (60)
Lichaam/staart
3578 (22)
915 (19)
1177 (22)
1486 (25)
Overlappend/onbekend
2315 (14)
645 (13)
750 (14)
920 (15)
Ductaal adenocarcinoom
10167 (63)
2787 (58)
3362 (63)
4011 (68)
Divers*
166 (1)
23 (< 1)
43 (1)
59 (1)
Ongespecificeerd
5977 (37)
2002 (42)
1973 (37)
2002 (33)
I (T1-2N0M0)
641 (4)
197 (4)
217 (4)
227 (4)
II (T3N0/T1-2-3N1,M0)
2142 (13)
543 (11)
675 (13)
924 (15)
III (T4N0-1M0)
1288 (8)
339 (7)
487 (9)
462 (8)
IV (M1)
5783 (36)
1596 (33)
1900 (35)
2287 (38)
onbekend
425 (3)
133 (3)
123 (3)
169 (3)
geen PA-bevestiging
5983 (37)
2004 (42)
1976 (37)
2003 (33)
Geslacht
Leeftijd
Sublocatie
Histologie
Stadium (TNM 7e editie)
*Maligniteiten zoals intraductal papillary-mucinous carcinoma (IPMC), (mucineus) cystadenocarcinoma,
acinair cell carcinoma.
Bron: IKNL© 2013.
In de algemene Nederlandse populatie bedraagt het risico op alvleeskanker 0,3%
tot 65-jarige leeftijd en 0,9% tot 80-jarige leeftijd, in de periode 2005-2009 (IKNL,
geraadpleegd 2013; cijfersoverkanker.nl).
4.5
Stadiumverdeling bij diagnose in relatie
tot behandeling en overleving
4.5.1
90
Stadium en diagnostiek
In tabel 4.1 en figuur 4.2 wordt de stadiumverdeling van patiënten naar TNM-stadium
(Appendix 2.2) weergegeven van alle tumoren in de alvleesklier samen. Uit deze
gegevens blijkt dat de stadiumverdeling van alvleesklierkanker nauwelijks is
veranderd tussen 2003 en 2011. Slechts bij ongeveer 20-25% van alle patiënten lijkt het
adenocarcinoom op het moment van diagnose beperkt gebleven tot de alvleesklier
zelf of de directe omgeving en/of de regionale lymfklieren (TNM-stadium I-II:
T1-2-3N0-1M0; niet-PA-bevestigde diagnoses in de noemer).
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
100
90
80
percentage
70
60
50
40
30
20
10
0
2003-2005
2006-2008
2009-2011
stadium:
I
IV
II
onbekend
III
geen/ondersteunend PA-bevestiging
Figuur 4.2: Stadiumverdeling (TNM-7) van patiënten met alvleesklierkanker, naar periode.
4.5.2
Stadium en behandeling
In tabel 4.2 staat de behandeling van patiënten met alvleesklierkanker voor drie
periodes aangegeven. Het percentage patiënten dat niet wordt behandeld is
afgenomen in de afgelopen jaren, terwijl het percentage dat chemotherapie krijgt na
een operatie of in combinatie met radiotherapie toenam.
Patiënten met een stadium-I-II-alvleesklierkanker (ca. 20% van de patiënten)
ondergaan in principe een in opzet curatieve operatie, terwijl van de patiënten met
alvleesklierkanker van een onbekend stadium minder dan 10% deze behandeling
ondergaat (figuur 4.3). Het merendeel van de patiënten in deze groep evenals die met
een klinische diagnose krijgen geen of alleen ondersteunende behandeling.
Tabel 4.2: Behandeling van patiënten met alvleesklierkanker, naar periode.
Behandeling
Totaal
N=16262 (%)
2003-2005
N=4812 (%)
2006-2008
N=5378 (%)
2009-2011
N=6072 (%)
Geen
11875 (73)
3862 (80)
3948 (73)
4065 (67)
Chemotherapie/radiotherapie
2538 (16)
505 (11)
851 (16)
1182 (20)
Resectie
1269 (8)
388 (8)
449 (8)
432 (7)
Resectie + chemotherapie
580 (4)
57 (1)
130 (2)
393 (7)
Bron:
IKNL© 2013.
Vroege ontdekking van adenocarcinoom van de alvleesklier
91
100
90
80
percentage
70
60
50
40
30
20
10
0
I
II
III
IV
stadium
resectie
chemotherapie
resectie + chemotherapie
geen/ondersteunend
onbekend
klin.
diagnose
Figuur 4.3: Behandeling van patiënten met alvleesklierkanker naar TNM-stadium in
de periode 2003-2011.
Patiënten bij wie een resectie van de alvleesklierkanker heeft plaatsgevonden,
blijken in veel gevallen (32%) een uitgebreidere tumor (PA) te hebben dan via
beeldvorming inclusief chirurgische exploratie was beoordeeld. In 35% van de
gevallen is het klinisch T-stadium gelijk aan de uitkomst na pathologisch onderzoek.
Een klinisch als T4 geclassificeerde tumor (betrokkenheid grote bloedvaten) zal
slechts in uitzonderlijke gevallen worden verwijderd (zie figuur 4.3).
Bij patiënten met een alvleesklierkanker in TNM-stadium I-II is het resectie­
percentage sinds 2003 gestegen van 53% naar 65% (figuur 4.4). Bij patiënten met een
stadium III-IV tumor is dit gelijk gebleven (2% resectie); deze patiënten hebben wel in
toenemende mate chemotherapie gekregen (van 20% naar 34%).
Bovenstaande data laten zien dat de mogelijkheden voor een in opzet curatieve
behandeling aanzienlijk groter zijn bij vroege stadia (stadium I en II).
4.5.3
92
Stadium en overleving
Tabel 4.3 geeft de overleving 1, 3 en 5 jaar na diagnose van patiënten met alvleesklier
weer. Ondanks een curatieve intentie van behandelmogelijkheden voor patiënten
met stadium-I-II-alvleesklierkanker is de langetermijnoverleving ook voor hen
beperkt. De 5-jaarsoverleving bij stadium I en II is respectievelijk 13% en 7%. Wel is
de mediane overleving van patiënten met stadium-I-II-alvleesklierkanker gestegen
van 9 maanden in 2003-2005 naar ruim 12 maanden in 2009-2011 (p < 0,001). Dit is nog
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
100
90
80
70
60
50
40
30
20
10
0
100
90
80
percentage
70
60
50
40
30
20
10
0
’03-’05
’06-’08
’09-’11
’03-’05
stadium I/II
’06-’08
’09-’11
stadium III/IV
resectie
chemotherapie
resectie + chemotherapie
geen/ondersteunend
Figuur 4.4: Behandeling van patiënten met alvleesklierkanker in de tijd, naar TNM-stadium, in de periode 2003-2011
Stadium TNM = onbekend (2%) en niet-PA-bevestigde diagnoses (37%) niet meegenomen in grafiek.
niet zichtbaar in gegevens over 3- en 5-jaars overleving. De overleving na resectie bij
stadium I en II is veel beter vergeleken bij geen resectie bij hetzelfde stadium.
Oudere patiënten (75 jaar of ouder) met een alvleesklierkanker hebben
een beduidend slechtere overleving dan jongere patiënten. Onafhankelijk
van leeftijd is de 1-jaarsoverleving bij stadium I en II zo’n 2 tot ruim 4 maal
groter dan bij respectievelijk stadium III en IV. Mede gezien de ook betere
behandelingsmogelijkheden bij stadium I en II is er een noodzaak om te zoeken
naar aangrijpingspunten voor het verbeteren van vroege ontdekking van de
alvleesklierkanker.
In 20 jaar ging in Nederland de incidentie voor alvleesklierkanker van 13,6 naar 13,3 per
100.000 mannen per jaar en van 9,2 naar 10,4 per 100.000 vrouwen (Karim-Kos et al.
2012). De mortaliteit veranderde van 15,8 naar 15,3 voor mannen en van 11,1 naar 11,8
voor vrouwen. De relatieve 5-jaarsoverleving van patiënten met alvleesklierkanker is
in 20 jaar weliswaar iets gestegen (van 3% naar 6%), maar is nog steeds erg laag. De
Nederlandse incidentie-, mortaliteit- en overlevingsgegevens van alvleesklierkanker
zijn vergelijkbaar met die in andere Europese landen (Karim-Kos et al. 2012).
Geconcludeerd kan worden dat er over een lange periode weinig veranderd is wat
betreft incidentie, mortaliteit en 5-jaarsoverleving.
Vroege ontdekking van adenocarcinoom van de alvleesklier
93
100
90
80
70
60
50
40
30
20
10
0
Tabel 4.3: De 1-, 3-, en 5-jaarsoverleving van patiënten met alvleesklierkanker naar
TNM-stadium en leeftijd (periode 2003-2011). N (%)
1-jaar
3-jaar
5-jaar
Alle stadia*
16262 (100)
17%
4%
2%
Alle leeftijden Stadium I
641 (4)
48%
20%
13%
Stadium II
2142 (13)
45%
12%
7%
Stadium III
1288 (8)
27%
4%
2%
Stadium IV
5783 (36)
6%
1%
< 1%
Stadium I-II
683 (22)
58%
18%
12%
Stadium III-IV
1856 (60)
12%
2%
1%
Stadium I-II
1415 (20)
48%
16%
9%
Stadium III-IV
3690 (51)
10%
1%
< 1%
Stadium I-II
685 (11)
29%
8%
2%
Stadium III-IV
1523 (25)
7%
< 1%
<1%
Resectie=ja
329 (51)
76%
38%
25%
Resectie=nee
311 (49)
19%
4%
2%
Resectie=ja
1319 (62)
63%
21%
12%
Resectie=nee
823 (38)
19%
2%
1%
< 60 jaar
60-74 jaar
≥ 75 jaar
Stadium I
Stadium II
* Exclusief niet-adenocarcinomen (3-5% van alle alvleesklierkanker), inclusief stadium onbekend (2%) en niet
PA bevestigde diagnoses (37%).
Stadium: I = T1-2N0M0; II = T3N0/T1-3N1M0; III = T4N0-1M0; IV = M1.
Bron: IKNL© 2013.
4.6
Stand van zaken m.b.t. verschillende
invalshoeken van vroege ontdekking
In totaal werden op basis van de zoektermen (zie hoofdstuk 2) 936 artikelen in de
systematische literatuurstudie gevonden (vanaf 2002 tot 2013), waarvan 136 artikelen
beoordeeld werden. Uiteindelijk bleken 50 artikelen empirische studies te betreffen
(waarvan sommige meta-analyses van oorspronkelijke studies) die relevant waren
voor de onderzoeksvragen.
Dit hoofdstuk richt zich op het adenocarcinoom van de alvleesklier. In verband met
de leesbaarheid zal veelal de aanduiding ‘alvleesklierkanker’ gebruikt worden.
4.6.1
94
Risicofactoren
De belangrijkste risicofactoren die uit de gevonden studies naar voren kwamen
waren chronische pancreatitis, erfelijke pancreatitis, familiaire alvleesklierkanker,
roken, nieuw gediagnosticeerde diabetes en alcoholconsumptie (bij met name 22-35
eenheden per week en ≥ 35 eenheden per week). Tabel 4.4 geeft een overzicht van de
onderzochte risicofactoren.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 4.4: Overzicht risicofactoren voor ontwikkelen van alvleesklierkanker.
Risicofactor
OR (95% BI)
Studie 1 ( jaar)
Totaal
Eerstegraads familielid met alvleesklierkanker
1,8 (1,48-2,12)2
1,71 (1,37-2,05)2 (5 studies)
Meta-analyse (Permuth-Wey and
Egan 2009)
Eerste- en tweedegraads familielid met
alvleesklierkanker
2,70 (1,40-4,00)2 (2 studies)
Niet gespecificeerd
2,51 (0,41-4,61)2 (2 studies)
Eerstegraads familielid met alvleesklierkanker
1,76 (1,19-2,61)
Aantal eerstegraads familieleden met
alvleesklier­k anker
geen vs. 1
geen vs. ≥ 2
1,70 (1,14-2,53)
4,26 (0,48-37,79)
Leeftijd bij diagnose van jongste eerstegraads
familielid
geen vs. ≥ 60 jaar
geen vs. < 60 jaar
1,82 (1,05-3,13)
1,54 (0,71-3,34)
≥ 1 eerstegraads familielid met alvleesklier­kanker
9,0 (4,5-16,1)3
Erfelijke en familiare factoren
Geen eerstegraads familielid met
alvleesklier­k anker
1,8
Jacobs, Chanock et al. (2010)
Klein (2012)
(0,22-6,4)3
Klinische factoren
Diabetes
Hippisley-Cox and Coupland (2012)
Type 2 diabetes
vrouw
man
2,07 (1,66-2,58)
2,11 (1,76-2,52)
Diabetes
1,5 (1,1-2,1)
Leeftijd bij diagnose diabetes
< 50 jaar
50-59 jaar
≥ 60 jaar
0,85 (0,42-1,7)
1,7 (0,97-2,9)
1,8 (1,2-2,8)
Duur diabetes voor kankerdiagnose
1-4 jaar
5-9 jaar
≥ 10 jaar
2,4 (1,4-4,0)
2,0 (1,2-3,4)
0,86 (0,52-1,4)
Gebruik orale medicatie en insuline
2,5 (1,6-4,0)
Wang, Gupta et al. (2006)
Pancreatitis
Chronische pancreatitis
vrouw
man
3,15 (1,17-8,46)
3,94 (1,93-8,01)
Pancreatitis (type niet gespecificeerd)
Chronisch pancreatitis
Hereditaire (erfelijke) pancreatitis
5,1 (3,5-7,3) (11 studies)
13,3 (6,1-28,9) (7 studies)
69,0 (56,4-84,4) (3 studies)
Vroege ontdekking van adenocarcinoom van de alvleesklier
Hippisley-Cox and Coupland
(2012)
Meta-analyse (Raimondi,
Lowenfels et al. 2010)
95
OR (95% BI)
Studie1 ( jaar)
Positieve serologie
1,25 (0,75-2,09)
Lindkvist, Johansen et al. (2008)
Positieve serologie & rookstatus:
nooit gerookt
huidige roker
vroeger gerookt
4,97 (1,23-20,1)
1,01 (0,52-1,97)
1,52 (0,45-5,10)
Positieve serologie & risicogebruik van alcohol:
laag risico
matig risico
hoog risico
2,19 (0,98-4,88)
1,38 (0,64-2,98)
0,24 (0,023-2,48)
Risicofactor
Klinische factoren
Helicobacter pylori
Hepatitis
Meta-analyse (Xu, Fu et al. 2013)
Chronische hepatitis B (of drager inactieve
HBsAg)
1,20 (1,01-1,39)
Eerdere infectie met hepatitis B
1,24 (1,05-1,42)
Eerdere infectie met hepatitis C
1,26 (1,03-1,50)
Leefstijlfactoren
Inname roodvlees (tegenover (zéér) door­
bakken bereid)
1,60 (1,01-2,54); (Q1 vs Q5)
Inname (1e vs. 3e tertiel)
Cholesterol
Eiwit
Vitamine C
2,06 (1,11-3,85)
1,52 (0,85-2,73)
0,45 (0,22-0,94)
Alcoholconsumptie bij mannen:
22-35 dranken/week
> 35 dranken/week
binge drinking
2,2 (1,1-4,0)
2,6 (1,3-5,1)
3,5 (1,6-7,5)
Zware roker (≥ 20 sigaretten/dag)
vrouw
man
2,39 (1,65-3,48)
1,88 (1,36-2,61)
Anderson, Mongin et al. (2012)
Lin, Tamakoshi et al. (2005)
Gupta, Wang et al. (2010)
Hippisley-Cox and Coupland (2012)
1
Prospectieve studies en populatiebrede case-controlstudies.
2
Risicomaat is het relatief risico (RR).
3
Risicomaat is de standardized incidence ratio (SIR).
OR = odds ratio, BI = betrouwbaarheidsinterval, HBsAg = hepatitis B surface antigen, NS = niet significant,
Q = quintiel.
4.6.2
96
Klachten en symptomen
De vraag is of er specifieke klachten en/of symptomen zijn die kunnen wijzen op
alvleesklierkanker in een vroeg stadium. Voor een aantal symptomen werden
relatief sterke associaties met alvleesklierkanker gevonden, bijvoorbeeld buikpijn
en eetlustverlies. Ongewone opgeblazenheid (opgezette buik; bloating) en
ongewoon boeren (belching) vertoonden eveneens sterke associaties. Bij navraag
bij de onderzoekers bleek dat niet was onderzocht of er een relatie was tussen de
symptomen en het stadium waarin alvleesklierkanker was ontdekt. In tabel 4.5
worden de klachten en symptomen van de twee gevonden studies weergegeven.
De voorspellende waarde van een groot aantal risicofactoren, klachten en
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
symptomen was onderzocht door Hippisley-Cox en Coupland (2012) in een zeer grote
studie onder 2,3 miljoen huisartspatiënten op basis van de registratiesystemen van
375 huisartspraktijken in Engeland. Er werd een hoogrisicogroep gedefinieerd (op
basis van individuele risicoschattingen) aan de hand van een combinatie van de
meest voorspellende risicofactoren, klachten en symptomen in deze studie, namelijk
leeftijd, roken, diabetes type 2, chronische pancreatitis, buikpijn, eetlustverlies,
gewichtsverlies, opgezette buik (alleen voor vrouwen) en slikproblemen en
constipatie (alleen voor mannen). Deze hoogrisicogroep bevatte 62% (sensitiviteit)
van alle in 2 jaar gediagnosticeerde alvleesklierkankersoorten, met een specificiteit
van 91%. Echter, de positief voorspellende waarde was slechts 0,6%. M.a.w.: meer
dan 150 patiënten zonder kanker zouden zijn doorgestuurd voor nader diagnostisch
onderzoek om 1 patiënt met alvleesklierkanker te ontdekken.
Tabel 4.5: Overzicht klachten en symptomen van alvleesklierkanker.
Symptoom
OR (95% BI)
Studie1 ( jaar)
Eetlustverlies
vrouw: 3,90 (2,61-5,82)
man: 2,46 (1,43-4,23)
Gewichtsverlies
vrouw: 3,27 (2,35-4,56)
man: 12,5 (7,84-19,9)
Hippisley-Cox and Coupland
(2012); Eerste keer symptomen in
huisartsregistratie
Buikpijn
vrouw: 4,09 (3,46-4,84)
man: 5,23 (4,48-6,11)
Opgezette buik (opgeblazen gevoel)
vrouw: 3,04 (1,68-5,50)
man: NS
Slikproblemen
vrouw: NS
man: 2,56 (1,60-4,10)
Constipatie
vrouw: NS
man: 1,91 (1,35-2,71)
Geelzucht
20 (8,0-49)
Bleke ontlasting
31 (7,3-134)
Jeuk
5 (2,3-11)
Donkere urine
10 (2,9-36)
Ongewone opgeblazen gevoel (≥ 4 weken)
20 (5,9-67)
Ongewoon boeren (≥ 5 weken) )
17 (3,9-75)
Ongewoon maagzuur (≥ 4 weken)
2,3 (1,2-4,5)
Ongewone diarree
5,6 (2-16)
Constipatie
7,3 (2-26)
Eetlustverlies
41 (14-120)
Buikpijn
30 (9,1-101)
Gewichtsverlies
12 (5,2-28)
Vermoeidheid
3,8 (2-7,3)
Veranderd slaappatroon
2,9 (1,3-6,3)
1
Holly, Chaliha et al. (2004);
Gerapporteerde symptomen tot 5 jaar
vóór de diagnose alvleesklierkanker
Prospectieve studies en populatiebrede case-controlstudies.
OR = odds ratio, BI = betrouwbaarheidsinterval, NS = niet significant (waarde niet vermeld in originele artikel).
Conclusies
•Vroege opsporing van alvleesklierkanker aan de hand van klachten en
symptomen of op basis van de aanwezigheid van een of meer risicofactoren is
niet mogelijk ten gevolge van een zeer lage positief voorspellende waarde.
Vroege ontdekking van adenocarcinoom van de alvleesklier
97
•Voor een aantal symptomen werden relatief hoge odds-ratio’s gevonden,
bijvoorbeeld buikpijn en eetlustverlies, maar dergelijke symptomen kunnen ook
bij andere ziektes voorkomen. Symptomen die mogelijk minder vaak voorkomen
bij andere ziektes zoals ongewone opgeblazenheid (bloating; ≥ 4 weken),
ongewoon boeren (belching; ≥ 5 weken) en ongewoon maagzuur (heartburn;
≥ 4 weken) hadden eveneens relatief hoge odds-ratio’s. De studie op basis van
huisartsenregistraties van Hippisley-Cox vond dat een opgeblazen buik alleen
bij vrouwen een onafhankelijke voorspeller voor alvleesklierkanker was. In deze
studie was het symptoom ‘ongewoon boeren’ niet onderzocht. De vraag blijft
derhalve of er meer aandacht moet komen voor ongewone opgeblazenheid
(bloating) en ongewoon boeren (belching) als mogelijk minder bekende
symptomen van alvleesklierkanker.
•Bij patiënten met chronische pancreatitis moet rekening gehouden worden
met het verhoogde risico op het ontwikkelen van alvleesklierkanker, met name
wanneer deze patiënten roken, overgewicht en diabetes type 2 hebben.
4.6.3
Patient en doctor’s delay
Vaak hebben alvleesklierkankerpatiënten al langere tijd last van aspecifieke (vage)
klachten zoals onwelbevinden in de bovenbuik, misselijkheid (braken, geen zin in
eten, maagklachten), vage pijnklachten (in bovenbuik en/of rug) en gewichtsverlies
zonder duidelijke reden, voordat na differentiaal diagnostische omzwervingen de
diagnose alvleesklierkanker definitief wordt gesteld. Gezien het feit dat het om
aspecifieke en/of vage klachten gaat, gaan patiënten vaak pas naar de huisarts als de
klachten wat langer aanhouden (mogelijke patient delay). Een deel van de patiënten
heeft in de jaren voorafgaand diabetes mellitus ontwikkeld of langdurig ontregelde
suikerwaarden.
Probleem voor de huisarts is dat de meeste klachten en symptomen van deze
patiënten ook bij andere ziektebeelden kunnen horen. Gezien de zeer lage incidentie
van alvleesklierkanker in de huisartspraktijk (ca. 1 patiënt per 3-4 jaar), is moeilijk
in te schatten wanneer bij deze klachten doorverwezen moet worden i.v.m. een
vermoeden op een maligniteit. Alleen bij obstructieve geelzucht (ontkleurde
ontlasting en donker gekleurde urine) worden patiënten direct doorverwezen.
Slechts één studie is gevonden waarin mogelijke delay in diagnose werd onderzocht
(Raptis et al. 2010). Deze studie gaf aanwijzingen dat bij patiënten zonder geelzucht
(met buikpijn of gewichtsverlies) mogelijk doctor’s delay kan optreden, omdat
symptomen van geelzucht vaker leiden tot verwijzing. Echter, de vraag is of er meer
specifieke symptomen voor alvleesklierkanker zijn anders dan geelzucht. Het is dus
de vraag in welke mate patient of doctor’s delay is te voorkomen, want er zijn geen
goed opgezette studies hiernaar verricht. Ongewone opgeblazenheid (bloating) en
ongewoon boeren (belching) waren niet onderzocht in dit onderzoek.
Er is volgens de experts kans op diagnostic delay bij pancreatitispatiënten. Bij
zulke patiënten bestaat de kans dat mogelijke symptomen van alvleesklierkanker
worden toegeschreven aan de pancreatitis. Ook is een tumor bij pancreatitis
moeilijk met beeldvormende technieken (CT, MRI, EUS) te detecteren, omdat er al
allerlei veranderingen en afwijkingen in het pancreas zijn opgetreden door de lang
bestaande onderliggende ontsteking en deze moeilijk te onderscheiden zijn van
(beginnende) tumorontwikkeling.
98
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Daarentegen hoeft diagnostic delay geen rol te spelen bij patiënten met
alvleeskliercyste(s), IPMN en MCN, tenminste als deze cyste in een asymptomatisch
stadium bij toeval wordt gevonden (expertsmening). Dit komt steeds vaker voor door
de toenemende inzet van diagnostisch onderzoek geïndiceerd voor andere ziekten,
waarbij de alvleesklier ook wordt afgebeeld (CT, MRI). Alvleeskliercystes zijn dan een
‘toevalsbevinding’ waarvoor de patiënt wordt verwezen naar een pancreaschirurg of
MDL-arts.
Conclusies
•Wegens gebrek aan gepubliceerd onderzoek is het niet mogelijk vast te stellen of
er sprake is van vermijdbare vertraging van de diagnose van alvleesklierkanker.
•Experts zijn van mening dat hier mogelijk sprake van zou kunnen zijn bij
patiënten met pancreatitis.
4.6.4
Screening
De huidige methode voor het vroegtijdig ontdekken van alvleesklierkanker zijn
meestal beeldvormende technieken en in mindere mate biomarkers, zoals CA 199. De vaak toegepaste technieken voor de beeldvorming van de alvleesklier zijn
endoscopische echografie/echo-endoscopie (EUS, Endoscopische UltraSonografie
), vaak met FNA (Fine Needle Aspiration, i.e. biopsie bij verdachte laesies), CT-scan
of MRI. Voor surveillance is CT een ongeschikte techniek vanwege de herhaalde
blootstelling aan ioniserende straling.
Uit onderzoek naar de mogelijkheden van vroege ontdekking van alvleesklierkanker
met behulp van de biomarker CA 19-9, blijkt dat deze biomarker alleen hoogsensitief
voor latere stadia van alvleesklierkanker is (Safi et al. 1997; Egawa et al. 2004). Er
is voor verschillende andere serumbiomarkers, waaronder RCAS1 (Akashi et al.
2003), ULBP2 (Chang et al. 2011), HSP70 (Dutta et al. 2012) en pro-CPA (Topilow et
al. 2011) onderzocht of deze mogelijkheden bieden voor de vroege ontdekking
van alvleesklierkanker. Maar dit onderzoek bevindt zich merendeels nog in een
experimenteel stadium op basis van case-controlstudies met relatief kleine
steekproeven.
4.6.4.1
Screening in de algemene populatie
Er zijn twee studies gevonden die screening in de algemene populatie onderzochten,
respectievelijk met behulp van beeldvormende technieken (Kuroki-Suzuki et al. 2011)
en de biomarker CA 19-9 (Kim et al. 2004) als primaire screeningstest.
Eén hiervan was een Japanse studie waarin 2.511 asymptomatische individuen
op eigen verzoek waren gescreend met transabdominale echografie (TUS,
transabdominal ultrasound) en MRI, indien de alvleesklier slecht zichtbaar was op
TUS. De detectiecijfers voor het ontdekken van alvleesklierkanker in deze groep
waren 0,12% (3/2511 alleen TUS) en 0,20% (5/2511 TUS+MRI) (Kuroki-Suzuki, Kuroki et
al. 2011).
In een Koreaanse studie onder 70.940 asymptomatische personen, die een
routinebezoek aan een gezondheidscentrum brachten, was de klinische
bruikbaarheid van CA 19-9 als screeningstest onderzocht (Kim et al. 2004).
Gedurende 1 jaar waren er 4 nieuwe gevallen van alvleesklierkanker die allen werden
ontdekt door een verhoogde CA 19-9-bloedwaarde, bij een verwijspercentage
van 1,5% (sensitiviteit 100%, specificiteit 99%). De positief voorspellende waarde
was slechts 0,9%: minder dan 1 op de 100 patiënten met een verhoogde CA 19-9
Vroege ontdekking van adenocarcinoom van de alvleesklier
99
waarde bleek uiteindelijk alvleesklierkanker te hebben. Bovendien kwamen 2 van
de 4 patiënten niet in aanmerking voor een in opzet curatieve behandeling. Door
de lage incidentie (4 op 70.940) was zelfs met een specificiteit van 99% de positief
voorspellende waarde te laag. Aangezien de incidentie van alvleesklierkanker in de
algemene bevolking laag is (life-time risico 1,3%), wordt internationaal screening op
deze aandoening niet aanbevolen voor de algemene bevolking (Canto et al. 2013).
4.6.4.2
Screening in hoogrisicogroepen
Ongeveer 5-10% van alle gevallen van alvleesklierkanker is toe te schrijven aan de
aanwezigheid van familiaire alvleesklierkanker en erfelijke genetische syndromen
(i.e. familial atypical multiple mole melanoma syndroom (FAMMM), Peutz-Jeghers
Syndroom (PJS), hereditaire borst- en ovariumkanker (HBOC), BRCA, Lynchsyndroom en Li-Fraumeni-syndroom). Patiënten met een erfelijke of familiaire vorm
van alvleesklierkanker hebben een life-time risico op alvleesklierkanker tussen
3,6% en 40%. Hiermee vormen patiënten met erfelijke en familiaire vormen van
alvleesklierkanker een hoogrisicogroep. De meeste onderzoeken naar evaluatie van
screening op alvleesklierkanker richtten zich op screening in hoogrisicogroepen.
Hoogrisicogroepen werden in deze onderzoeken verschillend gedefinieerd en
konden bestaan uit (combinaties van) de volgende risicofactoren: familiaire
alvleesklierkanker (> 1 eerstegraads familielid (FDG) met alvleesklierkanker, erfelijke
genetische syndromen en erfelijke pancreatitis (tabel 4.6)).
Tabel 4.6: Risico op alvleesklierkanker in hoogrisicogroepen.
Risicogroep
Risicomaat (95% BI)
CLR*
Studie ( jaar)
FAMMM
SIR:tussen
13,1 (1,5-47,4) en
21,8 (8,7-44,8)
10-17%
Goldstein, Fraser et al. (1995)
Syndroom van Peutz-Jeghers (PJS)
SIR:132 (44-137)
11-36%
Giardiello, Brensinger et al. (2000)
Erfelijke genetische syndromen:
Hereditaire borst- en ovariumkanker
(HBOC)
BRCA2
5%
RR:3,51 (1,87-6,58)
RR:4,1 (1,9-7,8)
Breast Cancer Linkage Consortium (1999)
Moran, O’Hara et al. (2012)
BRCA1
RR:2,26 (1.26-4.06)
RR:0,8 (0,1-2,9)
3,6%
Thompson, Easton et al. (2002)
Moran, O’Hara et al. (2012)
Lynchsyndroom
HR:8.6 (4.7-15.7)
3,7%
Kastrinos, Mukherjee et al. (2009)
Li-Fraumenisyndroom
RR:7,3 (2-19)
?
Ruijs, Verhoef et al. (2010)
Familiaire alvleesklierkanker
bij 1 eerstegraads familielid
bij 2 eerstegraads familieleden
bij 3 of meer eerstegraads familieleden
SIR:4,6 (0,5-16,3)
6,4 (1,8-16,4)
32,0 (10,2-74,7)
6,0%
8-12%
40%
Klein, Brune et al. (2004)
Erfelijke pancreatitis
SIR:53 (23-105)
25-40% Lowenfels, Maisonneuve et al. (1997)
* Gegevens afkomstig uit Grover and Syngal (2010).
CLR = cumulative lifetime risk, SIR = standardized incidence ratio, RR = relative risk, HR = hazard ratio:
Risicomaat > 5 betekent een relevant risico.
Tabel 4.7 toont een overzicht van de studies die zijn gevonden in de literatuur.
De studies waren gericht op het vroegontdekken van (pre)maligne laesies
en alvleesklierkanker. In de meeste studies werd gescreend met behulp van
beeldvormende technieken. De gerapporteerde detectiecijfers van premaligne
100
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
leasies of alvleesklierkanker varieerden van 1,3% tot 26% (Kimmey et al. 2002;
Canto et al. 2004; Canto et al. 2006; Langer et al. 2009; Poley et al. 2009; Verna et
al. 2010; Ludwig et al. 2011; Vasen, Wasser et al. 2011; Canto et al. 2012). In de studie
van Ludwig et al. (2011) was het overall detectiecijfer 8%, maar uitgesplitst naar
leeftijd was dit 35% voor individuen van 65 jaar en ouder (<55 jaar: 3%, 55-64 jaar:
3%). Een groot deel (70-100%) van de ontdekte alvleesklierkankertumoren in deze
studies bevond zich in een preklinisch stadium.
Gebruikmakend van de bloedtest CA 19-9 werd een detectiecijfer van 4% gevonden
in een hoogrisicogroep bestaande uit personen met tenminste één eerstegraads
familielid met alvleesklierkanker, Syndroom van Peutz-Jeghers en/of BRCA2mutatie (Zubarik, Gordon et al. 2011).
Onlangs is consensus bereikt over het beleid ten aanzien van patiënten met een
verhoogd risico op familiaire alvleesklierkanker door het International Cancer
of the Pancreas Screening (CAPS) Consortium (Canto et al. 2013). Hoewel het
bewijs ontbreekt, komen volgens dit consortium de volgende risicogroepen in
aanmerking voor screening op alvleesklierkanker: eerstegraads familieleden
van patiënten met tenminste twee eerstegraads familieleden met familiaire
pancreatitis en patiënten met erfelijke syndromen (Peutz-Jeghers patiënten,
dragers van p16- of BRCA2-mutaties of patiënten met erfelijke colonkanker
van wie minstens 1 eerstegraads familielid ook drager is). EUS (Endoscopische
UltraSonografie ) en/of MRCP (magnetic resonance cholangiopancreatography)
zijn volgens het consortium de aangewezen (initiële) screeningsmethoden.
Het bewustzijn (awareness) van het verhoogde risico op alvleesklierkanker bij deze
patiënten of hun zorgprofessionals en het bestaan van deze richtlijn zou mogelijk
verhoogd moeten worden.
Aanbevolen wordt een eenduidige richtlijn in Nederland hieromtrent te
ontwikkelen en uit te dragen. Awareness van het hogere risico is alleen zinvol
als er bij hoogrisico­patiënten een redelijke bereidheid aanwezig is om aan
wetenschappelijk cohort­onderzoek deel te nemen, waarbij de doelstelling voor de
patiënt helder moet zijn. Dit verdient een goede afweging.
4.6.4.3
Surveillance bij patiënten met pancreascystes (IPNM en MCN)
Alvleeskliercystes komen voor bij 2,4% - 20% van de bevolking, afhankelijk van
bijvoorbeeld de leeftijd in de onderzochte populatie (de Jong, Nio et al. 2010). Het
risico op het ontwikkelen van kanker hangt samen met de karakteristieken van
de cyste. De karakteristieken van de cystes worden ingedeeld in de categorieën
‘hoogrisico’ en ‘verdacht (worrisome)’. Hoogrisicocystes betreffen die met een
verwijding (van 10 mm of meer) van de main-duct of waarbij een enhanced solide
component zichtbaar is. ‘Verdachte’ cystes hebben een diameter ≥ 3cm, een 5- 9
mm verwijding van de hoofdalvleesklierbuis of zogenaamde “non-enhancing mural
nodules”. Afzonderlijk of in combinatie vormen deze karakteristieken de leidraad
voor het klinisch beleid (Tanaka, Fernandez-del Castillo et al. 2012). De cyste(s)
wordt operatief verwijderd (middels enucleatie of gedeeltelijke pancreasresectie)
of de ontwikkeling ervan wordt gevolgd door periodieke radiologische controle
(surveillance) met MRI of EUS elke 3-6 of 12 maanden (Tanaka, Fernandez-del
Castillo et al. 2012). Er is nog onvoldoende onderzoek verricht om betrouwbaar te
kunnen inschatten welke cysten kwaadaardig gaan worden.
Vroege ontdekking van adenocarcinoom van de alvleesklier
101
Tabel 4.7: Overzicht uitkomst gevonden screeningsstudies met behulp van
beeldvormende technieken in hoogrisicogroepen.
Auteur ( jaar)
(land)
Hoogrisicogroep
(N)
Screeningsstrategie
Kimmey, Bronner et al. (2002)
(VS)
FPC 1
(N = 46)
EUS; indien abnormaal ERCP
Canto, Goggins et al. (2004)
(VS)
FPC 2; PJS
(N = 38; ≥ 40 jaar)
EUS; indien abnormaal: FNA, spiraal-CT,
ERCP
Canto, Goggins et al. (2006)
(VS)
FPC 2,3; PJS
(N = 78; 30-80 jaar)
EUS; indien abnormaal: FNA, spiraal-CT,
ERCP
Langer, Kann et al. (2009)
(Duitsland)
FPC of MPCS 2,4
(N = 76; 35-85 jaar)
EUS, MRI/MRCP; indien abnormaal:
EUS+FNA
Poley, Kluijt et al. (2009)
(Nederland)
FPC 2; PJS, FAMMM, BRCA-mutatie;
Lynch syndroom, Li-Fraumeni
syndroom; erfelijke pancreatitis
(N = 44; ≥ 40 jaar)
EUS; indien abnormaal: CT en/of MRI
Verna, Hwang et al. (2010)
(VS)
Familiegeschiedenis van
alvleesklierkanker 5
(N = 51; 29-77 jaar)
MRI/MRCP of EUS; indien abnormaal
EUS+/-FNA, ERCP
Ludwig, Olson et al. (2011)
(VS)
FPC 6; BRCA-mutatiedrager 7
(N = 109; gem. 54 jaar)
MRCP (of CT); indien abnormaal
EUS-FNA
Vasen, Wasser et al. (2011)
(Nederland)
p16-Leiden kiembaanmutatiedrager
(N = 79; 39-72 jaar)
MRI/MRCP
Canto, Hruban et al. (2012)
(VS)
PJS; BRCA drager 6; FPC 8
(N = 216; 30/40-80 jaar)
MRI/MRCP), CT, EUS (indien abnormaal
ERCP)
Zubarik, Gordon et al. (2011)
(US)
FPC 8, PJS, BRCA2-mutatie drager
(N = 546, ≥ 40 jaar)
serum CA19.9; indien verhoogd EUS
Definitie FPC in de verschillende studies:
1
≥ 2 eerste- of tweedegraads familieleden met alvleesklierkanker.
2≥
2 eerstegraads familieleden met alvleesklierkanker.
3
Geassocieerd met een bekend erfelijk genetisch syndroom.
4
Familielid van BRCA2- of CDKN2a-mutatiedrager.
5Risico:
gemiddeld: één familielid > 55 jaar met alvleesklierkanker; matig: ≥ 1 familielid of één eerstegraads
familielid < 55 met alvleesklierkanker; hoog: ≥ 3 familieleden met alvleesklierkanker, genetisch syndroom (PJS,
HNPCC, BRCA, FAMMM, erfelijke pancreatitis, FPC), en/of één eerstegraads en één tweedegraads familielid
(< 55 jaar) met alvleesklierkanker.
Sommige cysten worden misschien wel nooit kwaadaardig; anderzijds kan soms
in een korte periode van 6 maanden een onschuldig uitziende cyste van 2,5 cm
veranderen in onresectabele of zelfs uitgezaaide alvleesklierkanker. Er is meer
onderzoek nodig, in grote IPMN-(en MCN) cohorten, om te leren voorspellen wie wel
en wie niet baat heeft bij een operatie.
Idealiter vindt een alvleesklierresectie plaats voordat een tumor overgaat van
hoog­gradige dysplasie naar invasief carcinoom, aangezien de 5-jaars overleving
102
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Diagnostische opbrengst
[gevonden afwijkingen; follow-up]
Overige gevonden afwijkingen
12/46 = 26%
[dysplasie; geen carcinoma]
2/38 = 5.3%
[T2N1 adenocarcinoma; IPMN]
N = 2 serous cystadenoma; N = 1 PanIn 1A-1B,
N = 1 PanIn 1-2, N = 1 PanIn 1-3
8/78 = 10,2%
[N = 7 IPMN; N = 1 PanIN]
1/76 = 1,3%
[PanIN1 met gastric type IPMN]
N = 1 PanIN1, N = 1 PanIN2, N = 1 PanIN1+squamous
metaplasia, N = 1 PanIN1 i.c.m. serous oligocystic
adenoma; N = 2 serous oligocystic adenoma
10/44 = 22.7%
[N = 2 T3N1M0; N = 1 T1N0M0; N = 7 IPMN]
6/51 = 12%
[N = 2 alvleesklierkanker (waarvan een stadium IV );
N = 4 IPMN-B (waarvan 2 alleen o.b.v. beeldvorming]
9/109 = 8,3%
[N = 1 T3N0 alvleesklierkanker; N = 2 IPMN, N = 1 PanIN3;
N = 1 PanIN2; N = 1 serous cystadenoma’ en 3 verdachte
IPNM (waarvan geen pathologie)]
naar leeftijd: < 55: 3%; 55-64: 3%; ≥ 65: 35%
7/79 = 9%
[N = 1 goed; N = 4 matig; N = 1 slecht gedifferentieerde
alvleesklierkanker; N = 1 niet geopereerd]
(mediane follow-up: 4 jaar, 0-10 jaar)
pathologie bevestigd
5/216 = 2,3% [N = 5 IPNM]
(gemiddelde follow-up 28.8 mnd; 14– 47.2 mnd)
Alle gevonden afwijkingen: N = 82 bevestigde/verdachte
IPMN; N = 2 combined IPMN; N = 3 pancreatic endocrine
tumor; N = 4 verwijde ‘main pancreatic duct’;
N = 1 indeterminate benigne cyste; N = 32 aspecifieke
chronische pancreatitits-achtige laesies
5/114 =4,4%
[N = 1 adenocarcinoma (T2N0M0), 1 IPNMN, 1 NET, 1 MCN,
1 PanIN]
(3,5 jaar follow-up)
6≥
7
1 eerstegraads familielid < 50 jaar of ≥ 2 familieleden of ≥ 3 tweedegraads familieleden met alvleesklierkanker.
BRCA-mutatiedrager met ≥ 1 eerstegraads familielid met alvleesklierkanker.
8≥
1 eerstegraads familielid met alvleesklierkanker.
FPC = familiaire alvleesklierkanker, EUS = endoscopische ultrasonografie, FNA = fine needle aspiration
(endosonografische punctie), ERCP = endoscopische retrograde cholangiopancreaticografie, PJS = Peutz-Jeghers
syndroom, IPMN = intraductale papillaire mucineuze neoplasmata, PanIn = pancreatische intra-epitheliale
neoplasia, MRI = magnetic resonance imaging, MPCS = melanoma alvleesklierkanker syndroom,
MRCP = magnetische resonantie cholangiopancreaticografie, FAMMM = familial atypical multiple mole melanoma,
mnd = maanden, NET = neuroendocriene tumoren, CT = computed tomography.
van een klein (< 2cm) invasief carcinoom van de alvleesklier slecht is en men dan
eigenlijk al te laat is.
Er zijn geen gegevens bekend over het life-time risico op alvleesklierkanker bij patiënten met alvleeskliercystes. In een aantal studies wordt het detectie­­percentage en de
incidentie van alvleesklierkanker tijdens surveillance van pancreascystes gerapporteerd, inclusief tumoren die elders in de alvleesklier werden gevonden. Tabel 4.8 geeft
een overzicht van een aantal surveillancestudies die incidentiecijfers rapporteren.
Vroege ontdekking van adenocarcinoom van de alvleesklier
103
De incidentiecijfers tijdens surveillance zijn waarschijnlijk een onderschatting van
de daadwerkelijke kans op het ontwikkelen van alvleesklierkanker, omdat de followup gegevens van deze studies vaak incompleet zijn.
Tabel 4.8: Overzicht van surveillancestudies met schatting van incidentie tijdens
follow-up.
Kenmerken IPMN
Percentage ontdekte kanker
Incidentie (95% BI)
Studie ( jaar)
IPMN: mucineproductie
en MD verwijding ‘hoofd’
alvleesklierbuis > 3 cm
5% (4 uit 80)
[N = 2*]
5-jaars: ~ 12,5%
Tada, Kawabe et al.
(2006)
(afgelezen uit figuur)
Branch duct IPMN < 1 mm, 8% (5 uit 60)
geen kankercellen in
alvleeskliersap
Jaarlijks:
1,1% (0,1%-2,2%)
5 jaars:
6,9% (0,4%-13,4%)
Uehara, Nakaizumi et al.
(2008)
Branch duct IPMN
6% (6 uit 103)
[N = 2*]
5-jaars: 2,4%
10-jaars: 20%
Sawai, Yamao et al. (2010)
Laag-hooggradig IPMN
4% (5 uit 130)
[N = 2 metastase]
1-jaars: 0%
5-jaars: 7%
10-jaars: 38%
He, Cameron et al. (2013)
Pathologisch/
radiologisch bevestigd;
CEA ≥ 200 ng/ml
39% (72 uit 186): Resectiegroep
[N = 5*]
Niet gerapporteerd
Lafemina, Katabi et al.
(2013)
11% (18 uit 170): Surveillancegroep
[N = 5*]
* Kanker gevonden niet ter plaatse van de indexcyste.
IPMN = intraductale papillaire mucineuze neoplasmata, BI = betrouwbaarheidsinterval, CEA = carcino-embryonaalantigeen.
4.6.4.4
Te verwachten gezondheidswinst en kosteneffectiviteit van screening
In paragraaf 4.6.4.2 zijn de verschillende screeningsstudies beschreven gericht op
individuen die een hoogrisico hebben op het ontwikkelen van alvleesklierkanker,
op basis van familiegeschiedenis of als drager van een genetisch syndroom. De
follow-up van deze studies was te kort om te kunnen rapporteren over overleving en
ziektevrije overleving. Er zijn geen studies gevonden waaruit blijkt dat screening in
hoogrisicogroepen kan leiden tot vermindering van de sterfte aan alvleesklierkanker
Er zijn vier modelleerstudies gevonden (tabel 4.9) waarin de kosten(-effectiviteit)
van screening op alvleesklierkanker in hoogrisicogroepen wordt berekend (Martin
and Ulrich 2000; Rulyak et al. 2003; Latchford et al. 2006; Rubenstein, Scheiman
et al. 2007). Deze modelleerstudies hebben echter nog niet geleid tot eenduidige
conclusies. Zo bleek uit de studie van Rulyak en collega’s (2003) dat eenmalig
screenen van 50-jarigen met alvleesklierkanker in de familie met behulp van EUS
en ERCP (endoscopic retrograde cholangiopancreatography) kosteneffectief zou
kunnen zijn. Echter, in deze strategie is geen rekening gehouden met onder meer
kwaliteit van leven (QALY’s) en de langetermijneffecten van pancreatectomie
(tabel 4.9). De geschatte winst van jaarlijks screenen met behulp van EUS en FNA
(bij verdachte laesies) van mensen met chronische pancreatitis en tenminste één
eerstegraads familielid met alvleesklierkanker bleek niet kosteneffectief te zijn in de
studie van Rubenstein et al. (2007). In deze modelleerstudie leek ‘niets doen’ de beste
104
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 4.9: Overzicht uitkomst gevonden modelleerstudies voor screening met behulp
van beeldvormende technieken in hoogrisicogroepen.
Auteur ( jaar) Hoog­risico­
groep
Screenings­strategie
Martin and
Ulrich (2000)
40-jarigen
met erfelijke
pancreatitis
Rulyak,
Kimmey
et al. (2003)
50-jarigen uit
1) Geen screening
een FPC-familie
Latchford,
Greenhalf
et al. (2006)
30-jarigen met
PJS
Rubenstein,
Scheiman
et al. (2007)
45-jarige
mannen met
chronische
pancreatitis
uit FPC-familie
(≥ 1 eerste­
graads
familielid met
alvleesklierkanker)
1
Jaarlijks EUS
gedurende 5 jaar
Uit­komst
Levens­
jaren
Voor kwaliteit Kosten ($)
gecorrigeerde
levensjaren
(QALY)
ICER ($)
-
-
164.285
per kanker
gedetecteerd
-
1720
-
327.118
(directe
kosten)
2) E
enmalige EUS,
gevolgd door ERCP
bij verdachte laesies
en TP indien nodig
1758
Jaarlijks EUS gevolgd
door ERCP of CT bij
verdachte laesies
-
968.733
(directe
kosten)
-
16.885
372.708
per gered
leven
1) Niets doen
29,16
18,57
2.983
2) Profylactische TP
24,65
14,28
199.911
Gedomineerd 1
3) J aarlijks EUS gevolgd 24,78
door TP bij laesie
verdacht voor kanker
14,54
186.089
Gedomineerd 1
4) J aarlijks EUS
gevolgd door FNA
bij verdachte laesies
en TP bij positieve
of verdachte
cytologische
bevinding
17,94
42.521
Gedomineerd 1
28,26
Gedomineerd is als men voor hetzelfde geld meer effecten kan behalen met een andere interventie.
QALY = quality-adjusted life year, ICER = incrementele kosten-effectiviteitsratio, EUS = Endoscopische
UltraSonografie, FPC = familiaire alvleesklierkanker, ERCP = Endoscopische Retrograde CholangioPancreaticografie,
FNA = fine needle aspiration (endosonografische punctie), TP = totale pancreatectomie (chirurgische resectie ),
PJS = Peutz-Jeghers-Syndroom.
strategie. Mogelijk kan risicostratificatie leiden tot een kosteneffectievere strategie.
In een modelleerstudie (tabel 4.10) is de kosteneffectiviteit van surveillance en
chirurgie na diagnose van een alvleeskliercyste (specifiek: branch-duct IPMN)
berekend. Surveillance van alvleeskliercystepatiënten leverde 0,193 extra QALY’s op
ten opzichte van geen surveillance (Huang et al. 2010). In deze modelleersstudie bleek
surveillance kosteneffectiever dan onmiddellijke chirurgie na diagnose.
De vele onzekerheden over het natuurlijk beloop van IPMN en de grote heterogeniteit
in klinisch beloop binnen de groep patiënten met alvleeskliercysten (in deze
modelleerstudie gericht op branch-duct IPMN) maakt de interpretatie van dergelijke
resultaten moeilijk.
Conclusies
•Screening in de algemene populatie met bestaande methoden, zoals CT-scan,
MRI en EUS, leidt tot een te lage positief voorspellende waarde en zou resulteren
Vroege ontdekking van adenocarcinoom van de alvleesklier
105
in onacceptabele fout-positieve testuitslagen. Pas als een test met acceptabele
testkarakteristieken beschikbaar is voor screening in hoogrisicopatiënten
(genetisch/familiair en alvleeskliercysten), kan de bruikbaarheid van deze test
worden onderzocht voor screening in de algemene populatie.
•De detectiecijfers van screening in hoogrisicogroepen lagen tussen de 4% (CA
19-9) en 1,3-26% (beeldvormende technieken). Een groot deel (70-100%) van de
asymptomatische alvleeskliertumoren die met behulp van beeldvormende
technieken zijn ontdekt, bevond zich in een preklinisch stadium.
•Om patiënten in hoogrisicogroepen (genetisch/familiair en alvleeskliercysten)
op het juiste moment te selecteren voor operatie, zijn bestaande criteria op basis
van beeldvorming en analyse van cystevloeistof waarschijnlijk onvoldoende.
•Lopend en toekomstig (moleculair) onderzoek levert mogelijk verbeterde screenings­
methodes op, zoals biomarker(s) met een hoge positief voorspellende waarde.
Tabel 4.10: Uitkomst gevonden modelleerstudie voor surveillance onder
pancreascystepatiënten.
Studie ( jaar)
Hoogrisicogroep
Surveillance strategie
Uitkomst
Levens­jaren
Huang, Gazelle Cohort 60-jarigen
et al. (2010)
met diagnose
van branch-duct
IPMN in de
alvleesklierkop
Voor kwaliteit
gecorrigeerde
levensjaren
(QALY)
Kosten ($) ICER ($)
Chirurgische resectie
alleen bij ontwikkeling
van de symptomen
(geen surveillance)
10,930
222.593
Surveillance met
behulp van consensus
richtlijnen voor
chirurgische resectie
(surveillance)
-
11,123
226.474
20.096
Onmiddellijk operatie
na de initiële diagnose
van branch-duct IPMN
(chirurgie)
-
11,274
246.493
132.436
QALY = quality-adjusted life year, ICER = incrementele kosten-effectiviteitsratio, IPMN = intraductal papillary
mucinous neoplasms..
4.7
Wat zit er in de pijplijn?
Van verschillende lopende onderzoekslijnen in Nederland en in het buitenland,
worden de resultaten over 4-6 jaar verwacht. Onderstaande tabellen geven de
nationale (tabel 4.11) en internationale (tabel 4.12) lopende onderzoeken weer.
Dit overzicht is alleen gericht op initiatieven op het gebied van de onderzochte
vraagstellingen, waarvan het aspect is aangegeven in de eerste kolom. Het
Parelsnoer Instituut, een samenwerkingsinitiatief van de Nederlandse Universitaire
Medische Centra voor verzameling van klinische data en biomaterialen, richt zich
ook op de alvleesklier (de PancreasParel).
106
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 4.11: Lopende nationale initiatieven.
Onderzocht
aspect
Titel en initiatiefnemer
Doel
Aanvullende informatie
Natuurlijk
beloop
biomarkers
Pancreatic cyst follow-up study
ErasmusMC onder auspicien van
de DPCG (Dutch Pancreatic Cancer
Group)
Prof. dr. M.J. Bruno
Het verzamelen van
kennis betreffende de
natuurlijke ontwikkeling
van pancreascysten door
het organiseren van
systematische follow-up
volgens een Europese
consensus richtlijn.
Tevens wordt cystevocht
verzameld dat samen met
het gouden standaard
resectiepreparaat in geval
van operatie kan worden
onderzocht en vergeleken
om markers op te sporen ter
1. differentiatie van cysten
en 2. vaststellen risico op
maligne progressie
Nationale studie, echter
voor een deel van de studie
zullen ook Europese centra
aansluiten
Surveillance
hoogrisicogroepen
ErasmusMC in samenwerking met het
Johns Hopkins ziekenhuis Baltimore
USA en een internationaal studie
consortium.
Prof. dr. M.J. Bruno
Onderzoek naar de
mogelijkheden en waarde
van surveillance van
individuen die een erfelijk
verhoogd risico hebben
op alvleesklierkanker (10
tot 40% life-time risk)
middels MRI/MRCP, EUS en
moleculaire markers
Nationaal (alle genetische
centra zijn aangesloten) en
internationaal (er wordt
een international registry
m.b.t. de follow-up opgezet)
Biomarker
PancreasParel
http://www.parelsnoer.org/page/
De-Parels/Pancreas
Het betreft een gezamenlijk initiatief
van de DPCG en de Pancreatitis
Werkgroep Nederland (PWN)
Coördinator biobank: dr. M. Besselink
PancreasParel zal zich
(Inter)nationaal
in eerste instantie
richten op patiënten die
een pancreasresectie
ondergaan ongeacht
indicatie (maligniteiten van
pancreas, distale galwegen,
neuroendocriene tumoren,
pancreascysten, chronische
pancreatitis, etc). Het is de
bedoeling de biobanking ook
uit te breiden naar patiënten
waar analyse gedaan wordt
van mogelijke pre-maligne
en inoperabele tumoren
Behandeling
Dutch Pancreatic Cancer Group
(DPCG),
Samenwerkingsverband tussen
meerdere ziekenhuizen in Nederland
(oprichtingdatum: 16 november 2 011)
http://www.dpcg.nl/
DPCG
Voorzitter: Prof.dr. Olivier Busch
Verbeteren van de
Nationaal
uitkomsten van behandeling
bij patiënten met pancreasen periampullaire tumoren
door wetenschappelijk
onderzoek, een
landelijke audit van
behandelresultaten en bijen nascholing
Vroege ontdekking van adenocarcinoom van de alvleesklier
107
Tabel 4.12: Lopende internationale initiatieven.
Onderzocht
aspect
Initiatief(nemer)
Doel
Aanvullende informatie
Klachten en Hamilton W University of
symptomen Bristol, UK
en patient
en doctor’s
delay
Bestuderen van ‘symptomatic
en diagnostic delay’. Nagegaan
zal worden wat de oorzaken/
redenen van delay zijn en welke
nieuwe designs specifiek voor
vroegdiagnostiek bij hoog
risicogroepen ontwikkeld kunnen
worden
Te bestuderen
tumorsoorten: colon, long en
alvleesklierkanker,
kwalitatieve studie
(vragenlijsten en
diepte interviews,
huisartsenregistratie)
Biomarker
Jack Andraka,
15-jarige student,
prijswinnaar op de
International Science and
Engineering Fair 2012
Ontwikkelen van een
eenvoudige en goedkope test om
alvleesklierkanker in een vroeg
stadium te ontdekken
http://www.skipr.nl/
tedxnijmegen-08-april-2013.html
Biomarker
Pancreatic Cancer SPOREs,
Mayo Clinic, University of
Alabama at Birmingham
and University of Nebraska
Medical Center
Alvleesklierkanker-geassocieerde
diabetes; ontdekken van
biomarkers voor vroege
opsporing van pancreas
ductaal adenocarcinoom,
biomarkers voor de diagnose van
alvleesklierkanker
Screening in Gastrointestinal Cancer
hoogrisico- SPOREs,
Johns Hopkins University
groepen
4.8
Vroege opsporing van
humane colorectale kanker
en alvleesklierkanker;
screening van individuen
met hoge predispositie voor
alvleesklierkanker
Overlapt met binnen Erasmus
MC uitgevoerd onderzoek,
getiteld: ’Screening of
individuals at high risk for
pancreatic cancer’ van prof.
Bruno
Conclusies en implicaties voor praktijk en
onderzoek, en aanbevelingen
4.8.1
Conclusie m.b.t. vroegontdekking
Risicofactoren/klachten en symptomen
•Vroegere ontdekking van pancreaskanker in de algemene populatie aan de hand
van klachten en symptomen lijkt op dit moment helaas niet mogelijk. Een opgeblazen gevoel (bloating) en ongewoon boeren (belching) zijn opvallende symptomen,
maar deze klachten komen veel vaker voor bij verstoorde spijs­vertering in de
slokdarm, maag en/of dunne darm zonder aanwijsbare oorzaak of afwijking in het
spijsverteringskanaal (functionele dyspepsie) en lijken dus niet onderscheidend
genoeg om alvleesklierkanker in een vroeg stadium vast te kunnen stellen.
•Een duidelijk verhoogd risico op pancreaskanker hangt samen met erfelijke
genetische syndromen, familiaire pancreaskanker en erfelijke pancreatitis
(chronische pancreatitis). Personen met dit verhoogde risico kunnen relatief
goed worden geïdentificeerd. Deze personen vertegenwoordigen een
relatief klein percentage (ca. 5-10%) van alle patiënten waarbij uiteindelijk
pancreaskanker wordt gediagnosticeerd. Kennis betreffende vroegdiagnostiek
die bij deze groep van erfelijk belaste individuen wordt opgedaan, kan
mogelijk wel belangrijke informatie opleveren en implicaties hebben voor de
108
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
vroegdiagnostiek van pancreaskanker in de algemene bevolking.
•Individuen zonder symptomen bij wie een pancreascyste (per toeval) is ontdekt
hebben eveneens een verhoogd risico om alvleesklierkanker te ontwikkelen.
Delay
•Of vermijdbare vertraging in het vaststellen van de diagnose bestaat die leidt tot
een slechtere prognose van alvleesklierkanker, is niet vast te stellen op basis van
gepubliceerd onderzoek.
Screening
•Er zijn nog geen bruikbare biomarkers voor het ontdekken van voorstadia of
vroege stadia van pancreaskanker beschikbaar.
•Het is onbekend of screening in hoog risicogroepen kan leiden tot vermindering
van de sterfte aan pancreaskanker.
•Op theoretische gronden en middels wetenschappelijk onderzoek is de
verwachting dat systematische screening van hoogrisicogroepen nuttig kan zijn,
met name met behulp van beeldvormende technieken, zoals in:
-patiënten met pancreaskanker in de familie of erfelijke aanleg voor pancreas­
kanker. Het life-time risico op pancreaskanker in deze groep bedraagt 10-40%.
-asymptomatische patiënten met pancreascystes. Het risico varieert,
afhankelijk van het type pancreascysten van erg laag tot wel 20%. Exacte
bepaling van het risico van de verschillende subtypes van pancreascystes
is daarom belangrijk, evenals in hoeverre analyse van cystevocht kan
bijdragen tot risicoschatting. De gepubliceerde modelleerstudies over de
kosteneffectiviteit van screening in hoogrisicogroepen hebben nog niet
geleid tot eenduidige conclusies. De modelleerstudies lijken gedateerd
en hebben niet gebruik gemaakt van recentere data van beeldvorming in
hoogrisicogroepen. Dit is noodzakelijk om de uitkomsten van screening, en
risicostratificatie daarbij, goed te kunnen inschatten.
Surveillance
•De optimale surveillancestrategie voor patiënten met pancreascystes wordt
onderzocht. Er moet meer inzicht komen in de heterogeniteit en het klinisch
beloop van pancreascystes.
•De kosteneffectiviteit van surveillance van patiënten met alvleeskliercystes moet
nog verder worden onderzocht.
4.8.2
Implicaties voor de praktijk
•Pancreascystes zijn op te sporen met beeldvormende technieken, maar het is
nog onvoldoende bekend welke pancreascystes een verhoogd risico hebben om
maligne te ontaarden.
•Er is momenteel geen aanbeveling te geven over extra alertheid op specifieke
symptomen die kunnen wijzen op pancreaskanker. De meeste symptomen van
pancreaskanker zijn aspecifiek.
•Het is op basis van de huidige kennis over klachten en symptomen belangrijk om
de patiënt en zijn of haar familie te behoeden voor schuldgevoelens over het niet
tijdig onderkennen van klachten en symptomen.
•Extra alertheid bij zowel arts als patiënt is nodig bij chronische pancreatitis,
omdat deze patiënten een sterk verhoogd risico op pancreaskanker hebben.
Vroege ontdekking van adenocarcinoom van de alvleesklier
109
Bovendien bestaat volgens experts bij pancreatitispatiënten de kans op
vertraging in de diagnose, omdat mogelijke symptomen van pancreaskanker
worden toegeschreven aan de pancreatitis en een tumor in het geval van
chronische pancreatitis radiografisch moeilijk te detecteren is.
•Onlangs is consensus bereikt over het beleid ten aanzien van patiënten met een
verhoogd risico op familiaire pancreaskanker door het International Cancer of
the Pancreas Screening (CAPS) Consortium, waarin ook Nederlandse specialisten
participeren.
4.8.3
Implicaties voor onderzoek
•Onderzoek is nodig naar bruikbare biomarkers in o.a. serum, pancreasvocht,
pancreascystevocht, urine en ontlasting (bijv. eiwitten, RNA, DNA of
circulerende tumorcellen), waarmee voorstadia van pancreaskanker mogelijk
kunnen worden ontdekt.
•Om meer inzicht te verkrijgen in de maligniteitskansen van pancreascystes is
landelijke registratie voor cysteuze pancreastumoren in Nederland nodig. Er is
hiertoe een nationaal initiatief ontplooid wat continuering behoeft in de zin van
langdurig prospectieve cohort follow-up.
•Voor het vaststellen van de voorspellende waarde van de symptomen
opgeblazenheid (bloating) en ongewoon boeren (belching) naar stadium
is prospectief onderzoek nodig waarin patiënten met de verdenking op
pancreaskanker bij binnenkomst worden geregistreerd.
•Om de effectiviteit van screening in hoogrisicogroepen vast te stellen, moeten
nieuwe modelleerstudies worden uitgevoerd die de meer recente imaging- en
biomarkergegevens integreren, om zodoende schattingen te kunnen maken van
mogelijke effecten van vroegontdekking naar risicogroep en methode.
•Onderzoek is nodig naar de redenen van het relatief lage resectiepercentage
bij stadium I (en II) in Nederland, om na te gaan of er aangrijpingspunten voor
verbetering zijn.
•Onderzoek naar relatie voorstadia en optreden kanker is nodig.
4.8.4
Eindconclusie
Winst te behalen
Voor de algemene populatie zijn er op korte termijn geen verbeteringen in de vroeg­
ontdekking van pancreaskanker te verwachten. Wel zijn er veelbelovende ontwikkelingen in het onderzoek naar vroege ontdekking van pancreaskanker in hoogrisico­groepen.
Onderzocht wordt of risicostratificatie in deze groepen mogelijk is aan de hand van:
1. Morfologische kenmerken (imaging)
2. Biomarkers in bijvoorbeeld pancreasvocht, bloed of urine.
Mogelijk levert het onderzoek naar de maligniteitskansen van pancreascystes,
op basis van een landelijke registratie voor cysteuze pancreastumoren zoals die
is opgezet in Nederland, aangrijpingspunten voor vroegontdekking. Voldoende
patiënten dienen geïncludeerd en gedurende lange tijd gevolgd te worden om hierop
antwoord te kunnen geven.
Knelpunten
•Vroege symptomen die kunnen optreden bij alvleesklierkanker zijn meestal
niet specifiek en kunnen ook bij andere ziektes voorkomen. Pijn en een specifiek
110
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
symptoom als geelzucht treden pas op als de kanker in een vergevorderd
stadium is.
•Het is nog niet voldoende duidelijk welke pancreascystes zich ontwikkelen tot
maligniteit en op welke termijn.
Kansen
•De ontwikkeling van pancreaskanker kent een lange periode voor potentiële
vroegdetectie (grote ‘windows of opportunity’).
•Technologische ontwikkelingen in beeldvormende technieken en nieuwe
diagnostische tests (biomarkers) maken het mogelijk dat ook asymptomatische
voorstadia kunnen worden ontdekt en vervolgd.
4.8.5 Aanbevelingen
•Onderzoek wordt aanbevolen naar de reden waarom niet alle patiënten met een
stadium I en II behandeld worden met resectie.
•Verder inzicht in de carcinogenese en daarmee de premaligne laesies en
voorstadia van alvleesklierkanker is nodig om de mogelijkheden van vroege
ontdekking te vergroten.
•Onderzoek naar het klinisch beloop van pancreascystes en het identificeren
van biomarkers in cystes en andere lichaamsweefsels kan worden
geïntensiveerd, door middel van systematische inclusie van patiënten in de
lopende wetenschappelijke cohorten. Dit onderzoek maakt het mogelijk om
hoogrisicopatiënten voor alvleesklierkanker te identificeren.
•Onderzoek is nodig gericht op betere voorspelling van het maligniteitsrisico bij
pancreascysten (d.m.v. beeldvorming of biomarkertesten) en vaststelling van
het optimale tijdstip voor een pancreasresectie tijdens de follow-up van een
pancreascyste. Hiervoor is grootschalig cohortonderzoek nodig.
•Onderzoek moet vaststellen wat de te behalen gezondheidswinst (sterfte- en/
of morbiditeitsreductie) van screening in hoogrisicogroepen is en voor welke
patiënten de nadelen van intensieve follow-up opwegen tegen de voordelen van
screening, o.a. door het uitvoeren van modelleerstudies.
•Aanbevolen wordt om in Nederland een eenduidige richtlijn voor het beleid ten
aanzien van patiënten met een verhoogd risico op familiaire alvleesklierkanker te
ontwikkelen en uit te dragen.
4.9
Referenties
Akashi T et al. (2003) Expression and diagnostic evaluation of the human tumorassociated antigen RCAS1 in pancreatic cancer. Pancreas 26(1): 49-55
Anderson KE et al. (2012) Pancreatic cancer risk: associations with meat-derived
carcinogen intake in the Prostate, Lung, Colorectal, and Ovarian Cancer
Screening Trial (PLCO) cohort. Mol Carcinog 51(1): 128-137
Breast Cancer Linkage Consortium (1999) Cancer risks in BRCA2 mutation carriers.
J Natl Cancer Inst 91(15): 1310-1316
Canto MI et al. (2006) Screening for early pancreatic neoplasia in high-risk individuals:
a prospective controlled study. Clin Gastroenterol Hepatol 4(6): 766-781; quiz 665
Canto MI et al. (2004) Screening for pancreatic neoplasia in high-risk individuals: an
EUS-based approach. Clin Gastroenterol Hepatol 2(7): 606-621
Vroege ontdekking van adenocarcinoom van de alvleesklier
111
Canto MI et al. (2013) International Cancer of the Pancreas Screening (CAPS)
Consortium summit on the management of patients with increased risk for
familial pancreatic cancer. Gut 62(3): 339-347
Canto MI et al. (2012) Frequent detection of pancreatic lesions in asymptomatic highrisk individuals. Gastroenterology 142(4): 796-804; quiz e714-795
Chakraborty S et al. (2011) Current status of molecular markers for early detection of
sporadic pancreatic cancer. Biochim Biophys Acta 1815(1): 44-64
Chang YT et al. (2011) Secretome-based identification of ULBP2 as a novel serum
marker for pancreatic cancer detection. PLoS One 6(5): e20029
De Jong K et al. (2012) Epidemiology, diagnosis, and management of cystic lesions of
the pancreas. Gastroenterol Res Pract 2012: 147465
De Jong K et al. (2010) High prevalence of pancreatic cysts detected by screening
magnetic resonance imaging examinations. Clin Gastroenterol Hepatol 8(9):
806-811
Dutta SK et al. (2012) Serum HSP70: a novel biomarker for early detection of
pancreatic cancer. Pancreas 41(4): 530-534
Egawa S et al. (2004) Clinicopathological aspects of small pancreatic cancer.
Pancreas 28(3): 235-240
Giardiello FM et al. (2000) Very high risk of cancer in familial Peutz-Jeghers
syndrome. Gastroenterology 119(6): 1447-1453
Goldstein AM et al. (1995) Increased risk of pancreatic cancer in melanoma-prone
kindreds with p16INK4 mutations. N Engl J Med 333(15): 970-974
Grover S and Syngal S (2010) Hereditary pancreatic cancer. Gastroenterology 139(4):
1076-1080, 1080 e1071-1072
Gupta S et al. (2010) Risk of pancreatic cancer by alcohol dose, duration, and pattern
of consumption, including binge drinking: a population-based study. Cancer
Causes Control 21(7): 1047-1059
He J et al. (2013) Is it necessary to follow patients after resection of a benign
pancreatic intraductal papillary mucinous neoplasm? J Am Coll Surg 216(4): 657665; discussion 665-657
Hippisley-Cox J and Coupland C (2012) Identifying patients with suspected pancreatic
cancer in primary care: derivation and validation of an algorithm. Br J Gen Pract
62(594): e38-45
Holly EA et al. (2004) Signs and symptoms of pancreatic cancer: a population-based
case-control study in the San Francisco Bay area. Clin Gastroenterol Hepatol 2(6):
510-517
Hruban RH et al. (2000) Progression model for pancreatic cancer. Clin Cancer Res
6(8): 2969-2972
Hruban RH et al. (2008) Update on pancreatic intraepithelial neoplasia. Int J Clin Exp
Pathol 1(4): 306-316
Hruban RH et al. (2007) Precursors to pancreatic cancer. Gastroenterol Clin North Am
36(4): 831-849, vi
Huang ES et al. (2010) Consensus guidelines in the management of branch duct
intraductal papillary mucinous neoplasm: a cost-effectiveness analysis. Dig Dis
Sci 55(3): 852-860
Iacobuzio-Donahue CA (2012) Genetic evolution of pancreatic cancer: lessons learnt
from the pancreatic cancer genome sequencing project. Gut 61(7): 1085-1094
IKNL. (2012) Nederlandse Kankerregistratie. Retrieved december, 2013, from
http://www.cijfersoverkanker.nl/
112
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Jacobs EJ et al. (2010) Family history of cancer and risk of pancreatic cancer: a pooled
analysis from the Pancreatic Cancer Cohort Consortium (PanScan). Int J Cancer
127(6): 1421-1428
Karim-Kos HE et al. (2012) Progress against cancer in the Netherlands since the late
1980s: an epidemiological evaluation. Int J Cancer 130(12): 2981-2989
Kastrinos F et al. (2009) Risk of pancreatic cancer in families with Lynch syndrome.
JAMA 302(16): 1790-1795
Kim JE et al. (2004) Clinical usefulness of carbohydrate antigen 19-9 as a screening
test for pancreatic cancer in an asymptomatic population. J Gastroenterol
Hepatol 19(2): 182-186.
Kimmey MB et al. (2002) Screening and surveillance for hereditary pancreatic cancer.
Gastrointest Endosc 56(4 Suppl): S82-86
Klein AP (2012) Genetic susceptibility to pancreatic cancer. Mol Carcinog 51(1): 14-24.
Klein AP et al. (2004) Prospective risk of pancreatic cancer in familial pancreatic
cancer kindreds. Cancer Res 64(7): 2634-2638
Kuroki-Suzuki S et al. (2011) Pancreatic cancer screening employing noncontrast
magnetic resonance imaging combined with ultrasonography. Jpn J Radiol 29(4):
265-271
Lafemina J et al. (2013) Malignant progression in IPMN: a cohort analysis of patients
initially selected for resection or observation. Ann Surg Oncol 20(2): 440-447
Langer P et al. (2009) Five years of prospective screening of high-risk individuals from
families with familial pancreatic cancer. Gut 58(10): 1410-1418
Latchford A et al. (2006) Peutz-Jeghers syndrome and screening for pancreatic
cancer. Br J Surg 93(12): 1446-1455
Lin Y et al. (2005) Nutritional factors and risk of pancreatic cancer: a populationbased case-control study based on direct interview in Japan. J Gastroenterol
40(3): 297-301.
Lindkvist B et al. (2008) A prospective study of Helicobacter pylori in relation to the
risk for pancreatic cancer. BMC Cancer 8: 321.
Lowenfels AB et al. (1997) Hereditary pancreatitis and the risk of pancreatic cancer.
International Hereditary Pancreatitis Study Group. J Natl Cancer Inst 89(6): 442-446
Ludwig E et al. (2011) Feasibility and yield of screening in relatives from familial
pancreatic cancer families. Am J Gastroenterol 106(5): 946-954
Macgregor-Das AM and Iacobuzio-Donahue CA (2013) Molecular pathways in
pancreatic carcinogenesis. J Surg Oncol 107(1): 8-14
Martin SP and Ulrich CD (2000) Pancreatic cancer surveillance in a high-risk cohort.
Is it worth the cost? Med Clin North Am 84(3): 739-747, xii-xiii
Moran A et al. (2012) Risk of cancer other than breast or ovarian in individuals with
BRCA1 and BRCA2 mutations. Fam Cancer 11(2): 235-242
Permuth-Wey J and Egan KM (2009) Family history is a significant risk factor for
pancreatic cancer: results from a systematic review and meta-analysis. Fam
Cancer 8(2): 109-117
Poley JW et al. (2009) The yield of first-time endoscopic ultrasonography in screening
individuals at a high risk of developing pancreatic cancer. Am J Gastroenterol
104(9): 2175-2181
Poruk KE et al. (2013) Screening for pancreatic cancer: why, how, and who? Ann Surg
257(1): 17-26
Raimondi S et al. (2010) Pancreatic cancer in chronic pancreatitis; aetiology,
incidence, and early detection. Best Pract Res Clin Gastroenterol 24(3): 349-358
Vroege ontdekking van adenocarcinoom van de alvleesklier
113
Raptis DA et al. (2010) Clinical presentation and waiting time targets do not affect
prognosis in patients with pancreatic cancer. Surgeon 8(5): 239-246
Rubenstein JH et al. (2007) A clinical and economic evaluation of endoscopic
ultrasound for patients at risk for familial pancreatic adenocarcinoma.
Pancreatology 7(5-6): 514-525
Roggin et al. (2010) Pancreatic cystic neoplasm. Curr Probl Chir 47(6): 459-510
Ruijs MW et al. (2010) TP53 germline mutation testing in 180 families suspected of LiFraumeni syndrome: mutation detection rate and relative frequency of cancers
in different familial phenotypes. J Med Genet 47(6): 421-428
Rulyak SJ et al. (2003) Cost-effectiveness of pancreatic cancer screening in familial
pancreatic cancer kindreds. Gastrointest Endosc 57(1): 23-29
Safi F et al. (1997) Diagnostic value of CA 19-9 in patients with pancreatic cancer and
nonspecific gastrointestinal symptoms. J Gastrointest Surg 1(2): 106-112
Sawai Y et al. (2010) Development of pancreatic cancers during long-term follow-up
of side-branch intraductal papillary mucinous neoplasms. Endoscopy 42(12): 10771084
Tada M et al. (2006) Pancreatic cancer in patients with pancreatic cystic lesions: a
prospective study in 197 patients. Clin Gastroenterol Hepatol 4(10): 1265-1270
Tanaka M et al. (2012) International consensus guidelines 2012 for the management of
IPMN and MCN of the pancreas. Pancreatology 12(3): 183-197
Thompson D et al. (2002) Cancer Incidence in BRCA1 mutation carriers. J Natl Cancer
Inst 94(18): 1358-1365
Topilow AA et al. (2011) Confirmation of a potential biomarker for early-stage
pancreatic cancer. Cancer Biomark 10(1): 27-33
Uehara H et al. (2008) Development of ductal carcinoma of the pancreas during
follow-up of branch duct intraductal papillary mucinous neoplasm of the
pancreas. Gut 57(11): 1561-1565
Vasen HF et al. (2011) Magnetic resonance imaging surveillance detects early-stage
pancreatic cancer in carriers of a p16-Leiden mutation. Gastroenterology 140(3):
850-856
Verna EC et al. (2010) Pancreatic cancer screening in a prospective cohort of high-risk
patients: a comprehensive strategy of imaging and genetics. Clin Cancer Res
16(20): 5028-5037
Vogelstein B et al. (2013) Cancer genome landscapes. Science 339(6127): 1546-1558
Wang F et al. (2006) Diabetes mellitus and pancreatic cancer in a population-based
case-control study in the San Francisco Bay Area, California. Cancer Epidemiol
Biomarkers Prev 15(8): 1458-1463
Winter JM et al. (2006) Periampullary and pancreatic incidentaloma: a single
institution’s experience with an increasingly common diagnosis. Ann Surg 243(5):
673-680; discussion 680-673
Xu JH et al. (2013) Hepatitis B or C viral infection and risk of pancreatic cancer: a metaanalysis of observational studies. World J Gastroenterol 19(26): 4234-4241
Yachida S and Iacobuzio-Donahue CA (2013) Evolution and dynamics of pancreatic
cancer progression. Oncogene 32(45): 5253-5260
Yachida S et al. (2010) Distant metastasis occurs late during the genetic evolution of
pancreatic cancer. Nature 467(7319): 1114-1117
Zubarik R et al. (2011) Screening for pancreatic cancer in a high-risk population with
serum CA 19-9 and targeted EUS: a feasibility study. Gastrointest Endosc 74(1):
87-95
114
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Vroege ontdekking van adenocarcinoom van de alvleesklier
115
‘Zolang nieuwe en agressieve
behandelingen de prognose van
eierstokkanker niet verbeteren, is
een andere strategie nodig om deze
killing disease een halt toe te roepen.
Dit rapport toont aan dat KWF
patiënten met tumoren met een
slechte prognose, zoals
eierstokkanker, niet in de kou laat
staan.’
Prof. dr. René Verheijen
5
roege ontdekking van epitheliale
V
eierstokkanker
5.1
Inleiding
Eierstokkanker is in Nederland de zevende vaakst voorkomende kankersoort bij
vrouwen, verantwoordelijk voor circa 3% van alle nieuw gediagnosticeerde kanker­
gevallen bij vrouwen. Eierstokkanker is de vijfde doodsoorzaak als gevolg van kanker
bij vrouwen, verantwoordelijk voor 2% van alle sterfgevallen door kanker. In 2012
waren er 1.288 nieuwe gevallen van eierstokkanker en stierven er 1.028 aan deze ziekte
(IKNL, geraadpleegd 2013; Cijfersoverkanker.nl).
In de afgelopen twintig jaar is het absolute aantal patiënten met de diagnose
epitheliale eierstokkanker (70-80% van alle eierstoktumoren) in Nederland vrijwel
stabiel gebleven (1084 patiënten per jaar in 1989 en 1073 patiënten per jaar in 2011).
Pogingen tot vroege ontdekking en nieuwe therapeutische benaderingen gericht
op het verlagen van de mortaliteit zijn de afgelopen twintig jaar weinig succesvol
geweest.
Eierstokkanker wordt vaak in een laat stadium ontdekt. Doordat eierstokkanker
zich aanvankelijk alleen uitbreidt door expansie van de tumor in de eierstok, meestal
zonder ingroei in structuren en organen, krijgen patiënten vaak pas laat klachten.
Pijn is over het algemeen een laat symptoom. Echter ook als eierstokkanker wel in
een vroeg stadium wordt ontdekt, is de behandeling niet altijd curatief. Minder dan
40% (gemiddeld over alle stadia) geneest van eierstokkanker (Romero and Bast 2012).
Eierstokkanker heeft dus nog steeds een slechte prognose.
Eierstokkanker is niet één ziekte, maar kent verschillende histologische typen
met ieder hun eigen oorsprong en ontwikkelingswijze. Van alle eierstoktumoren
is ca. 5-15% familiair of erfelijk en het overige deel sporadisch. Dit hoofdstuk richt
zich op de mogelijkheden van vroege ontdekking van epitheliale eierstokkanker.
De epitheliale maligniteiten van de eierstok worden, afhankelijk van ontstaan en
ontwikkeling, onderverdeeld in type-I- en type-II-tumoren. De type-I-tumoren
zijn langzaam groeiende tumoren die vaak in een vroeg stadium worden ontdekt
en een betere prognose hebben dan de snel groeiende type-II-tumoren, die bijna
altijd in een laat stadium worden ontdekt. Type-II-tumoren brengen meer van het
eiwit CA-125 tot expressie dan type-I-tumoren. Daardoor is CA-125 als biomarker
beter bruikbaar voor de agressievere type-II-tumoren. Omdat type-I-tumoren
zich vaak langzaam ontwikkelen als een in omvang groter wordende tumor in het
ovarium kunnen deze tumoren soms vroegtijdig ontdekt worden door transvaginale
echografie (TVE).
Tot de type-I-tumoren behoren laaggradig sereuze, laaggradig endometrioide,
mucineuze en clear-celltumoren. Hooggradig sereuze en hoog-gradige
endometrioide tumoren en carcinosarcoma behoren tot type-II-tumoren. Het
hooggradig sereus adenocarcinoom is de meest voorkomende vorm van epitheliale
eierstokkanker. Van de totale groep sereuze eierstoktumorenkankers is 25% een
type-I-tumor en 75% een type-II-tumor.
Vroege ontdekking van epitheliale eierstokkanker
117
Teneinde zowel langzaam- als snelgroeiende tumoren vroegtijdig te ontdekken
zijn screeningsprogramma’s ontworpen die gebruik maken van zowel de CA-125
biomarker als beeldvormende technieken. Evaluatie van deze screeningsmethode
wordt momenteel onderzocht in een aantal grootschalige trials. De overlevingswinst
is het grootst wanneer we in staat zouden zijn om de type-II-tumoren in een vroeg
stadium (FIGO I of IIa) te ontdekken.
Leeswijzer hoofdstuk
Dit hoofdstuk is als volgt opgebouwd: Allereest wordt de huidige kennis m.b.t. het
ontstaan en de ontwikkeling van eierstokkanker beschreven. Aan de hand van een
casus worden de dilemma’s m.b.t de vroegdiagnostiek van deze tumorsoort geïllus­
treerd. Vervolgens wordt op basis van een analyse van gegevens uit de Nederlandse
Kankerregistratie (NKR) ingegaan op het vóórkomen van eierstokkanker en wordt
het stadium bij diagnose in relatie tot zowel behandelingsmogelijkheden als over­
leving gepresenteerd. Deze inleidende paragrafen (paragraaf 1 t/m 5) onderstrepen
het belang van het ontdekken van eierstokkanker in een eerder stadium. Indien
men uitsluitend geïnteresseerd is in de stand van zaken van de wetenschappelijke
kennis en klinische praktijk van vroege ontdekking bij epitheliale eierstokkanker
is het tweede deel van dit hoofdstuk relevant (vanaf paragraaf 6). Hierin wordt het
resultaat van de analyse van verschillende aspecten van vroege ontdekking (risico­
factoren, klachten en symptomen, terugdringen van patient en doctor’s delay,
screening en surveillance en de mogelijke gezondheidswinst na vroege ontdekking)
beschreven en een kort (niet uitputtend) overzicht van voor dit rapport relevante
lopende (inter)nationale projecten gepresenteerd. Het hoofdstuk sluit af met een
paragraaf met conclusies en aanbevelingen (paragraaf 8). Hierin wordt ingegaan op
de implicaties voor de praktijk en voor onderzoek, maar ook op de knelpunten en
kansen t.a.v. vroege ontdekking van epitheliale eierstokkanker. Het hoofdstuk wordt
afgesloten met tumorspecifieke aanbevelingen.
5.2
Ontstaan en ontwikkeling van
eierstokkanker
5.2.1
Ontstaan van eierstokkanker
Lange tijd is verondersteld dat de ontwikkeling van epitheliale eierstokkanker in het
eierstokepitheel (aan het oppervlak of uit cystes) begint. Er is echter nog nooit een
precursorlaesie in de eierstok gevonden. Wel zijn er premaligne laesies, sereuze tubaire
intraepitheliale carcinomen (STIC’s) genaamd, in de distale eileider (tuba) gevonden en
daardoor wordt de distale tuba tegenwoordig als startplaats van carcinogenese van
hooggradig sereuze eierstokkanker (type II) aangemerkt (Piek et al. 2001).
Er zijn inmiddels in toenemende mate aanwijzingen dat type I en type II epitheliale
eierstoktumoren zich onafhankelijk van elkaar ontwikkelen, volgens verschillende
moleculaire pathways.
Type-I-tumoren staan bekend om een stapsgewijze ontwikkeling, die lijkt op de
stapsgewijze ontwikkeling van het colorectale carcinoom (Kurman, 2010). Ze zijn
relatief genetisch stabiel. Elk histologisch type (resp. laaggradig sereus, laaggradig
endometrioid, mucineus en clear-cell) heeft een eigen moleculair genetisch profiel.
118
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Figuur 5.1: Oorsprong en histologische subtypen van eierstokkanker in relatie met
Type-I- en Type-II-classificatie.
* Laaggradig sereuze kanker
** Hooggradig sereuze kanker
Reprinted with permission from: Vaughan et al. (2011) Rethinking ovarian cancer: recommendations for
improving outcomes. Nat Rev Cancer 11(10): 719-25
Typisch mutaties komen voor in KRAS, BRAF, PTEN en sporadisch TP53. Deze
tumoren zijn bij presentatie beperkt tot de ovaria, worden vaak in een vroeg stadium
(FIGO I en IIa) ontdekt en groeien traag over het algemeen.
Type-II-tumoren zijn chromosomaal zeer instabiel en moleculair zeer homogeen. Ze
bevatten in bijna alle gevallen (meer dan 80%) TP53-mutaties. Deze tumoren vertonen
morfologisch subtiele verschillen (papillaire, glandulaire en solide patronen), waardoor
ze tot de komst van de immuunhistochemie pathologisch moeilijk te onderscheiden
waren en men deze tumoren een lange tijd als een ‘single disease’ heeft beschouwd.
Het betreft zeer agressieve tumoren, die zich snel ontwikkelen en zich daardoor bijna
altijd in een laat stadium (FIGO III-IV) presenteren.
5.2.2
Aannames m.b.t. natuurlijk beloop en consequenties voor vroege ontdekking
Om meer inzicht te verkrijgen in het natuurlijke beloop van sereuze tumoren,
waarvan het merendeel tot de type-II-tumoren behoort, is een simulatiemodel
ontworpen op basis van een uitgebreide analyse van gepubliceerde gegevens over
Vroege ontdekking van epitheliale eierstokkanker
119
sereuze type eierstokkanker in BRCA1-mutatiedragers (Brown and Palmer 2009). Er
zijn geen aanwijzingen dat het natuurlijk beloop bij sporadische en andere erfelijke
en/of familiaire vormen van eierstokkanker anders is dan het beschreven model
(Brown and Palmer 2009). Volgens dit model ontstaan hooggradige sereuze tumoren
gemiddeld 5,1 jaar voor de klinische diagnose. Gemiddeld 0,8 jaar voor klinische
diagnose is er progressie van een vroeg stadium (FIGO I-II) naar een gevorderd
stadium (FIGO III-IV). Er zou bijgevolg een ‘window of opportunity’ van 4,3 jaar zijn
voor het ontdekken van een vroeg stadium van sereuze eierstoktumoren. Dit model
geeft aan dat tumoren in een vroeg stadium gedurende meer dan 90% van het
‘window of opportunity’ kleiner dan 0,9 cm blijven (te klein om met beeldvormende
technieken zoals transvaginale echografie te detecteren). Meer dan 50% van de
tumoren vertoont progressie naar een gevorderd stadium voordat ze drie cm zijn.
Berekend is dat detectie van sereuze tumoren voordat ze stadium III hebben bereikt,
vraagt om een methode die tumoren van 0,4 cm in diameter (bij sensitiviteit van
80%) kan detecteren, middels een jaarlijkse screening bij een niet geselecteerde
populatie. Met een jaarlijkse screening op basis van een screeningstest die tumoren
van 0,5 cm in diameter kan ontdekken, zou volgens dit model de sterfte aan sereuze
eierstokkanker met 50% te reduceren zijn.
5.3
Casuïstiek van een patiënt
Onderstaande casus illustreert dat eierstokkanker vaak laat klachten geeft en
daardoor meestal in een laat stadium wordt gediagnosticeerd.
Casus
Een 63-jarige vrouw heeft de afgelopen maanden een langzaam dikker wordende buik bemerkt. Pas
de laatste week is dat ook haar omgeving (echtgenoot en dochter) opgevallen. Ze bezoekt op hun
aandringen de huisarts. Bij navraag door de huisarts had ze de laatste twee maanden wat minder
zin in eten en is ze ongeveer vier kilogram afgevallen. Afgezien van wat vermoeidheid heeft zij
verder nergens last van, met name heeft ze geen buikpijn, is niet misselijk en zijn er geen plas- of
ontlastingsproblemen.
Ze is actief als vrijwilligster. Tweemaal per week past ze op de kinderen van haar dochter. Ze rookt
niet en drinkt geen alcohol. Ze woont samen met haar echtgenoot die nog werkzaam is. Zij doet
haar boodschappen per fiets en wandelt regelmatig één tot anderhalf uur.
Bij lichamelijk onderzoek door de huisarts valt met name de dikke buik op, bij een vrouw met enig
overgewicht.
De huisarts vraagt een echo-abdomen aan in het naburige ziekenhuis. Daarop wordt een ruimte
innemend proces gezien van zestien cm en wat ascites. Onder verdenking van eierstokkanker
verwijst hij haar door naar de poli gynaecologische oncologie van het dichtstbijzijnde academisch
ziekenhuis. Bij de gynaecoloog is de anamnese conform.
Familie-anamnese is niet bijdragend, met name komt er geen borst- of eierstokkanker in de familie
voor. Onderzoek toont een niet zieke vrouw met matig overgewicht. Er is een demping hoorbaar bij
percussie van de bovenbuik. Er wordt een zwelling vastgesteld in de onderbuik tot twee cm boven
de navel. Het onderzoek is niet pijnlijk.
Inwendig onderzoek vertoont een normaal grote uterus en een elastische zwelling in het cavum
Douglasi die net bereikbaar is. Echoscopisch onderzoek laat naast een complexe cyste van zestien
120
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
bij veertien cm met papillaire formaties, een ruime hoeveelheid vrij vocht zien. Bloedonderzoek
toont een normaal bloedbeeld en normale lever- en nierfuncties, bij een sterk verhoogd CA-125. Een
CT-scan van de buik toont naast een groot ruimte innemend proces, waarschijnlijk uitgaand van
de rechter eierstok, ook veel ascites en aanwijzingen voor omentale en peritoneale metastasen. Er
worden geen afwijkingen in lever of milt gezien.
5.4
Vóórkomen van eierstokkanker
Eierstokkanker komt vooral voor bij vrouwen op oudere leeftijd: de gemiddelde
leeftijd bij diagnose is 64 jaar, en 26% van de patiënten is ten tijde van de diagnose 75
jaar of ouder. Het merendeel van de eierstoktumoren bestaat uit sereuze tumoren
(tabel 5.1).
In de afgelopen twintig jaar is het absolute aantal patiënten met de diagnose
epitheliaal eierstokkanker in Nederland vrijwel stabiel gebleven, ca. 1070 patiënten
per jaar.
Figuur 5.2 toont het vóórkomen van eierstokkanker ten opzichte van andere
gynaecologische tumoren in Nederland (naar leeftijdsgroep). Hierin is te zien
dat eierstokkanker na baarmoederkanker de meest voorkomende vorm van
gynaecologische kanker is. In de algemene Nederlandse populatie bedraagt het risico
voor vrouwen op eierstokkanker 0,5% tot 65-jarige leeftijd en 1% tot tachtigjarige
leeftijd, in de periode 2005-2009 (IKNL, geraadpleegd 2013; cijfersoverkanker.nl).
2000
aantal patiënten
1600
1200
800
400
0
schaamlippen
vagina
0-59 jaar
70-79 jaar
60-69 jaar
80+ jaar
baarmoederhals
baarmoederlichaam
eierstok
Figuur 5.2: Aantal nieuwe patiënten met verschillende gynaecologische tumoren in
Nederland in 2011.
Vroege ontdekking van epitheliale eierstokkanker
121
5.5
Stadiumverdeling bij diagnose in relatie tot behandeling en overleving
5.5.1
Stadium en diagnostiek
In tabel 5.1 en figuur 5.3 wordt de stadiumverdeling van patiënten naar FIGOstadium (appendix 2.2) weergegeven. Slechts bij ongeveer 21% van alle patiënten
lijkt eierstokkanker op het moment van diagnose beperkt gebleven tot de
eierstokken zelf (FIGO-stadium I). De stadiumverdeling is de afgelopen tien jaar
vrij stabiel gebleven. De sereuze tumoren (sereus en adenocarcinoom ‘niet nader
gespecificeerd’) worden duidelijk veel minder vaak in een vroeg stadium ontdekt
(< 20%) dan de langzaam groeiende type-I-tumoren (mucineus, endometroid, clearcell) (> 45%) (figuur 5.3).
Tabel 5.1: Patiënt- en tumorkenmerken van patiënten met eierstokkanker*, naar periode.
Leeftijd
18-60 jaar
60-74 jaar
≥ 75 jaar
Histologie
Sereus
Mucineus
Endometrioïd
Clear-cell
Adeno nos
Overig
FIGO-stadium
I
II
III
IV
onbekend
geen PA bevestiging
Totaal
N=9626 (%)
2003-2005
N=3118 (%)
2006-2008
N=3231 (%)
2009-2011
N=3277 (%)
3371 (35)
3740 (39)
2515 (26)
1170 (37)
1205 (39)
743 (24)
1171 (36)
1215 (38)
845 (26)
1030 (31)
1320 (40)
927 (28)
4413 (46)
880 (9)
1032 (11)
530 (6)
2225 (23)
546 (6)
1372 (44)
332 (11)
312 (10)
170 (5)
772 (25)
160 (5)
1508 (47)
261 (8)
374 (12)
185 (6)
727 (23)
176 (5)
1533 (47)
287 (9)
346 (11)
175 (5)
726 (22)
210 (6)
2050 (21)
754 (8)
4358 (45)
2058 (21)
111 (1)
295 (3)
731 (23)
240 (8)
1406 (45)
613 (20)
44 (1)
84 (3)
657 (20)
263 (8)
1470 (46)
701 (22)
42 (1)
98 (3)
662 (20)
251 (8)
1482 (45)
744 (23)
25 (1)
113 (3)
* Uitsluitend tumoren van de ovaria zijn geïncludeerd (niet van de tubae en geen extra-ovariële tumoren).
Bron: IKNL© 2013.
5.5.2
122
Stadium en behandeling
Tabel 5.2 toont de behandelingsmethoden van patiënten met eierstokkanker
voor drie periodes. De meerderheid van de patiënten met eierstokkanker wordt
behandeld met chirurgie of een combinatie van chirurgie en chemotherapie. De mate
waarin de verschillende behandelingen werden toegepast, is in de laatste tien jaar
stabiel gebleven.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
100
percentage
80
60
40
20
sereus
mucineus
laag stadium (tm IIa)
endometrioïd
clear-cell
’09-’11
’03-’05
adeno nos
’06-’08
’06-’08
’09-’11
’03-’05
’06-’08
’09-’11
’03-’05
’09-’11
’06-’08
’03-’05
’06-’08
’09-’11
’03-’05
’09-’11
’03-’05
’06-’08
0
overig
onbekend
hoog stadium (IIb+)
Figuur 5.3: Stadiumverdeling (FIGO) van patiënten met eierstokkanker, naar type en
periode.
Tabel 5.2: Behandeling van patiënten met eierstokkanker, naar stadium (laag/hoog)
en naar periode.
Behandeling
Geen
Chirurgie2
Chirurgie+chemotherapie
Chemotherapie
Overig
Behandeling (laag stadium, t/m FIGO IIA)1
Geen/overig
Chirurgie
Chirurgie+chemotherapie
Behandeling (hoog stadium, FIGO IIB+)1
Geen chirurgie/chemotherapie
Debulking
Primaire debulking+ chemotherapie
Interval debulking
Alleen chemotherapie
1
2
Totaal
N=9626 (%)
2003-2005
N=3118 (%)
2006-2008
N=3231 (%)
2009-2011
N=3277 (%)
1076 (11)
1783 (19)
5859 (61)
832 (9)
76 (1)
327 (10)
601 (19)
1901 (61)
266 (9)
23 (1)
366 (11)
599 (19)
1977 (61)
263 (8)
26 (1)
383 (12)
583 (18)
1981 (60)
303 (9)
27 (1)
19 (1)
1309 (60)
838 (39)
9 (1)
418 (54)
343 (45)
4 (1)
438 (62)
259 (37)
6 (1)
453 (65)
236 (34)
1083 (15)
459 (6)
2903 (40)
2089 (28)
815 (11)
321 (14)
175 (8)
1091 (47)
458 (20)
259 (11)
371 (15)
156 (6)
1050 (42)
655 (26)
256 (10)
391 (15)
128 (5)
762 (30)
976 (38)
300 (12)
111 patiënten met stadium onbekend (X) zijn geëxcludeerd.
Chirurgie: ovariëctomie/tubectomie, totaalextirpatie.
Bron: IKNL© 2013.
Vroege ontdekking van epitheliale eierstokkanker
123
100
90
80
percentage
70
60
50
40
30
20
10
0
I
II
III
IV
FIGO
chirurgie
overig
chirurgie en chemotherapie
geen
geen PA
bevestiging
onbekend
chemotherapie
Figuur 5.4: Behandeling van patiënten met eierstokkanker, naar FIGO-stadium, in de
periode 2010-2011.
Bijna alle patiënten met FIGO-stadium I en II en het merendeel van de patiënten met
stadium III worden behandeld, voornamelijk met chirurgie al dan niet in combinatie
met chemotherapie, terwijl ca. 60% van de patiënten met stadium IV en patiënten
bij wie geen weefselonderzoek (PA) is afgenomen deze behandelingen ondergaan
(figuur 5.4). Patiënten in deze laatste groepen krijgen vaker alleen chemotherapie of
geen behandeling.
De behandeling van patiënten met een laag stadium eierstokkanker (FIGO-stadium
I en IIa) bestaat uit chirurgie (ovariëctomie/tubectomie, totaalextirpatie) al dan niet
aangevuld met chemotherapie. Het percentage patiënten met een laag stadium dat
een combinatie van chirurgie en chemotherapie ondergaat, is de afgelopen jaren
gedaald (van 45% in de periode 2003-2005 naar 34% in de periode 2009-2011), terwijl
het aantal patiënten dat alleen chirurgisch is behandeld is gestegen (tabel 5.2, figuur
5.5). Bij patiënten met een hoog stadium eierstokkanker is het percentage chirurgie
licht gedaald. Er heeft de afgelopen tien jaar een verschuiving plaatsgevonden van
primaire debulkingoperatie naar interval-debulkingoperatie (tabel 5.2).
5.5.3
124
Stadium en overleving
Uit figuur 5.6 blijkt dat eierstokkanker de slechtste overleving van de gynaecologische
tumoren heeft. Na vijf jaar is iets meer dan één op de drie vrouwen met eierstok­
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
100
90
80
70
60
50
40
30
20
10
0
100
90
80
percentage
70
60
50
40
30
20
10
0
’03-’05
’06-’08
’09-’11
stadium I/IIA
’03-’05
’06-’08
’09-’11
stadium IIB/IV
chirurgie
overig
chirurgie en chemotherapie
geen
chemotherapie
Figuur 5.5: Behandeling van patiënten met eierstokkanker in de tijd, naar FIGO-stadium, in de periode 2003-2011.
kanker nog in leven (kanker.nl). De relatieve 5-jaarsoverleving van patiënten met
eierstokkanker (alle stadia samen) is in de afgelopen jaren weliswaar iets gestegen
(van 32% in de periode 1989-1994 naar 35% in 2006-2010), maar nog steeds laag (IKNL,
geraadpleegd 2013; Cijfersoverkanker.nl).
Van alle histologische typen eierstokkanker heeft sereuze eierstokkanker (en
adenocarcinoom nos, vaak behorend tot het sereuze type) de slechtste prognose
(onderste twee lijnen in figuur 5.7). Het merendeel van sereuze eierstokkanker is
hooggradig (dat wil zeggen type-II-eierstoktumoren). Endometroid, clear-cell en
mucinues, meestal behorend tot de laaggradige type-I-eierstoktumoren, hebben de
beste prognose.
Tabel 5.3 toont de overleving één, drie en vijf jaar na de diagnose van patiënten
met eierstokkanker. Ondanks verbeteringen in behandeling en diagnostiek is de
5-jaarsoverleving van patiënten met een eierstokkanker nog steeds slecht. Het
afgelopen decennium laten de overlevingscijfers vrijwel geen verbetering zien.
De overleving van patiënten met eierstokkanker is sterk afhankelijk van het stadium.
De 1-jaarsoverleving is 94% bij stadium I, maar is slechts 50% bij patiënten met
stadium IV. Het verschil in overleving tussen de stadia is beduidend groter bij de
3-jaars- en 5-jaarsoverleving.
Vroege ontdekking van epitheliale eierstokkanker
125
100
90
80
70
60
50
40
30
20
10
0
100
90
80
overleving (%)
70
60
50
40
30
20
10
0
1
2
3
4
5
jaren na diagnose
baarmoederlichaam
schaamlippen
vagina
eierstok
baarmoederhals
Figuur 5.6: Overleving van verschillende gynaecologische tumoren.
Tabel 5.3: 1-, 3-, en 5-jaarsoverleving van patiënten met eierstokkanker naar FIGO-stadium en leeftijd (periode 2003-2011).
N
Stadium
Periode
Bron:
126
1-jaar
3-jaar
5-jaar
I-IV, incl. X
28368
70%
46%
35%
I
6707
94%
85%
78%
II
2273
83%
63%
52%
III
11788
67%
35%
19%
IV
4489
50%
19%
10%
onbekend
572
43%
29%
25%
geen PA bevestiging 2539
50%
23%
13%
‘03-’05
3607
72%
48%
36%
‘06-’08
3793
73%
47%
35%
‘09-’11
3853
73%
47%
IKNL© 2013.
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
100
90
80
overleving (%)
70
60
50
40
30
20
10
0
1
2
3
4
5
jaren na diagnose
sereus
mucineus
clear-cell
adeno nos
endometrioïd
overig
Figuur 5.7: Overleving van eierstokkanker naar type histologie.
5.6
Stand van zaken m.b.t. verschillende
invalshoeken van vroege ontdekking
Op basis van de zoektermen gebaseerd op de onderzoeksvragen (zie hoofdstuk 2)
werden 1379 artikelen in de systematische literatuurstudie gevonden (vanaf 2002
tot 2013), waarvan 333 artikelen beoordeeld moesten worden. Uiteindelijk bleken
54 artikelen empirische studies te betreffen (waarvan sommige meta-analyses van
oorspronkelijke studies) die van toepassing waren op onze vier vraagstellingen.
Dit hoofdstuk richt zich op epitheliale eierstokkanker. In verband met de
leesbaarheid zal veelal de aanduiding ‘eierstokkanker’ gebruikt worden.
5.6.1
Risicofactoren voor eierstokkanker in de algemene populatie
In de literatuur zijn verschillende factoren beschreven die het risico op het ontwikkelen
van eierstokkanker beïnvloeden (tabel 5.4). De bekendste is het gebruik van de anti­
conceptie­pil dat gerelateerd is aan een halvering van het risico (Bell et al. 1998).
Ongeveer 10% van de epitheliale eierstoktumoren en 24% van de sereuze type-IIeierstoktumoren hebben een erfelijke basis. Bekende genetische predispositiegenen
zijn BRCA1 en BRCA2 (zie paragraaf 5.6.4.2).
Vroege ontdekking van epitheliale eierstokkanker
127
Tabel 5.4: Risicofactoren voor eierstokkanker in de algemene populatie.
Risicofactor
OR
Studie (jaar)
Roken
(bij > 1 pakje/dag)
2,9 (alleen bij mucineuze
eierstokkanker, geen associatie
tussen roken en andere typen
eierstokkanker)
Zhang et al. (2004)
Lichaamsbeweging
(verhoogde kans bij 2x per week bewegen
op leeftijd 15-35)
1,4-1,7
Carnide et al. (2009)
Inname van voedingsvezels
0,77-0,96
Silvera et al. (2007a)
Drinken van koffie en thee
1-1,6
Silvera et al. (2007b)
BMI (per 5 units)
1,06
(1,02-1,11)
WCRF (2014)
Anticonceptiepil bij gebruik van 5 jaar
50% verlaagd risico (0,66)
Risch (1983);
Cochrane review van Bell (1998)
Nullipariteit
Verdubbelt het risico; bij elke
levend geboren kind daalt het
risico
Schorge (2010)
Permuth-Wey (2009)
2,79
2,16
2,05
Shields et al. (2002)
Geen effect
Cosgrove et al. (2011);
Dublin et al. (2002)
Leeftijd bij menarche
Lengte bij menarche
Geen effect
Geen effect
Jordan et al. (2005)
Late menopauze
Verhoogd risico
Schorge (2010)
Leefstijl
Beroep en beroepsblootstelling
Chocolate and candy workers
Paper and packaging workers
Mechanical, chemical, other technical
field work
Geneesmiddelen
Antidepressiva- en benzodiazepinegebruik
Individueel bepaalde factoren
OR = odds ratio. OR > 5 betekent een relevant risico.
5.6.2
128
Klachten en symptomen
Vaak hebben patiënten al langere tijd last van aspecifieke (vage) klachten zoals een
vol gevoel in de buik, vage pijnklachten, dikker wordende buik en gewichtsverlies.
Eierstokkanker is dan vaak al in een gevorderd stadium. De vraag is of er specifieke
klachten en/of symptomen zijn die kunnen wijzen op eierstokkanker in een vroeg
stadium.
De voorspellende waarde van een groot aantal symptomen (en andere factoren,
zoals leeftijd) is onderzocht in een grote prospectieve studie onder 2,3 miljoen
huisartspatiënten op basis van de registratiesystemen van 375 huisartspraktijken
in Engeland (Hippisley-Cox and Coupland 2012). Onafhankelijke predictoren waren
hogere leeftijd, familiegeschiedenis van eierstokkanker (RR 9,8), bloedarmoede
(anaemia) (RR 2,3), buikpijn (RR 7), opgezette buik (RR 23), rectale bloeding (RR 2),
postmenopauzale bloeding (RR 6,6) en eetlustverlies (RR 5,2). Er is een algoritme op
basis van deze factoren ontwikkeld waarmee het individuele risico (hoog of laag) op
eierstokkanker kan worden berekend. Patiënten die tot de hoogrisicogroep behoren
(10% van alle patiënten) hadden 0,8% kans op eierstokkanker (positief voorspellende
waarde). Met dit algoritme kon weliswaar meer dan de helft van de eierstoktumoren
worden gevonden (sensitiviteit 63,2%), maar de specificiteit was relatief laag
(90,8%). Een groot aandeel van de vrouwen met een hoogrisicoscore moest onnodig
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tabel 5.5: De voorspellende waarde van klachten en symptomen voor vroege stadia
van eierstokkanker (case-control studies).
Klachten
Sensitiviteit
Specificiteit
Cases
Controles
Studie
Vroege stadia:
56,7%
Late stadia:
79,5%
Specificiteit van
vroege en late
stadia niet
gerapporteerd,
overall:
86,7% (< 50 jaar)
90% (50 jaar en
ouder)
Vrouwen met
operatie i.v.m.
gezwel in de buik
(N = 149)
Gezonde, hoog
risico groep
geworven via
OCEDS en
vrouwen die
ultrasound
ondergingen
(N = 488)
Goff et al. (2007)
Vroege stadia:
62,3%
Late stadia:70,7%
Vroege stadia:
94,9%,
late stadia:
94,9%
Interviews bij
vrouwen met
eierstokkanker
(NKR, N = 812)
population-based
Random selectie;
vrouwen zonder
geschiedenis van
eierstokkanker
(N = 1313);
population-based
Rossing et al.
(2010)
Vroege stadia:
55,1-73,3%
Late stadia:
67,0-78,3%
Specificiteit van
vroege en late
stadia niet
gerapporteerd,
overall: 89,7-98,9%
Vrouwen met
eierstokkanker uit
UK OCPS
(N = 149)
Random
geselecteerde
controlegroep
(N = 268)
Lim et al. (2012)
Goff-index*
Andere symptomenindex
Consensus
criteria**
Vroege stadia:
58,6%,
late stadia:
69,3%
Vroege stadia:
93,9%,
late stadia:
93,9%
Interviews bij
vrouwen met
eierstokkanker
(NKR, N = 812)
population-based
Random selectie;
vrouwen zonder
geschiedenis van
eierstokkanker
(N = 1313);
population-based
Rossing et al.
(2010)
Symtomenindex 1***
Niet gerappor­
teerd voor vroege
en late stadia
Niet gerappor­
teerd voor vroege
en late stadia
Vrouwen met
eierstokkanker uit
UK OCPS
(N = 149)
Random
geselecteerde
controlegroep
(N = 268)
Lim et al. (2012)
Overall
Index 1: 69-91%
Index 2: 67,3-91%
Overall
Index 1: 76-90%
Index 2: 82,4-94%
Symptomenindex 2 ****
*Bekken/buikpijn, opgeblazen gevoel/toegenomen omvang van buik, vol gevoel/moeite met eten, als deze
minstens 1 keer per maand aanwezig zijn en korter dan 12 maanden voor de diagnose (of de referentiedatum bij
de controles) begonnen waren.
**Consensuscriteria waren opgeblazenheid of vol gevoel, bekken- of buikpijn, plasurgentie of vaak moeten
plassen, als deze minstens 1 keer per maand aanwezig zijn en korter dan 12 maanden voor de diagnose (of de
referentiedatum bij de controles) begonnen waren.
***Bekken- of buikpijn, verlies eetlust/vol gevoel, gewichtsverlies, opgezette buik, opgeblazen buik, kan knobbel
in buik voelen, als deze minstens 1 keer per maand aanwezig zijn en korter dan 12 maanden voor de diagnose (of
de referentiedatum bij de controles) begonnen waren.
****Bekken- of buikpijn, verlies eetlust/vol gevoel, opgezette buik, kan knobbel in buik voelen, vaginale
afscheiding, als deze minstens 1 keer per maand aanwezig zijn en korter dan 12 maanden voor de diagnose (of de
referentiedatum bij de controles) begonnen waren.
diagnostisch onderzoek ondergaan, omdat ze geen eierstokkanker bleken te hebben.
Er waren geen gegevens over het stadium van eierstokkanker beschikbaar.
Voor het identificeren van symptomen voor vroege opsporing van eierstokkanker
ontwikkelden Goff et al. (2007) een symptomenindex gebaseerd op frequentie, ernst
en duur van symptomen. De symptomenindex wordt beschouwd als ‘ongunstig’
Vroege ontdekking van epitheliale eierstokkanker
129
als vrouwen minstens één van de zes onderstaande symptomen korter dan twaalf
maanden geleden en meer dan twaalf keer per maand hadden (Goff et al. 2007). Het
betrof de volgende symptomen:
•Pijn in de (onder)buik
- Pijn ter hoogte van bekken
- Pijn ter hoogte van buik
• Opgezwollen buik/opgeblazen gevoel
- Toegenomen buikomvang
- Opgeblazen gevoel
• Vol gevoel
• Moeite met eten
De sensitiviteit van combinaties van deze symptomen voor het ontdekken van vroege
stadia varieerde tussen 56-73% en de specificiteit (in een studie gerapporteerd)
rond de 94% (tabel 5.5). De positief voorspellende waarde van combinaties van
symptomen was laag (1-4%).
In drie andere studies die de voorspellende waarde van een aantal symptomen voor
eierstokkanker hadden onderzocht, was niet nagegaan of deze symptomen ook een
voorspellende waarde hadden voor het ontdekken van kanker in een vroeg stadium
(Hamilton et al. 2009; Lurie et al. 2009; Pavlik et al. 2009). De waarde van deze drie
studies was voor de inventarisatie van dit rapport beperkt.
Conclusies
•Behalve genetische aanleg lijkt er geen duidelijk individueel risicoprofiel te zijn
dat voorspellend is voor eierstokkanker.
•Vroege ontdekking van eierstokkanker aan de hand van klachten en symptomen
of op basis van de aanwezigheid van één of meer andere risicofactoren anders
dan genetisch bepaald, is op dit moment niet mogelijk.
5.6.3
Patient en doctor’s delay
Doordat eierstokkanker vage klachten geeft, gaan patiënten vaak pas naar de
huisarts als de klachten aanhouden. Probleem voor de huisarts is dat de meeste
klachten en symptomen van deze patiënten aspecifiek zijn. Gezien de lage
incidentie van eierstokkanker in de huisartspraktijk (een patiënte per vijf jaar
per huisartspraktijk), is het voor een huisarts moeilijk in te schatten wanneer bij
deze klachten echoscopisch onderzoek moet worden aangevraagd en wanneer
doorverwezen moet worden met een vermoeden op een maligniteit. De vraag is of
patient en/of doctor’s delay van invloed is op de prognose van eierstokkanker.
In de literatuur is weinig gepubliceerd over patient en doctor’s delay bij de diagnose
eierstokkanker. De drie gevonden retrospectieve studies publiceerden over:
•Tijdsduur tussen eerste herinnerde symptomen en eerste bezoek aan de huisarts
(Nagle et al. 2011: Kirwan et al. 2002).
•Tijdsduur tussen tijdstip eerste bezoek (presentatie van symptomen) bij huisarts
en tijdstip van diagnose (Nagle et al. 2011; Tate et al. 2009).
•Tijdsduur tussen eerste huisartsconsult en verwijzing, (Kirwan et al. 2002).
•Tijdsduur tussen diagnose (in ziekenhuis) en behandeling (Kirwan et al. 2002).
Gebruikmakend van de UK General Practice Research Database lieten Tate, Martin et
al. ( 2009) de volgende mediane tijd tussen de eerste rapportage van klachten en de
definitieve diagnose van eierstokkanker in huisartsenregistraties zien:
130
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
•Dertien weken bij de klacht buikpijn (41% van alle gerapporteerde symptomen
voorafgaand aan de diagnose eierstokkanker).
•21 weken voor urogenitale problemen (25%).
•9,5 weken voor opgezette buik (24%).
•8,5 weken voor obstipatie/verandering in de stoelgang (23%).
De mediane tijd tussen eerste huisartsconsult (eerste keer dat patiënt zich met een
klacht bij de huisarts meldt) en diagnose was 19,5 weken.
Belangrijk echter is om na te gaan of een langere tijdsduur tussen het optreden van
eerste symptomen en de diagnose ook effect heeft op de overleving. Dit was in twee
studies onderzocht.
In een case-controlstudie werden 1.463 vouwen met eierstokkanker geïnterviewd
over de symptomen die hadden geleid tot hun diagnose eierstokkanker en werden
gedurende vijf jaar gegevens over de sterfte verzameld (Nagle et al. 2011). Tijd tot aan
de diagnose werd gemeten vanaf de dag van het eerste herinnerde symptoom tot de
datum van diagnose. Lange tijdsduur (> 12 maanden) ten opzichte van korte tijdsduur
((≤ 1 maand) van het eerste herinnerde symptoom tot diagnose bleek geen effect te
hebben op het stadium van eierstokkanker bij diagnose en overleving (hazard ratio
0,94; 95% CI, 0,68-1,3; geen mediane tijden gerapporteerd).
In een retrospectieve studie van huisartsnotities werd bij 135 vrouwen met
eierstokkanker de relatie tussen de overleving en tijdsduur tussen de start van de
symptomen en het eerste huisartsbezoek (patient interval), tijdsduur tussen eerste
huisartsbezoek en de verwijzing (general practice interval) en tijdsduur tussen
ziekenhuisbezoek en behandeling (hospital interval) onderzocht (Kirwan et al. 2002).
De gemiddelde duur van symptomen ten tijde van het ziekenhuisbezoek was 95,3
dagen (SD 15,1). De mediane tijd tussen de verwijzing door de huisarts en het tijdstip
waarop de vrouw het ziekenhuis bezocht was zes dagen (range 0-190). De tijd tussen
de start van de symptomen en de verwijzing had geen invloed op overleving.
In deze studies werd gebruik gemaakt van retrospectief verzamelde gegevens over
eerste symptomen, waardoor er kans bestond op herinneringsbias (recall bias). Dit
wil zeggen dat er kans was dat personen zich sommige opvallende symptomen beter
herinnerden dan andere minder opvallende symptomen.
Conclusie
•Op basis van deze studies zijn er geen duidelijke aanwijzingen voor delay
(vermijdbare vertraging in het vaststellen van de diagnose) noch dat de prognose
van eierstokkanker slechter wordt door patient en/of doctor’s delay.
5.6.4
Screening
De meest onderzochte methoden voor het vroegtijdig ontdekken van eierstokkanker
zijn transvaginale echografie (TVE), transabdominale echografie of een serumtest op
de biomarker CA-125, vaak in combinatie (of sequentieel).
5.6.4.1
Screening in de algemene populatie
Er lopen op dit moment vier grootschalige prospectieve, gecontroleerde
cohortstudies in verschillende stadia van follow-up (zie tabel 5.6).
Vroege ontdekking van epitheliale eierstokkanker
131
Tabel 5.6: Grootschalige screeningsstudies.
Studie
Inclusie
Follow-up
Doelgroep
Screeningsmethode
Prospectieve cohortstudies met controlegroep
Prostate, Lung, Colorectal
and Ovarian Cancer trial
(RCT)
November
1993-juli 2001
Tot 13 jaar
vanaf inclusie
55-74 jaar
Jaarlijks TVE en CA-125
(gedurende 4 jaar),
daarna alleen CA-125
(gedurende 2 jaar)
UK Collaborative Trial of
Ovarian Cancer Screening
(RCT )
April 2001 oktober 2005
Tot 13,8 jaar
vanaf inclusie
Postmenopauzale
vrouwen
Jaarlijkse CA-125
(Geïnterpreteerd met een
Risk of Ovarian Cancer
Algorithm, ROCA) met
TVE als 2e stap,
jaarlijks alleen TVE
Shizuoka Cohort Study of
Ovarian Cancer Screening
(RCT)
September
1995-1999
Tot 17,3 jaar
vanaf inclusie
Asymptomatische
postmenopauzale
vrouwen
Jaarlijks TVE (tot 1990
Transabdominale
ultrasound) en CA-125
Kentucky Ovarian Cancer
Screening Project
(Geen RCT)
December
1987-juli 2011
Tot 23 jaar
vanaf inclusie
Asymptomatische
vrouwen ≥ 50 jaar,
hoogrisicogroep
≥ 25 jaar
Jaarlijks screening met TVE,
interventie uitgevoerd bij
asymptomatische vrouwen
en een hoogrisicogroep
Lu et al. (2013)
4051 asymptomatische
postmenopauzale
vrouwen
Jaarlijks CA-125 (CA-125
risicostratificatie met
UKCTOCSS algoritme) met
TVE als 2e stap
Saito et al (2005)
21.374 asymptomatische CA-602 en CA-546
vrouwen
Andere prospectieve studies
TVE = transvaginale echografie, RCT = gerandomiseerd gecontroleerd onderzoek.
In de literatuur zijn verschillende tussentijdse resultaten m.b.t. de vier lopende,
grootschalige prospectieve cohortstudies gepubliceerd.
132
Prostate, Lung, Colorectal and Ovarian Cancer trial (PLCO)
De detectierate van screening met TVE+CA-125 was 0,6% en de voorspellende waarde
was 1,1% (over alle screeningsronden) (Partridge et al. 2009). Het merendeel (72%) van
de door screening ontdekte tumoren bevond zich in een gevorderd stadium (III/IV)
(Buys et al. 2011; Partridge et al. 2009). De screening leidde niet tot een substantiële
stadiumverschuiving, hetgeen een noodzakelijke voorwaarde is voor het realiseren
van sterftereductie.
Het aandeel sereuze tumoren was vergelijkbaar onder patiënten die via screening
waren ontdekt (58%) en die niet via screening waren ontdekt (66%). Tumoren die via
TVE alleen (dat wil zeggen bij normale CA-125-waarde) waren ontdekt, bevonden zich
vaker in een vroeg stadium (71%; tien van de veertien via TVE ontdekte tumoren).
Daarentegen bevonden de tumoren met verhoogde CA-125-waarden, ongeacht de
TVE uitkomst, zich meestal in een laat stadium (89% van de 27 met normale TVE en
79% van de negentien met abnormale TVE).
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Detectie
Gunstige stadiumverschuiving Detectie Type I/Type II
Sterftereductie
212/34.253 =
detectierate 0,006
Nee
Via screening:
58% Type II,
niet via screening:
66% Type II
Nee
CA-125+TVE: 34/50.078 =
detectierate 0,00067
Nog niet bekend (50% van door
screening ontdekte eierstok­
kankers in stadium I-II)
CA-125+TVE:
15% Type I
85% Type II,
controlegroep: nog niet
bekend
Nog niet bekend
TVE:
33% Type I
67% Type II,
controlegroep: nog niet
bekend
Nog niet bekend
TVE: 24/48.230 =
detectierate 0,00048
47/37.293 =
detectierate 0,0013
Geen significant verschil in
detectie % stadium I tussen
gescreende en controlegroep
Geen significant verschil in
Nog niet bekend
detectie % tussen
gescreende en controlegroep
62/39.293 =
detectierate 0,0016
Ja, maar controlegroep was niet
door random toewijzing
gevormd
Via screening:
21% Type I
79% Type II,
controlegroep: niet
gerapporteerd
Ja, maar controlegroep
was niet door random
toewijzing gevormd
Andere prospectieve studies
4 eierstoktumoren ontdekt Geen controlegroep;
(detectierate 0,0009)
1x stadium IA, 2x stadium IC, en
1x stadium IIB
Geen controlegroep
9 eierstoktumoren ontdekt Geen controlegroep; 4 (van de 9
(detectierate 0,0004
ontdekte eierstoktumoren) in
stadium I
Geen controlegroep
Uiteindelijke werden er 212 eierstoktumoren gevonden in de interventiegroep en 176
tumoren in de controlegroep (Buys et al. 2011). Er waren 118 sterfgevallen (3,1/10.000)
als gevolg van eierstokkanker in de interventiegroep en honderd (2,6/10.000)
in de controlegroep (RR: 1,18, 95% CI 0,91-1,54). De screening had dus niet geleid
tot sterftereductie aan eierstokkanker (Buys et al. 2011). Tevens was er een forse
morbiditeit door onterechte operaties als gevolg van de screening.
Een recente studie berekende of toepassing van een risicoalgoritme (ROCA, risk of
ovarian cancer algorithm) zoals gebruikt in de UKCTOCS-trial (zie hieronder), wel zou
hebben geleid tot sterftereductie (Pinsky et al. 2013). Onder de aanname van bestcase scenario (alle extra tumoren ontdekt door het algoritme blijven leven) en stageshift scenario (alle extra vrouwen met tumoren ontdekt door het algoritme hebben
stadium I/II overleving) leidde dit echter niet tot een significante sterftereductie (RR
0,90 (95% CI: 0,69–1,17) en RR 0,95 (95% CI: 0,74–1,23)), maar geeft wel indicaties dat een
algoritme een betere methode voor vroege ontdekking is dan een standaard cut-offwaarde. In een andere studie waarin gebruik werd gemaakt van het zogenaamde
‘parametric empirical Bays (PEB) longitudinal algoritme’, lieten Drescher et al. (2013)
ook zien dat met PEB eierstokkanker eerder werd ontdekt dan wanneer een vast
Vroege ontdekking van epitheliale eierstokkanker
133
afkapwaarde van CA-125 wordt gehanteerd. In het PEB-algoritme wordt het verloop
van CA-125 in de tijd bij asymptomatische vrouwen gemodelleerd. Hiermee kan
vervolgens per vrouw een individuele afkapwaarde worden vastgesteld, afhankelijk
van haar uitslag op voorgaande screeningen. Met de gegevens in deze studie kon
echter niet worden bepaald of de vroegere ontdekking ook had geleid tot diagnose in
een vroeg stadium of tot sterftereductie.
UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS)
Dit is de grootste nog lopende RCT naar de effectiviteit van screening op eierstok­
kanker onder post-menopauzale vrouwen. Er werden twee screeningsstrategieën
geëvalueerd: screening met TVE en een tweestapsscreening, waarbij het risico op
eierstokkanker aan de hand van veranderingen van het CA-125- niveau over de tijd en
per leeftijd werd vastgesteld (ROCA, risk of ovarian cancer algorithm), gevolgd door
TVE bij vrouwen met een hoge score. De sensitiviteit en specificiteit van screening
met CA-125+TVE op basis van dit algoritme voor risicostratificatie was hoog, resp. 89%
en 99,8%, evenals de sensitiviteit en specificiteit van TVE alleen, namelijk resp. 85% en
98%. Na uitsluiten van borderlinetumoren was de sensitiviteit van TVE 75%, terwijl de
sensitiviteit van screening met CA-125+TVE gelijk bleef. De positief voorspellende waar­
de lag tussen 7,5-11% (eerste ronde rapportage (Menon et al. 2009)). Ongeveer de helft
van de via screening ontdekte tumoren bevond zich in een vroeg stadium
(I/II). Bij screening met CA-125+TVE waren 29 (85%) van de 34 ontdekte tumoren van het
snelgroeiende type II (nl. sereus, carcinocarcoma of adenocarcinoom) en slechts vijf
(15%) van 34 waren endometrioide of clear-cell langzaam groeiende varianten (type I).
Bij screening met alleen TVE waren zestien (67%) van 24 ontdekte tumoren van het snel
groeiende type II en acht (33%) van de 24 van de langzaam groeiende type-I-variant.
Rapportage over het effect van de screening op de sterfte wordt in 2015-16 verwacht.
Shizuoka Cohort Study of Ovarian Cancer Screening (SCSOCS)
Na de eerste screeningsronde werden 27 eierstoktumoren ontdekt in de interventie­
groep en 33 eierstoktumoren in de controlegroep (geen significant verschil)
(Kobayashi et al. 2008). De sensitiviteit was 79,5% en de specificiteit was 99,9%.
De positief voorspellende waarde in deze eerste screeningsronde was 47%.
Het percentage ontdekte tumoren in stadium I was in de gescreende groep 86% en in
de controlegroep 38%, maar dit was geen statistisch significant verschil. Tussen via
screening ontdekte tumoren en tumoren ontdekt in de controlegroep waren eveneens
geen significante verschillen naar histologische type (30% vs. 50% sereus) en gradering
(40% vs. 41% graad 1). Het wachten is op de rapportage over het effect van de screening
op de sterfte. De auteurs geven echter zelf aan dat mogelijke sterftereductie als gevolg
van de screening in deze studie moeilijk aan te tonen zal zijn, omdat de studie te
weinig power heeft om dit aan te tonen (Kobayashi et al. 2008).
Kentucky Ovarian Cancer Screening Project (KOCSP)
De sensitiviteit en specificiteit van screening met TVE in deze studie was
respectievelijk 85% en 99%, de positief voorspellende waarde 8,8 - 27%. De diagnose
werd in de gescreende groep significant vaker in stadium I of II gesteld (82%) dan in
de ongescreende controlegroep (34%) (van Nagell et al. 2011). Van de 47 via screening
ontdekte epitheliale eierstoktumoren behoorden er tien tot de langzaam groeiende
variant (21%) en 37 (79%) tot snel groeiende type-II-variant (geen gegevens over
snel/langzaam groeiende type-I-variant in controlegroep). De 5-jaarsoverleving
134
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
van vrouwen in de screeningsgroep was hoger: 74,8% (inclusief intervaltumoren),
ten opzichte van de 53,7% in de controlegroep. De controlegroep was beperkt tot
patiënten met eierstokkanker die geen screening hadden ondergaan, maar deze
waren niet door random toewijzing in de controlegroep beland. Hierdoor is niet
uit te sluiten dat de groepen in andere opzichten dan de screening van elkaar
verschilden, waardoor ze niet goed vergelijkbaar zijn. De impact van de screening op
de sterfte kan hierdoor in feite niet op valide wijze worden vastgesteld.
Net als in de UKCTOCS-trial werd in een andere grootschalige prospectieve studie
(onder 4.051 asymptomatische postmenopauzale vrouwen) een tweestapsscreening
geëvalueerd, waarbij het risico op eierstokkanker aan de hand van verandering van
het CA-125 niveau over de tijd en leeftijd werd vastgesteld (Lu et al. 2013). Vrouwen
met een hoge CA-125 waarde ondergingen TVE. In deze studie bevonden zich alle
ontdekte eierstoktumoren in een vroeg stadium (tabel 5.6). Of dit leidt tot betere
overleving is niet onderzocht.
Screening met behulp van andere markers dan CA-125 is onderzocht in een grootschalige
studie onder ruim 21.000 asymptomatische vrouwen. De screening bestond uit een
bloedtest op basis van de combinatie van serummarkers CA-602 en CA-546 als eerste
stap. In deze eerste stap werden 2760 (12,9%) vrouwen verwezen voor de tweede stap. In
de tweede stap ondergingen 2.023 vrouwen TVE of TAS (transabdominal sonography),
van wie uiteindelijk negen eierstokkanker bleken te hebben. Dit leidde tot een positief
voorspellende waarde van 0,33%. De sensitiviteit was niet gerapporteerd. Vier van de
negen ontdekte eierstoktumoren (detectierate 0,04%) bevonden zich in een vroeg
stadium (stadium I) (Saito et al. 2005). Dit betekent dat de combinatie van CA-602
en CA-546 eierstokkanker in een vroeg stadium kan ontdekken. Of deze screening de
overleving gunstig beïnvloed kon niet worden onderzocht (geen RCT).
Met behulp van bloedmonsters afkomstig uit de Prostate, Lung, Colorectal and
Ovarian Cancer trial (PLCO) was de diagnostische waarde van verschillende
biomarkers onderzocht. In deze case-controlstudie werden de diagnostische
waarden van 28 biomarkers van 118 bloedmonsters verkregen voor de diagnose
eierstokkanker en 9.151 bloedmonsters van gematchte controlepersonen ‘blind’
gemeten (Zhu et al. 2011). In deze studie bleek dat geen van de biomarkers beter was
in het diagnosticeren van eierstokkanker dan de biomarker CA-125.
Daarnaast zijn nog andere case-controlstudies uitgevoerd waarin verschillende
markersets, vaak met CA-125 als referentietest, zijn onderzocht, maar de studies
betroffen merendeels case-controlvergelijkingen in relatief kleine steekproeven of
het betrof onderzoek in een experimenteel stadium. Of deze markers ook vroege
stadia in asymptomatische vrouwen kunnen ontdekken is nog niet onderzocht.
Daarvoor is prospectief onderzoek nodig. Op basis van deze studies is het nog niet
mogelijk om definitieve conclusies te trekken over de mogelijkheden van screening
met behulp van andere biomarkers dan CA-125.
Daarnaast waren er twee case-controlstudies die screening met CA-125 in
combinatie met de Goff-symptomenindex hadden onderzocht (Andersen et al. 2008;
Macuks et al. 2011). Eén van deze twee studies rapporteerde dat de sensitiviteit van
CA-125 in combinatie met de symptomenindex hoger was voor vroege stadia dan de
sensitiviteit van CA-125 of symptomenindex afzonderlijk (80,6% vs. 64,5%/45,2%),
Vroege ontdekking van epitheliale eierstokkanker
135
maar de specificiteit was lager (83,5 vs. 95,3/88,2) (Andersen et al. 2008). De andere
studie had geen gegevens over de sensitiviteit en specificiteit van vroege stadia.
Toevoeging van een symptomenindex aan screening met CA-125 lijkt daarmee niet
beter dan screening met CA-125 alleen.
Gezondheidswinst en kosteneffectiviteit
Screening met behulp van TVE en een CA-125-serumtest kan eierstokkanker in een
vroeg stadium ontdekken. Of screening leidt tot vermindering van de sterfte moet
nog worden vastgesteld. Alleen de UKCTOCS-trial kan hierop antwoord geven.
Tweestapsscreening op basis van een algoritme voor risicostratificatie van CA-125
(UKCTOCS; Lu et al. 2013) lijkt veelbelovend. Rapportage over de impact van de
screening op de sterfte in de UKCTOCS wordt verwacht in 2015.
In een modelleerstudie werd met behulp van een Markov-model het natuurlijke
beloop van eierstokkanker in een cohort van vrouwen in de leeftijd 20-100
gemodelleerd (Havrilesky et al. 2008). Leeftijdspecifieke incidentie en sterfte waren
gebaseerd op SEER. De sensitiviteit van de screeningtest was gesteld op 85%, de
specificiteit op 95% en de kosten van de screening op $ 50,-. De door het model
voorspelde life-time risico op eierstokkanker (1,38%), life-time risico op sterfte aan
eierstokkanker (0,95%) en de stadiumverdeling (FIGO-stadium I - 19%; II - 7%; III, IV of
onbekend - 74%) kwamen goed overeen met de SEER-data. Jaarlijkse screening van
vrouwen tussen 50-85 resulteerde in 43% reductie van de sterfte aan eierstokkanker,
met een incremental cost-effectiveness ratio (ICER) van $ 73.469/gewonnen levensjaar
(basis scenario) en $ 36.025/gewonnen levensjaar (in een hoogrisicopopulatie)
ten opzichte van geen screening. In het basisscenario was het gemiddelde aantal
valspositieve testuitslagen (life-time) 1,06.
In een geüpdate modelleerstudie berekenden Havrilesky et al. (2011) de mogelijke
sterftereductie die met screening kan worden bereikt op basis van SEER-data
en gevalideerd met resultaten uit de UKCTOCS-trial. Mogelijke sterftereductie
werd geschat voor twee modellen, het 1-fenotypemodel, waarbij één fenotype
werd verondersteld en het 2-fenotypemodel, waarbij agressieve en indolente
fenotypen werden verondersteld, op basis van histopathologische criteria. De te
bereiken sterftereductie voor de UKCTOCS-trial werd geschat op 6-11%. De lange­
termijnsterftereductie voor jaarlijkse screening bij post-menopauzale vrouwen in de
algemene populatie (VS) op 14,7% (1-fenotype model) en 10,9% (2-fenotype model). De
mogelijke sterftereductie aan eierstokkanker lijkt daarmee beperkt of in ieder geval
beperkter dan in een aantal andere screeningen op kanker.
Een recente systematische review (Reade et al. 2013) gericht op de voor- en nadelen van
screening op eierstokkanker in asymptomische vrouwen, concludeerde op basis van een
meta-analyse van de resultaten van tien gerandomiseerde studies (gepubliceerd sinds
1979,waaronder PLCO, UKCTOCS en SCSOCS en een aantal kleinere trials) dat screening
niet leidt tot vermindering van de sterfte of diagnose in een gevorderd stadium. Ook
leidt screening tot onnodige operaties: TVE resulteerde in gemiddeld 38 operaties per
ontdekte eierstokkanker en screening met CA-125 leidde tot vier operaties per ontdekte
eierstokkanker, waarbij 6% van de geopereerde vrouwen ernstige complicaties door de
operatie had. Kwaliteit van leven werd niet beïnvloed door screening, maar vrouwen
met foutpositieve uitslag waren twee jaar na de screening vaker bezorgd over hun risico
op kanker dan vrouwen met een normale uitslag.
136
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
De belangrijke vraag is of er al meer moet en kan gebeuren dan afwachten op de
UKCTOCS. Er zijn verschillende elementen uit verschillende studies die op korte
termijn nadere analyse vergen. Enerzijds wordt er een hoge sensitiviteit gevonden
met CA-125 als screeningsmarker. Ongeveer de helft van de via screening ontdekte
tumoren bevond zich in een vroeg stadium (I/II). Anderzijds vindt de PLCO-trial
geen sterftereductie en worden sereuze tumoren niet eerder ontdekt. Er is een
simpele modelanalyse gemaakt met SEER-data en informatie over de prevalente
screening in de UKCTOCS die een geringe sterfte-reductie zouden voorspellen.
Tegelijkertijd zijn secundaire analyses verricht van betere afkapstrategieën in de
PLCO-trial. Het is te overwegen om op basis van de data uit de UKCTOCS- en PLCOtrials een modelleerstudie op te zetten naar de mogelijke effecten van screening van
eierstokkanker in Nederland. Een modelleerstudie maakt het mogelijk rekening te
houden met al deze verschillende aspecten, zodat de effecten hiervan systematisch
kunnen worden onderzocht. Gezien de doorlooptijd van dergelijke analyses, is het
aan te bevelen dit tijdig te starten. Bekeken moet worden of vigerende modellen
van het natuurlijk beloop van kanker hiervoor gebruikt kunnen worden en of ze
onderscheid naar histologie en test moeten maken.
5.6.4.2
Screening in hoogrisicogroepen
De belangrijkste hoogrisicogroepen voor eierstokkanker zijn BRCA1- en BRCA2mutatiedragers, vrouwen met het Lynch-syndroom (HNPCC) of het Syndroom van
Peutz-Jeghers en vrouwen met een familiegeschiedenis van eierstokkanker, zonder
aantoonbare mutaties (tabel 5.7).
Tabel 5.7: Risico op eierstokkanker in hoogrisicogroepen.
Risicofactor
OR
Studie (jaar)
BRCA1 mutatiedragers
59% life-time risico
Chen and Parmigiani (2007)
BRCA2 mutatiedragers
35% life-time risico
Chen and Parmigiani (2007)
Syndroom van Peutz-Jeghers
27
Giardiello (2000)
Lynch II syndroom (HNPCC)
4
Watson and Lynch (1993)
• HNPCC-MSH6
3-4
Boilesen et al. (2008)
Risico op eierstokkanker na borstkankerdiagnose:
• bij familiegeschiedenis borst- en/of eierstokkanker
• indien geen familiegeschiedenis
3,9
1,6
Bergfeldt et al. (2002)
Familiegeschiedenis van borst en/of eierstokkanker
2,2
Komata et al. (2009)
Familiegeschiedenis van eierstokkanker:
• bij 1 eerstegraads familielid
• bij 1 of meer eerstegraads familieleden
2
10
Bell (1998)
OR = odds ratio. OR > 5 betekent een relevant risico.
Een aantal cohortstudies heeft het effect van screening op de detectie van
eierstokkanker in hoogrisicogroepen (vanwege familiegeschiedenis/genetische
aanleg) onderzocht (tabel 5.8), met de volgende resultaten:
Familiegeschiedenis
In elk van deze studies afzonderlijk werd maar maximaal één vrouw met
eierstokkanker gevonden. Het merendeel van de gevonden eierstoktumoren bevond
zich in een laat stadium.
Vroege ontdekking van epitheliale eierstokkanker
137
Tabel 5.8: Cohortstudies voor de detectie van eierstokkanker door screening in
hoogrisicogroepen (familiegeschiedenis/genetische aanleg).
Doelgroep
Screenings­
methode
Sensitiviteit/
specificiteit
PVW/NPW
Resultaten
Studie
Vrouwen met familiegeschiedenis
Vrouwen met
familiegeschiedenis
van borst- en/of
eierstokkanker en/of
BRCA1-2 mutatie
(N = 311)
CA-125 en TVE
(retrospectief)
TVE: 100%/100%
CA-125: 0%/n.r.
n.r.
0% n.r.
1 eierstokkanker ontdekt
Laframboise
(detectierate 0,3%; stadium et al. (2002)
IA, grade 1 endometrioïde
adenocarcinoom)
Symptomatische
vrouwen met
familiegeschiedenis
van borst- en
eierstokkanker
(N = 4526)
2-jaarlijks TVE
n.r.
n.r.
12 mnd follow-up:
4 primair peritoneaal
carcinoom,
4 tubacarcinoom,
2 epitheelcarcinoom
(stadium IIIA and IIIB),
2 endometrium carcinoom
Fishman
et al. (2005)
Vrouwen met
familiegeschiedenis
van borst- en
eierstokkanker
(N = 676)
Jaarlijks CA-125
en TVE
CA-125: n.r./99,4%
TVE: n.r./99,2%
CA-125 en TVE:
100%/98,7%
(1 prevalente
eierstokkanker)
14,2% n.r.
16,6% n.r.
10%/100%
1 sereus cystadeno­
carcinoom ontdekt
(stadium 1C)
Bosse
et al. (2006)
Asymptomatische
vrouwen met
familiegeschiedenis
van eierstokkanker
(N = 341)
Jaarlijks
CA-125 en TVE
(retrospective
audit van case
records van
NHS Trust)
TVE:
33,3%/85,8%
hoog risico:
33,3%/84,5%
TVE:
1,1%/99,6%
hoog risico:
1,1%/99,6%
1 eierstokkanker ontdekt
(stadium III/IV)
Woodward
et al. (2007)
TVE+CA-125:
66,7%/82,9%
hoog risico:
50%/82,8%
TVE+CA-125:
1,5%/99,8%
hoog risico:
1,3%/99,7%
TVE: 100%/100%
(1 prevalente
eierstokkanker)
CA-125: 0%/n.r.
n.r.
1 eierstokkanker ontdekt
(detectie rate 0,3%);
stadium IA, grade 1
endometrioid adeno­
carcinoma)
Laframboise
et al. (2002)
n.r.
25,5%/99,9%
In vervolg screeningsron­
den: 2 van de 13 in stadium I
en II.
Rosenthal
et al. (2013)
100%
(1 prevalente
eierstokkanker)
100%
1 eierstokkanker ontdekt
(stadium IIIC)
Oei et al.
(2006)
8/269 (3%) maligne
tumoren (1 borderline, 1 IIa,
2 IIIb, 3 IIIc, 1 IV)
Gaaren­
stroom et al.
(2006)
Vrouwen met bewezen genetische aanleg
CA-125 en TVE
Vrouwen met
BRCA1/2 mutatie en/ (retrospectief)
of familie­
geschiedenis van
borst- en/of eierstok­
kanker (N = 311)
Vrouwen met
familie­geschiedenis
van borst- en/of
eierstokkanker en/of
genetische mutatie
geassocieerd met
borst- en/of
eierstokkanker
(hereditary breast
and ovarian
cancer (HBOC))
(N = 3563)
Jaarlijks
CA-125 en TVE
Vrouwen met
BRCA1/2- mutatie
en/of familie­
geschiedenis van
borst- en/of eierstok­
kanker (N = 512)
CA-125 en TVE
en bekken­
onderzoek
(pelvic
examination)
BRCA1/2 mutatie­
dragers
(N = 269)
Jaarlijks CA-125
en TVE
138
0%/n.r.
(Prospectief
cohort;
UK-FOCSS)
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Screenings­
methode
Doelgroep
Sensitiviteit/
specificiteit
PVW/NPW
Resultaten
Studie
Vrouwen met bewezen genetische aanleg
(1) BRCA1/2
(2) Leden van HBOC
familie
(3) Borstkanker­
patiënten van
HBOC familie
(N = 311)
≥ 35 jaar;
profylactische
operatie of
screening
(1) jaarlijks,
(2) tweejaar­
lijks: CA-125 en
TVE
40%/99%
40%/n.r.
3 van de 4 door screening
Olivier et al.
(2006)
ontdekte tumoren in een
gevorderd stadium
(1 stadium 1C, 1 stadium IIIB,
1 stadium IV, 1 interval­
kanker stadium IV)
BRCA1/2mutatiedragers
(N = 888)
Jaarlijks CA-125
en TVE
42%/99%
23%/n.r.
8 van de 10 in stadium III/IV
(detectierate 0,006)
Geen verschil in stadium­
verdeling tussen gescreen­
den en niet gescreenden
Hermsen et
al. (2007)
BRCA1/2mutatiedragers
(N = 3532)
Jaarlijks CA-125
en TVE
n.r.
n.r.
65% van ontdekte tumoren
in stadium III en IV; Geen
verschil in stadiumverde­
ling tussen gescreenden en
niet gescreenden.
Na uitsluiting van
borderline tumoren,
verschil in overleving
tussen dragers en
niet-dragers niet meer
significant
Evans et al.
(2009)
BRCA1/2 mutatie­
dragers
(N = 241)
CA-125 en TVE
en bekken­
onderzoek
(pelvic
examination)
(retrospectief
cohort)
33%/92%
3%/99,4%
3 tumoren ontdekt, alle in
een gevorderd stadium
Van der
Velde et al.
(2009)
PVW = positief voorspellende waarde, NPW = negatief voorspellende waarde, TVE = transvaginale
echografie, n.r. = niet gerapporteerd.
BRCA-/HNPCC-mutatiedragers
Ook onder deze risicogroepen was het aantal ontdekte eierstoktumoren klein en
bevonden ze zich merendeels in een laat stadium. De UK-FOCSS studie, rapporteerde
de eerste screeningsresultaten van een fase-I-studie (Rosenthal et al. 2013).
Hoewel 2/3 van de prevalente tumoren (gevonden tijdens de eerste screeningsronde)
een vroeg stadium betrof, liet nadere analyse zien dat 3/5 van de casussen met
FIGO-stadium I het Lynch-syndroom had. Ook de resultaten van de daaropvolgende
jaarlijkse screeningsronde waren teleurstellend: slechts twee van de dertien
gevonden eierstoktumoren bevond zich in stadium I of II. De positief voorspellende
waarde was 25,5% en de negatief voorspellende waarde 99,9%. Er vond geen
significante stadiumverschuiving plaats ten opzichte van prevalente eierstok­
tumoren en derhalve is overlevingswinst niet te verwachten.
Ook in een andere screeningsstudie (retrospectief cohort) onder BRCA1/2-mutatie­
dragers (Van der Velde et al. 2009) waren alle ontdekte eierstoktumoren in een
gevorderd stadium; de sensitiviteit (33%) en positief voorspellende waarde (3%)
waren eveneens laag.
Slechts één van deze studies had het effect van screening in een groep van
BRCA1/2- en MMR-dragers op de sterfte onderzocht. In deze studie was er geen
Vroege ontdekking van epitheliale eierstokkanker
139
prospectieve controlegroep, maar was er wel een groep van 111 BRCA1/2-dragers
met eierstokkanker geïdentificeerd die niet waren gescreend. In de gescreende
groep hadden 64 vrouwen eierstokkanker (59 invasief en vijf borderline), van wie
49 BRCA1/2-dragers en twee MMR-dragers. Het percentage met stadium I-II in de
ongescreende groep (29%) was niet significant verschillend vergeleken met die van
de patiënten met eierstokkanker in de gescreende groep (39%). In totaal stierven 24
vrouwen aan eierstokkanker in de gescreende groep. De 5- en 10-jaarsoverleving bij
BRCA1/2-dragers in de gescreende groep was respectievelijk 58,6% (95% BI 50,9% 66,3%) en 36% (95% BI 27% - 45%). Deze overlevingscijfers verschillen weinig van die in
de ongescreende populatie (Evans et al. 2009).
Twee prospectieve studies onderzochten het effect van screening op eierstok­
kanker onder vrouwen met symptomen (tabel 5.9). In een van de twee studies werd
geen enkele eierstokkanker gevonden, mogelijk door de relatief kleine steekproef.
In de andere studie was de detectierate 0,76%, wat ongeveer tien keer hoger is dan
in de grote screeningstrials onder asymptomatische populaties (Gilbert et al. 2012).
Het overgrote deel (81%) van de ontdekte tumoren was een sereuze type-II-tumor,
waarvan het merendeel (zeven van de negen) echter pas in een laat stadium werd
ontdekt.
Tabel 5.9: Detectie van (vroege stadia van) eierstokkanker in screeningsstudies in
hoogrisicogroepen (op basis van symptomen).
Doelgroep
Screeningsmethode
Sens/spec/PVW
Ontdekte tumoren (aantal, %)
Studie
Symptomatische
vrouwen* > 45 jaar
(N = 290)
CA-125 en TVE
-
Geen
Rufford et al.
(2007)
Symptomatische
vrouwen**
(N = 1455)
CA-125 en TVE
-
11; 0,76%
Gilbert et al.
9 sereus Type II, w.o. 7 stadium III-IV (2012)
*Minstens een van de volgende symptomen: pijn in buik, bekken of rug, opgezwollen buik of een opgeblazen
gevoel, vol gevoel, veranderde plasfrequentie, incontinentie, constipatie, diarree, abnormale vaginale bloeding,
verminderde eetlust, moeilijkheden met eten, gewichtsverlies, pijn tijdens het vrijen, vermoeidheid of lethargie,
misselijkheid en overgeven, darmproblemen
**Een van de volgende problemen langer dan twee weken, korter dan een jaar: klachten in buik of bekken
140
Conclusies
•Met het algoritme voor CA-125, waarbij het risico op eierstokkanker aan de
hand van veranderingen van het CA-125- niveau over de tijd en per leeftijd wordt
vastgesteld, gevolgd door TVE, is het mogelijk om vroege stadia te ontdekken.
Het is echter nog onbekend of deze tweestapsscreening onder asymptomatische
vrouwen, gevolgd door vroegtijdige behandeling, leidt tot een betere overleving
en/of sterftereductie.
•Met het algoritme voor CA-125, gevolgd door TVE, worden meer snelgroeiende
tumoren (type II) ontdekt dan met TVE alleen.
•Screening kan leiden tot meer nadelen dan voordelen. In een grootschalige RCT
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
(PLCO) leidde de screening tot onnodige operaties, terwijl er geen voordelen
waren voor diagnose van vroege stadia en sterftereductie. Het wachten is op
de uitkomsten van de UK Collaborative Trial of Ovarian Cancer Screening met
betrekking tot sterftereductie, maar ook met betrekking tot psychosociale
effecten/kwaliteit van leven en kosteneffectiviteit.
•Biomarkerstudies op basis van gegevens van de algemene populatie (PLCO trial)
hebben tot nu toe geen meerwaarde laten zien van andere serummarkers boven
CA-125.
•Screening in hoogrisicogroepen, zowel onder vrouwen met familiegeschiedenis
of genetische predispositie als onder vrouwen met symptomen, lijkt niet te
leiden tot een gunstigere stadiumverdeling bij diagnose ten opzichte van
niet-gescreende vrouwen en derhalve is gezondheidswinst in de vorm van betere
overleving niet te verwachten. Jaarlijkse screening met CA-125 en TVE onder
BRCA1/2-dragers heeft niet geleid tot betere overleving.
5.7
Wat zit er in de pijplijn?
In tabel 5.10 wordt aangegeven welke studies er lopen op het gebied van de in dit
rapport beschreven invalshoeken van vroege ontdekking, resp. risicofactoren,
klachten en symptomen, patient en doctor’s delay, screening en effect van screening:
sterftereductie en/of verbeterde overleving. De resultaten van deze studies leiden
mogelijk tot meer inzicht in de te behalen winst met vroege ontdekking.
Biomarkers
Onderzoek naar epigenetische veranderingen als belangrijk mechanisme voor
ontstaan en ontwikkeling van kanker is in opkomst (Nogueira da Costa and
Herceg 2012). Er wordt naar mogelijkheden gezocht voor de vroege ontdekking
van eierstokkanker met behulp van epigenetische biomarkers (Jones 2010), maar
vooralsnog lijken er geen epigenetische biomarkers geschikt om eierstokkanker
in een vroeg stadium nauwkeurig te kunnen detecteren in lichaamsweefsel of
-vloeistoffen (Bijron et al. 2012).
De ‘molecular scores’ uit het The Cancer Genome Atlas (TCGA) project (2011) en
de daarop gebaseerde DNA repair hypothesis driven approach (Kang et al. 2012) en de
detectie van vrij cfDNA in het bloed (ook wel bekend onder de noemer ‘liquid biopsy’ )
(Forshew et al. 2012) bieden mogelijk aangrijpingspunten voor verder onderzoek naar
de mogelijkheden van vroege ontdekking van eierstokkanker.
Beeldvorming
Door een constante verbetering in kwaliteit van beeldvorming neemt de resolutie
van bestaande beeldvormingsmethoden toe (echografie, CT, MRI). Dit kan de
detectie en differentiatie van kleine afwijkingen ten goede komen, maar daardoor
neemt ook de kans op foutpositieve uitslagen toe. Toekomst zal uitwijzen of
dit voor een verbeterde screening zal zorgen. Daarnaast zijn er ook nieuwe
beeldvormingsmethoden in ontwikkeling (bijvoorbeeld fusie PET-MRI of de
ontwikkeling van nieuwe PET-tracers) (Afaq et al. 2013), die in de toekomst nieuwe
aangrijpingspunten kunnen opleveren voor vroege ontdekking.
Vroege ontdekking van epitheliale eierstokkanker
141
Tabel 5.10: Internationale lopende studies initiatieven.
onderzocht aspect
Initiatief(nemer)
Doel
Aanvullende informatie
Klachten en
symptomen
ICBP
Onderzoek naar houding
(attitude) en opvattingen
(beliefs) over kanker bij het
algemene publiek.
Optionele modules richten
zich op:
•bewustzijn van risicofactoren
van kanker
•bewustzijn en opvattingen
over screening op kanker
•bewustzijn en opvattingen
over eierstokkanker
Dataverzameling tot 2011.
Ipsos MORI voerde
computer-ondersteunende
telefonische interviews uit, met
behulp van de ABC vragenlijsten
voor elke ICBP partner. Zij namen
vragenlijsten af bij meer dan
19.000 mannen en vrouwen van
50 jaar en ouder in Australië
(New South Wales en Victoria),
Canada, Engeland, Noord
Ierland, Denemarken,
Noorwegen, Zweden en Wales
Delay
ICBP
Internationale vergelijking van
de tijdsintervallen van eerste
symptomen tot aan de diagnose
en start van behandeling van
kankerpatiënten; metingen
werden verricht via vragenlijsten
bij patiënten met borst-, long-,
darm- en eierstokkanker. Het
doel is om de hypothese te
testen dat langere tijdsinterval­
len bijdragen aan slechtere
kankeruitkomsten
800 patiënten – 200 patiënten
per kankersoort (borst-, long-,
darm- en eierstokkanker) zullen
in het vragenlijstonderzoek
worden geïncludeerd voor elke
partnerorganisatie. Het doel is
om in totaal minstens 6.000
patiënten in elk van de 9
deelnemende partners te
includeren. Als een patiënt
toestemming voor deelname aan
de studie heeft gegeven, zal de
huisarts en specialist worden
benaderd voor een korte
vragenlijst
Screening in
asymptomatische
postmenopauzale
vrouwen
UKCTOCS, UK
Collaborative Trial of
Ovarian Cancer
Screening
Sterftereductie door vroege
ontdekking middels jaarlijkse
CA-125 screening (met gebruik
van risicostratificatie) met TVE
als 2e stap
Resultaten m.b.t. sterftereductie
verwacht na 2014
Screening in
asymptomatische
postmenopauzale
vrouwen
SCSOCS, Shizuoka
Cohort Study of
Ovarian Cancer
Screening in Japan
Sterftereductie door vroege
ontdekking middels jaarlijkse
screening met TVE en CA-125
Resultaten m.b.t. sterftereductie
niet beschikbaar
Uterien uitstrijkje
voor de detectie van
eierstokkanker
(Lavage of the uterine
cavity as potential tool
for diagnosis of
epithelial ovarian
cancer and its
precursors; LUSTIC)
Speiser, Wenen; Johns
Hopkins Kimmel
Cancer Center, The
Ludwig Center for
Cancer Genetics and
Therapeutics, Bert
Vogelstein - Baltimore,
USA
Mogelijke screeningsmethode
voor de detectie van (voorstadia,
STIC’s) van epitheliale eierstok­
kanker
Looptijd 2013-2017
CRUK = Cancer Research UK, ICRP = International Cancer Benchmarking Partnership.
142
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
5.8
Conclusies, implicaties voor praktijk en
onderzoek, en aanbevelingen
5.8.1
Conclusies m.b.t. vroegontdekking
Risicofactoren/klachten en symptomen
•Eventuele vroege symptomen, zoals vol gevoel in de buik, vage pijnklachten,
dikker wordende buik en gewichtsverlies zijn niet voldoende onderscheidend
(specifiek) voor eierstokkanker.
•Vroegere ontdekking van eierstokkanker in de algemene populatie aan de hand
van klachten en symptomen is op dit moment niet mogelijk. De best voorspelbare
symptomenindex (op basis van een algoritme in een huisartspatiëntenpopulatie)
kent een relatief lage sensitiviteit en een positief voorspellende waarde van
slechts enkele procenten. Het is bovendien niet bekend of deze symptomenindex
een vroeg stadium kan opsporen.
•Een duidelijk verhoogd risico op eierstokkanker hangt samen met bepaalde
genetische profielen, welke een klein percentage (ca. 10%) van alle vrouwen met
eierstokkanker betreft. Ongeveer 10% van de epitheliale eierstoktumoren en
24% van de sereuze type-II-eierstoktumoren hebben een erfelijke basis. Bekende
genetische predispositiegenen zijn BRCA1 en BRCA2.
•In de algemene populatie is, zonder testen op genetische aanleg (o.m. BRCA1/2),
geen hoogrisicogroep voor eierstokkanker te identificeren.
Delay
•Er zijn geen duidelijke aanwijzingen voor het bestaan van patient en/of doctor’s
delay (vermijdbare vertraging in het vaststellen van de diagnose), noch dat de
prognose van eierstokkanker wordt beïnvloed door deze vormen van delay.
Aangetekend moet worden dat het aantal beschikbare studies zeer beperkt is.
Screening
Asymptomatische vrouwen, zonder familiegeschiedenis en/of genetische predispositie:
•Met het algoritme voor CA-125, waarbij het risico op eierstokkanker aan de
hand van veranderingen van het CA-125-niveau over de tijd en per leeftijd wordt
vastgesteld, gevolgd door TVE, is het mogelijk om vroege stadia te ontdekken.
Het is echter nog onbekend of deze tweestapsscreening onder asymptomatische
vrouwen leidt tot een betere overleving en/of sterftereductie.
•Met het algoritme voor CA-125 gevolgd door TVE worden meer snelgroeiende
tumoren (type II) ontdekt dan met TVE alleen.
•Screening op eierstokkanker kan ook leiden tot meer morbiditeit als gevolg van
foutpositieve uitslagen en onnodige operaties.
•Een combinatie van serumbiomarkers CA-602 en CA-546 lijkt vroege stadia te
kunnen opsporen vooralsnog zonder gegevens over specificiteit. Desalniettemin
laten population-based (nl. PLCO) biomarkerstudies hiervan tot nu toe geen
meerwaarde zien boven CA-125.
Vroege ontdekking van epitheliale eierstokkanker
143
Hoogrisicopatiënten:
•Screening in hoogrisicogroepen, zowel onder vrouwen met familiegeschiedenis
of genetische predispositie als onder vrouwen met symptomen, leidt niet tot
een gunstigere stadiumverdeling bij diagnose ten opzichte van niet-gescreende
vrouwen en derhalve is gezondheidswinst in de vorm van betere overleving
niet te verwachten. Jaarlijkse screening met CA-125 en TVE onder BRCA1/2mutatiedragers heeft niet geleid tot betere overleving.
5.8.2
Implicaties voor de praktijk
•Gezien het feit dat klachten en symptomen geassocieerd zijn met gevorderde
stadia van eierstokkanker en er geen aanwijzingen zijn dat de omvang van
patient delay en doctor’s delay van invloed is op de prognose, lijken inspanningen
om eventuele diagnostic delay aan te pakken weinig gezondheidswinst op te
leveren.
•Screening van asymptomatische vrouwen op de aanwezigheid van
eierstokkanker kan niet worden aanbevolen.
•Op dit moment worden BRCA1/2-mutatiedragers geadviseerd om preventief
de eierstokken en eileiders te laten verwijderen, aangezien screening op
eierstokkanker niet effectief is in het verlagen van sterfte aan eierstokkanker.
Deze ingreep is, mits tijdig aangeboden, zeer effectief in het verlagen van de kans
op het ontwikkelen van sereus type-II-eierstokkanker.
5.8.3
Implicaties voor onderzoek
•Onderzoek naar vroegdetectie van het hooggradig sereus carcinoom in de
eileiders moet worden gestimuleerd, omdat dit type carcinoom niet alleen het
meeste voorkomt, maar ook zeer agressief is. Bovendien kan TVE niet worden
ingezet voor inspectie van de eileiders. Dit vraagt om onderzoek naar andere
detectiemogelijkheden van vroege stadia in de eileiders.
•De uitkomsten van de Engelse grootschalige screeningsstudie (UKCTOCS)
zijn cruciaal. In een Amerikaanse grootschalige studie (PLCO-trial) werd geen
sterftereductie gevonden door screening. Modelleerstudies kunnen een
antwoord geven over discrepanties of verklaringen tussen de trials. Te overwegen
is om met modelleerstudies vast te stellen bij welke stadiumverschuivingen en
mortaliteitsreductie een screeningsprogramma (in Nederland) kosteneffectief
kan zijn (bij een positief resultaat van de UKCTOCS) of om een eenduidig
antwoord te krijgen op de vraag waarom de huidige testen (TVE en CA-125) falen
(bij een negatief resultaat van de UKCTOCS).
5.8.4
Eindconclusie
Winst te behalen
Deze inventarisatie van alle recente literatuur en raadpleging van experts laat helaas
zien dat we op korte termijn geen aanknopingspunten hebben om bij epitheliale
eierstokkanker gezondheidswinst te boeken door vroege opsporing.
Knelpunten
•Er is tot nu toe geen asymptomatisch voorstadium van eierstokkanker bekend
dat met behulp van weinig invasieve technieken is op te sporen en waarvan
behandeling leidt tot een genezing of een goede prognose.
144
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
•Eierstokkanker bestaat uit een heterogene groep m.n. epitheliale tumoren, die
zich histologisch, moleculair-biologisch en klinisch van elkaar onderscheiden.
Er is nog weinig bekend over de preklinische ontwikkeling van de verschillende
typen eierstokkanker. Voor het ontwikkelen van een effectieve strategie voor
vroege ontdekking is echter inzicht in de preklinische ontwikkeling van de
histologisch te onderscheiden type I en II onontbeerlijk.
•De grootste groep betreft de sereuze epitheliale tumoren, die klinisch vaak in een
vergevorderd stadium worden gediagnosticeerd. Van dit type kanker is inmiddels
bekend dat ze primair buiten de eierstokken ontstaan en pas secundair in de
eierstokken zullen worden aangetroffen. Eenmaal in de eierstokken zijn ze vaak
al in een gevorderd stadium.
Kansen
•Sereuze tumoren produceren CA-125 en het peritoneum aangetast door deze
tumor ook. Daardoor hebben hooggradig sereuze tumoren een hogere CA-125waarde in het bloed. Clear-cell en mucineuze tumoren brengen minder CA-125 tot
expressie. CA-125 is als biomarker beter bruikbaar voor de agressievere type-IItumoren (sereuze type II) dan voor de type-I-tumoren (laaggradig sereus).
•Voor de meerderheid van de, ook prognostisch slechtere, type-IIeierstoktumoren zijn ‘slimme’ algoritmen met de CA-125 waarde (in bloed)
ontwikkeld, die beter zijn dan een simpel afkappunt voor elke vrouw. Met deze
algoritmen is het mogelijk om vroege stadia op te sporen.
•De langzaamgroeiende type I epitheliale tumoren die begrensd blijven tot de
ovaria, zullen mogelijk met bekkenonderzoek en transvaginale ultrasound
opgespoord kunnen worden.
•Nieuwe aangrijpingspunten voor vroege ontdekking van de verschillende type-I- en
type-II-tumoren zijn te identificeren op basis van hun genetische ontwikkeling:
type-I-tumoren ontwikkelen zich met name via mutaties in genen uit signaal­
transductiepathways), type-II-tumoren door veranderingen in p53-expressie.
•Verbeteringen in de kwaliteit van de beeldvorming kan detectie en differentiatie
van kleinere tumoren bevorderen.
•Detectie van biomarkers in andere lichaamsvloeistoffen dan serum, bijvoorbeeld
uitstrijkje, uterienvocht of urine kan bijdragen aan de ontwikkeling van een
nieuwe screeningstest.
5.8.5
Aanbevelingen
•Aanbevolen wordt om standaard serum en weefsel (en eventueel buikvocht) van alle
patiënten met epitheliale eierstokkanker op te slaan in biobanken. Ook opslag van
weefsel van preventieve verwijderde eierstokken en eileiders bij hoog­risico­groepen
is gewenst. De opslag van weefsel is nodig voor het onderzoek naar nieuwe serum­
testen. Onderzoek aan dit materiaal biedt mogelijk aangrijpingspunten voor meer
kansrijke screeningsstrategieën voor eierstokkanker.
•Onderzocht moet worden of detectie van biomarkers in andere
lichaamsvloeistoffen dan serum een bruikbare methode voor screening is,
bijvoorbeeld in het uitstrijkje van de baarmoederhals.
•Nieuwe kennis over de pathogenese (de vroege ontwikkeling) van de
verschillende histologische typen eierstokkanker op basis van hun moleculaire en
genetische kenmerken zou aangrijpingspunten voor nieuwe mogelijkheden voor
vroege ontdekking kunnen bieden van zowel de snel- als de langzaamgroeiende
Vroege ontdekking van epitheliale eierstokkanker
145
eierstoktumoren. Onderzoek naar vroegdetectie van het hooggradig sereus
carcinoom in de eileiders moet worden gestimuleerd, omdat dit type carcinoom
niet alleen het meeste voorkomt, maar ook zeer agressief is. Bovendien kan TVE
niet worden ingezet voor inspectie van de eileiders. Dit vraagt om onderzoek
naar andere detectiemogelijkheden van vroege stadia in de eileiders.
•Vooruitlopend op de uitkomst van de UKCTOCS-trial en in analogie met
vergelijkbare studies met betrekking tot bijvoorbeeld longkanker, kan
het nuttig zijn met modelleerstudies de mogelijke voor- en nadelen van
verschillende screeningsscenario’s voor Nederland te analyseren. Aanbevolen
wordt om op korte termijn de klinische data uit in ieder geval de twee grote
screeningsstudies te integreren en in relatie te brengen tot het natuurlijk
beloop van de histologisch verschillende types eierstokkanker. Dit is nodig om
de vraag te kunnen beantwoorden of en zo ja hoeveel gezondheidswinst er met
welke screeningstrategie in Nederland te behalen is en tevens inzicht te krijgen
in de mogelijke nadelige effecten van de screening (foutpositieven, onnodige
operaties).
5.9
Referenties
Afaq A et al. (2013) PET/MRI: a new technology in the field of molecular imaging. Br
Med Bull 108:159-71
Andersen MR et al. (2008) Combining a symptoms index with CA 125 to improve
detection of ovarian cancer. Cancer 113: 484-9
Bell R et al. (1998) Screening for ovarian cancer: a systematic review. Health Technol
Assess 2: i-iv, 1-84
Bergfeldt K et al. (2002) Risk of ovarian cancer in breast-cancer patients with a family
history of breast or ovarian cancer: a population-based cohort study. Lancet 360:
891-4
Bijron JG et al. (2012) Epigenetic biomarkers in the diagnosis of ovarian cancer. Expert
Opin Med Diagn 6: 421-38
Boilesen AE et al. (2008) Risk of gynecologic cancers in Danish hereditary nonpolyposis colorectal cancer families. Acta Obstet Gynecol Scand 87: 1129-35
Brown PO and Palmer C (2009) The preclinical natural history of serous ovarian
cancer: defining the target for early detection. PLoS Med 6: e1000114
Buys SS et al. (2011) Effect of screening on ovarian cancer mortality: the Prostate,
Lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled
Trial. JAMA 305: 2295-303
Carnide N et al. (2009) Association between frequency and intensity of recreational
physical activity and epithelial ovarian cancer risk by age period. Eur J Cancer Prev
18: 322-30
Chen S and Parmigiani G (2007) Meta-analysis of BRCA1 and BRCA2 penetrance. J Clin
Oncol 25: 1329-33
Cosgrove L et al. (2011) Antidepressants and breast and ovarian cancer risk: a review
of the literature and researchers’ financial associations with industry. PLoS One
6: e18210
Drescher CW et al. (2013) Longitudinal screening algorithm that incorporates change
over time in CA125 levels identifies ovarian cancer earlier than a single-threshold
rule. J Clin Oncol 31: 387-92
146
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Dublin S et al. (2002) Risk of epithelial ovarian cancer in relation to use of
antidepressants, benzodiazepines, and other centrally acting medications.
Cancer Causes Control 13: 35-45
Evans DG et al. (2009) Screening for familial ovarian cancer: poor survival of BRCA1/2
related cancers. J Med Genet 46: 593-7
Fishman DA et al. (2005) The role of ultrasound evaluation in the detection of earlystage epithelial ovarian cancer. Am J Obstet Gynecol 192: 1214-21; discussion 1221-2
Forshew T et al. (2012) Noninvasive identification and monitoring of cancer
mutations by targeted deep sequencing of plasma DNA. Sci Transl Med 4: 136ra68
Gaarenstroom KN et al. (2006) Efficacy of screening women at high risk of hereditary
ovarian cancer: results of an 11-year cohort study. Int J Gynecol Cancer 16 Suppl 1:
54-9
Giardiello FM et al. (2000) Very high risk of cancer in familial Peutz-Jeghers
syndrome. Gastroenterology 119: 1447-53
Gilbert L et al. (2012) Assessment of symptomatic women for early diagnosis of ovarian
cancer: results from the prospective DOvE pilot project. Lancet Oncol 13: 285-91
Goff BA et al. (2007) Development of an ovarian cancer symptom index: possibilities
for earlier detection. Cancer 109: 221-7
Hamilton W et al. (2009) Risk of ovarian cancer in women with symptoms in primary
care: population based case-control study. BMJ 339: b2998
Havrilesky LJ et al. (2011) Development of an ovarian cancer screening decision model
that incorporates disease heterogeneity: implications for potential mortality
reduction. Cancer 117: 545-53
Havrilesky LJ et al. (2008) Reducing ovarian cancer mortality through screening: Is it
possible, and can we afford it? Gynecol Oncol 111: 179-87
Hermsen BB et al. (2007) No efficacy of annual gynaecological screening in BRCA1/2
mutation carriers; an observational follow-up study. Br J Cancer 96: 1335-42
Hippisley-Cox J and Coupland C (2012) Identifying women with suspected ovarian
cancer in primary care: derivation and validation of algorithm. BMJ 344: d8009
Jordan SJ et al. (2005) Height, age at menarche, and risk of epithelial ovarian cancer.
Cancer Epidemiol Biomarkers Prev 14: 2045-8
Kang J et al. (2012) A DNA repair pathway-focused score for prediction of outcomes
in ovarian cancer treated with platinum-based chemotherapy. J Natl Cancer Inst
104: 670-81
Kirwan JM et al. (2002) Effect of delays in primary care referral on survival of women
with epithelial ovarian cancer: retrospective audit. BMJ 324: 148-51
Kobayashi H et al. (2008) A randomized study of screening for ovarian cancer: a
multicenter study in Japan. Int J Gynecol Cancer 18: 414-20
Komata D et al. (2009) The prevalence of hereditary breast/ovarian cancer risk in
patients with a history of breast or ovarian cancer in Japanese subjects. J Obstet
Gynaecol Res 35: 912-7
Laframboise S et al. (2002) Use of CA-125 and ultrasound in high-risk women. Int J
Gynecol Cancer 12: 86-91
Lim AW et al. (2012) Predictive value of symptoms for ovarian cancer: comparison of
symptoms reported by questionnaire, interview, and general practitioner notes.
J Natl Cancer Inst 104: 114-24
Lu KH et al. (2013) A 2-stage ovarian cancer screening strategy using the Risk of
Ovarian Cancer Algorithm (ROCA) identifies early-stage incident cancers and
demonstrates high positive predictive value. Cancer 119: 3454-61
Vroege ontdekking van epitheliale eierstokkanker
147
Lurie G et al. (2009) Prediagnostic symptoms of ovarian carcinoma: a case-control
study. Gynecol Oncol 114: 231-6
Macuks R et al. (2011) Diagnostic test for ovarian cancer composed of ovarian cancer
symptom index, menopausal status and ovarian cancer antigen CA125. Eur J
Gynaecol Oncol 32: 286-8
Menon U et al. (2009) Sensitivity and specificity of multimodal and ultrasound
screening for ovarian cancer, and stage distribution of detected cancers: results
of the prevalence screen of the UK Collaborative Trial of Ovarian Cancer Screening
(UKCTOCS). Lancet Oncol 10: 327-40
Nagle CM et al. (2011) Reducing time to diagnosis does not improve outcomes for
women with symptomatic ovarian cancer: a report from the Australian Ovarian
Cancer Study Group. J Clin Oncol 29: 2253-8
Nogueira da Costa A and Herceg Z (2012) Detection of cancer-specific epigenomic
changes in biofluids: powerful tools in biomarker discovery and application.
Mol Oncol 6: 704-15
Olivier RI et al.(2006) CA125 and transvaginal ultrasound monitoring in high-risk
women cannot prevent the diagnosis of advanced ovarian cancer. Gynecol Oncol
100: 20-6
Partridge E et al. (2009) Results from four rounds of ovarian cancer screening in
a randomized trial. Obstet Gynecol 113: 775-82
Pavlik EJ et al. (2009) The search for meaning-Symptoms and transvaginal sono­
graphy screening for ovarian cancer: predicting malignancy. Cancer 115: 3689-98
Piek JM et al. (2001) Dysplastic changes in prophylactically removed Fallopian tubes
of women predisposed to developing ovarian cancer. J Pathol 195: 451-6
Pinsky PF, Zhu C, Skates SJ, Black A, Partridge E, Buys SS, Berg CD (2013) Potential
effect of the risk of ovarian cancer algorithm (ROCA) on the mortality outcome of
the Prostate, Lung, Colorectal and Ovarian (PLCO) trial. Int J Cancer 132: 2127-33
Reade CJ et al. (2013) Risks and benefits of screening asymptomatic women for
ovarian cancer: a systematic review and meta-analysis. Gynecol Oncol 130: 674-81
Risch HA et al.(1983) Events of reproductive life and the incidence of epithelial ovarian
cancer. Am J Epidemiol 117: 128-39
Romero I et al. (2012) Minireview: human ovarian cancer: biology, current
management, and paths to personalizing therapy. Endocrinology 153: 1593-602
Rosenthal AN et al. (2013) Results of annual screening in phase I of the United
Kingdom familial ovarian cancer screening study highlight the need for strict
adherence to screening schedule. J Clin Oncol 31: 49-57
Rossing MA et al. (2010) Predictive value of symptoms for early detection of ovarian
cancer. J Natl Cancer Inst 102: 222-9
Saito M et al. (2005) Efficient screening for ovarian cancers using a combination of
tumor markers CA602 and CA546. Int J Gynecol Cancer 15: 37-44
Shields T et al. (2002) Occupational exposures and the risk of ovarian cancer in
Sweden. Am J Ind Med 42: 200-13
Silvera SA et al. (2007a) Dietary fiber intake and ovarian cancer risk: a prospective
cohort study. Cancer Causes Control 18: 335-41
Silvera SA et al. (2007b) Intake of coffee and tea and risk of ovarian cancer:
a prospective cohort study. Nutr Cancer 58: 22-7
Tate AR et al. (2009) Determining the date of diagnosis--is it a simple matter?
The impact of different approaches to dating diagnosis on estimates of delayed
care for ovarian cancer in UK primary care. BMC Med Res Methodol 9: 42
148
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Van der Velde NM et al. (2009) Time to stop ovarian cancer screening in BRCA1/2
mutation carriers? Int J Cancer 124: 919-23
Van Nagell JR, et al.(2011) Long-term survival of women with epithelial ovarian cancer
detected by ultrasonographic screening. Obstet Gynecol 118: 1212-21
Watson P and Lynch HT (1993) Extracolonic cancer in hereditary nonpolyposis
colorectal cancer. Cancer 71: 677-85
WCRF (2014) Food, Nutrition, Physical Activity, and the Prevention of Ovarian Cancer
2014. In: Research WCRFAIfC (ed) Continuous Update Project Report.
Woodward ER et al. (2007) Annual surveillance by CA125 and transvaginal ultrasound
for ovarian cancer in both high-risk and population risk women is ineffective.
BJOG 114: 1500-9
Zhang Y et al. (2004) Cigarette smoking and increased risk of mucinous epithelial
ovarian cancer. Am J Epidemiol 159: 133-9
Zhu CS et al. (2011) A framework for evaluating biomarkers for early detection:
validation of biomarker panels for ovarian cancer. Cancer Prev Res (Phila) 4: 375-83
Vroege ontdekking van epitheliale eierstokkanker
149
‘De overlevingswinst bij
eierstokkanker is het grootst als
type-II-tumoren in een vroeg stadium
kunnen worden ontdekt,
bijvoorbeeld met een screeningstest.’
Prof. dr. René Verheijen
6
eschouwing, belangrijkste
B
conclusies en beleidsaanbevelingen
In dit rapport is onderzocht of het mogelijk is om slokdarm-, alvleesklier of
eierstokkanker eerder te ontdekken dan het gebruikelijke moment van klinische
diagnosestelling aan de hand van de volgende vragen:
1.Welke onderscheidende klachten treden herkenbaar op in vroege stadia van de
kanker, zodat herkenning daarvan tot een eerdere diagnose zou kunnen leiden?
2.Kan diagnostiek eerder worden ingezet door het verminderen van patient en/of
doctor’s delay?
3.Is er een test in staat om de kanker eerder te ontdekken?
4.Wie lopen er hoog risico en bij wie zou bij identificatie van risicofactoren een
tumor eerder ontdekt kunnen worden?
Tenslotte is van belang vast te stellen voor welke eerder te ontdekken stadia eerdere
behandeling ook effectiever is (zie conceptueel kader).
Is test in staat
kanker eerder te
ontdekken?
Wie
loopt hoog
risico?
Vroeg te ontdekken (voor-)stadia
Voor welke (voor-)stadia is
eerdere behandeling effectief?
Welke onderscheidende
klachten treden herkenbaar op
in vroege stadia?
Klinische
diagnose
Gezondheidswinst
door eerdere
ontdekking en
behandeling
Kan diagnostiek
eerder worden
ingezet?
Beloop van de ziekte (tijd)
Figuur 6.1: Conceptueel kader van mogelijke mechanismen voor gezondheidswinst in
dit rapport.
Een beperking van de huidige inventarisatie is de korte periode (2002-2013) van
de uitgevoerde systematische literatuurstudie. Daarom is een aanvullende
search uitgevoerd, waarin gezocht is naar recentere publicaties van belangrijke
onderzoekers die uit de systematische literatuurstudie naar voren waren gekomen
en naar systematische reviews verschenen na 2013.
Meerwaarde van het onderzoek is de combinatie van een systematische aanpak
van het literatuuronderzoek en betrokkenheid van inhoudsdeskundigen, die zitting
hadden in de drie ingestelde tumorspecifieke begeleidingsgroepen. Zij werden op
verschillende momenten in het onderzoekstraject gevraagd om advies, bijvoorbeeld
over de gehanteerde zoekstrategieën, de uitkomst van het literatuuronderzoek,
bestaande richtlijnen, literatuur over carcinogenese en de uiteindelijke conclusies
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
151
en aanbevelingen per tumorsoort. Hierdoor werd naast de stand van wetenschap
ook de klinische praktijk in kaart gebracht en is er draagvlak bij de benaderde
experts voor de boodschap van het rapport. Belangrijk is ook het gehanteerde brede
perspectief, door de mogelijkheden voor vroege ontdekking niet te beperken tot
screening, maar ook te inventariseren of identificatie van klachten, symptomen
en risicofactoren en/of terugdringing van vermijdbare vertraging van de diagnose
kunnen leiden tot verbetering van vroege ontdekking. De meeste reviews beperken
zich namelijk tot één enkel aspect.
In deze beschouwing wordt ingegaan op wat de verworven kennis m.b.t. de onderzochte aspecten van vroege ontdekking betekent voor de vooraf gestelde beleids­
vragen. Zo worden de knelpunten van vroege ontdekking bij slokdarm-, alvleesklier- en
eierstokkanker op hoofdlijnen samengevat en per tumorsoort beschouwd (paragraaf
6.1). De kansen op het gebied van screening en surveillance voor de bestudeerde
tumorsoorten worden besproken (paragraaf 6.2). Vervolgens wordt aangegeven welke
implicaties de opgedane kennis m.b.t. de onderzochte aspecten van vroege ontdekking heeft voor de voorlichting (paragraaf 6.3), de klinische praktijk (paragraaf 6.4)
en onderzoek (paragraaf 6.5). In paragraaf 6.6 wordt de huidige infrastructuur voor
onderzoek en samenwerking met betrekking tot slokdarm-, alvleesklier- en eierstokkanker in Nederland beschreven. Dit hoofdstuk sluit af met de belangrijkste conclusies
uit dit rapport (paragraaf 6.7) en beleidsaanbevelingen op het gebied van voorlichting,
de klinische praktijk en onderzoek (paragraaf 6.8).
6.1Knelpunten bij de bestudeerde aspecten
van vroege ontdekking
Deze paragraaf gaat in op de knelpunten ten aanzien van de onderzochte aspecten
van vroege ontdekking, respectievelijk identificatie van klachten en symptomen,
risicofactoren en personen met een verhoogd risico, terugdringen van patient en
doctor’s delay en screening en/of surveillance. Er wordt een antwoord gegeven op de
vraag welke knelpunten ondervonden worden bij vroege ontdekking van slokdarm-,
alvleesklier- en eierstokkanker.
6.1.1
152
Vroege ontdekking op basis van klachten, symptomen en risicofactoren
Bij vroege ontdekking op basis van klachten, symptomen en risicofactoren van
slokdarm-, alvleesklier- en eierstokkanker werden de volgende knelpunten ervaren/
gevonden:
•Klachten, symptomen en/of risicofactoren zijn vaak niet onderscheidend genoeg
voor slokdarm-, alvleesklier- en eierstokkanker en bovendien zijn klachten en
symptomen vaak late signalen van de ziekte.
•Hoewel slokdarm-, alvleesklier- en eierstokkanker relatief veel voorkomen, ziet
een huisarts patiënten met deze soorten kanker maar zelden in haar/zijn praktijk
(gemiddeld eens in de drie tot vijf jaar) en kan de huisarts hier weinig ervaring
mee opdoen.
•Risicoprofilering op basis van klachten, symptomen en riscofactoren t.b.v. het
identificeren van individuen met een verhoogd risico op slokdarm-, alvleesklier-
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
en eierstokkanker is op dit moment nog niet mogelijk in de huisartsenpraktijk.
De huisarts heeft geen handvatten om patiënten te identificeren bij wie nader
onderzoek naar kanker nodig is. Dit bemoeilijkt het tijdig doorverwijzen van
patiënten die zich melden met klachten en symptomen die op slokdarm-,
alvleesklier- en eierstokkanker kunnen wijzen.
•Identificatie van hoogrisicogroepen is alleen mogelijk op grond van erfelijke/
familiaire factoren of klinische factoren.
Dat de rol van bepaalde klachten, symptomen en/of risicofactoren bij het vroeg­
ontdekken van (deze) kanker(soorten) gering is, illustreert een grootschalig Engels
onderzoek onder huisartspatiënten (Hippisley-Cox and Coupland 2011; 2012a; b).
Op basis van dit onderzoek was een algoritme voor een web-based tool ontwikkeld
(http://qcancer.org/female/), waarmee de huisarts het risico op kanker zou kunnen
berekenen voor patiënten die zich presenteren met bepaalde klachten of symptomen
(Hippisley-Cox and Coupland 2013a). Voor slokdarm-, alvleesklier- en eierstokkanker
is de web-based tool niet bruikbaar, vanwege de lage positief voorspellende
waarde van de risicoscore ( 0,6-1,2%, tabel 6.1). Dit onderzoek laat daarmee zien hoe
weinig onderscheidend veel voorkomende klachten, symptomen en risicofactoren
Tabel 6.1: Sensitiviteit, specificiteit en voorspellende waarde van een algoritme
waarmee het risico op kanker wordt berekend1 onder huisartspatiënten.
Algoritme bestaande uit meest voorspellende klachten, symptomen en/of
risicofactoren
Klachten en/of symptomen
Slokdarmkanker
Alvleesklierkanker
Eierstokkanker
Buikpijn
Eetlustverlies
Gewichtsverlies
Slikproblemen
Buikpijn
Eetlustverlies
Gewichtsverlies
Slikproblemen
Opgezette buik (alleen
voor vrouwen)
Constipatie (alleen voor
mannen)
Buikpijn
Eetlustverlies
Bloedarmoede
Opgezette buik
Bloedarmoede
Rectale bloeding
Postmenopauzale bloeding
Bloedbraken
Risicofactoren
Leeftijd
Roken
Leeftijd
Roken
Type 2 diabetes
Chronische pancreatitis
Leeftijd
Familiegeschiedenis van
eierstokkanker
Sensitiviteit2
77%
62%
63%
Specificiteit2
91%
91%
91%
0,6%
0,8%
Positief voorspellende waarde2 1,2%
1
Diagnose in de komende 2 jaar.
2
Bij 10% verwijzing voor nader diagnostisch onderzoek, nl. afkappunt op basis van 9e deciel van de individuele
risicoschattingen verkregen uit een algoritme op basis van een combinatie van de meest voorspellende klachten,
symptomen en risicofactoren.
Bron: Hippisley-Cox and Coupland (2011; 2012a; b).
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
153
voor de drie bestudeerde tumorsoorten zijn (zie tabel 6.1). Een beperking van dit
onderzoek was dat er geen gegevens over het stadium bij diagnose waren, zodat er
geen conclusies konden worden getrokken over de relatie tussen het optreden van
symptomen en klachten en het stadium van kanker.
Ook ander onderzoek wees uit dat klachten, symptomen en/of risicofactoren slecht
bruikbaar zijn om de aanwezigheid van slokdarm-, alvleesklier- en eierstokkanker
in een vroeg stadium vast te stellen, zoals hierna voor elk van de onderzochte
kankersoorten uiteengezet wordt.
Slokdarmkanker
Verschillende klachten en symptomen van slokdarmkanker, zoals slikproblemen,
gewichtsverlies en bloedbraken, treden pas op in een laat stadium. Hoewel
de frequentie en duur van refluxsymptomen de kans op slokdarmkanker en
op het voorstadium van slokdarmkanker (Barrett-slokdarm) verhogen, is de
aanwezigheid van refluxsymptomen geen bruikbare methode voor vroege
ontdekking van slokdarmkanker (Hippisley-Cox and Coupland 2013a), omdat deze
symptomen vrij veel in de bevolking voorkomen. Naar schatting heeft 4-9% van
de volwassenen dagelijks refluxsymptomen en 20% heeft ze wekelijks (Garside
et al. 2006). In deze groep zal naar schatting slechts 6-14% bij endoscopisch
onderzoek de diagnose Barrett-slokdarm krijgen. Bovendien zijn er waarschijnlijk
veel meer Barrett-slokdarmpatiënten in de bevolking (bij wie dit niet klinisch is
vastgesteld), omdat veel van deze Barrett- slokdarmpatiënten geen of weinig
refluxklachten ondervinden. Barrett-slokdarmpatiënten vormen wel een belangrijke
hoogrisicogroep voor het ontwikkelen van het adenocarcinoom van de slokdarm.
Alvleesklierkanker
Symptomen van alvleesklierkanker zijn meestal niet specifiek en kunnen ook bij
andere ziektes voorkomen. Pijn en een specifiek symptoom als geelzucht treden pas
op in een vergevorderd stadium. Een opgeblazen gevoel (bloating) en ongewoon
boeren (belching) (niet opgenomen in bovenbeschreven grootschalige studie)
hebben een sterke relatie met alvleesklierkanker (Holly et al. 2004), maar het is
onbekend in welke mate deze symptomen ook bij andere ziektes voorkomen.
Bovendien moet onderzoek nog uitwijzen aan welke tumorstadia de symptomen
opgeblazen gevoel en ongewoon boeren gerelateerd zijn.
Patiënten met alvleeskliercysten vormen een hoogrisicogroep voor alvleesklier­
kanker, omdat deze cysten maligne kunnen ontaarden. Pijn en misselijkheid
komen voor bij patiënten met pancreascysten, maar de meeste pancreascysten
zijn asymptomatisch en worden bij toeval ontdekt. Ook pancreatitispatiënten
hebben een verhoogd risico op het ontwikkelen van alvleesklierkanker. Klachten bij
chronische pancreatispatiënten worden vaak toegeschreven aan de pancreatitis,
maar kunnen ook te maken hebben met maligne ontaarding.
Eierstokkanker
Voor het eerder ontdekken van eierstokkanker in de huisartsenpraktijk zijn
verschillende symptomen-indices ontwikkeld om vrouwen te identificeren voor wie
nader onderzoek nodig is. De indices werken op basis van frequentie en ernst en
duur van een aantal symptomen (Goff et al. 2007; Lim et al. 2012; Rossing et al. 2010).
Hoewel m.b.v. de Goff-index meer dan de helft van de vroege stadia van eierstokkanker
154
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
(stadium I of II) (56-73%) in de onderzochte asymptomatische populatie kon worden
vastgesteld, was de positief voorspellende waarde heel laag (1-4%). Dat betekent dat
veel vrouwen onnodig diagnostisch onderzoek moesten ondergaan.
Klachten, symptomen en risicofactoren zijn daarom niet bruikbaar voor vroege
ontdekking van eierstokkanker. Er zijn wel hoogrisicogroepen voor het ontwikkelen
van eierstokkanker op basis van familiaire en genetische profielen.
6.1.2
Vermijdbare patient en doctor’s delay
Het (beperkte) onderzoek gaf geen duidelijke aanwijzingen voor (vermijdbare)
vertraging in het vaststellen van de diagnose, noch dat de prognose van slokdarm-,
alvleesklier- en eierstokkanker wordt beïnvloed door deze vormen van delay. Uit
een studie van de Engelse National Audit of Cancer Diagnosis in Primary Care
blijkt wel dat er grote variatie bestaat in het aantal keren dat een patiënt de
huisarts bezoekt, alvorens deze wordt doorverwezen vanwege een vermoeden op
kanker (Lyratzopoulos et al. 2012). Uit dit onderzoek blijkt dat patiënten met o.a.
alvleesklierkanker en eierstokkanker hun huisarts vaak drie of meer keer bezochten
wat mogelijk een indicatie kan zijn van delay in de eerste lijn bij diagnosestelling
(Lyratzopoulos et al. 2013).
Knelpunten met betrekking tot het terugdringen van vermijdbare vertraging in
de diagnosestelling (patient en/of doctor’s delay) zijn op basis van de bestudeerde
literatuur en de geraadpleegde experts niet aan te geven.
6.1.3
Screening en surveillance en geschatte gezondheidswinst
Voor de mogelijkheden van screening en een inschatting van de daarmee te behalen
gezondheidswinst vonden we de volgende knelpunten:
•Er is onvoldoende kennis over het natuurlijk verloop dat ten grondslag ligt aan de
carcinogenese.
•Het is onbekend welke premaligne afwijkingen maligne ontaarden en wanneer.
•Van de huidige beschikbare testen of technieken voor screening of surveillance
is niet bekend of deze een asymptomatisch voorstadium kunnen opsporen
waarvan behandeling leidt tot genezing of minder morbiditeit en/of betere
kwaliteit van leven.
•Een persoonsvriendelijke, tevens weinig belastende test of techniek die voor
screening in de asymptomatische populatie kan worden ingezet is momenteel
niet voorhanden.
•Gerandomiseerd onderzoek naar de effectiviteit van screening ontbreekt.
•Er is sprake van verouderde modelleerstudies.
Achtereenvolgens worden alle knelpunten besproken, en wat die voor de
afzonderlijke kankersoorten betekenen.
Voor het ontwikkelen van een efficiënte en effectieve strategie voor vroege
ontdekking van kanker is inzicht in de preklinische ontwikkeling van een tumor
onontbeerlijk. Welke afwijkingen zijn potentieel kwaadaardig, wanneer ontwikkelt
een afwijking zich tot een kwaadaardige tumor, hoe lang duurt het tot een
voorstadium of tumor klinisch detecteerbaar is? Onvoldoende kennis over het
natuurlijk beloop en het risico op maligne ontaarding van premaligne afwijkingen
speelt een rol bij alle drie de kankersoorten.
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
155
Voor screening is het van belang dat er een asymptomatisch voorstadium bekend is
dat met behulp van weinig invasieve technieken is op te sporen. Een screeningstest
moet een hoge sensitiviteit en specificiteit voor het opsporen van kanker in
een preklinisch (vroeg) stadium hebben. Bij voorkeur is de screeningstest ook
persoonsvriendelijk, wat betekent dat de test zo weinig mogelijk belastend moet
zijn voor de patiënt. Dat kan bijvoorbeeld een simpele bloed- of urinetest zijn of
een echoscopie. Voor alvleesklierkanker en eierstokkanker bestaan niet-invasieve
methoden die geschikt lijken voor vroege ontdekking in een asymptomatisch
populatie. Alvleeskliercystes bijvoorbeeld kunnen worden opgespoord met
beeldvormende technieken, terwijl een serumtest op de biomarker CA-125, vaak
in combinatie met transvaginale echografie (TVE) of transabdominale echografie,
wellicht geschikt is voor bij eierstokkanker. Deze testen zijn bestudeerd in lopende
en afgeronde RCT’s, maar de effectiviteit van screening op basis van deze methoden
is nog onbekend. Voor de vroege ontdekking van slokdarmkanker zijn op dit moment
goedkope, niet-invasieve screeningstesten voorhanden, die hoogrisicogroepen, zoals
Barrett-slokdarmpatiënten, kunnen identificeren en die in de algemene populatie
moeten worden onderzocht. Identificatie van een Barrett-slokdarm kan op dit
moment nog alleen worden vastgesteld door middel van endoscopisch onderzoek, een
voor de patiënt vervelende procedure.
Ten slotte is gerandomiseerd gecontroleerd onderzoek naar de effectiviteit van
screening op kanker essentieel om vast te stellen of de betreffende kanker te
ontdekken is in een stadium waarin de tumor nog succesvol behandeld (chirurgisch
verwijderd) kan worden én of daardoor de mortaliteit en/of morbiditeit aan kanker
wordt verlaagd.
156
Slokdarmkanker
Op dit moment zijn patiënten met Barrett-slokdarm de enige hoogrisicogroep waarin
vroege opsporing van slokdarmadenocarcinoom mogelijk is. Grove schattingen
geven aan dat een groot aantal (tussen de 92-98%) van de patiënten met Barrettslokdarm niet tijdig wordt gediagnosticeerd. De kans dat Barrett-slokdarmpatiënten
slokdarmkanker krijgen is echter klein, waardoor de kosten van een surveillance­
programma voor Barrett-slokdarmpatiënten hoog zijn. Risicostratificatie bij Barrettslokdarm kan de kosteneffectiviteit van een surveillanceprogramma verhogen.
Het is echter nog onbekend welke Barrett-slokdarmpatiënten een hogere kans
hebben om slokdarmkanker te ontwikkelen. De lengte van het Barrett-segment,
oesophagitis en endoscopisch zichtbare afwijkingen zijn in combinatie met dysplasie
mogelijk bruikbare klinische factoren voor stratificering. Probleem is echter dat het
diagnosticeren van dysplasie lastig is. Er bestaat grote variabiliteit in pathologische
interpretatie doordat dysplastisch weefsel endoscopisch niet of nauwelijks te
onderscheiden is van normaal cilinderepitheel en de histologische gradering van de
ernst van de dysplasie onderhevig is aan een hoge mate van subjectiviteit. Daarnaast
komt sampling error bij het nemen van biopten voor. Er is bij pathologen behoefte aan
een objectieve methode voor de vaststelling van de dysplasiegraad, aan de hand van
morfologische kenmerken en/of biomarkers.
De kosteneffectiviteit van screening op Barrett-slokdarm in nog niet bekend. Er zijn
tot dusver alleen modelleerstudies uitgevoerd bij een type risicogroep (50-jarige
blanke mannen met refluxsymptomen). Deze studies lieten zien dat screening
op Barrett-slokdarm (gevolgd door surveillance bij ontdekking van een Barrett-
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
slokdarm) met ultrathin endoscopie of de cytosponge meer kosteneffectief is dan
standaard endoscopie. Nader onderzoek moet de bruikbaarheid van deze technieken
t.b.v screening op (voorstadia van) slokdarm nog aantonen.
Alvleesklierkanker
Verschillende premaligne laesies en cysteuze afwijkingen zijn als voorstadium van
alvleesklierkanker geïdentificeerd. Er is echter nog geen test of techniek beschikbaar
om deze voorstadia te ontdekken. De uitdaging is een effectieve test of methode te
vinden waarmee alvleesklierkanker in dit voorstadium kan worden ontdekt.
Als alvleeskliercystes bij toeval worden ontdekt met beeldvormende technieken, is
het klinisch beloop van de cystes en de kans op maligne ontaarding nog onvoldoende
bekend, waardoor het onduidelijk is of en wanneer deze chirurgisch moeten worden
verwijderd.
Screening op alvleesklierkanker in de algemene populatie is niet zinvol, omdat de
detectiegraad en positief voorspellende waarde zeer laag zijn. Screening m.b.v.
beeldvormende technieken lijkt alleen zinvol in hoogrisicogroepen, maar het is nog
onbekend of dit tot sterftereductie leidt.
Eierstokkanker
Wat vroege ontdekking van eierstokkanker compliceert is de heterogeniteit in
tumortypen. Binnen de epitheliale tumoren (grootste groep eierstoktumoren) zijn
verschillende tumortypen te onderscheiden met elk hun eigen ontstaanswijze en
ontwikkeling. Er is nog weinig bekend over de preklinische ontwikkeling van deze
verschillende tumoren. Voor het ontwikkelen van een effectieve strategie voor
vroege ontdekking van epitheliale eierstokkanker is verder inzicht in de preklinische
ontwikkeling van de histologische te onderscheiden type-I- en II-tumoren dan ook
onontbeerlijk. De grootste groep betreft de sereuze type II epitheliale tumoren, die
klinisch vaak in een vergevorderd stadium worden gediagnosticeerd. Van dit type
kanker is inmiddels bekend dat ze primair buiten de eierstokken ontstaan, namelijk
in de eileiders en pas secundair in de eierstokken zullen worden aangetroffen.
Eenmaal in de eierstokken zijn ze vaak al in een gevorderd stadium. Het is inmiddels
duidelijk dat eierstoktumoren moeten worden ingedeeld op basis van hun genetische
karakteristieken (door middel van DNA-sequencing). Hoewel er specifieke biomarkers
geassocieerd zijn met deze genetische kenmerken, is onbekend in welk stadium van
carcinogenese de betreffende tumor zich dan bevindt.
Voor eierstokkanker zijn in de afgelopen decennia enkele grootschalige trials opgezet
met als doel een effectieve screeningstest voor eierstokkanker te ontwikkelen en/of te
implementeren. Om zowel langzaam- (type I) als snelgroeiende tumoren (type II) vroegtijdig te ontdekken zijn screeningsprogramma’s ontworpen die gebruik maken van
zowel de CA-125 biomarker als beeldvormende technieken. Tot nog toe heeft dit grootschalige onderzoek nog niet kunnen bevestigen dat dergelijke screeningsprogramma’s
leiden tot vermindering van de sterfte of ziektelast. De resultaten van de grootste
Engelse UKCTOCS trial onder 200.000 vrouwen worden pas rond 2015 verwacht.
Schattingen van de gezondheidswinst (daling van de sterfte en/of ziektelast) door
screening is momenteel dus alleen mogelijk voor screening op eierstokkanker,
omdat alleen voor deze kanker screeningsprogramma’s in de algemene populatie in
gerandomiseerd onderzoek zijn onderzocht. Bij het ontbreken van gerandomiseerd
onderzoek voor het vaststellen van de effectiviteit van screening kunnen modelleer­
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
157
studies opgezet worden om de mogelijke gezondheidswinst te schatten. Veel van de
uitgevoerde modelleerstudies voor alvleesklierkanker en slokdarmkanker berusten
echter niet op recente gegevens.
6.2Kansen met betrekking tot screening en
surveillance
Er zijn verschillende kansen om de mogelijkheden van screening en/of surveillance
bij hoogrisicogroepen in de toekomst te bevorderen.
Slokdarmkanker
Er zijn nieuwe technieken voor het diagnosticeren van een Barrett-slokdarm
ontwikkeld, zoals string-capsule endoscopie, ultrathin endoscopie en de
cytosponge. Deze methoden zijn minder invasief en dus minder belastend voor de
patiënt dan conventionele endoscopie en bieden kansen voor screening op Barrettslokdarm. Onderzoek moet dit uitwijzen.
Verbeterde endoscopische beeldvorming maakt het tevens mogelijk om gerichter
biopsieën te nemen, waardoor zowel detectie van dysplasie als identificatie van
biomarkers die voorspellend zijn voor maligne ontaarding bij Barrett-slokdarm,
worden vergroot. Deze verbeterde technologieën vergroten de kans dat nieuwe
biomarkers voor maligne ontaarding worden ontdekt. Dat kan vervolgens weer
leiden tot betere risicostratificatie van Barrett-slokdarmpatiënten en mogelijk een
kosteneffectieve surveillancestrategie.
Alvleesklierkanker
De ontwikkeling van alvleesklierkanker kent waarschijnlijk een lange periode voor
klinische ontdekking, waardoor er een grote ‘window of opportunity’ voor vroege
ontdekking en behandeling lijkt te zijn. Dat biedt kansen voor screening. Zowel op
het gebied van beeldvormende technieken als in het onderzoek naar biomarkers zijn
er nieuwe ontwikkelingen die kansen bieden om asymptomatische voorstadia te
ontdekken. Zo wordt momenteel onderzocht of risicostratificatie bij patiënten met
pancreascysten mogelijk is aan de hand van morfologische kenmerken (imaging) en
analyse van biomarkers in bijvoorbeeld pancreasvocht, bloed of urine. Een betere
inschatting van de kans op het ontwikkelen van een maligniteit bij pancreascystes is
van belang voor de klinische besluitvorming m.b.t. chirurgisch ingrijpen.
Eierstokkanker
De meest gebruikte biomarker voor de vroegdetectie van eierstokkanker, CA-125,
lijkt beter bruikbaar te zijn voor de agressievere sereuze vormen van eierstokkanker
(type II), dan voor de langzaam groeiende tumoren (type I). Voor eierstokkanker is
een algoritme op basis van het CA-125-gehalte (in bloed) ontwikkeld, dat beter is
dan een simpel afkappunt voor elke vrouw. Dit algoritme werd toegepast in een
screeningsprogramma in de algemene bevolking in een grote gerandomiseerde trial
in Engeland. Dit onderzoek liet zien dat screening met het CA-125 algoritme vaker
de snelgroeiende type-II-tumoren ontdekt dan screening met alleen TVE. Of dit
algoritme als screeningsmethode leidt tot sterftereductie moet worden afgewacht.
De uitkomsten hiervan worden in 2015 verwacht.
158
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Er is nog geen eenduidig beeld van de te verwachte effecten van screening. In een
recente Amerikaanse trial (PLCO) zorgde screening er niet voor dat eierstokkanker
vaker in een vroeg stadium werd ontdekt (ten opzichte van geen screening in de
controlegroep). Er werd dan ook geen sterftereductie waargenomen. In de nog
lopende Britse trial (UKCTOCS) is het percentage ontdekte eierstoktumoren in een
vroeg stadium wel hoger dan in de PLCO-trial. Toepassing van het CA-125 algoritme
op de gegevens van de PLCO-trial in secundaire data-analyses, leverde desondanks
nog steeds geen sterftereductie op. Er werd daarentegen wel een (geringe)
sterftereductie voorspeld in een modelanalyse gebruikmakend van SEER-data en
gegevens van de UKCTOCS.
Verbeterde beeldvormende technieken en bloedbepalingen bieden mogelijkheden
om kleinere tumoren te ontdekken dan voorheen mogelijk was.
Tabel 6.2: Positief voorspellende waarde van de 9 signalen van kanker bij mannen en
vrouwen
Positief voorspellende waarde
van de belangrijkste2 symptomen
bij vrouwen (Hippisley-Cox and
Coupland 2013b)
Positief voorspellende waarde
van de belangrijkste2 symptomen
bij mannen (Hippisley-Cox and
Coupland 2013a)
1.Blijvende heesheid of hoest; bloed in
opgehoest slijm
8% (bloed ophoesten)
10% (bloed ophoesten)
2.Slikklachten; als slikken pijn doet of als het
eten in de slokdarm niet goed zakt
8%
13%
5.Een verdikking of bobbeltje ergens in het
lichaam
Knobbel in borst; 11%
Knobbel in de nek; 10%
6.Vrouw: ongewoon vaginaal bloedverlies,
abnormale afscheiding buiten de
menstruatieperiode
Man: pijn of veranderingen aan de
zaadballen, zoals zwelling of verharding
Postmenopauzale bloedingen; 7%
De 9 signalen van kanker
(KWF Kankerbestrijding)1
3.Moedervlekken en huidplekjes die
veranderen, of die nieuw zijn
4.Een plekje dat schilfert, of een bobbeltje op
de huid
7.Blijvende verandering in de ontlasting
zonder duidelijke aanleiding; bloedverlies
en/of slijm bij de ontlasting
8.Veranderingen bij het plassen: moeilijker
kunnen plassen, vaker moeten plassen, pijn
bij het plassen of bloed in de urine
Moeilijker kunnen plassen; 14%
9.Gewichtsverlies zonder aanleiding
11%
Andere symptomen, klachten of
risicofactoren
Bloedarmoede
6%
Haematurie
Veneus trombo-embolisme
19%
13%
5%
1 Bron: KWF Kankerbestrijding (2007-2010).
2Symptomen met de hoogste positief voorspellende waarde voor de diagnose van kanker (in komende 2 jaar),
ongeacht het type kanker.
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
159
6.3
Implicaties voor de voorlichting
Het onderzoek onder huisartspatiënten van Hippisley-Cox leverde een lijst op
van klachten, symptomen en risicofactoren met de hoogste associatie met
kanker ongeacht het soort kanker. Vergelijking met de bekende negen signalen
van kanker uit de campagne van KWF Kankerbestrijding (2007-2010) laat zien
dat er veel overeenkomsten zijn, maar ook dat een aantal klachten, symptomen
en risicofactoren uit het genoemde onderzoek niet voorkomen op de lijst van
negen alarmsymptomen, namelijk bloedarmoede, veneus thrombo-embolisme
(bij vrouwen) en heamaturie (bij mannen) (tabel 6.2). Opvallend is ook dat een
aantal van de negen signalen van KWF Kankerbestrijding niet voorkomen in de
lijst met de factoren met de hoogste voorspellende waarde in het onderzoek onder
huisartspatiënten (Hippisley-Cox and Coupland 2013a; b). Gezien de lage positief
voorspellende waarde is de voorlichting over signalen die op kanker kunnen duiden
door KWF Kankerbestrijding weinig zinvol en meer een taak voor de beroepsgroepen
(bijvoorbeeld NHG: Thuisarts.nl), mede doordat bepaalde symptomen ook op
andere ziektebeelden kunnen wijzen. Het algemene advies blijft om met klachten en
symptomen die aanhouden naar de huisarts te gaan.
Beleid gericht op verhoging van de kennis en het bewustzijn bij huisarts en publiek van
klachten en symptomen zal bij slokdarm-, alvleesklier- en eierstokkanker geen grote
gezondheidswinst opleveren. Publieksvoorlichting verdient derhalve geen prioriteit.
Er ligt een taak voor huisartsen en andere zorgprofessionals om bij een diagnose
van met name alvleesklier- en eierstokkanker patiënten te behoeden voor eventuele
schuldgevoelens over het niet tijdig onderkennen van klachten en symptomen.
Ervaren klachten en symptomen zijn namelijk vaak late signalen van de ziekte.
6.4
Implicaties voor de klinische praktijk
In dit onderdeel beschrijven we wat de bevindingen van het onderzoek met
betrekking tot de verschillende aspecten van vroege ontdekking van slokdarm-,
alvleesklier- en eierstokkanker voor de klinische praktijk kunnen betekenen. We gaan
in op patiëntengroepen die extra aandacht vragen, adviezen uit richtlijnen op het
gebied van de onderzochte aspecten van vroege ontdekking en de aandacht voor
hoogrisicogroepen voor het ontwikkelen van kanker.
6.4.1
Patiëntengroepen die extra aandacht vragen
Volgens experts bestaat bij pancreatitispatiënten de kans op vertraging van
de diagnose doordat mogelijke symptomen van alvleesklierkanker worden
toegeschreven aan de pancreatitis. Bovendien is een tumor bij pancreatitis moeilijk
te detecteren met beeldvorming.
De diagnose van alvleesklierkanker wordt relatief laat gesteld en curatief
(chirurgisch) ingrijpen is dan slechts in zeer beperkte mate mogelijk. De verschillen
in overleving naar stadia en de mate van curatieve behandeling naar stadium zijn tot
nu toe relatief klein. Hoewel het aantal resecties bij stadium I en II in de afgelopen
jaren is toegenomen, ondergaan niet alle patiënten met stadium I en II resectie.
160
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
6.4.2
Adviezen uit richtlijnen m.b.t. surveillance en screening
Slokdarmkanker
Systematische screening op Barrett-slokdarm wordt op dit moment niet aanbevolen. Wel stelt een Nederlandse richtlijn (in ontwikkeling) dat het aanvragen van
aanvullende diagnostiek (gastroscopie) vanuit de eerste lijn, gericht op het stellen
van de diagnose Barrett-slokdarm, overwogen kan worden bij blanke mannen
ouder dan vijftig jaar met langdurige (> 5 jaar) ernstige (dagelijkse) refluxklachten
en bij personen met een familiegeschiedenis van slokdarmkanker.
Hoewel er geen bewijs is dat surveillance van Barrett-slokdarmpatiënten
kosteneffectief is, bevelen bestaande Engelse en Amerikaanse richtlijnen aan om
patiënten met een Barrett-slokdarm op te nemen in een surveillanceprogramma.
In Nederland wordt eveneens aanbevolen om Barrett-slokdarm patiënten die
bekend zijn te volgen in een surveillanceprogramma (Schenk et al. 2013). Het
risico op carcinogenese in Barrett-slokdarm neemt toe met de toename van
de dysplasiegraad. Risicostratificatie naar dysplasiegraad wordt om die reden
vooralsnog aanbevolen (Schenk et al. 2013).
Alvleesklierkanker
Onlangs is consensus bereikt over het beleid ten aanzien van patiënten met een
verhoogd risico op familiaire alvleesklierkanker door het International Cancer of
the Pancreas Screening (CAPS) Consortium (Canto et al. 2013). De richtlijn beveelt
screening van hoogrisicogroepen aan, maar geeft ook aan dat meer onderzoek nodig
is met betrekking tot patiënten bij wie laesies zijn ontdekt. Volgens deze richtlijn zou
screening voor de volgende groepen moeten worden overwogen:
•
I ndividuals with three or more affected blood relatives, with at least one affected
First Degree Relative (FDR), should be considered for screening.
•Individuals with at least two affected FDRs with PC, with at least one affected
FDR, should be considered for screening once they reach a certain age.
•Individuals with two or more affected blood relatives with PC, with at least one
affected FDR, should be considered for screening.
•All patiënts with Peutz–Jeghers syndrome should be screened, regardless of
family history of PC.
•p16 carriers with one affected FDR should be considered for screening.
•BRCA2 mutation carriers with one affected FDR should be considered for
screening.
•BRCA2 mutation carriers with two affected family members (no FDR) with PC
should be considered for screening.
•PALB2 mutation carriers with one affected FDR should be considered for
screening.
•Mismatch repair gene mutation carriers (Lynch syndrome) with one affected FDR
should be considered for screening.
De experts bevelen aan om in Nederland een eenduidige richtlijn voor het beleid
ten aanzien van patiënten met een verhoogd risico op familiaire pancreaskanker te
ontwikkelen en uit te dragen.
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
161
Eierstokkanker
Voor hoogrisicogroepen van eierstokkanker is in Nederland momenteel een
nieuwe consensus-based richtlijn voor erfelijke en familiaire eierstokkanker in
ontwikkeling (verwacht in 2015-16). Hierin wordt geadviseerd om vrouwen met
een BRCA1- of BRCA2-mutatie, vrouwen met een erfelijke aanleg voor Lynchsyndroom, vrouwen met Peutz-Jeghers-syndroom en vrouwen zonder aangetoonde
mutatie (bij henzelf of hun aangedane verwanten) uit een familie met twee of meer
eerstegraads verwanten met eierstokkanker, te verwijzen naar een gynaecoloog met
aandachtsgebied erfelijke kanker. Op dit moment wordt BRCA1/2-mutatiedragers
geadviseerd om preventief de eierstokken en eileiders te laten verwijderen,
aangezien screening op eierstokkanker niet effectief is in het verlagen van sterfte
aan eierstokkanker.
6.4.3
Aandacht voor hoogrisicogroepen voor het ontwikkelen van kanker
Voor de drie bestudeerde kankersoorten zijn in de algemene populatie
hoogrisicogroepen te identificeren op grond van erfelijke/familiaire kenmerken of
klinische factoren. Het betreft relatief kleine groepen:
Slokdarmkanker
•Patiënten met een Barrett-slokdarm (ongeveer 2.500 nieuwe patiënten per jaar).
•Patiënten met een familiegeschiedenis van slokdarmkanker.
Alvleesklierkanker
•Patiënten met bepaalde genetische profielen of familiegeschiedenis van
alvleesklierkanker.
•Chronische pancreatitispatiënten.
•Patiënten met alvleeskliercystes (2-20% van de algemene bevolking).
Eierstokkanker
•Patiënten met bepaalde genetische profielen of een familiegeschiedenis van
eierstok- en/of borstkanker.
Voor deze hoogrisicogroepen kan beleid gericht op preventie worden ingezet,
bijv. screening of surveillance, advies (bijv. leefstijladviezen) of profylactische
behandeling (bijv. verwijderen van de eierstokken). Voor de meeste van deze
hoogrisicogroepen bestaan klinische richtlijnen met aanbevelingen voor de zorg
voor/management van deze patiënten.
6.5
Implicaties voor onderzoek
Vogelstein en collega’s (2013) zijn van mening dat in de komende tien tot twintig jaar
de kankersterfte met meer dan 75% kan worden gereduceerd, maar dat dit alleen
mogelijk is als men zich primair richt op onderzoek naar vroege ontdekking en
preventie en niet op therapie van gemetastaseerde tumoren. De geïnventariseerde
knelpunten en kansen in dit rapport geven aan waar het toekomstig onderzoek
zich op zou moeten richten. Daarom zijn een groot aantal aanbevelingen voor
onderzoek gedaan in laatste paragraaf van de tumorspecifieke hoofdstukken over
respectievelijk slokdarm- (hoofdstuk 3), alvleesklier- (hoofdstuk 4) en eierstokkanker
(hoofdstuk 5). Langetermijnbeleid van financiers van onderzoek is van belang om
vroege ontdekking bij deze tumorsoorten te bevorderen.
162
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
6.6Huidige infrastructuur voor onderzoek en
samenwerking
Slokdarmkanker
•Er is in Nederland geen structuur voor onderzoek en samenwerking op het
gebied van vroege ontdekking van slokdarmkanker.
Alvleesklierkanker
•De samenwerking op het gebied van alvleesklierkanker, maar ook de opzet van
cohortonderzoek en de infrastructuur voor weefselopslag t.b.v. onderzoek in
Nederland is uniek vergeleken met andere Europese landen.
•De wijze waarop in Nederland wordt samengewerkt en het opgezette
cohortonderzoek in Nederland biedt kansen voor een betere prognose van
alvleesklierkankerpatiënten.
•Voor familiare pancreaskanker is een goede infrastructuur opgezet met een
landelijke dekking en medewerking vanuit alle klinisch-genetische centra, die
daarbij strenge inclusiecriteria hanteren. Thans worden zo’n 300-350 familiair
belaste personen gescreend op alvleesklierkanker.
•Voor alvleeskliercystes is een en ander nog minder ontwikkeld; inspanning
vinden met name op nationaal niveau plaats. Er is veel enthousiasme voor
nationale screening van deze hoogrisicogroep. Dit omdat er onduidelijkheid is
over wat te doen bij cystes die op een CT-scan worden gezien. Er zijn wensen om
dit op dezelfde manier aan te pakken als gebeurt bij familiair belaste personen
voor alvleesklierkanker. Er is een Dutch Pancreatic Cancer Group (DPCG) die zich
hiermee bezighoudt. Men wil voor de opslag van cysteweefsel aansluiten bij de
pancreasparel van Parelsnoer.
Eierstokkanker
•Bijna al het onderzoek naar vroege ontdekking van eierstokkanker vindt
plaats in Engeland en is geconcentreerd rondom UKCTOCS (aanjager op dit
gebied). Er is daarbuiten nog niet veel gestart om eierstokkanker eerder te
kunnen ontdekken of om nieuwe (bio)markers te vinden. In Nederland vindt
binnen de STOET (Stichting Opsporing Erfelijke Tumoren) overleg plaats over
lopende initiatieven gericht op vroege ontdekking van eierstokkanker. Er is
geen overzicht c.q. coördinatie met betrekking tot onderzoek en eventuele
weefselopslag.
In dit rapport wordt het belang onderstreept van opslag van lichaamsmaterialen
(bloed, serum, cystevocht, uitstrijkjes, biopten) in biobanken ten behoeve van
onderzoek naar premaligne en vroege stadia en maligne ontaarding van voorstadia,
om kanker eerder te kunnen ontdekken. De huidige wet- en regelgeving voor opslag
van lichaamsmateriaal, de ‘Code Goed Gebruik’, is opgesteld voor gebruik van
restmateriaal en niet voor gebruik van lichaamsmateriaal van personen, waar het
veelal bij dit type onderzoek om gaat. Tevens laat deze regelgeving internationale
uitwisseling en opslag van elders verzameld weefsel niet, of slechts met moeite, toe.
Dit leidt er toe dat onderzoek aan lichaamsmateriaal van personen moeizaam van
de grond komt en dan alleen nog in het kader van lokale studies, terwijl nationale en
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
163
internationale samenwerking in screeningsstudies of cohortstudies uit- of minstens
achterblijft. Dit beperkt de mogelijkheden in het vinden van nieuwe strategieën om
kanker eerder te ontdekken.
6.7
Belangrijkste conclusies uit dit rapport
Op basis van de inventarisatie verricht voor dit rapport kunnen de volgende
conclusies worden getrokken over de mogelijkheden van vroege ontdekking van
slokdarm-, alvleesklier- en eierstokkanker.
•Op korte termijn zijn er geen verbeteringen te verwachten wat betreft de vroege
ontdekking van slokdarm- en alvleesklierkanker voor de algemene bevolking. Wel
zijn er mogelijkheden voor vroege ontdekking in hoogrisicogroepen.
•Bij slokdarmkanker is een heel duidelijke risicogroep bekend: patiënten met een
Barrett-slokdarm. Er is nog geen optimale surveillancestrategie vastgesteld.
De hiervoor nog te beantwoorden vragen zijn:
-Welke Barrett-slokdarmpatiënten moeten in een surveillanceprogramma
worden opgenomen?
-Hoe en hoe vaak moet surveillance plaatsvinden?
- Wanneer is behandeling bij Barrett-slokdarmpatiënten nodig?
•Naast mensen met familiaire alvleesklierkanker, chronische pancreatitis en
bepaalde erfelijke genetische syndromen hebben ook personen met (toevallig
vastgestelde) alvleeskliercystes een verhoogd risico op alvleesklierkanker. Het
is echter onbekend hoe hoog het risico op alvleesklierkanker bij individuen
met asymptomatische alvleeskliercystes is en welke alvleeskliercystes zich
kunnen ontwikkelen tot premaligne afwijkingen. Bestaande criteria op basis
van beeldvorming en analyse van cystevloeistof zijn nog onvoldoende voor de
selectie van patiënten die in aanmerking moeten komen voor een operatie.
Het is daarom onbekend wat een kosteneffectieve follow-upstrategie voor
deze hoogrisicogroep is en wanneer er tot chirurgische resectie moet worden
overgegaan.
•Voor eierstokkanker bestaan er screeningstesten die vroege stadia kunnen
opsporen in de algemene populatie, maar het is onbekend of screening op
basis van deze testen leidt tot sterftereductie. Van de ter beschikking staande
screeningstesten voor eierstokkanker (serumtesten, echografie en de combinatie
daarvan) is de effectiviteit momenteel onvoldoende aangetoond om het invoeren
van een landelijk screeningsprogramma voor de opsporing van eierstokkanker te
rechtvaardigen. Ook de speciaal voor eierstokkanker ontwikkelde symptomen­
index blijkt niet voldoende voorspellend te zijn om eierstokkanker in een vroeg
stadium te ontdekken. De uitkomst van de grootste gerandomiseerde trial naar
de effectiviteit van screening op eierstokkanker zal over één tot twee jaar een
antwoord geven op de vraag of screening op eierstokkanker kan leiden tot een
daling van de sterfte of ziektelast in de algemene bevolking en welk (im)materieel
prijskaartje daaraan hangt.
•Het is voor de huisarts heel moeilijk om op basis van klachten en symptomen
slokdarm-, alvleesklier- en eierstokkanker in een vroeg stadium te ontdekken.
•In het algemeen kan gesteld worden dat er nog onvoldoende kennis bestaat
over de carcinogenese van slokdarm-, alvleesklier- en eierstokkanker. Kennis
164
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
over identificeerbare premaligne afwijkingen en de kans op en tijdsduur
van de ontwikkeling tot maligniteit is essentieel voor het vinden van
aangrijpingspunten voor vroege ontdekking.
Voor overige conclusies m.b.t. de bestudeerde aspecten van vroege ontdekking
per tumorsoort wordt verwezen naar de laatste paragraaf van hoofdstuk 3
voor slokdarm­k anker, hoofdstuk 4 voor alvleesklierkanker en hoofdstuk 5 voor
eierstokkanker.
6.8
Beleidsaanbevelingen
Aanbevelingen m.b.t. voorlichtingsbeleid
•Aanbevolen wordt om de bevindingen van de huidige inventarisatie geschikt te
maken voor algemene publiek en patiënten, met specifieke aandacht voor:
-het feit dat klachten en symptomen late signalen zijn en dat patiënten zich
niet schuldig hoeven te voelen over het feit dat ze lang hebben gewacht om
met dergelijke signalen naar de dokter te gaan;
-de reden waarom screening en/of bevolkingsonderzoek bij slokdarmkanker-,
alvleesklierkanker en eierstokkanker op dit moment nog niet tot de
mogelijkheden behoort.
Aanbevelingen ten aanzien van de klinische praktijk
•Zolang klachten en symptomen weinig onderscheidend zijn, moet de indicatie
voor het verrichten van nadere diagnostiek op kanker worden afgewogen in het
licht van een individuele patiëntprofilering, waarbij zowel de familiaire belasting,
leefomstandigheden en gewoonten, medische geschiedenis en bijkomende
klachten en symptomen van belang zijn.
•Er moet meer aandacht komen voor groepen met een verhoogd risico op het
ontwikkelen van kanker. Zowel kennis van geïdentificeerde risicogroepen als
kennis van de mogelijkheden voor surveillance is van belang.
•Het is van belang om personen met een verhoogd risico op slokdarm- en
alvleesklier­­kanker te includeren in lopende en nieuw te starten cohorten gericht
op surveillance om meer kennis te verwerven over het carcinogeneseproces en
het daadwerkelijke risico op kanker in hoogrisicogroepen. Voor het trekken van
conclusies zijn groepen van voldoende omvang in deze cohorten van belang.
Aanbevelingen m.b.t. onderzoek
•Langetermijninvesteringen zijn juist nodig bij kankersoorten waar nog weinig
inzicht bestaat in de carcinogenese, zoals slokdarm-, alvleesklier- en eierstokkanker. Dit om vooruitgang te kunnen boeken m.b.t. de prognose van deze
patiënten, zowel op het gebied van vroege ontdekking als van behandeling.
Dit vraagt om langetermijnbeleid van financiers van onderzoek, zoals KWF
Kankerbestrijding en ZonMW. Daarnaast kunnen andere partijen, zoals zorg­
verzekeraars, bij de financiering van multicenter, prospectief (cohort)onderzoek
en de daarbij behorende registraties en weefselopslag een rol spelen.
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
165
•De huidige inventarisatie laat zien dat er mogelijkheden op het gebied van
vroege ontdekking bij de bestudeerde tumorsoorten bestaan (grote ‘window
of opportunity’, identificatie van hoogrisicogroepen, ontwikkeling van minder
invasieve en patiëntvriendelijke tests voor surveillance en screening). Nader
onderzoek is nodig om dit te bevestigen.
-Onderzoek gericht op het identificeren van groepen met een verhoogd
risico op het ontwikkelen van kanker en de follow-up daarvan in
onderzoekscohorten moet worden gestimuleerd.
-Binnen deze cohorten is weefselopslag in biobanken en goede registratie
van belang om meer inzicht te kunnen verwerven in het carcinogenese­
proces, de voorstadia en de kans op maligne ontaarding van deze voorstadia.
-Vragenlijsten gericht op het in kaart brengen van klachten, symptomen
en risicofactoren zouden structureel onderdeel moeten uitmaken
van deze onderzoeksprotocollen, om eventueel frequent optredende
patronen hierin te herkennen.
-Onderzoek gericht op risicostratificatie binnen hoogrisicogroepen, zoals
modelleerstudies, moet worden gestimuleerd om de (kosten)effectiviteit van
surveillance en/of screening te vergroten (t.a.v. sterftereductie, verlaging van
de ziektelast en kosteneffectieve benadering).
-Onderzoek gericht op het ontwikkelen en valideren van innovatieve detectie­
methoden t.b.v. screening moet worden gestimuleerd.
-Onderzoek gericht op het ontwikkelen van patiëntvriendelijke en
kosteneffectieve surveillancestrategiën bij hoogrisicogroepen is van belang
om de haalbaarheid van surveillance te vergroten.
-De aanwezigheid van een grote ‘window of opportunity’ voor vroege
ontdekking biedt mogelijkheden om met de inzet van de nieuwe omicstechnieken en met de analyse van andere weefselbronnen dan alleen serum,
relevante biomarkers voor vroege stadia te identificeren, in eerste instantie
met name bij hoogrisicogroepen.
•In Nederland worden bij het opzetten en uitvoeren van weefselonderzoek
gericht op het ontdekken van premaligne of vroege stadia van kanker en bij
het bestuderen van de maligne ontaarding van voorstadia knelpunten ervaren.
Voor iedere nieuw geïdentificeerde marker (op eiwit-, RNA- of DNA-niveau) of
nieuwe detectietechniek die op opgeslagen lichaamsmateriaal van personen
onderzocht moet worden, moet niet alleen opnieuw goedkeuring van de
Medisch Ethische Commissie, maar tevens een nieuw een informed consent
worden verkregen, omdat het hierbij niet om restweefsel van patiënten gaat. De
huidige wet- en regelgeving voor opslag van lichaamsmateriaal, primair gericht
op de bescherming van het individu, bemoeilijkt niet alleen de uitvoering van
dit type onderzoek in Nederland, maar tevens de internationale uitwisseling
van patiëntenmateriaal en daardoor de internationale samenwerking op dit
gebied. Dit terwijl grootschalig internationaal multicenter onderzoek naar van
detectie van premaligne en vroege stadia en de kans op maligne ontaarding
juist van belang is. Diverse partijen zoals KWF Kankerbestrijding, ZonMW, maar
ook de beroepsgroep en de zorgverzekeraars, zouden onderzoekers kunnen
ondersteunen bij langdurige en administratief belastende processen van
goedkeuring door Medisch Ethische Commissies of het verkrijgen van een breder
geldend informed consent. Ook zouden zij deze problematiek (inter)nationaal
kunnen agenderen.
166
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Tumorspecifieke aanbevelingen m.b.t. infrastructuur en samenwerking
•Er moet een nationale database voor Barrett-slokdarmpatiënten komen. De
beroepsgroep kan een rol spelen bij het onderbrengen van patiënten in de
database. Vastgesteld moet worden welke karakteristieken bij Barrett-slokdarm
in deze database geregistreerd moeten worden. Voor de karakterisering van
Barrett-slokdarmpatiënten (met name dysplasiegraad) moet een expertpanel
worden opgezet. Dit moet leiden tot minder variatie in beoordeling en
kwaliteitsbevordering van de karakterisering. De nieuwe Barrett-richtlijn geeft
advies m.b.t. behandeling bij Barrett-slokdarmpatiënten (bij welke groepen
behandeling aangewezen is). De acht in Nederland vastgestelde expertisecentra
moeten ziekenhuizen adviseren over klinisch beleid bij Barrett-slokdarm.
•Het is van belang om screening onder nieuw geïdentificeerde hoogrisicogroepen
voor het ontwikkelen van alvleesklierkanker gestructureerd op te zetten.
Als voorbeeld hiervoor dient de screening zoals die in Nederland plaatsvindt
voor familiair belaste personen met een hoog risico op het ontwikkelen van
pancreaskanker. Hier ligt een taak voor de beroepsgroep.
•Er is in Nederland behoefte aan overzicht c.q. coördinatie van het onderzoek
naar vroege ontdekking van eierstokkanker en de eventuele hieraan gekoppelde
weefselopslag. Hier ligt een taak voor de beroepsgroep.
Voor overige tumorspecifieke aanbevelingen wordt verwezen naar de laatste
paragraaf van hoofdstuk 3 voor slokdarmkanker, hoofdstuk 4 voor alvleesklierkanker
en hoofdstuk 5 voor eierstokkanker.
6.9
Referenties
Canto MI et al. (2013) International Cancer of the Pancreas Screening (CAPS)
Consortium summit on the management of patients with increased risk for
familial pancreatic cancer. Gut 62: 339-47
Schenk E et al. (2013) Wat is de optimale surveillance strategie bij diagnose Barrettslokdarm en hoe dient deze te geschieden? richtlijn in ontwikkeling
Garside R, et al. (2006) Surveillance of Barrett’s oesophagus: exploring the
uncertainty through systematic review, expert workshop and economic
modelling. Health Technol Assess 10: 1-142, iii-iv
Goff BA et al. (2007) Development of an ovarian cancer symptom index: possibilities
for earlier detection. Cancer 109: 221-7
Hippisley-Cox J and Coupland C (2011) Identifying patients with suspected gastrooesophageal cancer in primary care: derivation and validation of an algorithm.
Br J Gen Pract 61: e707-14
Hippisley-Cox J and Coupland C (2012a) Identifying patients with suspected
pancreatic cancer in primary care: derivation and validation of an algorithm.
Br J Gen Pract 62: e38-45
Hippisley-Cox J, and Coupland C (2012b) Identifying women with suspected ovarian
cancer in primary care: derivation and validation of algorithm. BMJ 344: d8009
Hippisley-Cox J and Coupland C (2013a) Symptoms and risk factors to identify men
with suspected cancer in primary care: derivation and validation of an algorithm.
Br J Gen Pract 63: e1-10
Beschouwing, belangrijkste conclusies en beleidsaanbevelingen
167
Hippisley-Cox J and Coupland C (2013b) Symptoms and risk factors to identify women
with suspected cancer in primary care: derivation and validation of an algorithm.
Br J Gen Pract 63: e11-21
Holly EA et al. (2004) Signs and symptoms of pancreatic cancer: a population-based
case-control study in the San Francisco Bay area. Clin Gastroenterol Hepatol 2:
510-7
Lim AW et al. (2012) Predictive value of symptoms for ovarian cancer: comparison of
symptoms reported by questionnaire, interview, and general practitioner notes.
J Natl Cancer Inst 104: 114-24
Lyratzopoulos G et al. (2013) Measures of promptness of cancer diagnosis in primary
care: secondary analysis of national audit data on patients with 18 common and
rarer cancers. Br J Cancer 108: 686-90
Lyratzopoulos G et al. (2012) Variation in number of general practitioner
consultations before hospital referral for cancer: findings from the 2010 National
Cancer Patient Experience Survey in England. Lancet Oncol 13: 353-65
Nederlands HuisartsenGenootschap (2014) Standpunt oncologische zorg in de
huisartsenpraktijk
Rossing MA et al. (2010) Predictive value of symptoms for early detection of ovarian
cancer. J Natl Cancer Inst 102: 222-9
Vogelstein B et al. (2013) Cancer genome landscapes. Science 339: 1546-58
168
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Begrippenlijst
Biomarker
Een kenmerk, vastgelegd op DNA-, RNA- of eiwitniveau, dat objectief te meten is
in cellen of lichaamsvloeistoffen en onder meer gebruikt wordt als indicatie van
de kans op kanker en als screeningstest.
95%-Betrouwbaarheidsinterval
Intervalschatting voor een parameter. In tegenstelling tot een puntschatting
geeft een betrouwbaarheidsinterval een heel interval van betrouwbare waarden
(schattingen) van de parameter. Bij herhaling van de procedure, met steeds
nieuwe (aselecte) steekproeven uit dezelfde populatie, mogen we verwachten
dat 95 procent van de zo berekende intervallen de waarde van de parameter
zullen bevatten.
Carcinogenese
Ontstaan en groei van kanker, veroorzaakt door veranderingen in het erfelijke
materiaal van normale cellen.
Case-controlestudie
Een observationele studie waar men een groep met een bepaalde conditie (de
‘cases’) vergelijkt met een vergelijkbare groep zonder diezelfde conditie (de
‘controls’). Men vergelijkt bijvoorbeeld patiënten met een bepaalde kankersoort
met gezonde personen, om te kijken of er bepaalde risicofactoren geassocieerd
zijn met een verhoogde kans op deze kankersoort. De kansverhouding (odds)
van wel en niet hebben van een bepaalde risicofactor onder de ‘cases’ wordt
vergeleken met die kansverhouding in de ‘controles’. De ratio van beide, de odds
ratio (OR), oftewel de factor waarmee de kansverhoudingen verschillen, vormt
de uitkomstmaat.
Patient delay
De tijd die verloopt tussen het hebben van klachten en het presenteren van deze
klachten aan de huisarts.
Cohort
Een onderzoeksgroep die gedurende een bepaalde periode wordt blootgesteld
aan een bepaalde risicofactor of interventie (bijvoorbeeld een uitnodiging voor
deelname aan screening).
Cohortonderzoek
Cohortonderzoek kan prospectief zijn, waarbij een groep mensen gevolg wordt
in de tijd, of retrospectief, waarbij het vaststellen van de uitkomst het startpunt
van het onderzoek is en men vervolgens teruggaat in de tijd. Zo volgt men in een
prospectieve cohortstudie personen die al of niet een risicofactor hebben of al of
niet een interventie ondergaan (bijv. screening) in de tijd en kijkt of ze al dan niet
de ziekte of het probleem ontwikkelen.
Confounding bias
Wanneer bij case-controleonderzoek de te vergelijken groepen van gescreende
en niet-gescreende personen verschillen in risicofactoren voor kankersterfte
kan dit leiden tot een onjuiste schatting van het effect van screening op
de kankersterfte. Er is dan sprake van verstoring van het effect, oftewel
confounding bias.
Begrippenlijst
171
Delay
Vermijdbare late behandeling door een vertraging in het vaststellen van de
diagnose en/of een vertraging tussen de diagnose en de start van behandeling.
Detectiecijfer/rate
Het aantal ontdekte kankergevallen per duizend deelnemers aan de screening.
Doctor’s delay
De tijd die verloopt tussen het presenteren van symptomen door de patiënt en
het vast stellen van de diagnose
Effectiviteit van een screeningsprogramma
Mate waarin een screeningsprogramma leidt tot verminderde ziektelast,
sterftereductie en betere kwaliteit van leven (gezondheidswinst), vastgesteld in
gerandomiseerd onderzoek.
Foutnegatief
De screeningstest valt negatief uit, terwijl de ziekte wel aanwezig is. Als de test
veel foutnegatieve uitkomsten heeft, betekent dit dat de test weinig gevoelig is
(een lage sensitiviteit heeft) voor de betrokken ziekte.
Foutpositief
De screeningstest valt positief uit, terwijl de ziekte niet aanwezig is blijkens de
nadere diagnostiek. Als de test veel foutpositieve uitkomsten heeft, betekent
dit dat de test weinig specifiek is (een lage specificiteit heeft) voor de betrokken
ziekte.
Gezondheidswinst
Winst als gevolg van een interventie (zoals screening of surveillance) in termen
van verminderde ziektelast, sterftereductie en betere kwaliteit van leven
Hoogrisicogroepen
Personen met een reeds vastgesteld (sterk) verhoogd risico op het ontwikkelen
van kanker.
ICER
Incremental cost effectiveness ratio. Verhouding van de verandering in kosten
(C) en effecten (E) als gevolg van interventie (i): ICER = (C – Ci) / (E – Ei) . Het is
een maat om de kosten en effecten van een bepaalde interventie, bijvoorbeeld
screening, te vergelijken.
Incidentie
Het aantal nieuwe gevallen van een aandoening binnen een specifiek tijdvak.
Kosteneffectiviteit
De kosteneffectiviteit van een screeningsprogramma zegt iets over de
meerwaarde van screenen ten opzichte van een alternatieve benadering
(bijvoorbeeld geen screening), uitgedrukt in extra kosten per gewonnen
levensjaar of QALY (quality-adjusted life year)
Meta-analyse
Meta-analyse is een kwantitatieve samenvatting van de resultaten van
afzonderlijke onderzoeken. Meta-analyse kan bestaan uit het combineren van
de resultaten van afzonderlijke onderzoeken tot één overall schatting van het
bestudeerde effect (poolen) en/of uit het bestuderen van mogelijke bronnen van
heterogeniteit.
Modelleerstudie
Wiskundige studie waarin met behulp van aannames de effecten van een
interventie, bijv. screening, worden voorspeld, vaak door gebruik te maken van
computer-gegenereerde (simulatie) gegevens .
172
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Negatief voorspellende waarde (NVW)
Proportie van testuitslagen met als uitslag geen verdenking op kanker waarbij
geen kanker wordt gediagnosticeerd.
Odds ratio (OR)
Zie case-controlestudie.
Overleving
Het percentage patiënten dat een bepaald aantal jaren na diagnose nog in leven
is. De gepresenteerde overleving is de relatieve overleving, een benadering voor
de kankerspecifieke overleving. Dit houdt in dat de waargenomen overleving
is gecorrigeerd voor de verwachte sterfte die is gebaseerd op de Nederlandse
populatie vergelijkbaar op basis van geslacht, leeftijd en kalenderjaar. Omdat de
overleving sterk kan verschillen per leeftijdsgroep is ook gestandaardiseerd naar
leeftijdsgroep.
Positief voorspellende waarde (PVW)
Proportie van testuitslagen met als uitslag een verdenking op kanker waarbij
kanker wordt gediagnosticeerd.
Precursorlaesie
Voorloperstadium waaruit een tumor kan ontstaan.
Progressie
Voortgaande verandering in een kwaadaardige tumor.
QALY
Quality-adjusted life year. Een maat waarmee de gezondheidswinst van een
bepaalde interventie kan worden bepaald, waarin zowel de kwantiteit als de
kwaliteit van het leven wordt meegenomen.
Randomiseren
Bij een experimenteel onderzoek de proefpersonen willekeurig (at random)
verdelen over de experimentele onderzoeksgroep en de controlegroep.
RCT
Random Controlled Trial, studie waarbij personen vooraf willekeurig ingedeeld
worden in groepen om het effect van een interventie te meten.
Relatief risico (RR)
Ook wel risicoratio genoemd. De verhouding tussen twee absolute risico’s.
Uitkomstmaat van een experimenteel onderzoek (een gerandomiseerde
screeningstrial) of van een observationeel onderzoek.
Risicofactoren
Factoren (demografisch, genetisch, levenstijl-, klinisch) die de kans op het krijgen
van een bepaalde ziekte of aandoening verhogen.
Risicostratificatie
Indeling van een groep personen naar hun kans op ziekte.
Screening
Vroege opsporing bij een nader gedefinieerde groep personen, die geen
symptomen hebben en zich niet ziek voelen, om een bepaalde ziekte of
aandoening in een dusdanig vroeger stadium te ontdekken dat er betere en
effectievere behandelingsmogelijkheden zijn.
Selectiebias
Vertekening van de studieresultaten doordat deelnemers aan screening van
niet-deelnemers kunnen verschillen in kenmerken zoals sociaaleconomische
status die, naast het screeningseffect, invloed hebben op de uitkomstmaat van
de studie.
Begrippenlijst
173
Sensitiviteit
De gevoeligheid van een diagnostische test of techniek om alle personen met de
gezochte ziekte te identificeren. De sensitiviteit van een test wordt voornamelijk
bepaald door het aantal fout negatieve testen (aantal ‘gemiste tumoren’).
Specificiteit
Het onderscheidend vermogen van een diagnostische test of techniek om
alle niet-zieke personen als zodanig te identificeren. De specificiteit van een
diagnostische test wordt voornamelijk bepaald door het aantal foutpositieve
testen (aantal keren ‘vals alarm’).
Stadium
Zie TNM-stadium.
Surveillance
Periodieke controle van individuen met een reeds vastgesteld (sterk)
verhoogd risico op het ontwikkelen van een bepaalde ziekte of aandoening
(hoogrisicogroepen).
TNM-stadium
Uitgebreidheid van een kankerproces. Hierbij worden drie kenmerken betrokken:
de grootte van de tumor (T), uitzaaiingen in de nabij gelegen lymfeklieren (N), en
uitzaaiingen (metastasen, M) op afstand in andere organen.
Ziektelast
De hoeveelheid gezondheidsverlies in een populatie door een bepaalde ziekte.
174
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Bijlage
Informatie over de SCK en haar
werkgroepen
De Signaleringscommissie Kanker (SCK) is in 1997 geïnstalleerd door het bestuur
van KWF Kankerbestrijding met als taak het bestuur van advies te dienen over te
verwachten ontwikkelingen binnen de kankerbestrijding. De SCK heeft verschillende
(tijdelijke) werkgroepen van experts ingesteld die studie verrichten naar
uiteenlopende deelgebieden binnen de kankerbestrijding. De SCK fungeert hierbij als
overkoepelend orgaan.
In de SCK heeft een aantal vaste leden zitting, alsmede de voorzitters van de door de
SCK ingestelde werkgroepen gedurende de looptijd van de studie. Zowel vaste als
tijdelijke leden worden benoemd door het bestuur van KWF Kankerbestrijding. De
werkgroepen hebben evenals de SCK zelf een brede samenstelling. De SCK-leden en
de werkgroepleden verlenen hun medewerking op vrijwillige basis.
De rapporten van de SCK zijn bestemd voor verschillende doelgroepen, waaronder
zorgverleners, patiëntenverenigingen, zorgverzekeraars, voorlichters, onderzoekers
en beleidsmedewerkers binnen de gezondheidszorg en de overheid. Het beoogde
doel van deze signaleringsrapporten is beleid op het gebied van de kankerbestrijding
te initiëren, te sturen en zo nodig bij te stellen. De signaleringsrapporten zijn als pdf
te downloaden van de website van KWF Kankerbestrijding: www.kwf.nl.
Eerder verschenen signaleringsrapporten:
•Signaleringsrapport Kanker 1999 en bijbehorend Deelrapport Zorg (1999)
•Ultraviolette straling en huidkanker (2002)
•De rol van voeding bij het ontstaan van kanker (2004)
•Vroege opsporing van dikkedarmkanker; Minder sterfte door
bevolkingsonderzoek (2004)
•Kanker in Nederland; Trends, prognoses en implicaties voor zorgvraag (2004)
•Beeldvormende technieken binnen de kankerbestrijding; Vizier op de toekomst
(2005)
•De rol van lichaamsbeweging bij preventie van kanker (2005)
•Advies inzake wachttijdnormen in de kankerzorg (2006)
•Allochtonen en kanker; Sociaal-culturele en epidemiologische aspecten (2006)
•Biomarkers en kankerbestrijding (2007)
•Kwaliteit van kankerzorg in Nederland (2010)
•De relatie tussen kanker, zonnestraling en vitamine D (2010)
•Nazorg bij kanker: de rol van de eerste lijn (2011)
•Kanker in Nederland tot 2020. Trends en prognoses (2011)
•Kwaliteit van kankerzorg in Nederland, voortgang en blik op de toekomst (2014)
•Toegankelijkheid van dure kankergeneesmiddelen. Nu en in de toekomst (2014)
Bijlage
175
De SCK is per 1 januari 2014 als volgt samengesteld:
Voorzitter
Prof.dr. A. (Ate) van der Zee, hoogleraar Gynaecologische Oncologie, afdeling
Obstetrie & Gynaecologie en lid Raad van Bestuur, Universitair Medisch Centrum
Groningen, Groningen
Vicevoorzitter
Prof.dr. C. (Chris) Meijer, emeritus hoogleraar Pathologie, afdeling Pathologie, VUmc,
Amsterdam
Leden
Prof.dr. N. (Neil) Aaronson, hoogleraar Kwaliteit van leven bij chronische en/
of levensbedreigende ziekten, Universiteit van Amsterdam en hoofd afdeling
Psychosociaal Onderzoek en Epidemiologie, Nederlands Kankerinstituut,
Amsterdam
Prof.dr. N. (Nicole) Blijlevens, hoofd afdeling Hematologie en hoogleraar
Hematologie, Radboudumc, Nijmegen
Dr. E. (Els) Borst-Eilers, oud-voorzitter Nederlandse Federatie van
Kankerpatiëntenorganisaties, Utrecht († februari 2014)
Prof.dr. W. (Winette) van der Graaf, hoofd Oncologie en hoogleraar Medische
Oncologie, Radboudumc, Nijmegen
Prof.dr. ir. K. (Koos) van der Hoeven, hoogleraar Medische Oncologie, hoofd afdeling
Klinische Oncologie, Leids Universitair Medisch Centrum, Leiden
Drs. R. (Ronald) Keus, radiotherapeut-oncoloog, Arnhems Radiotherapeutisch
Instituut, Arnhem
Prof.dr. H. (Harry) de Koning, hoogleraar Maatschappelijke Gezondheidszorg &
Evaluatie van vroegopsporing van ziekten, Erasmus MC, Rotterdam
Prof.dr. J. (Jean) Muris, universitair hoofddocent, vakgroep Huisartsgeneeskunde,
Maastricht Universitair Medisch Centrum, Maastricht
Prof. dr. J. (Johan) Polder, chief science officer Gezondheidseconomie, Rijksinstituut
voor Volksgezondheid en Milieu en Tilburg University, Tilburg
Prof. dr. L. (Lonneke) van de Poll-Franse, hoogleraar Kankerepidemiologie en
overleving, School of Social and Behavioral Sciences, Tilburg University, Tilburg en
hoofd Onderzoek IKZ, Eindhoven
Prof.dr. J. (Jaap) Stoker, hoofd Research en hoogleraar Radiologie, afdeling
Radiologie, Academisch Medisch Centrum, Amsterdam
176
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Appendix 1.1
Algemene vroeg­opsporingscriteria
Omvangrijke gezondheidswinst:
• gewonnen levensjaren
• cognitieve, motorieke en/of sociaal-emotionele verbetering
• vergroting van (be)handelingsopties
Effecten eenduidig vastgesteld, liefst in gerandomiseerd onderzoek
Geringe mate van ongunstige neveneffecten:
• mate van vervroeging, overdiagnose en neveneffecten geschat
• voor kwaliteit van leven gecorrigeerde levensjaren
Balans inzichtelijk voor deelname
Redelijke verhouding tussen kosten en effecten
Implementatie leidt niet tot omvangrijke onbedoelde effecten (ongelijkheid)
Ontwikkelingen op andere terreinen veranderen de afweging op korte termijn niet
Bron: De Koning, H. J. (2009). De mysterieuze massa. Oratie uitgesproken dd. 26.06.2009 ter gelegenheid van de
aanvaarding van de leerstoel Evaluatie van vroegopsporing van ziekten. Rotterdam, Erasmus MC.
Geactualiseerde criteria voor het aanbieden van screening: samenvatting van de
screening criteria voorgesteld afgelopen 40 jaar.
1. Het screeningsprogramma moet inspelen op een erkende behoefte
2. Het doel van de screening moet bij aanvang zijn vastgesteld
3. De doelgroep van de screening moet zijn vastgesteld
4. De effectiviteit van het screeningsprogramma moet wetenschappelijk bewezen zijn
5.Het programma moet een samenhangend geheel zijn van opleiding, scholing, testpraktijk, zorg en
programmamanagement
6. De kwaliteit van het programma moet geborgd zijn om de potentiële risico’s van screening te minimaliseren
7.Het programma moet garanties bieden voor geïnformeerde keuze en de privacy en de autonomie van het individu
respecteren
8. De toegankelijkheid van de screening moet gewaarborgd zijn voor de hele doelgroep
9. Het programma moet vanaf het begin geëvalueerd worden
10.De voordelen van de screening moeten opwegen tegen de mogelijke nadelen van de screening
Bron: Andermann A, Blancquaert I, Beauchamp S, Déry V. Revisiting Wilson and Jungner in the genomic age:
a review of screening criteria over the past 40 years. Bulletin of the World Health Organisation 2008; 86(4): 317-319.
Appendix 1.1
17 7
Huidige ‘UK National Screening Committee Criteria’.
The condition
1. The condition should be an important health problem.
2.The epidemiology and natural history of the condition, including development from latent to declared disease,
should be adequately understood and there should be a detectable risk factor, disease marker, latent period or
early symptomatic stage.
3.All the cost-effective primary prevention interventions should have been implemented as far as If the carriers of a
mutation are identified as a result of screening, the natural history of people with this status should be understood, including the psychological implications.
The test
4.There should be a simple, safe, precise and validated screening test.
5.The distribution of test values in the target population should be known and a suitable cut-off level defined and
agreed.
6.The test should be acceptable to the population.
7.There should be an agreed policy on the further diagnostic investigation of individuals with a positive test result
and on the choices available to those individuals.
8.If the test is for mutations, the criteria used to select the subset of mutations to be covered by screening, if all
possible mutations are not being tested, should be clearly set out.
The treatment
9.There should be an effective treatment or intervention for patients identified through early detection, with
evidence of early treatment leading to better outcomes than late treatment.
10.There should be agreed evidence-based policies covering which individuals should be offered treatment and the
appropriate treatment to be offered.
11.Clinical management of the condition and patient outcomes should be optimised in all healthcare providers prior
to participation in a screening programme.
The screening programme
12.There should be evidence from high-quality randomised controlled trials that the screening programme is
effective in reducing mortality or morbidity. Where screening is aimed solely at providing information to allow
the person being screened to make an informed choice (eg, Down’s syndrome, cystic fibrosis carrier screening),
there must be evidence from high-quality trials that the test accurately measures risk. The information that is
provided about the test and its outcome must be of value and readily understood by the individual being screened.
13.There should be evidence that the complete screening programme (test, diagnostic procedures, treatment/
intervention) is clinically, socially and ethically acceptable to health professionals and the public.
14.The benefit from the screening programme should outweigh the physical and psychological harm (caused by the
test, diagnostic procedures and treatment).
15.The opportunity cost of the screening programme (including testing, diagnosis and treatment, administration,
training and quality assurance) should be economically balanced in relation to expenditure on medical care as a
whole (ie value for money). Assessment against this criteria should have regard to evidence from cost benefit and/
or cost-effectiveness analyses and have regard to the effective use of available resource.
16.All other options for managing the condition should have been considered (eg, improving treatment, providing
other services), to ensure that no more cost-effective intervention could be introduced or current interventions
increased within the resources available.
17.There should be a plan for managing and monitoring the screening programme and an agreed set of quality
assurance standards.
18.Adequate staffing and facilities for testing, diagnosis, treatment and programme management should be
available prior to the commencement of the screening programme.
19.Evidence-based information, explaining the consequences of testing, investigation and treatment, should be
made available to potential participants to assist them in making an informed choice.
20.Public pressure for widening the eligibility criteria for reducing the screening interval, and for increasing the
sensitivity of the testing process, should be anticipated. Decisions about these parameters should be scientifically
justifiable to the public.
21.If screening is for a mutation, the programme should be acceptable to people identified as carriers and to other
family members.
Bron: www.patient.co.uk/doctor/screening-programmes-in-the-uk.
178
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Wilson en Jungner klassieke screening criteria (1968).
1.De op te sporen ziekte moet een belangrijk gezondheidsprobleem zijn
2.Er moet een algemeen aanvaarde behandelingsmethode voor de ziekte zijn
3.Er moeten voldoende voorzieningen voorhanden zijn voor diagnose en behandeling
4.Er moet een herkenbaar latent of vroeg symptomatisch stadium van de ziekte zijn
5.Er moet een betrouwbare opsporingsmethode bestaan
6.De opsporingsmethode moet aanvaardbaar zijn voor de bevolking
7.Het natuurlijke verloop van de op te sporen ziekte moet bekend zijn
8.Er moet overeenstemming bestaan over de vraag wie behandeld moet worden
9.De kosten van opsporing, diagnostiek en behandeling moeten in een acceptabele verhouding staan tot de kosten
van de gezondheidszorg als geheel
10.Het proces van opsporing moet een continu proces zijn en niet een eenmalig project
Bron: Wilson JMG, Jungner G. Principles and practice of screening for disease. Geneva: WHO, 1968.
Appendix 1.1
179
Appendix 1.2
Stand van zaken (proef-)bevolkings­
onderzoeken in Nederland
Bevolkingsonderzoek borstkanker
In 1989 werd het huidige landelijke bevolkingsonderzoek naar borstkanker
geleidelijk ingevoerd, aanvankelijk voor vrouwen tussen vijftig en zeventig jaar.
In 1998 is dat uitgebreid naar de leeftijd van 75 jaar en sindsdien worden alle
vrouwen in de leeftijd van vijftig tot en met 75 jaar iedere twee jaar uitgenodigd
voor mammografie. Ieder jaar worden er 1,3 miljoen vrouwen uitgenodigd voor
screening, waarvan ongeveer 80% daadwerkelijk deelneemt. Inmiddels is er
een duidelijk effect van screening waar te nemen op de borstkankersterfte in de
doelgroep. In 2010 was het borstkankersterftecijfer 30% lager dan het gemiddeld
cijfer in de jaren 1986-88, de jaren voor de invoering van het bevolkingsonderzoek
(Landelijke Evaluatie Team voor bevolkingsonderzoek naar Borstkanker (LETB)
2014). Vanaf 2010 wordt het bevolkingsonderzoek naar borstkanker geheel
uitgevoerd met behulp van digitale mammografie. Naar aanleiding van discussie
over het nut van screening op borstkanker en nieuwe ontwikkelingen (o.a. digitale
mammografie) heeft de minister van VWS in juni 2012 de Gezondheidsraad verzocht
om het huidige bevolkingsonderzoek opnieuw te beoordelen en te kijken naar
nieuwe ontwikkelingen voor het optimaliseren en/of verbeteren van screening.
Dit advies is op 22 januari 2014 uitgebracht, waarin wordt geconcludeerd dat het
bevolkingsonderzoek in Nederland aanzienlijke gezondheidswinst oplevert en dient
te worden voortgezet en verbeterd, bijvoorbeeld door risicostratificatie op basis van
dichtheid van het borstweefsel (Gezondheidsraad 2014).
Bevolkingsonderzoek baarmoederhalskanker
Het huidige landelijke bevolkingsonderzoek naar baarmoederhalskanker is in 1996
ingevoerd. Sindsdien worden vrouwen in de leeftijdscategorie van dertig tot en
met zestig jaar iedere vijf jaar uitgenodigd om deel te nemen aan dit onderzoek.
Het onderzoek bestaat uit het zgn. uitstrijkje (Pap-test), dat wordt onderzocht
op afwijkende cellen (cytologie) die kunnen duiden op baarmoederhalskanker
of de voorstadia hiervan, cervicale intra-epitheliale neoplasie (CIN). Vanaf 2016
zal cytologie worden vervangen door een test op de aanwezigheid van humaan
papillomavirus-(hrHPV)-typen die een verhoogd risico op baarmoederhalskanker
met zich meebrengen. Aan vrouwen die geen gehoor geven na (herhaalde)
herinneringsuitnodigingen zal de hrHPV-thuistest worden aangeboden.
Jaarlijks neemt ca. 65% van de doelgroep mee aan het bevolkingsonderzoek. Bij de
vrouwen die hebben deelgenomen aan de screening in 2010, kreeg 0,8% een directe
verwijzing naar de gynaecoloog wegens sterk afwijkende cytologie. Vier op de
duizend gescreende vrouwen had ernstige dysplasie en 2,4 op de 10.000 gescreende
vrouwen had baarmoederhalskanker (Landelijke Evaluatie Bevolkingsonderzoek
Baarmoederhalskanker (LEBA) 2011).
Appendix 1.2
181
Bevolkingsonderzoek darmkanker
In januari 2014 is het landelijk bevolkingsonderzoek naar darmkanker gestart.
Geleidelijk zullen mannen en vrouwen in de leeftijdscategorie 55 tot en met 75 jaar
worden uitgenodigd voor deelname. In tegenstelling tot de twee eerdere beschreven
bevolkingsonderzoeken, is de primaire screeningstest een zelftest/thuistest. Het
gaat om een ontlastingstest die thuis moet worden afgenomen en vervolgens ter
beoordeling moet worden opgestuurd naar het laboratorium. Deze test, de zgn.
immunochemische Fecaal Occult Bloed Test (iFOBT), spoort bloed in de ontlasting
op. Een positieve iFOBT wordt gevolgd door een coloscopie waarmee de dikke
darm wordt bekeken naar voorstadia van darmkanker (poliepen) of kanker. Naar
verwachting zal dit bevolkingsonderzoek vanaf 2039 jaarlijks 2400 sterfgevallen aan
darmkanker voorkomen (Gezondheidsraad 2009).
Proefbevolkingsonderzoeken
Er bestaan momenteel drie proefbevolkingsonderzoeken waarin de effectiviteit
van screening wordt/werd onderzocht in een gerandomiseerde trial, te weten voor
prostaatkanker, longkanker en blaaskanker.
1. European Randomized Study of Screening for Prostate Cancer (ERSPC trial).
De ERSPC is een multicenterstudie, die wordt uitgevoerd in acht Europese landen.
Voor dit project werden voornamelijk mannen tussen 55-69 jaar gerekruteerd. De
meeste mannen in de screeningsgroep worden iedere vier jaar uitgenodigd voor
een prostaatspecifiek antigeen-(PSA)-test. Na een gemiddelde follow-up van elf jaar
werd 21% minder prostaatkankersterfte waargenomen in de screeningsgroep ten
opzichte van de controlegroep die geen systematische screening was aangeboden
(Schroder, Hugosson et al. 2012). Uit modelberekeningen blijkt dat het voordeel van
screening met PSA lager uitvalt door verlies aan QALY’s wegens langetermijneffecten
na behandeling (Heijnsdijk et al. 2012). Daarom zijn lange follow-upgegevens van
zowel de ERSPC als kwaliteit-van-levenanalyses en een kosteneffectiviteitsanalyse
onmisbaar voordat een eventueel bevolkingsonderzoek naar prostaatkanker kan
worden aanbevolen.
2. Nederlands-Leuvens Longkanker Screenings Onderzoek (NELSON-studie).
In 2003 is de NELSON-studie gestart met als doel na te gaan of screening in een
hoogrisicogroep met behulp van low dose CT (LDCT) de sterfte aan longkanker kan
verminderen. De hoogrisicogroep bestaat uit rokers en ex-rokers (minder dan tien
jaar voor randomisatie gestopt met roken), die langer dan 25 jaar dagelijks meer
dan vijftien sigaretten roken (rookten) of die langer dan dertig jaar dagelijks meer
dan tien sigaretten roken (rookten) (Van Klaveren et al. 2009). Deelnemers in de
screeningsgroep worden uitgenodigd voor screening met LDCT bij aanvang van
de studie (eerste ronde), één jaar later (tweede ronde), drie jaar later (derde ronde),
en 5,5 jaar later (vierde ronde). In 2013 verschenen de resultaten van de eerste drie
screeningsronden, waarin 209 longtumoren door screening zijn gedetecteerd bij
200 deelnemers in de screeningsgroep. Meer dan de helft van de gedetecteerde
longtumoren waren adenocarcinoma’s (51,2%) en de grote meerderheid werd
gediagnosticeerd in een vroeg stadium (stadium I, 70,8%) (Horeweg et al. 2013).
Het effect van screening op de longkankersterfte wordt de komende jaren verder
onderzocht om een antwoord te geven op de vraag of longkankerscreening in deze
hoogrisicogroep effectief is.
182
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
3. Blaaskanker Urine Marker Project (BLU-P studie).
In 2008 is de BLU-P-studie gestart met als doel het bestuderen van de
testeigenschappen van op moleculaire technieken gebaseerde methodes om
blaaskanker onder de algemene bevolking op te sporen. Uit eerdere pilotstudies,
waarin gebruik is gemaakt van een hematurietest voor het opsporen van bloed in
de urine, bleek dat bij ongeveer 20% van de deelnemers cystoscopie, een belastende
en dure onderzoeksmethode, volgde bij een positieve test. De bedoeling van de
BLU-P-studie is dan ook het aantal cystoscopieën te beperken en te onderzoeken
welke (combinatie van) tests daartoe het beste in staat zijn (Gezondheidsraad.
Commissie WBO 2007; Roobol et al. 2010). In de urine van mannen met een positieve
haematurietestuitslag worden de vier verschillende moleculaire tests uitgevoerd
gericht op de markers NMP22 (Nuclear matrix protein 22), FGFR3-(Fibroblast growth
factor receptor 3)-mutatie, microsatellieten en MLPA-(Multiplex ligation-dependent
probe amplification)-methylering (Roobol et al. 2010). Vorig jaar zijn de resultaten
van dit project gepubliceerd, die laten zien dat screening op blaaskanker met behulp
van thuisurinesticks en moleculaire markers haalbaar is. Hoewel het gebruik
van moleculaire markers het aantal cystoscopieën verminderde, werden zeer
weinig urotheliale tumoren (0,23%) in een asymptomatische Europese bevolking
gediagnosticeerd (Bangma et al. 2013).
Referenties
Bangma et al. (2013) Outcomes of a bladder cancer screening program using home
hematuria testing and molecular markers. Eur Urol 64(1): 41-47.
Gezondheidsraad (2009) Bevolkingsonderzoek naar darmkanker. Den Haag,
Gezondheidsraad. publicatienr. 2009/13.
Gezondheidsraad (2014) Bevolkingsonderzoek naar borstkanker: verwachtingen en
ontwikkelingen. Den Haag, Gezondheidsraad. publicatienr. 2014/01.
Gezondheidsraad. Commissie WBO (2007). Wet bevolkingsonderzoek: moleculaire
tests voor screening op blaaskanker. Den Haag, Gezondheidsraad. publicatienr.
2007/01WBO.
Heijnsdijk EA et al. (2012) Quality-of-life effects of prostate-specific antigen
screening. N Engl J Med 367(7): 595-605.
Horeweg N et al. (2013) Characteristics of lung cancers detected by computer
tomography screening in the randomized NELSON trial. Am J Respir Crit Care
Med 187(8): 848-854.
Landelijke Evaluatie Bevolkingsonderzoek Baarmoederhalskanker (LEBA) (2011) LEBA
rapportage tot en met 2011. E. MC. Rotterdam.
Landelijke Evaluatie Team voor bevolkingsonderzoek naar Borstkanker (LETB) (2014)
LETB rapportage 2014. E. MC. Rotterdam.
Roobol MJ et al. (2010) Feasibility study of screening for bladder cancer with urinary
molecular markers (the BLU-P project). Urol Oncol 28(6): 686-690.
Schroder FH et al. (2012) Prostate-cancer mortality at 11 years of follow-up.
N Engl J Med 366(11): 981-990.
Van Klaveren RJ et al. (2009) Management of lung nodules detected by volume
CT scanning. N Engl J Med 361(23): 2221-2229.
Appendix 1.2
183
Appendix 2.1
Zoekstrategieën per vraag­stelling (search) en kankersoort
184
Searches
Slokdarmkanker
Search 1
Zijn er klachten en symptomen die (vroege stadia
van) [slokdarmkanker]
[alvleesklierkanker]
[eierstokkanker] kunnen
voorspellen?
(Risk factors [Mesh] OR Signs and symptoms [Mesh] OR (suspect*
[ti/ab] OR suspic* [ti/ab])) AND (((“Esophageal Neoplasms”[Mesh]
OR Oesopha* [ti/ab] OR Esopha* [ti/ab]) AND (Barrett
Esophagus[mesh]) AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/
ab] OR carcinoma* [ti/ab]))) AND (“Population Surveillance”[Mesh]
OR surveil*[tw] OR mass screening [tw] OR screen*[tw] OR
(early[tw] AND detection[tw])) AND (eng[la] OR dutch [la] OR
French[lang] OR German[lang] OR Italian[lang] OR Spanish[lang] OR
Portuguese[lang]) AND 2002:5000[dp]
Search 2
Is er sprake van doctor’s
en/of patient delay bij de
diagnose van [slokdarmkanker] [alvleesklierkanker] [eierstokkanker]?
(“Delayed Diagnosis”[Mesh] OR “Referral and Consultation”[Mesh]
OR ((“patients”[MeSH] OR “patients”[All Fields] OR “patient”[All
Fields]) AND ((delay[All Fields] OR late[All Fields]) AND detection[All
Fields]))) AND(((“Esophageal Neoplasms”[Mesh] OR Oesopha*
[ti/ab] OR Esopha* [ti/ab]) AND (Barrett Esophagus[mesh])
AND (neoplasms[MESH] OR cancer*[ti/ab] OR tumor[ti/ab]
OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/ab] OR
carcinoma* [ti/ab]))) AND (eng[la] OR dutch [la] OR French[lang]
OR German[lang] OR Italian[lang] OR Spanish[lang] OR
Portuguese[lang]) AND 1990:5000[dp]
Search 3
Is er een detecteerbaar
preklinisch stadium?
(Asymptomatic Diseases [Mesh] OR Presymptomatic Disease
[Mesh] OR Neoplasm Staging [mesh]) AND (((“Esophageal
Neoplasms”[Mesh] OR Oesopha* [ti/ab] OR Esopha* [ti/ab])
AND (Barrett Esophagus[mesh]) AND (neoplasms[MESH] OR
cancer*[ti/ab] OR tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/
ab] OR neoplas*[ti/ab] OR carcinoma* [ti/ab]))) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR mass screening [tw] OR
screen*[tw] OR (early[tw] AND detection[tw])) AND (eng[la] OR
dutch [la] OR French[lang] OR German[lang] OR Italian[lang] OR
Spanish[lang] OR Portuguese[lang]) AND 2002:5000[dp]
Search 4
Welke screenings­
methoden zijn
beschikbaar?
(Diagnostic molecular pathologies [Mesh] OR Molecular Diagnostic
Techniques [Mesh] OR Diagnostic Techniques, Endocrine [Mesh]
OR Diagnostic Tests, Routine [Mesh] OR Diagnostic Self Evaluation
[Mesh] OR Biomarker [ti/ab] OR Diagnostic Techniques and
Procedures [Mesh]) AND(((“Esophageal Neoplasms”[Mesh] OR
Oesopha* [ti/ab] OR Esopha* [ti/ab]) AND (Barrett Esophagus[mesh])
AND (neoplasms[MESH] OR cancer*[ti/ab] OR tumor[ti/ab]
OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/ab] OR
carcinoma* [ti/ab]))) AND (“Population Surveillance”[Mesh]
OR surveil*[tw] OR mass screening [tw] OR screen*[tw] OR
(early[tw] AND detection[tw])) AND (eng[la] OR dutch [la] OR
French[lang] OR German[lang] OR Italian[lang] OR Spanish[lang]
OR Portuguese[lang]) AND 2002:5000[dp] NOT (animals[mesh] NOT
humans[mesh])
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Alvleesklier
Eierstokkanker
(Risk factors [Mesh] OR Signs and symptoms
[Mesh] OR (suspect* [ti/ab] OR suspic* [ti/ab])) AND
(Pancreatic Neoplasms [Mesh] OR (Pancrea* [ti/
ab] AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR
neoplas*[ti/ab] OR carcinoma* [ti/ab] OR lesi* [ti/ab])))
AND (“Population Surveillance”[Mesh] OR surveil*[tw]
OR mass screening [tw] OR screen*[tw] OR (early[tw]
AND detection[tw])) AND (“2002/01/01”[PDAT]:
“2012/03/01”[PDAT])
Risk factors [Mesh] OR Signs and symptoms [Mesh] OR
suspect [ti/ab] AND (Ovarian Neoplasms [Mesh] OR
ovari* [ti/ab] OR ovary [ti/ab]) AND (neoplasms[MESH]
OR cancer*[ti/ab] OR tumor [ti/ab] OR tumors[ti/ab] OR
tumou*[ti/ab] OR neoplas*[ti/ab] OR carcinoma* [ti/ab])
AND (“Population Surveillance”[Mesh] OR surveil*[tw]
OR mass screening [Mesh] OR screen*[tw] OR (early[tw]
AND detection[tw])) AND 2002:5000[dp]
((“Delayed Diagnosis”[Mesh]) OR “Referral and
Consultation”[Mesh] OR (patient [ti/ab] AND delay [ti/
ab])) AND (Pancreatic Neoplasms [Mesh] OR (Pancrea*
[ti/ab] AND (neoplasms[MESH] OR cancer*[ti/ab]
OR tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/
ab] OR neoplas*[ti/ab] OR carcinoma* [ti/ab]))) AND
(“2002/01/01”[PDAT]: “2012/02/01”[PDAT])
(Delayed Diagnosis [Mesh] OR Referral and Consultation
[Mesh] OR (patient [ti/ab] AND delay [ti/ab]) OR (late [ti/
ab] AND diagnosis [ti/ab]) OR (late [ti/ab] AND detection
[ti/ab]) OR late detection [tw] OR late diagnosis [tw])
AND (Ovarian Neoplasms [Mesh] OR ovari* [ti/ab] OR
ovary [ti/ab]) AND (neoplasms[MESH] OR cancer*[ti/ab]
OR tumor [ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR
neoplas*[ti/ab] OR carcinoma* [ti/ab]) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR mass screening
[tw] OR screen*[tw] OR (early[tw] AND detection[tw]))
AND 2002:5000[dp]
(Asymptomatic Diseases [Mesh] OR Presymptomatic
Disease [Mesh] OR Neoplasm Staging [mesh]) AND
(Pancreatic Neoplasms [Mesh] OR (Pancrea* [ti/ab] AND
(neoplasms[MESH] OR cancer*[ti/ab] OR tumor[ti/ab]
OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/
ab] OR carcinoma* [ti/ab]))) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR mass screening
[tw] OR screen*[tw] OR (early[tw] AND detection[tw]))
AND (“2002/01/01”[PDAT]: “2012/02/01”[PDAT]) AND
(eng[lang] OR dutch [lang] OR French[lang] OR
German[lang] OR Italian[lang] OR Spanish[lang] OR
Portuguese[lang])
(Asymptomatic Diseases [Mesh] OR Presymptomatic
Disease [Mesh] OR Neoplasm Staging [mesh]) AND
(Ovarian Neoplasms [Mesh] OR ovari* [ti/ab] OR ovary
[ti/ab]) AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR
neoplas*[ti/ab] OR carcinoma* [ti/ab]) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR Mass Screening
[Mesh] OR Early Detection of Cancer [MESH]) AND
2002:5000[dp]
(Diagnostic molecular pathologies [Mesh] OR
Molecular Diagnostic Techniques [Mesh] OR Diagnostic
Techniques, Endocrine [Mesh] OR Diagnostic Tests,
Routine [Mesh] OR Diagnostic Self Evaluation [Mesh]
OR Biomarker [ti/ab] OR Diagnostic Techniques and
Procedures [Mesh]) AND (Pancreatic Neoplasms
[Mesh] OR (Pancrea* [ti/ab] AND (neoplasms[MESH]
OR cancer*[ti/ab] OR tumor[ti/ab] OR tumors[ti/ab]
OR tumou*[ti/ab] OR neoplas*[ti/ab] OR carcinoma*
[ti/ab]))) AND (“Population Surveillance”[Mesh]
OR surv eil*[tw] OR mass screening [tw] OR
screen*[tw] OR (early[tw] AND detection[tw])) AND
(“2002/01/01”[PDAT]: “2012/02/01”[PDAT]) AND (eng[lang]
OR dutch [lang] OR French[lang] OR German[lang] OR
Italian[lang] OR Spanish[lang] OR Portuguese[lang])
(Diagnostic Techniques and Procedures [Mesh] OR
Biomarker [ti/ab] OR Molecular Diagnostic Techniques
[Mesh] OR Diagnostic Techniques, Endocrine [Mesh]
OR Diagnostic Tests, Routine [Mesh]) AND (Ovarian
Neoplasms [Mesh] OR ovari* [ti/ab] OR ovary [ti/
ab]) AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR
neoplas*[ti/ab] OR carcinoma* [ti/ab]) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR Mass Screening
[Mesh] OR Early Detection of Cancer [MESH] ) AND
2002:5000[dp]
Appendix 2.1
185
186
Searches
Slokdarmkanker
Search 5
Wat zijn de
testeigenschappen?
Diagnostic Techniques and Procedures [Mesh] AND sensitivity
and specificity [Mesh] AND (((“Esophageal Neoplasms”[Mesh]
OR Oesopha* [ti/ab] OR Esopha* [ti/ab]) AND (Barrett
Esophagus[mesh]) AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/
ab] OR carcinoma* [ti/ab])) AND (“Population Surveillance”[Mesh]
OR surveil*[tw] OR mass screening [tw] OR screen*[tw] OR
(early[tw] AND detection[tw]))) AND (eng[la] OR dutch [la] OR
French[lang] OR German[lang] OR Italian[lang] OR Spanish[lang]
OR Portuguese[lang]) AND 2002:5000[dp] NOT (animals[mesh] NOT
humans[mesh])
Search 6
Wat is de geschatte
winst na vroege
ontdekking?
(“Mortality”[Mesh] OR Cost-Benefit Analysis [MESH]) AND “Early
Detection of Cancer”[Mesh] AND (((“Esophageal Neoplasms”[Mesh]
OR Oesopha* [ti/ab] OR Esopha* [ti/ab]) AND (Barrett
Esophagus[mesh]) AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/
ab] OR carcinoma* [ti/ab]))) AND (eng[la] OR dutch [la] OR
French[lang] OR German[lang] OR Italian[lang] OR Spanish[lang] OR
Portuguese[lang]) AND 2002:5000[dp]
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Alvleesklier
Eierstokkanker
Diagnostic Techniques and Procedures [Mesh] AND
sensitivity and specificity [Mesh] AND (Pancreatic
Neoplasms [Mesh] OR (Pancrea* [ti/ab] AND
(neoplasms[MESH] OR cancer*[ti/ab] OR tumor[ti/ab]
OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/
ab] OR carcinoma* [ti/ab]))) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR mass screening
[tw] OR screen*[tw] OR (early[tw] AND detection[tw]))
NOT (animals[mesh] NOT humans[mesh]) AND
(“2002/01/01”[PDAT]: “2012/02/01”[PDAT]) AND (eng[lang]
OR dutch [lang] OR French[lang] OR German[lang] OR
Italian[lang] OR Spanish[lang] OR Portuguese[lang])
Diagnostic Techniques and Procedures [Mesh] AND
sensitivity and specificity [Mesh] AND (Ovarian
Neoplasms [Mesh] OR ovari* [ti/ab] OR ovary [ti/
ab]) AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor[ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR
neoplas*[ti/ab] OR carcinoma* [ti/ab]) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR mass screening
[tw] OR screen*[tw] OR (early[tw] AND detection[tw]))
AND 2002:5000[dp]
(“Mortality”[Mesh] OR Cost-Benefit Analysis
[MESH]) AND “Early Detection of Cancer”[Mesh] AND
(Pancreatic Neoplasms [Mesh] OR (Pancrea* [ti/ab] AND
(neoplasms[MESH] OR cancer*[ti/ab] OR tumor[ti/ab]
OR tumors[ti/ab] OR tumou*[ti/ab] OR neoplas*[ti/
ab] OR carcinoma* [ti/ab]))) AND (“2002/01/01”[PDAT]:
“2012/03/01”[PDAT])
Mortality [Mesh] OR Cost-benefit analysis [Mesh]
AND early detection of cancer [Mesh] AND (Ovarian
Neoplasms [Mesh] OR ovari* [ti/ab] OR ovary [ti/
ab]) AND (neoplasms[MESH] OR cancer*[ti/ab] OR
tumor [ti/ab] OR tumors[ti/ab] OR tumou*[ti/ab] OR
neoplas*[ti/ab] OR carcinoma* [ti/ab]) AND (“Population
Surveillance”[Mesh] OR surveil*[tw] OR mass screening
[tw] OR screen*[tw] OR (early[tw] AND detection[tw]))
AND 2002:5000[dp]
Appendix 2.1
187
Appendix 2.2
Stadiumverdeling naar TNM-classificatie
(UICC zevende editie 2009)
Slokdarmkanker
Stadium Omschrijving
I
Tumor beperkt tot bindweefsellaag (lamina propria/muscularis mucosae/submucos) van de slokdarm,
geen uitzaaiingen in lokale lymfklieren of op afstand (T1N0M0)
IIA
Tumor is gegroeid tot in de spierlaag (muscularis propria) of in de adventitia (buitenste laag van de
slokdarmwand), met uitzaaiing(en) in regionale lymfklier(en) (T2-T3N0M0)
IIB
Tumor is beperkt tot bindweefsellaag of gegroeid tot in de spierlaag, met uitzaaiing(en)
III
Tumor is gegroeid tot de buitenste laag van de slokdarmwand met uitzaaiingen in de lymfeklieren
(T3N1M0) of tumor doorgegroeid naar omliggende structuren, zonder uitzaaiingen (T4N0M0)
IV
Tumor is uitgezaaid naar andere organen of lymfeklieren in het lichaam (M1)
Bron: www.oncoline.nl.
Alvleesklierkanker
Stadium Omschrijving
I
Tumor beperkt tot de alvleesklier, geen uitzaaiingen in lokale lymfklieren of op afstand (T1-T2N0M0)
IIA
Directe uitbreiding buiten de alvleesklier, maar zonder betrokkenheid van de truncus coeliacus of de
arterie mesenterica superior (T3N0M0)
IIB
Uitzaaiing(en) in lokale lymfklier(en) (T1-3N1M0)
III
Betrokkenheid van de truncus coeliacus of de arterie mesenterica superior, met of zonder uitzaaiing(en) in
lokale lymfklier(en) en geen uitzaaiingen op afstand (T4N0-1M0)
IV
Betrokkenheid van de truncus coeliacus of de arterie mesenterica superior, met of zonder uitzaaiing(en) in
lokale lymfklier(en) en met uitzaaiingen op afstand (T4N0-1M1)
Bron: www.oncoline.nl.
188
Vroege ontdekking van slokdarm-, alvleesklier- en eierstokkanker
Eierstokkanker
TNM
FIGO-stadium
FIGO-indeling van de eierstokkanker
T1
I
Tumor beperkt tot de ovaria
T1a
IA
Tumor beperkt tot één ovarium, kapsel intact, geen maligne cellen in ascites¹of
peritoneaal spoelvocht, geen tumorcellen op het ovariumoppervlak
T1b
IB
Tumor beperkt tot beide ovaria, kapsel intact, geen maligne cellen in ascites¹of
peritoneaal spoelvocht, geen tumorcellen op het ovariumoppervlak
T1c
IC
Tumor beperkt tot een of beide ovaria, met geruptureerd kapsel, en/of tumorweefsel op
ovariumoppervlak en/of maligne cellen in ascites of in het peritoneaal spoelvocht
T2
II
Tumor in een of twee ovaria met uitbreiding in het bekken
T2a
IIA
Uitbreiding naar uterus of tubae, geen maligne cellen in ascites¹of in het peritoneaal
spoelvocht
T2b
IIB
Uitbreiding naar andere structuren in het kleine bekken, geen maligne cellen in
ascites¹of in het peritoneaal spoelvocht
T2c
IIC
Stadium IIA of IIB met maligne cellen in ascites of peritoneaal spoelvocht
T3
III
Histologisch bevestigde peritoneale uitbreiding buiten het kleine bekken en/of
regionale lymfklier metastasen
T3a
IIIA
Microscopische peritoneale uitbreiding buiten het bekken
T3b
IIIB
Macroscopische peritoneale uitbreiding buiten het kleine bekken <2 cm (diameter
afzonderlijke tumornoduli)
T3c
IIIC
Peritoneale uitbreiding buiten het kleine bekken > 2 cm (diameter afzonderlijke
tumornoduli) en/of regionale lymfklier metastasen
T4
IV
Uitbreiding buiten de buikholte en regionale lymfklieren
¹ Onder ascites wordt door de FIGO verstaan: een overmaat aan peritoneale vloeistof met daarin malignecellen.
Bron: www.oncoline.nl.
Appendix 2.2
189
De Signaleringscommissie Kanker (SCK) is in 1997 geïnstalleerd door het bestuur
van KWF Kankerbestrijding met als taak het bestuur van advies te dienen over te
verwachten ontwikkelingen binnen de kankerbestrijding. De SCK heeft
verschillende werkgroepen ingesteld die studie verrichten naar uiteenlopende
deelgebieden binnen de kankerbestrijding. Dit Signaleringsrapport is vervaardigd
door de SCK-werkgroep Vroege ontdekking.
Op het gebied van onderzoek en beleid is er nationaal en internationaal veel
aandacht voor vroege ontdekking van kanker, echter deze lijkt zich te concentreren
rond tumorsoorten waar reeds nationaal en internationaal het gunstige effect van
vroegopsporing is bewezen. KWF Kankerbestrijding vindt het van belang dat er ook
aandacht is voor vroege ontdekking bij tumorsoorten met een slechte prognose,
waarin de afgelopen periode weinig vooruitgang is geboekt. De inventarisatie
uitgevoerd voor dit rapport geeft inzicht in de knelpunten en aangrijpingspunten
voor verbetering op het gebied van vroege ontdekking van slokdarmkanker,
alvleesklierkanker en eierstokkanker. Dit rapport benoemt aandachtspunten voor
actie en beleid op het gebied van voorlichting, klinische praktijk en onderzoek.
KWF Kankerbestrijding
Postbus 75508
1070 AM Amsterdam
T (020) 570 05 00
F (020) 675 03 02
E [email protected]
www.kwf.nl
IBAN: NL23 RABO 0333 7779 99
BIC: RABONL2U
Prinses Beatrix is beschermvrouwe van het Koningin Wilhelmina Fonds voor de
Nederlandse Kankerbestrijding










