PARATE KENNIS CHEMIE 4e JAAR
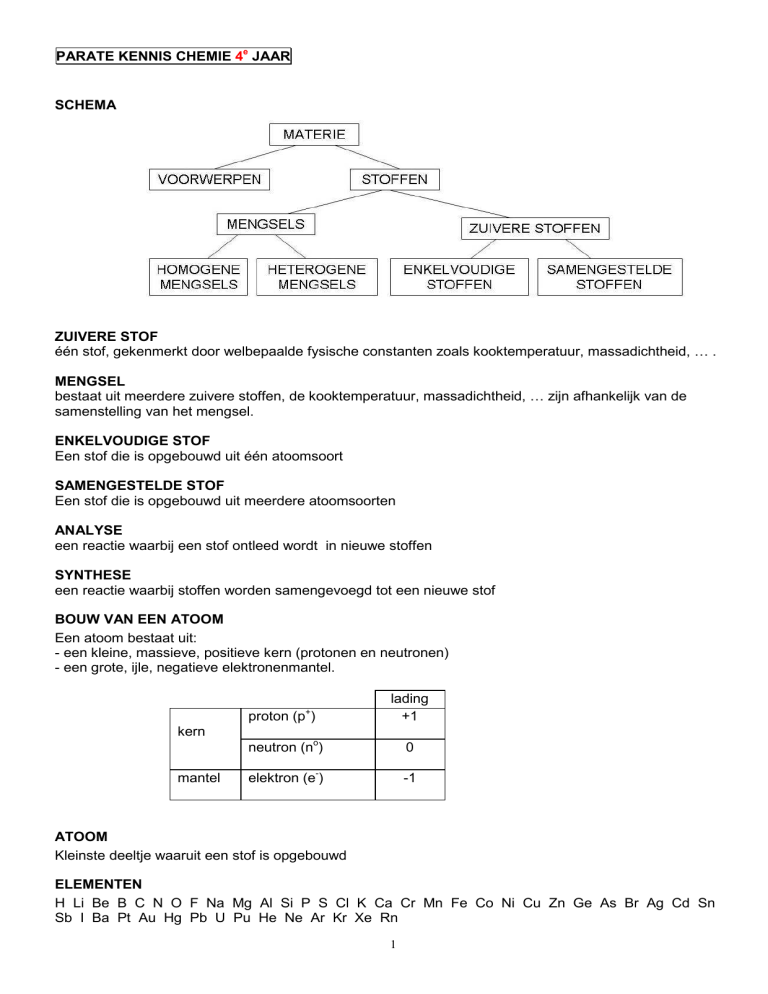
SCHEMA
ZUIVERE STOF
één stof, gekenmerkt door welbepaalde fysische constanten zoals kooktemperatuur, massadichtheid, … .
MENGSEL
bestaat uit meerdere zuivere stoffen, de kooktemperatuur, massadichtheid, … zijn afhankelijk van de
samenstelling van het mengsel.
ENKELVOUDIGE STOF
Een stof die is opgebouwd uit één atoomsoort
SAMENGESTELDE STOF
Een stof die is opgebouwd uit meerdere atoomsoorten
ANALYSE
een reactie waarbij een stof ontleed wordt in nieuwe stoffen
SYNTHESE
een reactie waarbij stoffen worden samengevoegd tot een nieuwe stof
BOUW VAN EEN ATOOM
Een atoom bestaat uit:
- een kleine, massieve, positieve kern (protonen en neutronen)
- een grote, ijle, negatieve elektronenmantel.
proton (p )
lading
+1
neutron (no)
0
elektron (e-)
-1
+
kern
mantel
ATOOM
Kleinste deeltje waaruit een stof is opgebouwd
ELEMENTEN
H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Mn Fe Co Ni Cu Zn Ge As Br Ag Cd Sn
Sb I Ba Pt Au Hg Pb U Pu He Ne Ar Kr Xe Rn
1
MOLECULE
Groepering van atomen
INDEX
aantal keer dat een atoom voorkomt in een molecule
COEFFICIENT
geeft het aantal moleculen of atomen weer
NAAM ENKELVOUDIGE STOFFEN
H2 N2 O2 F2 Cl2 Br2 I2
O3 S8 P4
DIATOMISCHE MOLECULEN
H2 N2 O2 F2 Cl2 Br2 I2
INFORMATIE UIT HET PERIODIEK SYSTEEM KUNNEN OPZOEKEN
atoomnummer (Z)
A
massagetal (A)
Z
elektronegatieve waarde
groep & periode
X
GROEP
elementen behoren tot eenzelfde groep als ze evenveel valentie-elektronen bezitten
PERIODE
elementen met evenveel gevulde schillen behoren tot dezelfde periode
BELANGRIJKE GROEPEN IN HET PERIODIEK SYSTEEM
Alkalimetalen
Aardalkalimetalen
Aardmetalen
Koolstofgroep
Stikstofgroep
Zuurstofgroep
Halogenen
Edelgassen
NAAM EN LADING VAN DE BELANGRIJKSTE POLYATOMISCHE IONEN
Naam van het ion
Formule
hydroxide
nitraat
nitriet
chloraat
sulfaat
sulfiet
carbonaat
fosfaat
bromaat
jodaat
ammonium
OHNO3NO2ClO3SO42SO32CO32PO43BrO3IO3NH4+
2
ENKELE BELANGRIJKE TRIVIALE NAMEN
HCl-opl.
zoutzuur
HNO3-opl.
H2SO4-opl.
zwavelzuur
HNO2
H2SO3
zwaveligzuur
H3PO4
H2O
water
H2CO3
NH3
ammoniak
CH4
salpeterzuur
salpeterigzuur
fosforzuur
koolzuur
Methaan
VALENTIE-ELEKTRONEN
elektronen op de buitenste schil
OCTETSTRUCTUUR = EDELGASCONFIGURATIE
8 elektronen op de buitenste schil
ELEKTRONEGATIEVE WAARDE (EN-waarde – e.n.w.)
De elektronegatieve waarde is een maat voor de kracht waarmee een gebonden atoom de
bindingselektronen aantrekt.
Metalen hebben een kleine EN-waarde; ze geven dus gemakkelijk elektronen af.
Niet-metalen hebben een grote EN-waarde; ze trekken gemakkelijk elektronen aan.
IONVERBINDING
Verbinding tussen positieve en negatieve ionen.
Verbinding tussen een metaal (positief ion) en een niet-metaal (negatief ion).
Bij een ionverbinding is het verschil in EN-waarde groter dan of gelijk aan 1,6.
Metaaloxiden, zouten en basen zijn ionverbindingen.
COVALENTE VERBINDINGEN (ATOOMVERBINDING)
Verbinding tussen niet-metalen.
Bij een covalente verbinding is het verschil in EN-waarde kleiner dan 1,6.
Niet-metaaloxiden en zuren zijn covalente verbindingen
ATOOMMASSA-EENHEID
massa van 1 proton of 1 neutron (1 u = 1,66.10-27 kg)
MOLAIRE MASSA (M)
massa van één mol deeltjes (uitgedrukt in g/mol), zie PSE
HOEVEELHEID STOF (n)
uitgedrukt in mol
1 mol = 6,02 .1023 deeltjes
n = m/M
GETAL VAN AVOGADRO
6,02 .1023 deeltjes
MOLAIRE CONCENTRATIE (C)
Aantal mol opgeloste stof per liter oplossing (mol/l)
c= n/V
3
CHEMISCH REKENEN
Massa (m)
gram
XM
:M
: NA
Hoeveelheid
stof (n)
Aantal deeltjes
x NA
mol
:V
X V
Molaire concentratie (c)
EXO- EN ENDOENERGETISCHE REACTIES
exo-energetische reactie: reactie waarbij energie vrijkomt
endo-energetische reactie: reactie waarbij energie nodig is
REACTIEVERGELIJKINGEN UITBALANCEREN
REACTIEVERGELIJKINGEN OPSTELLEN AAN DE HAND VAN GEGEVEN FORMULES
NEUTRALISATIEREACTIE
Een neutralisatiereactie is een reactie tussen een zuur en een base met vorming van een zout en water.
EEN NEERSLAGREACTIE
een neerslagreactie is een reactie tussen stoffen waarbij een onoplosbare stof wordt gevormd.
Gebruik van de oplosbaarheidstabel
EEN GASVORMINGSREACTIE
Een gasvormingsreactie is een reactie tussen 2 stoffen waarbij een gasvormige stof ontstaat.
De belangrijkste gassen : CO2, H2S, NH3, SO2
pH-SCHAAL:
INDICATOREN:
indicator
lakmoes
fenolftaleine
methyloranje
Kleur in zuur milieu
rood
kleurloos
rood
H2
knalgas
O2
nodig voor de verbranding
4
Kleur in basische milieu
blauw
paars
geel
REDOXREACTIE
Een redoxreactie is een elektronenuitwisselingsreactie. Hierbij treedt steeds een reductie en een oxidatie
op.
OXIDATIE
Een chemische reactie waarbij de oxidatiegetal (OG) stijgt.
Tijdens een oxidatie worden er elektronen afgestaan.
REDUCTIE
Een chemische reactie waarbij de oxidatiegetal (OG) daalt.
Tijdens een reductie worden er elektronen opgenomen.
e-
REDUCTOR
Een stofdeeltje dat elektronen afgeeft.
reductor
OXIDATOR
Een stofdeeltje dat elektronen opneemt.
Aan de hand van de tabel OG kunnen gebruiken
eoxidator
POLAIRE VERBINDINGEN
Polaire verbindingen zijn verbindingen waaraan we een positieve en een negatieve pool kunnen
onderscheiden.
Water (H2O) is een polair oplosmiddel.
Zuren, zouten, hydroxiden zijn polaire verbindingen.
Polaire verbindingen lossen op in polaire oplosmiddelen.
APOLAIRE VERBINDINGEN
Aan apolaire verbindingen kan men geen positieve en negatieve pool onderscheiden.
Ether, CCl4, white-spirit zijn apolaire oplosmiddelen.
Olie (vet) is een apolaire verbinding.
Apolaire verbindingen lossen op in apolaire verbindingen.
ELEKTROLYT
Elektrolyten zijn stoffen die in opgeloste toestand en gesmolten toestand vrije ionen vormen en daardoor de
elektrische stroom geleiden.
Zuren, hydroxiden en zouten zijn elektrolyten.
Alcohol en suiker zijn voorbeelden van niet-elektrolyten.
ANORGANISCHE VERBINDINGEN
Algemene
formule
Zuur
Base
metaaloxide
HxZ
M (OH)y
NH4OH
MxOy
Nietmetaaloxide
NMxOy
Formulevorming: aan de hand van de tabel met OG.
ORGANISCHE VERBINDINGEN
Alkanen zijn opgebouwd uit verzadigde koolwaterstoffen
5
Zout
MxZy
NAAM EN LADING VAN DE BELANGRIJKSTE MONOATOMISCHE IONEN; deze tabel kunnen
gebruiken .
Naam van het ion
waterstof
natrium
kalium
zilver
magnesium
calcium
barium
aluminium
kwik
tin
koper
lood
ijzer
fluoride
chloride
bromide
jodide
oxide
sulfide
Symbool met bijhorende lading
H+
Na+
K+
Ag+
Mg2+
Ca2+
Ba2+
Al3+
Hg+, Hg2+
Sn2+, Sn4+
Cu+, Cu2+
Pb2+ , Pb4+
Fe2+ , Fe3+
FClBrIO2S2-
6












