Uitwerkingen van de vragen en opdrachten van hoofdstuk 7
Paragraaf 7.2 Exotherm en endotherm
Vragen en opdrachten
4
a
onttrokken
b
c
aan het water
Water is de reagerende stof want na afloop is de vloeistof vast geworden.
Reactie
Na+ + CH3COO─ + 3H2O → NaCH3COO.3H2O
water is de omgeving want deze neemt de warmte van de brander op
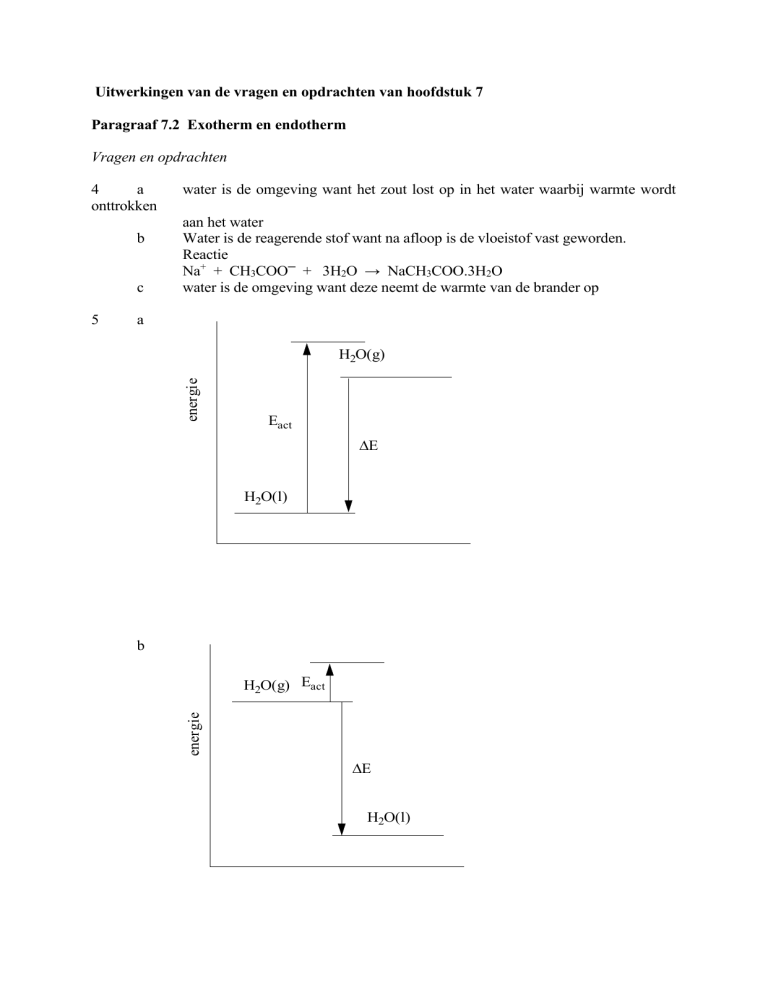
a
energie
H2O(g)
Eact
E
H2O(l)
b
H2O(g) Eact
energie
5
water is de omgeving want het zout lost op in het water waarbij warmte wordt
E
H2O(l)
6
a
Het branden van papier is exotherm want na het aansteken blijft het branden en
dan komt er warmte bij vrij.
b
Eact
energie
C2H10O5(s) + 2O2
E
5H2O(g)+ 2CO2(g)
7
energie
CuSO4 (s)+ 5H2O(g)
Eact
E
CuSO45H2O (s)
Paragraaf 7.3 Energie-berekeningen bij reacties
9
reactievergelijking b want daar wordt ethanol uit de elementen gevormd
10
ontledingsreactie is omgekeerd aan de vormingreactie dus
∆E = 3,51J / mol (tabel 57A)
11
a
reactievergelijking
C18H36O2 + 17O2 → 18CO2 + 18H2O
Stap 1 C18H36O2 → 18C + 18H2 + O2
Stap 2 17 O2 (g) → 17 O2 (g)
Stap 3 H2(g) + ½ O2(g) → H2O(l) ∆E =
Stap 4 C(s) + O2 (g) → CO2 (g)
∆E = ? J/mol
∆E = 0
̶ 2,86 105 J/mol
∆E = ̶ 3,935 105 J/mol
∆E =? + 18 -2,86 105 + 9 -3.935 105 = -1,1280 107
? = -1,1280 107 + 18 2,86 105 + 18 3,935 105 = 106 J / mol
Dus vormingswarmte = - 106 J / mol
NH4NO3 (s) → N2O(g) + 2H2O (l)
Stap 1 NH4NO3 → N2 (g) + 2H2(g) + 1,5 O2
∆E = 3,66 105 J / mol
Stap 2 N2 (g) + 0,5 O2 (g) → NO2 (g)
∆E = 0,816 105 J /mol
Stap 3 2H2(g) + O2(g) → 2H2O(l)
∆E = 2-2,86 105J /mol
∆E = 3,66 105 + 0,816 105 + 2-2,86 105 = -1,24 105 J / mol
b
C2H5OH (l) + O2 (g) → CH3COOH (l) + H2O (l)
c
Stap 1 C2H5OH(l) → 2C(s) + 3H2 (g) + 0,5O2(g) ∆E = 2,78 105 J/mol
Stap 2 2C(s) + 2H2 (g) + O2 (g) → CH3COOH (l) ∆E = -4,84 105 J/mol
Stap 3 H2 (g) + 0,5O2 (g) → H2O (l)
∆E = -2,84 105 J/mol
∆E = 2,78 105 + ̶ 4,84 105 + ̶ 2,84 105 = -4,9 105 J /mol
12
2,30 g CaCl2 M = 110,98
mol
g
1
110,98
?
2,30
? = Error! = 0,0207 mol CaCl2
Massa mengsel m =50,0 + 2,3 = 52,3 g
∆T = 31,0 ̶ 19,8 = 10,2
Q = cw m ∆T = 4,2 52,3 10,2 = 2240,5 J
mol
J
0,0207
2240,5
1
?
? = Error!= 1,08 105 J / mol
Dus oploswarmte is ̶ 1,08 105 J /mol
13
a
De temperatuur van de oplossing neemt toe dus de reactie is exotherm
b
Bij punt P stopt de temperatuurstijging dus komt er geen warmte meer vrij dus is
de reactie afgelopen omdat alle waterstofchloride gereageerd heeft.
c
De temperatuur van de toegevoegde KOH oplossing is veel lager dan het
reactiemengsel dus daalt de temperatuur van het reactiemengsel.
d
e
mol
L
2,00
1
?
0,0100
? = Error!= 0,0200 mol HCl
dichtheid is 1,0 kg/ dm3 dus 1 g per ml
10 ml weegt dus 10 g
∆T = 37,6 ̶ 23,0 = 14,6
Q = cw m ∆T = 4,2 10 14,6 = 6,1 102 J
f
mol
J
0,0200
6,1 102
1
?
? = Error!= 3,1 104 J / mol
Paragraaf 7.4 Reactiesnelheid
15
16
a
Vang de hoeveelheidgas op met bv een gasmeetspuit of vang het gas op in een
met watergevulde maatcilinder die omgekeerd in een bak met water zit. Meet nu
steeds na een vast tijdsinterval de hoeveelheid (ontstane) zuurstof
b
Waterstofbromide en waterstof zijn kleurloos en broom is bruin.Maak dus een
gas mengsel met een bepaalde concentratie broom en meet de tijd tot het
reactiemengsel dezelfde kleur heeft.
a
In alle drie gevallen is het zuur in overmaat dus de hoeveelheid
calciumcarbonaat bepaald de ontstane hoeveelheid CO2. Alle drie de leerlingen
gaan uit van dezelfde hoeveelheid calciumcarbonaat dus krijgen zo ook alle drie
dezelfde hoeveelheid CO2
Gepoederd calciumcarbonaat reageert sneller dan brokjes calciumcarbonaat
Bij een hogere temperatuur is de snelheid hoger. Dus de hoogste snelheid bij
gepoederd calciumcarbonaat bij 30ºC , daarna gepoederd bij 20ºC en het
langzaamst zijn de brokken bij 20ºC. Dus I is Frans, II is Ruud en III is Loes.
b
17
a
Het energieniveau van diamant is hoger dan het energieniveau van grafiet. Dit
verschil komt vrij bij de overgang van diamant naar grafiet dus een exotherm
proces.
b
c
∆E = 0,019 105 J / mol ≙ 1,9 103 J / mol
De activeringsenergie is erg hoog, Je moet er dus eerst heel veel energie in
stoppen om deze te overwinnen.
18
Bij een endotherme reactie zul je energie moeten blijven toevoegen om deze te laten
plaatsvinden. Een exotherme reactie die eenmaal op gang gebracht is gaat steeds maar
door. Om de reactie op gang te brengen moet je de activeringsenergie overbruggen.
Dus de reactie die het snelst gaat is een exotherme reactie met een lage
activeringsenergie.
19
a
c
d
20
a
Bij een hogere temperatuur zal de reactie sneller gaan dus er zal sneller H2
gevormd worden de curve zal sneller stijgen. De maxiamaal ontstane H2 zal
gelijk blijven want de hoeveelheid zwavelzuur blijft gelijk (magnesium was in
overmaat dus zwavelzuur bepaald hoeveelheid H2
ml H2
b
Bij proefje 1 en 2 is het enige verschil de temperatuur. Bij proefje 2 duurt de
ontkleuring korter dus is de reactiesnelheid groter. Dit kan alleen aan de
temperatuur liggen dus T2 is hoger dan T1
Bij een hogere temperatuur bewegen de deeltjes sneller dus zullen zij vaker
botsen en dus ook meer effectieve botsingen hebben, vandaar dat de
reactiesnelheid groter is
Proef 4 is nodig om te kijken of A en C samen ook ontkleuren.
Stof C versnelt de reactie( zie proef 1 en 3), maar vergroting van de
hoeveelheid C heeft geen effect. Stof C moet dus katalysator zijn.
I
grafiek 1
t
De beginsnelheid zal hoger zijn dus de curve begin hoger. Doordat de reactie
sneller gaat zal de reactie eerder afgelopen zijn. Oppervlak onder de grafiek is
een maat voor de hoeveelheid omgezette stof en zal dus gelijk blijven.
snelheid in mol L-1s-1
b
II
t
grafiek II
21
a
vormings warmte water = 2,86 • 105 J / mol
1,00 kg water
M(H2O) = 18,02 g / mol
gegevens
mol
1
?
b
c
g
18,02
1,00 • 103
? = Error!= 55,49 mol
ontledingswarmte is omgekeerd aan de vormingswarmte dus
∆E = - 2,86 • 105 J / mol
mol
J
1
- 2,86 • 105
55,49
?
? = Error! = -1,59 • 107 J
Er komt dus 1,59 • 107 J vrij aan warmte
De overgang van vloeibaar water naar gasvormig water kost energie. Dus komt
er minder warmte vrij als we uitgaan van gasvormig water.
Diagram 1. want het mengsel moet eerst aangestoken worden dus er is een
activeringsenergie dus 3 en 4 vallen af. Ook komt er warmte vrij bij dit proces
dus moet het energieniveau van het product (H2O) lager liggen dan van de
uitgangstoffen(H2 en O2) dus valt diagram 2 af.
paragraaf 7.5 Klokreacties
23
a
b
In het begin zijn de concentratie het hoogst dus veel botsingen (en dus is de
snelheid van de reactie het hoogst), dus een snelle gasontwikkeling. De
concentratie daalt dus snel en dus minder botsingen (en dus neemt ook de
snelheid van de reactie af) en zal er minder gasontwikkeling zijn.
Na 10 s is er 12 cm3 gas ontstaan
1 mol heeft volume van 24,0 dm3 of 1 mmol heeft volume van 24,0 cm3
cm3
24,0
12
mmol
1
?
1 • 12;24
= 0,50 mmol H2 ontstaan
0
H2 : H+ = 1 : 2 dus 1,0 mmol H+ is weggereageerd
Begonnen met 10,0 ml 0,800M
mol / L is gelijk aan mmol/ml
mmol
ml
0,800
1
?
10
?=
? = Error!= 8,00 mmol
dus nog over 8,00 – 0,50 = 7,50 mmol
[H+] = Error!= ½= 0,750 M
c
tijd
s
10
30
40
50
75
100
125
150
200
250
300
350
400
450
gas
cm3
22
34
44
50
63
73
80
86
91
94
95
96
96
96
ontstane nog over
mmol H2 mmol H+
0,92
6,17
1,42
5,17
1,83
4,33
2,08
3,83
2,63
2,75
3,04
1,92
3,33
1,33
3,58
0,83
3,79
0,42
3,92
0,17
3,96
0,08
4,00
0,00
4,00
0,00
4,00
0,00
[H+]
0,62
0,52
0,43
0,38
0,28
0,19
0,13
0,08
0,04
0,02
0,01
0,00
0,00
0,00
d
Paragraaf 7,6 Toepassingen
Waterstof al alternatief
1
Door ontleding van water.
2
Bij de verbranding van waterstof ontstaan geen schadelijke producten. Er ontstaat nl
alleen water.
3
Als de reactie niet omkeerbaar zou zijn dan wou je de waterstof niet meer vrij kunnen
maken. Dus dan zou het niet op deze manier opgeslagen kunnen worden.
4
M(FeTiH2) = 55,85 + 47,87 + 2 • 1,008 = 105,74 g / mol
mol
1
?
g
105,74
1000
?=
1 • 1000;105
= 0,946 mol FeTiH2
74
FeTiH2 : H2 = 1 : 1
dus ook 0,946 mol H2
M(H20 = 2,016 g /mol
mol
1
0,946
g
1000
1,91
5
g
2,016
?
J
1,21 • 108
?
? = Error!= 1,91 g
? = Error!= 2,30 • 105 J < 4,25 • 107
Doordat de vormingswarmte van MgH2 groter is dan van FeTiH2 zal je om het waterstof
uit het hydride vrij te maken meer energie vrij komen in de vorm van warmte. Deze
energie gaat dan verloren en waarschijnlijk zul je dan ook moeten koelen
6
De molmassa van MgH2 ( M = 26,33)is veel kleiner dan van FeTiH2 dus 1 kg MgH2
levert meer mol H2 of dan 1 kg FeTiH2.
Hexaan
7
8
2C6H14 + 19O2 → 12CO2 + 14H2O
vormingsenergie vindt je in tabel
stap 1 CO → C + ½O2
∆E = 1,105 • 105 J(+ teken want is ontleding)
stap 2 NO → ½N2 + ½O2
∆E = – 0,913 • 105 J(– teken want is ontleding)
stap 3 C + O2 → CO2
∆E = –3,935 • 105 J
(laatste stof is al element dus geen vormingsenergie)
∆ E = 1,105 • 105 + –0,913 • 105 + -3,935 • 105 = -3,743 • 105 J
9,10
Eact
E
Oplossen
11
Bereken eerst aantal mol toegevoegde NaOH
25 ml ≙ 0,025 L ( 1L ≙ 1000 ml)
mol
0,50
?
L
1
0,025
mol
1
0,0125
J
4,5 • 104
?
? = Error! = 0,0125 mol
Bereken dan de hoeveelheid vrijgekomen
energie
? = Error!= 5,625 • 102 J
30 % gaat verloren dus 70 % blijft over om
het water te verwarmen
5,625 • 102 • 0,70 = 3,94 •102 J
nodig 4,4 J per ml per graad
dus per 25 ml heb je 112,5 J nodig
∆T
1
?
J
112,5
3,94 • 102
? = Error!=3,5 graden
12
De massa van de oplossing is dan kleiner en
dus is de temperatuur stijging groter.
De temperatuurstijging zal nu sneller verlopen en doordat het water sneller warmer
wordt lost het natriumhydroxide sneller op . Als het helemaal is opgeloste voeg je nog 5
ml water toe en roert de oplossing.
13
Je kunt de pillen natriumhydroxide fijn malen voor je ze aan de oplossing toevoegt.
Melkbusschieten
14
Er staat dat er een zwarte walm ontstaat. Dat kan hier alleen maar als er bij de reactie
koolstof ontstaat en dat is alleen in reactie 1 het geval.
15
stap 1 C2H2 → 2C +H2
∆E =-2,27 • 105 J (– teken want het gaat om ontleding)
stap 2 C + O → CO
∆E = –1,105 • 105- J
stap 3 H2 + ½O2 → H2O ∆E = – 2,86 • 105 J
(overige stoffen zijn al elementen)
∆E = 2,27 • 105 + –1,105 • 105 + – 2,86 • 105 = -1,70 • 105 J
16
Er komt warmte bij vrij dus een exotherme reactie maar hij moet wel worden
aangestoken dus wel een duidelijke activeringsenergie
Eact
E












