Biobrandstofcel
(examen 2009)
De bacterie Rhodoferax ferrireducens leeft in anaëroob milieu (zuurstofloze omstandigheden).
Voor zijn energievoorziening zet deze bacterie glucose om tot onder andere koolstofdioxide.
Bij de omzetting van glucose tot koolstofdioxide is glucose reductor. Als oxidator in het
anaërobe milieu treedt Fe3+ op, dat wordt omgezet tot Fe2+. De reactie, en de functie van de
bacteriën daarbij, is onderzocht. Daartoe werden proeven uitgevoerd waarbij glucoseoplossingen en oplossingen met Fe3+ werden samengevoegd zowel in aanwezigheid van de
bacteriën als zonder bacteriën. Zonder bacteriën treedt geen reactie op.
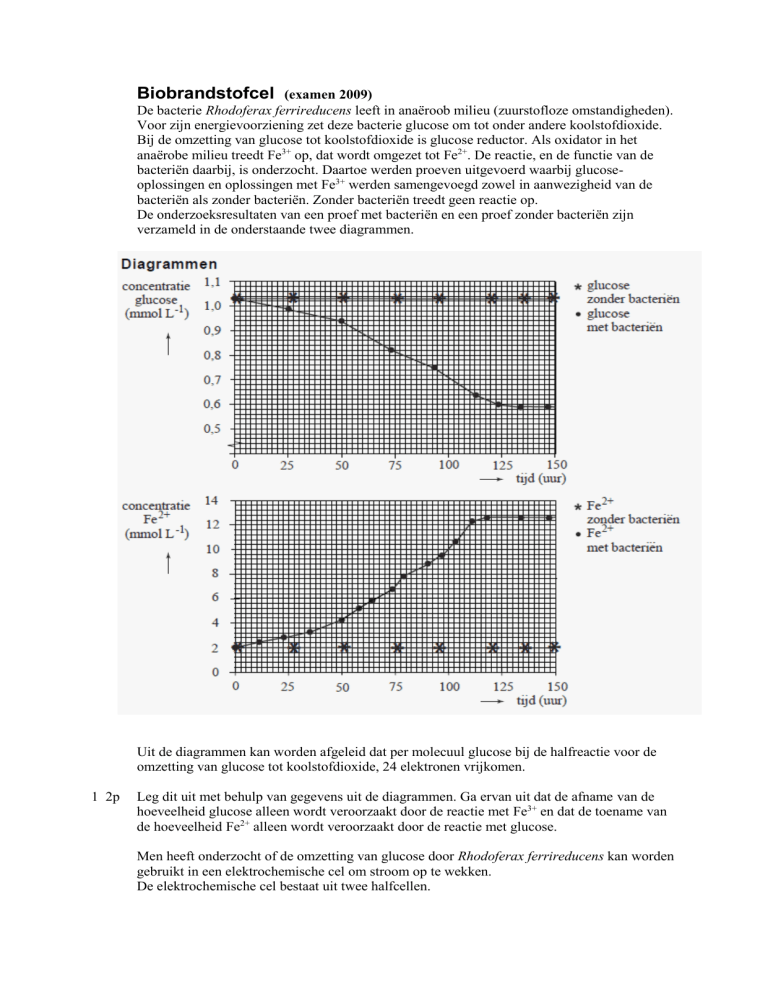
De onderzoeksresultaten van een proef met bacteriën en een proef zonder bacteriën zijn
verzameld in de onderstaande twee diagrammen.
Uit de diagrammen kan worden afgeleid dat per molecuul glucose bij de halfreactie voor de
omzetting van glucose tot koolstofdioxide, 24 elektronen vrijkomen.
1 2p
Leg dit uit met behulp van gegevens uit de diagrammen. Ga ervan uit dat de afname van de
hoeveelheid glucose alleen wordt veroorzaakt door de reactie met Fe3+ en dat de toename van
de hoeveelheid Fe2+ alleen wordt veroorzaakt door de reactie met glucose.
Men heeft onderzocht of de omzetting van glucose door Rhodoferax ferrireducens kan worden
gebruikt in een elektrochemische cel om stroom op te wekken.
De elektrochemische cel bestaat uit twee halfcellen.
De ene halfcel van de elektrochemische cel bestaat uit een poreuze elektrode van grafiet die is
geplaatst in een gebufferde glucose-oplossing. Op en rond de elektrode bevinden zich de
bacteriën. Om te voorkomen dat zuurstof in de oplossing terechtkomt, wordt stikstofgas
doorgeleid. De pH van de oplossing moet 6,90 zijn. Daarom is aan het stikstofgas wat
koolstofdioxide toegevoegd en aan de glucose-oplossing wat NaHCO3. De hoeveelheid
koolstofdioxide die aan het stikstofgas wordt toegevoegd is zodanig dat in de oplossing de
concentratie koolzuur voortdurend gelijk is aan 0,011 mol L–1.
De elektronen die bij de omzetting van glucose vrijkomen, worden overgedragen aan de
elektrode.
In de andere halfcel bevindt zich de oxidator. Dat is in de elektrochemische cel niet Fe3+, maar
zuurstof. Deze halfcel bestaat uit een elektrode, eveneens van grafiet, die is geplaatst in een
bufferoplossing (ook pH = 6,90), waar lucht doorheen wordt geleid. Als de twee elektroden
worden verbonden, gaat een elektrische stroom lopen. De zuurstof uit de lucht wordt daarbij
omgezet volgens:
O2+ 4 H+ + 4 e─ → 2 H2O
De ontstane elektrochemische cel wordt een biobrandstofcel genoemd
2 3p
Geef de vergelijking van de halfreactie voor de omzetting van glucose tot koolstofdioxide.
Behalve de formules van de genoemde stoffen komen in de
vergelijking nog e─, H+ en H2O voor.
3 2p
Leid de vergelijking af van de totale reactie waarop de stroomlevering door de biobrandstofcel
berust.
4 4p
Maak een schets van zo’n biobrandstofcel. Benoem de onderdelen van de cel en vermeld op de
juiste plaats alle stoffen en oplossingen die worden gebruikt, evenals de bacteriën. Geef in je
tekening ook aan wat tijdens de stroomlevering de positieve en de negatieve elektrode is.
Space Shuttle
5
6
Bij het lanceren van de Space Shuttle is zeer veel energie nodig om het gevaarte de ruimte in
te krijgen. Een deel van die energie wordt opgewekt door een reactie tussen twee vaste stoffen:
ammoniumperchloraat (NH4ClO4) en aluminium
De bereiding van ammoniumperchloraat verloopt in een aantal stappen. Eén van die stappen is
de bereiding van natriumperchloraat. Bij deze bereiding wordt in een reactievat van staal een
oplossing van natriumchloraat (NaClO3) geëlektrolyseerd.
De positieve elektrode is van platina. Het staal in het reactievat fungeert als negatieve
elektrode. Bij deze elektrolyse wordt ClO3 omgezet in ClO4. Tijdens de elektrolyse wordt de
pH op 6,5 gehouden.
Geef de vergelijking van de halfreactie voor de omzetting van ClO3 in ClO4.
Leg uit aan welke elektrode deze omzetting plaatsvindt.
Ky-auto
Personenauto's die op benzine rijden, produceren koolstofdioxide. In december 1997 is in
Kyoto (Japan) afgesproken dat in 2012 de hoeveelheid koolstofdioxide per gereden km
gemiddeld met minstens 40% moet zijn teruggebracht. Daarom doet de auto-industrie
uitgebreide research om de uitstoot van koolstofdioxide te verlagen. Eén van de onderzoeken
richt zich op een auto uitgerust met een elektromotor. De elektrische stroom voor de
elektromotor wordt geleverd door een zogenoemde directe methanol-brandstofcel.
In figuur 1 is de directe methanol-brandstofcel met elektromotor schematisch weergegeven.
In het vervolg van deze opgave duiden we zo’n cel kortheidshalve aan met brandstofcel.
In compartiment I van de brandstofcel wordt een mengsel van methanol en water geleid. In
compartiment II wordt zuurstof (lucht) geleid. Aan de poreuze platina-elektroden (EI en EII)
treden de volgende halfreacties op:
CH3OH + H2O CO2 + 6 H+ + 6 eO2 + 4 H+ + 4e─ 2 H2O
(halfreactie 1)
(halfreactie 2)
Tussen de poreuze elektroden bevindt zich een membraan dat alleen H+ ionen doorlaat.
Koolstofdioxide en waterdamp worden uit de brandstofcel afgevoerd.
7 2p
Leg uit of de elektronen via de elektromotor stromen van EI naar EII of van EII naar EI.
Een auto die is uitgerust met deze brandstofcel hoeft alleen methanol te tanken. Het water dat
voor halfreactie 1 nodig is, wordt geleverd door halfreactie 2. Omdat er in compartiment II
meer water ontstaat dan voor halfreactie 1 nodig is, wordt een deel van dat water afgevoerd.
8 3p
Leid aan de hand van de gegeven halfreacties af hoeveel procent van het in compartiment II
gevormde water moet worden afgevoerd.
Zink
Bij de winning van zink uit zinkerts blijft doorgaans 95 % van het gedolven gesteente achter in de vorm
van zuur slib. Dit slib wordt gedumpt in door dijken omgeven bassins. In april 1998 is bij een zinkmijn
in Spanje een dijk van zo’n bassin doorgebroken. Tussen de vijf en zeven miljoen m 3 slib stroomde
weg. Een deel van het slib kon met dijken tot stilstand gebracht worden. Een ander deel kwam in een
belangrijk natuurgebied terecht en veroorzaakte de dood van vele vissen en vogels. Naar aanleiding van
deze milieuramp verscheen in een Nederlandse krant commentaar van een grondstoffendeskundige:
TekstFragment 1
Neem wat ijzersulfide, het glimmende mineraal pyriet; zinksulfide of kopersulfide
mag ook. Vermaal het. Voeg water toe. Doe de lakmoesproef. De oplossing zal
zuur blijken. Zwavelzuur, kan nadere analyse nog onthullen. Mits op voldoende
grote schaal uitgevoerd, is dit het recept voor een milieuramp. De schaal van een
ertsmijn bijvoorbeeld. Overal waar sulfidisch gesteente aan de oppervlak wordt
gebracht, ontstaan grote hoeveelheden zuur afvalslib. Dat is een chemische
onvermijdelijkheid.
Naar : de Volkskrant van 9 mei 1998
In de eerste regel worden ijzersulfide en pyriet genoemd. In het krantenbericht wordt daarmee één en
dezelfde stof bedoeld. De formule van deze stof is FeS2 en pyriet is de triviale naam ervan. De stof is
opgebouwd uit ionen.
9 2p
10 2p
Leg aan de hand van formules van ionen uit of ijzersulfide een juiste systematische naam voor pyriet is.
Ga er daarbij vanuit dat er twee soorten ijzerionen bestaan.
Beschrijf hoe de vermelde lakmoesproef moet worden uitgevoerd en wat je dan waarneemt.
Pyriet wordt door zuurstof uit de lucht en water omgezet tot een oplossing die, behalve H + ionen, ook
Fe3+ ionen en SO42 ionen bevat. Deze reactie is een redoxreactie.
De vergelijking van de halfreactie van FeS2 is hieronder onvolledig weergegeven :
FeS2 + H2O Fe3+ + SO42 + H+
In deze vergelijking ontbreken de elektronen en er moeten nog coëfficiënten worden geplaatst.
11 3p
Geef de volledige vergelijking van de halfreactie van FeS2.
12 2p
Leid met behulp van deze halfreactie en de halfreactie van zuurstof de totale reactievergelijking af van
deze omzetting van pyriet door zuurstof en water.
Volgens deskundigen is de dambreuk ontstaan doordat onder de dijken mergel aanwezig is. Mergel
bevat onder andere calciumcarbonaat. Het calciumcarbonaat reageerde met de grote hoeveelheid H+
ionen uit het slib. De dam verloor door deze reactie zijn stabiliteit en brak door.
13 3p
Geef de vergelijking van de reactie tussen het calciumcarbonaat in de mergel en de H + ionen waardoor
de dampbreuk is ontstaan. Neem aan dat het calciumcarbonaat met H + ionen reageerde in de
molverhouding 1 : 2
Ruim vier maanden na de ramp werd in de pers melding gemaakt van scherpe kritiek op de
opruimingswerkzaamheden:
TekstFragment 2
Niet alleen kwam de waterzuivering pas een maand geleden op gang, ook twijfelt
men of de speciaal aangelegde installatie en het meertje waarin het sterk verzuurde
slib werd geneutraliseerd met natriumcarbonaat, goed heeft gefunctioneerd
Naar : NRC Handelsblad van 10 september 1998
In een scheikundeles worden de tekstfragmenten besproken. Een leerling brengt naar voren dat er
waarschijnlijk veel natriumcarbonaat nodig is om al het zure slib te neutraliseren. Het natriumcarbonaat
moet naar het meertje worden vervoerd. Het meertje is wellicht niet goed bereikbaar. Dit zou wel eens
één van de redenen kunnen zijn waarom de neutralisatie van het zure slib zo langzaam verloopt.. De
leerling krijgen de opdracht een berekening uit te voeren om te schatten hoeveel natriumcarbonaat maar
het meertje moet worden vervoerd.
Ze moeten uitgaan van de volgende veronderstellingen
· 3 miljoen m3 zuur slib moet in het meertje worden geneutraliseerd;
· 50 volumeprocent van het slib bestaat uit vast, niet zure bestanddelen;
· de pH van de te neutraliseren vloeistof is 2,5;
· het natriumcarbonaat wordt aangevoerd in de vorm van soda (Na 2CO3 · 10H2O);
· natriumcarbonaat en H+ ionen reageren in de molverhouding 1 : 2
14 5p
Bereken met deze veronderstellingen hoeveel kg soda naar het meertje moet worden vervoerd. De
massa van een mol Na2CO3 · 10H2O is 286,2 g
Biobrandstofcel
1
concentraties aflezen uit grafieken
glucose
Fe2+
Begin
1,03
2,0
Eind
0,59
12,6
Dus omgezet glucose 1,03 ─ 0,59 = 0,44 mmol / L
Gevormd Fe2+
12,6 ─ 2,0 = 10,6
Verhouding 10,6 : 0,44 = 24 : 1
Fe3+ + e─ Fe2+
Dus moet er per glucose molecuul 24 elektronen afgestaan worden
2
Basis opschrijven
C6H12O6 6 CO2
Hulpdeeltjes H2O en H+ en massabalans kloppend maken
C6H12O6 + 6H2O 6 CO2 + 24H+
Ladingbalans kloppend maken door elektronen in de vergelijking te zetten
C6H12O6 + 6H2O 6 CO2 + 24H+ + 24 e─
3
C6H12O6 + 6H2O 6 CO2 + 24H+ + 24 e─
1x
+
─
O2 + 4H + 4e 2 H2O
6x +
C6H12O6 + 6H2O + 6 O2 + 24H+ 6 CO2 + 24H+ + 12 H2O
Corrigeren voor H2O en H+ geeft
C6H12O6 + 6 O2 6 CO2 + 6 H2O
4
Space Shuttle
5
Eerst basis opschrijven geeft
ClO3─ ClO4─
Hulpdeeltjes H2O en H+ in vergelijking zetten en massa balans kloppen maken geeft
ClO3– + H2O → ClO4– + 2H+
Ladingbalans kloppend maken door elektronen in de vergelijking te zetten geeft
ClO3– + H2O → ClO4– + 2H+ + 2 e–
6
Omzetting vindt plaats aan de positieve elektrode want daar kan hij zijn elektronen afgeven
Ky-auto
7
in compartiment I worden de elektronen afgestaan en in compartiment II worden de elektronen
opgenomen. De elektronen stromen dus van compartiment I naar II .`
8
CH3OH + H2O CO2 + 6 H+ + 6 e- 4x
O2 + 4 H+ + 4e─ 2 H2O
6x +
4 CH3OH + 4 H2O + 6 O2 + 24 H+ 4 CO2 + 24 H+ + 12 H2O
corrigeren voor stoffen na en voor de pijl geeft
4 CH3OH + 6 O2 4 CO2 + 8 H2O
dus 8 van de 12 dus 67 %
Zink
9
In ijzersulfide zitten of Fe3+ en S2– ionen en zou dan de formule Fe2S3 moeten hebben of er zitten Fe2+
en S2– ionen in er zou dan de formule FeS moeten hebben. Dus is ijzersulfide geen goede naam voor
FeS2
10
Maak een blauw lakmoes papiertje vochtig met de ontstane oplossing. Als het papiertje rood wordt dan
was de oplossing zuur.
11
FeS2 + 8 H2O
FeS2 + 8 H2O
12
O2 + 4H+ + 4e– → 2H2O
15x
FeS2 + 8 H2O → Fe3+ + 2SO42– + 16 H+ + 15 e–
4x
15 O2 + 60 H+ + 4 FeS2 + 32 H2O → 30 H2O + 4 Fe3+ + 64 H+
15 O2 + 4 FeS2 + 2 H2O → 4 Fe3+ + 4 H+
→ Fe3+ + 2SO42– + 16 H+
→ Fe3+ + 2SO42– + 16 H+ + 15 e–
13
CaCO3 + 2H+ → Ca2+ + H2O + CO2
14
3 · 106 m3 slib ≙ 1,5 · 106 m3 vloeistof ≙ 1,5 · 109 L
massabalans kloppend
ladingbalans kloppend
pH = 2,5 [H+] = 10-2,5 =3,16 · 10─3 mol / L
hoeveelheid H+ = 1,5 · 109 · 3,16 · 10─3 =4,74 · 106 mol
Na2CO3 + H+ = 1 : 2 dus 2 · 4,74 · 106 = 9,49 · 106 mol Na2CO3
9,49 · 106 · 286,2 = 2,7 · 109 g natriumcarbonaat
corrigeren voor H2O en H+ geeft












