Activiteit 3
Atoomeconomie
Chemische fabrieken maken van een aantal reactanten een product. Zo’n productieproces
kent vaak een aantal stappen en wordt een ‘synthese’ genoemd.
Elke ontwerper van een synthese wil de maximale hoeveelheid product maken vanuit een
bepaalde reactant. Het is mogelijk om uit te rekenen hoe succesvol een dergelijke synthese
is door gebruik te maken van ‘atoomeconomie’.
Atoomeconomie is gedefinieerd als:
Mr product
atoomeconomie =
x 100%
Mr alle producten
Voorbeeld:
Door methanol met azijnzuur te laten reageren, ontstaat de ester methylethanoaat en water.
H
C
H
H
H
+
O
H
32,04
H
H
C
O
H
C
H
O
+
O H
H
C
H
H
C
O
C
H
+
H
H
O
H
60,06
74,08
18,02
Uit dit voorbeeld blijkt dat uit 32,04 g methanol en 60,06 g azijnzuur maximaal
74,08 g methylethanoaat en 18,02 g water gevormd kan worden.
atoomeconomie van methylethanoaat =
74,08
x 100%
74,08 + 18,02
atoomeconomie van methylethanoaat = 80,3%
23
Scheikunde | Werkblad Thema Groene Chemie| HV
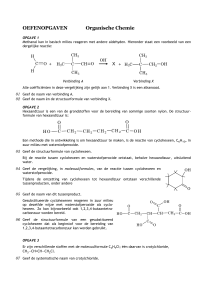
Opgave 3.1
a.
b.
Wanneer, bij welk soort proces, is de
atoomeconomie 100% ?
Is het ook mogelijk om de definitie van
atoomeconomie te schrijven als:
Mr product
atoomeconomie =
x 100%
Mr alle beginstoffen
c.
Bereken de atoomeconomie van ijzer tijdens het
hoogovenproces.
Fe2O3 (s) + 3 CO (g) 2 Fe (l) + 3 CO2 (g)
Rendement
Atoomeconomie is een ‘ideaal plaatje’ van een synthese. In de praktijk is het begrip
atoomeconomie niet handig omdat syntheses vaak ook evenwichtsreacties zijn, of dat niet alle
reactanten even zuiver zijn. Daarom gebruiken technici het begrip ‘rendement’.
Rendement wordt als volgt omschreven:
rendement =
praktische opbrengst
x 100%
theoretische opbrengst
Voorbeeld 1:
Om ammoniak te maken wordt stikstofgas in een continu proces met waterstofgas verbonden
volgens onderstaande reactie:
N2 (g)
+
3 H2 (g)
Opgave 3.2
a.
b.
2 NH3 (g)
Bereken de atoomeconomie van de productie van
ammoniak. Verbaast je deze uitkomst? Licht je
antwoord toe.
Als er in bovenstaande reactie 28,02 g stikstof en 6,05
g waterstof reageren, ontstaat er in theorie 34,07 g
ammoniak.
Bereken het rendement als de theoretische opbrengst
van 34,07 g niet gehaald wordt, maar de praktische
opbrengst 28,00 g ammoniak is.
24
Scheikunde | Werkblad Thema Groene Chemie| HV
Voorbeeld 2:
Tijdens het hoogovenproces wordt ijzererts (Fe2O3) met koolstofmono-oxide omgezet in ijzer
en koolstofdioxide volgens onderstaande reactie:
Fe2O3 (l)
+
Opgave 5
a.
3 CO (g)
2 Fe (l)
+
3 CO2 (g)
Bereken de theoretische opbrengst van ijzer in deze
reactie, als 200 kg ijzererts reageert.
b.
Wat is het rendement als er tijdens bovenstaand proces uit
160 ton ijzererts 90 ton ijzer ontstaat?
Voorbeeld 3:
Maleïnezuuranhydride is een belangrijk tussenproduct in de fabricage van geneesmiddelen,
pigmenten en geur- en kleurstoffen. DSM is een grote producent van deze stof.
Maleïnezuuranhydride wordt gemaakt door benzeen (C6H6) te oxideren volgens
onderstaande reactie:
O
+
4, 5 O 2
HC
C
O
HC
+
2 CO 2
+
2 H2O
C
O
benzeen
zuurstof
maleпnezuuranhydride
2 C6H6 (l) + 9 O2 (g) 2 C4H2O3 (s) + 4 CO2 (g) + 4 H2O (l)
Opgave 3.4
a.
b.
Bereken de atoomeconomie van deze reactie.
Bereken het rendement als uit 100 kg benzeen 100 kg
maleïnezuuranhydride ontstaat.
E-factor
Een nadeel van effectief atoomgebruik is dat het geen rekening houdt met de
milieuproblematiek. Een reactie waarbij tonnen koolstofdioxide wordt geproduceerd, is een
grotere vervuiler dan een reactie waarbij alleen tonnen water geproduceerd worden. Het is
daarom vaak belangrijker om de gebruikte atomen te onderzoeken.
Door professor Roger Sheldon van de TU Delft is een nieuwe waarde ontwikkeld om van een
synthese te bepalen hoe groen deze is: E-factor.
25
Scheikunde | Werkblad Thema Groene Chemie| HV
De E-factor is de hoeveelheid afval per kg product:
Let op Mr is bepaald door het rendement van de reactie
In onderstaande tabel is een overzicht van de belangrijkste chemische industrieën. Hierin is
weergegeven hoe groot de productie is en de E-factor.
Hoe groter de E-factor hoe groter de vervuiling
Olie industrie
Productie
(ton)
106-108
E-factor (kg afval/kg
prod)
< 0,1
Bulk chemie
102-106
< 1-5
Fijn chemie
Farmaceutische
industrie
102-104
5 .. 50
10-103
25 .. >100
Industrie
Opgave 3.5
Hieronder staat de productie van hydroquinon vanuit
aniline.
Uit 17,45 g aniline (C6H5NH2) ontstaat 11,34 g
hydroquinon (C6H6O2). Na een reactietijd van 2 uur, is
er nog 5,32 g aniline over.
a.
Bereken atoomeconomie, rendement en E-factor
O
NH2
+
2
+
4 MnO 2
5 H2SO 4
2
O
aniline
2 x 93,13
4 x 86,94
5 x 98,08
O
(NH4)2SO 4
132,1
+
4 MnSO 4
4 x 151,0
+
4 H2O
4 x 18,02
2 x 108,09
OH
+
Fe
+
+
H2O
O
108,09
+
FeO
OH
55,85
18,02
Scheikunde | Werkblad Thema Groene Chemie| HV
110,11
71,85
26
Bij de bepaling van de E-factor mag je de massa’s van water weglaten; water is geen
vervuilende stof.
Opgave 3.5
vervolg
Stap 1
CH3
Bereken de atoomeconomie en E-factor voor ibuprofen
volgens onderstaande synthese.
C
HC
CH
C
CH
HC
H3 C
O
O
CH
CH3
O
+
CH
CH2
CH3
C
CH
HC
CH3
C
O
HC
C
CH3
C
H3 C
CH
CH2
O
CH
+
H3 C
OH
O
Stap 2
CH3
2
CH
HC
O
CH3
C
Stap 3
O
H2
hydroquinon
2
C
CH
CH
CH3
C
HC
C
H3C
CH
CH
CH2
O
CH3
CH3
C
HC
H
CH
CH
HC
H
CH
CH
HC
CH2
+
CH
CH
CH2
CH3
CH3
C
HC
H3 C
H3 C
C
C
C
CH
CH
HC
OH
CH3
C
HC
+
CO
H3 C
C
CH2
CH
CH
27
Scheikunde | Werkblad Thema Groene Chemie| HV
Vervuilingscoëfficiënt Q
Onder de vervuilingsfactor Q verstaan we de mate waarin een stof vervuilend/gevaarlijk is.
Bijvoorbeeld:
Water
Q=0
Niet schadelijke zouten zoals NaCl Q=1
Giftige producten
Q=100 … 1000
We bekijken nog eens de vergelijking van de productie van maleïnezuuranhydride.
O
+
4, 5 O 2
HC
C
+
O
HC
2 CO 2
+
2 H2O
C
O
benzeen
zuurstof
maleпnezuuranhydride
In onderstaande vergelijking zijn de atomen die in het product terecht komen vet weergegeven.
Daarmee is het duidelijker wat afval is.
O
H
H
H
C
C
C
C
C
H
H
C
+
3 O2
+
C
C
1, 5 O 2
H
O
C
H
H
+
2 CO 2
+
2 H2O
C
O
Atomen die in het product voorkomen zijn vet weergegeven.
Opgave
3.6
a.
Wat versta je onder MAC waarde? Leg uit dat je de MAC
waarde uit de BINAS kunt gebruiken om een waarde van Q
af te leiden.
b.
Welke Q-waarde zou je aan CO2 willen toekennen? En aan
SO2?
c.
Wat kun je zeggen over de waarde die ontstaat als je E met
Q vermenigvuldigt?
28
Scheikunde | Werkblad Thema Groene Chemie| HV
Samengevat
Vat in onderstaand schema de begrippen samen:
Begrip
Omschrijving
Atoomeconomie
Rendement
E-factor
Vervuilingscoëfficiënt
Praktische opbrengst
Theoretische opbrengst
29
Scheikunde | Werkblad Thema Groene Chemie| HV
Samenvattende opgave
Aan de hand van verschillende synthesen van fenol kun je oefenen met de begrippen die in deze
paragraaf behandeld zijn.
Fenol (C6H5OH) is een giftige stof die vroeger als grondstof diende voor de productie van
bakeliet (de eerste kunststof). Ook wordt fenol gebruikt om zenuwen in het lichaam stil te leggen.
Opgave 3.7
Hieronder staan drie processen voor de productie van
fenol (C6H5OH).
Bereken voor de drie processen telkens:
atoomeconomie
E-factor
Q
Vul de tabel met de 12 principes van Groene Scheikunde
voor de drie syntheses in.
Ga ervan uit dat Na2SO3 in proces 1 niet verkocht kan
worden. (Voor water spreekt dat voor zich.)
proces 1
OH
+
H2SO 4
+
+
2 NaOH
Na2SO 3
+
2 H2O
proces 2
OH
+
H
N2O
+
+
oxidatie
N2
proces 3
HO
CH3
O
OH
Cu, Mg
2
+
3 O2
2
140 °C
+
2 H2O
240 °C
2
+
2CO
+ 2H2O
30
Scheikunde | Werkblad Thema Groene Chemie| HV
Principes
Proces 1
Proces 2
Proces 3
Preventie
Atoomeconomie
Minder gevaarlijke chemische
productiemethoden
Ontwikkelen van veiliger chemische stoffen
Veiliger oplosmiddelen
Energie-efficiënt ontwerpen
Gebruik van hernieuwbare grondstoffen
Reacties in weinig stappen
Katalyse
Ontwerpen met het oog op afbraak
Tussentijdse analyse met het oog op
preventie van milieuverontreiniging
Veiliger chemie om ongelukken te
voorkomen
Geef met -- / - / 0 / + / ++ aan hoe de processen zich met het gegeven principe verhouden.
31
Scheikunde | Werkblad Thema Groene Chemie| HV
Reactietypen
Zoals je weet zijn er heel veel verschillende reactietypen. Het ene type is veel groener dan het
andere. Dat wil zeggen dat het ene type een veel betere atoomeconomie heeft dan het andere
type.
Opgave 3.8
Hieronder staat een tabel met daarin een aantal veel voorkomende reactietypen.
Daaronder staan een aantal reactievergelijkingen. Gebruik die onderstaande
reactievergelijkingen om de tabel in te vullen.
Vul bij Nr het reactienummer in.
Geef bij ‘omschrijving’ een korte algemene omschrijving van het reactietype.
Reken bij ‘Atoomeconomie’ het percentage uit.
Vul de ‘E-factor’ in.
Geef bij ‘Voorbeeld’ een eigen voorbeeld.
Reactietype
Nr
Omschrijving
reactietype
Atoomeconomie
Efactor
Voorbeeld
Additie
Condensatie
Eliminatie
Isomerisatie
Substitutie
32
Scheikunde | Werkblad Thema Groene Chemie| HV
1
H3C
Cl
2
H3C
CH2
+
NaOH
+
KOH
H3C
OH
+
NaCl
H2C
CH2
+
H2O
+
KBr
Br
CH CH3
CH CH
CH CH2
CH CH2
3
H2C
H2C
Br
4
H2C
CH2
+
Br Br
CH2 CH2
Br
OH
5
CH2 OH
H3C
CH2
+
H3C
C
O
H3C
O
C
CH2
CH2
CH3
+
H2O
O
De reacties vinden NIET plaats in water.
Opgave 3.9
Vul in de onderstaande figuur op de lijnen het reactietype in dat
het meest overeenkomt met het percentage.
Reactietype
100 %
atoom
gebruik
0%
geen reactie, verkeerde reactie
33
Scheikunde | Werkblad Thema Groene Chemie| HV
Activiteit 4
Opgaven energiebalans
4.1
In een hoogoven koelt men het ontstane vloeibare ijzer (7500 ton per dag) af van 1811 K
tot 298 K. Bereken hoeveel warmte per dag hierbij moet worden afgevoerd.
4.2
a.
b.
In hoogovens wordt het metaal ijzer gemaakt door ijzererts te laten reageren met behulp
van koolstof:
Fe2O3 (s) + 3 C (s) 2 Fe (s) + 3 CO (g)
Bereken de reactiewarmte van deze reactie.
Teken het energiediagram van deze reactie.
c.
In de hoogoven wordt per dag 7500 ton ijzer geproduceerd.
Bereken hoeveel warmte er per dag nodig is of ontstaat.
4.3
a.
b.
4.4
a.
b.
4.5
In een spiritusbrander verbrand je zuivere ethanol:
C2H5OH (l) + 3 O2 (g) 2 CO2 (g) + 3 H2O (l)
Bereken de reactiewarmte van deze reactie.
Teken het energiediagram van deze reactie.
Bij het ontstaan van 1,0 mol ethanol ontstaat -0,45. 105 J.mol-1.
Een fabriek produceert per dag 1000 ton ethanol.
Bereken hoeveel J energie er per dag vrijkomt.
De warmte die vrijkomt wordt gebruikt om water te verhitten.
Bereken hoeveel liter water je van 20 tot 100 °C kan verhitten met deze hoeveelheid
water. Gebruik hierbij als soortelijke warmte van water 4,2 J.g-1.K-1. Je mag
warmteverliezen buiten beschouwing laten.
Carbid is CaC2 (s); de chemische naam is calciumcarbide. Het wordt gemaakt door
krachtig verhitten van calciumcarbonaat(marmer) en koolstof(steenkool):
CaCO3 (s) + 4 C (s) CaC2 (s) + 3 CO (g)
34
Scheikunde | Werkblad Thema Groene Chemie| HV
a.
b.
Bereken de reactie-energie per mol carbid.
De vormingsenergie van carbid is -12 kJ.mol-1.
Teken het energiediagram van deze reactie.
35
Scheikunde | Werkblad Thema Groene Chemie| HV