MODULE : Kunstmest en de industrie (4h)
Kunstmest en de industrie (4h)
De module in vogelvlucht:
Productie, samenstelling en gebruik van kunstmest. Kunstmest & terrorisme en werken in de industrie.
Totaal aantal hoofdstukken: 6
Hoofdstuk van "Kunstmest en de industrie (4h)"
1. Associaties bij het Wereld Voedsel probleem
Het wereldvoedselprobleem is iets dat iedereen aangaat. Je gaat klassikaal kijken naar twee videofragmenten over
het wereldvoedselprobleem. Bekijk twee fragmenten onder beeldmateriaal: Wereldvoedselprobleem NOS archief
en Wereldvoedselprobleem Swaziland.
De film over Swaziland
De 60-jarige Mina Zulu is de enige volwassene die de familieboerderij in Swaziland kan runnen, terwijl ze op haar
95-jarige man en 6 kleinkinderen past. De rest van haar familie is, net als bij zoveel Afrikaanse families , gestorven
aan aids.
En dat is maar 1 van de problemen van de regio. Door de klimaatveranderingen is het hard nodig dat landen als
Swaziland hun manier van produceren veranderen en zorgen voor behoud van bodem en water.
Doordat de droogte in 2006 de oogst van 2007 deed verwoesten, leden mensen honger en konden de - veelal kleine
- boeren geen kunstmest of zaad meer kopen. Daarbij stegen de prijzen voor bijvoorbeeld brandstof aanzienlijk.
Dankzij een gift van de Europese unie werd er een ruilhandel in producten opgezet, zodat boeren weer kunnen
produceren, maar het wordt hoog tijd om de manier van produceren na 50 jaar te veranderen en flink te gaan
investeren in de landbouw voor de lange termijn.
Opdracht
Na het bekijken van deze filmpjes ga je klassikaal een mindmap maken (zie kenniskaart). De mindmap maak je in
groepjes van vier leerlingen. Je krijgt hier tien minuten voor. Daarna kom je met de hele groep tot een "klassikale"
mindmap die door de docent op het bord getekend wordt.
Hoofdstuk van "Kunstmest en de industrie (4h)"
2. Gevolgen van bemesting nader onderzocht
2.1 Introductie
Ieder van ons heeft wel gehoord van kunstmest. Het woord kunst-mest is eigenlijk een misleidend woord. Is het
kunst? Is het mest? Bij kunst denken we al snel aan iets dat een kunstenaar maakt of bedenkt. Het woord kunst
slaat hier echter op 'kunstmatig' of ook wel: 'door de mens gemaakt'.
Bij mest denken we aan uitwerpselen, zoals koemest,
paardenmest, kippenmest. Het gekke is dat je niet zo snel
denkt aan hondenpoep. Het lijkt of mest iets functioneels
is. Het woord mest heeft dan eerder iets te maken met
‘bemesten’. Bemesten van grond om gewassen beter te
laten groeien. In feite voeg je zinvolle voedingsstoffen aan
te bodem toe.
Kunstmest is dus niets anders dan door de mens gemaakte
en samengestelde voedingsstoffen voor de bodem om
planten beter te laten groeien. Die voedingsstoffen zijn
veelal zouten of onderdelen van zouten. Naast keukenzout
zijn er honderden zouten.
Meer informatie en vragen kun je links van dit scherm
vinden onder Artikelen in "Artikel over kunstmest"
Een koeievlaai, stront dus, met op de achtergrond de
'boosdoener'.
Koeiemest is goed voor de vruchtbaarheid van de
grond, maar dan moet het wel gelijkmatig verdeeld
worden, en dan ook nog verplicht in de grond
'geïnjecteerd' worden.
Kunstmest ziet er ook niet uit als bijvoorbeeld koemest.
Zouten zijn vaste stoffen, vaak wit maar ook niet altijd.
Deze vaste stoffen kunnen we mengen in tot brokjes of
korrels persen. Korrels zijn lekker makkelijk, omdat we
die eenvoudig kunnen rondstrooien.
In kunstmest komen onder andere de volgende zouten
voor:
Ammoniumnitraat en kaliumfosfaat.
Kunstmest
Als je niet meer weet wat
zouten zijn en waaruit ze zijn
opgebouwd, kijk dan in een
van de kenniskaarten hoe dat
ook alweer zat voordat je
verder gaat. Ook is het
belangrijk dat je de
zoutformules en namen goed
kent. Weet je hoe je met
behulp van BINAS kunt
bepalen of zouten oplosbaar
zijn?
Vraag:
Kun je bedenken wat het voordeel van bemesten met kunstmestkorrels is ten opzichte van ‘koeienvlaaien’?
Als kunstmest op het land wordt gestrooid, zullen door regenwater de zouten in de korrels oplossen en in de bodem
trekken.
Vraag:
Denk je dat alle zouten in kunstmest daadwerkelijk door de planten worden opgenomen? Waarom wel of waarom
niet? Waar hangt dat van af?
Als het veel regent zie je al snel dat de sloten rondom een bouwland vol met water staan. Regenwater dat op het
land valt dat net met (kunst)mest is behandeld, zal oplosbare zouten meenemen naar de sloten. We noemen
slootwater ook wel oppervlaktewater.
Om de gevolgen van het gebruik van kunstmest te bestuderen, gaan we oppervlaktewater op aanwezige zouten
onderzoeken. We kunnen ook de grond die met kunstmest is bestrooid onderzoeken. De reden dat we
oppervlaktewater gebruiken is dat het onderzoek hieraan veel gemakkelijker is
We gaan bepalen wat de ammoniumconcentratie in oppervlaktewater is. Dit doen we klassikaal. We maken hierbij
gebruik van een spectrofotometer. Uitleg over deze meter krijg je klassikaal.
Daarnaast bepalen we klassikaal ook de fosfaatconcentratie met een kant en klaar setje dat voor je wordt
klaargezet.
Opdracht 1
Voer de volgende proef uit
Introductieproef over verdunnen en ijkreeks
Als introductie op de fotometrische bepaling wordt er door de leerlingen een ijkreeks gemaakt van
ijzerthiocyanaat-ionen.
Benodigdheden: standaardoplossing van 10 mg Fe3+/L en 2M KSCN-oplossing
Reactie: Fe3+ + SCN- → FeSCN2+
De Fe3+-oplossing en de SCN--oplossing zijn kleurloos. Het complex-ion, FeSCN2+ is rood gekleurd. Bij dit
experiment wordt een overmaat aan SCN- toegevoegd en hoe meer Fe3+ aanwezig is, hoe roder de kleur.
Experiment: Doe 8 reageerbuizen in een reageerbuisrek. Doe in de eerste reageerbuis 1,0 mL Fe3+ -oplossing (10
mg/L) met behulp van een pipet. Doe in de tweede reageerbuis 2,0 mL Fe+ -oplossing en ga zo door tot en met buis
8 (deze reageerbuis bevat dus 8,0 mL Fe3+ - oplossing). Voeg 1,0 mL KSCN-oplossing (2,0 mol/L) toe aan elke
reageerbuis. Vul elke reageerbuis met gedestilleerd water aan tot een volume van 10,0mL.
Er is nu een ijkreeks ontstaan.
Neem 4,0 mL van een watermonster van onbekende concentratie en voeg wederom 1,0 mL KSCN-oplossing toe en
vul daarna met gedestilleerd water aan tot een volume van 10,0 mL.
- Bereken de concentratie Fe3+ in elke reageerbuis. Voor de berekening kun je de kenniskaart "verdunnen"
raadplegen of downloaden door hier te klikken.
- Vergelijk het watermonster met de ijkreeks en bereken de concentratie Fe3+ van het watermonster.
Opdracht 2
Voer de volgende proef uit
Fotometrische bepaling van de ammoniumconcentratie
Je gaat in groepjes van twee of drie leerlingen een watermonster nemen. Het monster is afkomstig uit
oppervlaktewater (bijv: een sloot of een kanaal) dat grenst aan een met kunstmest bemest land (let op: het hoeft
niet een onlangs bemest land te zijn!). Vul een frisdrankfles met dit water en neem dat mee naar school. Je gaat dit
monster gebruiken voor de volgende proef.
WATERONDERZOEK
Doel:
Bepalen van ammoniumgehalte 5.7 (Merck pp 4-9;NEN3235-6.1.1./KNAG geografisch tijdschrift
XVII 1983, bewerkt door P. Otter en H. Kramer).
Principe:
Het NH4+ vormt met het Nessler reagens een geelbruin complexe verbinding van
Reagentia:
Materiaal:
ammoniumkwikoxidejodide.
Ammoniumstandaard; 1g NH4+/L (2,966g ammoniumchloride/L). Deze standaard 1000
keer verdunnen; bevat 1 mg/l NH4+
Reagens 1; 25% kaliumtartraat
Reagens 2; Nesslerreagens
Spectrofotometer en cuvetten
7 reageerbuizen
pipetten van 1 mL
Bepaling
in duplo
Standaard
(5x)
Uitvoering:
St1=blanc
o
St2
St3
St4
St5
St 6
0:10
1:10
2:10
4:10
6:10
8:10
=0,0
=???
=???
=???
= ???
= ???
mg/L NH4-
standaardo
plossing in
reageerbuis
0 mL
1 mL
2 mL
4 mL
6 mL
8 mL
gedestillee
rd water
8m
7 mL
6 mL
4 mL
2 mL
0 mL
verdunnen
monster in 8 mL
reageerbuis
reagens1
1 mL
1 mL
1 mL
1 mL
1 mL
1 mL
1 mL
reagens2
1 mL
1 mL
1 mL
1 mL
1 mL
1 mL
1 mL
Homogeni
seer de
inhoud van
de
reageerbuiz
en
Na 5 minuten kun je met de metingen beginnen. Je gebruikt een filter met een golflengte van 440 nm.
De colorimeter: Klik hier voor de werking en het werken met de colorimeter.
Zet in een grafiek de extinctie (Y-as) uit tegen de concentratie (X-as). Je krijgt oplossingen met verschillende
concentraties door de standaard te verdunnen. Bepaal het ammoniumgehalte van het monster met behulp van de
ijklijn.
Opdracht 3
Voer de volgende proef uit
Fosfaatgehalte bepaling aan de hand van een set
WATERONDERZOEK
Je gaat twee watermonsters onderzoeken waarvan er een afkomstig is van oppervlaktewater nabij bemest weiland
en een afkomstig is van oppervlakte water nabij een onbemest weiland.
Doe een fosfaatgehalte bepaling aan de hand van een eenvoudige set die je hebt aangeschaft.
Hoofdstuk van "Kunstmest en de industrie (4h)"
3. Verschillende aspecten van kunstmest
3.1 Inleiding
In dit hoofdstuk staat een aantal onderzoeken die je in groepjes van twee tot drie personen moet uitvoeren. Over
deze onderzoekjes maak je een presentatie.
Je moet aan de hand van jouw presentatie twee vragen/opdrachten maken voor je klasgenoten waarin je
opneemt wat jij wilt dat zij van jouw presentatie moeten onthouden en leren. Het is de bedoeling dat je zelf
het antwoord op deze vragen/opdrachten weet.
Je moet als het ware de klas aan het denken zetten. Voorbeeld van een dergelijke vraag:
'Niet alle Ammoniak die je via bemesting op het land brengt komt in de plant. Leg uit hoe dit komt'.
Het is voor de beoordeling niet alleen van belang dat je de praktische opdracht goed uitvoert, maar ook dat je het
duidelijk aan de rest van de klas presenteert. Presentaties voor de klas kunnen door middel van een powerpoint of
het maken van een poster. Vergeet niet dat we van elkaar moeten leren en dat een groot deel terug komt op de
toets.
3.2 Opdrachten
Voer een aantal van de volgende opdrachten uit:
Je vindt de onderzoeken onder: praktische opdrachten.
Elk onderzoek heeft een bepaalde zwaarte, aangegeven met een aantal kunstmestkorrels. Elk groepje moet in elk
geval 60 kunstmestkorrels halen.
Hoofdstuk van "Kunstmest en de industrie (4h)"
4. Presentaties
De presentaties van de groepsonderzoeken (Hoofdstuk 3) vinden plaats voor de klas aan de hand van een
powerpoint of een poster. Elke presentatie eindigt met twee verdiepingsvragen. Hiermee wordt bedoeld dat je twee
kernvragen stelt die betrekking hebben op de presentatie. Die kernvragen worden in de verdiepingsfase
(Hoofdstuk 6) verder klassikaal uitgediept.
Je eindcijfer voor de module kunstmest en de industrie wordt voor 50% bepaald door het cijfer op de
groepspresentatie. De theoretische toets bepaalt 50% van het eindcijfer. Je hebt zeker een les nodig voor het
voorbereiden van de presentatie. Je zult daarna ook moeten oefenen. Vergeet niet de tekst uit het hoofd te leren.
Hieronder vind je het beoordelingschema voor een powerpoint en een poster:
Power Point Presentatie (totaal 100 punten)
a. Titel dekt inhoud - 5 punten
b. Hypothese/ Vraagstelling - 10 punten
c. Uitvoering en onderzoeksresultaten - 30 punten
d. Netheid, logische ordening - 10 punten
e.Technische uitvoering - 10 punten
f. Bronvermelding - 10 punten
g. Presentatie - 25 punten
NB: onderdeel g wordt gevormd door een gemiddelde te bepalen van alle groepsleden.
Poster (totaal 100 punten)
a. Leesbaarheid op 1 a 2 meter - 10 punten
b. Overzichtelijke, logische ordening - 10 punten
c. Goede vlakverdeling - 5 punten
d. Netheid - 10 punten
e. Prikkelend, nodigt uit tot het stellen van vragen - 10 punten
f. Uitvoering en onderzoeksresultaten - 30 punten
g. Presentatie - 25 punten
NB: onderdeel g wordt gevormd door een gemiddelde te bepalen van alle groepsleden.
Het is wellicht een aanrader om de posters een tijdje in de gang van de school op te hangen voordat er een
presentatie in de klas gegeven wordt. In dat geval kunnen alle leerlingen de posters goed bekijken. Een
andere mogelijkheid is dat de posters voorafgaand aan de presentatie in het klaslokaal eerst goed door de
leerlingen bekeken worden.
Een bruikbaar voorbeeld van een beoordelingsformulier staat hieronder:
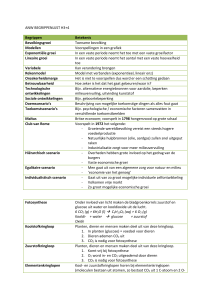
Beoordelingsformulier
N
aam: ………………………………..
Presentatie kunstmest
C
ijfer:
………….
N
aam: ………………………………..
max
Inleiding
Presentatie
Slot
5
Inhoud
30
Opbouw
10
5
Helderheid
20
Aantrekkelijkheid
20
Duopresentatie
10
Totaal
score
Hoofdstuk van "Kunstmest en de industrie (4h)"
5. Wat moet je kunnen/ kennen
De stof voor de toets is opgebouwd uit:
1. de theorie uit hoofdstuk 2
2. de kenniskaarten
3. de stof die wordt behandeld naar aanleiding van de presentaties in de verbindingslessen
De toetsstof bestaat uit de volgende onderwerpen:
1. molberekeningen, pH-berekeningen, berekeningen aan verdunnen en ijkreeks, berekeningen aan een blokschema
2. zuren en basen (eenvoudig), zuur-base-reacties (eenvoudig), reactievergelijkingen die voorkomen in de
praktische opdrachten (en presentaties)
3. theorie over de stikstofkringloop
4. werking van kunstmest (het artikel niet leren!)
5. evenwichten
6. ook de manier waarop je kunt verdunnen en een ijkreeks maken, moet je beheersen
Hoofdstuk van "Kunstmest en de industrie (4h)"
6. Verdieping
De verdieping bestaat uit een aantal lessen waarin de theorie klassikaal besproken wordt aan de hand van
verdiepingsvragen. Samen met de docent werk je klassikaal de powerpoint presentaties door. Bovendien kunnen de
kenniskaarten worden uitgelegd.
Onderwerpen die sowieso centraal zullen staan zijn:
1.
2.
3.
4.
5.
6.
Berekeningen ten aanzien van kunstmest(productie)
Berekeningen aan een ijkreeks en verdunnen
Eenvoudige pH-berekeningen
Theorie over de stikstofkringloop
Evenwichten
Werking van kunstmest
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Klik hier voor de kenniskaart
Weetjes:
Voorbeeldvragen:
Begrippen:
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Kenniskaart bij opdracht 5: Het stikstofgehalte in kunstmest
In kunstmest zit NH4+. Dit is een zuur en reageert met de base OH-.
Door aan een oplossing van kunstmest een oplossing van NaOH toe te voegen, krijg je de volgende reactie:
NH4+ (aq) + OH- (aq) ------>
NH3 (g) + H2O (l)
Door een overmaat van de NaOH-oplossing
toe te voegen, zal alle NH4+ (aq)reageren tot NH3 (g). Door het koken van de oplossing zal alle NH3 (g) uit de
oplossing verdwijnen en blijft de overmaat OH- (OH- wat niet gereageerd heeft) achter.
Je weet hoeveel mmol NaOH-oplossing je hebt toegevoegd, n.l. het aantal ml NaOH-oplossing maal de molariteit
van de NaOH-oplossing.
Als je nu bepaalt hoeveel mmol OH- je overhoudt, weet je ook hoeveel mmol OH- gereageerd heeft met NH4+
Om de overmaat OH- te bepalen, laat je dit reageren met een oplossing van HCl van bekende concentratie. Hierbij
krijg je de reactie:
OH-(aq)+ H+ (aq) ------->
H2O (l)
Door het toevoegen van de indicator fenolftaleïne zal de oplossing met overmaat OH- (basische-oplossing)
rood/roze kleuren. Door het toevoegen van H+ zal de OH- reageren tot H2O. Als alle OH- weg gereageerd is, zal na
toevoegen van overmaat H+ de indicator kleurloos worden.
Door nu net zoveel HCl-oplossing toe te voegen tot de kleur met één druppel omslaat van rood/roze naar kleurloos,
weet je hoeveel mmol H+ je hebt toegevoegd en dit komt overéén met het aantal mmol overmaat OH-. Hiermee kun
je uitrekenen hoeveel mmol OH- gereageerd heeft met NH4+ en dit komt overéén met het aantal mmol aanwezig
NH4+ en dit is weer gelijk aan het aantal mmol aanwezige N (stikstof).
Voorbeeld:
Je koop een brood bij de bakker, je betaald met twee Euro, je krijgt 0,5 Euro terug en je weet hoeveel een brood
kost
Brood
€
0,50
mmol NH4+
mmol H+
|----------------|------------------|
|-----------------------------------|
|----------------------|------------|
|-----------------------------------|
€
2,00
mmol overmaat OHBrood = €
2,00
-
€
0,50
mmol NH4+/ N = mmol overmaat OH- - mmol H+
Weetjes:
Voorbeeldvragen:
Begrippen:
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
De Kenniskaart kun je hier downloaden.
Weetjes:
Voorbeeldvragen:
Vraag:
Bereken de concentratie ijzer-ionen als je een standaard-oplossing van 1,0 mg/L 8 x verdunt.
Antwoord: 1,0/8 = 0,125 mg/L; dus de concentatie is 0,125/55,85 = 0,0022 mol/L
Begrippen:
Berekeningen aan een ijkreeks
Bij de kwantitatieve bepaling van het ammoniumgehalte in oppervlaktewater moet je een standaardoplossing
verdunnen.
Op het moment dat je 10x moet verdunnen, betekent dat 1 deel oplossing en 9 delen water. Dus bijvoorbeeld 1,0
ml standaardoplossing en 9,0 ml water. Op het moment dat je 25 x moet verdunnen, betekent dit 1 oplossing en 24
delen water. Zie ''voorbeeldvragen'' hieronder voor een voorbeeldvraag.
Daarnaast is het van belang dat je aan de hand van een ijkreeks het ammoniumgehalte in oppervlaktewater kunt
berekenen. Door de extinctie van een aantal oplossingen met bekende ammoniumconcentratie te meten, kun je een
ijklijn maken.
Je maakt deze ijklijn door de Extinctie op de verticale as en de bekende concentraties op de horizontale as te
plaatsen. Je trekt vervolgens een ijklijn door de oorsprong en de andere punten. Je kunt dit ook op je grafische
rekenmachine doen.
Als laatste meet je de extinctie van de onbekende oplossing en bepaalt via de ijklijn de onbekende
ammoniumconcentratie.
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Weetjes:
Voorbeeldvragen:
Begrippen:
Chemisch rekenen
Voor het downloaden van het schema van het omrekenen van mol naar massa, liters, deeltjes en omgekeerd, klik
dan hier.
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Kenniskaart - De stikstof cyclus
1. Wat is stikstof en wat is het belang ervan voor levende organismen?
Stikstof is het meest aanwezige element in onze atmosfeer. Het kan op natuurlijke wijze meerdere vormen
aannemen en komt voor in de lucht, de grond, water en in alle levende organismen. Ongeveer 79% van de lucht die
we inademen bestaat uit stikstof. In de grond en water komt stikstof meestal voor in de vorm van ammonium en
nitraat.
Waarom is stikstof belangrijk?
Stikstof is een nutriënt (voedingsstof) en is essentieel voor de opbouw van DNA en eiwitten (proteïnen) bij planten
en dieren. De meeste levende organismen zijn niet in staat om stikstofgas rechtstreeks te gebruiken.
Hoe wordt het dan gebruikt door levende organismen?
Organische stikstof (in rottende planten/humus) moet worden omgezet in minerale (anorganische) ammonium- of
nitraationen om gebruikt te kunnen worden door planten – dit gebeurt wanneer bacteriën en schimmels de
organische structuur afbreken. Wanneer de voorraad aan ammonium- en nitraationen na de herfst niet wordt
aangevuld, worden de organische stikstofreserves in de grond geleidelijk opgebruikt. Wanneer er niet meer
voldoende aanwezig is, zal de oogst mislukken. De moderne voedselproductie heeft dus voldoende stikstof nodig
en daarom gaat men de natuurlijke stikstof verder aanvullen door ofwel organische of minerale meststoffen toe te
voegen.
Daarnaast zijn er ook zogenaamde stikstof-fixerende bacteriën, dat wil zeggen bacteriën die in staat zijn om
stikstof gas direct uit de atmosfeer te binden en zo in de bodem te brengen.
2. Wat is de stikstofkringloop nu precies?
De stikstofkringloop beschrijft de circulatie van stikstof in het milieu van de atmosfeer naar de grond, het water en
levende organismen, en dan weer naar de lucht. De voornaamste processen in deze kringloop zijn:
Stikstofbinding – stikstof in de lucht wordt omgezet in ammonium en vervolgens in organische stikstof (wordt ook
wel
Nitrificatie – ammonium wordt omgezet in nitriet en vervolgens in nitraat, dit is een oxidatieproces
Denitrificatie – nitraat en nitriet worden omgezet in stikstofgas, dit is een reductieproces
Anammox – ammonium wordt omgezet in nitraat bij afwezigheid van zuurstof
Assimilatie – anorganische stikstof wordt omgezet in organische vormen en uiteindelijk biomassa
Mineralisatie – organische stikstof wordt omgezet in ammonium
3. Op welke manier beïnvloedt de landbouw de natuurlijke stikstofkringloop?
De Europese landbouw vindt plaats in verschillende topografische en klimatologische omstandigheden en de
invloed op de stikstofkringloop is afhankelijk van meerdere factoren.
Een gebrek aan stikstof is vaak de oorzaak voor een beperkte groei van gewassen op voldoende geïrrigeerd land,
aangezien het slechts in beperkte hoeveelheid in de grond aanwezig is. De Romeinen ontwikkelden reeds het
concept van wisselbouw, waarbij peulvruchten (planten met bacteriën op de knolvoet die rechtstreeks met
stikstofgas kunnen binden) werden afgewisseld met gewassen die niet met stikstof binden om zo de grond met
stikstof te voeden. Hoewel wisselbouw nog steeds op sommige plaatsen in de wereld wordt toegepast, werd het
sinds het midden van de twintigste eeuw in het merendeel van West-Europa vervangen door intensievere
landbouwmethoden en het gebruik van op stikstof gebaseerde kunstmeststoffen en organische mest. Dit heeft
geleid tot een teveel aan stikstof ter bevordering van de groei in de meeste Europese landbouwgebieden.
Weetjes:
Voorbeeldvragen:
Begrippen:
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Een voorbeeld van een mindmap, gemaakt tijdens een college
(bron: Wikipedia)
Weetjes:
Voorbeeldvragen:
Begrippen:
In de leertheorie is een mindmap een grafisch schema (of informatieboom) dat vertrekt van een centraal
onderwerp en daaraan bijzaken en verwante concepten linkt. Een mindmap kan bij het studeren helpen details van
hoofdzaken te onderscheiden en informatie logisch te ordenen in het geheugen. Er zijn geen formele restricties
voor het soort van linken dat je gebruikt, maar vaak hanteert men kleuren, woorden en lijnen. De verschillende
elementen worden ingedeeld naar belang en in groepen of gebieden voorgesteld.
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Weetjes:
Voorbeeldvragen:
Begrippen:
Monster
Volgens Van Dale is een monster een kleine hoeveelheid van een artikel dat wordt gekeurd. In het geval van
onderzoek aan oppervlaktewater praten we dus over een klein beetje water dat vervolgens wordt onderzocht.
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Download hier de kenniskaart "pH-berekeningen en zuur-base
Weetjes:
Voorbeeldvragen:
pH berekening (voorbeeld)
Bereken de pH van een zure oplossing die 0,0015 mol H+ in 450 ml bevat.
0,0015 mol/0,450 liter = 0,00333 mol/L. pH = -log(0,00333) = 2,5
Ook het omgekeerde proces kan:
Bereken de concentratie H+-ionen van een oplossing met een pH van 4,5
10-pH = 10-4,5 = 3,16.10-5
De pH waarden liggen doorgaans tussen 1 en 14.
Experimentje:
Giet de volgende vier oplossingen in een klein bekerglaasje:
1. Cola
2. Tafelazijn
3. Toiletontstopper-oplossing
4. Keukenzout-oplossing
5. Soda-oplossing
Bepaal de pH m.b.v. universeel indicator.
Zuur-base reactie (voorbeeld)
Geef de vergelijking voor de reactie van een zoutzuur oplossing met natronloog.
1. Zoutzuur is een oplossing van HCl. Natronloog is een oplossing van natriumhydroxide (NaOH)
2. In verdund zoutzuur zijn H+ ionen aanwezig. In natronloog zijn OH- ionen aanwezig.
3. Het zuur is H+(aq) en de base is OH-(aq)
4. H+(aq) + OH- (aq) -----> H2O(l)
Begrippen:
pH-berekeningen
De zuurgraad, pH van een oplossing wordt bepaald door de concentratie van H+-ionen. De concentratie is de
hoeveelheid stof per volume. We drukken concentratie uit in mol per liter. De concentratie kun je verkort noteren
met vierkante haken. Bijvoorbeeld als de concentratie van H+-ionen 0,10 mol is in 1,0 liter, noteer je dit als [H+] =
0,10 mol/L.
Zuur-base reacties
Je stelt een zuur-base reactie als volgt op.
1. Wat zijn de formules van de gegeven stoffen?
2. Welke deeltjes zijn aanwezig?
3. Zoek het zuur en base op.
4. Stel de reactievergelijking op.
Voorbeelden zijn hiernaast te vinden.
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Weetjes:
Voorbeeldvragen:
Begrippen:
De Spectrofotometer
De spectrofotometer is een apparaat waarmee nauwkeurige bepalingen van ionconcentraties gedaan kunnen
worden. Het principe is dat je licht door een met oplossing gevulde cuvet stuurt. De oplossing bestaat uit ionen die
licht kunnen opnemen. Hoe hoger de concentratie, hoe meer licht wordt opgenomen (dus hoe hoger de extinctie).
Op deze manier kunnen we de spectrofotometer gebruiken voor kwantitatieve doeleinden. Het verband tussen
extinctie en concentratie wordt weergegeven door de wet van Lambert-Beer (zie Binas 37E). Uit de wet blijkt dat
de extinctie recht evenredig is met de concentratie van de ionen.
Om van een onbekende oplossing de concentratie te bepalen, moet je eerst van een aantal oplossingen met bekende
molariteit de extinctie bepalen. De grafiek van de extinctie tegen de concentratie moet dan een rechte lijn door de
oorsprong opleveren. Zo'n lijn noemen we een ijklijn. Als je daarna van de onbekende oplossing de extinctie meet,
kun je met behulp van deze ijklijn de onbekende concentratie bepalen. (bron: Chemie, vwo bovenbouw scheikunde
2, Wolters Noordhoff, pagina 67)
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
Verdunnen
Als je iets meer wilt weten over de relatie tussen verdunnen en concentraties klik dan hier.
Weetjes:
Voorbeeldvragen:
Begrippen:
Kenniskaart van "Kunstmest en de industrie (4h)"
Meer Weten:
De Kenniskaart "zouten" kun je hier downloaden.
Informatie over de +ionen
De + ionen zijn vrijwel altijd metaalionen. Dus enkelvoudige ionen (1 atoomsoort) met lading 1+, 2+ of 3+. Voor
symbool en lading van enkelvoudige ionen zie tabel 40 A in het Binas boekje. Uit tabel 99 (Binas) is lading ook
vaak af te lezen : groep 1 is 1+, groep 2 is 2+, Groep 3 t/m 12 is meestal 2+, maar ook wel 1+ of 3+. Groep 13 is
3+.
Als een metaalion meerdere + ladingen kan hebben, moet je dat in de naam met een Romeins cijfer aangeven; bijv.
ijzer(III) is het Fe3+ ion. En ijzer(II) is het Fe2+ ion.
Er is 1 samengesteld + ion, dat is het ammonium ion : NH4+ . Dit is geen metaalion, maar ammoniumzouten zijn
wel zouten.
In tabel 45A (Binas) staan in de 1e kolom de meest voorkomende + ionen. Je moet de formules van deze
metaalionen kennen (symbool en lading).
Informatie over de -ionen
Enkelvoudige – ionen:
dat zijn ionen van niet-metaal atomen, groep 14 t/m groep 17.
Groep 17 wordt 1-, groep 16 wordt 2-, groep 15 wordt 3- en groep 14 wordt 4- als het in zouten voorkomt. Zie
verder tabel 40 A (Binas) voor symbool en lading. Let op andere namen voor het – ion: groep 17: fluoride,
chloride, bromide, jodide en groep 16 :oxide, sulfide, selenide, telluride.
Samengestelde – ionen:
Veel – ionen in zouten zijn opgebouwd uit meerdere atomen van niet-metalen, bijv. het sulfaat ion SO42- . Dit ion
bestaat uit 1 S atoom en 4 O atomen; de totale lading is 2-. Deze 5 atomen blijven steeds aan elkaar vastzitten bij
bijv. smelten en oplossen.
Een aantal van deze samengestelde – ionen staan in Binas tabel 66B (rechterkant). Het hydroxide ion OH- en het
silicaation SiO32- hoort hier eigenlijk ook bij.
Opstellen van zoutformules
Noteer het + ion en – ion naast elkaar. Geef met index 2 of meer rechts achter(en iets onder) de formule van +
en/of –ion aan de eenvoudigste verhouding ,waarbij de totale lading 0 wordt. Bij samengestelde ionen met index 2
of meer zijn haakjes verplicht.
Weetjes:
Voorbeeldvragen:
Begrippen:
Zouten
Zouten zijn stoffen , die hoge smeltpunten hebben. Het zijn ontleedbare stoffen. Ze bestaan uit geladen deeltjes: +
ionen en – ionen.
Oplossen van zouten
Voor zouten geldt : oplossen is splitsen in vrije ionen. Voor de pijl staat de zoutformule (aan elkaar) . Na de pijl de
vrije ionen zo nodig met een geheel getal (coefficient) er voor om de reactievergelijking kloppend te maken. De
zouten , die in tabel 45a(binas) een g hebben zijn goed oplosbaar in water.
Er zijn 4 zouten , die bij oplossen in water een echte reactie met H2O geven, dat zijn de 4 oplosbare oxiden:
natriumoxide, kaliumoxide, bariumoxide en calciumoxide. De O2- ionen veranderen in OH- ionen.
Indampen van zoutoplossingen
Dit is het omgekeerde van het oplossen. De vrije ionen staan voor de pijl , de zoutformule (aan elkaar) na de pijl.
De + en – ionen worden gedwongen om aan elkaar vast te gaan zitten.
Opstellen van zoutformules
Na+ClDe totale lading is nul. De zoutformule klopt.
Na+SO42De totale lading is -1. Om de totale lading op nul te krijgen moet je twee Na+ hebben. Je verandert dan de index
van Na+. De zoutformule wordt dan: Na2+SO42Mg2+ClDe totale lading is +1. Om de totale lading op nul te krijgen moet je twee Cl- hebben. Je verandert dan de index van
Cl-. De zoutformule wordt dan: Mg2+Cl2Oplossen van zouten
Na+Cl- oplossen in water geeft: Na+ + ClNa+2SO42- oplossen in water geeft: 2Na+ + SO42Mg2+Cl2- oplossen in water geeft: Mg2+ + 2Cl-
Kanjerkaart van "Kunstmest en de industrie (4h)"
Opdracht bij ammoniakfabriek
Meer weten:
Ammoniakfabriek(uit Chemie v6 3e druk, Wolters Noordhoff, blz 190,191)
Bij de productie van ammoniak maakt men gebruik van een gasmengsel dat uit waterstof en stikstof bestaat, in de
mol verhouding 3 : 1. Men noemt dit gasmengsel synthesegas. Dit brengt men bij een temperatuur van 500 °
C en een druk van 200 bar in een reactor. Bij de reactie stelt zich een evenwicht in.
Na de reactor blijkt er in het gasmengsel 12 volumeprocent ammoniak voor te komen. Men heeft niet helemaal
gewacht tot het evenwicht is ingesteld.
Na de reactor wordt dit ammoniak afgescheiden en het niet omgezette synthesegas wordt samen met vers
synthesegas teruggestuurd naar de reactor.
Deze opgave kun je hier downloaden als word-bestand
Opdrachten:
Extra vraag bij ammoniakfabriek(uit Chemie v6 3e druk, Wolters Noordhoff, blz 190,191)
1. Geef de reactievergelijking en geef de evenwichtsvoorwaarde.
2. Waarom wacht men niet tot het evenwicht volledig is ingesteld?
3. Bereken hoeveel
% van het synthesegas is omgezet in ammoniak.
4. Uit onderzoek blijkt dat bij hogere druk er een grotere opbrengst van ammoniak wordt verkregen. Waarom
kiest men geen druk van 1000 bar ?
5.
6.
7.
8.
De ammoniakfabriek produceert 1500 ton ammoniak per dag.
Bereken hoeveel ton synthesegas per dag gemaakt moet worden.
Bereken hoeveel ton synthesegas per dag de reactor binnenkomt.
Bereken hoeveel ton synthesegas per dag recirculeert.
Noem een mogelijkheid hoe de ammoniak, dat in het reactieproduct aanwezig is, afgescheiden wordt van
het niet omgezette gas.
De reactie is exotherm. Voor het evenwicht is het gunstiger om de reactie bij lagere temperatuur uit te
voeren, b.v. 200 °C. Toch wordt in de praktijk gekozen voor 500 ° C. Waarom wordt niet voor een lagere
temperatuur gekozen?
Kanjerkaart van "Kunstmest en de industrie (4h)"
Opdracht bij de stikstof cyclus
Meer weten:
Bij deze opdracht horen 2 bronnen die je kunt vinden onder "artikelen". Je kunt daar de twee artikelen als
word-bestand downloaden.
Opdrachten:
Download hier de kanjeropdracht, de chemie van de stikstofcyclus.
Kanjerkaart van "Kunstmest en de industrie (4h)"
Opdracht bij salpeterzuurfabriek
Meer weten:
Kanjerkaart bij salpeterzuur fabriek
In een salpeterzuurfabriek wordt in de eerste reactor per minuut 10,0 kmol gasmengsel geleid. Dit gasmengsel
bestaat uit 12,0 volume % ammoniak en 88,0 volume % lucht.
Lucht bestaat uit 20,9 volume % zuurstof . De volumina van de gassen worden gemeten bij dezelfde temperatuur
en druk.
Er geldt voor gassen: molverhouding = volumeverhouding
Gebruik voor de volgende vragen de totale reactievergelijking:
NH3(g) + 2 O2(g) --------> H+ (ag) + NO3-(aq) + H2O (l)
Deze totaal reactie is opgebouwd uit drie reacties:
In reactor A vindt reactie 1 plaats:
4 NH3 (g) + 5 O2(g) ---------> 4 NO(g) + 6 H2O(l)
In reactor B vindt reactie 2 en 3 plaats :
Reactie 2 : 2 NO(g) + O2(g) ---> 2 NO2(g)
|x3
Reactie 3 : 3 NO2(g) + H2O (l) ---> 2 H+ (aq) + 2 NO3 – (aq) + NO(g) |x2
Na optellen van reactie 2 (x3) en reactie 3(x2) valt NO­2 weg en wordt verkegen:
4 NO(g) + 3 O2(g) + 2 H2O(l) ----------> 4 H+ (aq) + 4 NO3 -(aq)
Opdrachten:
Download hier de opdracht en de bijbehorende bron bij deze kanjerkaart.
Kanjerkaart van "Kunstmest en de industrie (4h)"
Spectrofotometrische bepaling van de nitraatconcentratie
Meer weten:
Opdrachten:
Fotometrische bepaling van de nitraatconcentratie
WATERONDERZOEK
Doel:
Bepalen van nitraatgehalte V35 (Boden und Bodenuntersuchungen von Reinhard Bochter/bewerkt door P. Otter)
Principe:
Nitraat wordt door zinkpoeder gereduceerd tot nitriet. Het ontstane nitriet vormt met sulfanylzuur en
naphthyl-ethyleendiamine in een zure omgeving
a:
een roze/paarse verbinding (azokleurstof).
andaard;1 g/L (1,37 g NaNO3 /l)
Deze standaard 1:100 verdunnen; bevat 10 mg/L NO3Azijnzuur 50%
Zinkpoeder
NaOH 5 mol/l (199 gNaOH/l)
Reactiemengsel; 12 g L(+)-wijnsteenzuur
+ 1 g 4-aminobenzolsulfonzuur
+ 0,2 g N-(1-Naphthyl)-ethyleendiamine-diwaterstofchloride
l:
in mortier mengen en in donker bewaren.
otometer en cuvetten
ge en centrifugebuizen
van 10 ml em 1ml
ch
ans
ven
Uitvoering:
Bepaling
in duplo
Blanco
Verdunnen
monster in
centrifugebuis
5ml
Standaard
(5x)
St1
St2
St3
St4
ST5
0:50
0,25:50
0,5:50
5:50
50:100
=0.0
=0,05
=0.1
=1,0
=5,0
mg/LNO32-
5 ml
5ml
5ml
5ml
5ml
5ml
standaarden in
centrifugebuis
NaOH 5 mol/l
0,5ml
0,5ml
0,5ml
0,5ml
0,5ml
0,5ml
0,5ml
Zinkpoeder
0,5g
0,5g
0,5g
0,5g
0,5g
0,5g
0,5g
Buizen afsluiten met stoppen en 1 min. krachtig schudden. Centrifugeer 5 min. op hoogste stand. Bovenstaande
vloeistof overgieten in nieuwe centrifugebuizen.
Azijnzuur 50%
1ml
Reaktiemengsel
0,5g
1ml
1ml
1ml
1ml
1ml
1ml
0,5g
0,5g
0,5g
0,5g
0,5g
Buizen afsluiten met stoppen en 1 min. krachtig schudden. Centrifugeer 5 min. op hoogste stand. Bovenstaande
vloeistof overgieten in cuvetten.
Na 5 min. extinctie aflezen bij een golflengte van 530 nm. Zet de extinctie uit tegen de concentratie (ijklijn). Je
krijgt oplossingen met verschillende concentraties door de standaard te verdunnen. Bepaal het nitraatgehalte van
het monster met behulp van de ijklijn.
Maak een presentatie voor je klasgenoten waarin je de methode uitlegt en inzicht geeft in de nitraatgehaltebepaling.
Maak gebruik van vier powerpointdia’s.
Praktische opdracht van "Kunstmest en de industrie (4h)"
Nu je een aantal opdrachten hebt gedaan is het tijd om een beetje je eigen weg door deze module te zoeken.
hieronder staan een aantal uitdagende opdrachten.
Het is de bedoeling dat je, uiteraard in overleg met je docent, er een aantal uitkiest, en wel zo dat je in ieder geval
60 kunstmest korrels verzamelt (dit betekent dat als je een opdracht ziet die 40 korrels waard is, je er dus een
andere opdracht bij moet zoeken die minstens 20 oplevert. Méér mag uiteraard ook.)
1. Zelf een kunstmest maken
Bij deze praktische opdracht ga je zelf een kunstmest maken.
Opdracht 1 (20 kunstmestkorrels voor het maken, 30 voor het testen van de kunstmest).
Voor deze opdracht heb je ook de kenniskaart "zelf een kunstmest maken" nodig. Klik hier om deze kenniskaart te
downloaden.
2. De ammoniakfabriek
Bij deze opdrachten ga je verschillende aspecten van de ammoniakfabriek bekijken.
Informatie kun je vinden onder "artikelen".
Opdracht 2a (20 kunstmestkorrels)
Opdracht 2b (10 kunstmestkorrels)
Bij de volgende opdracht ga je specifiek de verschillende stofstromen in een ammoniakfabriek bekijken.
Opdracht 2c (40 kunstmestkorrels)
3. De salpeterzuurfabriek
Bij deze opdracht ga je kijken hoe salperzuur gemaakt wordt in de salpeterzuurfabriek.
Opdracht 3 (20 kunstmestkorrels)
4. Bemesting
Bij deze opdracht ga je rekenen aan een bemestingsonderzoek. Hierbij heb je de kenniskaart "pH-berekeningen en
zuren-basen" nodig. Deze kun je vinden onder "Kenniskaarten". Je kunt hem hier ook downloaden.
Opdracht 4a (berekening) (10 kunstmestkorrels)
Bij deze opdracht ga je praktisch bemestingsonderzoek doen.
Opdracht 4b (praktisch) (60 kunstmestkorrels)
Bij deze praktische opdracht ga je onderzoeken in hoeverre de weersomstandigheden van invloed zijn voor de
uitspoeling van kunstmest en met name wat de invloed van regen is op de bemesting.
Opdracht 4c (40 kunstmestkorrels)
5. Bepaling Stikstofgehalte van kunstmest
Bepaling van het stikstofgehalte van kunstmest m.b.v. zuur/base titratie. Bij deze opdracht heb je de kenniskaart
"Het stikstofgehalte in kunstmest" nodig. Deze kun je vinden bij kenniskaarten en/of hier downloaden.
Opdracht 5 (30 kunstmestkorrels)
6. Aardgas
Deze praktische opdracht gaat over de rol van aardgas in onze samenleving. Wat is het verband tussen aardgas en
kunstmest?
Opdracht 6 (10 kunstmestkorrels)
7. Locatie van kunstmestfabrieken
Deze praktische opdracht gaat over de locatie van kunstmestfabrieken over de hele wereld. Welke grondstoffen
zijn nodig bij de kunstmestproductie en waar komen die vandaan?
Opdracht 7 (10 kunstmestkorrels)
8. Technische aardwetenschappen aan de TU Delft
Deze praktische opdracht gaat over de vraag welke mensen nodig zijn om een kunstmestfabriek draaiende te
houden en welke opleiding die mensen hebben genoten.
Opdracht 8 (10 kunstmestkorrels)
9. Ammoniumnitraat
Deze praktische opdracht gaat over de risico's die zijn verbonden aan het gebruik van ammoniumnitraat.
Opdracht 9 (10 kunstmestkorrels)
10. Bomaanslag in Oklahoma
Deze praktische opdracht gaat over kunstmest en terrorisme.
Opdracht 10 (10 kunstmestkorrels)
11. De stikstof cyclus.
Bij deze opdracht leer je aan de hand van een aantal bronnen wat het belang is van stikstof in de bodem. Je zult
zien hoe het daar terecht kan komen en wat voor invloed stikstof heeft op de groei van plant en dier. Ook leer je dat
stikstof dat lijkt te verdwijnen, bijvoorbeeld doordat een koe het gras (waarin opgenomen stikstof zit) afgraasd
uiteindelijk toch op de een of andere manier weer terug in de bodem komt.
Verdiep je in de volgende bronnen en beantwoord met behulp van die bronnen en internet de vragen in de beide
"werkbladen". Bronnen vind je bij het onderdeel "Artikelen".
Opdracht 11a (25 kunstmestkorrels)
Opdracht 11b (25 kunstmestkorrels)
Als je meer wilt weten over de stikstofcyclus, en dan met name de scheikunde die er achter zit dan kun je onder
"kanjerkaarten" een uitdagende opdracht voor de stikstofcyclus vinden!
Artikelen van "Kunstmest en de industrie (4h)"
Informatie bij productie van ammoniak:
Artikel bij productie van ammoniak
Informatie bij opdracht 11, De stikstof cyclus:
Artikel 1 bij de stikstofcyclus, uit: ANW Overal, Algemene Natuurwetenschappen HAVO/VWO voor de tweede
fase, eerste druk 1998.
Artikel 2 bij de stikstofcyclus, uit: Biologie voor Jou, VWO B2 deel 1.
Artikel over kunstmest.
Docentenhandleiding van "Kunstmest en de industrie (4h)"
Hieronder zijn te vinden:
Eindtermen
Opmerking vooraf
Benodigde voorkennis
Lesindeling
Een beschrijving en toelichting per hoofdstuk
Uitwerkingen
Opmerkingen bij praktische opdrachten (nav ervaringen op Bornego college)
Eindtermen
Download hier de kernconcepten en eindtermen van de module Kunstmest en de industrie.
Opmerking vooraf
Om ervoor te zorgen dat het rendement voor zowel docent als leerling van deze module optimaal is, is het van
belang dat de leerling vooral bewust met het leerproces bezig is, in plaats van het uitvoeren van een serie
opdrachten. Om het leren naar een hoger niveau te krijgen zou de docent kunnen vragen om wat feedback van de
leerling.
Dit kan bijvoorbeeld door het stellen van de volgende vragen, zowel aan het begin van de module, alsook aan het
eind om te zien of de leerling misschien door voortschrijdend inzicht van mening is veranderd.
Wat is volgens jou de betekenis van kunstmest? Wat is volgens jou de link tussen kunstmest en industrie? Wat zijn
volgens jou de voordelen van het gebruik van kunstmest? En denk je dat er ook nadelen aan het gebruik van
kunstmest kleven? Uiteraard kunnen naar eigen inzicht vragen aan dit rijtje worden toegevoegd.
De antwoorden op deze vragen worden door de docent ingenomen en bewaard. Aan het eind van de module stelt u
de vragen opnieuw aan de leerling, en vraagt hem daarna om zijn/haar antwoorden te vergelijken met de
antwoorden die aan het begin werden gegeven. Vraag naar de verschillen en laat de leerling de reden voor deze
verschillen noteren.
Benodigde voorkennis
(Ionen)formules, zouten, chemisch rekenen: molberekeningen, pH-berekeningen, percentages
Uit evaluaties van testscholen komt naar voren dat de module ook heel goed in havo 5 en in vwo 5 te gebruiken is.
In havo 5 is het dan meer een module die goed voorbereid op het examen. Wij als auteurs vinden dat het niveau
van de theoretische toetsvragen voor gebruik in vwo 5 moet worden aangepast.
Lesindeling
De module kunstmest en industrie is gebaseerd op 15 lessen van 50 minuten. Door het aantal praktische opdrachten
per groepje te varieren kan de studielast van de module worden aangepast. Hieronder volgt een mogelijke
lesindeling:
1. Associaties bij het Wereld Voedsel probleem (les 1 - 50 minuten)
2. Gevolgen van bemesting nader onderzocht (les 2 en 3 - 100 minuten)
3. Verschillende aspecten van kunstmest (les 4, 5, 6 en 7 - 200 minuten)
4. Presentaties (les 8, 9 en 10 - 150 minuten)
5. Verdieping (les 11, 12, 13, 14 en 15 - 250 minuten)
Een voorbeeld van een studiewijzer vindt u hieronder:
Week
Stof
Maken
Opmerkingen
27– 31
okt
Hoofdstuk
Doorwerken in mediatheek
http://test.scheikundeinbedrijf.nl
Aanleveren van twee watermonsters: een
uit oppervlaktewater naast een bemest
land en een uit oppervlaktewater naast een
onbemest land
de docent introduceert de module
Kunstmest en de Industrie
de docent toont een FeSCN2+-ijkreeks en
we rekenen hier klassikaal aan
3 –7 nov Hoofdstuk 2
Uitvoeren van de spectrofotometrische
de docent en TOA begeleiden de
ammoniumgehaltebepaling
leerlingen intensief bij het uitvoeren van
Uitvoeren van de fosfaatgehalte-bepaling de twee proeven
met een in de handel verkrijgbare test
10–14
nov
Hoofdstuk 3
Je kiest in groepjes van twee leerlingen
een onderwerp en je start met het
onderzoek. Als je snel klaar bent, krijg je
een tweede onderwerp
17-21
nov
Hoofdstuk 3+4 Onderzoek en start van de voorbereiding
op de presentaties
Vergeet niet dat je elke presentatie eindigt
met twee verdiepingsvragen (die je zelf
wel moet kunnen beantwoorden
natuurlijk!)
24-28
nov
Hoofdstuk 4
Voorbereiding Power Point Presentaties
(PPP’s)
In hoofdstuk 4 staan duidelijke
beoordelingscriteria!
De PPP’s tellen voor 50% van het
eindcijfer
1-5 dec
Hoofdstuk 4
Presentaties
De docent beoordeelt de presentaties.
8-12 dec Hoofdstuk 5
Verbindingslessen
De docent levert de PPP’s in papiervorm
aan voor elke leerling.
De theorie wordt klassikaal besproken aan
de hand van de verdiepingsvragen.
15-19
dec
Verbindingslessen
de docent en TOA begeleiden je bij het
onderzoek
Kerstvakantie
5-9 jan
Verbindingslessen
12-16 jan Toetsweek
Toetsstof: Theorie uit kenniskaarten,
PPP’s en verbindingslessen (50%)
Een beschrijving en toelichting per hoofdstuk
Hoofdstuk 1
De filmpjes die door de docent in de klas worden getoond, staan onder beeldmaterialen. De mindmap wordt door
de docent op het bord gezet. Hopelijk komen de leerlingen zelf met kunstmest op de proppen. Dit ligt voor de hand
omdat er een duidelijke relatie is met het wereldvoedselprobleem. Om de leerlingen zelf op kunstmest te laten
komen is het misschien aan te raden om de filmpjes via de beamer in de klas te tonen. Hierna kan de mindmap
gemaakt worden. De docent kan dan via een aantal sturende vragen/opmerkingen de leerlingen op het juiste spoor
zetten. het is van belang dat leerlingen niet meteen met deze website aan de gang gaan, op deze site zien ze
namelijk de titel van de module en dan is het meteen duidelijk dat het om kunstmest gaat!
nadat het maken van de mindmap heeft geleid tot de juiste conclusie, nl. kunstmest, kunnnen leerlingen in
de volgende lessen met de module aan de slag met behulp van http://www.scheikundeinbedrijf.nl/.
Hoofdstuk 2
Het is aan te raden om de leerlingen eerst in de mediatheek in hun schrift de kenniskaart van spectrofotometrie te
laten samenvatten. Vervolgens kan dit klassikaal besproken worden waarbij de docent start met het uitleggen van
het principe van de kwantitatieve bepaling aan de hand van de spectrofotometer.
Na het uitvoeren van de kwantitatieve bepaling aan de hand van de spectrofotometer is het een aanrader om de
leerlingen de resultaten te laten uitwerken. Aan de hand van deze resultaten kunnen de leerlingen een
Extinctie-concentratie-ijklijn maken. met behulp van die ijklijn kunnen ze de onbekende concentratie van het
oppervlaktewatermonster bepalen. Tevens moeten ze de concentratie van de ijkoplossing omrekenen van mg/l naar
mol/L. Ook dit is een goede oefening.
Proef verdunning en ijkreeks
Als introductie op het begrip ijkreeks zou de docent gebruik kunnen maken van een verdunningsreeks van
een ijzerthiocyanaatoplossing. Op die manier kunnen de leerlingen inzicht krijgen in het verband tussen de
concentratie Fe3+ en de kleur van de oplossing. Deze proef kun je eerst "op het oog" doen en vervolgens dezelfde
oplossingen m.b.v. een colorimeter nogmaals meten. de docent kan dan meteen de werking van de colorimeter
(globaal) uitleggen door deze simpelweg voor te stellen als een vervanger voor het oog, maar dan veel
nauwkeuriger. Als je de colorimeter aansluit op IPCOACH, kun je via "Maken van een ijklijn" de meting perfect
via een beamer op een scherm projecteren. De proef staat als eerste beschreven onder practische opdrachten.
Om de handleiding voor het instellen van IPCOACH 6 te downloaden, klik hier.
Het is een aanrader om de leerlingen als huiswerk verdunningsopgaven te laten maken. Deze opgaven staan in het
boek van havo-4 (bij pulsar chemie scheikunde 1 deel 1 bovenbouw opgave 41 t/m 44 van hoofdstuk 7). Deze
lesstof is weliswaar nog niet behandeld maar de leerling kan met behulp van het antwoordenboekje een heel eind
komen.
Fotometrische bepaling van het ammoniumgehalte
Laat de leerlingen zelf aan de hand van de proefbeschrijving de oplossingen voor de ijkreeks maken. Dit vraagt
veel begeleiding want de gemiddelde havo-4-leerling heeft heel weinig ervaring met verdunnen. Het meten met de
spectrofotometer vindt vervolgens onder strikte leiding van docent/TOA plaats. Mocht de school niet over een
spectrofotometer beschikken dan kan de bepaling ook met een colorimeter of minder nauwkeurig met het oog
gedaan worden.
Na het maken van de ijkreeks moeten de leerlingen vaak wachten tot de spectrofotometer beschikbaar is voor de
meting. Mocht er geen tijd zijn om elk groepje te laten meten dan kunnen de leerlingen de metingen van anderen
gebruiken voor het maken van het huiswerk (zie boven).
In plaats van een spectrofotometer kun je dit experiment ook prima doen met een colorimeter. Bij de
meeste analoge colorimeters lees je de transmissie in % af. In de proefomschrijving wordt verwezen naar een
document, waarin verteld wordt, hoe je simpel transmissie (in %) omrekent naar Extinctie (E). Bij de digitale
colorimeters kun je meteen de extinctie aflezen. Je kunt voor deze proef de zelfde handleiding voor de instelling
van IPCOACH 6 gebruiken als bij de proef over "verdunnen en ijkreeks", alleen moet je Fe3+ vervangen door NH4+
en de maximale concentratie NH4+veranderen.
Afval: het nessler-reagens bevat kwikverbindingen. Dit reagens is nog steeds verkrijgbaar en bij normaal gebruik
zal er geen kwikdamp vrijkomen. Het spreekt voor zich, dat het nessler-reagens niet drinkbaar is. Het is handig om
dit reagens in een fles met een dispenser, die ingesteld is op 1 ml, te bewaren, zodat er niet mee gemorst
kan worden. Het afval dient in een apart afvalvat of -fles verzameld te worden en na afloop van de proef is het
verplicht handen wassen!
De fosfaatgehaltebepaling aan de hand van de set kunnen de leerlingen geheel zelfstandig uitvoeren.
Tip: het bestellen van de chemicalien die nodig zijn voor de ammoniumbepaling moet vroegtijdig gebeuren. Het
kan lang duren voordat ze geleverd worden! Let op dat de oplossingen niet te geconcentreerd worden aangemaakt.
De chemicalien zijn duur!
Hoofdstuk 3
In hoofstuk 3 draait het om de groepsonderzoeken. De meeste onderzoeken zijn theoretisch van aard. Voor
praktische verdieping wordt verwezen naar de kanjerkaarten. Achterliggende gedachte bij de groepsonderzoeken is
dat de leerlingen elkaar van kennis gaan voorzien in de vorm van presentaties. De twee verdiepende vragen aan het
einde van elke presentatie worden in de verdiepingsfase gebruikt om een basis te leggen voor de theoretische toets.
De module draait dus eigenlijk op de "expertmethode".
Elk onderzoek heeft een bepaalde zwaarte, aangegeven in kunstmestkorrels. Elk groepje moet in elk geval 60
punten, dit zijn 60 "kunstmestkorrels", halen. De opdrachten lopen uiteen van 10 tot 60 kunstmestkorrels.
Het is aan de docent om een goede verdeling van groepjes over de praktische opdrachten te laten plaatsvinden. Het
mooiste is natuurlijk als deze verdeling zo gelijkmatig mogelijk is. In dat geval wordt elke praktische opdracht
tijdens de presentaties ook voldoende besproken.
Een tip is: om elk groepje opdrachten te laten uitzoeken voor 100 kunstmestkorrels en dat de docent vervolgens een
verdeling van de opdrachten kan maken, zodat elke opdracht minimaal één maal uitgevoerd wordt en de leerlingen
toch enkele door hun uitgekozen opdrachten kan uitvoeren.
Hoofdstuk 4
De docent kan uiteraard zelf bepalen hoe zwaar de toets, de presentatie en eventueel de klassikale proef meetellen
voor het eindcijfer. Dit zal ook te maken hebben met de eisen die worden gesteld aan het PTA.
De docent kan ook kiezen voor andere presentatievormen ten aanzien van het groepswerk. Hij moet zich wel
realiseren dat de presentaties grotendeels het programma van de verdieping (hoofdstuk 5) vormen. Elke presentatie
eindigt met twee verdiepingsvragen per opdracht.
Het is sterk aan te bevelen om met de leerlingen vooraf de presentatie te bespreken, niet alleen om ervoor te zorgen
dat de verdiepingsvragen voldoende niveau hebben, maar ook om te zorgen dat de vragen ook daadwerkelijk met
de kennis uit de presentatie te beantwoorden zijn. Met dit doel is het verstandig de presentaties ruim voor de
presentatiedatum in te nemen (in wat voor vorm dan ook) en deze aan de leerlingen terug te geven met wat
aanwijzingen, om het niveau te kunnen waarborgen. Het is nadrukkelijk niet de bedoeling de presentaties van
fouten te ontdoen, daarmee zou je de klasgenoten immers een leermoment ontnemen. Bovendien kunne chemische
onvolkomenheden makkelijk tijdens de verdiepingslessen worden rechtgezet.
Het is bovendien aan te raden de presentaties te kopieren en te verspreiden onder de leerlingen, zodat de
leerlingen voldoende basis en kennis hebben om de stof die uitvoerig wordt besproken in de verdiepingsfase te
begrijpen. Uit ervaring blijkt het handig te zijn de leerlingen de uitgeprinte presentaties voorafgaand aan de power
pointpresentaties te geven. Op die manier kunnen ze tijdens de presentaties aantekeningen maken. Eventuele fouten
worden er in de verbindingslessen door de docent (of klasgenoten) uitgehaald. Tijdens de powerpoint presentaties
is het aan te raden de leerlingen niet te wijzen op "chemische" fouten maar hiermee te wachten tot de
verbindingslessen. Op deze manier wordt vermeden dat een groepje dat later presenteert in het voordeel is.
Bovendien is het voor de leerlingen niet leuk om tijdens de presentaties steeds onderbroken te worden.
Hoofdstuk 5
In de verdieping wordt van de docent gevraagd dat hij een lijn aanbrengt in de informatie die uit de presentaties
naar voren is gekomen. Dit gebeurt in de vorm van een aantal verbindingslessen. Naast het gekopieerde materiaal
van de groepspresentaties van de leerlingen zal hier en daar meer theorie nodig zijn om goed voorbereid aan de
toets te kunnen beginnen. Deze theorie vindt u onder kenniskaarten. Ook de oefenvragen kunnen bijdragen aan
kennis en inzicht.
Hieronder vindt u een aantal leerdoelen. Deze leerdoelen moeten sowieso in de verbindingslessen aan de orde zijn
geweest. Het grootste deel van deze leerdoelen zal automatisch uit de kenniskaarten en presentaties naar
voren komen. Het overige zal door de docent zelf ingebracht moeten worden om te vermijden dat er op de toets
kennishiaten ontstaan.
1. Berekeningen ten aanzien van kunstmest(productie)
2. Berekeningen aan een ijkreeks en verdunnen
3.
4.
5.
6.
Eenvoudige pH-berekeningen
Theorie over de stikstofkringloop
Evenwichten
Werking van kunstmest
Uitwerkingen
De uitwerkingen zijn te vinden op het docentenforum van mijnscheikunde.nl. Om toegang te krijgen tot het forum dient u zich eenmalig te registeren. Hier
zijn geen kosten aan verbonden.
Voor aanvullende vragen kunt u mailen naar [email protected]
Opmerkingen bij de praktische opdrachten
(naar aanleiding van testen op het Bornego College)
Opdracht 5
1. Filtreren gaat sneller op watten dan met een rondfilter.
2. i.p.v. injectiespuit kan ook direct op een weegschaal 10,0 gram natronloog erbij gedruppeld worden, echter je
kan dan geen roermotor gebruikt worden.
Aan het eind weer druppelen op de weegschaal tot de kleur verdwijnt.
Opdracht 1
Er is hulp van de docent nodig bij het berekenen het aantal milliliter dat nodig is om ammoniumsulfaat te maken.
Opdracht 2
In het begin is er veel hulp van de docent nodig bij het berekenen (zie uitwerkingen) daarna loopt het prima.
Opdracht 3
Damp de gemaakt oplossingen voorzichtig in (zuurkast) en controleer de opbrengst met de te verwachten
theoretische opbrengst (Ammoniumnitraat heeft een hele lage ontledingstemperatuur, vandaar heel
voorzichtig indampen).
Eventueel alternatief: Zie: Chemistry Collected Experiments, blz. 166 -167.
Voor de berekening heb je de kenniskaart van deze opdracht nodig. Deze kun je via de website onder
opdracht 1 downloaden.
Opdracht 10
De tweede link kun je ook vinden door via google rechtstreeks:
''Eu streng over kunstmest in strijd tegen terreur'' in te typen.
Dan gaat het om het eerste blokje. (misschien beter hier de link opnemen? eerste blokje zal vast snel veranderen)
Colofon van "Kunstmest en de industrie (4h)"
De module Kunstmest en de industrie is een lesmodule voor de Nieuwe Scheikunde bestemd voor de vierde klas
havo.
Het ontwikkelteam:
Bertin Kok (CC de Noordgouw, Heerde)
Hylke Kramer (CSG Liudger, Drachten)
Roel Lageveen (CSG Liudger, Drachten)
Frans Meindertsma (Bornego College, Heerenveen)
Coach en auteur: Rony Grooten (RUG / Maartenscollege)
Dank aan de volgende deskundigen, die een belangrijke inbreng hadden bij het maken van de module:
Martin Voorwinden, DSM Agro
Vereniging van Kunstmestproducenten (VvK)
De rechten van dit lesmateriaal (uiteraard niet van de gebruikte bronnen) berusten bij de VNCI te Den Haag. Het
materiaal mag voor onderwijsdoeleinden vrij worden gebruikt. Voor andere doeleinden dient u contact op te nemen
met Stichting C3.
Gebruikte bronnen:
Merck pag 4-9; NEN3235-6.1.1/KNAG geografisch tijdschrift XVII 1983m bewerkt door P. Otter en H. Kramer
Boden und Bedenuntersuchungen von Reinhard Bochter bewerkt door P. Otter
www.schooltv.nl/beeldbank/clip/20030623_aardgas01
www.schooltv.nl/beeldbank/clip/20030623_aardgas02
www.schooltv.nl/beeldbank/clip/20030623_aardgas03
www.schooltv.nl/beeldbank/clip/20030623_aardgas04
www.vrom.nl/docs/ammoniumnitraat.pdf
www.wereldstudie.nl
Uiteraard is de module met veel zorg tot stand gekomen. De VNCI aanvaardt echter geen aansprakelijkheid voor
schade die eventueel is ontstaan bij het uitvoeren van deze module.
VNCI, Den Haag, maart 2009
________________________________________________________
Trial version converts only first 100000 characters. Evaluation only.
Converted by HTML-to-RTF Pro DLL .Net 3.0.9.1 (build March 27th, 2009).
(Licensed version doesn't display this notice!)
- Get license for the HTML-to-RTF Pro DLL .Net