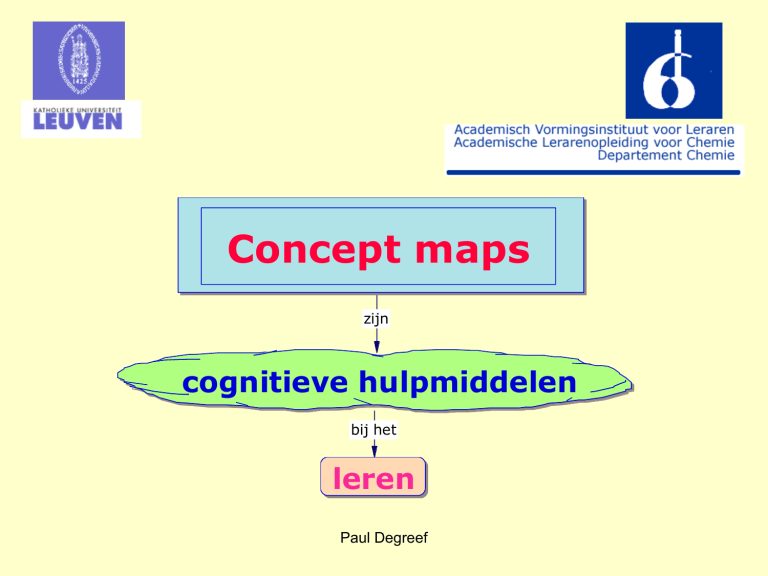
Concept maps
zijn
cognitieve hulpmiddelen
bij het
leren
Paul Degreef
Gebruik van concept maps door
leerkrachten wordt gestimuleerd
door het Europese project
Elise
E-Learning (in) In-Service (teacher training) in Europe
http://filolog.uni.lodz.pl/elise/
en gebracht op het leerplatform
Galatea is an online publication tool developed by
the Faculty of Arts at K.U. Leuven
(Belgium). http://elise.arts.kuleuven.ac.be/elise/
KULeuven
Academische Lerarenopleiding Chemie
2
Europese partners
KULeuven
Academische Lerarenopleiding Chemie
3
1 Wat is een concept?
2 Hoe wordt een concept aangeduid?
3 Hoe kunnen concepten in kaart gebracht
(gevisualiseerd) worden?
4 Welke elementen bevat een ‘bewerkte’
concept map? [Leerkracht georiënteerd referentieschema LGRS]
5 Hoe kan de leraar concept maps gebruiken
als didactisch hulpmiddel?
6 Zelf een concept map maken: opdrachten
7 Enkele interessante adressen
KULeuven
Academische Lerarenopleiding Chemie
4
1 Wat is een concept?
“Een concept (begrip) is een denkinhoud die betrekking
heeft op een verzameling van zaken die bepaalde
kenmerkende eigenschappen gemeenschappelijk
hebben”.
• iets uit onze leefwereld
• iets abstract
• iets ‘echt’
• een gebeurtenis
• ….
KULeuven
Academische Lerarenopleiding Chemie
5
2 Hoe wordt een concept aangeduid?
• met
• een naam
• een symbool
• een teken
• een afbeelding
• een formule
• …..
KULeuven
Academische Lerarenopleiding Chemie
6
3 Hoe kunnen concepten in kaart
gebracht (gevisualiseerd) worden?
• association map
• mind map
• concept map
KULeuven
Academische Lerarenopleiding Chemie
7
3 Hoe kunnen concepten in kaart
gebracht (gevisualiseerd) worden?
• association map
• mind map
• concept map
KULeuven
Academische Lerarenopleiding Chemie
8
3.1 Association map
– visualisering van brainstormingsessie
– centraal thema
• verbonden via pijlen met
• met geassocieerde begrippen er rond
– lijkt op een spinnenweb
– geen verbanden tussen geassocieerde concepten
kerncentrale
radioactiviteit
radioactieve
straling
koeltoren
atoomsplijting
Kernenergie
atoombom
kernafval
uranium
gevaarlijk
H-bom
kernfusie
KULeuven
zon en
sterren
Academische Lerarenopleiding Chemie
9
3 Hoe kunnen concepten in kaart
gebracht (gevisualiseerd) worden?
• association map
• mind map
• concept map
KULeuven
Academische Lerarenopleiding Chemie
10
3.2 Mind map
www.mindjet.com
– gestructureerd overzicht van gedachten
– = association map met concepten in hiërarchische structuur
• bevat concepten en sleutelwoorden
• veel meer informatie
– samenvatting
– concepten verbonden door pijlen
– geen links tussen concepten
KERNSPLIJTING
Kernafval
Gecontroleerd
Kerncentrale
Reactor
Koeltoren
Elektriciteitscentrale
Zware kernen
Ongecontroleerd
Atoombom
Wet van Einstein E = mc²
Energievrijgave
Massaverlies
KERNENERGIE
19/09/2003 - v13
Ongecontroleerd
KERNFUSIE
H-bom
Zon en sterren
Lichte kernen
Wet van Einstein E = mc²
Radioactieve straling
KULeuven
Energievrijgave
Massaverlies
Gevaarlijk
Academische Lerarenopleiding Chemie
11
3 Hoe kunnen concepten in kaart
gebracht (gevisualiseerd) worden?
• association map
• mind map
• concept map
KULeuven
Academische Lerarenopleiding Chemie
12
massaverlies
3.3 Concept map
www.inspiration.com
http://www.inspiration.com/freetrial/index.cfm
http://cmap.coginst.uwf.edu/index.html [free]
zware kernen
van
wet van
Einstein
Kernenergie
komt vrij bij
voorbeeld
volgens de
komt vrij door
nl.
E = mc²
komt vrij bij
van
kernfusie
kernsplijting
in
geeft aanleiding tot
een
lichte kernen
in
zon en
sterren
in Hbom
kettingreactie
verloopt
k =1
van
gecontroleerd
als
verloopt
ongecontroleerd
in
in
kernreactor
atoombom
als
k>1
maakt deel uit
van
koeltoren
maakt deel
uit van
kerncentrale
veroorzaakt
dikke
wanden
tegengehouden
door
radioactieve
straling
KULeuven
produceert
elektriciteit
veroorzaakt
kernafval
Academische Lerarenopleiding Chemie
13
3.3.1 Wat is een concept map?
(Novak & Gowin, 1984)
– gestructureerd en georganiseerd overzicht van kennis
• voorgesteld door een aantal concepten en hun verbanden
– concept geplaatst in venster
lucht
– relaties tussen concepten
• aangeduid met pijlen
• verwoord in link
concept 1
link
concept 2
– meest eenvoudige CM = één propositie:
• bestaat uit 2 concepten
• verbonden door link
• te lezen in richting pijl
KULeuven
lucht
is
Academische Lerarenopleiding Chemie
blauw
14
– Complexe CM =
• vele conceptvensters
• ingebed in rooster van proposities
• dikwijls hiërarchisch gestructureerd
– belangrijkste concepten bovenaan
– minder belangrijke lager
– even belangrijke op gelijke hoogte
• centraal concept
– met vertakkingen: clusters
– cross-links tussen
verschillende clusters mogelijk
– relatie verwoord
cluster
cross-link
KULeuven
Academische Lerarenopleiding Chemie
15
KULeuven
Academische Lerarenopleiding Chemie
16
– CM =
• individueel !
• zeer persoonlijk
• afhankelijk van het gebruik
– Begrip ‘concept map’
• ontwikkeld door Novak
• steunend op cognitieve psychologie
– leren gebeurt door
» assimilatie van nieuwe concepten
» assimilatie van verbanden tussen deze nieuwe
concepten in de bestaande conceptenstructuur van
de lerende
• aansluitend bij het constructivisme
– leren gebeurt door
» constructief het kennisbestand te updaten als
nieuwe kennis aangeboden wordt
– hoe beter kennis gestructureerd is, hoe beter
nieuwe kennis geabsorbeerd wordt
KULeuven
Academische Lerarenopleiding Chemie
17
3.3.2 Wat is concept mapping?
– Concept mapping is het proces
waarbij concepten en
verbanden tussen concepten
worden samengebracht op een
hiërarchische manier, gaande van
meer inclusieve concepten naar
meer specifieke, minder
inclusieve concepten. (Novak &
Gowin, 1984)
– Hiërarchische structuur:
Kernenergie
komt vrij bij
komt vrij bij
kernfusie
kernsplijting
van
zware kernen
• bovenaan: de meer algemene,
meer inclusieve concepten
in
in
• er onder progressief: de meer
specifieke, minder inclusieve kernreactor
atoombom
concepten
van
lichte kernen
in
zon en
sterren
in
in H-bom
niet altijd een strikte vereiste
KULeuven
Academische Lerarenopleiding Chemie
18
VERPLAATSING
VAN HET
CHEMISCH
EVENWICHT
Nog een voorbeeld
hiërarchische structuur
kan door
kan door
concentratieveranderingen
c
door
temperatuurveranderingen
door
door
door
de hoeveelheid stof n
te wijzigen
n
het volume V
te wijzigen
V
met als gevolg dat
bij gassen de druk p te
wijzigen
p
met als gevolg dat
door
warmtetoevoer
(temperatuurverhoging)
met als gevolg dat
warmteafvoer
(temperatuurverlaging)
met als gevolg dat
met als gevolg dat
het evenwicht
verschuift
het evenwicht
verschuift
naar de
naar de kant met
naar de
het evenwicht
verschuift
naar de kant met
naar de kant met
het evenwicht
verschuift
naar de kant met
naar de
andere
kant
als
zelfde
kant
het grootste
aantal
deeltjes
het grootste
aantal
deeltjes
als
als
als
er een
vermeerdering
is
er een
vermindering
is
er een
verlaging
is
er een
verhoging
is
WET VAN LE CHATELIER =
PRINCIPE VAN DE KLEINS TE DWANG
van
van
van
van
Een uitwendige invloed verschuift het evenwicht zodanig
dat hij wordt tegengewerkt door het evenwicht.
het volume
het volume
de druk
de druk
het kleinste
aantal
deeltjes
endotherme
kant
als
er een
vermindering
is
van
van
de concentratie
van één van de
stoffen in een lid
van de
evenwichtsreactie
de concentratie
van één van de
stoffen in een lid
van de
evenwichtsreactie
naar de
het kleinste
aantal
deeltjes
als
er een
vermeerdering
is
het evenwicht
verschuift
exotherme
kant
Het evenwicht is een wringer.
KULeuven
Academische Lerarenopleiding Chemie
19
3.3.3 Hoe wordt een concept map gemaakt?
1. afbakenen van een centraal thema (concept)
2. bepalen van bijhorende concepten
•
•
[voor lagere schoolkinderen] : als een lijst van
gerangschikte (van algemeen naar specifiek)
conceptwoorden
[voor wat oudere leerlingen] : sleutelconcepten uit een
reeks woorden laten kiezen en ze laten rangschikken
van algemeen naar specifiek
3. noteren van de concepten
•
Kernenergie
in een tekstvenster
door tekenprogramma computer
•
Inspiration
www.inspiration.com
•
CMapTools
http://cmap.ihmc.us/
of
• op een zelfklevend blaadje
(post-it …)
KULeuven
Academische Lerarenopleiding Chemie
20
4. plaatsen van de concepten
•
•
op achtergrond (blad papier – magnetisch bord …) geplakt
in ‘nieuw’ document (map) ‘Inspiration’ …
–
–
–
•
makkelijk in te voeren
makkelijk te verschuiven
relatiepijlen kunnen ‘bewerkt’ worden
in hiërarchische structuur
5. opstellen van proposities
•
•
pijlen geven relaties (links) weer tussen concepten
verwoorden en noteren van de relaties
–
–
niet teveel woorden
toch duidelijkheid nodig
6. zoeken naar cross-links tussen concepten in
verschillende clusters
KULeuven
Academische Lerarenopleiding Chemie
21
7. herschrijven (hertekenen) van de concept map
•
de CM kan fouten en gebreken vertonen
kan wanordelijk en rommelig zijn
–
–
–
–
•
sommige te linken concepten bevinden zich aan
tegenovergestelde kanten van de CM
verkeerde links
fouten in hiërarchische ordening
spellingfouten
na herschrijven
–
–
–
–
–
ordelijke (hiërarchische structuur)
geen irrelevante links en concepten meer
betere plaatsing van de concepten
spellingfouten weg
verkeerde links verbeterd
KULeuven
Academische Lerarenopleiding Chemie
22
Enkele vergelijkingspunten tussen
↔
Computer-gebaseerde CM
Gemakkelijker te maken
op papier gemaakte CM
Vrijheid om naar believen
• eender waar
en
• wanneer
te werken
Gemakkelijker te wijzigen
Mooie, verzorgde opbouw
• verschillende vormen tekstvakken
• verschillende kleuren …
Concepten visualiseren met afbeeldingen
Notes plaatsen …
Hyperlinks leggen …
Niet zo mooi, niet zo plezant (?) …
Beperkt door
• beschikbaarheid van het tekenprogramma
• kostprijs programma
• complexiteit van programma
….
KULeuven
Academische Lerarenopleiding Chemie
23
Het opstellen van een CM kan gebeuren
•
•
•
samen met de leerkracht
samen met klasgenoten
individueel
3.3.4 Welke stappen zijn nodig voor de ontwikkeling
van de vereiste vaardigheden om concept maps te
maken ?
Demonstratie van
de constructie van
een concept map
CM maken
KULeuven
Beoordelen en
bespreken van
CM van
anderen
Herbekijken van
CM's in het licht
van de feedback en
de
peer-discussie
Academische Lerarenopleiding Chemie
Activiteiten
veralgemenen leidraad opstellen
voor de constructie
24
3.3.5 Samenvattend
KULeuven
Academische Lerarenopleiding Chemie
25
3.3.6 Theoretische basis voor concept mapping
•
ontwikkeld door Novak
•
bedoeling: betere onderwijsmethodes ontwikkelen om leerlingen te helpen
‘leren leren’
•
gebaseerd op 2 belangrijke ideeën [Ausubel (1968)]
1.
‘nieuw’ leren gebeurt door nieuwe concepten, afgeleide en gerelateerde, te plaatsen in een
bestaand conceptrooster
zinvol leren veronderstelt
2.
•
a.
reorganisatie van bestaande ideeën
b.
integratie van nieuwe informatie met bestaande informatie
cognitieve structuur is hiërarchisch opgebouwd : nieuwe concepten worden ondergebracht
in bredere, inclusievere concepten
betekenis van een concept hangt af van
1.
het aantal relevante links
2.
hiërarchie van die links
•
de hiërarchische plaatsing van concepten in een CM weerspiegelt de hiërarchische opbouw van
kennis in een cognitieve structuur
•
de links tussen de concepten tonen aan hoe nieuwe concepten geïntegreerd zijn in een
bestaande kennisstructuur
KULeuven
Academische Lerarenopleiding Chemie
26
3.3.7 Concept mapping als een leermiddel
I.
concept mapping zorgt voor zinvol leren omdat ze
1.
2.
veronderstelt een diepgaande betekenis te geven aan informatie
•
identificeren van conceptbetekenissen en leggen van relaties tussen
concepten zorgt voor een diepergaande informatieverwerking dan bij
overschrijven, memorisering en herhaling van informatie
•
langdurige opslag in het geheugen, gemak om zich iets te herinneren en
de mogelijkheid om kennis toe te passen in nieuwe situaties worden
bevorderd
zorgt voor constructivisme bij de lerende:
•
3.
concepten krijgen betekenis door nieuwe te linken aan eerdere concepten
en dan de concepten hiërarchisch te plaatsen om een geïntegreerd,
coherent netwerk te maken van het geleerde.
helpt bij het opdelen van kennis in zinvolle delen
•
betere kennisorganisatie in het geheugen
•
gemakkelijker herinnering van geleerde
•
verhoging van geheugencapaciteit
•
efficiëntere oplossing van problemen
KULeuven
Academische Lerarenopleiding Chemie
27
4.
de lerende afwisselend informatie doet verwerken
van ‘onder naar boven’ (concepten herkenen en links leggen)
en van ‘boven naar onder’ (algemeen schema herkennen)
5.
de lerende laat beseffen dat leren een individueel iets is.
Concept mapping zorgt dat de lerende meer moeite en tijd besteed om diep na
te denken en niet-duidelijke ideeën of opvattingen over het studiemateriaal
uitklaart: didactisch analytisch en synthetiserend denken is nodig
II.
Het product, de concept map, kan gebruikt worden als een
1.
zeer verfijnd middel om studenten te motiveren kennis systematisch te
organiseren
2.
referentieschema om een tekst beter te begrijpen
3.
hulpmiddel bij het memoriseren
4.
•
het vergemakkelijkt het heroproepen van informatie door de visuele
voorstelling van de hele map
•
nochtans mag de CM niet als dusdanig van buiten geleerd worden !!
middel voor cognitieve evaluatie
•
ze geven goed de persoonlijke betekenis van een concept weer
•
misconcepties worden makkelijk opgespoord
•
geven de leraar én de leerling een idee over de kennis van de lerende
KULeuven
Academische Lerarenopleiding Chemie
28
• A scientist must organize. One makes a science with
facts in the same way one makes a house with stones;
but an accumulation of facts is no more a science than a
pile of stones is a house.
Henri Poincare
• Een wetenschapper moet verbanden leggen. Men doet
aan wetenschappen met feitenmateriaal op dezelfde
manier als men een huis bouwt met stenen.
Maar een opeenstapeling van feiten is net zo min
‘wetenschap’ als een stapel stenen een huis zou zijn!
Henri Poincare
KULeuven
Academische Lerarenopleiding Chemie
29
1 Wat is een concept?
2 Hoe wordt een concept aangeduid?
3 Hoe kunnen concepten in kaart gebracht
(gevisualiseerd) worden?
4 Welke elementen bevat een ‘bewerkte’
concept map? [Leerkracht georiënteerd referentieschema LGRS]
5 Hoe kan de leraar concept maps gebruiken
als didactisch hulpmiddel?
6 Zelf een concept map maken: opdrachten
7 Enkele interessante adressen
KULeuven
Academische Lerarenopleiding Chemie
30
4 Welke elementen bevat een ‘bewerkte’
concept map? [Leerkracht georiënteerd referentieschema LGRS]
• verschillende proposities, bestaande uit concepten en links,
geplaatst in een logisch opgebouwd referentiekader
• eventueel verschillende clusters van proposities
•doelgerichte visualisatie-elementen op verschillende vlakken
• fenomenologisch : afbeelding, illustratie van verschijnsel
• conceptueel : symbolische voorstellingen (formules, reacties …)
corpusculaire voorstellingen van deeltjes
• contextueel : historisch, maatschappelijk, toepassingen
• gekoppeld aan
• concept
of aan
• mogelijke, bij een concept geplaatste, verklarende ‘notes’ met
• tekst, figuren, formules, tabellen, foto’s …. (statisch)
• hyperlink naar videofragment (dynamisch), geluidsfragment,
andere CM’s …
KULeuven
Academische Lerarenopleiding Chemie
31
KULeuven
Academische Lerarenopleiding Chemie
32
Verbrandingsdriehoek: uitgewerkte CM met
visualisering in ‘notes’ en met ‘hyperlinks’
licht
vuur
ontstekingstemperatuur
activeringsenergie
vlammen
warmte
wrijving
ontstaan
van nieuwe
stoffen
koolstofbevattende
brandstoffen
chemische reactie
met
indien voldoende
zuurstof
volledige
verbranding
CO2 + H2O
zuurstof
bij een klein tekort
aan zuurstof
bij een groot tekort
aan zuurstof
onvolledige
verbranding
zeer slechte
verbranding
KULeuven
Academische Lerarenopleiding Chemie
CO + H 2O
C + H 2O
33
Gebruik van ‘note’ : tekst en fenomenologische visualisering met afbeelding
ontstekings-temperatuur
vuur
is een mogelijkheid om een mengsel
van brandstof en zuurstof te
activeren
licht
vuur
activeringsenergie
ontstekingstemperatuur
vlammen
warmte
wrijving
ontstaan
van nieuwe
stoffen
koolstofbevattende
brandstoffen
chemische reactie
met
indien voldoende
zuurstof
volledige
verbranding
CO2 + H 2O
zuurstof
bij een klein tekort
aan zuurstof
bij een groot tekort
aan zuurstof
onvolledige
verbranding
zeer slechte
verbranding
KULeuven
Academische Lerarenopleiding Chemie
CO + H 2O
C + H 2O
34
Gebruik van ‘note’ : visualisering
• diatomic gas
•
Stored in a gas container
fenomenologisch
O2
• air contains 20%
oxygen, 79%
nitrogen and 1%
other gases
discovered by
Joseph PRIESTLY
(1733-1804)
• essential reactant
for combustion
conceptueel
KULeuven
contextueel:
historisch
Academische Lerarenopleiding Chemie
35
Gebruik van ‘hyperlink’ : fenomenologisch, conceptueel en contextueel
FUELS
petrol
methane
CH4
C8H18
wood
(C6H10O5)n
Stearic acid
KULeuven
coal
C17H35-COOH
Academische Lerarenopleiding Chemie
36
Gebruik van ‘hyperlink’ naar andere CM: fenomenologisch, conceptueel en
contextueel
die aangezogen
worden door een
H2 O
dat reageert met
tot
CO 2
dat zorgt voor de
condensat ie van het
verbrandingsproduct
wit
kopersulfaatanhydraat
ijswat er
blauw
kopersulfaatpentahydraat
tot
een
CaCO3-
kalkwat er
neerslag
met
en geleid worden
door
dat zorgt voor het
binden van het
verbrandingsproduct
met
met
die afgefiltreerd
wordt doorheen een
een erlenmeyer
in
erlenmeyer
een beker
filter
en dan door een
tweede
en dan gewogen op
een
een omgekeerde
trechter
naar waterstraalpomp
ijsbad
die opgevangen
worden door
CO 2 en
H2 O
weegschaal
blauw k opersulfaatpentahydraat
brandende kaars
produceert
CuSO4.5H 2O
kalkwater Ca(OH) 2
met witte troebel van CaCO3
namelijk
verbrandingsproduct en
KULeuven
Academische Lerarenopleiding Chemie
37
Gebruik van ‘hyperlink’ naar film: fenomenologisch, conceptueel en contextueel
ontstekingstemperatuur
reageren bij een
2 C2H2 + 5 O2
4 CO2 + 2 H2O + a kJ
brandstof
en
zuurstof
volledige verbranding van acetyleen
zoals in het
voorbeeld
bij onvoldoende
reageren in een
helder
kalkwater
Ca(OH)2
aan te tonen met
reageert met
koolstofdioxide
CO2
reageren in een
volledige
verbranding
tot
tot
bij onvoldoende
reageren in een
onvolledige
verbranding
of
slechte
verbranding
tot
onder vrijgave van
troebel
kalkwater
CaCO3
water
H 2O
aan te tonen met
blauw
kobaltchloridepapier
CoCl2
bij voldoende
onder vrijgave van
onder de vorm
van
tot
aan te tonen
met
onder de vorm
van
reageert met
onder de vorm
van
licht
ook tot
koolstofmonoxide
CO
energie
reageert met
rood
kobaltchloridepapier
CoCl2.6H2O
ook tot
oranje
PdCl2.2H2Okristallen
beweging
roet
C
tot
donkergrijs
Palladium
warmte
waar te nemen als
zwarte, in de
lucht
dwarrelende
roetslierten
zoals in het
voorbeeld
zoals in de
voorbeelden
2 C2H2 + O2
4 C + 2 H2O + d kJ
slechte verbranding van acetyleen
C2H2 + 2 O2
2 C2H2 + 3 O2
CO 2 + CO + H2O + b kJ
4 CO + 2 H2O + c kJ
onvolledige verbranding van acetyleen
KULeuven
Academische Lerarenopleiding Chemie
38
1 Wat is een concept?
2 Hoe wordt een concept aangeduid?
3 Hoe kunnen concepten in kaart gebracht
(gevisualiseerd) worden?
4 Welke elementen bevat een ‘bewerkte’
concept map? [Leerkracht georiënteerd referentieschema LGRS]
5 Hoe kan de leraar concept maps gebruiken
als didactisch hulpmiddel?
6 Zelf een concept map maken: opdrachten
7 Enkele interessante adressen
KULeuven
Academische Lerarenopleiding Chemie
39
5 Hoe kan de leraar concept maps
gebruiken als didactisch hulpmiddel?
Voor het onderwijsklaar maken en didactische vormgeving
conceptkaarten als hulpmiddel
ten behoeve van :
op te sporen, te analyseren, samen te vatten :
voorbeeldreeks nr.
ontwerpers van curricula en
leerplannen
curriculumopbouw, leerplandoelstellingen en inhouden
1
ontwerpers van didactische
materialen
handboeken, werkboeken, audiovisuele materialen,
ICT-toepassingen, demonstratiemiddelen, practica,
projectscenario's, enz. ...
2
vakleraren ,
vakgroepverantwoordelijken ,
pedagogische begeleiders ,
lerarenopleiders en
-nascholers
jaarplannen, leertrajecten en lesmethodieken, per
gewest , scholengemeenschap of vakgroep of
individuele vakleraar
3
wetenschappelijke achtergronden en data voor het
onderwijsklaar maken van een nieuw leerstofgebied
4
”
KULeuven
Academische Lerarenopleiding Chemie
40
conceptkaarten als hulpmiddel
ten behoeve van :
op te sporen, te analyseren, samen te vatten :
voorbeeldreeks nr.
”
specifieke concepten situeren en in verband brengen
met een ruimer wetenschappelijk en didactisch
referentiekader
5
“
bestaande of vermoedelijke meningen, woord betekenissen ,
préconcepten , misconcepten
bij de leerlingen
6
“
inventaris en selectie van leermethoden, werkvormen
, didactisch materiaal , visualiseringstechnieken ,
laboratoriummateriaal enz....
7
“
inventarisatie en ontwikkeling van krachtige
leeromgevingen voor domeinspecifieke thema's uit
het leervak , zoals b.v. leerstations,
geprogrammeerde instructies, projectpractica enz. ...
8
leerlingen
9
KULeuven
Academische Lerarenopleiding Chemie
41
5.1 Curriculumopbouw, leerplandoelstellingen,
leerinhouden
Verbranding
algemene
formule
bepaald
door
massaverhoudingen
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
aantalverhoudingen
als gevolg van
hangt af van de
aantal mol
tweede leerjaar '9'
uitgedrukt in
stofhoeveelheden
Stofklassen
karakteristieke
atoomgroepen
gekenmerkt door
met een
hebben een
welbepaalde
wordt bepaald door
de
Chemische
reacties
bepalen de aard van
de mogelijke
Chemische
eigenschappen
bepalen de
met een welbepaald
op te delen in een
aantal verschillende
berekend met
behulp van
molmassa
in welbepaalde
tussen
molaire
concentratie
gekenmerkt door
een bepaalde
stoffen
onderscheid
naamgeving
oplossing
oxidatiegetal
in
in
en in
anorganische
met als
onderverdeling
bvb. opgelost in
uit
alcoholen
met
bij
water
bvb.
en met de
begrippen
als
oplosmiddel
omdat ze in water
sterke
genoemd
elektrolyten
zwakke
zonder
oxidatie en
reductie
elektronenoverdracht
azijnzuur
genoemd
zonder
verbranding
bvb.
veel ionen
vormen
van o.a.
tussen
ethanol
atomen
alkaanzuren
in
aardolie
tussen de
hydroxiden
concentratie
elektronenoverdracht
van de
alkanen
met een bepaalde
vormen een
met
organische
met o.a.
oxiden
reactiesoorten
verandering
uitgedrukt als
genoemd
zuren
omdat ze in water
genoemd
met
neerslagvorming
ionoforen
ionogenen
als ze in hun
kristalstructuur
reeds
als hun moleculaire
structuur door
interactie met water
ionen
dragen
ionen
vormt
weinig ionen
vormen
zouten
met vorming van
met
met
gasvorming
neutralisatie
tussen zuren en
basen
Concepten i.v.m. ‘verbranding’ in het rood
KULeuven
Academische Lerarenopleiding Chemie
42
2 grote gebieden in leerstof
• stofklassen
• chemische reacties
Verbranding
algemene
formule
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
Stofklassen
hangt af van de
tweede leerjaar '1'
gekenmerkt door
hebben een
welbepaalde
karakteristieke
atoomgroepen
bepalen de
Chemische
eigenschappen
bepalen de aard van
de mogelijke
Chemische
reacties
tussen
stoffen
wordt bepaald door
de
naamgeving
KULeuven
Academische Lerarenopleiding Chemie
43
Onderscheid tussen
• anorganische en organische stoffen
• reacties zonder en met elektronenoverdracht
Verbranding
algemene
formule
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
stofhoeveelheden
hangt af van de
tweede leerjaar '2'
in welbepaalde
Stofklassen
karakteristieke
atoomgroepen
gekenmerkt door
bepalen de
Chemische
eigenschappen
Chemische
reacties
bepalen de aard van
de mogelijke
met een
hebben een
welbepaalde
tussen
stoffen
op te delen in een
aantal verschillende
wordt bepaald door
de
onderscheid
reactiesoorten
naamgeving
in
anorganische
en in
organische
met
elektronenoverdracht
KULeuven
Academische Lerarenopleiding Chemie
zonder
elektronenoverdracht
44
Onderscheid in anorganische stoffen tussen
• oxiden, hydroxiden, zuren en zouten
Verbranding
algemene
formule
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
hangt af van de
tweede leerjaar '3'
Stofklassen
gekenmerkt door
met een
hebben een
welbepaalde
karakteristieke
atoomgroepen
bepalen de
Chemische
eigenschappen
stofhoeveelheden
Chemische
reacties
bepalen de aard van
de mogelijke
op te delen in een
aantal verschillende
wordt bepaald door
de
in welbepaalde
tussen
stoffen
onderscheid
in
anorganische
naamgeving
reactiesoorten
en in
organische
met als
onderverdeling
met
oxiden
zonder
hydroxiden
elektronenoverdracht
elektronenoverdracht
zuren
zouten
KULeuven
Academische Lerarenopleiding Chemie
45
Onderscheid in organische stoffen tussen
• alkanen, alcoholen en carbonzuren
Verbranding
algemene
formule
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
hangt af van de
tweede leerjaar '4'
stofhoeveelheden
Stofklassen
karakteristieke
atoomgroepen
gekenmerkt door
met een
hebben een
welbepaalde
bepalen de
Chemische
eigenschappen
Chemische
reacties
bepalen de aard van
de mogelijke
op te delen in een
aantal verschillende
wordt bepaald door
de
in welbepaalde
tussen
stoffen
onderscheid
in
naamgeving
reactiesoorten
en in
anorganische
met als
onderverdeling
organische
met o.a.
oxiden
hydroxiden
alkanen
uit
alcoholen
bvb.
met
aardolie
ethanol
elektronenoverdracht
alkaanzuren
bvb.
zonder
elektronenoverdracht
azijnzuur
zuren
zouten
KULeuven
Academische Lerarenopleiding Chemie
46
Stoechiometrische aspecten : reacties in welbepaalde
massaverhoudingen, als gevolg van deeltjesverhoudingen;
massa uitgedrukt in molhoeveelheden:
Verbranding
massaverhoudingen
Aanknopingspunten in het
leerprogramma?
als gevolg van
tweede leerjaar '5'
stofhoeveelheden
algemene
formule
worden voorgesteld
door een bepaalde
Stofklassen
hangt af van de
karakteristieke
atoomgroepen
gekenmerkt door
met een
hebben een
welbepaalde
bepalen de
Chemische
eigenschappen
bepaald
door
aantalverhoudingen
aantal mol
uitgedrukt in
Chemische
reacties
bepalen de aard van
de mogelijke
op te delen in een
aantal verschillende
wordt bepaald door
de
berekend met
behulp van
molmassa
in welbepaalde
tussen
gekenmerkt door
een bepaalde
stoffen
onderscheid
in
naamgeving
reactiesoorten
en in
anorganische
met als
onderverdeling
organische
met o.a.
oxiden
hydroxiden
alkanen
uit
alcoholen
bvb.
aardolie
met
ethanol
elektronenoverdracht
alkaanzuren
bvb.
zonder
elektronenoverdracht
azijnzuur
zuren
zouten
KULeuven
Academische Lerarenopleiding Chemie
47
Stoffen opgelost in water met een bepaalde molaire concentratie
Verbranding
algemene
formule
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
karakteristieke
atoomgroepen
gekenmerkt door
met een
hebben een
welbepaalde
bepalen de
Chemische
eigenschappen
aantalverhoudingen
als gevolg van
hangt af van de
aantal mol
uitgedrukt in
tweede leerjaar '6'
Stofklassen
bepaald
door
massaverhoudingen
stofhoeveelheden
Chemische
reacties
bepalen de aard van
de mogelijke
op te delen in een
aantal verschillende
wordt bepaald door
de
berekend met
behulp van
molmassa
in welbepaalde
tussen
molaire
concentratie
gekenmerkt door
een bepaalde
stoffen
onderscheid
in
reactiesoorten
en in
anorganische
met als
onderverdeling
oplossing
naamgeving
bvb. opgelost in
concentratie
elektronenoverdracht
alkanen
uit
met
in
water
alcoholen
bvb.
als
aardolie
tussen
zonder
hydroxiden
met een bepaalde
organische
met o.a.
oxiden
vormen een
uitgedrukt als
ethanol
oplosmiddel
van o.a.
elektrolyten
zonder
alkaanzuren
bvb.
azijnzuur
elektronenoverdracht
zuren
zouten
KULeuven
Academische Lerarenopleiding Chemie
48
Elektrolyten
onderscheid in
• zwakke en sterke
• ionoforen en ionogenen
Verbranding
algemene
formule
bepaald
door
massaverhoudingen
aantalverhoudingen
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
als gevolg van
hangt af van de
aantal mol
tweede leerjaar '7'
uitgedrukt in
stofhoeveelheden
Stofklassen
karakteristieke
atoomgroepen
gekenmerkt door
met een
hebben een
welbepaalde
bepalen de
Chemische
eigenschappen
Chemische
reacties
bepalen de aard van
de mogelijke
op te delen in een
aantal verschillende
wordt bepaald door
de
berekend met
behulp van
molmassa
in welbepaalde
tussen
molaire
concentratie
gekenmerkt door
een bepaalde
stoffen
onderscheid
in
reactiesoorten
en in
anorganische
met als
onderverdeling
oplossing
naamgeving
bvb. opgelost in
met een bepaalde
vormen een
concentratie
organische
elektronenoverdracht
met o.a.
oxiden
uitgedrukt als
alkanen
uit
met
in
water
als
oplosmiddel
aardolie
veel ionen
vormen
omdat ze in water
van o.a.
tussen
sterke
hydroxiden
alcoholen
bvb.
genoemd
ethanol
elektrolyten
genoemd
zonder
zwakke
zonder
alkaanzuren
bvb.
azijnzuur
elektronenoverdracht
genoemd
zuren
omdat ze in water
genoemd
ionoforen
ionogenen
als ze in hun
kristalstructuur
reeds
als hun moleculaire
structuur door
interactie met water
ionen
dragen
ionen
vormt
weinig ionen
vormen
zouten
KULeuven
Academische Lerarenopleiding Chemie
49
Reacties tussen elektrolyten zonder elektronenoverdracht
onderscheid in
• neerslagreacties
• gasontwikkelingreacties
• neutralisatiereacties
Verbranding
bepaald
door
massaverhoudingen
algemene
formule
aantalverhoudingen
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
als gevolg van
hangt af van de
aantal mol
tweede leerjaar '8'
uitgedrukt in
stofhoeveelheden
Stofklassen
karakteristieke
atoomgroepen
gekenmerkt door
met een
hebben een
welbepaalde
bepalen de
Chemische
eigenschappen
Chemische
reacties
bepalen de aard van
de mogelijke
op te delen in een
aantal verschillende
wordt bepaald door
de
berekend met
behulp van
molmassa
in welbepaalde
tussen
molaire
concentratie
gekenmerkt door
een bepaalde
stoffen
onderscheid
in
reactiesoorten
en in
anorganische
met als
onderverdeling
oplossing
naamgeving
concentratie
organische
elektronenoverdracht
met o.a.
oxiden
met een bepaalde
vormen een
bvb. opgelost in
uitgedrukt als
alkanen
uit
in
met
oplosmiddel
als
water
aardolie
veel ionen
vormen
omdat ze in water
van o.a.
tussen
sterke
hydroxiden
alcoholen
bvb.
genoemd
ethanol
elektrolyten
genoemd
zonder
zwakke
zonder
alkaanzuren
bvb.
azijnzuur
elektronenoverdracht
genoemd
zuren
omdat ze in water
genoemd
met
neerslagvorming
ionoforen
ionogenen
als ze in hun
kristalstructuur
reeds
als hun moleculaire
structuur door
interactie met water
ionen
dragen
ionen
vormt
weinig ionen
vormen
zouten
met
met
KULeuven
gasvorming
neutralisatie
tussen zuren en
basen
Academische Lerarenopleiding Chemie
50
Reacties met elektronenoverdracht
onderscheid in
• oxidatie- en reductiereacties
• veranderingen in oxidatiegetallen
• verband met verbrandingsreacties en hun producten
Verbranding
algemene
formule
bepaald
door
massaverhoudingen
Aanknopingspunten in het
leerprogramma?
worden voorgesteld
door een bepaalde
aantalverhoudingen
als gevolg van
hangt af van de
aantal mol
tweede leerjaar '9'
uitgedrukt in
stofhoeveelheden
Stofklassen
karakteristieke
atoomgroepen
gekenmerkt door
met een
hebben een
welbepaalde
wordt bepaald door
de
Chemische
eigenschappen
bepalen de
Chemische
reacties
bepalen de aard van
de mogelijke
met een welbepaald
op te delen in een
aantal verschillende
berekend met
behulp van
molmassa
in welbepaalde
tussen
molaire
concentratie
gekenmerkt door
een bepaalde
stoffen
onderscheid
naamgeving
oplossing
oxidatiegetal
in
in
en in
anorganische
met als
onderverdeling
bvb. opgelost in
verandering
uit
hydroxiden
met
bij
water
bvb.
en met de
begrippen
als
oplosmiddel
omdat ze in water
sterke
genoemd
elektrolyten
zwakke
zonder
oxidatie en
reductie
elektronenoverdracht
azijnzuur
genoemd
zonder
verbranding
bvb.
veel ionen
vormen
van o.a.
tussen
ethanol
atomen
alkaanzuren
in
aardolie
tussen de
alcoholen
met een bepaalde
vormen een
concentratie
elektronenoverdracht
van de
alkanen
uitgedrukt als
met
organische
met o.a.
oxiden
reactiesoorten
genoemd
zuren
omdat ze in water
genoemd
met
neerslagvorming
ionoforen
ionogenen
als ze in hun
kristalstructuur
reeds
als hun moleculaire
structuur door
interactie met water
ionen
dragen
ionen
vormt
weinig ionen
vormen
zouten
met vorming van
met
met
KULeuven
gasvorming
neutralisatie
tussen zuren en
basen
Academische Lerarenopleiding Chemie
51
5.2 Ontwerpen
van didactische
materialen
Welk materiaal moet
ontwikkeld worden door
uitgevers … voor een
cursusontwerp?
• handleiding
• handboek
• conceptueel
• contextueel
• opdrachten
• evaluaties
•…
KULeuven
Academische Lerarenopleiding Chemie
52
5.3 Jaarplanning, leertrajecten en lesmethodieken
KULeuven
Academische Lerarenopleiding Chemie
53
Mogelijkheden
• Overzicht leerstofverdeling
• Gebruik van kleuren:
–
–
–
–
groen: anorganische verbindingsklassen
blauw: organische verbindingsklassen
grijs: water en waterige oplossingen
roze: gedrag in water en reacties zonder overdracht van
elektronen
– paars: redoxreacties
• Test: donkerblauwe balk
• In ‘note’:
– geplande en effectieve lesdatum
– aantekeningen over
•
•
•
•
•
•
•
leerstofpunten
specifieke situaties
leerproblemen
tips voor demonstratie-experimenten
klaar te zetten labomateriaal
hyperlinks naar MSWord … met toetsen, practicumopdrachten …
…
KULeuven
Academische Lerarenopleiding Chemie
54
KULeuven
Academische Lerarenopleiding Chemie
55
5.4 Nieuw leerstofgebied
onderwijsklaar maken
• Concept map
biedt overzicht
structuur nieuw
leerstofgebied
KULeuven
Academische Lerarenopleiding Chemie
56
• ‘Notes’ bevatten
definities van
concepten.
KULeuven
Academische Lerarenopleiding Chemie
57
• De verschillende
isomeriesoorten
worden voorgesteld
met 3Dmolecuulmodellen.
• Klikken op de
naam volstaat om
met ChimePro een
dynamisch beeld van
de molecule te
starten.
• In een ‘note’ achter
het model staat de
formule geschreven.
Een ‘vertaling’ van
model naar
schrijfwijze formule
kan door de lerende
zelf geëvalueerd
worden.
KULeuven
Academische Lerarenopleiding Chemie
58
Omgekeerd
•De verschillende
isomeriesoorten worden
voorgesteld met
formules.
• Klikken op de naam
volstaat om met
ChimePro een dynamisch
beeld van de molecule te
starten.
• In een ‘note’ achter het
model staat het
moleculemodel
geschreven.
Een ‘vertaling’ van
formule naar voorstelling
model kan door de
lerende zelf geëvalueerd
worden.
KULeuven
Academische Lerarenopleiding Chemie
59
5.5 Specifieke concepten plaatsen
en in verband brengen
in een ruimer kader
KULeuven
Academische Lerarenopleiding Chemie
60
5.6 Meningen, woordbetekenissen,
pre- en misconcepties
bij leerlingen
• Een concept map rond het
centrale thema ‘zuurstof’
werd door een leerling
opgesteld.
• Een leraar onderzoekt deze
map.
• Met o.a. een kleurencode
(bvb. rood) kan makkelijk
aangeduid worden waar een
verkeerd concept in dit
referentieschema geplaatst
werd.
• Zo kan in ‘Inspiration’ een
CM gemakkelijk ‘bewerkt’
worden.
KULeuven
Academische Lerarenopleiding Chemie
61
* Aan leerlingen van het 5de leerjaar van een basisschool
in Vlaanderen werd in maart 2003 gevraagd om een
'ideeënmap' rond verbranding op te bouwen.
Hieronder staan een drietal werkstukken, die eigenlijk
'association maps' zijn.
Naast de klassieke concepten rond verbranding (rook, vuur,
brandweer, warmte, zwart ...) hebben deze leerlingen zich
blijkbaar ook laten leiden door wereldschokkende
gebeurtenissen zoals 'Enschede' en de aanslag op de 'WTCtorens'.
Opvallend is dat bij deze leerlingen toch ook al een aantal
wetenschappelijke concepten leeft. Een aantal onder hen
gebruikt zelfs al chemische formules!
Een leerkracht kan op zulk een map ook vrij makkelijk
juiste en verkeerde concepten detecteren.
KULeuven
Academische Lerarenopleiding Chemie
62
In deze eerste map kan men
merken dat 'Stephanie' het
begrip CO-vergiftiging goed
associeert met een brandende
kachel.
KULeuven
Academische Lerarenopleiding Chemie
63
Uit de map van Wouter blijkt dat deze
leerling verkeerdelijk denkt aan
koolstofdioxide-vergiftiging.
KULeuven
Academische Lerarenopleiding Chemie
64
• Als leraar kan men zich bij de analyse van een concept map naar
woordbetekenissen, pre- en misconcepten trachten een beeld te vormen
van de ‘kennis’ van de leerling.
• Hieronder staan enkele vragen ter illustratie.
Opdrachten
• Hoe zou 'Stephanie' , nochtans pas leerling van een 5de leerjaar lager
onderwijs, reeds kennis gemaakt hebben met het toch wel chemisch
gegeven CO ?
• Wouter heeft het over CO2 -vergiftiging. Geef een verklaring voor het feit
dat hij het concept CO2 , weer als tiener, reeds gebruikt alhoewel hij nog
niet in contact gekomen is met 'chemie'.
Hoe zou het komen dat hij de index '2' als een superscript schrijft?
* In de volgende map van Céline kan je zelf op zoek gaan naar een
misconceptie!
KULeuven
Academische Lerarenopleiding Chemie
65
KULeuven
Academische Lerarenopleiding Chemie
66
5.7 Leermethoden,
visualiseringstechnieken,
didactisch materiaal,
labomateriaal, werkvormen
• Een concept map met een
cluster ‘onderwijsmethoden’
en een cluster
‘onderwijsmiddelen’ rond het
centrale thema ‘verbranding’.
• In ‘notes’ achter de concepten
kan een leraar een concrete
invulling en opsomming
geven van zijn methoden en
nodige hulpmiddelen voor het
betreffend thema: bvb. nodige
chemicaliën, te gebruiken
transparanten …
• Deze algemene CM kan
gebruikt en aangepast worden
voor ieder lesthema
KULeuven
Academische Lerarenopleiding Chemie
67
Deze CM geeft een
visuele voorstelling van
de experimentele
opstelling nodig voor
een
kwalitatief onderzoek
van de verbranding van
een kaars. De
labobenodigdheden
(equipment) worden als
concepten aangeduid
met een rode rechthoek.
De andere concepten en
de proposities
beschrijven en
visualiseren de
gebeurtenissen bij de
verbranding en bij de
analyse.
Een link vanuit de
algemene CM naar deze
concrete CM is mogelijk.
KULeuven
Academische Lerarenopleiding Chemie
68
De onderstaande meer
uitgebreide
CM visualiseert de
opstelling bij een
kwantitatief onderzoek
van de verbranding van
een kaars. Vergelijking
van de twee CM's laat
zien dat de CaCO3 neerslag wordt
afgefiltreerd en
gewogen. Deze massa
kan gebruikt worden om
via stoechiometrische
berekeningen de
hoeveelheid
stearinezuur, die als
kaarsvet verbrand is, te
berekenen.
KULeuven
Academische Lerarenopleiding Chemie
69
5.8 Krachtige leeromgevingen :
leerstations, geprogrammeerde
instructie, projectpractica …
• Het doorlopen van een aantal
leerstations i.v.m. een bepaald
onderwerp bvb. ‘Metalen kunnen
branden’ creëert een krachtige
leeromgeving.
• De verschillende leerstations
kunnen goed weergegeven worden
op een CM. Met een kleurencode kan
de differentiatie tussen de stations
aangeduid worden:
• blauw: essentie:
herhaling en nieuwe
voorbeelden
• roze: omstandigheden
nieuw te leren aspecten
• geel: gebruik in het
dagelijks leven
• Achter ieder ‘station’concept kan
verdere info in een note geplaatst
worden.
KULeuven
Academische Lerarenopleiding Chemie
70
• Een onvolledige CM
kan in ‘Inspiration’
ook als een krachtige
leeromgeving
gebruikt worden.
• Concepten en links
kunnen gesleept en
neergezet worden
om een gekozen
plaats.
•Een hyperlink naar
een juist ingevulde
CM laat zelfevaluatie
toe.
KULeuven
Academische Lerarenopleiding Chemie
71
KULeuven
Academische Lerarenopleiding Chemie
72
5.9 Gebruik in de klas
• Door de leerlingen
• analyse van tekst
• zelfstandig samenvatting hoofdstuk maken
• gekregen concepten in een CM plaatsen
• CM verder invullen met te zoeken of gegeven concepten en links (zie
5.8)
• ….
• Mogelijkheden tot co- en peerassessment
• De leraar kan
• een lesopbouw schematisch en progressief in een CM laten groeien
tijdens de lesevolutie
• een CM aanbieden als samenvatting na de les
• de strategie van probleemoplossend denken bij een vraagstuk met
behulp van een CM ontwikkelen
•…
KULeuven
Academische Lerarenopleiding Chemie
73
Daniëll-cel
Zn2+ ionen
Deze CM kan na de
instructiefase gegeven
worden.
Cu
tot
Oxidatie
elektronen
A- O
Anode
tot
doorheen
er gebeurt
Kathode
K-R
is
er gebeurt
Reductie
naar
van hier stromen
is
metaalbrug =
elektronenbrug
- pool
De opbouw van de cel uit 2
halfcellen kan als centraal
concept geplaatst worden
naar analogie met de laboopstelling in het demoexperiment.
De verschillende begrippen
en gebeurtenissen aan
iedere halfcel kunnen
parallel links en rechts
ontwikkeld worden in de
CM.
In de cluster beneden
wordt dan de bronspanning
van de volledige cel
bekeken.
KULeuven
ondergaat
+ pool
ondergaat
fungeert als
reductor
is
fungeert als
Zn-plaatje
bevat
Zn2+/Znhalfcel
E0 = - 0,63 V
oxidator
bevat een
bevat
Zn2+ -ionen
naar
heeft een
normpotentiaal
ondergaat
Cu-plaatje
bevat een
SO 42- - ionen
ondergaan
SO 42- -ionen
lopen door
lopen door
bevat
Cu2+/Cuhalfcel
zijn
bevat
Cu2+ -ionen
naar
elektrolytbrug
= ionenbrug
Zn/Zn2+//Cu2+/Cu-cel
reactievergelijking:
Zn + Cu2+ ---> Zn2+ + Cu
heeft een
normpotentiaal
E0 = + 0,47 V
heeft een
bronspanning
= Ub
=
E0st. ox - E0st. red =
+ 0,47 V - (-0,63 V)
= 1,10 V
Academische Lerarenopleiding Chemie
74
Vraagstuk
waspoeder
Deze CM’s kunnen
gebruikt worden om
stap per stap het
vraagstuk te
analyseren en op te
lossen.
Vooral de visuele
voorstelling van de
verschillende
experimentele
stappen en de daarbij
horende kwantitatieve
aspecten kunnen in
een CM goed
weergegeven worden.
Een CM met
oplossingsstrategie
kan voor of na het
oplossen aangeboden
worden.
KULeuven
12,00 g
waspoeder
12,00 g waspoeder wordt opgelost in 250,0 ml water.
Aan 50,0 ml hiervan voegt men een overmaat KI toe.
De oplossing wordt aangezuurd met azijnzuur.
Bij een titratie met Na2S2O3 (c = 0,0510 mol/l)
wordt 16,2 ml verbruikt.
Bereken het massaprocent actieve Cl2 in dit
waspoeder!
Academische Lerarenopleiding Chemie
75
12,00 g waspoeder wordt opgelost in 250,0 ml water. Aan
50,0 ml hiervan voegt men een overmaat KI toe. De
oplossing wordt aangezuurd met azijnzuur.
Bij een titratie met Na2S2O3 (c = 0,0510 mol/l) wordt
Gegevens vraagstuk
0
16,2 ml verbruikt.
Bereken het massaprocent actieve Cl2 in dit waspoeder!
10
20
30
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
250,0 ml
waterige
oplossing van
12,00 g
waspoeder
tot
50,0 ml
KULeuven
de te titreren
oplossing
Academische Lerarenopleiding Chemie
76
0
Vraagstelling
vraagstuk
10
20
30
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
tot
50,0 ml
250,0 ml
waterige
oplossing van
12,00 g
waspoeder
de te titreren
oplossing
Bereken het
massaprocent
actieve Cl2 in
dit waspoeder!
KULeuven
Academische Lerarenopleiding Chemie
77
het vrijgezet I2
reageert met het
Na2S2O 3 volgens
aantal mol
Cl 2 in de 50,0
oplossingsstrategie
ml oplossing
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
0
----> 2 NaI + Na2S4O6
10
zetten evenveel mol
I2 vrij
alle Cl2 uit het
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
reageren met
20
tweemaal
zoveel mol
Na2S 2O 3
aantal mol I2
kunnen berekend
worden uit het
aantal mol
toegevoegd
Na2S2O 3
30
16,2 ml
Na2S2O 3
c = 0,0510 mol/l
40
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
dit aantal mol moet eerst
berekend worden... en dan
omgekeerde weg !!!
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
Bereken het
massaprocent
actieve Cl2 in
tot
50,0 ml
250,0 ml
waterige
oplossing van
12,00 g
waspoeder
in de 50,0 ml was er
dus 5x minder Cl2
de te titreren
oplossing
m(Cl2) = n.M =
m(Cl 2) = ?
n mol Cl2
dit waspoeder!
?
is
? g.100%
12,00g
massaprocent
=
massa.100%
massatotaal
KULeuven
Academische Lerarenopleiding Chemie
78
Reacties
vraagstuk
het vrijgezet I2
reageert met het
Na2S2O3 volgens
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
0
----> 2 NaI + Na2S4O6
10
alle Cl2 uit het
20
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
30
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
tot
50,0 ml
250,0 ml
waterige
oplossing van
12,00 g
waspoeder
de te titreren
oplossing
Bereken het
massaprocent
actieve Cl2 in
dit waspoeder!
KULeuven
Academische Lerarenopleiding Chemie
79
Omzetting
gegeven in
mol
het vrijgezet I2
reageert met het
Na2S2O3 volgens
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
0
----> 2 NaI + Na2S4O6
10
alle Cl2 uit het
20
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
30
n = c.V = 0,0510
mol.l-1.16,2.10-3 l
= 8,3.10-4 mol
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
tot
50,0 ml
250,0 ml
waterige
oplossing van
12,00 g
waspoeder
de te titreren
oplossing
Bereken het
massaprocent
actieve Cl2 in
dit waspoeder!
KULeuven
Academische Lerarenopleiding Chemie
80
Berekening
dijood
het vrijgezet I2
reageert met het
Na2S2O3 volgens
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
0
----> 2 NaI + Na2S4O6
10
reageren met
alle Cl2 uit het
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
20
8,3.10-4 mol
Na2S 2O 3
4,15.10-4 mol I2
n = c.V = 0,0510
mol.l-1.16,2.10-3 l
30
= 8,3.10-4 mol
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
Bereken het
massaprocent
actieve Cl2 in
dit waspoeder!
tot
50,0 ml
250,0 ml
waterige
oplossing van
12,00 g
waspoeder
KULeuven
de te titreren
oplossing
Academische Lerarenopleiding Chemie
81
Berekening
dichloor in
50,0 ml
het vrijgezet I2
reageert met het
Na2S2O3 volgens
4,15.10-4 mol
Cl 2
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
alle Cl2 uit het
----> 2 NaI + Na2S4O6
10
werden vrijgezet
door
reageren met
20
4,15.10-4 mol
I2
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
0
8,3.10-4 mol
Na2S 2O 3
n = c.V = 0,0510
mol.l-1.16,2.10-3 l
= 8,3.10-4 mol
30
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
tot
50,0 ml
250,0 ml
waterige
oplossing van
12,00 g
waspoeder
de te titreren
oplossing
Bereken het
massaprocent
actieve Cl2 in
dit waspoeder!
KULeuven
Academische Lerarenopleiding Chemie
82
Berekening
dichloor in
250,0 ml
het vrijgezet I2
reageert met het
Na2S2O 3 volgens
4,15.10-4 mol
Cl 2
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
alle Cl2 uit het
----> 2 NaI + Na2S4O6
10
werden vrijgezet
door
reageren met
20
4,15.10-4 mol
I2
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
0
8,3.10-4 mol
Na2S 2O 3
30
n = c.V = 0,0510
mol.l-1.16,2.10-3 l
= 8,3.10-4 mol
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
Bereken het
massaprocent
actieve Cl2 in
250,0 ml
waterige
oplossing van
12,00 g
in de
waspoeder oorspronkelijke
oplossing (250,0
ml) was er dus 5x
meer Cl2
tot
50,0 ml
de te titreren
oplossing
5 x 4,15.10-4
mol =
20,75.10-4
mol Cl2
dit waspoeder!
KULeuven
Academische Lerarenopleiding Chemie
83
Berekening
massa
dichloor in
12,0 g
poeder
het vrijgezet I2
reageert met het
Na2S2O 3 volgens
4,15.10-4 mol
Cl 2
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
alle Cl2 uit het
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
0
----> 2 NaI + Na2S4O6
10
werden vrijgezet
door
reageren met
20
4,15.10-4 mol
I2
8,3.10-4 mol
Na2S 2O 3
30
n = c.V = 0,0510
mol.l-1.16,2.10-3 l
= 8,3.10-4 mol
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
Bereken het
massaprocent
actieve Cl2 in
dit waspoeder!
250,0 ml
waterige
oplossing van
12,00 g
in de
waspoeder oorspronkelijke
oplossing (250,0
ml) was er dus 5x
meer Cl2
KULeuven
tot
50,0 ml
de te titreren
oplossing
5 x 4,15.10-4
mol =
20,75.10-4
mol Cl2
m(Cl2) = n.M =
m(Cl2)
20,75.10-4mol.71g.mol-1
= 0,15 g
Academische Lerarenopleiding Chemie
84
Berekening
massaprocent
dichloor in
12,0 g poeder
het vrijgezet I2
reageert met het
Na2S2O 3 volgens
4,15.10-4 mol
Cl 2
I 2 + 2 Na2S2O3
Cl2 + 2 KI ---> 2 KCl + I 2
alle Cl2 uit het
waspoeder in de
50,0 ml oplossing
reageert weg met
het KI volgens
0
----> 2 NaI + Na2S4O6
10
werden vrijgezet
door
reageren met
20
4,15.10-4 mol
I2
8,3.10-4 mol
Na2S 2O 3
30
n = c.V = 0,0510
mol.l-1.16,2.10-3 l
= 8,3.10-4 mol
40
16,2 ml
Na2S2O3
c = 0,0510 mol/l
50
250,0 ml
water
met
azijnzuur
een overmaat KI
tot
wordt toegevoegd
aan
wordt de oplossing
aangezuurd
worden opgelost in
wordt getitreerd
met
tot
hiervan neemt men
12,00 g
waspoeder
Bereken het
massaprocent
actieve Cl2 in
50,0 ml
250,0 ml
waterige
oplossing van
in de
12,00 g
oorspronkelijke
waspoeder
oplossing (250,0
ml) was er dus 5x
meer Cl2
dit waspoeder!
1,25%
tot
5 x 4,15.10-4
mol =
20,75.10-4
m(Cl2) = n.M =
m(Cl2)
-4
20,75.10 mol.71g.mol-1
= 0,15 g
mol Cl2
KULeuven 0,15g.100%
is
de te titreren
oplossing
12,00g
Academische
Lerarenopleiding Chemie
massaprocent
=
massa.100%
massatotaal
85
Vraagstuk
verbranding
kaars
Ook hier wordt
de
experimentele
opstelling
geanalyseerd
en het
vraagstuk stap
per stap
opgelost.
Het kaarsvet van een kaars bestaat uit zuiver stearinezuur. De kaars brandt gelijkmatig en de
verbrandingsproducten worden via een waterstraalpomp door een omgekeerde trechter weggezogen. Het
water wordt in een eerste erlenmeyer gecondenseerd door een ijsbad en gebonden door watervrij
kopersulfaat. Het koolstofdioxidegas wordt in een tweede erlenmeyer geleid doorheen kalkwater, waardoor
het gebonden wordt en er een calciumcarbonaatneerslag ontstaat.
Na doven van de kaars filtreert men het calciumcarbonaat af en na weging stelt men vast dat de neerslag een
massa van 45 gram had.
Bereken hoeveel gram kaarsvet er verbrand zijn.
naar waterstraalpomp
ijsbad
watervrij kopersulfaat CuSO 4
kalkwater Ca(OH) 2
Opstelling experiment
KULeuven
Academische Lerarenopleiding Chemie
86
Reactievergelijking:
C17H35COOH
+
26 O2
-------> 18 H2O
+
18 CO 2
naar waterstraalpomp
ijsbad
watervrij k opersu lfaat CuSO4
kalkwater Ca(OH) 2
kaars brandt
ijsbad
vloeibaar
water
tot
kalkwater
condenseert in een
dit wil zeggen
waterdamp
wordt geleid door
het
wordt aangezogen
door de
waterstraalpomp
wordt aangezogen
door de
tot
stearinezuur
reageert met
dizuurstof
en tot
KULeuven
koolstofdioxidegas
Academische Lerarenopleiding Chemie
87
C17H35COOH
+
Reactievergelijking:
26 O2 -------> 18 H2O
+
18 CO 2
naar waterstraalpomp
ijsbad
blauw k opersu lfaatpentahydraat
CuSO4.5H2O
kalkwater Ca(OH) 2
met witte troebel van CaCO3
CuSO4.5H2O
tot
watervrij
CuSO4
volgens de
reactievergelijking
wordt gebonden
door
kaars brandt
ijsbad
tot
vloeibaar
water
Ca(OH)2 + CO 2 ---> CaCO 3 + H 2O
een neerslag
van CaCO 3
tot
kalkwater
condenseert in een
dit wil zeggen
reageert met het
waterdamp
stearinezuur
reageert met
dizuurstof
wordt aangezogen
door de
waterstraalpomp
tot
en tot
KULeuven
wordt geleid door
het
wordt aangezogen
door de
koolstofdioxidegas
Academische Lerarenopleiding Chemie
88
C17H35COOH
+
Reactievergelijking:
26 O2 -------> 18 H2O
+
18 CO2
ijsbad
blauw k opersu lfaatpentahydraat
CuSO4.5H 2O
filtratie van de CaCO3 -neerslag
kalkwater Ca(OH) 2
met witte neerslag van CaCO3
wordt afgefiltreerd
en nadien gewogen
CuSO4.5H 2O
tot
watervrij
CuSO4
wordt gebonden
door
kaars brandt
ijsbad
tot
een neerslag
van CaCO3
volgens de
reactievergelijking
tot
Ca(OH)2 + CO 2 ---> CaCO 3 + H 2O
vloeibaar
water
kalkwater
condenseert in een
dit wil zeggen
en gewogen
weging van de CaCO3 -neerslag
reageert met het
waterdamp
stearinezuur
reageert met
dizuurstof
wordt aangezogen
door de
waterstraalpomp
tot
en tot
KULeuven
wordt geleid door
het
wordt aangezogen
door de
koolstofdioxidegas
Academische Lerarenopleiding Chemie
89
C17H35COOH
Reactievergelijking:
26 O2 -------> 18 H2O
+
+
18 CO2
ijsbad
blauw k opersu lfaatpentahydraat
CuSO4.5H 2O
filtratie van de CaCO3 -neerslag
kalkwater Ca(OH) 2
met witte neerslag van CaCO3
wordt afgefiltreerd
en nadien gewogen
CuSO4.5H 2O
tot
watervrij
CuSO4
wordt gebonden
door
kaars brandt
een neerslag
van CaCO3
volgens de
reactievergelijking
en gewogen
tot
Ca(OH)2 + CO 2 ---> CaCO 3 + H2O
ijsbad
tot
vloeibaar
water
kalkwater
weging van de CaCO3 -neerslag
condenseert in een
dit wil zeggen
45 gram CaCO3
reageert met het
waterdamp
stearinezuur
reageert met
dizuurstof
wordt aangezogen
door de
waterstraalpomp
tot
en tot
wordt geleid door
het
wordt aangezogen
door de
is volgens n =
m/M =
45 g/100 g.mol-1
koolstofdioxidegas
0,45 mol
KULeuven
Academische Lerarenopleiding Chemie
90
C17H35COOH
Reactievergelijking:
26 O2 -------> 18 H2O
+
+
18 CO2
ijsbad
blauw k opersu lfaatpentahydraat
CuSO4.5H 2O
filtratie van de CaCO3 -neerslag
kalkwater Ca(OH) 2
met witte neerslag van CaCO3
wordt afgefiltreerd
en nadien gewogen
CuSO4.5H2O
tot
watervrij
CuSO4
wordt gebonden
door
kaars brandt
een neerslag
van CaCO 3
volgens de
reactievergelijking
en gewogen
tot
Ca(OH)2 + CO 2 ---> CaCO 3 + H 2O
ijsbad
tot
vloeibaar
water
kalkwater
weging van de CaCO3 -neerslag
condenseert in een
dit wil zeggen
uit
reageert met het
waterdamp
stearinezuur
reageert met
dizuurstof
wordt aangezogen
door de
waterstraalpomp
tot
en tot
KULeuven
wordt geleid door
het
wordt aangezogen
door de
koolstofdioxidegas
0,45 mol
CO2
ontstonden volgens
de
reactievergelijking
0,45 mol
CaCO3
Academische Lerarenopleiding Chemie
45 gram CaCO3
is volgens n =
m/M =
45 g/100 g.mol-1
91
C17H35COOH
Reactievergelijking:
26 O2 -------> 18 H2O
+
ontstonden volgens
de
reactievergelijking
+
18 CO2
uit
(1/18).045
mol
stearinezuur
ijsbad
is
0,025 mol
stearinezuur
blauw k opersu lfaatpentahydraat
CuSO4.5H 2O
filtratie van de CaCO3 -neerslag
kalkwater Ca(OH) 2
met witte neerslag van CaCO3
wordt afgefiltreerd
en nadien gewogen
CuSO4.5H 2O
tot
watervrij
CuSO 4
wordt gebonden
door
kaars brandt
een neerslag
van CaCO3
volgens de
reactievergelijking
en gewogen
tot
Ca(OH)2 + CO2 ---> CaCO 3 + H2O
ijsbad
tot
vloeibaar
water
kalkwater
weging van de CaCO3 -neerslag
condenseert in een
dit wil zeggen
uit
reageert met het
waterdamp
stearinezuur
reageert met
dizuurstof
wordt aangezogen
door de
waterstraalpomp
tot
en tot
KULeuven
wordt geleid door
het
wordt aangezogen
door de
koolstofdioxidegas
0,45 mol
CO2
ontstonden volgens
de
reactievergelijking
0,45 mol
CaCO3
Academische Lerarenopleiding Chemie
45 gram CaCO3
is volgens n =
m/M =
45 g/100 g.mol-1
92
ontstonden volgens
de
reactievergelijking
R eactieverg elijkin g
C 1 7H 3 5-C O O H
+
26 O 2
1 8 H 2O
+
18 C O
2
uit
(1/18).045 mol
stearinezuur
ijsbad
is
0,025 mol
stearinezuur
blauw k opersu lfaatpentahydraat
CuSO4.5H 2O
filtratie van de CaCO3 -neerslag
kalkwater Ca(OH) 2
met witte neerslag van CaCO3
heeft volgens m =
n.M een massa van
wordt afgefiltreerd
kaars brandt
en nadien gewogen
CuSO 4.5H 2O
tot
0,025 mol.284 g.mol-1
wordt gebonden
door
reageren weg als de
is
watervrij
CuSO4
dit wil zeggen
ijsbad
tot
een neerslag
van CaCO 3
volgens de
reactievergelijking
tot
en gewogen
Ca(OH) 2 + CO 2
CaCO 3 + H2 O
vloeibaar
water
kalkwater
weging van de CaCO3 -neerslag
condenseert in een
7,1 gram
stearinezuur
reageert met het
waterdamp
stearinezuur
reageert met
dizuurstof
wordt aangezogen
door de
waterstraalpomp
tot
en tot
KULeuven
uit
wordt geleid door
het
wordt aangezogen
door de
koolstofdioxidegas
0,45 mol
CO2
ontstonden volgens
de
reactievergelijking
0,45 mol
CaCO3
Academische Lerarenopleiding Chemie
45 gram CaCO3
is volgens n =
m/M =
45 g/100 g.mol-1
93
1 Wat is een concept?
2 Hoe wordt een concept aangeduid?
3 Hoe kunnen concepten in kaart gebracht
(gevisualiseerd) worden?
4 Welke elementen bevat een ‘bewerkte’
concept map? [Leerkracht georiënteerd referentieschema LGRS]
5 Hoe kan de leraar concept maps gebruiken
als didactisch hulpmiddel?
6 Zelf een concept map maken: opdrachten
7 Enkele interessante adressen
KULeuven
Academische Lerarenopleiding Chemie
94
6 Zelf een concept map maken
Opdracht 1. Link zoveel mogelijk concepten met elkaar .
KULeuven
Academische Lerarenopleiding Chemie
95
Mogelijk antwoord
KULeuven
Academische Lerarenopleiding Chemie
96
Opdracht 2: maak proposities door mogelijke links op de pijlen te schrijven
Mogelijk antwoord
KULeuven
Academische Lerarenopleiding Chemie
97
Opdracht 3: maak cross-links en schrijf links op de pijlen
Mogelijk antwoord
KULeuven
Academische Lerarenopleiding Chemie
98
Opdracht 4:
1. Maak een 'concept map' met de onderstaande concepten.
reductor – oxidatie – oxidatiegetal – reductie – oxidator
elektronen - redoxreactie
Start met het hiërarchisch ordenen van de concepten.
Zoek er relaties tussen. Geef deze aan met pijlen en benoem
de relaties. Let op: geen zinnen gebruiken maar eerder
slagwoorden of werkwoorden.
Verwerk je 'concept map' met Inspiration.
2. Bekijk de 'concept map' van collega's.
Stuur je 'concept map' bij.
KULeuven
Academische Lerarenopleiding Chemie
99
1 Wat is een concept?
2 Hoe wordt een concept aangeduid?
3 Hoe kunnen concepten in kaart gebracht
(gevisualiseerd) worden?
4 Welke elementen bevat een ‘bewerkte’
concept map? [Leerkracht georiënteerd referentieschema LGRS]
5 Hoe kan de leraar concept maps gebruiken
als didactisch hulpmiddel?
6 Zelf een concept map maken: opdrachten
7 Enkele interessante adressen
KULeuven
Academische Lerarenopleiding Chemie
100
7 Enkele interessante adressen
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
http://www.inspiration.com/home.cfm
http://cmap.ihmc.us/
http://www.mindjet.com/
http://hyperphysics.phy-astr.gsu.edu/hbase/hframe.html !!!
http://users.edte.utwente.nl/lanzing/cm_home.htm
http://www.fed.cuhk.edu.hk/~johnson/misconceptions/concept_map/concept_
maps.html
http://chemcases.com/
http://necsi.org/guide/concepts/
http://archive.concord.org/intec/tools/hop/hopcm.html
http://science.uniserve.edu.au/school/support/strategy.html#Concept
http://www.sdmesa.sdccd.net/~dgergens/chem100/
http://www.unisaarland.de/fak5/ezw/abteil/lehr/concept/cmaplink.html#Concept%20Map%20
Beispiele
http://king.prps.k12.ca.us/prhs/pasohigh/classes/Fairbank/public.www/homep
age/chemist/concept.htm
http://science.kennesaw.edu/~mhermes/chem1212/map.htm
http://www.psychologie.uni-freiburg.de/signatures/ploetz/projekte/physik.html
http://www.csun.edu/~vceed002/physics/index.html#top
KULeuven
Academische Lerarenopleiding Chemie
101











