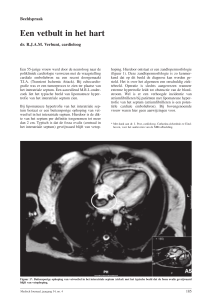
269
32 Atriale ritmestoornissen
I.C. van Gelder
32.1 Inleiding
Atriumfibrilleren is de meest voorkomende ritmestoornis van
het hart. De prevalentie van atriumfibrilleren wordt geschat op
0,4% in de algemene bevolking en neemt toe met de leeftijd en
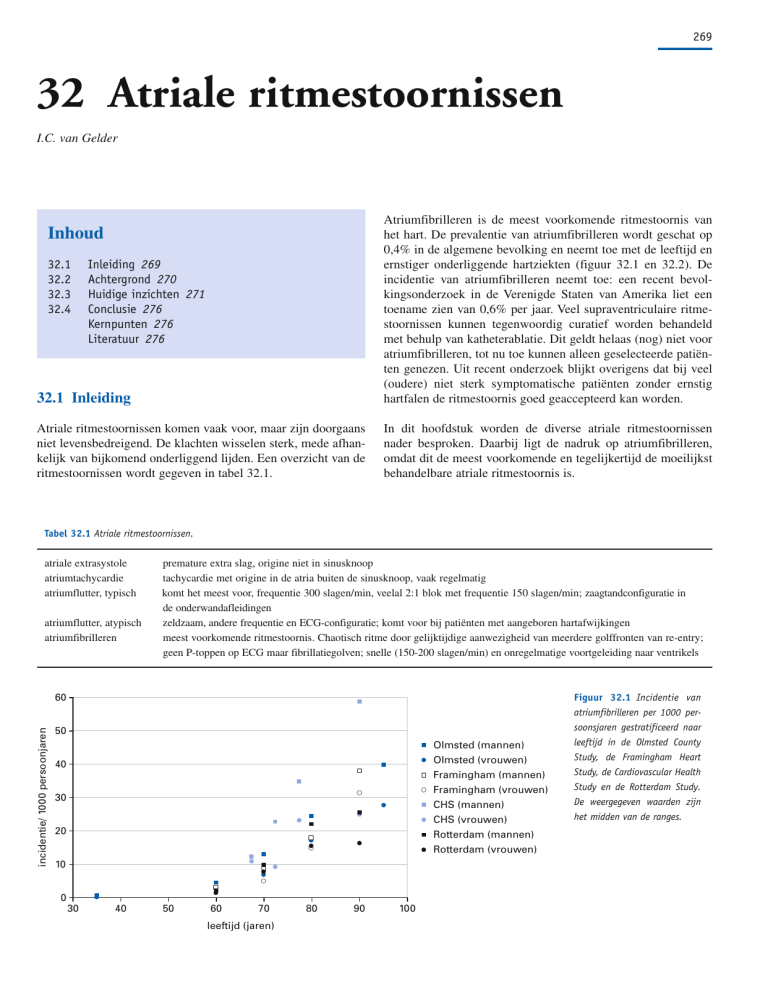
ernstiger onderliggende hartziekten (figuur 32.1 en 32.2). De
incidentie van atriumfibrilleren neemt toe: een recent bevolkingsonderzoek in de Verenigde Staten van Amerika liet een
toename zien van 0,6% per jaar. Veel supraventriculaire ritmestoornissen kunnen tegenwoordig curatief worden behandeld
met behulp van katheterablatie. Dit geldt helaas (nog) niet voor
atriumfibrilleren, tot nu toe kunnen alleen geselecteerde patiënten genezen. Uit recent onderzoek blijkt overigens dat bij veel
(oudere) niet sterk symptomatische patiënten zonder ernstig
hartfalen de ritmestoornis goed geaccepteerd kan worden.
Atriale ritmestoornissen komen vaak voor, maar zijn doorgaans
niet levensbedreigend. De klachten wisselen sterk, mede afhankelijk van bijkomend onderliggend lijden. Een overzicht van de
ritmestoornissen wordt gegeven in tabel 32.1.
In dit hoofdstuk worden de diverse atriale ritmestoornissen
nader besproken. Daarbij ligt de nadruk op atriumfibrilleren,
omdat dit de meest voorkomende en tegelijkertijd de moeilijkst
behandelbare atriale ritmestoornis is.
Inhoud
32.1
32.2
32.3
32.4
Inleiding 269
Achtergrond 270
Huidige inzichten 271
Conclusie 276
Kernpunten 276
Literatuur 276
Tabel 32.1 Atriale ritmestoornissen.
atriale extrasystole
atriumtachycardie
atriumflutter, typisch
atriumflutter, atypisch
atriumfibrilleren
premature extra slag, origine niet in sinusknoop
tachycardie met origine in de atria buiten de sinusknoop, vaak regelmatig
komt het meest voor, frequentie 300 slagen/min, veelal 2:1 blok met frequentie 150 slagen/min; zaagtandconfiguratie in
de onderwandafleidingen
zeldzaam, andere frequentie en ECG-configuratie; komt voor bij patiënten met aangeboren hartafwijkingen
meest voorkomende ritmestoornis. Chaotisch ritme door gelijktijdige aanwezigheid van meerdere golffronten van re-entry;
geen P-toppen op ECG maar fibrillatiegolven; snelle (150-200 slagen/min) en onregelmatige voortgeleiding naar ventrikels
incidentie/ 1000 persoonjaren
60
50
Olmsted (mannen)
Olmsted (vrouwen)
Framingham (mannen)
Framingham (vrouwen)
CHS (mannen)
CHS (vrouwen)
Rotterdam (mannen)
Rotterdam (vrouwen)
40
30
20
10
0
30
40
50
60
70
leeftijd (jaren)
80
90
100
Figuur 32.1 Incidentie van
atriumfibrilleren per 1000 persoonsjaren gestratificeerd naar
leeftijd in de Olmsted County
Study, de Framingham Heart
Study, de Cardiovascular Health
Study en de Rotterdam Study.
De weergegeven waarden zijn
het midden van de ranges.
270
DEEL E ELEKTROFYSIOLOGIE, RITMESTOORNISSEN EN PACING
80
70
prevalentie (%)
60
50
40
30
20
10
0
50-59
60-69
70-79
80-89
leeftijd (jaren)
atriumfibrilleren
hartfalen
coronairlijden
hypertensie
Figuur 32.2 Prevalentie van atriumfibrilleren afhankelijk van leeftijd en
onderliggende hartziekte. Gegevens van een Amerikaans bevolkingsonderzoek, de Framingham Heart Study.
32.2 Achtergrond
32.2.1 Pathofysiologie
Ritmestoornissen worden veroorzaakt door één of meer mechanismen, te weten afwijkingen in de impulsformatie zoals abnormale automatie en ‘triggered activity’, of impulsgeleiding zoals
re-entry (zie hoofdstuk 30). Abnormale automatie betekent dat
cellen spontaan eerder depolariseren dan de sinusknoop. Dit kan
leiden tot een atriale extrasystole en uiteindelijk tot een atriumtachycardie doordat in de atria of – en dit werd pas kortgeleden
ontdekt – in de venae pulmonales of in de vena cava superior
cellen versneld spontaan depolariseren. De meest voorkomende
oorzaak van atriale ritmestoornissen is re-entry, waarbij kleinere of grotere golffronten in delen van de atria rondcirkelen.
Inzicht in de pathofysiologische mechanismen van atriale ritmestoornissen is van belang om een keuze te maken uit de behandelingsmogelijkheden.
Het onderliggende mechanisme van atriumfibrilleren staat
momenteel enigszins ter discussie. Sinds meer dan dertig jaar
wordt de theorie aangehangen van de ‘meerdere golffronten van
re-entry’-hypothese. Een focale origine ten gevolge van abnormale automatie en een klein golffront van re-entry (microreentry) of ‘triggered activity’ lijkt momenteel niet volledig uitgesloten. Waarschijnlijk spelen beide bij de individuele patiënt
meer of minder een rol. De stabiliteit van atriumfibrilleren is
afhankelijk van het aantal golffronten dat tegelijkertijd aanwezig is in de atria.
Wijffels en Allessie toonden aan dat ‘atriumfibrilleren haar
eigen voortbestaan stimuleert’. Dit wordt veroorzaakt door de
hoge stimulatiefrequentie in de atria tijdens fibrilleren. De myocardcellen ‘remodelleren’, hetgeen betekent dat door de hoge
frequenties de cellen zich aanpassen aan deze nieuwe situatie.
Daardoor ontstaan cellulaire veranderingen, namelijk elektrofysiologische, contractiele en structurele veranderingen. Elektrofysiologische veranderingen, ook wel elektrische remodellering
genoemd, bestaan uit een verkorting van de atriale refractaire
periode en het ontbreken van de mogelijkheid om de duur van de
refractaire periode aan te passen aan de hartfrequentie. Deze veranderingen zijn voornamelijk in experimentele modellen aangetoond, maar ook bij patiënten.
Naast deze elektrische remodellering ontstaan er ook functionele veranderingen ofwel contractiele remodellering. In dat geval
contraheert de atriale cel niet meer. Dit is de oorzaak van het
verhoogde risico op trombo-embolische complicaties tijdens,
maar ook nog enige tijd na atriale ritmestoornissen.
Hoe langer atriumfibrilleren bestaan heeft, en hetzelfde geldt
voor atriumflutter en waarschijnlijk ook voor atriumtachycardieën, des te langer duurt het herstel. Dit betekent dat na een
hersteld sinusritme antistolling altijd moet worden gecontinueerd indien de atriale ritmestoornis tevoren langer dan 48 uur
heeft bestaan.
Ten slotte ontstaan structurele veranderingen ofwel structurele
remodellering, die onder andere bestaan uit een vergroting van
de atria en veranderingen in de structuur, bijvoorbeeld ten
gevolge van fibrose. Door deze veranderingen wordt het ontstaan en voortbestaan van atriumfibrilleren bevorderd. Vandaar
dat bij patiënten met grotere atria, bijvoorbeeld bij hypertensie,
zo gemakkelijk atriumfibrilleren ontstaat en moeilijk te onderdrukken is. De snelle activatie tijdens atriumfibrilleren leidt tot
een snelle en onregelmatige ventrikelrespons, mits de elektrische geleiding van atrium naar ventrikel (de atrioventriculaire
verbinding, AV-knoop) intact is.
Vaak ontstaat atriumfibrilleren als gevolg van een onderliggende (behandelbare) aandoening, met als meest voorkomende oorzaken hypertensie, hartkleplijden, coronairlijden en hartfalen
(figuur 32.3). Bij een deel van de patiënten met atriumfibrilleren
wordt geen onderliggende oorzaak aangetoond; men spreekt
dan van ‘lone’ atriumfibrilleren. Bij sommige patiënten speelt
het autonome zenuwstelsel een rol in het ontstaan van paroxismaal atriumfibrilleren. Vagaal atriumfibrilleren ontstaat vooral
bij patiënten zonder onderliggend lijden en begint vaak ’s nachts
of na een zware maaltijd. Adrenerg geïnduceerd atriumfibrilleren daarentegen is zeldzaam en vaak geassocieerd met onderliggend coronairlijden.
Atriumtachycardieën zijn veel zeldzamer en veelal goedaardig.
Ze komen zowel op jonge als oudere leeftijd voor. Ze ontstaan
op basis van abnormale automatie (focus) of een klein golffront
van re-entry (microre-entry) of ‘triggered activity’. Op oudere
leeftijd is er veelal sprake van bijkomend onderliggend lijden.
Uiteindelijk kunnen atriumtachycardieën atriumfibrilleren veroorzaken doordat door de hoge frequentie de atria ‘remodelleren’, zoals hierboven beschreven.
Atriumflutter komt meestal voor in de vorm van typische atriumflutter, vaak ook samen met atriumfibrilleren (in 25-35% van
de gevallen). Atriumflutter ontstaat door een groot golffront van
32
271
ATRIALE RITMESTOORNISSEN
Patiënten met atriumfibrilleren en atriumflutter hebben een ééntot vijfmaal verhoogd risico op trombo-embolische complicaties. Mogelijk geldt dit ook voor patiënten met atriumtachycardieën. In het algemeen is men van mening dat deze complicaties
een gevolg zijn van een embolie uit het linker atrium. Daarnaast
kunnen ze worden veroorzaakt door een intrinsieke cerebrovasculaire ziekte en/of atherosclerose in de proximale aorta of arteria carotis. Daarnaast lopen patiënten met atriale ritmestoornissen risico op het ontwikkelen of verergeren van hartfalen. Dit is
niet alleen het gevolg van het verlies van de atriale contractie,
het onregelmatige en te snelle hartritme, maar ook van een door
de tachycardie veroorzaakte (tachy)cardiomyopathie. De mortaliteit is verhoogd bij patiënten met atriumfibrilleren en is vooral
gerelateerd aan de ernst van het onderliggende lijden.
80
70
prevalentie (%)
60
50
40
30
20
10
0
nieuw gedocumenteerd AF
paroxismaal AF
persisterend AF
permanent AF
32.3 Huidige inzichten
leeftijd (jaren)
lone AF
kleplijden
hartfalen
coronairlijden
hypertensie
Figuur 32.3 Verdeling van onderliggende hartziekten bij de verschillende
typen atriumfibrilleren (gegevens van de Euro Heart Survey).
AF = atriumfibrilleren.
re-entry (macrore-entry). Dit golffront is bij de typische atriumflutter gelokaliseerd in het rechter atrium. Atypische atriumflutters komen sporadisch voor en dan vooral na een hartoperatie, bijvoorbeeld in verband met aangeboren hartafwijkingen. Het golffront cirkelt dan meestal rondom littekenweefsel.
32.2.2 Klachten en complicaties
Onbehandeld veroorzaken alle atriale ritmestoornissen wisselende klachten: hartkloppingen, kortademigheid, vermoeidheid,
duizeligheid, druk op de borst en frequent plassen. Soms kunnen patiënten collaberen, vooral direct na het begin van een
(snelle) tachycardie of door een pauze direct na het stoppen van
de tachycardie omdat de sinusknoop moeite heeft weer op gang
te komen. Atriumfibrilleren is onregelmatig. Afhankelijk van het
type blok naar het ventrikel tijdens atriumflutter en atriumtachycardie (continu 2:1 blok zoals onbehandeld vaak voorkomt
versus wisselend 2:1, 3:1 en 4:1 blok) kan deze ritmestoornis
zowel regelmatig als onregelmatig verlopen. Klachten kunnen
sterk wisselen, afhankelijk van de frequentie van de tachycardie,
de ernst van de onderliggende hartziekte, de duur van de ritmestoornis en de perceptie van de individuele patiënt.
Bij elke patiënt met klachten van een ritmestoornis is de anamnese van groot belang. Op die manier kan het onderscheid met
een normale sinustachycardie worden gemaakt. Indien atriumfibrilleren vooral in rust (’s nachts) begint, kiest men voor andere preventieve medicatie dan wanneer de ritmestoornis bij
inspanning begint (zie hieronder).
Bij nieuw ontdekt atriumfibrilleren, atriumflutter en atriumtachycardie, maar ook bij een recidief moet zorgvuldig worden
gekeken naar de aanwezigheid van een, eventueel behandelbare,
onderliggende oorzaak. Denk hierbij vooral aan onbehandelde
hypertensie, ischemie, een exacerbatie van hartfalen, infectie
dan wel hyperthyreoïdie. Voordat met de behandeling van de ritmestoornis begonnen mag worden, moet eerst de onderliggende
hartziekte optimaal worden behandeld. Wanneer ondanks
behandeling van de onderliggende oorzaak de ritmestoornis
aanwezig blijft, zal – vooral op grond van de klachten die de
patiënt ondervindt – een keuze worden gemaakt uit de behandelingsmogelijkheden (ritme- of frequentiecontrole). Wanneer
wordt gekozen voor ritmecontrole met gebruik van antiaritmische medicatie, speelt de ernst van het onderliggende lijden een
belangrijke rol bij de keuze van het meest geschikte middel.
Atriumtachycardie en de typische atriumflutter zijn tegenwoordig vaak goed te behandelen met katheterablatie. Dat geldt niet
voor atriumfibrilleren. Belangrijk is dat de patiënt duidelijk
wordt gemaakt dat atriumfibrilleren niet eenvoudig te genezen
is, maar dat de risico’s op ernstige complicaties gering zijn
indien de ritmestoornis goed wordt behandeld. Vroeger of later
zal bij de meeste patiënten, ondanks optimale medicamenteuze
therapie, toch weer een recidief optreden (‘eens atriumfibrilleren altijd atriumfibrilleren’). Curatieve katheterablatie is
momenteel slechts voorbehouden voor een selecte groep. Hieronder wordt een en ander nader uitgewerkt.
32.3.1 Classificatie en diagnostiek
Classificatie van atriumfibrilleren en andere atriale ritmestoornissen is van belang voor de behandeling. De 3P-indeling geeft
een verdeling naar tijdspatroon. Daarbij wordt onderscheid
gemaakt naar paroxismaal, persisterend en permanent atriumfibrilleren (tabel 32.2).
272
DEEL E ELEKTROFYSIOLOGIE, RITMESTOORNISSEN EN PACING
Tabel 32.2 Classificatie van atriumfibrilleren.
paroxismaal atriumfibrilleren
– episoden van atriumfibrilleren typisch < 24-48 uur (tot zeven dagen)
– intermitterend sinusritme
– vaak spontane conversie naar sinusritme of met antiaritmische
medicatie
persisterend atriumfibrilleren
– continu atriumfibrilleren > 24-48 uur
– eindigt niet spontaan
– (elektrische) cardioversie mogelijk
permanent atriumfibilleren
– continu atriumfibrilleren > 24-48 uur
– geen cardioversie (meer) mogelijk
umfibrilleren. De kans op succes van conversie naar sinusritme
binnen één uur is 59-92%. Tijdens infusie moet men wel continu het hartritme bewaken omdat deze middelen door extreme
geleidingsvertraging aanleiding kunnen geven tot ventrikeltachycardieën. Indien er een contra-indicatie bestaat voor klasse-IC-middelen, moet worden gekozen voor elektrische cardioversie. Conversie met een klasse-III-antiaritmicum (sotalol) is
slechts bij 19-46% van de patiënten effectief en is daarom geen
alternatief. Klasse-III-antiaritmica zijn wel effectief bij conversie van een atriumflutter naar sinusritme. Orale behandeling met
amiodaron converteert 15-40% van de patiënten met atriumfibrilleren of -flutter naar sinusritme, maar dit kan weken duren.
Digitalis, bètablokkers en calciumantagonisten zijn niet effectief bij de conversie van atriumfibrilleren en -flutter naar sinusritme. Ze vertragen slechts de ventrikelfrequentie. Bij hemodynamisch instabiele patiënten kan amiodaron intraveneus gegeven worden. Dit heeft twee effecten, namelijk vertraging van de
ventrikelrespons en (eventueel) conversie naar sinusritme. Zo
nodig kan een elektrische cardioversie worden verricht.
32.3.2 Behandeling
Tabel 32.4 Antiaritmica volgens de indeling van Vaughan Williams.
De behandeling van atriumfibrilleren en andere atriale ritmestoornissen kan worden onderverdeeld in:
– conversie van paroxismaal en persisterend atriumfibrilleren/flutter/-tachycardie naar sinusritme;
– behoud van sinusritme bij patiënten met paroxismaal en persisterend atriumfibrilleren/-flutter/-tachycardie;
– controle van de ventrikelfrequentie tijdens paroxismaal, persisterend en permanent atriumfibrilleren/-flutter/-tachycardie.
Afhankelijk van de ernst van de klachten en van het onderliggende lijden kan een behandelingsstrategie worden gekozen. In eerste instantie zal men bij de meeste patiënten proberen het sinusritme te herstellen. Wanneer een patiënt echter weinig tot geen
klachten van de ritmestoornis ondervindt, kan men er ook voor
kiezen de ritmestoornis te accepteren en een adequate hartfrequentiecontrole na te streven (tabel 32.3). Patiënten met een typische atriumflutter en patiënten met atriumtachycardieën worden
momenteel vaak behandeld met een curatieve katheterablatie.
Farmacologische cardioversie
Bij patiënten met symptomatisch atriumfibrilleren dat korter
duurt dan 48 uur, kan worden overgegaan tot farmacologische
(chemische) cardioversie met antiaritmica (tabel 32.4). Antistolling is hiervoor niet geïndiceerd. Klasse-IC-antiaritmica (flecaïnide, propafenon) zijn eerste keuze voor conversie van atri-
klasse IA
kinidine
disopyramide
procaïnamide (alleen intraveneus)
klasse IB
lidocaïne (alleen intraveneus)
difantoïne
klasse IC
flecaïnide
propafenon
klasse II
metoprolol
atenolol
bisoprolol
carvedilol
klasse III
sotalol
amiodaron
ibutilide (alleen intraveneus)
klasse IV
verapamil
diltiazem
overige
digoxine
adenosine
Tabel 32.3 Factoren die een rol spelen bij de keuze voor frequentie- of ritmecontrole bij de behandeling van atriumfibrilleren.
frequentiecontrole
– weinig of geen klachten van het atriumfibrilleren
– oudere leeftijd (> 75 jaar)
– grote kans op recidief ariumfibrilleren
– bijwerkingen van antiaritmica
– wanneer antistolling sowieso geïndiceerd is
(onafhankelijk van het hartritme)
ritmecontrole
– veel klachten van het atriumfibrilleren
– jonge leeftijd (< 65 jaar)
– verbeterde linkerventrikelfunctie en inspanningstolerantie tijdens sinusritme
– slecht te reguleren hartfrequentie tijdens atriumfibrilleren
– mogelijkheid tot staken van antistolling bij sinusritme
32
ATRIALE RITMESTOORNISSEN
Wanneer atriumfibrilleren of atriumflutter langer dan 48 uur
bestaat (persisterend atriumfibrilleren/-flutter), neemt de effectiviteit van antiaritmica snel af. De kans op succes van een ‘direct
current’ (DC) externe elektrische cardioversie is vele malen groter en heeft dus de voorkeur.
Er is weinig bekend over conversie van paroxismale dan wel
‘incessant’ (steeds opnieuw opstartende) atriumtachycardieën.
Meestal zijn ze moeilijk te behandelen. Men kan een vagale
manoeuvre, adenosine, een calciumantagonist of een bètablokker proberen. De effectiviteit hangt af van het onderliggende
pathofysiologische mechanisme. Voor de laatste twee medicamenten geldt dat wanneer ze niet effectief zijn, ze in elk geval
de hartfrequentie vertragen.
Elektrische cardioversie
DC-cardioversie betekent het afgeven van een elektrische shock
die gesynchroniseerd met de eigen elektrische activiteit wordt
gegeven. Het succes van een elektrische cardioversie wordt
bepaald door de duur van de ritmestoornis, de ernst van het
onderliggende lijden en de stroom die aan het hart wordt afgegeven. De paddels kunnen in de anterolaterale positie (apex van
het ventrikel en recht infraclaviculair) of in de anteroposteriore
positie worden geplaatst. Voor het slagen van een elektrische
cardioversie is in het algemeen van belang dat voldoende druk
wordt uitgeoefend, op de juist gepositioneerde peddels, en dat
voldoende energie wordt afgegeven.
Indien de atriale ritmestoornis langer dan 48 uur bestaat, moet
de patiënt voorafgaand aan elektrische cardioversie gedurende
vier weken adequaat worden ontstold. Een alternatief is om met
behulp van een slokdarmecho de eventuele aanwezigheid van
‘spontaan contrast’ of stolsels in de atria uit te sluiten. Wanneer
bij een betrouwbaar onderzoek geen aanwijzingen voor stolsels
worden gevonden, kan de cardioversie veilig worden verricht.
Omdat de atriumcontractie pas na enkele dagen tot weken
terugkomt, moet na de cardioversie behandeling met een vitamine-K-antagonist (bijvoorbeeld acenocoumarol) minimaal vier
weken worden voortgezet.
Medicamenteuze preventie
Het risico op een recidief van een atriale ritmestoornis is groot.
Meestal zijn enkele farmacologische of elektrische cardioversies
en diverse antiaritmica nodig om een patiënt langdurig in sinusritme te houden. Risicofactoren voor een recidief ritmestoornis
zijn een lange duur van het eerdere atriumfibrilleren/-flutter/
-tachycardie (> 1-3 jaar), een oudere leeftijd (> 65 jaar), een zeer
groot linker atrium (> 55 mm) en ernstiger onderliggend lijden.
Bij de keuze van de optimale antiaritmische therapie voor een
individuele patiënt spelen het type ritmestoornis (paroxismaal of
persisterend), de aan- of afwezigheid van een onderliggende
structurele hartziekte en de etiologie een bepalende rol.
De meeste antiaritmica (klasse IC en III en bètablokkers) zijn
matig effectief. Het meest effectieve antiaritmicum is amiodaron, maar dit middel heeft helaas ook de meeste (niet-cardiale)
bijwerkingen. In de klinische praktijk kan een bètablokker een
goede eerste keuze zijn. Wanneer er duidelijk sprake is van
vagaal (paroxismaal) atriumfibrilleren heeft disopyramide de
voorkeur boven een bètablokker. Faalt de bètablokker, dan zijn
273
klasse-IC-antiaritmica of sotalol middelen van tweede keuze.
Flecaïnide en propafenon kunnen veilig worden gegeven aan
patiënten die geen onderliggende structurele hartziekte hebben.
Benadrukt moet worden dat deze antiaritmica altijd in combinatie met een negatief-chronotroop middel, zoals een bètablokker,
calciumantagonist of digoxine, moeten worden gegeven. Dat is
nodig omdat tijdens behandeling met een klasse-IC-antiaritmicum bij een recidief een langzame atriumflutter kan ontstaan
met eventueel 1:1 AV-geleiding naar de ventrikels en daardoor
een zeer snelle hartfrequentie.
Na instelling op een klasse-IC-antiaritmicum mag het QRScomplex niet meer dan 150% langer worden. Hierbij kan
inspanningsonderzoek nuttig zijn omdat klasse-IC-antiaritmica
hun effect vooral uitoefenen tijdens hogere hartfrequenties (‘use
dependent’-effect). Na een infarct of bij hartfalen zijn deze
medicijnen gecontra-indiceerd. Wanneer met een klasse-IIIantiaritmicum wordt gestart, moet de QT-tijd nauwkeurig in de
gaten worden gehouden om zo het risico op het optreden van
‘torsades de pointes’ te vermijden. In tegenstelling tot klasse-ICmiddelen oefenen klasse-III-antiaritmica hun effect vooral uit
tijdens langzamere hartritmen (‘reverse use dependency’). Een
holterregistratie is nuttig om juist (’s nachts) tijdens langzamere
ritmen de QT-tijd en het eventuele optreden van ‘torsades de
pointes’ te beoordelen. De QTc moet bij behandeling met klasse-IA- en klasse-III-antiaritmica – met als mogelijke uitzondering amiodaron – onder de 520 ms blijven. Daarnaast mag niet
met (niet-cardiale) medicamenten worden gestart die ook de
QT-tijd kunnen verlengen, zoals een antidepressivum (zie ook
www.torsades.org).
Gezien de frequente bijwerkingen is behandeling met amiodaron vaak therapie van derde keuze. Deze bijwerkingen betreffen
vooral zonovergevoeligheid (insmeren met factor 30-60) en
schildklier-, lever- en (zelden) longproblemen. Aangeraden
wordt om tijdens behandeling met amiodaron de bovengenoemde functies regelmatig te controleren.
In recente onderzoeken zijn aanwijzingen gevonden voor een
mogelijk antiaritmisch effect van remmers van het angiotensineconverterend enzym, angiotensinereceptorblokkers en statinen. Naast hun effect bij de behandeling van het onderliggende
lijden zouden deze middelen ook direct effect hebben op het
atriumweefsel (remodelleringsproces) en aldus het optreden van
atriumfibrilleren en andere atriale ritmestoornissen helpen voorkomen. Hoewel medicamenteuze preventie van atriale ritmestoornissen meestal alleen een recidief uitstelt, is dit bij veel
symptomatische patiënten toch een goede behandeloptie.
Een abonnement op een cardioversie, één tot drie keer per jaar,
is voor veel patiënten een prima behandeling. Wanneer medicamenteuze therapie tekortschiet (ineffectiviteit en/of intolerantie)
en het atriumfibrilleren klachten blijft geven, dienen niet-medicamenteuze behandelopties te worden overwogen, afhankelijk
van de ernst van de klachten van de patiënt.
Frequentiecontrole
Frequentiecontrole tijdens paroxismaal, persisterend en permanent atriumfibrilleren heeft als doel de klachten van de patiënt te
verminderen en het optreden van hartfalen te voorkomen. Het
AFFIRM- en het RACE-onderzoek en andere studies hebben
274
laten zien dat frequentiecontrole (‘rate control’) in vergelijking
met ritmecontrole (‘rhythm control’) niet leidt tot een hogere
morbiditeit en mortaliteit. Daarom kan frequentiecontrole bij
veel (oudere) patiënten met weinig klachten als therapie van
eerste keuze worden gestart. Frequentiecontrole wordt als een
gemakkelijkere behandeling beschouwd. Uit het AFFIRMonderzoek blijkt echter dat medicamenten en doseringen regelmatig moeten worden veranderd.
Op dit moment is niet duidelijk wat de optimale hartfrequentie is
tijdens atriumfibrilleren. Strikte frequentiecontrole (hartfrequentie < 80 slagen/min in rust en < 110 slagen/min tijdens matige
inspanning, zoals aanbevolen wordt in de Europese en Amerikaanse richtlijnen) kan zorgen voor minder klachten, een betere
kwaliteit van leven, een vermindering van het optreden van hartfalen en zodoende minder trombo-embolische complicaties en
een betere overleving. Aan de andere kant kan de strikte controle (door de vaak hogere doseringen) leiden tot meer aan medicatie gerelateerde bijwerkingen zoals symptomatische bradycardieën (trage hartslag), met als consequentie een verhoogd risico
op duizeligheid, syncope en eventueel pacemakerimplantatie.
In het AFFIRM-onderzoek werd de strikte frequentiecontrole
toegepast. Uiteindelijk werd bij twee derde van de patiënten de
doelhartfrequentie bereikt. Vooral bètablokkers waren effectief
bij het bereiken van dit doel. Bij 5,3% van de patiënten was hiervoor echter een AV-knoopablatie met additionele pacemakerimplantatie nodig. Daarnaast werd bij 7,3% van de patiënten een
pacemaker geïmplanteerd in verband met symptomatische bradycardieën. In het RACE-onderzoek, waarin men een meer
gematigde frequentiecontrole nastreefde (rusthartfrequentie
< 100 slagen/min), kreeg slechts 1,2% van de patiënten een
pacemaker (allen na AV-knoopablatie). Het is tot nu toe dus nog
onduidelijk of een strikte frequentiecontrole uiteindelijk beter is
dan een meer gematigde frequentiecontrole. Nieuw gerandomiseerd onderzoek (onder meer het RACE-II-onderzoek) zal hierop een antwoord kunnen geven.
Bètablokkers, calciumantagonisten en digoxine worden het
meest gebruikt voor frequentiecontrole. Er is weinig onderzoek
verricht naar de verschillen in effectiviteit. Bètablokkers en calciumantagonisten zijn doorgaans eerste keuze omdat ze de frequentie tijdens inspanning beter reguleren dan digoxine. Digoxine daarentegen is vaak voldoende bij oudere patiënten met
atriumfibrilleren. Uit kortetermijnonderzoeken blijkt dat de
combinatie van een bètablokker met digoxine mogelijk de beste
frequentiecontrole geeft.
Patiënten die sterk symptomatisch blijven ondanks adequate
negatief-chronotrope medicatie, of patiënten die deze medicatie
niet kunnen verdragen, kunnen een AV-knoopablatie met
implantatie van een pacemaker ondergaan. De AV-knoop wordt
dan met behulp van katheterablatie doorgebrand. De patiënt is
daarna pacemakerafhankelijk, maar heeft een rustig hartritme.
Daarna kunnen de negatief-chronotrope medicijnen worden
gestopt. Overleving na een gemiddelde follow-up van drie jaar
is bij patiënten zonder onderliggend hartlijden vergelijkbaar met
de verwachte overleving in de algemene populatie. In een recent
onderzoek werden 99 patiënten met een goede linkerventrikelfunctie en mild tot matig symptomatisch permanent atriumfibrilleren gerandomiseerd naar ofwel AV-knoopablatie en
DEEL E ELEKTROFYSIOLOGIE, RITMESTOORNISSEN EN PACING
implantatie van een pacemaker, of naar farmacologische frequentiecontrole. Bij het begin van het onderzoek was de linkerventrikelfunctie normaal. Na een jaar was er geen verschil in
linkerventrikelfunctie en inspanningsvermogen tussen beide
groepen, terwijl de kwaliteit van leven beter was in de groep die
een AV-knoopablatie onderging. Tegenwoordig zijn er veel aanwijzingen dat pacen in het rechter ventrikel bij patiënten met
een verminderde pompfunctie wel kan leiden tot een verslechtering van de linkerventrikelfunctie. Of pacen in het linker ventrikel of in beide ventrikels (biventriculair pacen) bij deze patiënten nog voordeel kan hebben, is vooralsnog onduidelijk.
Niet-farmacologische behandeling
Katheterablatie van atriumfibrilleren
In de laatste tien jaar is ablatie als behandeling van atriumfibrilleren een belangrijke therapeutische mogelijkheid geworden. Haissaguerre e.a. beschreven als eersten dat in een groep patiënten met
onbehandelbaar paroxismaal atriumfibrilleren ectopische atriale
foci, voornamelijk gelokaliseerd in de longvenen, atriumfibrilleren kunnen induceren. Ablatie van deze foci bleek uiteindelijk
maar matig effectief, dus werd de procedure uitgebreid en werd
overgegaan tot isolatie van de longvenen door middel van transveneuze katheterablatie. Pappone e.a. beschrijven hoge succespercentages van een anatomisch geleide isolatie van de longvenen. In hun handen varieert het succes van 90% bij patiënten met
paroxismaal atriumfibrilleren, tot 80% bij patiënten met persisterend ariumfibrilleren. Deze techniek wordt momenteel steeds
vaker toegepast, ook in Nederland. De succespercentages zijn in
onze handen 60 à 80. Opgemerkt moet worden dat een deel van
de patiënten een antiaritmicum moet blijven gebruiken. Inmiddels
lijkt een dergelijke ablatietechniek ook mogelijkheden te bieden
voor patiënten met onderliggend hartlijden en/of hartfalen.
Door verbeteringen van de procedure, mede door nieuwe technieken zoals verbeterde visualisatie tijdens de ablatie met
behulp van intracardiale echocardiografie of MRI-technieken in
combinatie met het driedimensionale Carto-mappingsysteem,
zal het succes verder toenemen. Het risico op complicaties is op
dit moment nog relatief hoog. In een recent onderzoek bleek dat
wereldwijd bij ruim 525 van de 8700 behandelde patiënten (6%)
ernstige complicaties voorkwamen. Tamponnade en longvenenstenose zijn de meest voorkomende complicaties. Een atrialeoesofageale fistel komt zeer zelden voor maar is wel levensbedreigend. Anno 2007 blijft deze veelbelovende techniek nog
voorbehouden aan sterk symptomatische patiënten met atriumfibrilleren.
Katheterablatie van atriumflutter en atriumtachycardie
Patiënten met een typische atriumflutter ondergaan steeds eerder een curatieve katheterablatie. In een gerandomiseerd prospectief onderzoek vergeleek men medicamenteuze therapie met
katheterablatie. Na een gemiddelde follow-upduur van 21 ±
11 maanden waren meer patiënten in de ablatiegroep in sinusritme (80 versus 36%). Bovendien was het aantal ziekenhuisopnamen significant lager bij de patiënten die met katheterablatie werden behandeld (22 versus 63%) en was de kwaliteit van
leven significant beter.
32
275
ATRIALE RITMESTOORNISSEN
Het vóórkomen van atriumfibrilleren na katheterablatie varieert
afhankelijk van het tevoren voorkomen van atriumfibrilleren
van 8 tot 86%. Patiënten zonder eerder atriumfibrilleren doen
het dus veel beter.
Atriumtachycardie is lastig medicamenteus te behandelen. Ook
bij deze ritmestoornis is katheterablatie zeer effectief. In een
onderzoek waarin 514 patiënten werden ingesloten, werd in
86% van de gevallen succes geboekt.
Mazeoperatie
Mazechirurgie werd in 1987 geïntroduceerd door Cox. Deze procedure is gebaseerd op mappingonderzoek waarbij strategisch
geplaatste incisies de re-entrygolffronten onderbreken, met als
gevolg het voorkomen van atriumfibrilleren. De procedure is
gaandeweg gemodificeerd. Tijdens een mazeoperatie worden
beide hartoren verwijderd, de longvenen geïsoleerd en diverse
incisies in beide atria gemaakt. Dit is een zeer effectieve behandeling. Het succes op lange termijn is 80-90%, zonder antiaritmische medicatie. Daarnaast blijft de atriumcontractie (grotendeels)
behouden en verbeteren de kwaliteit van leven, het inspanningsvermogen en de linkerventrikelfunctie. Natuurlijk zijn er complicaties, maar die wegen ruimschoots op tegen de enorme winst die
wordt behaald. Deze ingreep, eventueel in een iets gemodificeerde vorm, kan bij patiënten met (een voorgeschiedenis van) atriumfibrilleren ook worden uitgevoerd in combinatie met andere
hartchirurgie, bijvoorbeeld klepvervanging. Tegenwoordig gaat
de voorkeur uit naar bovengenoemde katheterablatie.
Atriaal pacen
Gerandomiseerde onderzoeken hebben aangetoond dat pacen
(stimuleren) in het atrium met een pacemaker bij patiënten met
een bradycardie het optreden van atriumfibrilleren beter voorkomt dan bij patiënten die in het ventrikel worden gepaced.
Pacen in het atrium ter preventie van atriumfibrilleren zonder
onderliggende geleidingsstoornis is nog steeds een experimentele behandeling. Overtuigende effectiviteit is niet aangetoond.
Atriale defibrillator
Het effect van een atriale defibrillator ter preventie van atriumfibrilleren werd onderzocht bij 51 patiënten met onbehandelbaar
atriumfibrilleren. Gedurende een follow-up van 259 dagen werd
96% van de 227 episoden van atriumfibrilleren succesvol gecardioverteerd. De atriale defibrillator ontdekt atriumfibrilleren kort
na het ontstaan en kan of automatisch, of door patiënt of arts
worden geactiveerd en een shock afgeven. Theoretisch is dit een
interessante behandelingsmogelijkheid die echter geen hoge
vlucht zal nemen, omdat het atriumfibrilleren niet wordt voorkomen, de shock pijnlijk is en de nieuwe ablatietechnieken deze
vorm van behandeling eigenlijk overbodig hebben gemaakt.
Nieuwe ontwikkelingen bij atriumfibrilleren
Primaire preventie, zoals bij patiënten met hartfalen en atriumfibrilleren:
• remmer van het angiotensineconverterend enzym en
angiotensinereceptorblokkers lijken bij deze patiënten
nieuwe atriale ritmestoornissen te voorkomen;
• onderzoek wordt gedaan naar nieuwe typen ‘antiaritmica’.
Eerder een agressieve maar effectieve behandeling met
katheterablatie:
• door verbeteringen van de procedure, mede door nieuwe
technieken, zal het succes verder toenemen.
Wat is de rol van atriumfibrilleren bij patiënten met hartfalen? Toekomstig onderzoek zal ons daar meer over leren.
32.3.3 Antistolling
Tijdens niet-reumatisch atriumfibrilleren is er een één- tot vijfmaal verhoogd risico op trombo-embolische complicaties.
Risicofactoren voor het optreden van trombo-embolische complicaties zijn onder andere leeftijd > 65 jaar, (voorgeschiedenis
van) hypertensie, hartfalen, mitralisklepstenose, diabetes mellitus, verminderde linkerventrikelfunctie, coronairlijden of een
eerder doorgemaakte trombo-embolische complicatie. In grote
onderzoeken is het effect van vitamine-K-antagonisten (onder
andere acenocoumarol) ter preventie van trombo-embolische
complicaties bij patiënten met atriumfibrilleren aangetoond.
Recent is duidelijk geworden dat ook indien het sinusritme
wordt hersteld, antistolling moet worden doorgegeven wanneer
er risicofactoren voor trombo-embolische complicaties aanwezig zijn.
In tabel 32.5 is aangegeven wanneer wel en wanneer niet vitamine-K-antagonisten dan wel acetylsalicylzuur moet worden
voorgeschreven aan patiënten met (doorgemaakt) atriumfibrilleren. Geadviseerd wordt dit mede in overleg met de patiënt te
doen en daarbij steeds de voor- en nadelen van antistollingstherapie af te wegen. Aangeraden wordt bij de aanwezigheid van
één hoogrisicofactor of twee gematigde risicofactoren te kiezen
voor profylactische behandeling met vitamine-K-antagonisten.
Bij één gematigde risicofactor kan men kiezen voor een vitamine-K-antagonist of acetylsalicylzuur, en is er geen enkele risicofactor, dan kan of niets worden gegeven of acetylsalicylzuur. Let
wel: deze adviezen gelden voor alle soorten atriumfibrilleren,
dus ook voor paroxismaal atriumfibrilleren, en ook voor atriumflutter en -tachycardie. Alternatieven voor vitamine-K-antagonisten zijn in ontwikkeling.
Tabel 32.5 Risicostratificatie voor primaire preventie van tromboembolische complicaties.
hoog risico
gematigd risico
– eerdere TEC/embolie
− leeftijd 65-75 jaar
– (behandelde)
− coronairlijden
hypertensie
− diabetes mellitus
– leeftijd > 75 jaar
– slechte linkerventrikelfunctie
– kunstklep
– reumatisch kleplijden
– twee of meer gematigde
risicofactoren
laag risico
− leeftijd < 65 jaar
− geen risicofactoren
276
DEEL E ELEKTROFYSIOLOGIE, RITMESTOORNISSEN EN PACING
32.4 Conclusie
Atriale ritmestoornissen en vooral atriumfibrilleren zijn veelvoorkomende afwijkingen. Vaak zijn ze het gevolg van een
onderliggende (hart)ziekte. Als eerste moet altijd worden
gezocht naar behandelbare uitlokkende factoren. De keuze van
behandeling, ritme- of frequentiecontrole, hangt vooral af van
de mate waarin een patiënt klachten van de ritmestoornis ondervindt. Frequentiecontrole kan bij veel patiënten als therapie van
eerste keuze worden toegepast. Toekomstig onderzoek zal zich
richten op preventie van atriumfibrilleren bij patiënten met een
hoog risico (hypertensie, hartfalen), en op verbetering van (niet-)
farmacologische ritmecontrole bij sterk symptomatische patiënten.
Kernpunten
• Maak onderscheid tussen diverse typen atriale ritmestoornissen:
– atriumtachycardie: tachycardie met origine in de atria
buiten de sinusknoop;
– typische atriumflutter: atriumfrequentie 300 slagen/
min, onbehandeld veelal 2:1 blok met ventrikelfrequentie van 150 slagen/min; zaagtand;
– atypische atriumflutter: zeldzaam, andere atriumfrequentie en elektrocardiografische configuratie;
– atriumfibrilleren: chaotisch atriumritme (geen P-toppen
op elektrocardiogram maar fibrillatiegolven); snelle en
onregelmatige ventrikelfrequentie.
• Onderliggende mechanismen van atriale ritmestoornissen
zijn van belang voor de behandelingsmogelijkheden:
– atriumtachycardie: abnormale automatie (triggered
activity) of microre-entry;
– typische atriumflutter: macrore-entry rechter atrium;
– atypische atriumflutter: abnormale automatie (triggered activity) of macrore-entry;
– atriumfibrilleren: chaotisch atriumritme (geen P-toppen op elektrocardiogram maar fibrillatiegolven); snelle en onregelmatige ventrikelfrequentie;
– Complicaties van atriale ritmestoornissen: hartkloppingen, moeheid, kortademigheid, druk op de borst, trombo-embolische complicaties, hartfalen, verhoogde
mortaliteit, waarschijnlijk gerelateerd aan een onderliggende hartziekte.
• Atriale ritmestoornissen: zoek en behandel eerst het
onderliggende lijden!
– Conversie van paroxismaal atriumfibrilleren/-flutter
naar sinusritme met behulp van respectievelijk een
klasse-IC-antiaritmicum (flecaïnide, atriumfibrilleren)
of klasse-III-antiaritmicum (sotalol, atriumflutter) of
elektrische cardioversie. Conversie van persisterend
atriumfibrilleren/-flutter naar sinusritme met behulp
van elektrische cardioversie.
– Preventie van atriumfibrilleren en andere atriale ritmestoornissen (ritmecontrole) met antiaritmica is niet
altijd eerste keuze. Steeds vaker kan bij relatief asymptomatische patiënten worden gekozen voor acceptatie
(frequentiecontrole).
• Indien antiaritmica voor het behoud van sinusritme ineffectief zijn, is katheterablatie een belangrijke nieuwe
therapie, vooral bij patiënten die (sterk) symptomatisch
zijn, eventueel al na falen van één antiaritmicum.
• De optimale hartfrequentie tijdens atriumfibrilleren is
onbekend. Vaak wordt onvoldoende aandacht besteed aan
de controle van de hartfrequentie tijdens atriumfibrilleren,
zeker indien behoud van sinusritme wordt nagestreefd.
Literatuur
Allessie MA, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res.
2002;54:230-46.
Allessie MA, Bonke FI, Schopman FJ. Circus movement in rabbit atrial muscle as a mechanism of tachycardia. III. The ‘leading
circle’ concept: a new model of circus movement in cardiac tissue without the involvement of an anatomical obstacle. Circ Res.
1977;41:9-18.
Blomström-Lundqvist C, Scheinman MM, Aliot EM, Alpert JS, Calkins H, Camm AJ, et al. ACC/AHA/ESC guidelines for the
management of patients with supraventricular arrhythmias – executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop guidelines for the management of patients with supraventricular arrhythmias)
developed in collaboration with NASPE-Heart Rhythm Society. J Am Coll Cardiol. 2003;42:1493-531.
Cox JL, Schuessler RB, D’Agostino HJ Jr, Stone CM, Chang BC, Cain ME, et al. The surgical treatment of atrial fibrillation. III.
Development of a definitive surgical procedure. J Thorac Cardiovasc Surg. 1991;101:569-83.
Fuster V, Ryden LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA et al. ACC/AHA/ESC guidelines for the management of
patients with atrial fibrillation: executive summary. A report of the American College of Cardiology/American Heart Association
Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (writing committee to revise 2001 guidelines for the management of patients with atrial fibrillation) developed in collaboration with the European
Heart Rhythm Association and the Heart Rhythm Society. Eur Heart J. 2006;27:1979-2030.
32
ATRIALE RITMESTOORNISSEN
277
Gelder IC van, Hagens VE, Bosker HA, Kingma JH, Kamp O, Kingma T, et al. A comparison of rate control and rhythm control
in patients with recurrent persistent atrial fibrillation. N Engl J Med. 2002;347:1834-40.
Haissaguerre M, Jais P, Shah DC, Takahashi A, Hocini M, Quiniou G, et al. Spontaneous initiation of atrial fibrillation by ectopic
beats originating in the pulmonary veins. N Engl J Med 1998;339:659-66.
Miyasaka Y, Barnes ME, Gersh BJ, Cha SS, Bailey KR, Abhayaratna WP, et al. Secular trends in incidence of atrial fibrillation in
Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation.
2006;114:119-25.
Moe GK, Abildskov JA. Atrial fibrillation as a self-sustaining arrhythmia independent of focal discharge. Am Heart J.
1959;58:59-70.
Pappone C, Rosanio S, Augello G, Gallus G, Vicedomini G, Mazzone P, et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized long-term study. J Am
Coll Cardiol. 2003;42:185-97.
Rensma PL, Allessie MA, Lammers WJ, Bonke FI, Schalij MJ. Length of excitation wave and susceptibility to reentrant atrial
arrhythmias in normal conscious dogs. Circ Res. 1988;62:395-410.
Vaughan Williams EM. A classification of antiarrhythmic actions reassessed after a decade of new drugs. J Clin Pharmacol.
1984;24:129-47.
Wijffels MC, Kirchhof CJ, Dorland R, et al. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented
goats. Circulation. 1995;92:1954-68.
Wyse DG, Waldo AL, DiMarco JP, Domanski MJ, Rosenberg Y, Schron EB, et al. A comparison of rate control and rhythm
control in patients with atrial fibrillation. N Engl J Med. 2002;347:1825-33.