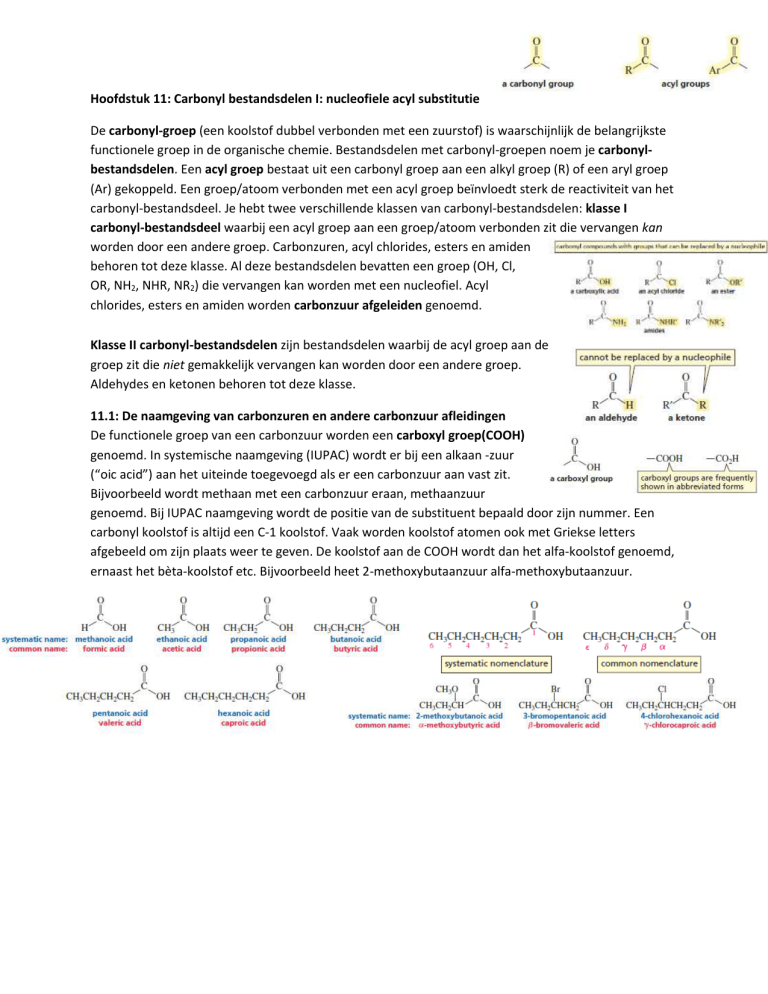
Hoofdstuk 11: Carbonyl bestandsdelen I: nucleofiele acyl substitutie
De carbonyl-groep (een koolstof dubbel verbonden met een zuurstof) is waarschijnlijk de belangrijkste
functionele groep in de organische chemie. Bestandsdelen met carbonyl-groepen noem je carbonylbestandsdelen. Een acyl groep bestaat uit een carbonyl groep aan een alkyl groep (R) of een aryl groep
(Ar) gekoppeld. Een groep/atoom verbonden met een acyl groep beïnvloedt sterk de reactiviteit van het
carbonyl-bestandsdeel. Je hebt twee verschillende klassen van carbonyl-bestandsdelen: klasse I
carbonyl-bestandsdeel waarbij een acyl groep aan een groep/atoom verbonden zit die vervangen kan
worden door een andere groep. Carbonzuren, acyl chlorides, esters en amiden
behoren tot deze klasse. Al deze bestandsdelen bevatten een groep (OH, Cl,
OR, NH2, NHR, NR2) die vervangen kan worden met een nucleofiel. Acyl
chlorides, esters en amiden worden carbonzuur afgeleiden genoemd.
Klasse II carbonyl-bestandsdelen zijn bestandsdelen waarbij de acyl groep aan de
groep zit die niet gemakkelijk vervangen kan worden door een andere groep.
Aldehydes en ketonen behoren tot deze klasse.
11.1: De naamgeving van carbonzuren en andere carbonzuur afleidingen
De functionele groep van een carbonzuur worden een carboxyl groep(COOH)
genoemd. In systemische naamgeving (IUPAC) wordt er bij een alkaan -zuur
(“oic acid”) aan het uiteinde toegevoegd als er een carbonzuur aan vast zit.
Bijvoorbeeld wordt methaan met een carbonzuur eraan, methaanzuur
genoemd. Bij IUPAC naamgeving wordt de positie van de substituent bepaald door zijn nummer. Een
carbonyl koolstof is altijd een C-1 koolstof. Vaak worden koolstof atomen ook met Griekse letters
afgebeeld om zijn plaats weer te geven. De koolstof aan de COOH wordt dan het alfa-koolstof genoemd,
ernaast het bèta-koolstof etc. Bijvoorbeeld heet 2-methoxybutaanzuur alfa-methoxybutaanzuur.
Acyl chlorides hebben een Cl in plaats van een OH groep bij het carbonzuur. De naamgeving wordt dan
overal -oylchloride (“yl chloride”) erachter. Methaanzuur wordt dan bijvoorbeeld methaanoylchloride.
Esters hebben een OR groep in plaats van de OH groep bij het carbonzuur. Bij de naamgeving
van een ester wordt de R groep aan de carboxyl-zuurstof eerst genoemd, gevolgd door de
naam van de groep met –oaat erachter. Bij ester zouten wordt dan eerst het elektrofiel
genoemd.
Een amide heeft een NH2, NHR of NR2 groep in de plaats van de OH groep bij carbonzuren. Bij de
naamgeving zet je amide erachter. Als een substituent gebonden is aan een stikstof, wordt eerst de
naam van de substituent gezegd , gevolgd door de naam van de amide. De naam van elke substituent
wordt voor af gegaan met een hoofdletter N om aan te geven dat de substituent gebonden is aan een
stikstof (nitrogeen).
11.2: De structuren van carbonzuren en carbonzuur afgeleiden
De carbonyl-koolstof bij carbonzuren en afgeleiden daarvan zijn sp2 gehybridiseerd.
Het carbonyl-koolstof gebruikt zijn drie sp2 orbitalen om σ bindingen te maken met de
carbonyl zuurstof, de alfa-koolstof en de substituent (Y). Deze drie atomen gebonden
aan de carbonyl-koolstof liggen allemaal in hetzelfde vlak en hebben een hoek van 120
graden onderling. De carbonyl-zuurstof is ook sp2 gehybridiseerd. Één van zijn sp2
orbitalen maakt een σ-binding met de carbonyl-koolstof, twee sp2 orbitalen vormen lone pairs en de
overige p orbitaal vormt een π-binding.
Esters, carbonzuren en amiden hebben altijd twee resonantie bijdragers. De resonantie bijdrager aan
de rechterkant draagt meer bij aan de hybdride in de amide dan in de ester of carbonzuur, omdat het
minder elektronegatief stikstofatoom beter een positieve lading verdraagt.
11.5: Hoe carbonzuren en carbonzuur-bestandsdelen reageren
De reactiviteit van carbonyl-bestandsdelen komt door de polariteit van de carbonyl-groep dat
veroorzaakt wordt doordat zuurstof meer elektronegatief dan koolstof is. Het carbonyl-koolstof is
daarom elektrofiel en wordt daardoor aangevallen door nucleofielen. Als een nucleofiel de koolstof
aanvalt, wordt de zwakste verbinding (de C=O) verbroken en een intermediair gevormd. Dit intermediair
wordt een tetrahedrale intermediair genoemd, omdat de sp2 koolstof een sp3 koolstof is geworden in
het intermediar. Over het algemeen zal een bestandsdeel dat een sp3 koolstof gebonden heeft aan een
zuurstofatoom meer instabiel zijn dan een sp3 koolstof gebonden aan een ander koolstofatoom. Het
tetrahedrale intermediair zal hierdoor onstabiel zijn omdat zowel Y- als Z- elektronegatieve atomen zijn.
De lone pair op de zuurstof vormt opniew een π-binding en of Y- of Z- wordt eruit geduwd. Of nu Y- of Zeruit wordt geduwd is afhankelijk van hun relatieve base-strekte. De zwakkere base wordt er
gemakkelijker uitgeduwd -> hoe zwakker de base, hoe beter zijn leaving group is. Omdat een zwakke
base zijn elektronen niet zo gemakkelijk deelt als een sterke base doet, zal een zwakkere base een
zwakkere binding vormen die gemakkelijk te verbreken is. Als Z- een zwakkere base is dan Y-, zal Z- eruit
worden geduwd. In dat geval zal er geen nieuw product gevormd worden. De nucleofiel valt de
carbonyl-koolstof aan, maar de tetrahedrale intermediair verdrijft de aanvallende nucleofiel.
Aan de andere kant als Y- een veel zwakkere base is dan Z-, zal Y- eruit worden geduwd en zal er een
nieuw product gevormd worden. Deze reactie wordt een nucleofiele acyl substitutie reactie genoemd
omdat een nucleofiel (Z-) de substituent (Y-) vervangt die aan de acyl groep gebonden zat.
Als de base van Y- en Z- gelijk zijn aan elkaar, zullen sommige moleculen van het tetrahedrale
intermediair Y- eruit gooien en andere juist Z- eruit gooien. Wanneer de reactie over is, zullen zowel
reactant als product aanwezig zijn. We kunnen dan ook zeggen: een carbonzuur afgeleide zal een
nucleofiele acyl substitutie reactie ondergaan, als gegeven is dat de adderende groep aan de
tetrahedrale intermediair geen zwakkere base is dan de groep die aan de acyl-groep zit.
11.6: Relatieve reactiviteiten van carbonzuur en carbonzuur afgeleiden
We hebben net gezien dat er twee stappen zijn in de nucleofiele acyl substitutie reactie: vorming van
een tetrahedrale intermediair en het uiteenvallen van het tetrahedrale intermediair. Hoe zwakker de
base aan de acyl-groep is, hoe gemakkelijker het is dat beide
stappen plaatsvinden. Hoe minder basisch de substituent is, hoe
meer reactief de carbonzuur afgeleide is.
Een zwakkere base is een meer elektronegatieve base. Hierdoor zal deze gemakkelijker elektronen
wegtrekken van het carbonyl-koolstofatoom, hierdoor deze kwetsbaar makend voor een aanval van een
nucleofiel. Dit vergemakkelijkt de eerste stap. Maar ook de tweede stap wordt vergemakkelijkt door
zwakke bases, deze zijn namelijk verbonden met een zwakke binding en dus gemakkelijker eruit te
gooien.
De carbonzuur afgeleide kan worden omgezet in een minder reactieve carbonzuurafgeleide, maar niet in
eentje die meer reactief is. Een acyl chloride zal bijvoorbeeld omgezet worden tot een ester, omdat een
alkoxideion, zoals een methoxide ion, een sterkere base is dan een chloride ion. Een ester kan dus niet
omgezet worden in een aceyl chloride , omdat een chloride ion een zwakkere base is dan een alkoxide
ion.
11.7: De reactie van acyl chlorides
Acyl chlorides reageren met alcoholen van esters, met water van carbonzuren en met amines tot
amides, omdat telkens de inkomende nucleofiel een sterkere base is dan de uitgaande chloride ion.
Alle carbonzuur afgeleides ondergaan een nucleofiele acyl
substitutie reactie door één van de volgende mechanismes. Het
enige verschil in de twee mechanismes is of de nucleofiel
neutraal of geladen is.
Mechanisme van conversie van een acyl chloride tot een ester
(met een neutraal geladen nucleofiel):
- De nucleofiel valt de carbonyl-koolstof aan, hiermee
een tetrahedrale intermediair vormend.
- De proton laat los voordat de tetrahedrale intermediair ineenvalt.
- De tetrhedrale intermediar valt in elkaar terwijl het de zwakkere base eruit stoot.
Mechanisme van conversie van een acyl chloride tot een ester (met een negatief geladen nucleofiel):
- De nucleofiel valt de carbonyl-koolstof aan, hiermee een tetrahedrale intermediair vormend.
- De tetrahedrale intermediair valt ineen terwijl het de zwakkere base eruit gooit.
11.8: De reactie van esters
Esters reageren niet met Cl- omdat het een veel zwakkere base is dan de RO- leaving groep van de ester.
Een ester regeert met water tot een carbonzuur en een alchol. Dit is een voorbeeld van een hydrolyse
reactie, hierbij vormt een reactie met water van één bestandsdeel twee bestandsdelen.
Een ester reageert met een alcohol tot een nieuwe ester en een nieuwe alcohol. Dit is een voorbeeld
van een alcoholyse reactie- een reactie met een alcohol waarbij er uit één bestandsdeel twee
bestandsdelen worden gemaakt. Dit wordt ook wel een transesterificatie reactie genoemd omdat een
ester omgezet wordt in een andere ester. Beide reacties zijn zeer langzaam omdat water en alcholen
slechte nucleofielen zijn en esters zwakke (basische) leaving groups hebben. Deze reactie worden vaak
dan ook gekatalyseerd door het toevoegen van een zuur (HCl bijvoorbeeld). Esters reageren ook met
amines tot amides. Een reactie waarbij een amine één bestandsdeel omzet tot twee bestandsdelen
wordt aminolyse genoemd. Omdat amine een beter nucleofiel is, gaat deze reactie sneller.
11.9: Zuur-gekatalyseerde ester hydrolyse
De snelheid van hydrolyse kan dus verhoogd worden met behulp van een zuur. Wanneer een zuur wordt
toegevoegd aan de reactie, zal het zuur als eerste het atoom protoneren in de reactant die de grootste
elektronendichtheid heeft, dus het meest basisiche atoom.
Mechanisme van zuur-gekatalyseerde ester hydrolyse:
-
Het zuur protoneerd de carbonyl-zuurstof.
Het nucleofiel (H2O) valt de carbonyl-koolstof
aan van de geprotoneerde carbonyl groep,
hiermee een tetrahedrale intermediar I
vormend.
- Tetrahedrale intermediair I is in evenwicht met
zijn niet-geprotoneerde vorm (tetrahedrale intermediair II).
- Zo snel als het tetrahedrale intermediair II is gevormd, kunnen zowel de OH als de OCH3 groep
van intermediaire I geprotoneerd worden; de ene keer tetrahedrale intermediair I (OH
geprotoneerd) vormend en de andere keer tetrahedrale intermediair III (OCH3 geprotoneerd)
vormend.
- Wanneer het tetrahedrale intermediair I in elkaar valt, gooit het eerder H2O eruit dan CH3O(omdat H2O een zwakkere base is) en vormt een ester. Wanneer het tetrahedrale intermediair III
in elkaar valt, gooit het CH3OH er eerder uit dan HO- (omdat CH3OH een zwakkere base is) en
vormt een carbonzuur.
Omdat zowel H2O als CH3OH ongeveer dezelfde base sterkte hebben, zal zowel het tetrahedrale
intermediair I als III in een vallen en resprectievelijk een ester en carbonzuur vormen. Uiteindelijk zal de
concentratie bij een evenwichtstoestand gelijk zijn. Het zuur wat toegevoegd is, werkt als een
katalysator en versneld de vorming van het tetrahedrale intermediair en het ineenvallen ervan. Hij
versnelt de vorming ervan door het protoneren van de carbonyl-zuurstof (geprotoneerde carbonylgroepen zijn meer kwetsbaar voor nucleofiele aanvallen omdat een positief geladen zuurstof meer
elektronen wegtrekt dan een neutraal geladen zuurstof). Het zuur versneld ook de invalling van het
tetrahedrale intermediair door het verminderen van de base sterkte van de leaving group, zodat de
leaving group gemakkelijker eruit kan gaan.
Transesterificatie wordt ook gekatalyseerd door een zuur. Het mechanisme is precies hetzelfde maar
dan is het nucleofiel ROH in plaats van H2O. De twee leaving groups in het gevormde tetrahedrale
intermediair hebben ongeveer dezelfde base sterkte. Dus in evenwicht zullen beide esters in dezelfde
hoeveelheid aanwezig zijn.
11.11: Reacties van carbonzuren
Carbonzuren kunnen een nucleofiele acyl substitutie ondergaan, alleen als ze in hun zuurvorm zijn. De
basische vorm heeft een negatief geladen carboxylaat ion en is daarom bestand tegen nucleofiele
aanvallen. Carbonzuren hebben ongeveer dezelfde reactiviteit als esters, omdat de HO- leaving group
van een carbonzuur ongeveer dezelfde base sterkte heeft als de RO- leaving group van een ester.
Daarom zullen carbonzuren ook niet met chloride ionen reageren. Carbonzuren reageren met alcoholen
tot esters. De reactie moet onder zure omstandigheden plaats vinden, niet alleen voor katalysatie maar
ook om het carbonzuur in zijn zure vorm te houden zodat het kan reageren met het nucleofiel.
Omdat het tetrahedrale intermediair gevormd bij deze reactie twee potentiele leaving groups hebben
van dezelfde base sterkte, zullen zowel carbonzuur als ester in dezelfde hoeveelheden aanwezig zijn bij
evenwicht. De Fischer esterificatie is het reageren van een
carbonzuur met een alcohol tot een ester (met aanweizgheid
van een zuur).
Carbonzuren ondergaan geen nucleofiele acyl substitutie reacties
met amines. Omdat een carbonzuur een zuur is en een amine een
base, zal de carbonzuur meteen een proton doneren aan de amine.
Het resulterende ammonium carboxylaatzout is meteen het
eindproduct van de reactie: het carboxylaat ion is onreactief en de
geprotoneerde amine is niet een nucleofiel.
11.12: Reactie van amides
Amides zijn hele onreactieve bestandsdelen. Ze reageren niet met chloride ionen, alcoholen of water,
omdat in elk geval de inkomende nucleofiel een zwakkere base is dan de leaving group van de amide.
Amides reageren echter wel met water en alcholen als de reactie verhit wordt in de aanwezigheid van
een zuur.
11.13: Zuur-gekatalyseerde amide hydrolyse
Het mechanisme voor zuur-gekatalyseerde hydrolyse van een amide is hetzelfde als bij die van een
ester.
Mechanisme van zuur-gekatalyseerde hydrolse van een
amide:
- Het zuur protoneerd de carbonyl-zuurstof
waardoor de carbonyl-koolstof gemakkelijker
aangevallen kan worden door een nucleofiel.
- Een nucleofiele aanval door water op de
carbonyl-koolstof leidt tot een tetrahedraal
intermediair I, welke in evenwicht is met zijn niet
geprotoneerde vorm: het tetrahedrale
intermediair II.
- Her-protonatie van het tetrahedrale intermediair
II kan zowel op het zuurstofatoom gebeuren tot
het tetrahedrale intermediair I of op de stikstof tot het tetrahedrale intermediair III. Protonatie
van stikstof gebeurd eerder omdat NH2 een sterkere base is dan de OH groep.
- Van de twee mogelijke leaving groups van het tetrahedrale intermediair III (HO- en NH3) is NH3
de zwakkere base. Deze wordt eruit gegoooid en een carbonzuur wordt gevormd als
eindproduct.
- Omdat de reactie uitgevoerd wordt in een zure oplossing, zal NH3 geprotoneerd worden nadat
het uit het tetrahedrale intermediair is gegooid. Dit zorgt ervoor dat de reactie niet de andere
kant op kan gaan omdat NH4+ geen nucleofiel is.
Zonder katalysator zal de amide niet geprotoneerd worden.
Daarom zal water, een zeer zwak nucleofiel, de neutrale
amide moeten aanvallen die veel minder kwetsbaar is voor
een nucleofiele aanval dan de geprotoneerde amide.
11.14: De synthese van carbonzuur afgeleiden
We hebben gezien dat carbonzuren relatief onreactief zijn naar nucleofiele acyl substituatie reacties
omdat de OH groep van de carbonzuur een sterke base is en dus een slechte leaving group. Daarom
moet het carbonzuur eerst geactiveerd worden. De makkelijkste manier is door het adderen van een
nucleofiel tot een acyl chloride. Carbonzuren worden dan ook geativeerd door ze om te zetten naar acyl
chlorides. Dit kan worden gedaan door de carbonzuur te verhitten met SOCl2, deze reagent vervangt de
OH groep met Cl. Wanneer de acyl chloride is gevormd, kan je gemakkelijk esters en amides
synthetiseren door het toevoegen van een geschikt nucleofiel.
Hoofdstuk 12: carbonyl-bestandsdelen II
Carbonyl-bestandsdelen konden in twee klassen opgedeeld worden: klasse I was met een groep die
vervangen kon worden door een nucleofiel en klasse II was met een groep die niet vervangen kon
worden met een nucleofiel, zoals ketonen en aldehydes. De simpelste aldehyde is formaldehyde
(CH2=O). Aldehydes zijn carbonyl-koolstoffen gebonden aan een zuurstof en een alkyl (of aryl) groep.
Een keton is een carbonyl-koolstof gebonden aan twee alkyl (of aryl) groepen. Aldehydes en ketonen
hebben geen groep die vervangen kunnen worden door andere groepen omdat H- en R- te sterke basen
zijn en niet vervangen kunnen worden door een nucleofiel.
12.1: Naamgeving van aldehydes en ketonen
De systematische naam van een aldehyde krijg je daar –al aan het einde van de
naam te zetten. Dus de aldehyde van ethaan wordt ethanal, de aldehyde van
methaan wordt methanal. De positie van de aldehyde groep is
altijd op 1. Soms wordt ook hier gebruik gemaakt van Griekse
letters om de positie weer te geven.
De systematische naam van een keton krijg je door –on toe te voegen
aan het uiteinde van de naam. Ethaan wordt hierbij bijvoorbeeld
ethanon en methaan methanon. De keten wordt genummerd in de
richting dat de carbonyl-koolstof het laagste cijfer krijgt. Het kleinste
keton is propanon en wordt vaak aceton genoemd.
12.2: Relatieve reactiviteiten van carbonyl-bestandsdelen
We weten dat een carbonyl-groep polair is door zijn zuurstof,
die meer elektronegatief dan koolstof en dus een groter
aandeel heeft in de elektronen van de dubbele binding. De
gedeeltelijk positieve lading op de carbonyl-koolstof zorgt
ervoor dat het aangevallen wordt door nucleofiele-bestandsdelen. Een aldehyde heeft een
grotere positieve lading op zijn carbonyl-koolstof dan een keton omdat de waterstof een
elektron sterker wegtrekt vergeleken met een alkyl groep. Een aldehyde is daarom ook meer
kwetsbaar voor een nucleofiele aanval. Sterische factoren vergroten ook de reactiviteit van een
aldehyde. De carbonyl-koolstof van een aldehyde is beter aan te vallen door een nucleofiel dan
de carbonyl-koolstof van een keton, omdat de waterstof aan de carbonyl-koolstof van een aldehyde
kleiner is dan de twee alkyl groep aan de carbonyl-koolstof van een keton. Ketonen met kleine alkyl
groepen gebonden aan de carbonyl-koolstof zullen meer reactief zijn dan ketonen met grote alkyl
groepen. Aldehydes en ketonen zijn minder reactief dan acyl chlorides maar meer reactief dan esters,
carbonzuren en amides.
12.3: Hoe aldehydes en ketonen reageren
De carbonyl-groep van een carbonzuur of carbonzuur afgeleides zitten aan een
groep die vervangen kan worden met een andere groep. Dit kan niet bij
aldehydes of ketonen. Daarom zul je in plaats van een nucleofiele acyl substitutie
een nucleofiele additie krijgen.
12.4: Grignard reagentia
Grignard reagentia worden veel gebruikt voor koolstof-nucleofielen. Ze worden voorbereid door het
toevoegen van een alkyl-halide (zoals bijvoorbeeld CH3CH2Br) aan magnesium in een diethyl ether
oplossing. Grignard reagentia reageren alsof ze carbanions zijn, dus als een soort zout. Grignard
reagentia hebben een nucleofiele koolstof omdat de koolstof gebonden aan een atoom minder
elektronegatief is dan een koolstof niet gebonden aan een ander atoom. Deze nucleofiele koolstof
reageert weer met een elektrofiel. De koolstof van een Grignard reagens is
nucleofiel omdat het aan een atoom zit die minder elektronegatief is, de
koolstof van de alkyl-halide is elektrofiel omdat het aan een atoom zit dat meer
elektronegatief is dan de koolstof.
Grignard reagentia zijn zulke sterke basen dat ze meteen met elk zuur zullen
reageren, ookal is dit zuur in lage concentratie of heel zwak, zoals water,
alcohol of amides. Als dit gebeurt, wordt de Grignard reagens omgezet tot
een alkaan.
12.6: De reactie van carbonyl-bestandsdelen met hybdride-ionen
Een hydride ion is een sterke basisch nucleofiel dat reageert met aldehydes en ketonen tot nucleofiele
additie producten. Het mechanisme wordt hieronder beschreven.
Mechanisme voor de ractie van een aldehyde of keton met een hydride
ion:
-
Nucleofiele aanval van een hydride ion op de carbonyl-koolstof vormt een alkoxide ion.
Op volgende protonatie van een zuur produceert een alcohol. De reactie voegt dus H2 toe aan
de carbonyl-groep.
De additie van een waterstof aan een organisch bestandsdeel is altijd een reductie reactie.
Aldehydes en ketonen worden gemakkelijk gereduceerd door het boorhybride (NaBH4)
fungerendals hydroxide ion. Aldehydes worden gereduceerd tot primaire alcoholen en ketonen
worden gereduceerd tot secundaire alcoholen. Let wel op dat het zuur pas na de eerste stap
met het hydroxide ion wordt toegevoegd!
Omdat klasse I carbonyl-bestandsdelen een groep hebben die vervangen kan worden door een andere
groep, ondergaan ze twee opeenvolgende reacties met het hybride ion, net zoals ze twee
opeenvolgende reactie ondergaan met de Grignard reagens. Hierdoor zal de reactie van een acyl
chloride met natriumboorhydride een alcohol vormen. Het mechanisme hiervoor wordt hieronder
gegeven:
Mechanisme voor de reactie van een acyl chloride met een hydride ion:
-
-
De acyl chloride ondergaat een nucleofiele acyl substitutie reactie omdat het een groep (Cl-)
heeft die vervangen kan worden met een hybride ion. Het product van deze reactie is een
aldehyde.
De aldehyde ondergaat vervolgens een nucleofiele additie reactie met een tweede hybride ion,
hierbij een alkoxide ion vormend.
Protonatie van de alkoxide ion geeft een primaire alcohol.
NaBH4 is niet een sterk genoeg hybride donor om te reageren met carbonyl-bestandsdelen die minder
reactief zijn dan aldehyde en ketonen. Daarom moeten esters, carbonzuren en amides gereduceerd
worden met lithium aluminum hydride (LiAlBH4), een meer reactieve hybride donor.
De reactie van een ester met LiAlH4 produceert twee alcoholen, de een
corresponderend met de acyl gedeelte van de ester en de andere met de
alkyl gedeelte.
De reactie van een carbonzuur met LiAlBH4 vormt een primaire alcohol.
Amides ondergaan ook twee opeenvolgende additie reacties van een hybride ion wanneer ze reageren
met LiAlBH4. De reactie zet een carbonyl-groep om in een CH2 groep. Daarom is het product van de
reactie een amine. Primaire, secundaire en tertiaire amines kunnen gevormd worden, afhankelijk van
het aantal substituenten gebonden aan de stikstof van de amide. Merk op dat hier eerder H2O wordt
gebruikt dan H3O+, deze zou namelijk de stikstof protoneren en dus een ammonium ion vormen.
12.8: De reactie van aldehydes en ketonen met water
De additie van water aan een aldehyde of keton vormt een hydraat. Een hydraat is een molecuul met
twee OH groepen op hetzelfde koolstofatoom. Hydraten van aldehydes en ketonen zijn over het
algemeen te onstabiel om geïsoleerd te worden omdat de tetrahedrale atoom aan twee elektronzuigende (zuurstof) atomen zit.
Water is een zwak nucleofiel en reageert daarom langzaam met de carbonyl-groep. Door middel van een
katalysator (een zuur) kan de reactie versneld worden. Het mechanisme wordt hieronder weergeven:
Mechanisme van zuur-gekatalyseerde hydraat vorming:
-
Het zuur protoneert de carbonyl-zuurstof, waardoor de carbonyl-koolstof kwetsbaarder wordt
voor nucleofiele aanval.
- Water valt de carbonyl-koolstof aan.
- Verlies van een proton van de geprotoneerde tetrahedrale intermediair geeft de hydraat.
De hoeveelheid van ketonen en aldehydes die omgezet wordt tot hydraten, is afhankelijk van de
substituenten op de carbonyl-bestandsdeel. Grote substituenten verlagen het percentage van hydraat
aanwezigheid in evenwichtstoestand, waarbij kleine substituenten en elektonopzuigende substituenten het juist doen toenemen.
Hoofdstuk 13: Carbonyl-bestandsdelen III
Bij carbonyl-bestandsdelen is de site van de reactiviteit op de gedeeltelijk positief geladen carbonylkoolstof, welke aangevallen wordt door nucleofielen.
Aldehydes en ketonen hebben een tweede site van reactiviteit. Een waterstof gebonden aan de koolstof
naast de carbonyl-koolstof is zuur genoeg om te worden verwijderd door
een sterke base. Deze koolstof naast de carbonyl-koolstof wordt een αkoolstof genoemd. En de waterstof gebonden aan de α-koolstof een αwaterstof.
13.1: De zuursterkte van een α-waterstof
Waterstof en koolstof hebben ongeveer dezelfde elektronegativiteit, dus de elektronen die de
binding tussen hen maken zijn ongeveer gelijkmatig verdeeld. Een waterstof gebonden aan koolstof
is normaalgesproken dan ook niet zuur en al helemaal niet aan een sp3-koolstof. De hoge pKa van ethaan
geeft ook bewijs van de lage zuursterkte van waterstof gebonden aan een sp3-koolstof.
Een waterstof gebonden aan een sp3-koolstof naast de carbonyl-koolstof is
echter veel zuurder dan de waterstofatomen gebonden aan andere sp3koolstoffen. Bijvoorbeeld ligt de pKa waarde voor de loslating van een proton
van een α-koolstof van een aldehyde of keton tussen de 16-20 en die van een ester rond de 25. Nog
steeds is een α-waterstof minder zuur dan water (pKa = 15,7).
De α-waterstof is zuurder omdat de base die gevormd wordt als een proton verwijderd wordt van de αkoolstof meer stabiel is dan de base die gevormd wordt als een proton wordt verwijderd
van een ander sp3-koolstof: hoe stabieler de base is, hoe sterker zijn conjugeerde base is.
Deze base is meer stabiel omdat wanneer een proton bijvoorbeeld verwijderd wordt van
een ethaan, de elektronen achter blijven en rond de koolstof gaan zitten. Omdat koolstof
niet erg elektronegatief is, is zijn carbanion onstabiel. Als een resultaat is de pKa van het conjugeerde
zuur heel hoog.
Wanneer daarentegen een proton verwijderd wordt van een koolstof naast de carbonyl-koolstof, zijn er
twee dingen die zorgen voor verhoogde stabiliteit van de base. Het eerste ding is dat de elektronen die
achtergelaten zijn, nadat het proton verwijderd is, gedelocaliseerd zijn en zoals we weten zorgt een
gedelocaliseerde elektron voor verhoogde stabiliteit. Maar het tweede ding is dat de elektronen
gedelocaliseerd zijn rond de zuurstof, een atoom wat gemakkelijker elektronen opneemt doordat hij
meer elektronegatief is dan koolstof.
De elektronen die achter blijven wanneer een proton verwijderd wordt van de α-koolstof van een ester
worden niet zo gemakkelijk gedelocaliseerd op de carbonyl-zuurstof als bij een aldehyde of keton. Dit
komt omdat de zuurstof van de OR groep van de ester een extra lone pair heeft die gedecolariseerd kan
worden. Twee paren elektronen wedijveren dus met elkaar voor de delocalisatie van dezelfde zuurstof.
Als een koolstof tussen de twee carbonyl-groepen zit, wordt de
zuursterkte van de α-waterstof zelfs groter. Bijvoorbeeld is de
pKa waarde voor loslaten van een proton van de α-koolstof van
2,4-pentaandion, een α-koolstof tussen twee keton groepen, 8,9
en de pKa voor ethyl 3-oxobutyraat, een α-koolstof tussen een
keton-carbonylgroep en een ester-carbonylgroep 10,7.
De zuursterkte van α-waterstoffen gebonden aan koolstoffen met twee carbonyl-groepen aan beide
zijdes wordt verhoogd, omdat de elektronen die
achter blijven,wanneer het proton verwijderd
wordt, gedelocaliseerd kunnen worden tussen
twee zuurstofatomen.
13.2: Keto-enol tautomeren
Een keton bestaat in zijn evenwichtstoestand met zijn enol tautomeer. Tautomeren
zijn isomeren met een snelle evenwichtsovergang tussen twee isomeren. Keto-enol
tautomeren verschillen in locatie door een dubbele binding en een waterstof.
Voor ketonen is de enol tautomeer minder stabiel dan de keto tautomeer.
Bijvoorbeeld zal aceton in een water oplossing 99,9% in keto tautomeer bestaan en
minder dan 0,1% in de enol tautomeer. Fenol is daartegen weer een structuur waarbij
de enol tautomeer meer stabiel is dan zijn keto tautomeer omdat de enol tautomeer
aromatisch is en de keto tautomeer niet.
13.3: Keto-enol interconversie
Nu we weten dat de waterstof gebonden aan de naburige koolstof naast de carbonyl-koolstof zuurder is,
zal er interconversie optreden bij keto-enol tautomeren. Dit wordt een keto-enol interconversie of
tautomerisatie genoemd. De interconversie kan gekatalyseerd worden door zowel een base als een
zuur:
Mechanisme voor base-gekatalyseerde keto-enol interconversie:
- Het hydroxide ion verwijdert een proton van de α-koolstof van een keto tautomeer, hiermee het
anion enolaat ion vormend. Het enolaat ion heeft twee resonantie contributeurs.
- Protonatie van zuurstof vormt de enol tautomeer, waarbij protonatie van de α-koolstof de keto
tautomeer vormt.
Mechanisme voor zuur-gekatalyseerde keto-enol interconversie:
- Het zuur protoneert de carbonyl-zuurstof van de keto tautomeer.
- Water verwijdert een proton van de α-koolstof, hierbij een enol vormend.
De stappen bij base- zuur-gekatalyseerde reacties zijn omkeerbaar. Bij de base reactie, kan de base een
proton verwijderden van de α-koolstof in de eerste stap en de zuurstof protoneren in de tweede stap.
Bij de zuur reactie, kan de zuurstof geprotoneerd worden in de eerste stap en de proton verwijderd
worden van de α-koolstof in de tweede stap.
13.4: Alkylatie van enol ionen
Een enolatie ion heeft twee elektronen-rijke sites: de α-koolstof en de
zuurstof. Welke nucleofiel (C of O) reageert met het elektrofiel is
afhankelijk van het elektrofiel. Protonatie vindt voornamelijk plaats op de
zuurstof omdat de concentratie negatieve lading groter is op de
elektronegatieve zuurstof. Als echter het elektrofiel iets anders is dan een
proton, zal koolstof eerder de nucleofiel zijn omdat koolstof een beter
nucleofiel is dan zuurstof. Alkylatie gebeurt door eerst een proton te
verwijderen van de α-koolstof met een sterke base en vervolgens een
alkyl-halide toe te voegen. Omdat alkylatie een SN2 reactie is, werkt
dit het best met primaire alkyl-halides en methyl-halides.
13.5: Een aldol additie vormt β-hydroxyaldehydes en β-hydroxyketonen
De carbonyl-koolstof van aldehydes en ketonen is een elektrofiel. We hebben net
gezien dat het verwijderen van een proton het α-koolstof omzet tot een nucleofiel.
Een aldol (ald staat voor aldehyde en ol voor alcohol) additie is een reactie waar
beide dingen voorkomen: een molecuul van een carbonyl-bestandsdeel (nadat een
proton is verwijderd van het α-koolstof) reageert als een nucleofiel en valt de
elektrofiele carbonyl-koolstof aan van het tweede carbonyl-bestandsdeel. Een aldol additie is dus een
reactie tussen twee moleculen van een aldehyde of twee moleculen van een keton. Wanneer de
reactant een aldehyde is, wordt het additie product een β-hydroxyaldehyde en bij een keton wordt het
een β-hydroxyketon.
Mechanisme voor aldo additie (aldehyde en keton):
- Een base verwijdert een proton van het α-koolstof, hiermee een enol ion (nucleofiel) vormend.
- Het enolaat ion addeert aan de carbonyl-koolstof van het twee carbonyl-bestandsdeel.
- Het negatief geladen zuurstof wordt geprotoneerd door de oplossing.
Omdat de aldol additie voorkomt tussen twee moleculen met hetzelfde cabonyl-bestandsdeel, zal het
product twee keer zoveel koolstoffen hebben als de reagerende aldehyde of keton.
13.6: Dehydratie van een product van een aldol additie
De β-hydroxyaldehyde en β-hydroxyketon producten van aldol additie worden gemakkelijker
gehydroliseerd dan alcoholen omdat de dubbele binding gevormd als resultaat van dehydratie
geconjugeerde is met de carbonyl-groep. Conjugatie versterkt de stabiliteit van het product en maakt
het hierdoor gemakkelijker te vormen. Als het product van een aldol additie gehydroliseerd is, wordt het
een aldol condensatie genoemd. Een condensatie reactie is een reactie die twee moleculen combineert
door het vormen van een nieuwe C-C binding,
terwijl het een klein molecuul (vaak water of een
alcohol) verwijdert. Een aldol condesatie vormt
hierbij een α, β-onverzadigde aldehyde of een α,
β-onverzadigde keton.
13.7: Een Claisen condensatie vormt een β-keto ester
Wanneer twee moleculen van een ester een condensatie reactie ondergaan, wordt dit een Claisen
condensatie genoemd. Het product is een β-keto ester. Bij Claisen condensatie wordt het ene carbonylbestandsdeel omgezet tot een enolaat ion dat reageert met het tweede carbonyl-bestandsdeel.
Mechanisme voor Claisen condensatie:
- Een sterke base verwijdert een proton van de α-koolstof, hierbij een enolaat ion vormend.
- Het enolaat ion valt de carbonyl-koolstof van het tweede molecuul van de ester aan. De nieuwe
C-C binding wordt gevormd tussen het α-koolstof van het ene molecuul van de koolstof en de
koolstof van voorheen de carbonyl-koolstof van het andere molecuul.
- De negatief geladen zuurstof hervormt de koolstof-zuurstof π-binding en gooit de –OR groep
eruit.
Wanneer de reactie over is, wordt HCl toegevoegd aan de –OR groep.
De base voor de Claisen condensatie correspodeert met de leaving
group van de ester, zodat de reactant niet zal veranderen als de base
zich zou gedragen als een nucleofiel en de carbonyl-groep zou
aanvallen.
Het verschil met de aldol additie is dat bij de Claisen condensatie de
negatief geladen zuurstof de koolstof-zuurstof π-binding hervormt
en bij de aldol additie de negatief geladen zuurstof een proton
opneemt van de oplossing. De Claisen condensatie is dan ook een
nucleofiele substitutie reactie , waarbij de aldo additie een
nucleofiele additie reactie is.
13.8: Carbonzuren met een carbonyl-groep op de 3-positie kan gedecarboxyleerd worden
Carboxylaat ionen laten CO2 niet los omdat de leaving group dan een carbonion is,
net als alkanen ook geen proton verliezen. Carbanions zijn namelijk zeer sterke
bases en daarom zeer slechte leaving groups. Als echter de CO2 gebonden is aan de
koolstof naast de carbonyl-koolstof, kan hij verwijderd worden omdat de
elektronen die achterblijven gedelocaliseerd kunnen worden op de carbonyl-zuurstof. Hierdoor zullen
carboxylaat ionen met een carbonyl groep op de 3-positie CO2 verliezen, wanneer ze worden verhit. Dit
effect wordt decarboxylatie genoemd.
Bij het verwijderen van H+ gebeurt hetzelfde, bij beide reacties wordt de substituent verwijderd van de
α-koolstof en zijn gebonden elektronen gedelocaliseerd op een
zuurstof.
Decarboxylatie gaat zelfs gemakkelijker als ze onder zurige
omstandigheden wordt uitgeveord, omdat de reactie dan
gekatalyseerd wordt door een intramoleculaire transfer van een
proton van de carboxyl-groep naar de carboxyl-zuurstof. Het enol wat
gevormd wordt, wordt meteen omgezet tot een keton.
13.10: De acetoacetische ester synthese: een methode om een methyl keton te synthetiseren
Het product van acetoacetische ester synthese is een methyl keton.
Acetoacetische ester synthese:
- Een base verwijdert gemakkelijk een proton van de α-koolstof
omdat het wordt omgeven door twee ester groepen (pKa = 13).
- De resulterende α-carbanion reageert met de alkyl halide. Omdat alkylatie een SN2 reactie,
werkt het het beste met primaire alkyl halides en methyl halides.
- Verhitten van het tussenproduct in een zure oplossing hydrolyseert beide ester groepen.
- Verdere verhitting van decarboxylaat nog meer en zorgt voor een acetoacetische ester als
eindproduct.
Hoofdstuk 15: organische chemie en carbohydrate
Carbohydraten zijn polyhydroxy aldehydes zoals D-glucose, of polyhydroxy ketonen zoals D-fructose, en
bestandsdelen zoals sucrose gevormd door combinatie van aldehydes en ketonen. De chemische
structuren van carbohydraten worden weergegeven door wedge-and-dash structuren en door Fischer
projecties. Een Fischer projectie is een weergave van het molecuul zonder diepte. Hierbij worden alle
individuele bindingen als lijntje getoond. De horizontale lijnen
corresponderen met atomen die uit het molecuul steken en de verticale top lijnen zijn atomen naar
achter gelegen. De meest voorkomende carbohydraat in de natuur is D-glucose. Dieren halen D-glucose
uit planten die D-glucose bevatten. En planten produceren D-glucose door fotosynthese. Planten halen
hun energie voor fotosynthese uit zonlicht, door de opvangende chlorofiel moleculen in de groenen
delen van de plant.
15.1 en 2: De classificatie van carbohydraten en D- en L-notatie
Sacharide, suiker en carbohydraten betekenen allemaal hetzelfde. Er zijn twee verschillende
carbohydraten: simpele carbohydraten (monosacharide) en complexe carbohydraten (2 of meer
suikers). Disachariden zijn twee monosachariden bij elkaar gevoegd en oligosacharide bestaan uit 3 tot
10 monosachariden. Polysachariden bestaan uit meer dan 10 monosachariden. Door middel van
hydrolyse worden deze complexe sachariden opgebroken tot monosachariden. Monosachariden
bestaan uit polyhydroxy aldehydes (aldoses genoemd) en polyhydryoxy ketonen (ketoses genoemd).
Monosacharides met drie koolstoffen worden trioses genoemd, met vier koolstoffen tetroses, met vijf
koolstoffen pentoses en met zes en zeven koolstoffen hexoses en heptoses. De kleinste aldose is
glyceraldehyde. Omdat het een asymmetrisch koolstof atoom heeft, heeft het of R of S configuratie. Als
de waterstof op de horizontale verbindingsstreepje links zit is het R, en als deze rechts zit is het S. De
notatie D en L worden gebruikt voor carbohydraten. Als de OH aan de linker kant zit is het een L-suiker
en aan de rechter kant is het een D-suiker. Bijna alle suikers in de natuur zijn D-suikers. + en – laten zien
of het molecuul gepolariseerd licht naar links of naar rechts afbuigt.
15.3 en 15.4: Configuratie van aldoses en ketoses
Bij het uitbreiden van glyceraldehyde addeer je telkens een H-C-OH groep die op twee verschillende
manieren geaddeerd kan worden. Hierdoor krijg je dus een soort boom van 1:2:4:8 vormen. Dit zijn dus
uit eigenlijk 16 stereo-isomeren maar omdat alleen D voorkomt, komen alleen die acht enantiomeren
voor. Bij ketoses is dit 1:1:2:4. Diastereomeren die verschillen in configuratie bij alleen maar één
asymmetrisch centrum noem je epimeren. Bijvoorbeeld D-ribose en D-arabinose zijn C2 epimeren
omdat ze alleen verschillen in configuratie op C-2; D-idose en D-talose zijn C-3 epimeren. D-glucose, Dmannose en D-galactose komen veel voor in de natuur. D-mannose is een C-2 epimeer van D-glucose en
D-galactose is een C-4 epimeer van D-glucose, wellicht maakt dit makkelijker om te onthouden.
Ketoses worden opgebouwd uit dihydroxyaceton. Een ketose heeft één minder asymmetrisch centrum
dan een aldose met hetzelfde aantal koolstoffen. Daarom heeft ketose maar de helft van de stereoisomeren als bij de aldoses.
15.5 Reacties van monosacharides in basische oplossingen
Het mechanisme van base-gekatalyseerde epimerisatie van
monosacharide:
-
De base haalt een proton weg van het alfa-koolstof, waarbij een enolaat ion gevormd wordt.
In het enolaat ion, is C-2 niet langer een asymmetrisch centrum.
Wanneer C-2 gereprotoneerd is, de proton kan van boven of van onderen aanvallen op het
planaire sp2 koolstof, hierbij zowel D-glucose als D-mannose vormend.
Omdat de reactie twee C-2 epimeren vormt, noem je dit een epimerisatie reactie. Epimerisatie
verandert de configuratie van een koolstof door het weghalen van een proton en weer terug plaatsen.
In een basische oplossing kan D-glucose ook, naast deze twee epimeren, een hervorming ondergaan,
welke resulteert in de vorming van D-fructose en andere ketohexoses.
Het mechanisme van base-gekatalyseerde
hervorming van een monosacharide:
-
-
De base haalt een proton weg van de
alfa-koolstof, hierbij een enolaat ion
vormend.
Het enolaat ion kan geprotoneerd worden door zuurstof, zodat een enediol gevormd wordt.
De enediol heeft twee OH-groepen die een carbonyl groep kunnen vormen. Tautomerisatie van
de OH bij C-1 hervormt D-glucose; tautomerisatie van de OH groep op C-2 vormt D-fructose.
15.6 oxidatie-reductie reacties van monosacharides
De carbonyl groep in aldoses en ketoses kan gereduceerd worden door natriumborohydride (NaBH4).
Het product wat hierbij gevormd wordt is een polyalcohol, een alditol. Reductie van een aldose vormt
dus een alditol. Bijvoorbeeld vormt de reductie van D-mannose een D-mannitol. Reductie van een
ketose vormt twee alditolen omdat de reactie een nieuw assymetrisch centrum creeert. Bijvoorbeeld
resulteert de reductie van D-fructose in D-mannitol en D-gluticol, de C-2 epimeer van D-mannitol.
Aldoses kunnen onderscheiden worden van ketoses met behulp van bromide. Br2 is een licht oxiderende
agent die gemakkelijk een aldehyde groep kan oxideren, maar niet een keton of alcohol groep. Bij het
toevoegen van een kleine oplossing Br2, zal de rode kleur verdwijnen als het een aldose is omdat Br2
gereduceerd wordt tot Br-, welke kleurloos is. Als de rode kleur blijft, zal er geen reactie van Br2 geweest
zijn, en zal de monosacharide dus een ketose zijn.
15.9: monosacharide vormen cyclische hemiacetalen
D-glucose kan bestaan in drie verschillende vormen: de open-keten vorm eerder besproken en twee
cyclische vormen – alfa-D-glucose en bèta-D-glucose. Een monosacharide zoals D-glucose heeft een
aldehyde groep en meerdere alcohol groepen. De alcohol groep gebonden aan C-5 van glucose reageert
met de aldehyde groep, hierbij twee cyclische hemiacetalen vormend. Om de Fischer projectie om te
zetten in een ring structuur moet je alle groepen aan de rechterkant naar beneden tekenen en de
groepen aan de linkerkant bij de Fischer projectie naar boven tekenen.
Er worden twee verschillende hemiacetalen gevormd omdat er een
nieuw assymetrisch centrum gevorm wordt bij de reactie. Als de OH
groep, gebonden aan het assymetrisch koolstofatoom (C-1) naar
beneden getekend is, noem je het een alfa-D-glucose en als hij naar
boven getekend is noem je het een bèta-D-glucose.
Alfa-D-glucose en bèta-D-glucose zijn anomeren, dit zijn twee suikers die verschillen in configuratie
alleen op de koolstof dat het carbonyl koolstof was in open-keten vorm. Dit koolstofatoom wordt een
anomerisch koolstofatoom genoemd. In een water oplossing bestaat er 0,02% glucose in openvorm,
36% in alfa-D-glucose vorm en 64% in bèta-D-glucose vorm. Dit komt doordat het koolstof bij alfa-Dglucose axiaal geplaats wordt en het koolstofatoom bij bèta-D-glucose equotoriaal geplaats wordt en
dus minder sterische hinder ondergaat. Als de open-keten glucose reageert, worden er meer openketens gevormd, welke weer een reactie kunnen ondergaan. Uiteindelijk reageren alle glucose
moleculen in de open-keten vorm. Wanneer alfa-D-glucose opgelost wordt in water, verandert de
draaiing van +112,2 tot +52,7. Bij bèta-D-glucose opgelost in water, leidt dit tot +18,7 naar +52,7.
Hierdoor zal de rotatie van glucose in water altijd +52,7 zijn. Dit noem je mutarotatie.
Vijf-membraan ringsuikers kunnen ook gevormd worden, een voorbeeld hiervan is D-ribose tot alfa-Dribose en bèta-D-ribose. Zes-membraan ringsuikers worden pyranoses genoemd en vijf-membraan
ringsuikers worden furanoses genoemd. Een alfa-D-glucose wordt dan ook wel een alfa-D-glycopyranose
genoemd en een alfa-D-ribose wordt ook wel een alfa-D-ribofuranose genoemd.
15.10 en 11: Glucose is de meest stabiele aldohexose en de formatie van glycosides
Glucose is de meest stabiele aldohexose omdat de OH groepen hierbij het minste sterische
hinder van elkaar ondergaan. Hierbij is alfa-D-glucose iets minder stabiel als bèta-D-glucose
omdat hierbij de OH groep aan de C-4 axiaal staat en bij bèta-D-glucose staat deze
equatoriaal. Alle groepen in bèta-D-glcuose zitten zelfs allemaal in equatoriale positie. Bij
alfa-D-galactose moet je dus alle OH groepen in equotriale posities zetten, behalve de OH
groepen op C-4 en C-1.
De cyclische hemiacetal gevormd door een monosacharide
kan reageren met een alcohol tot een acetal (of ketal). De
acetal of ketal van een suiker wordt de glycoside genoemd, en
de binding tussen het anometrisch koolstofatoom en de alkoxy
zuurstof wordt een glycosdische binding genoemd. Een
glycosodie van glucose heet een glucoside en een glycoside
van een galactose wordt een galactoside genoemd.
Een reactie van een enkel anomeer met een alchol leidt tot vorming van zowel alfa- als bèta-glycosides.
Het mechanisme wordt hieronder getoond.
Mechanisme van glycoside vorming:
- De OH groep gebonden aan de
anomerische koolstof wordt
geprotoneerd in de zuuroplossing.
- Een lone pair van de zuurstof helpt
met het aantrekken van een
watermolecuul. De anomerische
koolstof is nu sp2 gehybridiseerd,
zodat een deel van het molecuul
planair wordt.
- Wanneer de alcohol van de
bovenkant aanvalt, wordt een
bèta-glycoside gevormd en als hij
van onder komt wordt er een alfaglycosdie gevormd.
15.14: Polysacharides
Polysachardies bestaan uit 10 of meer monosacharides aan elkaar gevoegd
door glycosidische bindingen. De meest bekende polysacharides zijn
zetmeel en cellulose. Zetmeel wordt gevormd door twee verschillende
polysacharides: amylose (20%) en amylopectine (80%). Amylose bestaat uit
onvertakte ketens van D-glucose eenheden bij elkaar gevoegd door alfa-1,4’glycosidische bindingen. Amylopectine is een vertakte polysacharide. Net als
amylose bestaat amylopectine uit D-glucose eenheden bij elkaar gevoegd
met alfa-1,4’-glycosidische bindingen maar ook met alfa-1,6’-glycosidische
bindingen. Hierdoor worden er vertakkingen gevormd in de polysacharides.
Levende cellen oxideren D-glucose om energie te krijgen. Ook slaan ze
glucose op in de vorm van glycogeen. Glycogeen lijkt op amylopectine maar
heeft meerdere vertakkingen, hierdoor kunnen er tegelijkertijd meerdere
vertakkingen afgebroken worden en sneller energie gewonnen worden.
Planten zetten teveel aan D-glucose om in zetmeel.
Cellulose is het structurele materiaal van planten. Wol
bijvoorbeeld bestaat voor 90% uit cellulose en hout uit
50%. Net als amylose bestaat cellulose uit onvertakte D-glucose eenheden. Echter zijn de glucose
eenheden in cellulose verbonden door bèta-1,4’glycosidische bindingen dan door alfa-1,4’-glycosidische
bindingen. Alle zoogdieren hebben het enzym alfa-glycosidase die alfa-1,4’-glycosidische bindingen
hydrolyseren, maar ze hebben niet het enzym voor bèta-1,4’-glycosidische bindingen daarom kunnen
zoogdieren geen cellulose eten. Echter kunnen sommige bacteriën, aanwezig in de maag en darmen van
bijvoorbeeld paarden en koeien, dit wel.
Bèta-verbindingen in cellulose kunnen onderling ook waterstofbruggen vormen en hierdoor lineair op
een rij gaan zitten. Deze lineaire ketens zorgen ervoor dat ze niet goed kunnen oplossen in water, deze
vorm wordt bijvoorbeeld voor papier en cellofaan gebruikt.
Chitine is een polysacharide die lijkt op cellulose. Je vindt chitine terug in de schil van bijvoorbeeld
krabben of garnalen. Net als cellulose bevat chitine bèta-1,4’-glycosidische bindingen maar heeft het
een N-acetylamino groep in plaats van een OH groep op de C-2 positie. De bèta-1,4’-glycosidische
bindingen geven chitine zijn stevige structuur.
Hoofdstuk 16: De organische chemie van aminozuren, peptides en eiwitten
De drie soorten polymeren in de natuur zijn polysachariden, eiwitten en nucleïnezuren. Peptides en
eiwitten zijn polymeren van aminozuren. Een aminozuur is een carbonzuur met een amino groep op het
α-koolstof. Herhalende eenheden worden aminozuur residuen genoemd. Een dipeptide bevat twee
aminozuur residuen, een tri-peptide drie en een oligo-peptide 3-10, een polypeptide bevat meer dan
10 aminozuur residuen. Eiwitten zijn polypeptiden van tussen de 40 en 4000 aminozuur residuen.
Eiwitten en peptides dienen vele functies in ons biologisch systeem. Je hebt fibrouse eiwitten dit zijn
alle structurele eiwitten, deze eiwitten zijn oplosbaar in water. Globulaire eiwitten zijn voornamelijk
enzymen en zijn oplosbaar in water.
16.1: Classificatie en naamgeving van aminozuren
Er bestaan 20 aminozuren. De aminozuren verschillen alleen van substituent (R) op het α-koolstof en
zijn allemaal opgebouwd uit een carbonzuur gedeelte en een amino gedeelte. Deze R groep worden de
zijketens genoemd, deze bepaalt uiteindelijk zijn functie. Elk aminozuur heeft een drie letter afkorting
en een enkel-letter afkorting. Tien aminozuren zijn essentiële aminozuren die ons lichaam niet zelf kan
synthetiseren en daar voeding moet binnenkrijgen.
16.2: De configuratie van aminozuren
De α-koolstof van alle natuurlijk voorkomende aminozuren zijn een asymmetrisch centrum, behalve
glycine. Daarom kunnen 19 van de 20 aminozuren als enantiomeren bestaan De D en L notatie worden
gebruikt voor monosachariden en worden ook gebruikt voor aminozuren. Een aminozuur wordt
getekend met Fischer projectie met de carboxyl-groep op de top en de R group aan de onderkant van de
verticale as, het is een D-aminozuur als de aminogroep rechts zit en een L-aminozuur als de amino
groep links zit. De meeste aminozuren in de natuur hebben L-configuratie.
16.3: De zuur-base eigenschappen van aminozuren
Elk aminozuur bestaat uit een carboxyl-groep en een
aminogroep, elke groep kan zowel in basische vorm als in
zure vorm aanwezig zijn afhankelijk van de pH van de
oplossing. Sommige aminozuren hebben ook een ioniserende
zijketen zoals arginine, aspartaat etc. De bestandsdelen
bestaan in zure vorm (met extra protonen eraan) bij een
lage, zure pKa en bestaan in basische vorm (gebrek aan
protonen -> protonen zijn weg getrokken) bij een hoge,
basische pKa. Het zwitterion is een bestandsdeel die zowel
een negatieve lading heeft (op de carboxyl-kant COO-) als een
positieve lading (op de amino-kant NH3+). Vaak kom je bij
fysiologische pH (ongeveer 7,3) aminozuren tegen in de vorm
van een zwitterion.
16.4: Het isoelektrisch punt
Het isoelektrisch punt (pI) van een aminozuur is de pH waarbij het geen netto lading
heeft. Hierbij is de hoeveelheid negatieve lading gelijk aan de hoeveelheid positieve
lading en is de netto lading dus 0. Een pI van een aminozuur dat geen ioniserende
zijketen heeft (zoals alanine) zit tussen de twee pKa waardes in. De pI van een
aminozuur met wel een ioniserende zijketen is het gemiddelde van pKa waardes van de
ioniserende groepen. Bijvoorbeeld is de pI van lysine het gemiddelde van de pKa
waardes van de twee groepen die positief geladen zijn in hun zure vorm en ongeladen
zijn in hun basisiche vorm. De pI van glutamaatzuur is weer het gemiddelde van de pKa
waardes van de twee groepen die ongeladen zijn bij hun zure vorm en negatief geladen zijn bij hun
basische vorm. Dit komt omdat glutamaatzuur een OH groep heeft en dus zal de zuurstof bepalend zijn,
bij lysine is de NH3+ bepalend.
16.5: Scheiding van aminozuren
Aminozuren kunnen gescheiden worden met behulp van verschillende technieken:
Elektroforese:
Elektroforese scheidt aminozuren op basis van hun pI waardes. Een paar druppels van de oplossing met
het aminozuur worden op het midden van een filter papier of gel geplaatst. Wanneer het papier of gel
geplaatst wordt in een buffer oplossing tussen twee elektrodes en een elektrisch veld wordt
gegenereerd, zal het aminozuur met een hoger pI dan de pH van de buffer oplossing een gemiddelde
positieve lading krijgen en naar de kathode (negatieve pool) bewegen. Des te verder het aminozuur pI
afwijkt van de pH, des te positiever/negatiever hij zal zijn en hoe verder hij naar de negatieve/positieve
pool wordt aangetrokken. Als twee moleculen dezelfde lading hebben, zal het grotere molecuul
langzamer bewegen tijdens de elektroforese omdat dezelfde lading met een grotere massa moet
bewegen.
Aminozuren zijn kleurloos dus je wilt ze nog een mooi kleurtje geven. Nadat de aminozuren zijn
gescheiden, wordt het filter papier besproeid met ninhydrine en gedroogd in een warme oven. De
meeste aminozuren vormen dan een paarsproduct. De individuele aminozuren worden geindentificieerd
door hun locatie op het papier vergeleken met een standaard.
Ion-uitwisselingschromatografie (ion-exchange chromotagraphy):
Met ion-uitwisselingschromatografie kan je niet alleen de aminozuren indentificeren maar ook de
hoeveelheden van het aminozuur. Hierbij gebruik je een kolum met een onoplosbare resine. De
oplossing met aminozuren wordt bovenin de kolom geplaatst en een serie van buffer oplossingen van
toennemende pH worden vervolgens door de kolom gevoerd. Omdat de resine een chemisch materiaal
is met geladen zijketens zal bijvoorbeeld een oplossing van lysine en glutamaat, in een oplossing met pH
6 die door de kolom gevoerd wordt, glutamaat snel door de kolom gaan omdat
zijn negatieve zijketen afgestoten zal worden door de negatief geladen
sulfaatzuur groepen van de resine. De positieve zijketen van lysine zal dus door
zijn positieve lading langzamer erdoor heen gaan. Dit wordt kathodeuitwisselingsresine genoemd omdat het de positieve Na+ ionen van de SO3uitwisseld met de posieve ladingen van de moleculen in de oplossing. Ook zal de
relatieve niet-polaire vorm van de kolom niet-polaire aminozuren langer
tegenhouden dan polair aminozuren.
Een aminozuur analyse is een instrument die ionuitwisselingschromatografie automatisch uitvoert. Wanneer een oplossing
met aminozuren door de kolom gaat van een aminozuur analyse met een
kation-uitwisselingsresine, gaan de aminozuren met verschillende
snelheden door de kolom, afhankelijk van hun lading. De oplossing die
onderuit de kolom valt wordt in fracties opgevangen. Aan deze fracties wordt ninhydrine toegevoegd,
hierdoor kan in elke fractie met behulp van zichtbare spectroscopie (absorptie meting) de hoeveelheid
aminozuur bepaald worden.
16.6: Peptide bindingen en disulfidebindingen:
Peptide bindingen en disulfidebindingen verbinden aminozuur residuen met
elkaar tot een peptide of eiwit. De amide binding die aminozuur residuen
verbindt, worden peptidebindingen genoemd. Eiwitten en peptides worden
altijd geschreven van de N-terminus (links) naar de C-terminus (rechts). Een
peptidebinding heeft voor ongeveer 40% een dubbelbindingskarakter door
elektronen delocalisatie en is hierdoor onderhevig aan resonantie.
Wanneer thiolen geoxideerd worden onder milde condities, vormen ze disulfidebindingen. Dit is dus
een S-S binding. Disulfides kunnen weer gereduceerd worden tot thiolen. Cysteine is een
aminozuur die een thiol groep bevat. Twee cysteine moleculen kunnen dan ook geoxideerd
worden tot een disulfide binding, dit wordt een cystine genoemd. Deze binding wordt
ook wel een disulfidebrug genoemd. Disulfidebruggen dragen bij aan de structuur van
een eiwit. Het beste voorbeeld van een eiwit, waarvan de werking voornamelijk wordt
bepaald door disulfidebruggen, is insuline. Insuline, uitgescheiden door de pancreas, is een polypeptide
die bestaat uit twee peptide ketens. Het heeft
drie disulfidebruggen die de twee ketens met
elkaar verbinden.
16.7: Peptide synthese
De moeilijkheid van het synthetiseren van een polypeptide is dat de aminozuren twee
functionele groepen hebben (de amide en carboxyluiteindes) Door de amide of de carboxyluiteinde te
beschermen met een functionele groep, kan je bepalen welk aminozuur met welk aminozuur regaeert.
De reagent die gebruikt wordt om de amide kant te beschermen is di-tert-butyl-dicarbonaat (t-BOC). De
reagent die gebruikt wordt om de carboxyl kant vervolgens te activeren is dicyclohexylcarbodiimide
(DCC). DCC activeert de carboxylgroep door een goede leaving group aan de carboylkoolstof te zetten.
Nadat het aminozuur op de N-terminus beschermd is en de C-terminale groep geactiveerd is, wordt het
twee aminozuur toegevoegd. De onbeschermde amide groep van het twee aminozuur valt vervolgens
de geactiveerde carboxylgroep aan en er wordt een
peptidebinding gevormd. Door deze twee stappen te
herhalen (activeren van de carboxylgroep met DCC en
het
toevoegen van een nieuw aminozuur) kun je meerdere
aminozuren toevoegen. Wanneer je genoeg aminozuren
hebt
toegevoegd, wordt de t-BOC verwijderd met behulp van een sterkzuur zoals TFA
(trifluorazijnzuur, F3CCOOH))
Hoofdstuk 19:
Organische
chemie van
lipiden
Lipiden zijn
organische
bestandsdelen
die oplosbaar
zijn in nietpolaire
oplossingen,
doordat ze een
hydrofobe en
hydrofiele kant
hebben. Je hebt
veel
verschillende
lipiden, zoals
hormonen, vitamines vetten etc.
19.1: Vetzuren
Vetzuren zijn carbonzuren met lange
waterstof-koolstof ketens. De meeste
natuurlijke vetzuren zijn onvertakt en
bevatten een even aantal koolstofatomen, omdat ze uiteindelijk allemaal opgebouwd worden uit
acetaat, een bestandsdeel met twee koolstoffen. Vetzuren kunnen verzadigd zijn (minder dubbele
bindingen) of onverzadigd zijn (meer dubbele bindingen). Vetzuren met meer dan één dubbele binding
worden poly-onverzadigde vetzuren genoemd. Het smeltpunt van verzadigde en onverzadigde vetzuren
neemt toe met moleculaire massa, omdat er meer van der Waals interacties optreden tussen de
moleculen. De dubbele bindingen in onverzadigde vetzuren hebben vaak de cis configuratie en worden
altijd gescheiden door een CH2 groep. De dubbele binding zorgt voor een ‘knip’ in het vetzuur, zodat
deze niet gemakkelijk opgestapeld/opgevouwen kan worden. Daarom zullen onverzadigde vetzuren van
dezelfde moleculaire massa als een ander verzadigd vetzuur, minder intermoleculaire interacties
hebben en daarom een lager smeltpunt hebben. Het smeltpunt van onverzadigde vetzuren neemt ook
af met het toenemen van dubbele bindingen. De term omega-vetzuren is de eerste positie van de
dubbele binding, tellend van het methyl-uiteinde, in een onverzadigd vetzuur. Bijvoorbeeld wordt
linoleenzuur omega-6-vetzuur genoemd omdat haar eerste dubbele binding na het zesde koolstofatoom
is. Omdat mensen het enzym niet heeft dat een dubbele binding maakt na C-9, moet je deze innemen
door je voedsel.
19.2: Was bestaat uit esters
Was bestaat uit esters gevormd uit een lange reeks carbonzuren en zijketen alcoholen. Bijvoorbeeld
bijewas heeft een 26-koolstof carbonzuur component met een 30-koolstof alcohol component. Wassen
komen veel voor in de natuur, de veren van vogels zijn bedekt met was zodat ze water afstotend zijn,
maar ook op de oppervlaktes van bladeren zodat zo min mogelijk water verdamt.
19.3: Vetten en oliën
Triglycerides/triacylglycerol zijn bestandsdelen waarbij de OH van de
drie glycerol groepen een ester hebben gevormd met vetzuren.
Triglycerides die vloeibaar zijn bij kamertemperatuur worden vetten
genoemd. Bijvoorbeeld diervet bestaat voornamelijk uit verzadigde
vetzuren die dicht op elkaar zitten en hierdoor een hoog
smeltingspunt hebben, en dus in vast fase zijn bij kamertemperatuur.
Vloeibare triglycerides worden oliën genoemd. Oliën komen over het
algemeen uit plantproducten. Ze worden opgebouwd uit voornamelijk
triglycerides met vetzuur componenten die onverzadigd zijn en dus niet goed bij elkaar kunnen zitten.
Sommige van deze poly-onverzadigde oliën kunnen gereduceerd worden door katalitische hydrogenatie.
Margarine is oorspronkelijk een olie die onderheven wordt aan hydrogenatie tot de gewenste dichtheid.
Echter moet je met hydrogenatie oppassen dat je weer niet te veel reduceerd want dan krijg je een vet.
Wanneer een vet binnen is, wordt het gehydroliseerd tot glycerol en vetzuren. Zepen maken hier
gebruik van en hydrolyseren de vetzuren tot glycerol en een zout van een vetzuur.
Het verbranden van een vet geeft ongeveer zes keer zoveel energie als hetzelfde gewicht suiker, maar
het is moeilijker carbohydraten te oxideren, en omdat vetten niet-polair zijn binden ze niet met water.
Ook kost het tijd om carbohydraten af te breken en deze worden daarom ook meer als over langere tijd
energiebron gezien.
Poly-onverzadigde vetten en oliën worden gemakkelijk geoxideerd door O2 met behulp van een radicaal.
De beginstap is het verwijderen van een waterstof van de CH2 groep tssen twee dubbele bindingen door
een radicaal. Deze waterstof is het gemakkelijkst te verwijderen omdat het ongepaarde elektron
gedeeld wordt door drie koolstoffen. Door deze reactie worden vetzuren ‘ranzig’ en beginnen ze vies te
ruiken door het produceren van odors. Olestra is een gesynthetiseerd vet, wat dezelfde smaak heeft
maar niet verteerd kan worden door enzymen.
19.4: Fosfolipiden zijn componenten van membranen
Fosfoglycerides zijn de belangrijkste componenten voor
celmembranen en behoren tot de klasse fosfolipides (vetzuren met
een fosfaatgroep). Fosfoglycerides zijn hetzelfde als triglycerides
alleen is de OH groep bij één van de glycerol-groepen veresterd met
een fosfaatzuur in plaats van een vetzuur. De R-groep bestaat hierbij,
net als bij vetzuren, uit waterstoffen en koolstoffen. De C-2 koolstof
bij fosfoglycerides heeft de R-configuratie. De fosfolipides in onze
membranen bestaat uit twee veresteringen en worden fosfodiesters genoemd. De meest gebruikte
groepen voor de twee ester groep zijn ethanolamine, choline en serine. Fosfoglycerides in membranen
vormen een lipide bilaag. De polaire hoofde van de fosfoglyerides zitten aan beide kanten van de bilaag
en de vetzuurketens aan de binnenkant van de bilaag. De vloeibaarheid van het memrbaan wordt
gecontroleerd door de vetzuurcomponenten van de fosfoglycerides. Verzadigde vetzuren zitten dicht op
elkaar en zorgen hierdoor voor een verminderde vloeibaarheid van het membraan. En onverzadigde
vetzuren zitten minder dicht op elkaar en zorgen hierdoor voor een verhoogde vloeibaarheid van het
membraan. Cholesterol vermindert de vloeibaarheid en zorgt voor stijver membraan. De onverzadgide
vetzuurketens kunnen ook met O2 reageren, net als bij vetten en oliën. De oixidatie reactie leidt tot
afbraak van membranen. Vitamine E is een belangrijke anti-oxidant die vetzuurketens beschermd tegen
oxidatie. Vitamine E, ook wel alfa-tocoferol genoemd, wordt geklassificeerd als een lipide omdat hij
oplosbaar is in niet-polaire oplossingen. Het kan doordaat door membranen heen bewegen: als het daar
is, reageert het sneller met de zuurstof dan de fosfoglycerides van de bilaag, hierdoor kan er geen
oxidatie plaatsvinden van de fosfoglycerides. Vitamine E wordt dan ook vaak gebruikt voor langere
huidbaarheid van vetzuur bevattende producten. In fruiten en groentes zitten veel vitamines/antioxidanten. Anti-oxidanten bescheremen tegen cardiovasculaire ziektes, kanker etc. Chocolade bevat
echter ook veel anti-oxidanten, echter bevat witte chocolade geen anti-oxidanten.
19.5: Terpenen bevatten koolstof-atomen in meervouden van vijf
Terpenen kunnen koolwaterstoffen zijn of zuurstof bevatten en alcoholen, ketonen of aldehydes
vormen. Ze bestaan uit veelvouden van 5 koolstoffen (5-10-15-20 etc.). Ze worden dan ook opgebouwd
uit een vijftellig koolstofatoom: isopreen. Hierbij is de staart het onvertakte deel en de kop het vertakte
deel. Telkens bindt de staart aan de kop, dit wordt de isopreen regel genoemd.
Bij cyclische bestandsdelen wordt weer de staart aan de kopbevestigd. Hierbij wordt er een tweede
binding gevormd tot een ringstructuur met zes koolstoffen. Zie afbeelding rechtsboven.
Terpenen worden geklassificeerd door het aantal koolstofatomen dat ze bevatten. Monoterpenen
bestaat uit twee isopreen eenheden (10 koolstoffen dus), sesquiterpenen bestaan uit drie isopreen
eenheden (15 koolstoffen dus). Veel geur- en smaakstoffen gevonden in planten zijn monoterpenen en
sesquiterpenen. Dit worden essentiele oliën genoemd. Triterpenen (met 30 koolstoffen) en
tetraterpenen (met 40 koolstoffen) hebben belangrijke biologische rollen. Bijvoorbeel is squaleen
(triterpeen) een voorloper van cholesterol en daarom alle andere steroïde moleculen.
Carotenoïden zijn tetraterpenen. Lycopeen, die tomaten en watermeloen
hun rode kleur geven, en β-caroteen ,die wortels en abrikozen orange
maakt, zijn voorbeelden van carotenoïden. β-caroteen vindt je ook in de
bladeren van bomen, in de zomer zijn ze groen door de overmaat aan
chlorofiel maar als de chlorofiel af wordt gebroken in de herfst komt βcaroteen tevoorschijn en worden de bladeren meer ‘orange’. β-caroteen
wordt afgebroken in twee moleculen van vitamine A, de vitamine die een
belangrijke rol speelt bij zicht.
19.6: Hoe terpenen worden gesynthetiseerd in het lab
Voor de biosynthese van terpenen wordt niet isopreen gebruikt maar isopentenyl pyrofosfaat (eigenlijk
een isopreen met een goede leavingsgroup eraan). Het begin materiaal voor de biosynthese van
terpenen is dimethylallyl pyrofosfaat, dus eerst moeten een aantal isopentenyl pyrofosfaten omgezet
worden tot dimethylallyl pyrofosfaat. Deze omzetting vindt plaats door een enzym gekataliseerde
isomerisatie reactie, waarbij een proton geaddeerd wordt aan de sp2 koolstof van isopentenyl
pyrofosfaat die gebonden is aan het grootste aantal waterstoffen en een eliminatie van de proton van
de carbocation intermediar.
De reactie van dimethylallyl pyrofosfaat met isopentenyl pyrofosfaat vormt geranyl pyrofosfaat (10
koolstofbestandsdeel) in twee stappen. Isopentenyl pyrofosfaat gedraagd zich eerst als een nucleofiel
en verplaatst een pyrofosfaatgroep van de dimethyl pyrofosfaat. Pyrofosfaat is een stabiele base en
daarom een goede leaving group. Een proton wordt verwijderd in de volgende stap, hierbij geranyl
pyrofosfaat vormend.
Volgens hetzelfde principe kan een volgend isopentenyl pyrofosfaat reageren met de geranyl
pyrofosfaat tot farnesyl pyrofosfaat (15 koolstofbestandsdeel). Twee moleculen van farnesyl
pyrofosfaat vormt squaleen. De reactie wordt gekatalyseerd door een enzym die twee moleculen van
staart-naar-staart verbinden. Squaleen was de voorloper van cholesterol zoals eerder al genoemd. Maar
uit geranyl pyrofosfaat kan je natuurlijk nog vele andere terpenen synthetiseren.
19.7: Steroïden zijn chemische boodschappers
Hormonen zijn organische bestandsdelen gesynthetiseerd in klieren en in het bloedstroom losgelaten
om een reactie te veroorzaken in het gewenste weefsel/orgaan. Veel hormonen zijn steroïden. Omdat
steroïden niet-polaire bestandsdelen zijn, worden ze lipiden genoemd en kunnen ze door
celmembranen heen bewegen. Alle steroïden worden opgebouwd uit een tetracyclische ringsysteem
bestaand uit drie zes-tellende ringen en één vijf-tellende ring. Bij steroïden zijn
alle B, C en D ringen trans gefuseerd. Trans gefuseerde ringen zijn namelijk
meer stabiel dan cis gefuseerde ringen. De meest bekende lid van de steroïde
familie is cholesterol. Cholesterol wordt via biosynthese gevormd uit squaleen
en is een belangrijke component van cel membranen. Omdat cholesterol acht
assymetrische centra bevat, zijn er 256 steroisomeren mogelijk, maar alleen
één bepaalde stereoisomeer is aanwezig in de natuur.
Steroïde hormonen kunnen opgedeeld worden in vijf klassen: glycocorticoïden,
mineraalcorticoïden, androgenen, estrogenen en progestines.
Glucocorticoïden spelen voornamelijk een rol bij glucose metabolisme, maar ook bij
metabolisme van eiwitten en vetzuren. Cortison is een voorbeeld van een glucocorticoïde.
Door zijn anti-onstekkings effect wordt cortison gebruikt om arthritis en andere
onstekingsziektes tegen te gaan.
Mineraalcorticoïden verhogen de heropname (reabsorptie) van Na+, Clen HCO3- door de nieren en zorgen voor een verhoogde bloeddruk.
De seks hormonen androgenen worden voornamelijk door de testes
uitgescheiden. Zij zijn verantwoordelijk voor de ontwikkeling van
mannelijke secundaire geslachtskenmerken tijdens puberteit, waaronder
spier groei.
De seks hormonen estrogenen worden voornamelijk door de ovariën
geproduceerd en zijn verantwoordelijk voor de ontwikkeling van
vrouwelijke secundaire geslachtskenmerken. Ze reguleren ook de
menstruatie cyclus. Progesteron bereidt de binnenkant van de uterus op
voor het innestelen van een bevruchte eicel en is essentieel voor
zwangerschap. Het zorgt er ook voor dat er geen ovulatie plaats vindt
tijdens zwangerschap.
Ook al verschillen steroïden maar heel weinig van elkaar, ze kunnen toch hele verschillende functies
hebben. Cholesterol is niet alleen de precursor voor steroïden maar ook voor galzuren. De galzuren
(cholinezuur en chenodeoxycholinezuur) worden gesynthetiseerd in de lever, opgeslagen in de galblaas
en uigescheiden in de kleine darm. Hier dienen ze als emulsief agenenten zodat vetten en olïen door
wateroplosbare enzymen afgebroken kan worden. Cholesterol is ook de precursor van vitamine D.
19.8: Synthetische steroïden
Steroïden die helpen in het opbouwen van spieren worden anabolische steroïden genoemd. Twee van
zulke medicijnen zijn stanozolol en dianabol. Stanozolol was een medicijnen die door meerdere athleten
werd gebruikt tijdens de olympische spelen van 1988. Anabolische steroïden in hoge doseringen kan
zorgen voor lever tumoren, persoonlijksstoornissen en onvruchtbaarheid. In de juiste doseringen krijgen
atheleten anabolische steroïden.
Sommige synthetische steroïden blijken beter te
werken dan natuurlijke steroïden. Norethindroon
is bijvoorbeed beter dan progesteron in het tegen
gaan van de ovulatie. Bijvoorbeeld stopt
mifepriston zwangerschap tot negen weken. Beide
medicijnen lijken zeer erg op progesteron.