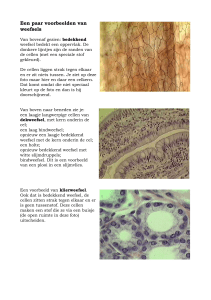
SAMEN WERKEN
AAN SAMENWERKEN
WETENSCHAPSKATERN 2013
Wetenschapskatern 2013
Voorwoord
WOORD VOORAF
Gelijktijdig met de verschijning van het Jaarverslag, publiceert Stichting MS Research elk jaar het zogeheten
Wetenschapskatern. Kern is dat de Stichting naast de cijfermatige verantwoording, ook verslag wenst te doen van
via haar ontplooide wetenschappelijke activiteiten. Hierbij spelen verschillende overwegingen een rol.
Drie redenen voor een Wetenschapskatern
Ten eerste: verreweg het grootste deel (bijna zeventig procent) van de beschikbare baten van Stichting MS Research
wordt besteed aan wetenschap. De resterende dertig procent is ten behoeve van overige twee doelstellingen van de
Stichting: voorlichting en bevordering van de kwaliteit van zorg voor mensen MS. Bij deze verdeling dient in acht
genomen te worden dat, om de drie doelstellingen te kunnen vervullen, wervings- en bureaukosten gemaakt moeten
worden (zie de Jaarrekening 2013).
Voorwoord
Beeldvorming en werkelijkheid
2013; precies zestig jaar na misschien wel een van de belangrijkste ontdekkingen in de medisch-biologische
wetenschappen: de structuur van de om elkaar heen gedraaide delen van een DNA-molecule. Medeontdekker Watson,
later geëerd met de Nobelprijs, schreef over de weg naar de ontrafeling van de moleculaire structuur de bestseller
The Double Helix. Hierin geeft hij eerlijk inzicht in de moeizame weg naar het resultaat. De verzamelde Wetenschapskaternen van Stichting MS Research hebben een vergelijkbaar doel: keuzes voor onderzoeksrichtingen beargumenteerd
verwoorden, om bij te dragen aan een beeld van MS-onderzoek dat spoort met de uitkomsten ervan.
In de tweede plaats draagt Stichting MS Research bij aan condities om wetenschappelijk onderzoek mogelijk te
maken. Concreet betekent dit dat de Stichting door de verstrekking van programmasubsidies, structureel bijdraagt aan
de instandhouding van gespecialiseerde academische centra voor onderzoek; de zogeheten MS-centra. Stichting MS
Research ondersteunt voorts activiteiten van de Nederlandse Hersenbank. De hoofdstukken 2 en 3 bevatten de nodige
bijzonderheden.
Ten derde hecht de Stichting eraan om de samenleving op begrijpelijke wijze te informeren over ontstaan en beloop
van MS (hoofdstuk 1). MS geldt als een complex ziektebeeld. Om deze reden vindt op verschillende gebieden
onderzoek naar MS plaats. Onderscheiden worden zes deelgebieden, ondergebracht in de hoofdstukken 4 t/m 9 van
dit Wetenschapskatern. Per deelgebied wordt in algemene bewoordingen een beeld geschetst van de relevantie voor
het geheel. Tevens wordt per deelgebied zowel de reeds lopende als de in het verslagjaar nieuw gestarte onderzoeken
kort belicht.
Wetenschap en wetenschapsbeoefening in de schijnwerpers
In aansluiting op de publieke functie van Stichting MS Research is zij q.q. betrokkene bij het in verslagjaar ontstane
debat over de wijze waarop het wetenschappelijk bedrijf is georganiseerd.
De achtergrond bij het debat is in algemene zin de wijze waarop wetenschap, mens en samenleving beïnvloedt. In
de afgelopen decennia zijn we bekend geraakt met het gegeven dat wetenschap niet per definitie gelijk staat aan
vooruitgang. Voorts is de organisatie, financiering en verantwoording van het wetenschappelijk bedrijf steeds complexer
geworden. En met de introductie van internet is de verhouding tussen wetenschap en publiek mede een vraagstuk van
gezag geworden.
In dit landschap spant Stichting MS Research zich van harte in om een steentje bij te dragen. Openheid, bijvoorbeeld
door de publicatie van dit Wetenschapskatern, is daarvan een illustratie.
Progressie in progressieve MS
Bij de vanzelfsprekende opdracht tot het afleggen van verantwoording en de specifieke toegevoegde waarde van de
in het verslagjaar gespendeerde donatiegelden, past ook een kanttekening. Gezondheidsonderzoek is een langzaam
proces, waarbij generatie op generatie wordt voortgebouwd op elkaars werk. Stichting MS Research heeft sinds de start
van haar activiteiten in 1980 bijgedragen aan aantoonbare vooruitgang in zowel de wetenschap als de zorg rondom MS.
Die waarde laat zich evenwel niet altijd uitdrukken in 12-maands-perioden. Een voorbeeld.
In 2013 zijn de werkzaamheden aan de voorbereidingen voor de lancering van een wereldwijd onderzoeksprogramma
naar progressieve MS afgerond. Hieraan is door een klein aantal landenorganisaties, waaronder Stichting MS Research,
jaren gewerkt. Ten tijde van de verschijning van dit verslag liggen bijna tweehonderd onderzoeksvoorstellen uit meer
dan twintig landen ter tafel ter beoordeling van een internationale wetenschappelijke raad (met vertegenwoordigers uit
Nederland). In enge zin kan niet gesproken worden van direct meetbaar resultaat; echter, onbetwist is dat de MSbeweging in 2013 een grote stap voorwaarts heeft gemaakt.
4
5
33 jaar MS-onderzoek
33 jaar MS-onderzoek
34 JAAR MS-ONDERZOEK
Subsidievormen
Sinds de oprichting van Stichting MS Research in 1980 heeft de Stichting in totaal meer dan 52 miljoen euro toegekend aan verschillende onderzoeksprojecten. De eerste subsidie werd toegekend in 1987. Sindsdien heeft de Stichting
301 projecten financieel ondersteund. Dankzij deze steun is het aantal onderzoekers dat zich met MS bezighoudt in
de afgelopen jaren flink gegroeid. Belangrijke wetenschappelijke resultaten hebben ertoe geleid dat het Nederlandse
onderzoek naar MS internationaal een hoog aanzien heeft. Mede hierdoor bestaat er een nauwe samenwerking tussen
de Nederlandse MS-centra en toonaangevende onderzoeksgroepen in het buitenland.
Aantal toegekende subsidies 1980 - 2013
350
300
250
200
Niet alle onderzoeken verlopen op dezelfde manier. Daarom hanteert Stichting MS Research verschillende vormen van
subsidie.
Programmasubsidies
Een goede samenwerking tussen onderzoekers in het laboratorium en artsen en onderzoekers in de kliniek is
noodzakelijk om tot een oplossing te komen voor MS. Het belang van deze samenwerking wordt door Stichting MS
Research onderstreept door het toekennen van programmasubsidies. Deze subsidies zijn er speciaal voor bedoeld om de
samenwerking te stimuleren. Een programmasubsidie biedt voor een periode van vier jaar structurele ondersteuning aan
een MS-centrum dat verbonden is aan een universitair medisch centrum. Een vereiste voor het krijgen van een
dergelijke programmasubsidie is dat het wetenschappelijk onderzoek dat met behulp van de subsidie wordt uitgevoerd,
gekoppeld wordt aan de zorg voor patiënten. De centra die momenteel door middel van een programmsubsidie ondersteund worden door de Stichting, zijn gevestigd in Amsterdam, Rotterdam en Sittard.
Zowel het MS Centrum in Rotterdam als het VUmc MS Centrum in Amsterdam ontvingen in 2013 subsidie voor een
coördinator communicatie en wetenschappelijk onderzoek. De coördinator vervult een belangrijke brugfunctie tussen
het MS-centrum en Stichting MS Research. Door deze intensieve samenwerking kan samen met het MS-centrum
deelgenomen worden aan evenementen en kunnen samen activiteiten worden ontplooid.
Meerjarige projecten
Het opzetten en uitvoeren van wetenschappelijke onderzoeksprojecten neemt vaak meerdere jaren in beslag. De
meerjarige projecten die door Stichting MS Research gefinancierd worden, duren over het algemeen drie jaar voor
onderzoekers die al gepromoveerd zijn en vier jaar voor promotieonderzoek. Dit promotieonderzoek wordt afgesloten
met een proefschrift.
150
100
50
MS-centra
13
12
20
11
20
10
20
09
20
08
20
07
20
06
20
05
MS-fellowships
20
04
20
03
20
02
20
01
20
00
20
99
20
98
19
97
reisstipendia
pilotprojecten
meerjarige projecten
19
96
19
95
19
94
19
93
19
92
19
91
19
90
19
89
19
88
19
19
19
87
0
Hersenbank
Totaal toegekende subsidies onderzoek 1980 - 2013
60.000.000
Pilotprojecten
Wetenschappelijk onderzoek is meestal gebaseerd op resultaten uit eerdere studies. Soms hebben onderzoekers nieuwe
ideeën die zij graag willen onderzoeken, maar waar nog niet eerder onderzoek naar is gedaan en er dus ook nog geen
resultaten uit eerdere studies over bekend zijn. Deze nieuwe ideeën worden niet getest in een meerjarig project, maar
met behulp van een korter durende pilotstudie. Met deze pilotstudie probeert de onderzoeker erachter te komen of een
bepaald onderzoek inderdaad tot goede resultaten kan leiden. De pilotprojecten die door Stichting MS Research worden
toegekend, mogen maximaal één jaar duren.
Fellowship en reisstipendium
Om jonge onderzoekers in het MS-veld te stimuleren wordt één keer in de vier jaar een MS-fellowship en een
reisstipendium uitgereikt. Het MS-fellowship is een persoonsgebonden subsidie voor vier jaar en kan aangevraagd
worden door ervaren onderzoekers of artsen. Het MS-fellowship biedt onderzoekers de mogelijkheid om zelf een
onderzoeksgroep of -lijn op te starten.
Het reisstipendium biedt jonge onderzoekers de kans om gedurende één jaar onderzoek te doen aan een buitenlands
instituut. In 2012 is het reistipendium voor de eerste keer uitgereikt.
50.000.000
40.000.000
30.000.000
20.000000
10.000.000
meerjarige projecten
pilotprojecten
reisstipendia
MS-fellowships
MS-centra
13
20
12
20
11
20
10
20
09
20
08
20
07
20
06
20
05
20
04
20
03
20
02
20
01
20
00
20
99
19
98
19
97
19
96
19
95
19
94
19
93
19
92
19
91
19
90
19
89
19
88
19
19
87
0
Hersenbank
Het totaal aantal toegekende onderzoekssubsidies van 1987 tot en met het aangegeven jaar. (In de periode 1980-1987 is beleid
geformuleerd om het wetenschappelijk MS-onderzoek in Nederland vorm te geven en zijn fondsen voor startkapitaal verworven).
6
7
33 jaar MS-onderzoek
33 jaar MS-onderzoek
Kwaliteit
voor alles: de Wetenschappelijke Raad
Alle aanvragen worden beoordeeld op kwaliteit, uitvoerbaarheid en relevantie voor MS door een Wetenschappelijke Raad
(WR). De leden van de WR worden benoemd voor een periode van vier jaar. Herbenoeming voor een aaneensluitende
periode is in principe slechts één keer mogelijk. De WR vergadert twee keer per jaar, waarna advies over de toe te
kennen subsidies wordt voorgelegd aan het Bestuur. Het Bestuur van Stichting MS Research neemt uiteindelijk het
definitieve besluit over de toekenning van de subsidie, op basis van het advies van de WR.
Ook de voortgang en eindresultaten van alle door de Stichting toegekende subsidies wordt beoordeeld door de WR.
Indienen van vooraanvraag
Beoordeling door WR
Afwijzing
Wie
maken het wetenschappelijke onderzoek mogelijk?
Onderzoek naar MS is hard nodig. Maar voor het uitvoeren van wetenschappelijk onderzoek is veel geld nodig.
Gemiddeld kost een jaar onderzoek ongeveer 50.000 euro. Dit geld is afkomstig van (particuliere) donaties,
periodieke schenkingen, nalatenschappen en giften van bedrijven. Maar ook veel initiatieven van particulieren
hebben het afgelopen jaar bijgedragen aan het financieren van wetenschappelijk onderzoek.
Het Wetenschapskatern
Om u een goed idee te geven van de stand van zaken van het wetenschappelijk onderzoek en de verschillende
gebieden waarop het door Stichting MS Research gesubsidieerde onderzoek plaatsvindt, hebben wij dit
Wetenschapskatern samengesteld.
Het katern bestaat uit een algemene inleiding, waar onder andere in beschreven wordt op welke gebieden onderzoek
naar MS wordt gedaan en waarom. Deze algemene inleiding wordt gevolgd door een beschrijving van de projecten en
programma’s die momenteel worden uitgevoerd met door Stichting MS Research verstrekte onderzoekssubsidies. De
projecten en de laatste resultaten zijn door de onderzoekers zelf beschreven.
Uitnodiging voor schrijven van volledige aanvraag
Alle onderzoekers hebben geprobeerd om de projecten zoveel mogelijk in algemeen gangbaar Nederlands te
beschrijven, zodat iedereen de essentie van de projecten kan begrijpen. Om deze reden is bovendien achter in dit
katern een woordenlijst bijgevoegd. Daarnaast staat achterin dit Wetenschapskatern een lijst met functies binnen de
wetenschap voor diegenen die graag meer willen weten over de wijze waarop wetenschappelijk onderzoek is
georganiseerd.
Indienen van volledige aanvraag
Beoordeling door buitenlandse experts
Schrijven van reactie door onderzoekers op beoordeling van experts
Beoordeling door WR
Afwijzing
Positief advies
Beoordeling door Bestuur
Afwijzing
Toekenning
Start project
Indienen tussentijdse rapportage (financieel en wetenschappelijk) halverwege project
Beoordeling door WR
Stop van project
Afwijzing
Goedkeuring
Voortzetten van project
Indienen eindrapportage (financieel en wetenschappelijk) na afronden project
Beoordeling door WR
Goedkeuring
8
Afwijzing
Uitkering van eindeprojectvergoeding
9
Inhoudsopgave
Inhoudsopgave
WOORD VOORAF
34 JAAR MS-ONDERZOEK
4
6
MS CENTRA VOOR ONDERZOEK
2.1 Inleiding
2.2 VUmc MS Centrum Amsterdam
2.3 ErasMS Rotterdam
2.4 MS Centrum Limburg
16
17
17
22
26
NEDERLANDSE HERSENBANK VOOR MS
30
KLINISCHE SYMPTOMEN EN NIEUWE THERAPIEËN
4.1 Inleiding
4.2 Proxy metingen bij Multiple Sclerose (06-594 MS)
4.3 Depressie in MS: de effecten van cognitieve gedragstherapie
(09-678 MS)
34
35
35
zelfhulp via internet
36
OMGEVINGS- EN ERFELIJKE FACTOREN
5.1 Inleiding
5.2 Opheldering van het bio moleculaire mechanisme van de differentiële IFNß
response in RRMS (08-660 MS)
5.3 MicroRNAs in bloedvaten in de hersenen, nieuwe aangrijpingspunten voor de behandeling van MS (09-689 MS)
5.4 Circulerende micro-RNAs als biomarkers voor MS (11-752 MS)
38
39
HET AFWEERSYSTEEM IN MS
6.1 Inleiding
6.2 De rol van antilichamen tegen
42
43
40
41
neurofilamenten in het ontstaan van schade
MS (07-627 MS)
6.3 Mechanismen van myeline opname tijdens MS (08-659 MS)
6.4 Bestudering van CD8 T lymfocyten in MS-laesies: antigeen specificiteit
en functie (09-670 MS)
6.5 Remming van CD40-TRAF6 interacties is een nieuwe anti-inflammatoire
strategie in multiple sclerose (13-809 MS)
6.6 In situ studies naar FoxP3+ regulatoire T -ellen tijdens autoimmuunziekte
centrale zenuwstelsel (r12-1 MS)
6.7 Wormen onderdrukken ontstekingen in multiple sclerose (11-771MS)
45
46
aan zenuwuitlopers en grijze stof in
47
48
van het
SCHADE BIJ ONTSTEKING EN LITTEKENVORMING
7.1 Inleiding
7.2 Zuurstofradicalen in MS pathologie: van bron tot oplossing (09-686 MS)
7.3 De rol van kinesines in de neurodegeneratieve pathologie van multiple
sclerose (09-691 MS)
7.4 Pre-actieve MS-laesies: de sleutel tot herstel van ontstekingen? (10-726 MS)
10
39
49
50
52
53
54
7.5 De
bloed-hersenvloeistof barrière: de eerste plaats van ontstekingen
tijdens multiple sclerose
7.6 Het
(12-791 MS)
57
ophelderen van de beschermende rol van reactieve astrocyten op de
bloed-hersenbarrière in
MS:
de rol van vitamine
A (12-797 MS)
MYELINEVORMENDE CELLEN EN STOFFEN DIE DEZE CELLEN BEÏNVLOEDEN
8.1 Inleiding
8.2 Karakterisering van een microglia fenotype dat remyelinisatie ondersteunt
(10-723 MS)
8.3 Onderzoek naar het transport van één van de belangrijkste myeline eiwitten,
MBP, naar het myelinemembraan (07-621 MS)
8.4 Grijze en witte stof astrocyten: onderzoek naar functionele verschillen in
hun vermogen om de heraanmaak van myeline te beïnvloeden (11-766 MS)
8.5 Onderzoek naar galectine-4 als mogelijk therapeutisch doel voor het
opnieuw aanmaken van myeline in MS (11-767 MS)
8.6 Optimalisering van iPS celtherapie gericht op remyelinisatie-inductie; studies
in een model voor MS (09 – 694 MS)
8.7 Onderzoek aan MS-oligodendrocyten met behulp van iPS cellen gegenereerd
uit huidfibroblasten van mensen met MS (12-778 MS)
8.8 Onderzoek naar de rol van het enzym weefseltransglutaminase bij
littekenvorming en bij de vorming van myeline (09-693 MS)
58
60
61
62
63
64
65
66
67
68
OORZAAK VAN KLINISCHE SYMPTOMEN EN ZIEKTEBELOOP
9.1 Inleiding
9.2 Cognitieve achteruitgang bij MS patiënten: de hippocampus en thalamus
in beeld (08-648 MS)
9.3 Functieverlies in MS begrijpen (08-650 MS)
9.4 Kan neurodegeneratie in vivo gemeten worden? Een onderzoek naar de
relevantie van op MRI gemeten atrofie van de grijze stof bij MS (10-718 MS)
9.5 Differentiatie van Multiple Sclerose en Cerebrovasculaire wittestofschade:
een pilotstudie op 7 Tesla MRI (11-769 MS)
9.6 Karakterisatie van MS-laesies van de Nederlandse Hersenbank (09-666 MS)
9.7 Nationaal Kinder MS Centrum (12-807 MS)
70
71
FUNCTIES BINNEN DE WETENSCHAP
80
72
73
74
75
77
78
WOORDENLIJST82
55
56
11
Onderzoek naar multiple sclerose: Algemene inleiding
multiple ScleroSe
Multiple sclerose (MS) is een chronische ziekte waarbij ontstekingen ontstaan in het centrale zenuwstelsel, dat bestaat
uit de hersenen en het ruggenmerg. Door deze ontstekingen raakt myeline, de beschermlaag die rond de zenuwen zit,
beschadigd. Hierdoor kan het centrale zenuwstelsel bepaalde signalen niet meer goed verwerken. Zenuwen in het
centrale zenuwstelsel worden weleens vergeleken met een stroomdraad. Wanneer de isolerende laag om een stroomdraad beschadigd is, wordt de stroom niet meer goed doorgegeven en zal een apparaat niet meer (goed) werken of
ontstaat er kortsluiting. De beschadigingen in het centrale zenuwstelsel kunnen leiden tot verschillende klachten, zoals
uitvalsverschijnselen, krachtsverlies, blindheid, extreme moeheid of geheugenproblemen. In de meeste gevallen wordt
de diagnose MS gesteld bij mensen tussen de 20 en 40 jaar oud.
MS is een zeer ingrijpende ziekte. Niet alleen voor de persoon zelf, maar ook voor de omgeving. Naast de geleidelijke
uitval van verschillende lichaamsfuncties, brengt de diagnose MS ook veel onzekerheid met zich mee. Dit begint al
vroeg in het ziekteproces bij het stellen van de diagnose. Maar ook als de diagnose eenmaal gesteld is, blijft er veel
onzekerheid over het beloop van de ziekte.
Bij het ontstaan en het beloop van MS speelt een groot aantal verschillende processen een belangrijke rol.
Wetenschappelijk onderzoek is noodzakelijk om deze processen te begrijpen en om MS in de toekomst mogelijk
beter te kunnen behandelen of zelfs voorkomen.
verSchillende
vormen van mS
MS kan bij verschillende personen een sterk verschillend beloop hebben. Daarnaast kunnen ook verschillende typen
van MS onderscheiden worden. Ook binnen deze typen kan het beloop sterk variëren. De meest voorkomende variant
is relapsing-remitting MS (RRMS) Ongeveer 85% van de mensen bij wie MS wordt vastgesteld hebben deze variant.
RRMS is een vorm van MS waarbij periodes met klachten (exacerbaties of schubs) worden afgewisseld met perioden
van herstel waarin klachten verminderen of zelfs verdwijnen. Vaak gaat RRMS na verloop van tijd over in secundair
progressieve MS. In deze tweede fase is er sprake van geleidelijke achteruitgang en treedt er tussentijds geen herstel
meer op. Bij ongeveer 15% van de mensen met MS treedt er meteen vanaf het begin verslechtering op zonder
tussentijds herstel. Er is dan sprake van primair progressieve MS.
relapsing-remitting MS
secundair progressieve MS
primair progressieve MS
schade aan
zenuwen
1
tijd
Vormen van MS
myeline
MULTIPLE SCLEROSE
Myeline vormt de isolerende laag rondom de zenuwen en zorgt voor een snelle geleiding van signalen die nodig zijn
voor het op gang brengen van processen in het menselijk lichaam. Beschadigingen van de myelinelaag leiden er daarom
toe dat signalen niet meer goed door de zenuwen worden doorgegeven. Afhankelijk van de plaats van de beschadiging
kunnen verschillende klachten ontstaan. Deze klachten (bijvoorbeeld slecht zien, spierzwakte of vermoeidheid)
verschillen hierdoor sterk tussen de ene en de andere persoon met MS.
13
Onderzoek naar multiple sclerose: Algemene inleiding
Hoofdstuk 1
Myelinevormende
cellen
Het centrale zenuwstelsel is opgebouwd uit zenuwcellen en ondersteunende cellen. De uitlopers van zenuwcellen
worden beschermd door myeline. Myeline wordt gemaakt door een bepaald type hersencel, de oligodendrocyt.
Oligodendrocyten die myeline hebben gemaakt, wikkelen zich om de zenuwcel en vormen zo de beschermende
myelinelaag. Oligodendrocyten kunnen beschadigd raken of zelfs gedood worden tijdens de aanval op myeline bij MS.
Op MRI-scans is te zien dat er in de gebieden waar myeline beschadigd is, soms nog gedeeltelijk myeline kan worden
terug gevormd. Er wordt veel onderzoek gedaan naar de reden dat myeline niet of slechts gedeeltelijk wordt terug
gevormd en hoe de productie van myeline verhoogd kan worden.
Beschadiging
van de zenuwen
Naast het verlies van myeline treedt er bij MS ook beschadiging van de zenuwen zelf op. Deze beschadigingen spelen
een belangrijke rol in het ontstaan van blijvende schade en lichamelijke beperkingen door MS. Een deel van het
wetenschappelijk onderzoek richt zich op hoe deze beschadigingen bijdragen aan de progressie van MS, de wijze
waarop de zenuwcellen worden beschadigd en hoe men dit eventueel kan herstellen of zelfs voorkomen.
Het
afweersysteem
Het is nog niet bekend hoe MS precies ontstaat. Wel is duidelijk dat het afweersysteem een grote rol speelt bij MS.
Het is mogelijk dat MS een auto-immuunziekte is. Bij een auto-immuunreactie is het afweersysteem van het lichaam
ontregeld en valt het, behalve virussen en bacteriën, ook lichaamseigen weefsel aan. Bij MS is myeline in de hersenen
en het ruggenmerg (het centrale zenuwstelsel) het doelwit van het afweersysteem.
Het afweersysteem is opgebouwd uit een heleboel verschillende typen cellen. De witte bloedcellen zijn de
belangrijkste cellen van het afweersysteem. Er bestaan verschillende soorten witte bloedcellen die elk hun eigen
functie hebben. Voorbeelden van dergelijke functies zijn: het aanvallen en doden van cellen waarbinnen zich een virus
bevindt, het maken van speciale eiwitten (antilichamen) die zich aan vreemde stoffen of bacteriën kunnen binden en
het onschadelijk maken van vreemde stoffen waaraan antilichamen gebonden zijn door deze ‘op te eten’.
De verschillende cellen van het afweersysteem kunnen elkaar beïnvloeden. Voor het grootste gedeelte gebeurt dit
met behulp van stoffen die cytokinen genoemd worden. Als cellen actief worden, bijvoorbeeld door contact met een
lichaamsvreemde stof, kunnen ze verschillende cytokinen maken en uitscheiden. Deze cytokinen kunnen ieder weer
verschillende typen cellen van het afweersysteem activeren of juist remmen. Door de verschillende typen cellen en de
verschillende manieren waarop zij elkaar beïnvloeden, vormt het afweersysteem een heel complex systeem. Hierdoor is
het vaak moeilijk om uit te zoeken wat er precies mis is wanneer het afweersysteem ontregeld is.
MS
en de bloed-hersenbarrière
Het centrale zenuwstelsel is een heel belangrijk onderdeel van het lichaam. Daarom wordt het beschermd door een
barrière die ervoor zorgt dat er geen binnendringers vanuit het bloed de hersenen binnenkomen. Dit wordt de bloedhersenbarrière genoemd. Deze barrière bestaat uit een aaneengesloten rij van cellen die samen de wanden van de
bloedvaten vormen. Deze bloedvaten worden extra verstevigd door een netwerk van speciale eiwitmoleculen.
Afweercellen en de meeste stoffen uit het bloed kunnen deze bloed-hersenbarrière niet zomaar passeren. Dit
betekent dat wanneer het afweersysteem actief wordt, dit in normale gevallen niet zal leiden tot ontstekingen in de
hersenen. Voor gevallen dat er, ondanks de bloed-hersenbarrière, toch iets in de hersenen komt dat daar niet thuis
hoort, beschikken de hersenen over een eigen, beperkt afweersysteem. Bij MS blijken er lekken op te treden in de
bloed-hersenbarrière. Hierdoor kunnen afweercellen uit het bloed toch de hersenen binnenkomen, daar ontstekingen
veroorzaken en myeline beschadigen.
Dat erfelijke factoren een rol spelen bij de gevoeligheid voor het krijgen van MS betekent overigens niet dat MS erfelijk
is in de gebruikelijke zin van het woord. De kans dat kinderen van personen met MS ook MS krijgen, is heel klein. Zelfs
mensen met precies hetzelfde erfelijke materiaal (eeneiige tweelingen) ontwikkelen vaker niet dan wel allebei MS. Wel
kan de kans op MS in sommige families hoger zijn dan het gemiddelde van 1:1000.
Magnetic
resonance imaging (MRI) en de MS-Hersenbank
Onderzoek naar en diagnose van MS zijn lange tijd bemoeilijkt, omdat je niet bij levende mensen in de hersenen kunt
kijken. Sinds ongeveer 30 jaar beschikt men echter over de MRI-techniek. Hierbij wordt gebruik gemaakt van magnetische velden waarmee het wel mogelijk is om een beeld te maken van de hersenen van een levend persoon. Deze
techniek is zeer belangrijk voor zowel de diagnose als het onderzoek naar MS.
Sinds 1990 wordt veel MS-onderzoek mogelijk gemaakt door de MS-Hersenbank, die financieel wordt ondersteund
door Stichting MS Research. De MS-Hersenbank verzamelt hersenmateriaal van mensen met en zonder MS, die tijdens
hun leven een speciaal donorcodicil hebben getekend. Dit hersenmateriaal wordt nauwkeurig bekeken en beschreven,
waarna het beschikbaar gesteld wordt aan MS-onderzoekers. Op deze manier kan onderzoek gedaan worden naar het
ziekteproces van MS in hersenmateriaal van mensen.
Belangrijke
resultaten tot nu toe
Hoewel er nog geen oplossing is waardoor MS genezen kan worden, zijn er in de afgelopen jaren wel belangrijke
resultaten geboekt binnen het wetenschappelijk onderzoek naar MS. In de afgelopen jaren zijn de criteria voor het
beoordelen van MRI-beelden aangepast. Hierdoor kan de diagnose MS nu sneller en met meer zekerheid gesteld
worden. Ook zijn er inmiddels verschillende medicijnen die het ziekteproces kunnen remmen. Dit zijn resultaten van
onderzoek die goed merkbaar zijn voor mensen met MS. Maar er worden ook belangrijke resultaten geboekt die niet
direct zichtbaar zijn. Er is door wetenschappelijk onderzoek meer bekend over de werking van de bloed-hersenbarrière
en over de werking van het afweersysteem in MS. Daarnaast wordt steeds meer duidelijk over omgevingsfactoren die
mogelijk een rol spelen in het ontstaan en het verloop van MS.
Wetenschappelijk
onderzoek naar MS
Zoals hierboven aangegeven spelen vele verschillende processen een rol bij het ontstaan en het verloop van MS.
Hoewel er al belangrijke resultaten zijn geboekt, wordt op al deze verschillende gebieden onderzoek gedaan om het
ziekteproces van MS nog beter te leren begrijpen. Meer kennis over de manier waarop MS ontstaat, is een voorwaarde
voor een gerichte zoektocht naar mogelijkheden om deze ziekte in de toekomst te kunnen behandelen en misschien te
voorkomen. Een belangrijk deel van het onderzoek richt zich nu op progressieve MS. Voor deze vorm van MS zijn nog
geen behandelmogelijkheden. Door een internationale samenwerking proberen wetenschappers het onderzoek naar
progressieve MS in een stroomversnelling te brengen.
De
rol van omgevings- en erfelijke factoren
Hoewel nog niet precies bekend is hoe MS ontstaat, is het wel bekend dat zowel omgevings- als erfelijke factoren de
kans op het krijgen van MS beïnvloeden. Het is nog niet precies bekend welke factoren hier precies een rol in spelen.
De reden hiervoor is, dat het waarschijnlijk gaat om een combinatie van vele factoren en dat deze factoren bovendien
voor verschillende personen anders kunnen zijn. Mogelijk kunnen de omgevings- en erfelijke factoren ook het verloop
van de ziekte beïnvloeden.
14
15
MS-centra voor onderzoek
2.1 inleiding
De zorg voor mensen met MS wordt in toenemende mate uitgevoerd in MS-centra. Dat wil zeggen dat ziekenhuizen
proberen om de zorg te optimaliseren door het opzetten van een samenwerkingsverband van neurologen, verpleegkundigen en andere deskundigen op het gebied van MS. In aansluiting hierop heeft Stichting MS Research besloten
tot het ondersteunen van MS-centra voor onderzoek en zorg. Hierbij krijgen MS-centra die zelf veel investeren in
onderzoek naar MS een langdurig en structurele ondersteuning van Stichting MS Research. Deze ondersteuning is
speciaal bedoeld om het onderzoek nog verder te stimuleren en uit te breiden. Het is de bedoeling dat met de toename
van dit onderzoek ook de zorg voor mensen met MS in deze centra toeneemt. In 2013 zijn drie MS-centra in Nederland
financieel door Stichting MS Research ondersteund.
2.2 vumc mS centrum amSterdam
onderzoeKSprogramma: neurodegeneratie
KlinieK (09-358d mS)
en neuroprotectie in
mS:
van molecuul tot
Doel van het centrum
Het VUmc MS Centrum Amsterdam is een toonaangevend (inter)nationaal centrum op het gebied van MS waar
hoogwaardig onderzoek, zorg voor patiënten en de opleiding van talenten centraal staan. Het centrum richt zich op de
vroege opsporing van MS en behandeling op maat.
Bij verschillende afdelingen binnen het VUmc wordt onderzoek gedaan naar MS. De samenwerking tussen de
verschillende vakgebieden is één van de sterke punten van het MS-centrum. Samen werken de afdelingen binnen
het VUmc MS Centrum Amsterdam aan het verbeteren van de diagnostische mogelijkheden voor het vaststellen en
typeren van MS en aan het zoeken naar effectievere behandeling van mensen met MS. Daarnaast werken ze aan het
ontrafelen van factoren die bijdragen aan de ziekte MS. De samenwerkende afdelingen zijn: moleculaire celbiologie
en immunologie, radiologie, neurologie, pathologie, revalidatiegeneeskunde, epidemiologie en biostatistiek, klinische
chemie en anatomie en neurowetenschappen.
2
Achtergrond van het centrum:
Het VUmc MS Centrum Amsterdam is in 1998 opgericht met steun van de Stichting MS Research. De Stichting
verzorgde de subsidiëring van verschillende onderzoekslijnen in een programmasubsidie, die de basis vormden van
het centrum (1998–2002). De continuering van het centrum werd gewaarborgd door een tweede programmasubsidie
(2002–2006). In de tweede programmasubsidie is ook het MS-MRI Centrum van het VU medisch centrum
opgenomen. Dit centrum werd al sinds 1995 gesubsidieerd door de Stichting MS Research. In 2006 is door de
Stichting MS Research een derde programmasubsidie voor het centrum gehonoreerd (2006-2010). In 2010 is een
vierde programmasubsidie gehonoreerd (2010–2014). Dit verslag behandelt deze vierde programmasubsidie. Een
substantieel deel van het wetenschappelijk onderzoek van het MS Centrum Amsterdam wordt financieel ondersteund
door de Stichting MS Research. Ofwel via structurele steun aan het centrum (de programmasubsidies) ofwel via de
subsidies voor losse onderzoeksprojecten.
Programmasubsidie 2010 - 2014 (09-358d MS)
MS CENTRA VOOR ONDERZOEK
Centrale thema
Het VUmc MS Centrum Amsterdam is een innovatief onderzoeksprogramma gestart naar de bescherming van hersencellen bij mensen met MS. MS werd tot voor kort gezien als een ‘pure’ ontstekingsziekte van het centraal zenuwstelsel.
De huidige geneesmiddelen zijn er dan ook op gericht om de ontsteking bij mensen met MS sterk te verminderen. Dit
helpt, maar geneest de ziekte niet. De laatste jaren is duidelijk geworden waarom de therapie niet voldoende is: het
verlies van functie van de hersencellen en van de verbindingen tussen hersencellen zorgt ervoor dat mensen met MS
steeds verder achteruit gaan. Door de schade en het verlies van hersencellen tegen te gaan, verwachten de onderzoekers van het VUmc MS Centrum Amsterdam dat zowel de neurologische achteruitgang als het geheugenverlies
kan worden aangepakt.
17
Hoofdstuk 2
MS-centra voor onderzoek
Het VUmc MS Centrum Amsterdam heeft er voor gekozen om gezamenlijk onderzoek te doen naar het voorkomen en
herstellen van beginnende schade aan hersencellen bij MS. Als één van de weinige MS-centra in de wereld beschikt
het centrum in Amsterdam over alle benodigde expertise om dit lastige, maar heel belangrijke onderzoek aan te pakken.
Om schade aan hersencellen te voorkomen is het van belang beter te begrijpen hoe deze schade ontstaat. Hiervoor is
nog veel onderzoek nodig. Hopelijk komen we met het onderzoek van de komende jaren tot een behandeling die niet
alleen het aantal ontstekingen vermindert, maar ook hersencellen beschermt of beschadigde hersencellen herstelt.
Daarnaast willen we graag onderzoeken hoe we de gevolgen van vergevorderde schade aan hersencellen voor mensen
met MS zoveel mogelijk kunnen beperken. Binnen deze programmasubsidie werken de verschillende afdelingen nauw
met elkaar samen in vier onderzoekslijnen, elk gericht op een onderdeel van dit werk. Zo hopen we voor alle mensen
met MS, of ze nu pas de diagnose te horen hebben gekregen of al lang met de gevolgen van MS leven, kennis te
vergaren die voor hen van belang is.
Belangrijkste resultaten
• Zenuwceluitlopers in MS-laesies kunnen minder goed voedingsstoffen opnemen en er treedt een verandering op in
het energie metabolisme als gevolg van niet goed functionerende mitochondriën.
• Het verminderen van de hoeveelheid hersenweefsel waar zenuwcellen zitten (grijze stof atrofie) gemeten met behulp
van MRI kan voornamelijk worden verklaard door verlies van zenuwceluitlopers (axonen) in de neocortex (deel van
de buitenkant van de hersenen).
• Kwantitatieve MRI-metingen, gevalideerd in post-mortem studies, kunnen mogelijk klinisch gebruikt worden om
patiënten ‘profielen’ beter in kaart te brengen en te relateren aan neurologische schade.
• We hebben een aantal gen-varianten gevonden die zijn geassocieerd met een kleiner hersenvolume bij mensen met
MS.
• We hebben op pathologieniveau kunnen aantonen dat beschermende ontstekingscellen aanwezig zijn in net
ontstane afwijkingen in het brein en ruggenmerg bij mensen met MS.
De onderzoekslijnen
Innovatie
Doel
We zoeken binnen deze innovatieve onderzoekslijn naar potentiële aangrijpingspunten voor behandelingen om hersenschade te herstellen of hersencellen te beschermen tegen schade. In deze onderzoekslijn wordt gebruik gemaakt van
diverse cel- en weefselkweekmodellen die relevant zijn voor MS om het proces van celschade en –verlies in elk detail te
onderzoeken.
Belangrijkste resultaten
• We begrijpen beter hoe bepaalde ontstekingscellen de hersenen in gaan en welke factoren hierbij een cruciale rol
spelen.
• Sommige ontstekingscellen kunnen beschermend werken en over grotere afstanden migreren in de hersenen dan
andere schadelijke ontstekingscellen.
• We laten zien dat stervormige hersencellen (astrocyten) onder invloed van een bepaald molecuul (PGC-1alpha) de
ontstekingsreactie kunnen verminderen.
Belang
Het begrijpen hoe ontstekingscellen migreren over de bloed-hersenbarrière en zich bewegen in de hersenen geeft beter
inzicht hoe we de migratie van schadelijke cellen de hersenen in kunnen tegen gaan en hoe we de mogelijk beschermende rol van ontstekingscellen en astrocyten kunnen stimuleren. Het verminderen van de ontsteking in de hersenen
van mensen met MS door de hersencellen zelf te beïnvloeden biedt mogelijk extra bescherming naast bestaande
anti-ontsteking therapieën.
Begeleider
Prof.dr. Elga de Vries
Vertaling
Doel
De fundamentele bevindingen vanuit onderzoekslijn 1 (in cellen, modellen en weefsels) worden in deze onderzoekslijn
vertaald naar de mens. Tegelijkertijd wordt gestart met het bestuderen van de effectiviteit van bestaande geneesmiddelen. Deze middelen worden ook met succes gebruikt bij andere ziektes met hersenschade, zoals de ziekte van
Parkinson en Alzheimer. Ook wordt er gekeken naar het effect van “brain training” om het geheugenverlies bij MSpatiënten te beperken.
18
Belang
Terwijl er steeds meer medicijnen beschikbaar zijn om relapsing-remitting MS (RRMS) te bestrijden, zijn er nog geen
middelen beschikbaar die effectief de progressie van de ziekte verminderen. Schade aan zenuwceluitlopers wordt
gezien als de belangrijkste oorzaak van deze progressie. Het beter begrijpen van processen die bijdragen aan het verlies
van deze uitlopers, zoals een veranderd energie metabolisme zijn daarom van essentieel belang voor het ontwikkelen
van therapieën om zenuwbanen te beschermen.
Grijze stof atrofie is een belangrijke maat voor de progressie van MS, echter tot nu toe was het onbekend wat grijze stof
atrofie, gemeten met behulp van MRI, precies is. Nu weten we zeker dat grijze stof atrofie een maat is voor zenuwafbraak en weten we met meer zekerheid dat zenuwafbraak een belangrijke rol speelt in MS.
Vertaling van post-mortem resultaten naar de in vivo setting heeft grote klinische relevatie; wanneer een ‘MS schade’
profiel (en de ontwikkeling hiervan) voor een persoon met MS in kaart gebracht kan worden, kan dit gebruikt worden om
een beter beeld te krijgen van (het verloop van) de cognitieve en lichamelijke invaliditeit, alsmede de farmacologische
behandelmethoden.
Begeleider
Prof.dr. Jeroen Geurts
Verbeelding
Doel
In deze onderzoekslijn wordt zenuwcelafbraak via MRI in beeld gebracht en bestudeerd via nauwkeurige metingen.
Hierbij wordt gekeken hoe het verlies aan zenuwen samenhangt met de andere afwijkingen die bij MS in het
hersenweefsel optreden. Vervolgens wordt ook onderzocht of het verlies van zenuwen haar relaties met de andere
veranderingen in de loop van het ziekteproces veranderen en of er hierin verschillen zijn tussen ziektetypen. Tenslotte
wordt het effect van verschillende therapieën hierop onderzocht.
Belangrijkste resultaten
• We hebben een methode ontwikkeld om 3D MRI-beelden beter en sneller te analyseren.
• In progressieve MS toont de zenuwafbraak weinig verband met andere afwijkingen.
• Met een groot aantal verschillende metingen worden verschillende therapieën vergeleken.
Belang
Het meten van het verlies van zenuwen met MRI is een belangrijk middel om de rol hiervan in het ziekteproces bij
MS te begrijpen. Maar niet alleen de afbraak van zenuwen zelf moet worden begrepen, ook hoe deze samenhangt met
de andere afwijkingen is van belang. Bijvoorbeeld voor het ontwikkelen van medicijnen die de schade aan zenuwen
bestrijden is het belangrijk te begrijpen in hoeverre deze schade optreedt, en in hoeverre deze voortvloeit uit de
andere MS-afwijkingen.
19
MS-centra voor onderzoek
Hoofdstuk 2
We gebruiken MRI-methoden hier ook voor het begrijpen en meten van de effecten van bestaande therapieën. Dit
onderzoek geeft door verbetering van methoden voor beide toepassingen niet alleen beter inzicht in ziekteprocessen,
maar levert ook betrouwbare manieren om de ontwikkeling en toepassing van nieuwe therapieën te verbeteren.
Onderzoeksleiders programmasubsidie
Prof.dr. Elga de Vries
Prof.dr. Jeroen Geurts
Begeleider
Dr.ir. Hugo Vrenken
Managementteam VUmc MS centrum Amsterdam
Prof.dr. Frederik Barkhof
Prof.dr. Christien Dijkstra
Prof.dr. Jeroen Geurts
Prof.dr. Bernard Uitdehaag
Prof.dr. Paul van der Valk
Verbetering
Doel
In deze onderzoekslijn wordt gezocht naar nieuwe manieren om zenuwafbraak bij mensen met MS te meten. Zo wordt
onderzoek gedaan naar het gebruik van OCT. Met deze oogscan kan in zeer korte tijd de schade van de oogzenuw in
beeld gebracht worden. De hoeveelheid schade aan de oogzenuw in de tijd is een maat voor de hoeveelheid schade in
de hersenen en dus voor het afsterven van zenuwcellen. Verder wordt er gekeken welke biomarkers (meetbare stoffen in
het bloed en in het hersenweefsel van overleden patiënten) een maat zijn voor de (hoeveelheid) schade in de hersenen.
Ook worden de verschillende testen voor het meten van geheugenverlies onderzocht op hun effectiviteit bij mensen met
MS.
Belangrijkste resultaten
• Schade aan het netvlies is afhankelijk van ziektetype; bij mensen met RRMS is de zenuwlaag in het netvlies dunner
dan bij primair progressieve MS en bij mensen met een goedaardig verloop van MS, de zogenaamde benigne MS.
• Zenuwcelschade in het oog reflecteert schade in het gehele visuele systeem van mensen met MS.
• Met behulp van OCT krijgen we meer inzicht in de mechanismen die verantwoordelijk zijn voor het verspreiden van
de afbraak van zenuwen (trans-synaptische degeneratie).
• Met een combinatie van MRI en spectrometrie is bepaald hoe normaal weefsel eruit ziet. Dit kunnen we nu
vergelijken met hersenweefsel van patiënten.
Instituut
VU medisch centrum, Amsterdam
Startdatum van het centrum
1998
Subsidie
vanaf 1 okt. 2010: € 1.200.000,- voor 2 jaar, met uitzicht op verlenging tot 1 oktober 2014.
Na twee jaar is het programma positief beoordeeld door een audit commissie die is ingesteld door Stichting MS
Research. Vanaf 1 okt 2012: € 1.125.000 voor 2 jaar.
Belang
De afbraak van zenuwen is verantwoordelijk voor onomkeerbare invaliditeit bij mensen met MS. Het meten hiervan is
belangrijk om in te schatten hoe de situatie van een persoon met MS is. Daarnaast kan het een voorspellende waarde
hebben voor mogelijke invaliditeit in de toekomst. Met OCT kan men schade aan het centraal zenuwstelsel meten, met
veel grotere precisie dan met bijvoorbeeld MRI. Tot op de µm nauwkeurig kunnen we zenuwcellen in kaart brengen,
waarmee op individueel niveau de mate van zenuwcelafbraak gemeten kan worden. Naast het monitoren van mensen
met MS is OCT waardevol in klinische trials, om subtiele effecten van nieuwe medicatie te onderzoeken.
Begeleider
Dr. Joep Killestein
Onderzoekers programmasubsidie
Drs. Daphne Vogel, afdeling Moleculaire celbiologie en immunologie
Drs. Philip Nijland, afdeling Pathologie
Drs. Melissa Pinheiro, afdeling Moleculaire celbiologie en immunologie
Drs. Martijn Steenwijk, afdeling Radiologie
Drs. Oliver Wiebenga, afdeling Radiologie
Drs. Lisanne Balk, afdeling Neurologie
Drs. Eva Strijbis, afdeling Neurologie
Drs. Laura Jonkman, afdeling Anatomie en neurowetenschappen
Drs. Roel Klaver, afdeling Anatomie en neurowetenschappen
Dr. Axel Petzold, afdeling Neurologie
20
21
MS-centra voor onderzoek
Hoofdstuk 2
2.3 ErasMS Rotterdam
Rotterdams MS-centrum voor patiëntenzorg en onderzoek
Onderzoeksprogramma: MS
vanaf de eerste aanval
(10-490c MS)
Doel van het centrum
ErasMS is een academisch kennis- en expertisecentrum voor MS, zowel op regionaal als op (inter)nationaal niveau.
Op het gebied van onderzoek is er een team van wetenschappers en artsen die zich ten taak hebben gesteld de snelle
biotechnologische ontwikkelingen en mogelijkheden te vertalen naar de wereld van de patiënt. Speciale aandacht gaat
uit naar families waarin meerdere mensen MS hebben, naar erfelijkheid, naar zwangerschap bij MS, naar (agressieve)
varianten van MS en naar MS bij kinderen. Binnen ErasMS zijn twee MS-verpleegkundigen en een kinder MS
verpleegkundige werkzaam. Zij informeren mensen met MS over hun aandoening en leren hen beter met hun ziekte om
te gaan. Belangrijk hierbij is de ondersteuning van een revalidatieteam. In Nederland wordt veel informatie verleend
aan de MS-patiëntenvereniging, andere organisaties en de media. Met diverse mensen uit de media wordt meegewerkt
ten aanzien van vragen uit het publiek over allerlei aspecten rond MS, met name verschillende nieuwe mogelijkheden
tot behandeling in het reguliere en ook alternatieve circuit. De programmasubsidie van de Stichting MS Research ondersteunt meerdere onderzoeksprojecten.
heeft hierbij een coördinerende functie.
Een voorbeeld van deze internationale samenwerking is de Europese richtlijn voor de behandeling van kinderen met
MS, die tot stand kwam dankzij een bijeenkomst voor de Europese onderzoekers in Rotterdam. Op dit moment ligt de
aandacht op het onderzoeken van het DNA van Nederlandse en Canadese kinderen met MS op bepaalde risicogenen
zoals die nu bekend zijn bij MS. Dit gebeurt in samenwerking met het Hospital for Sick Children in Toronto en de
afdeling Genetische Epidemiologie van het Erasmus MC.
Het onderzoek naar MS en verwante aandoeningen bij kinderen ging in 2007 van start. Alle kinderen met een eerste
aanval van demyelinisatie van het centraal zenuwstelsel in Nederland worden geïncludeerd en vervolgd. Hierdoor weten
we nu dat deze aandoeningen bij 0,66 van de 100.000 kinderen in Nederland voorkomt. Opvallend is het aantal kinderen van niet-Europese origine en de grote hoeveelheden autoimmuunziekten die in de families van kinderen met MS
worden gerapporteerd. Verder genetisch onderzoek volgt.
Deze onderzoekslijn heeft internationaal in belangrijke mate bijgedragen aan een beter model om bij kinderen al bij de
eerste verschijnselen te voorspellen of ze MS gaan ontwikkelen.
MS en ontstekingsfactoren
De ene mens verwerkt virus infecties makkelijker dan de andere. Wij bekijken nu of de reactie op het voor MS
belangrijke EBV virus anders verloopt bij patiënten en ook gezonde mensen die drager zijn van de MS-risicogenen.
Achtergrond van het centrum
Het MS centrum ErasMS is opgericht in 2002. De initiatiefnemers van het MS-centrum hebben Rotterdam uitgekozen
vanwege de grote kennis die hier aanwezig is op gebied van het immuunsysteem, erfelijkheid en virussen. Het MS-onderzoek is grotendeels ingebed in de Rotterdamse onderzoeksscholen NIHES (epidemiologie, de leer van de verspreiding van ziekten) en Molecular Medicine (biomedisch translationeel onderzoek, onderzoek gericht op toepassing van in
het laboratorium verkregen onderzoeksresultaten in de gezondheidszorg). Sinds januari 2005 werden door deze onderzoeksscholen cursussen voor biomedische onderzoekers en symposia over MS georganiseerd, waarin wetenschappers uit
diverse Europese landen deel uit namen. Voorts participeert het MS-centrum uiteraard in klinische studies naar nieuwe
behandelingsvormen die ziekteprocessen bij MS moeten afremmen. ErasMS heeft samen met Sanquin het landelijke
Expertisecentrum voor Neuromyelitis Optica (NMO) opgericht, dat service verleent aan alle neurologen in Nederland.
Vanwege de rol van het afweersysteem werd ook postdoc immunoloog dr. Marvin van Luijn aangesteld teneinde het
samenspel van deze omgevingsfactoren met het afweersysteem te onderzoeken. De afgelopen tijd werd vooral besteed
aan het ontwikkelen van moderne technieken om de functies van belangrijke cellen in het immuunsysteem beter te
kunnen uitlezen. De postdoc zet zich momenteel in om met de modernste technieken de karakteristieken en functie
van ontstekingscellen in het bloed van MS-patiënten beter in kaart te brengen. Remming van dit soort cellen is tot nog
toe het enige dat als waardevolle therapie is gebleken voor MS. Maar het moet nog veel beter. Een belangrijk doel is om
het meten van specifieke ontstekingscellen aan te wenden als biomarkers voor de ziekte, bijvoorbeeld voor voorspelling
van een goed of slecht beloop. Ook proberen we de immuunfunctie van bepaalde genen die geassocieerd zijn met MS
in ontstekingscellen te ontrafelen en hoe deze een negatieve rol kunnen spelen in het ziekteproces.
Programmasubsidie 2011 - 2014 (10-490c MS)
De onderzoekslijn heeft diepgravend onderzoek verricht naar de functie van het nieuwe MS risico gen CLEC16. Het
blijkt betrokken bij de presentatie van (auto) antigenen.
De derde programmasubsidie ‘MS vanaf de eerste aanval’ voor het MS Centrum ErasMS ging van start op 1 oktober
2011. Het betreft een ondersteuning voor het nieuwe onderzoek, dat de laatste jaren in Rotterdam werd opgestart op
het gebied van het thema “Biologische factoren die oorzaak en beloop van MS beïnvloeden”. Het onderzoek omvat
de vakgebieden genetica, epidemiologie, immunologie (de leer van het afweersysteem), de klinische neurologie en de
kinderneurologie. Centraal staat hierbij de persoon met MS die het centrum bezoekt op zoek naar goede zorg. Veelal
betreft het een second opinion, met name over de diagnose of over het behandelbeleid. Van alle mensen met MS wordt
materiaal verzameld zoals serum en cellen uit het bloed, hersenvocht en DNA. Met dit programma wordt beoogd zoveel
mogelijk koppeling te krijgen tussen aan de ene kant de situatie die wordt waargenomen bij de patiënt en aan de
andere kant de nieuw te meten biomarkers in het laboratorium.
De onderzoekslijnen
MS bij kinderen
MS en erfelijkheid
MS wordt beïnvloed door erfelijke factoren. Op het gebied van DNA variaties zijn inmiddels een aantal bekende genen
geïdentificeerd. Deze variaties verhogen het risico om MS te krijgen een beetje. Ook werd aannemelijk gemaakt dat MS
veel sterker door moeders dan door vaders aan het nageslacht wordt doorgegeven. Onder leiding van Prof. dr. Hintzen
heeft een internationale groep onderzoekers een nieuw gen gevonden dat mogelijk betrokken is bij de ontwikkeling
van MS, echter moet validatie van deze bevinding nog plaatsvinden. Inmiddels is ook een familielid van dit gen
geassocieerd met MS. Deze vondst is een doorbraak omdat het gen mogelijk een rol speelt bij de aftakeling die
optreedt in de loop van de ziekte. Genen waarvan eerder een relatie met MS zijn aangetoond, zijn allen gerelateerd
aan het immuunsysteem. De nieuw ontdekte genen, Kif-1b en Kif21b, komen echter met name tot expressie in het
zenuwstelsel. Het speelt een rol bij het transport van moleculen over de lange zenuwvezels in de hersenen en het
ruggenmerg. Dit draagt bij aan het bewijs dat neurodegeneratieve processen bij MS een rol spelen en biedt belangrijke
uitganspunten voor verder onderzoek. Deze onderzoekslijn is nauw verweven met het onderzoek van dr. Karim Kreft.
Heel sterk is ingezet op het identificeren van kinderen en jongeren met MS in Nederland. Van een deel van de subsidie
werd dr. Immy Ketelslegers en later drs. Danielle van Pelt als arts onderzoeker aangesteld. Dit onderzoek naar MS bij
kinderen wordt vanwege de zeldzaamheid van de aandoening direct gekoppeld aan onderzoeksprojecten in Amerika en
elders in Europa. De International Pediatric MS Study Group van de Multiple Sclerosis International Federation (MSIF)
22
23
Hoofdstuk 2
MS-centra voor onderzoek
Dr. Karim Kreft verricht o.a. onderzoek naar de expressie en lokalisatie van de neuronale Kif-1b en Kif-21b MSrisicogenen. Hiervoor werd hersenmateriaal van “gezonde, niet demente” controles, mensen met MS en mensen met
de ziekte van Alzheimer verzameld met behulp van de Nederlandse Hersenbank in Amsterdam. In dit materiaal werd
onderzocht of de genen verschillen in de hoeveelheid waarin het aangemaakt wordt tussen deze drie patiëntengroepen.
Tevens hebben we gekeken of de verschillen in hoeveelheid mogelijk veroorzaakt worden door de gevonden genetische
variatie in deze genen. Verder wordt onderzocht waar het eiwit product van dit gen tot expressie komt in de hersenen
van deze patiëntengroepen. We hebben gevonden dat een hoge expressie van dit eiwit ertoe leidt dat mensen met MS
sneller achteruitgaan. Dit is onafhankelijk van de variaties in de genen voor de kif’s. Momenteel zijn we aan het
onderzoeken of deze eiwitten ook meer tot expressie komen in de afwijkingen (laesies) in de hersenen van mensen
met MS. Tevens willen we onderzoeken waarom het nadelig is als er veel van dit eiwit tot expressie komt.
(biomarkers) en die ook meer informatie geven over biologische processen die een rol spelen bij MS. Hieruit zijn eerder
diverse eiwitten geïdentificeerd die in de hersenvloeistof van patiënten met MS verhoogd voorkwamen. Verscheidene
eiwitten die betrokken zijn bij ontstekingsreacties, zoals clusterine en complement C3 en eiwitten die van invloed zijn
op neurodegeneratie, zoals chromogranine A, zijn in verhoogde concentratie aanwezig in de ruggenmergvloeistof
van mensen met MS. Daarnaast zijn met de meest geavanceerde proteomics-technieken experimenten gedaan om
verschillen te ontdekken tussen mensen met verschillende soorten MS (primair progressief versus relapsing remitting).
Hieruit bleek dat er eigenlijk weinig verschillen te vinden zijn in de eiwitten in hersenvloeistof tussen de verschillende soorten MS, alhoewel de gevonden verschillen wel zeer interessant zijn. Onder andere een eiwit dat belangrijk zou
kunnen zijn bij het remyelinisatie proces in MS alsmede een eiwit gerelateerd aan de vitamine-D homeostase in het
lichaam werden namelijk in veel lagere concentraties aangetroffen in primair progressieve MS. Deze resultaten zijn
inmiddels gevalideerd met andere analyse technieken. Marcel Stoop promoveerde op dit onderzoek bij
prof. dr. R.Q. Hintzen.
De meest recente proteomics experimenten zijn uitgevoerd om het effect van behandeling van Relapsing Remitting
MS op de eiwitten in ruggenmergvloeistof te bepalen. Hiervoor werd ruggenmergvloeistof afgenomen voordat de
behandeling met Tysabri begon en een jaar later nogmaals. Hieruit bleek dat een zeer groot deel van de ontstekinggerelateerde eiwitten in lagere concentraties aanwezig is na behandeling met Tysabri. Validatie experimenten met
andere massa spectrometrie technieken hebben deze resultaten bevestigd.
Collega Vaibhav Singh uit India gebruikt dezelfde technieken om 1. te proberen om voorspellende markers te vinden in
de hersenvloeistof, 2. Biomarkers voor MS-activiteit te vinden in urine, 3. De immuunglobulinen in de hersenvloeistof
van mensen met MS te karakteriseren, en te bezien in welke mate ze unieke eigenschappen bezitten tussen mensen
met MS onderling.
Uit dit onderzoek blijkt dat kinesines betrokken zijn bij de neurodegeneratie die optreedt bij MS, maar ook bij de ziekte
van Alzheimer. Dit ondersteunt de gedachte dat er overlappende problematiek is tussen MS en andere neurodegeneratieve ziekten.
Voorspellen van MS
In september 2006 werd een samenwerkingsverband gestart met tien Nederlandse academische ziekenhuizen om
mensen na een eerste aanval van mogelijke MS (CIS) systematisch verder te vervolgen en te kijken of nieuwe testen
het verdere beloop kunnen voorspellen. Dit heet de PROUD studiegroep (Predicting the OUtcome of a Demyelinating
event). In dit onderzoek worden zowel klinische gegevens van patiënten als MRI, bloed en hersenvocht van patiënten
verzameld en bewaard voor latere analyse. Ruim 200 mensen zijn momenteel opgenomen in het onderzoek. Op dit
moment is dr. Naghmeh Jafari bezig met het vergelijken van de ernst van vermoeidheid binnen deze groep en gezonde
controles. Ook zullen dr. Jafari en drs. Runia in deze groep het verband tussen vitamine D en vermoeidheid onderzoeken. Naast deze recent opgezette studie, hebben we ook een al langer bestaand cohort van CIS-patiënten verzameld
binnen ons centrum. Bijna al deze mensen hebben MRI-scans gehad en zijn poliklinisch vervolgd. Een recent MRIonderzoek binnen dit deze groep mensen heeft onder andere de voorspellende waarde van bepaalde MS-criteria na CIS
bevestigd en een nieuw MRI-criterium onder de aandacht gebracht. Ook zijn de nieuwe diagnostische criteria voor het
stellen van de diagnose MS getest in onze CIS-populatie. Het bleek dat met behulp van de nieuwe criteria de diagnose
MS sneller te stellen is, wat voor de mensen een periode van onzekerheid kan wegnemen.
Voor mensen met juist gediagnosticeerde neuritis optica (oogzenuwontsteking) loopt er een trial naar het mogelijk
neuroprotectieve effect van hoge dosis vitamine D.
Een belangrijke nieuwe bevinding betreft het feit dat moeheid vaak al aanwezig is bij een eerste voor MS verdachte
aanval (ook zonder uitgebreide MRI afwijkingen) en dat deze klachten een toekomstige diagnose MS voorspellen.
Een andere zeldzame variant van MS (bij kinderen en volwassenen) waar onderzoek naar wordt verricht is neuromyelitis
optica (NMO, of de ziekte van Devic). ErasMS heeft hiervoor een expertisecentrum opgericht en samen met Sanquin
een bloedtest ontwikkeld. Deze test wordt nu landelijk ingezet om het stellen van de diagnose neuromyelitis optica te
vereenvoudigen en deze te kunnen onderscheiden van MS. Onderscheid tussen MS en NMO is belangrijk aangezien de
therapie verschilt.
Dit onderzoek heeft geleid tot identificatie van een nieuwe auto-antistof die specifiek is voor een subgroep van mensen
met NMO, naast het al bekende anti-aquaporine 4 (AQP4)
Onderzoekers programmasubsidie
Dr. Marvin van Luijn (post-doc, afdeling Immunologie)
Dr. Marcel Stoop (post-doc, afdeling Neurologie)
Dr. Naghmeh Jafari (arts-onderzoeker, afdeling Neurologie)
Drs. Tessel Runia (arts-onderzoeker, afdeling Neurologie)
Dr. Immy Ketelslegers (arts-onderzoeker, afdeling Neurologie)
Drs. Danielle van pelt (arts-onderzoeker, afdeling Neurologie)
Drs. Julia Mescheriakova (arts-onderzoeker, afdeling Neurologie)
Dr. Karim Kreft (onderzoeker, afdeling Neurologie)
Drs. Vaibahv Singh (promovendus, afdeling Neurologie)
Managementteam ErasMS MS Centrum Rotterdam
Prof. dr. Rogier Hintzen, neuroloog/immunoloog
Prof. dr. Jon Laman, immunoloog
Instituut
Erasmus MC, universitair medisch centrum Rotterdam
Startdatum van het centrum
Juli 2002
2002 Programmasubsidie 02-490
2006
Verlenging programmasubsidie 02-490
2007 05-490b
2011 10-490c
Biomarkers voor MS
Dr. Marcel Stoop maakt in zijn onderzoek gebruik van hypermoderne analyse technieken die het mogelijk maken in één
keer het scala aan eiwitten op te sporen dat in een bepaald vloeistof zit (proteomics). Doel van dit onderzoek is het
opsporen van eiwitten die kunnen worden gebruikt voor de diagnose of voor voorspelling van het verloop van de ziekte
24
Subsidie
Sinds 1 oktober 2011 €200.000 per jaar
25
MS-centra voor onderzoek
Hoofdstuk 2
2.4 MS Centrum Limburg
Achtergrond van het centrum
Het Academisch MS Centrum Limburg is een multidisciplinair behandelcentrum voor MS, dat in 2007 is ontstaan uit
een samenwerkingsverband tussen Orbis Medisch Centrum Sittard- Geleen, het Academisch ziekenhuis Maastricht en
de Faculty of Health, Medicine and Life Sciences in Maastricht. Naast het optimaliseren van de patiëntenzorg en de
kwaliteit van leven van mensen met MS is de missie van het Academisch MS centrum Limburg het opstellen en
uitvoeren van basaal wetenschappelijk onderzoek naar oorzaken en nieuwe behandelmethoden van MS. Hierbij wordt
intensief samengewerkt met de universiteit Maastricht (MUMC ) en de universiteit Hasselt (Diepenbeek).
Het Academisch MS Centrum Limburg is wetenschappelijk actief op het gebied van immunologisch onderzoek (o.a.
oorzaak MS), prognostisch onderzoek (o.a. indicatoren voor het beloop van MS), onderzoek naar voedingssupplementen
en neuropsychologisch onderzoek. Medisch-wetenschappelijk onderzoek heeft als doel het beantwoorden van een vraag
op het gebied van ziekte en gezondheid door het op een systematische wijze verkrijgen en bestuderen van gegevens.
Het academisch MS Centrum Limburg profileert zich in Nederland door intensief onderzoek naar de invloed van
vitamine D op de ziekte multiple sclerose.
Programmasubsidie 2011 - 2014 (10-707 MS)
Achtergrond vitamine D
Vitamine D is de laatste jaren een hot topic in de onderzoekswereld. Ook binnen onderzoek naar de ziekte MS heeft dit
vitamine een belangrijke plek ingenomen. We hebben vitamines nodig voor allerlei processen in ons lichaam. Daarom is
voldoende toevoer van vitamines ook zo belangrijk.
Hoe komt het lichaam aan vitamine D?
Vitamine D wordt grotendeels (voor 95%) aangemaakt in de huid onder invloed van UVB-straling in zonlicht. De overige
5% nemen we op uit voeding. Er bestaan verschillende vormen van vitamine D. Het UVB-licht zorgt voor vorming van
een pre-vitamine D dat onder invloed van onze lichaamstemperatuur wordt omgezet in vitamine D3 (cholecalciferol).
Via voeding krijgen we ook vitamine D3 binnen via bijvoorbeeld vette vis, en vitamine D2 (ergocalciferol), de plantaardige variant, komt in kleine hoeveelheden voor in bijvoorbeeld paddenstoelen. Vitamine D is na opname in het
lichaam nog niet actief. Het inactieve vitamine D wordt via het bloed naar de lever vervoerd, waar het onder invloed van
leverenzymen wordt omgezet in een tussenvorm van vitamine D (25-hydroxy vitamine D, calcidiol). Deze tussenvorm
wordt door weer andere enzymen in de nieren omgezet naar de actieve, dus de werkzame, vorm van vitamine D
(calcitriol). Ook cellen in de hersenen en afweercellen in het bloed zijn in staat inactief vitamine D om te zetten in
actief vitamine D. Als we het hebben over de vitamine D status of vitamine D spiegel, hebben we het over de gemeten
waarde van de tussenvorm van vitamine D (25-hydroxy vitamine D). Deze waarde zegt iets over de beschikbare hoeveelheid vitamine D in het lichaam.
Waarvoor is vitamine D belangrijk?
De belangrijkste functie van vitamine D is de opname van calcium voor de opbouw van botten. Bij een ernstig tekort
aan vitamine D op kinderleeftijd kan rachitis ontstaan, in de volksmond ook wel bekend als de Engelse ziekte. Deze
ziekte wordt gekenmerkt door vergroeiïngen van de botten. Op latere leeftijd kan een vitamine D tekort voor botontkalking zorgen, ook wel osteoporose genoemd. De Nederlandse gezondheidsraad, adviseert om die reden om extra
vitamine D in te nemen, wanneer mensen weinig aan zonlicht worden blootgesteld. Ook risicogroepen zoals jonge
kinderen, volwassenen met een donkere huidskleur, zwangere vrouwen en mensen in verpleeg- en verzorgingstehuizen
wordt geadviseerd extra vitamine D in te nemen. Daarnaast wordt er op dit moment veel onderzoek gedaan naar
allerlei andere functies van vitamine D. Bijvoorbeeld naar de werking ervan binnen het afweersysteem, de hersenen en
de spieren. Onderzoekers houden zich onder andere bezig met de vraag welke rol vitamine D speelt in het ontstaan van
verschillende ziekten zoals auto-immuunziekten, hart- en vaatziekten en suikerziekte.
26
Wat is er tot nu toe bekend over de rol van vitamine D bij multiple sclerose?
De relatie tussen (een tekort aan) vitamine D en (het ontstaan van) MS werd eigenlijk voor het eerst gelegd in 1960.
De laatste tientallen jaren is de aandacht hiervoor binnen de wetenschap steeds verder toegenomen. De huidige
opvattingen over de ontwikkeling van MS zijn dat de ziekte ontstaat door een combinatie van erfelijke factoren
(vastgelegd in ons DNA) en bepaalde omgevingsfactoren. Er wordt nu vanuit gegaan dat vitamine D in ieder geval tot
een van deze omgevingsfactoren behoort, naast bijvoorbeeld het doormaken van bepaalde virusinfecties en roken.
Het onderzoek naar vitamine D heeft zich tot nu toe vooral gericht op het relapsing remitting type MS (RR-MS), met
name bij mensen met MS met een korte ziekteduur. De reden hiervoor is dat er nu vanuit wordt gegaan dat vooral in
deze groep mensen een ontregeling van het afweersysteem de bron van de problemen is, en dat de rol van vitamine D
hier het grootste kan zijn. Uit die onderzoeken is gebleken dat patiënten met RR-MS met een hogere vitamine D
waarde, minder kans hadden op een terugval (schub/relapse). Hogere vitamine D waarden hebben dus mogelijk een
beschermend effect op het krijgen van schubs. Daarnaast is het ook van belang om te kijken naar de effecten van
vitamine D op de ernst van het beloop van de ziekte. Er zijn echter nog weinig studies die dit verband hebben
onderzocht, en zodoende zijn er nog onvoldoende aanwijzingen dat hogere vitamine D waarden een effect hebben
op de ernst van het beloop van de ziekte.
Ook is er onderzoek gedaan naar het verband tussen vitamine D en veelvoorkomende symptomen van MS. Zo is er
onderzoek gedaan naar klachten van het zien, depressie en vermoeidheid. Er werd gevonden dat hoe hoger de
vitamine D waarden in het bloed waren, hoe lager de scores voor depressie waren (dus minder depressieve
gevoelens). Later bleek echter dat met name zonblootstelling en niet zozeer vitamine D zelf depressieve gevoelens
en vermoeidheid bij mensen met MS leek te verminderen. Er zal dus nog meer onderzoek nodig zijn om hier meer
duidelijkheid in te krijgen.
Welke mogelijke effecten heeft vitamine D bij mensen met MS?
Uit voorgaande blijkt dus dat er aanwijzingen zijn dat een vitamine D tekort een rol speelt in het ontstaan van MS en
ook effect heeft op het aantal schubs tijdens de ziekte. Het is echter niet alleen de vraag OF, maar ook HOE vitamine D
deze effecten bij MS bewerkstelligt.
De onderzoekslijnen
SOLAR en SOLARIUM: vitamine D suppletiestudies
Doel
Op dit moment loopt er een grote Europese studie, de SOLAR studie, naar het aanvullende effect van vitamine D3 op
behandeling met Interferon Beta. Deze studie is ontwikkeld om een toename in het aantal aanvalsvrije patiënten te
meten. Er zijn op dit moment 232 patiënten die meedoen aan deze studie en 1 of 2 jaar lang vitamine D of placebo
krijgen. Er doen 53 centra in Europa mee en de deelname aan deze studie is gesloten. De laatste patiënten zullen tot
en met januari 2015 opgevolgd worden. Het Academisch MS Centrum Sittard heeft deze studie geïnitieerd. Daarnaast
voeren wij op dit moment binnen het Academisch MS Centrum als aanvulling op de SOLAR studie de SOLARIUM
studie uit. Het doel van deze sub-studie is om het achterliggende mechanisme van het effect van vitamine D op het
afweersysteem verder te ontrafelen, door naar specifieke witte bloedcellen van de deelnemende patiënten te kijken.
Totdat de resultaten van deze studie bekend zijn, is het NIET raadzaam om als MS-patiënt buiten studieverband om,
te starten met de inname van hoge doseringen vitamine D.
Onderzoeker: Drs. A-H Muris.
Functionele karakterisering van het afweersysteem: verschillen tussen multiple sclerose patiënten en
gezonde controles
Doel
Multiple sclerose (MS) is een neurologische aandoening, waarbij het eigen afweersysteem om een nog onbekende reden
de hersenen en het ruggenmerg aanvalt. Hierbij spelen verschillende soorten afweercellen een belangrijke rol. Sommige
afweercellen wakkeren de ziekte aan (slechte afweercellen), andere moeten deze slechte afweercellen juist
tegenhouden (regulerende afweercellen). Echter, uit eerder onderzoek blijkt dat deze laatste niet goed functioneren
27
Hoofdstuk 2
bij mensen met MS. In dit onderzoek willen we kijken naar verschillende functies van de afweercellen, zowel van de
slechte als de regulerende cellen. We zullen onderzoeken of deze functies verschillen tussen mensen met MS en
gezonde vrijwilligers. Verder zullen we onderzoeken of de functie van afweercellen beïnvloed wordt door patiënt
specifieke ziektekenmerken (o.a. medicatiegebruik en MS type)
Onderzoeker: Drs. A-H Muris
Researchverpleegkundigen
Database Academische MS Centrum Limburg: Vitamine D en progressie van de ziekte
De
•
•
•
Doel
Over het algemeen zijn er sterke aanwijzingen dat vitamine D de inflammatoire component in MS kan onderdrukken.
Lange termijn effecten, dat wil zeggen het effect op de snelheid van de fysieke achteruitgang, zijn echter nog
nauwelijks bekend. Dit terwijl mensen met progressieve MS (ondervinden een geleidelijke achteruitgang van de ziekte)
een lagere vitamine D status lijken te hebben in vergelijking met de mensen met MS die een aanvalsgewijze ziekte
hebben en mensen met MS met een lage vitamine D status lijken meer last van de ziekte te hebben.
In deze studie onderzoeken we daarom het verband tussen de vitamine D waarde en de fysieke achteruitgang van MS
patiënten in het verloop van de tijd. Hierbij kijken we ook naar de aanwezigheid van inflammatoire markers in het
bloed. We maken daarbij gebruik van historische verzameling van data van mensen met MS bij wie vitamine D status,
ziekteactiviteit en ernst van de ziekte werd bijgehouden.
Onderzoeker: Drs. A-H Muris
Vitamine D3 en de stress-as in multiple sclerose
Doel
Patiënten met multiple sclerose hebben een hoger risico op het krijgen van depressieve symptomen, ook al in een
vroege fase van de ziekte. Het is nog onduidelijk waarom dit zo is. Er wordt gedacht dat twee dingen een belangrijke rol
spelen: de verstoorde balans in het immuunsysteem en een overmatige activiteit van de stress-as. De stress-as is een
hormonaal feedback systeem, waarbij activatie van een kleine hersenstructuur, de hypothalamus, uiteindelijk zorgt voor
de productie van cortisol, het stress(-respons) hormoon, in de bijnieren.
Eerdere studies in onze groep hebben aangetoond dat vitamine D de balans terugbrengt in het immuunsysteem, maar
hebben ook aanwijzingen gegeven dat vitamine D mogelijk de stress-as kan beïnvloeden. Om dit te onderzoeken, vragen
we 80 vrouwelijke patiënten met RRMS voor deelname aan deze studie. Zij zullen gedurende 16 weken vitamine D of
placebo gebruiken. Voor en na die periode zullen we cortisol metingen doen in het speeksel van deze patiënten, alsook
immunologische bepalingen in het bloed. Dit zal meer inzicht geven in de potentiele effecten van vitamine D in MS en
als zodanig kunnen bijdragen aan behandelopties.
Onderzoeker: Drs. L. Rolf
28
MS-centra voor onderzoek
De programmasubsidie voor MS Centrum Limburg wordt met name gebruikt voor de ondersteuning van wetenschappelijke projecten van promovendi van het academisch MS Centrum Limburg door twee gespecialiseerde
verpleegkundigen.
•
•
•
•
•
taken van de researchverpleegkundige bij wetenschappelijk onderzoek zijn:
Zij draagt er zorg voor dat onderzoeken c .q. protocollen lokaal uitvoerbaar zijn.
Zij zorgt mede voor indiening van de protocollen ter goedkeuring bij de Medisch Ethische Toetsingscommissie.
Zij informeert mensen met MS naar de behandelmogelijkheden van MS en geeft informatie aangaande het
wetenschappelijk onderzoek. Verder zal zij gedurende de onderzoeksperiode nauwkeurig zorg dragen voor het
verzamelen van laboratoriummonsters, het verzamelen van data gegevens en het verwerken van deze gegevens in
databases.
Zij coördineert vervolgafspraken en onderzoeken met diverse specialisten.
Zij ondersteunt de diverse onderzoekers bij structurele verslaglegging en afsluiting van onderzoeksperiodes.
Zij is gedurende de onderzoeksperiode de contactpersoon voor de onderzoeker en de persoon met MS.
Zij is direct aanspreekbaar voor mensen met MS en zorgt daardoor voor een laagdrempelig contact.
Zij werkt vanuit een holistische visie waarbij de patiënt centraal staat. Hierbij wordt rekening gehouden met de
individuele wensen en behoeften van mensen met MS.
Verpleegkundigen
Maartje Bruijnen- Verhagen
Lianne van Gennip- Denessen
Aansturing
Prof. dr. R.M.M. Hupperts (neuroloog)
Instituut
Orbis Medisch Centrum, Sittard
Startdatum
april 2010
Subsidie
€ 220,996,-
29
De Nederlandse Hersenbank voor MS
3.1 inleiding
Onderzoek naar en de diagnose van MS zijn lange tijd bemoeilijkt, omdat het niet mogelijk is om bij levende mensen in
de hersenen te kijken. Om onderzoek aan menselijk materiaal mogelijk te maken, ondersteunt Stichting MS Research
sinds 1990 de Nederlandse Hersenbank voor multiple sclerose. De Hersenbank verzamelt hersenmateriaal van mensen
met en zonder MS, die tijdens hun leven een speciaal donorcodicil hebben getekend. De kenmerken van dit materiaal
worden nauwkeurig vastgelegd, waarna het hersenmateriaal beschikbaar wordt gesteld aan MS-onderzoekers. Hierdoor
krijgen zij de mogelijkheid om het ziekteproces te onderzoeken in hersenmateriaal van mensen. In de afgelopen jaren
heeft het materiaal van de Hersenbank een essentiële rol gespeeld bij vele MS-onderzoeksprojecten.
de nederlandSe herSenbanK
voor multiple ScleroSe
(09-406e mS)
Doel van het centrum
De missie van de Nederlandse Hersenbank voor MS (NHB-MS) is het faciliteren van wetenschappelijk onderzoek naar
MS, zodat oorzaken van en geneesmiddelen tegen MS kunnen worden gevonden. Om dit doel te bereiken geeft de
NHB-MS goed gedocumenteerd humaan hersenweefsel van mensen met MS en controledonoren uit aan MS-onderzoeks- projecten wereldwijd.
Achtergrond van het centrum
Sinds de oprichting van de NHB in 1985 kunnen mensen in heel Nederland zich tijdens hun leven registreren als
hersendonor door middel van een speciaal donorcodicil. De NHB is destijds gestart omdat het zeer moeilijk was om
voldoende menselijk hersenweefsel van overleden personen te verkrijgen voor onderzoek. Dergelijk weefsel is echter
hard nodig omdat het niet mogelijk is om bij levende mensen op cel- en molecuul niveau in de hersenen te kijken. Ook
MS-onderzoek en –diagnostiek zijn lange tijd bemoeilijkt door deze beperking. Om ook MS-onderzoek met menselijk
materiaal mogelijk te maken ondersteunt Stichting MS Research sinds 1990 de Nederlandse Hersenbank voor Multiple
Sclerose (NHB-MS).
Onderzoekslijnen en bereikte resultaten
NHB-MS heeft als doel om het hersenweefsel op zodanige wijze uit te nemen en voor te bereiden dat het optimaal
geschikt is voor onderzoek naar MS. Deze activiteiten kunnen worden uitgesplitst in vier hoofdonderdelen:
3
Donorwerving
Het totale donorbestand van de NHB omvat momenteel meer dan 2800 geregistreerde donoren, waarvan 479
MS- en 1432 controle registraties. NHB-MS heeft een speciaal donorwervingsprogramma dat onder meer bestaat uit
het geven van lezingen en het verspreiden van een zelfgemaakte DVD over hersendonorschap in relatie met MS. Het
aantal registraties van mensen met MS is relatief hoog in vergelijking met andere ziektebeelden en neemt stabiel toe
met ongeveer 35 nieuwe registraties per jaar. Het aantal nieuwe inschrijvingen van controledonoren blijft ook stabiel
met ongeveer 80 à 90 per jaar, wat ook voor MS-onderzoek heel belangrijk is: het controle-hersenmateriaal moet als
vergelijking dienen voor de gevonden afwijkingen in het MS-hersenmateriaal.
NEDERLANDSE HERSENBANK
VOOR MS
Hersenuitname (obductie)
Mede doordat donoren zich al bij leven registreren als hersendonor en NHB-MS 24 uur per dag paraat is, kan de
obductie zeer snel na overlijden plaatsvinden: binnen gemiddeld 6,5 uur. Door deze korte tijd is het hersenmateriaal
van de NHB van zeer hoge kwaliteit, een voorwaarde voor onderzoekstechnieken die veranderingen in eiwit- en genexpressie in MS blootleggen. Het hersenweefsel wordt op dusdanige wijze voor onderzoekers uitgenomen, dat zij precies
die gebieden krijgen die zij nodig hebben voor hun onderzoek. In geval van MS worden de hersenen na het overlijden
eerst met MRI gescand, zodat MS-afwijkingen die niet met het blote oog zichtbaar zijn op MRI-geleide kunnen worden
uitgenomen. Ook kunnen de MRI-beelden later worden vergeleken met microscopische beelden. Op deze wijze kunnen MRI-beelden van levende personen beter worden worden geïnterpreerd. Zodoende is het o.a. mogelijk geworden
om MS-laesies in de grijze stof te identificeren met MRI. De NHB heeft sinds 1985 weefsel verkregen van meer dan
3800 hersendonoren, waarvan meer dan 220 MS- en meer dan 1250 controle-obducties. Gemiddeld heeft de NHB 12
MS-obducties per jaar. Er zijn echter nog veel meer donoren nodig om aan alle onderzoeksvragen te kunnen voldoen.
31
Hoofdstuk 3
Diagnostiek en karakterisatie
Bij MS worden zo veel mogelijk MS-laesies uitgenomen uit hersenen en, indien mogelijk, het ruggemerg, soms meer
dan 40 laesies per persoon. Deze MS-leasies worden uitgebreid gekarakteriseerd op laesie activiteit, demyelinisatie,
remyelinisatie, zenuwschade en locatie. Ook worden foto’s gemaakt van deze MS-laesies, zodat onderzoekers precies
kunnen uitkiezen wat voor type weefsel zij nodig hebben voor hun onderzoek. Op basis van het klinisch beloop en de
analyse van het hersenweefsel stelt de neuropatholoog de einddiagnose van de persoon met MS.
De Nederlandse Hersenbank voor MS
Medewerkers NHB
Dr. Inge Huitinga (directeur Hersenbank)
Ing. Michiel Kooreman (technisch coördinator)
Petra Brom (communicatiemedewerker donorprogramma)
Drs. Afra van den Berg (analist)
Ing. Paul Evers (analist)
Bonnie van Huik, Msc (managementassistent)
Instituut
De Nederlandse Hersenbank is een afdeling van het Nederlands Herseninstituut in Amsterdam, een instituut van de
Koninklijke Nederlandse Akademie voor Wetenschappen.
Startdatum van het centrum
januari 1990. De programmasubsidie wordt per januari 2014 met 4 jaar verlengd.
Subsidie
€ 425.017
Uitgifte
Het hersenmateriaal wordt samen met uitgebreide medische informatie beschikbaar gesteld aan MS-onderzoekers.
Hierdoor krijgen zij de mogelijkheid om het ziekteproces en de aangetaste gebieden te onderzoeken in hersenmateriaal
van mensen. Sinds de start van NHB-MS heeft het hersenmateriaal bij vele MS-onderzoeksprojecten een essentiële
rol gespeeld. In de afgelopen 3 jaar heeft de NHB meer dan 2373 stukjes MS-weefsel van 164 verschillende donoren
kunnen uitgeven aan 43 onderzoeksprojecten in binnen- en buitenland. In 2013 ging het om 483 stukjes MS-weefsel
van 73 verschillende donoren die werden uitgegeven aan 18 onderzoeksprojecten. Het onderzoek richt zich op vele
onderwerpen, zoals het zoeken naar een mogelijke betrokkenheid van virussen bij MS, de functie van de bloed-hersenbarrière en mechanismen van ontstaan en herstel van MS-ontstekingen zoals demyelinisatie en remyelinisatie, grijze
stof laesies, B- en T-cellen in MS, stamcellen, man/vrouw verschillen in MS en eiwit- en genexpressie studies. In het
jaarverslag en op de website van de NHB staat alle informatie over de onderzoeksresultaten behaald met NHB weefsel
en de daaruit voortgekomen publicaties (www.hersenbank.nl).
32
33
Onderzoek naar klinische symptomen en nieuwe therapieën
4.1 inleiding
Bij onderzoek naar mogelijk nieuwe geneesmiddelen en behandelingen is het belangrijk dat dit zo min mogelijk risico’s
met zich meebrengt voor de persoon die aan het onderzoek deelneemt. Daarom wordt dit onderzoek voorafgegaan door
een zeer uitgebreid onderzoek in het laboratorium.
Bovendien vindt het onderzoek naar mogelijk nieuwe behandelingen over het algemeen plaats in 3 fasen.
• In de eerste fase wordt een mogelijk geneesmiddel getest bij een aantal gezonde personen om te bepalen welke
hoeveelheid van de stof kan worden ingenomen zonder ernstige bijwerkingen. Als de resultaten van dit fase-I
onderzoek veelbelovend zijn, wordt het onderzoek voortgezet.
• In de tweede testfase wordt de behandeling getest bij een beperkt aantal patiënten. Deze relatief kleine test is
bedoeld om een aanwijzing te krijgen of de behandeling een gunstig effect heeft op de ziekte. Daarnaast wordt
direct getest of dit gunstige effect groter is dan eventuele nadelige effecten. Als ook dit fase-II onderzoek
veelbelovend is, wordt het middel vervolgens getest bij een grote groep patiënten.
• Het doel van het fase-III onderzoek op een grote groep patiënten is om de aanwijzingen voor een gunstig effect
van het geneesmiddel in het fase-II onderzoek te bevestigen. Als ook dit fase-III onderzoek goede resultaten
oplevert, kan registratie van het geneesmiddel worden aangevraagd.
Vanwege de zorgvuldigheid die vereist is bij onderzoek naar een mogelijk nieuwe behandeling of geneesmiddel neemt
dit onderzoek vaak meer dan 10 jaar in beslag. Na registratie van een geneesmiddel kan evenuteel nog een fase-IV
onderzoek plaatsvinden. Met dit onderzoek wordt bepaald of het geneesmiddel ook werkt bij andere groepen patiënten
(met bijvoorbeeld andere vormen of stadia van MS of zelfs met hele ander ziektes) dan waarvoor het middel in eerste
instantie geregistreerd is.
Vragenlijsten worden vaak gebruikt om van mensen met MS te horen hoe het met hen gaat. Uit een kleine studie bleek
dat de uitkomsten hiervan vaak niet betrouwbaar zijn en dat mensen uit de directe omgeving in veel gevallen vaak beter
kunnen beoordelen wat de invloed van een ziekte op het dagelijks leven van een persoon met MS is. In het onderzoek
beschreven in paragraaf 4.2 wordt uitgebreider gekeken of het betrekken van zogenaamde proxy-respondenten bij de
beoordeling van de gezondheidstoestand leidt tot betrouwbare gegevens voor een arts.
In het onderzoek in paragraaf 4.3 worden de effecten van een internet-zelfhulpcursus bij klachten van depressie en
angst geëvalueerd.
4.2 proxy
metingen bij
multiple ScleroSe (06-594 mS)
Doel van het onderzoek
Het doel van deze studie is om inzicht te krijgen in overeenkomsten en verschillen tussen mensen met Multiple Sclerose (MS) en hun naasten (zogenaamde proxy-respondenten) bij het beoordelen van de gezondheidstoestand.
4
KLINISCHE SYMPTOMEN EN
NIEUWE THERAPIEËN
Achtergrond van het onderzoek
In de afgelopen jaren is er een toenemende erkenning voor vragenlijsten die door mensen met MS zelf worden ingevuld,
de zogenaamde zelfrapportage vragenlijsten. Een alternatief kan zijn om mensen uit de omgeving van de persoon met
MS, zogenaamde proxy-respondenten, te betrekken bij de beoordeling van de gezondheidstoestand. Eerdere studies
hebben aangetoond dat partners geschikte proxy-respondenten zouden kunnen zijn wanneer het gaat om het beoordelen
van de invloed van de ziekte op het dagelijks leven, maar er werden soms grote verschillen gevonden in overeenstemming. Daarom wordt in deze studie met een grotere onderzoeksgroep geprobeerd te achterhalen wat hiervan de
oorzaak is en of bepaalde kenmerken van de mensen met MS of hun partners van invloed kunnen zijn.
Illustratie: neuron
35
Hoofdstuk 4
Onderzoek naar klinische symptomen en nieuwe therapieën
Bereikte resultaten
Partners kunnen de ziekte van mensen met MS goed beoordelen wanneer het gaat om goed te observeren ziekteaspecten of lichamelijke beperkingen. Voor psychologische klachten en het algemeen functioneren lijkt dit lastiger te
zijn. De verschillen worden met name veroorzaakt door angst bij mensen met MS en depressie of een verhoogde zorglast
bij de partners.
• Wanneer specifiek wordt gekeken naar de loopfunctie en de impact van lichamelijke klachten als gevolg van MS,
blijkt dat de meerderheid van de mensen met MS en hun partners het eens zijn over verbetering, stabilisatie of
verslechtering van de klachten over 2 jaar tijd. Wanneer antwoorden niet overeen kwamen, werd dit veroorzaakt
door een verschil in leeftijd en door angst bij mensen met MS en depressie of een verhoogde zorglast bij de
partners.
• Het is mogelijk om op een betrouwbare wijze de score van partners te gebruiken in het onderzoek naar de
lichamelijke impact van MS, gemeten op verschillende tijdsmomenten.
een aantrekkelijk alternatief zijn voor face-to-face therapie omdat deelnemers zelf kunnen bepalen waar, wanneer en
hoe lang ze er mee bezig zijn. Het is al bekend dat kortdurende internettherapie effectief is bij het verminderen van een
depressieve stemming. Of dit ook geldt voor depressieve klachten bij MS is tot op heden niet onderzocht.
Waarom is juist dit onderzoek belangrijk voor MS?
De betrouwbaarheid en juistheid van de uitkomsten van mensen met MS kunnen worden beïnvloed wanneer er, als
gevolg van MS, cognitieve beperkingen (zoals bv geheugen en concentratieproblemen) of stemmingsproblemen (zoals
bv een depressie) optreden. Juist op de momenten dat het minder goed gaat, is het wel belangrijk om mensen met MS
te kunnen blijven volgen. Met toestemming van de mensen met MS kunnen we partners vragen om op die momenten
een beoordeling te geven van de gezondheidstoestand.
Bereikte resultaten
• Inmiddels nemen 136 mensen deel aan het onderzoek
• 67 deelnemers hebben de 5-weekse internettherapie gevolgd
• Dit jaar zullen de laatste 30 deelnemers geïncludeerd worden en de eerste resultaten geanalyseerd
Waarom is juist dit onderzoek belangrijk voor MS?
Depressieve klachten bij mensen met MS komen vaak voor en lijken onder behandeld. Mogelijk doordat face-to-face
behandelingen niet altijd haalbaar zijn. Als uit dit onderzoek blijkt dat internettherapie een effectieve behandeling is,
zou dit een goed alternatief kunnen zijn omdat deelnemers zelf kunnen bepalen waar, wanneer en hoe lang ze er mee
bezig zijn.
Onderzoeker
Drs. Rosa Boeschoten (promovendus/psycholoog)
Begeleiders
Prof. dr. Bernard Uitdehaag (neuroloog / epidemioloog)
Prof. dr. Chris Polman (neuroloog)
Begeleiders
Dr. Patricia van Oppen (GZ-psycholoog, VUmc)
Prof. dr. Joost Dekker (paramedisch hoogleraar, VUmc)
Prof. dr. Bernard Uitdehaag (neuroloog/epidemioloog, VUmc)
Prof. dr. Chris Polman (neuroloog, VUmc)
Dr. Emma Collette (psycholoog, VUmc)
Prof. dr. Aartjan Beekman (psychiater, VUmc)
Prof. dr. Pim Cuijpers (psycholoog, Vumc)
Instituut
VUmc MS Centrum Amsterdam
Instituut
VU medisch centrum & GGZ-inGeest, Amsterdam
Looptijd van het onderzoek
September 2009 - september 2013
Looptijd van het onderzoek
april 2011 - april 2016
Subsidie
€ 264.637
Subsidie
€ 206.054
Onderzoeker
Judith Sonder MSc (promovendus)
4.3 Depressie in MS:
(09-678 MS)
de effecten van cognitieve gedragstherapie zelfhulp via internet
Doel van het onderzoek
Het VU medisch centrum (VUmc) voert in samenwerking met GGZinGeest een onderzoek uit naar de effecten van een
kortdurende cognitieve gedragstherapie via internet op depressieve klachten bij mensen met MS.
Achtergrond van het onderzoek
Depressieve klachten komen vaak voor bij mensen met MS. Een depressie gaat helaas vaak niet vanzelf over, maar is
wel te behandelen. Mensen met MS en een depressie reageren over het algemeen goed op een psychotherapeutische
behandeling voor hun klachten. Vooral een cognitieve gedragstherapie gericht op het oplossen van problemen en
het stellen van doelen kan behulpzaam zijn. Echter, in veel gevallen worden depressieve klachten niet adequaat
behandeld. Wellicht komt dit doordat mensen met MS barrières ervaren in het krijgen van passende hulp door MS
gerelateerde problemen als vermoeidheid, fysieke problemen en transportmoeilijkheden. Internettherapie kan daarom
36
37
Onderzoek naar omgevings- en erfelijke factoren
5.1 inleiding
Hoewel al wel bekend is dat het afweersysteem een belangrijke rol speelt in MS, is helaas nog niet bekend waarom
en op welke manier MS ontstaat. Wel is inmiddels bekend dat zowel factoren uit de omgeving als erfelijke factoren
de kans op het krijgen van MS beïnvloeden. Dat deze factoren nog steeds niet bekend zijn, wordt veroorzaakt doordat
waarschijnlijk een combinatie van heel veel factoren een rol speelt. Bovendien kunnen deze factoren voor verschillende
personen anders zijn. Mogelijk kunnen omgevings- en erfelijke factoren ook het verloop van MS beïnvloeden.
Mensen met de relapsing-remitting vorm van MS kunnen behndeld worden met Interferon-bèta. Interferon-bèta (merknamen: Avonex®, Betaferon® en Rebif®) is sinds 1995 beschikbaar en kan de ziekte niet genezen, maar kan wel het
aantal aanvallen waarbij ontstekingen ontstaan verminderen. Bij een deel van de mensen die dit medicijn krijgen werkt
het middel niet of minder goed. Op dit moment kan alleen achteraf vastgesteld worden of de therapie bij een bepaalde
patiënt al dan niet effect heeft. Een mogelijke oorzaak van het minder functioneren van Interferon-bèta bij een deel van
de mensen met MS kan zijn dat het DNA van deze mensen net iets anders is. In het onderzoek in paragraaf 5.2 wordt
gekeken of dit veranderde DNA er inderdaad voor zorgt dat Interferon-bèta niet of minder goed werkt.
Normaal gesproken worden de hersenen goed beschermd door de bloed-hersenbarrière die ervoor zorgt dat de meeste
stoffen en cellen uit het bloed de hersenen niet zomaar in kunnen. Bij mensen met MS werkt deze bloed-hersenbarrière
minder goed. In het onderzoek in paragraaf 5.3 wordt gekeken of hele kleine stukjes genetisch materiaal (microRNAs)
de werking van de bloed-hersenbarrière kunnen beïnvloeden.
MicroRNAs spelen mogelijk ook een rol in de overgang van relapsing-remitting MS (RRMS) naar secundair progressieve
MS (SPMS). In de studie in paragraaf 5.4 wordt onderzocht of en welke microRNAs hierbij betrokken zijn.
5.2 opheldering van het
rrmS (08-660 mS)
bio moleculaire mechaniSme van de differentiële
ifnß
reSponSe in
Doel van het onderzoek
Inzicht verkrijgen in de moleculaire processen die ten grondslag liggen aan wel of geen baat hebben bij behandeling
met IFNß.
5
Achtergrond van het onderzoek
Of een persoon met MS baat zal hebben bij behandeling met IFNß is vooraf moeilijk te zeggen, dit verschilt van
persoon tot persoon. Het is echter wel belangrijk om hier een uitspraak over te kunnen doen om iedereen juist te
kunnen behandelen. In eerder onderzoek hebben we aangetoond dat bij mensen die niet reageren op IFNßbehandeling de biologische route die door IFNß aangezet wordt al voor de start van behandeling actief is. In dit
onderzoek proberen we beter te begrijpen waardoor deze route bij een groep van mensen met MS actief is. We
bestuderen wat deze route aanzet, in welke bloedcellen deze route aanstaat en of de remmingsmechanismen normaal
functioneren. Ook vergelijken we de uitkomsten van deze onderzoeken met de uitkomsten van studies naar mensen met
andere auto-immuunziekten, omdat is aangetoond deze route ook is aangezet in subsets van mensen met bijvoorbeeld
SLE (systemische lupus erythematosus) en RA (reumatoïde artritis).
OMGEVINGSEN ERFELIJKE FACTOREN
Bereikte resultaten
• De activatie van de IFNß route is in verschillende cellen/celsubsets zichtbaar
• Bij deze mensen is de ontregelde IFNß route op verschillende niveau’s in kaart gebracht
• We hebben inzicht verschaft in de oorzaak van activatie van de IFNß route
Waarom is juist dit onderzoek belangrijk voor MS?
Dit onderzoek draagt bij aan ‘medicatie op maat’, behandeling toegespitst op de individuele patiënt.
39
Onderzoek naar omgevings- en erfelijke factoren
Hoofdstuk 5
Onderzoeker
Saskia Vosslamber (postdoc)
Begeleiders
Prof. dr. Elga de Vries, celbioloog
Begeleiders
Prof. dr. Cor Verweij (medisch biochemicus)
Instituut
Afdeling Moleculaire Celbiologie en Immunologie, VU Medisch Centrum, Amsterdam
Instituut
VU medisch centrum, Amsterdam
Looptijd van het onderzoek
april 2011 – april 2013
Looptijd van het onderzoek
april 2010 – juli 2013
Subsidie
€ 249.948
Subsidie
€218.823
5.4 Circulerende
5.3 MicroRNAs
behandeling van
in bloedvaten in de hersenen, nieuwe aangrijpingspunten voor de
MS (09-689 MS)
Doel van het onderzoek
Identificeren van nieuwe aangrijppunten voor herstel van de beschermende functie van bloedvaten in de hersenen van
mensen met MS.
Achtergrond van het onderzoek
Bloedvaten in de hersenen hebben een unieke samenstelling en vormen een dam tegen stoffen en ontstekingscellen die
circuleren in de bloedbaan en schadelijk zijn voor onze hersencellen. Aan de andere kant hebben de endotheelcellen,
die de binnenkant van deze bloedvaten bekleden, specifieke eigenschappen die ervoor zorgen dat belangrijke voedingsstoffen de hersenen kunnen bereiken. Dit systeem wordt ook wel de bloed-hersenbarrière genoemd.
Tijdens MS is deze belangrijke functie van bloedvaten in de hersenen verstoord. Als gevolg daarvan staan de hersenen
bloot aan schadelijke stoffen en cellen van het afweersysteem die vervolgens bijdragen aan de vorming van de
ontstekingshaarden. Om de beschermende functie van bloedvaten in de hersenen van mensen met MS te kunnen
herstellen, hebben we onderzocht hoe endotheelcellen hun barrière functie regelen.
Bereikte resultaten
• Kleine genen, microRNAs, spelen belangrijke rol in de barrièrefunctie van endotheelcellen in de hersenen in een
kweekmodel
• MicroRNAs die barrièrefunctie bepalen zijn verminderd in bloedvaten in post-mortem weefsel van mensen met MS
• Herstel van expressie van microRNAs zorgen voor verminderen van immuun cel migratie en versterken de barrièrefunctie van het hersenendotheel
Waarom is juist dit onderzoek belangrijk voor MS?
Het verstevigen van de bloed-hersenbarrière zal de lekkage van schadelijke stoffen en de passage van ontstekingscellen
tegengaan in MS en op die manier zenuwcelschade voorkomen. Toekomstig onderzoek zal moeten uitwijzen of deze
kleine genen gebruikt kunnen worden voor herstel van de bloed-hersenbarrière en het voorkomen van ontstekingshaarden.
Onderzoekers
Dr. Arie Reijerkerk (post-doc)
Dr. Maarten Witte (post-doc)
Ing. Wouter Kamphuis (analist)
Ing. Joost Drexhage (anallist)
40
micro-RNAs als biomarkers voor
MS (11-752 MS)
Doel van het onderzoek
Het ontwikkelen van een op miRNA-expressie gebaseerde PCR-test die de overgang van RR-MS naar SP-MS kan
voorspellen.
Achtergrond van het onderzoek
Circulerende miRNA-profielen in bloed blijken ziekte en zelfs ziektestadium specifiek te kunnen zijn. Tot op heden is er
nog niet geprobeerd om circulerende miRNA profielen in MS progressie te definiëren met behulp van next generation
sequencing technologie. In dit project worden in bloed en CSF (hersenvocht) de circulerende miRNA-profielen van 30
controle, 30 mensen met RRMS, 30 mensen met SPMS en 10 mensen met PPMS bepaald. De monsters zijn verkregen
van de Nederlandse Hersenbank. Er zal worden onderzocht welke bron (bloed of CSF) de meest specifieke profielen
oplevert en op basis hiervan zal een PCR test ontwikkeld worden voor detectie van de overgang van RRMS naar SPMS.
Bereikte resultaten
• Er kunnen miRNA sequencing libraries worden gemaakt uit zowel CSF als serum.
• Interim analyse op een beperkt aantal samples suggereert dat er verschillen in miRNA profielen te detecteren zijn
tussen controle en MS samples.
• In dezelfde interim analyse zijn verschillen in miRNA profielen te detecteren tussen verschillende stadia van MS.
Waarom is juist dit onderzoek belangrijk voor MS?
Er is op dit moment geen test beschikbaar voor die de overgang van RRMS naar SPMS nauwkeurig kan detecteren. Als
dit werk een test oplevert voor deze overgang, zal dit gevolgen hebben voor behandeling van MS.
Onderzoekers
Anna Stachurska (postdoc)
Rutger Modderman (analist)
Begeleiders
Dr. Sebo Withoff (moleculair bioloog)
Dr. Jan Meilof (neuroloog)
Instituut
Universitair Medisch Centrum Groningen
Looptijd van het onderzoek
maart 2013 – juli 2015
Subsidie
€ 240.674
41
Onderzoek van het afweersysteem in MS
6.1 inleiding
Het afweersysteem is een verdedigingssysteem met als doel indringers of veranderde eigen cellen te bestrijden. Het
afweersysteem bestaat uit een groot aantal verschillende soorten witte bloedcellen die elk een eigen functie hebben.
Voorbeelden van dergelijke functies zijn het aanvallen en onschadelijk maken van virussen en bacteriën. Witte
bloedcellen zorgen er zo samen voor dat virussen en bacteriën opgeruimd worden.
Bij MS is het afweersysteem ontregeld en valt het, naast de virussen en bacteriën, ook eigen cellen aan. Vooral één
bepaald type witte bloedcellen, de lymfocyten, lijken bij MS ontregeld te zijn. In tegenstelling tot andere bloedcellen
kunnen lymfocyten heel specifiek lichaamsvreemd (=antigeen, bijvoorbeeld virussen of bacteriën) onderscheiden van
lichaamseigen materiaal. Lymfocyten herkennen het lichaamsvreemde materiaal niet zomaar. Dit moet eerst
aangeboden worden door een andere cel. Het aanbieden, of presenteren, van het lichaamsvreemde materiaal aan
de lymfocyten wordt ook wel antigeen presentatie genoemd. Een ander type witte bloedcel, de dendritische cel, ook
wel antigeen presenterende cel genoemd, is heel goed in het presenteren van lichaamsvreemd materiaal. De lymfocyten
herkennen het lichaamsvreemde materiaal door middel van een receptor. Wanneer de receptor het lichaamsvreemde
materiaal herkent, wordt de lymfocyt actief en zal proberen het lichaamsvreemde materiaal op te ruimen.
Er bestaan ruwweg twee categorieën lymfocyten: T-cellen en B-cellen. De T-cellen en B-cellen hebben allebei een
andere functie in het opruimen van lichaamsvreemd materiaal. Wanneer een B-cel actief wordt, gaat deze grote
hoeveelheden stoffen maken die aan het lichaamsvreemde materiaal hechten en ervoor zorgen dat dit opgeruimd
wordt. Deze antigeen-bindende stoffen van B-cellen zijn de zogenaamde antilichamen (ook wel antistoffen of
immuunglobulinen genoemd). Een T-cel daarentegen gaat na activatie zelf in de aanval om het lichaamsvreemde
materiaal onschadelijk te maken.
Onder normale omstandigheden zal het afweersysteem niet reageren tegen bestanddelen van het eigen lichaam, omdat
de cellen hebben geleerd dat dit niet vreemd is. Echter, bij MS wordt de isolatielaag om de zenuwen (myeline) in het
centrale zenuwstelsel door B- en T-cellen als lichaamsvreemd herkend. T-cellen vallen het myeline aan, waardoor het
afgebroken wordt. Ook de door de B-cellen geproduceerde antilichamen kunnen in MS bijdragen aan de afbraak van
myeline.
6
De verschillende cellen van het afweersysteem kunnen elkaar beïnvloeden. Door de verschillende typen cellen en de
verschillende manieren waarop zij elkaar beïnvloeden, vormt het afweersysteem een heel complex systeem. De cellen
beïnvloeden elkaar vooral met behulp van speciale eiwitten, die cytokinen worden genoemd. Cytokinen zijn de boodschappermoleculen van de cellen van het afweersysteem. Zowel bij het verergeren als bij het onderdrukken van ziekte
spelen de cytokinen een belangrijke rol.
De cellen van het afweersysteem herkennen de cytokinen door middel van zogenaamde receptoren. Dit zijn speciale
eiwitten op het oppervlak van een cel die heel specifiek een bepaalde stof kunnen herkennen en binden. Het effect van
een cytokine op een bepaalde cel wordt daarom niet alleen bepaald door de aanwezigheid van het cytokine, maar ook
door het al dan niet aanwezig zijn van de receptor op de cel. Cytokinen kunnen grofweg ingedeeld worden in twee
groepen: de ontstekingsremmende en de ontstekingsbevorderende cytokinen. Omdat MS een ontstekingsziekte is,
kunnen ontstekingsbevorderende cytokinen leiden tot verergering van de ziekte en is de vorming van ontstekingsremmende cytokinen in het algemeen gunstig. Een speciale klasse van cytokinen vormen de chemokinen. Chemokinen
doen als het ware dienst als richtingaanwijzers. Zij geven aan waar in het lichaam op dat moment afweercellen nodig
zijn en lokken deze afweercellen daarheen.
HET AFWEERSYSTEEM IN MS
Afhankelijk van de balans tussen de geproduceerde cytokinen kunnen bepaalde T-cellen zich tot verschillende typen
ontwikkelen. De zogenaamde Th1- en Th17-cellen werken hierbij ontstekingsbevorderend. Het Th2-type doet zijn werk
grotendeels zonder het bevorderen van ontstekingen.
Bij het activeren van T-cellen en bij het bepalen van de richting waarin deze cellen zich ontwikkelen, spelen de
antigeen-presenterende cellen een belangrijke rol. De manier en de omstandigheden (soort cytokinen) waarin de
antigeen-presentatie plaatsvindt, bepaalt hierbij in welke richting de T-cellen zich ontwikkelen. Naast B- en T-cellen
lijken ook macrofagen en microglia een belangrijke rol te spelen bij MS. Macrofagen (letterlijk: grote eters) zijn de
cellen van het afweersysteem die tot taak hebben om dode of beschadigde cellen en lichaamsvreemde stoffen waaraan
Illustratie: transport van een mitochondrion (energiecentrale van de cel) in een zenuwcel
43
Onderzoek van het afweersysteem in MS
Hoofdstuk 6
antilichamen gebonden zijn te verwijderen door deze ‘op te eten’. In het geval van MS brengen macrofagen schade
toe aan myeline, de beschermlaag rond de zenuwen, door dit myeline op te eten. Daarnaast scheiden macrofagen
schadelijke stoffen uit in ontstekingsgebieden. Wanneer zij dit doen in de hersenen leidt dit tot schade aan de zenuwen
en de beschermende myelinelaag. Hoewel macrofagen een belangrijke rol hebben in het toebrengen van schade, zijn ze
ook in staat om stoffen uit te scheiden die het herstel van weefsel juist bevorderen.
Aangezien witte bloedcellen onder normale omstandigheden niet in het centrale zenuwstelsel door kunnen dringen,
beschikt het centrale zenuwstelsel over een eigen afweersysteem. De belangrijkste cellen van dit afweersysteem van
de hersenen zijn de microglia (letterlijk: kleine glia). Zij zijn als het ware de macrofagen van de hersenen en spelen
waarschijnlijk een belangrijke rol in de vorming van ontstekingen (laesies) en de afbraak en het opruimen van weefsel
van het centrale zenuwstelsel. Naast microglia zijn in het centrale zenuwstelsel nog twee soorten glia (ondersteunende
cellen) aanwezig, oligodendrocyten en astrocyten. Oligodendrocyten maken myeline, de isolatielaag rondom de
zenuwen. Astrocyten (letterlijk: stervormige cellen) zijn de ondersteunende cellen die bij MS de door ontsteking
ontstane ruimte opvullen en hierbij een litteken vormen.
Bij MS ontstaan ontstekingen in de hersenen. Tijdens deze ontstekingen kunnen de zenuwen beschadigd raken. Dit
heeft tot gevolg dat bepaalde lichaamsfuncties niet goed of zelfs helemaal niet meer werken. In het in paragraaf 6.2
beschreven project wordt vooral gekeken naar de rol van één van de stoffen waaruit zenuwen zijn opgebouwd, de
neurofilamenten. Onderzocht wordt via welk mechanisme antilichamen schade aan zenuwcellen en specifiek aan
neurofilamenten kunnen veroorzaken.
Een kenmerk van MS is het beschadigen van myeline, de beschermlaag rondom de zenuwen. Myeline wordt opgeruimd
door cellen van het afweersysteem, de macrofagen. Deze cellen herkennen het myeline en ‘eten het vervolgens op’. In
het onderzoek in paragraaf 6.3 wordt onderzocht hoe de cellen van het afweersysteem myeline herkennen.
MS lijkt vaker voor te komen bij mensen die de ziekte van Pfeiffer hebben gehad. Het virus dat Pfeiffer veroorzaakt
zorgt ook voor een ontsteking. Hierbij richten de cellen van het afweersysteem zich tegen het virus. Het is mogelijk dat
het virus dat Pfeiffer veroorzaakt heel erg lijkt op stoffen die ook in de hersenen zitten. Hierdoor richten de Pfeifferafweercellen zich ook tegen de eigen hersenen, waardoor ook daar onstekingen ontstaan. In het project dat in paragraaf
6.4 is beschreven wordt onderzocht of dit inderdaad het geval is.
Bij MS dringen ontstekingscellen de hersenen binnen, waarna deze cellen allerlei ontstekingsmediatoren (o.a.
cytokinen) produceren. Dit leidt tot schade aan de zenuwen. Het is van belang om zowel het binnendringen van de
ontstekingscellen in de hersenen als de productie van de ontstekingsmediatoren te remmen. In het onderzoek in
paragraaf 6.3 wordt bekeken hoe deze processen geremd kunnen worden.
Normaal gesproken beschermt het afweersysteem tegen indringers van buitenaf, zoals virussen en bacteriën. Het
afweersysteem zit erg ingewikkeld in elkaar. Er zijn niet alleen cellen die de indringers aanvallen, er zijn ook cellen
die ervoor zorgen dat deze afweerreactie niet uit de hand loopt, de zogenaamde regulatoire cellen. Bij MS richt het
afweersysteem zich niet alleen tegen indringers, maar veroorzaakt het ook schade aan de zenuwen. Wij onderzoeken de
functie van de regulerende cellen in de hersenen. In het onderzoek in paragraaf 6.6 wordt bekeken of deze cellen ook
in de hersenen in staat zijn om de afweerreactie onder controle te houden en waarom dit bij MS minder goed werkt.
Er zijn aanwijzingen dat worminfecties beschermend kunnen werken bij MS. In de studie in paragraaf 6.7 wordt
onderzocht of en hoe wormen de ontstekingen in MS kunnen onderdrukken of zelfs voorkomen en welke componenten
van de wormen hiervoor verantwoordelijk zijn.
6.2 De
rol van antilichamen tegen neurofilamenten in het ontstaan van schade aan zenuw-
uitlopers en grijze stof in
MS (07-627 MS)
Doel van het onderzoek
Onderzoeken of en hoe immuunreacties tegen specifieke eiwitten in de zenuwcellen kunnen bijdragen aan schade aan
zenuwuitlopers in MS.
Achtergrond van het onderzoek
Schade aan zenuwcellen en hun uitlopers is een belangrijke bron van de blijvende, onomkeerbare schade die MS
veroorzaakt. Hoe zulke schade precies wordt veroorzaakt, is nog goeddeels onbekend. Onze onderzoeksgegevens wijzen
erop dat afweerreacties tegen eiwitten uit zenuwuitlopers een belangrijke bijdrage aan de schade zouden kunnen
leveren. Een voorbeeld hiervan is neurofilament light (NF-L), een eiwit wat onderdeel is van het ‘skelet’ van de
zenuwcel. Wanneer NF-L bij modellen voor MS wordt toegediend om een afweerreactie op gang brengen, ontstaan
verschijnselen van spasticiteit en verlammingen, die lijken op hetgeen zich bij MS voordoet. De afweerreactie leidt
tot directe schade aan zenuwcellen en hun uitlopers. Onderdeel van deze afweerreactie zijn T-cellen en antilichamen.
T-cellen komen voor in verschillende soorten en kunnen al dan niet schade aanbrengen. Antilichamen zijn kleine
eiwitten die onder andere het “doelwit” voor cellen van het immuunsysteem beter zichtbaar maken. Antilichamen
gericht tegen NF-L weten door te dringen tot in de zenuwuitlopers zelf. In dit project wordt onderzoek gedaan naar de
mogelijkheid van antilichamen en T-cellen specifiek gericht tegen NF-L om zenuwcellen te beschadigen.
Bereikte resultaten
• NF-L eiwitten worden opgenomen door cellen van het immuunsysteem in beschadigde gebieden in het brein van
personen met MS.
• Na twee jaar behandeling met natalizumab (Tysabri®) is een daling van de hoeveelheid antilichamen tegen NF-L in
het bloed zichtbaar.
• Antilichamen tegen NF-L verminderen het aantal zenuwuitlopers.
Waarom is juist dit onderzoek belangrijk voor MS?
Mensen met MS hebben T-cellen en antilichamen gericht tegen NF-L. Opname van NF-L eiwitten door cellen van het
immuunsysteem in beschadigde gebieden in het brein van personen met MS is een mogelijke oorzaak van het ontstaan
van een immuunreactie tegen NF-L zoals we zien in de biologische vloeistoffen in mensen met MS. Tevens zou het in
de gaten houden van antilichamen tegen NF-L gebruikt kunnen worden om een positief effect van een behandeling te
voorspellen. Echter hebben we ook aangetoond dat antilichamen tegen NF-L schade kunnen veroorzaken. De hoop is
dat verbeterd inzicht in de rol van deze afweerreacties nieuwe wegen opent om de vorming en voortgang van blijvende
schade bij MS te onderdrukken.
Onderzoeker
Drs. Baukje van der Star (promovendus)
Begeleider
Prof. dr. Sandra Amor (immunoloog)
Instituut
VU medisch centrum, Amsterdam
Looptijd van het onderzoek
september 2008 - februari 2014
Subsidie
€ 227.620
44
45
Onderzoek van het afweersysteem in MS
Hoofdstuk 6
6.3 Mechanismen
van myeline opname tijdens
MS (08-659 MS)
Doel van het onderzoek
Het doel van dit onderzoek is om nieuwe receptoren te identificeren die betrokken zijn bij myeline opname in MS en om
deze te remmen en daarmee MS te stoppen.
Achtergrond van het onderzoek
Macrofagen zijn lichaamscellen die zich bezighouden met de opname van lichaamsvreemde stoffen. In MS richten
macrofagen zich echter tot het lichaamseigen myeline (isoleerlaagje rondom zenuwcellen). Een macrofaag gebruikt
bepaalde structuren op zijn oppervlak om stoffen te binden en op te nemen. Deze structuren noemen we ‘receptoren’.
Uit eerder onderzoek is bekend dat myeline van mensen met MS wordt ‘gemarkeerd’ door bepaalde eiwitten
(antilichamen en complementsysteem), welke worden herkend door receptoren van macrofagen. Het blokkeren van
deze receptoren remt echter niet de totale myeline opname wat er op wijst dat ook andere receptoren een rol spelen.
Dit onderzoek richt zich op het identificeren van nieuwe receptoren. Myeline van mensen met MS laat veranderingen
zien en we vermoeden dat bepaalde receptoren deze veranderingen kunnen herkennen. Daarnaast kijken we of myeline
van mensen met MS beter opgenomen wordt dan myeline van controles. Dit zou impliceren dat veranderingen in het
myeline inderdaad bijdragen tot een versterkte opname door macrofagen.
Bereikte resultaten
• We hebben laten zien dat bepaalde scavenger receptoren verhoogd tot expressie komen in en rondom actieve MSlaesies (CD68, SR-AI/II, CXCL16), wat er op wijst dat ze betrokken zijn bij zowel de initiatie als de progressie van
MS-laesies.
• Het blokkeren van deze receptoren remt de opname van myeline door macrofagen in een kweekbakje en dit zou
kunnen betekenen dat ze mogelijk ook een rol hebben bij de opname van myeline in de hersenen van mensen met
MS.
• Myeline van mensen met MS wordt beter opgenomen dan myeline van controles in een kweekbakje, wat er op wijst
dat de veranderingen in het myeline van mensen met MS die al eerder beschreven werden, ook functionele consequenties heeft.
Waarom is juist dit onderzoek belangrijk voor MS?
Het is belangrijk om te weten welke receptoren er betrokken zijn bij de opname van myeline in MS-laesies, omdat dit
mogelijkheden biedt voor het ontwikkelen van medicijnen. Als we medicijnen hebben die gericht die receptoren
kunnen blokkeren die myeline binden en opnemen in MS, kunnen we de progressie van MS-laesies, en misschien zelfs
het ontstaan van nieuwe MS-laesies, remmen of voorkomen. Zo kan je de ziekte stoppen. Daarnaast hebben we laten
zien dat het myeline van mensen met MS beter opgenomen wordt dan myeline van controles door dezelfde cellen. De
volgende stap is om de veranderingen in het myeline die voor deze verhoogde opname zorgen te identificeren. Indien we
deze veranderingen in het myeline in mensen met MS kunnen ‘maskeren’ zodat macrofagen het niet meer herkennen,
kan worden voorkomen dat het myeline wordt opgenomen. Anderzijds zouden die veranderingen ons meer informatie
kunnen geven over welke receptoren dit mogelijk binden en kunnen we deze receptoren zelf blokkeren.
Subsidie
€ 234.984
6.4 Bestudering
(09-670 MS)
van
CD8 T
lymfocyten in
MS-laesies:
antigeen specificiteit en functie
Doel van het onderzoek
Identificatie van de functionele kenmerken en eiwitten waartegen cytotoxische T-lymfocyten in ontstoken hersenweefsel
van mensen met MS gericht zijn.
Achtergrond van het onderzoek
MS is een complexe ziekte die veroorzaakt wordt door een interactie tussen genetische en externe risicofactoren.
Epstein-Barr virus (EBV), veroorzaker van de ziekte van Pfeiffer, is een belangrijke risicofactor. Recent onderzoek duidt
op een mogelijk schadelijke rol van een bepaalde ontstekingscel: de CD8 T-cel. Bij mensen met MS zijn afweerreacties
tegen EBV verhoogd en worden CD8 T-cellen en incidenteel EBV in hersenvocht en/of hersenweefsel aangetroffen. Onze
hypothese is dat ziekte-inducerende EBV-specifieke CD8 T-cellen de hersenen van mensen met MS binnendringen en
daar (1) EBV zelf of (2) een op EBV-lijkend herseneiwit herkennen en daaropvolgend een chronische ontstekingsreactie
ontketenen. Deze hypothese, laat staan onderzoek naar de eigenschappen en de eiwitten herkend door CD8 T-cellen
in hersenvocht en/of hersenweefsel, is bij mensen met MS nog niet getoetst. Onze resultaten duiden op de mogelijke
betrokkenheid van EBV-specifieke CD8 T-cellen bij MS. Ons huidig onderzoek is gericht op de identificatie van het
virus-eiwit dat herkend wordt en de locatie van de desbetreffende CD8 T-cellen in ontstoken hersenweefsel van mensen
met MS.
Bereikte resultaten
• CD8 T-cellen in hersenen van mensen met MS vertonen kenmerken van lokaal geactiveerde T-cellen.
• CD8 T-cellen gekweekt uit hersenvocht en -weefsel van mensen met MS kunnen EBV-geïnfecteerde cellen
herkennen.
• CD8 T-cellen in hersenvocht en -weefsel van mensen met MS zijn niet gericht tegen MS-geassocieerde herseneiwitten.
Begeleiders
Dr. Inge Huitinga (neuroimmunoloog)
Dr. Jörg Hamann (immunoloog)
Waarom is juist dit onderzoek belangrijk voor MS?
Onderzoek aan modellen voor MS, die de ziekte slechts gedeeltelijk nabootsen, hebben een beter inzicht gegeven in de
rol van ontstekingscellen, zowel B- en T-cellen, in het ontstaan van de ziekte in deze modellen. Hierbij zijn de ziekteinducerende eigenschappen van T-cellen gericht tegen hersen-eiwitten in kaart gebracht. Overeenkomstige studies aan
T-cellen van mensen met MS, tijdens de verschillende fases van de ziekte, zijn grotendeels beperkt gebleven tot analyse
van bloed en incidenteel hersenvocht. De resultaten van deze studies zijn niet eenduidig: bevestiging nog ontkenning
van conclusies uit onderzoek aan MS-modellen. Naar onze mening is de gedetailleerde analyse van T-cellen op de plek
van de ziekte, d.w.z. hersenvocht en in het bijzonder ontstoken hersenweefsel van mensen met MS, essentieel om de
rol van T-cellen bij MS op te helderen. Hiervoor hebben wij, m.m.v. de Nederlandse Hersenbank, een in de wereld uniek
onderzoeks-platform opgezet om T-cellen uit klinisch materiaal te isoleren, te kweken en in detail te bestuderen. Identificatie van ziekte-geassocieerde kenmerken van T-cellen in hersenen van mensen met MS biedt mogelijkheden voor de
ontwikkeling van nieuwe therapieën in de toekomst.
Instituut
Nederlands Herseninstituut (NIN)
Onderzoeker
Ing. Gijsbert P. van Nierop (promovendus)
Onderzoeker
Debbie Hendrickx, MSc (promovendus)
46
Looptijd van het onderzoek
januari 2010 – januari 2014
47
Onderzoek van het afweersysteem in MS
Hoofdstuk 6
Begeleiders
Dr. Georges M.G.M. Verjans (Viro-Immunoloog)
Prof. dr. Rogier Q. Hintzen (Neuroloog)
Begeleiders
Prof. dr. Christien Dijkstra (arts, neuroimmunoloog)
Prof. dr. Esther Lutgens (arts, vasculair bioloog)
Instituut
Erasmus MC, Rotterdam
Instituut
VU Medisch Centrum / VUmc MS Centrum Amsterdam
Looptijd van het onderzoek
juni 2010 - augustus 2014
Looptijd van het onderzoek
september 2013 - september 2014
Subsidie
€ 250.000
Subsidie
€48.918
6.5 Remming
multiple
CD40-TRAF6 interacties
sclerose (13-809 MS)
van
is een nieuwe anti-inflammatoire strategie in
6.6 In
FoxP3+ regulatoire T -ellen
(r12-1 MS)
situ studies naar
centrale zenuwstelsel
tijdens autoimmuunziekte van het
Doel van het onderzoek
Het ontwikkelen van small molecule inhibitors van de CD40-TRAF6 interactie als nieuwe anti-inflammatoire strategie in
multiple sclerose (MS).
Doel van het onderzoek
Het doel van dit onderzoek is om uit te zoeken hoe regulatoire T-cellen auto-immuunziekten van het centrale
zenuwstelsel, zoals MS, remmen.
Achtergrond van het onderzoek
Tijdens de ziekte MS dringen ontstekingscellen de hersenen binnen, waarna deze cellen allerlei ontstekingsmediatoren
produceren. Dit leidt tot een excessieve ontstekingsreactie wat uiteindelijk resulteert in schade aan de zenuwen en
bijbehorende uitvalsverschijnselen in de persoon met MS. Remming van zowel de migratie van de ontstekingscellen als
de productie van de ontstekingsmediatoren is daarom een interessante strategie voor de behandeling van MS.
De eiwitten CD40 en CD40L spelen mogelijk een belangrijke rol in het ontstaan van MS, omdat het blokkeren van deze
eiwitten het ontstaan van MS-gerelateerde ziekteverschijnselen remt in experimentele studies. Helaas kan deze
strategie niet langdurig worden toegepast in mensen vanwege het ontstaan van ernstige bijwerkingen.
In ons onderzoek ontwikkelen we meer specifieke remmers van het CD40-CD40L systeem, die geen ernstige
bijwerkingen geven. Wij verwachten dat deze remmers het binnendringen van ontstekingscellen en de productie van
ontstekingsmediatoren verminderen en op die manier MS kunnen verminderen.
Achtergrond van het onderzoek
MS wordt verondersteld te worden geïnitieerd door een auto-immuunreactie tegen myeline; het isolatiemateriaal wat
rondom de zenuwen zit. Normaal gezien vallen de witte bloedcellen (effector T- en B-cellen) geen lichaamseigen
materiaal aan, maar in MS dus wel. Een belangrijke rol in een immuunreactie wordt gespeeld door regulatoire T-cellen
(Treg). In een normale situatie zorgen Treg ervoor dat een ontstekingsreactie niet uit de hand loopt; deze cellen remmen
de effector T-cellen af. In dit onderzoek wordt gekeken hoe Treg auto-immuunziekten van het centrale zenuwstelsel,
zoals MS, remmen. Er is namelijk nog niet veel bekend over de aanwezigheid en het functioneren van deze cellen in het
centrale zenuwstelsel. Tot zover is aangetoond dat de Treg aanwezig zijn in de hersenen. Nu wordt onderzocht of deze
cellen ook daadwerkelijk de effector T-cellen remmen (d.m.v. IL-10, een anti-ontstekingsstofje) en of ze iets veranderen
aan de bloed-hersenbarrière, waardoor de effector T-cellen de hersenen niet meer in kunnen.
Bereikte resultaten
• Behandeling van humane monocyten (ontstekingscellen) met de specifieke remmers vermindert de migratie van
deze cellen over de bloedvaten van de hersenen.
• Behandeling van modellen voor MS met de specifieke remmers is veilig en geeft geen (toxische, immuunsuppressieve of thrombo-embolische) bijwerkingen.
• De specifieke remmers verminderen ziekteverschijnselen in een model voor MS.
Waarom is juist dit onderzoek belangrijk voor MS?
Remming van CD40 en CD40L met behulp van antilichamen heeft zeer gunstige effecten in modellen voor MS. Deze
antilichamen kunnen echter niet langdurig worden toegepast in mensen vanwege bijwerkingen. Ons onderzoek kan
resulteren in de ontwikkeling van nieuwe remmers van CD40 en CD40L welke een gunstig effect hebben op MS maar
niet gepaard gaan met deze ernstige bijwerkingen.
Onderzoekers
Dr. Gijs Kooij (postdoc)
Drs. Tom Seijkens (promovendus)
Bereikte resultaten
• Regulatoire T-cellen zijn aanwezig in de laesies van mensen met MS
• Regulatoire T-cellen produceren IL-10 in de laesies van mensen met MS
• Regulatoire T-cellen zijn niet de enige cellen in de hersenen die IL-10 produceren
Waarom is juist dit onderzoek belangrijk voor MS?
Dit project helpt ons om te begrijpen hoe regulatoire T-cellen werken in het centrale zenuwstelsel. Als we een beter
begrip hebben van de aanwezigheid en functie van deze cellen, kunnen we dit wellicht gebruiken om nieuwe therapieën
voor MS te ontwikkelen.
Onderzoeker
MSc. Stephanie E.J. Zandee, MSC (promovendus)
Begeleiders
Prof. dr. Stephen M. Anderton (Professor of Therapeutic Immunology)
Dr. Anna Williams (Scottish Senior Research Fellow and Honorary Consultant Neurologist)
Instituut
University of Edinburgh, Queen’s Medical Research Institute
48
49
Hoofdstuk 6
Onderzoek van het afweersysteem in MS
Looptijd van het onderzoek
mei 2013 - mei 2015
Looptijd van het onderzoek
september 2012 - mei 2015
Subsidie
€50.000
Subsidie
€249.682
6.7 Wormen
onderdrukken ontstekingen in multiple sclerose
(11-771MS)
Doel van het onderzoek
Vaststellen hoe wormen de ontstekingen in MS kunnen onderdrukken of zelfs voorkomen.
Achtergrond van het onderzoek
Er is een opvallende correlatie wereldwijd tussen enerzijds de kans op het ontwikkelen van MS
en anderzijds de hygiëne status in een land of gebied. MS komt namelijk vrijwel niet voor in
gebieden waar de hygiëne slecht is en mensen veel meer blootgesteld worden aan bijvoorbeeld
worminfecties, denk hierbij aan derde wereld landen. Dit in tegenstelling tot de moderne wereld
waar we steeds meer “schoon” opgroeien, maar waar de kans op het ontwikkelen van MS steeds
meer toeneemt. Veel parasitaire wormen hebben de eigenschap dat ze ontstekingsreacties van de mens
kunnen onderdrukken, waardoor de wormen blijven leven en dus niet opgeruimd worden
door het immuunsysteem. In dit project maken wij met behulp van de Stichting MS Research
gebruik van dit natuurlijke beschermingsmechanisme om te ontdekken hoe de wormcomponenten
eieren van de worm
trichuris suis die
het menselijk afweersysteem zodanig beïnvloeden dat bescherming wordt verkregen voor MS, en
ontstekinen in ms
welke componenten deze positieve eigenschappen bezitten.
kunnen remmen
Bereikte resultaten
• De wormcomponenten remmen ziekteverschijnselen in een model voor MS.
• We hebben uitgevonden dat het ontstekingsremmend mechanisme van de worm- componenten wordt veroorzaakt
doordat ze de schadelijke effecten van menselijke macrofagen en dendritische cellen blokkeren.
• De wormcomponenten hebben daarnaast een sterk remmend effect op de schadelijke eigenschappen van de
voorlopercellen van macrofagen en dendritische cellen in het bloed, de monocyten.
Waarom is juist dit onderzoek belangrijk voor MS?
Huidige therapieën voor MS werken maar ten dele en hebben vaak veel bijeffecten. Het uiteindelijke doel van ons
onderzoek is om op basis van het werkingsmechanisme van de wormen een effectieve en veilige (natuurlijke) therapie
te ontwikkelen voor MS.
Onderzoekers
Dr. Gijs Kooij (postdoc)
Lisa Laan (research analiste)
Begeleiders
Dr. Irma van Die (microbioloog)
Prof. dr. Christien Dijkstra (neuroimmunoloog)
Instituut
VU medisch centrum / VUmc MS centrum Amsterdam
50
51
Onderzoek naar schade bij ontsteking en littekenvorming
7.1 inleiding
Het centrale zenuwstelsel is een belangrijk onderdeel van het lichaam. Daarom wordt het beschermd door een barrière
die ervoor zorgt dat er geen binnendringers vanuit het bloed de hersenen binnenkomen, de zogenaamde bloed-hersenbarrière. De bloed-hersenbarrière bestaat uit twee onderdelen die samen het binnendringen van ongewenste cellen en
stoffen tegengaan. Het eerste onderdeel wordt gevormd door cellen die de wand van het bloedvat vormen, endotheelcellen genaamd. In de bloedvaten van de hersenen en het ruggenmerg zijn deze endotheelcellen stevig met elkaar
verbonden. De cellen zijn als het ware aan elkaar vastgeklonken door speciale verbindingen tussen de cellen, de
zogenaamde ‘tight junctions’, letterlijk: stevige verbindingen. Dit voorkomt dat cellen van het afweersysteem en
stoffen uit het bloed tussen de cellen van de bloedvatwand door kunnen.
Het tweede onderdeel van de bloed-hersenbarrière wordt gevormd door twee lagen, bestaand uit eiwitten en andere
stoffen, die een hecht netwerk vormen. Deze lagen worden de basaalmembranen genoemd. Zij liggen tussen de cellen
van de bloedvatwand en de hersenen of het ruggenmerg in. Het ene deel van het basaalmembraan wordt gevormd door
cellen van de bloedvatwand, het andere door een bepaald type hersencellen, de astrocyten. Speciale stoffen zijn nodig
om het netwerk van de basaalmembranen doorlaatbaar te maken en ervoor te zorgen dat cellen van het afweersysteem
door deze membranen heen kunnen.
Witte bloedcellen en de meeste eiwitten in het bloed kunnen de bloed-hersenbarrière niet passeren. Hierdoor zal
activering van het afweersysteem van het lichaam in normale gevallen niet leiden tot ontstekingen in de hersenen. Bij
MS blijken er lekken op te treden in de bloed-hersenbarrière, waardoor de witte bloedcellen toch de hersenen binnen
kunnen komen, daar ontstekingen kunnen veroorzaken en myeline beschadigen.
In dit hoofdstuk wordt onderzoek beschreven naar het optreden van ‘lekkages’ in de bloed-hersenbarrière bij MS. Bij
onderzoek naar veranderingen die optreden in de hersenbloedvaten bij MS werden al in een vroeg stadium van de
ontwikkeling van een MS-ontsteking verschillende afwijkingen in de bloed-hersenbarrière gevonden. Daarnaast
hebben onderzoekers een model van de bloed-hersenbarrière ontwikkeld, dat bestaat uit menselijke endotheelcellen
en hersencellen. Dit model wordt gebruikt om de invloed van verschillende stoffen op de bloed-hersenbarrière te
bestuderen met behulp van gekweekte cellen.
Er zijn verschillende stoffen die bijdragen aan de schade in de hersenen die ontstaat bij MS. Eén van deze stoffen zijn
de reactieve zuurstofdeeltjes. Hoe en waardoor deze zuurstofdeeltjes in de hersenen gemaakt worden en of het maken
van de zuurstofdeeltjes geremd kan worden, wordt beschreven in paragraaf 7.2.
7
Zenuwcellen hebben veel energie nodig om te kunnen functioneren. Om de hele zenuwcel van energie te voorzien is een
goede verdeling van mitochondria, de energiefabriekjes van de cel, noodzakelijk. Bij mensen met MS zijn veranderingen
gevonden in het genetisch materiaal, waardoor de mitochondria mogelijk minder goed over de cel worden verdeeld. In
het onderzoek in paragraaf 7.3 wordt bekeken of er een verband bestaat tussen de manier waarop mitochondria binnen
zenuwcellen verdeeld kunnen worden en de progressie van MS. Hiervoor wordt heel specifiek gekeken naar de eiwitten
die de mitochondria door de cel transporteren.
Kenmerkend voor MS zijn de ontstekingen die in het centrale zenuwstelsel ontstaan. Hoe deze ontstekingen precies
ontstaan is nog niet bekend. In het onderzoek in paragraaf 7.4 wordt gekeken naar de allereerste veranderingen in het
centrale zenuwstelsel, de pre-actieve laesies, die uiteindelijk een ontsteking kunnen vormen.
SCHADE BIJ ONTSTEKING EN
LITTEKENVORMING
Bij mensen met MS dringen ontstekingscellen de hersenen binnen en veroorzaken daar schade. Om dit schadelijke
proces te remmen, is het van belang om te begrijpen hoe deze cellen de hersenen binnenkomen. Tot nu toe werd
gedacht dat deze cellen direct uit de bloedbaan afkomstig waren. Nieuwe aanwijzingen laten zien dat een speciale
hersenstructuur, de plexus chorioides, ook een plek kan zijn waar ontstekingscellen de hersenen binnekomen. In dit
project beschreven in paragraaf 7.5 wordt gekeken wat precies de rol is van deze plexus chorioides in het binnenlaten
van ontstekingscellen in de hersenen.
Illustratie: transport van een mitochondrion (energiecentrale van de cel) in een zenuwcel (zie blz. 55)
53
Onderzoek naar schade bij ontsteking en littekenvorming
Hoofdstuk 7
Speciale cellen die het bloedvaten ondersteunen zijn de astrocyten. Wanneer een ontsteking in de hersenen ontstaat,
reageren deze astrocyten hierop en veranderen in de zogenaamde reactieve astrocyten. Van deze reactieve astrocyten
is vooral bekend dat ze schadelijk kunnen zijn, terwijl ze mogelijk ook bescherming kunnen bieden. In deze studie in
paragraaf 7.6 wordt onderzocht wat het beschermingsmechanisme van deze cellen is. In het bijzonder wordt gekeken
naar de mogelijkheid van de reactieve astrocyten om vitamine A om te zetten naar retinolzuur, aangezien deze stof bij
kan dragen aan het verminderen van ontstekingsschade aan de bloedvaten.
Looptijd van het onderzoek
oktober 2010 – oktober 2014
7.2 Zuurstofradicalen
7.3 De rol van
(09-691 MS)
in
MS
pathologie: van bron tot oplossing
(09-686 MS)
Doel van het onderzoek
Het doel van ons onderzoek is om meer inzichten te verkrijgen in mechanismen die ten grondslag liggen aan de overmatige productie van zuurstofradicalen in MS-laesies en de beschermende effecten van antioxidant systemen te bestuderen.
Achtergrond van het onderzoek
De laatste jaren hebben diverse onderzoeken laten zien dat zuurstofradicalen een belangrijke rol spelen in de ontwikkeling en progressie van MS. Er is echter nog weinig informatie over de mechanismen die ten grondslag liggen aan de
productie van zuurstofradicalen in MS en de mogelijk beschermende effecten van antioxidanten in mensen met MS. Uit
vooronderzoek blijkt dat een bepaalde groep van enzymen, de NADPH oxidases, een belangrijke bron zijn van zuurstofradicalen en ons onderzoek heeft aangetoond dat deze enzymen verhoogd tot expressie komen in MS-laesies. Daarnaast
is gebleken dat activatie van Nrf2, een belangrijk eiwit betrokken bij het onschadelijk maken van zuurstofradicalen,
deze cellen beschermd tegen zuurstofradicalen door gepaarde productie van antioxidant enzymen. In ons onderzoek
zullen we vooral de beschermende effecten van Nrf2 activatie bestuderen in de context van oligodendrocyten, die
uiterst gevoelig zijn voor blootstelling aan radicalen, en in een model van MS.
Bereikte resultaten
• Na vergelijking van drie verschillende Nrf2-activerende stofjes, biedt Protandim primaire oligodendrocyten
afkomstig uit een model voor MS de meest potente bescherming tegen de schadelijke effecten van zuurstofradicalen.
• Protandim zorgt voor een significantere inductie van antioxidant enzymen vergeleken met de andere twee stofjes in
deze primaire oligodendrocyten, wat het verschil in het beschermende effect mogelijk kan verklaren.
• Het stofje dat oligodendrocyten de meest potente bescherming gaf tegen zuurstofradicalen, zorgde echter voor een
verergerd ziektebeeld van het model voor MS. Dit onverwachtse effect hebben we nog niet kunnen verklaren.
Waarom is juist dit onderzoek belangrijk voor MS?
Aangezien onderzoek heeft aangetoond dat oxidatieve schade een belangrijke rol speelt in de pathogenese van MS
is Nrf2-activatie een veelbelovende therapeutische target. Er zijn nog weinig geneesmiddelen voor MS (BG-12 is de
eerste) op de markt die gericht bescherming bieden tegen oxidatieve schade. Mogelijk dat deze Nrf2-activerende stofjes
dan ook de progressieve fase van MS kunnen verminderen, wat de huidige geneesmiddelen op de markt niet kunnen.
Onderzoekers
Jamie Lim, MSc (promovendus)
Susanne van der Pol, BSc (analist)
Begeleiders
Prof. dr. Jack van Horssen (neurobioloog)
Prof. dr. Elga de Vries (celbioloog/immunoloog)
Instituut
VU Medisch Centrum Amsterdam, Afdeling Moleculaire Celbiologie en Immunologie
54
Subsidie
€ 430.000
kinesines in de neurodegeneratieve pathologie van multiple sclerose
Doel van het onderzoek
Achterhalen wat de rol van het axonaal transportsysteem bij het verlies van zenuwcellen bij MS is.
Achtergrond van het onderzoek
Onze zenuwcellen zijn voor hun overleving volledig afhankelijk van een geavanceerd transportsysteem dat gebruik
maakt van moleculaire motoren om materiaal naar alle uithoeken van de cel te brengen. Deze moleculaire motoreiwitten
lopen over lange buizen, de microtubuli, van de celkern naar de zenuwuitloper en weer terug. Een van deze moleculaire
motoren is KIF1B. Enkele jaren geleden werd gevonden dat mutaties in het gen voor deze motor en een aantal
vergelijkbare eiwitten een verhoogd risico geeft op het ontwikkelen van MS. Het doel van ons onderzoek is het
ophelderen van de relatie tussen het transportsysteem en MS en te achterhalen welke rol KIF1B daarin speelt.
Hierbij kijken wij niet in de eerste plaats naar de immunologische kant van MS, maar meer naar de afbraak van
hersencellen die verantwoordelijk is voor de geleidelijke klinische achteruitgang die bij MS wordt gezien.
Bereikte resultaten
• Ontwikkeling van een model voor KIF1B.
• Inductie van EAE, op MS lijkende klachten, in dit model voor MS.
Waarom is juist dit onderzoek belangrijk voor MS?
Op dit moment richt al de beschikbare therapie voor MS zich op de immunologische kant van de ziekte. Echter, deze
therapie kan de ziekte vertragen, maar niet genezen of de al aanwezige schade herstellen. Onderzoek van de neurodegeneratieve kant van MS en daaruit voortkomende neuroprotectieve therapie zou dit in potentie wel kunnen. Ons onderzoek draagt hier op de lange termijn aan bij.
Onderzoeker
Drs. Robert van den Berg (promovendus)
Begeleiders
Prof. dr. Rogier Q. Hintzen (Neuroloog)
Prof. dr. Casper C. Hoogenraad (Moleculair bioloog)
Instituut
Erasmus Medisch Centrum Rotterdam en Universiteit Utrecht.
Looptijd van het onderzoek
januari 2011 – januari 2015
Subsidie
€ 249.655
55
Onderzoek naar schade bij ontsteking en littekenvorming
Hoofdstuk 7
7.4 Pre-actieve MS-laesies:
de sleutel tot herstel van ontstekingen?
(10-726 MS)
Doel van het onderzoek
Pre-actieve laesies worden gezien als de allereerste veranderingen in het brein van mensen met MS. Dit onderzoek is
erop gericht meer inzicht te krijgen in het ontstaan en verloop van deze pre-actieve laesies.
Achtergrond van het onderzoek
Multiple sclerose wordt gekenmerkt door ontstekingshaarden in het centrale zenuwstelsel, de zogeheten laesies ,waarbij
er schade ontstaat aan het myeline (demyelinisatie) en uiteindelijk littekenweefsel. Maar, wat veroorzaakt deze
ontstekingsreactie in de eerste plaats?
Al voordat er enige vorm van schade aan het myeline te zien is, worden er clusters van geactiveerde microglia
(ontstekingscellen van het brein) opgemerkt. Aangenomen wordt dat deze clusters het allereerste stadium zijn van
laesieformatie, vandaar de naam pre-actieve laesies. Echter, het merendeel zal vanzelf verdwijnen zonder zich te
ontwikkelen tot een laesie met schade aan het myeline.
Waarom de ene pre-actieve laesie zich ontplooit tot een actieve laesie en de ander niet is onbekend.
Een mogelijke verklaring zou kunnen liggen bij de microglia. Microglia spelen een belangrijke rol bij het controleren
van een ontsteking in het brein. Ze zijn noodzakelijk om de oorzaak van de ontsteking te verwijderen, zoals bacteriën,
virussen, maar ook hersencellen die niet goed functioneren. Deze functie wordt pro-inflammatoir genoemd. Een nadeel
is dat bij het opruimen ook schade aan de omgeving kan ontstaan. Aan de andere kant, zijn microglia ook noodzakelijk
voor herstel, dit wordt anti-inflammatoir genoemd.
Het zou dus mogelijk kunnen zijn dat sommige pre-actieve laesies, voornamelijk bestaan uit pro-inflammatoire
microglia, die voor schade aan het myeline zorgen. De pre-actieve laesies die verdwijnen zouden juist uit een type dat
voor herstel zorgt kunnen bestaan.
Maar wat zorgt er voor microglia activatie in het brein van mensen met MS? Recente data uit ons lab duiden op
een centrale rol voor gestreste oligodendrocyten, de cel die myeline maakt in het centrale zenuwstelsel. Wanneer
cellen onderhevig zijn aan stressvolle omstandigheden produceren zij een scala aan eiwitten. Een van deze eiwitten
is αB-crystalline. In pre-actieve laesies scheiden oligodendrocyten dit eiwit uit. Wanneer microglia in een
experimentele setting in aanraking komen met is αB-crystalline worden deze geactiveerd. Dit suggereert dat
gestreste oligodendrocyten een belangrijke rol spelen in het activeren van microglia in pre-actieve laesies.
Bereikte resultaten
• Pro- en anti-inflammatoire microglia, produceren andere eiwitten, hierdoor is het mogelijk om de verschillende
typen te beoordelen in pre-actieve laesies
• Er zijn niet twee soorten pre-actieve laesies zoals gedacht, maar ze zijn allemaal opgebouwd uit microglia die zowel
pro- als anti-inflammatoire markers tot expressie brengen
• Oligodendrocyten kunnen een rol spelen bij het activeren van microglia
Waarom is juist dit onderzoek belangrijk voor MS?
Pre-actieve laesies worden gezien als het eerste stadium van laesie formatie. Niet alle pre-actieve laesies zich zullen
ontwikkelen tot laesies met myeline schade en littekenweefsel. Dit gegeven suggereert dat pre-actieve laesies
antwoorden kunnen bieden op de vraag: wat induceert een verwoestende laesie en welke factoren kunnen dit
controleren? Deze antwoorden zouden kunnen leiden tot nieuwe therapeutische doelwitten die de omgeving in het
brein zo kunnen reguleren dat laesie formatie, en dus de schade in het brein, gestopt zouden kunnen worden.
Onderzoeker
Laura Peferoen, Msc (promovendus)
Begeleiders
Prof. dr. Sandra Amor (immunoloog)
Prof. dr. Paul van der Valk (neuropatholoog)
Prof. dr. Markus Kipp (neuroanatoom)
56
Instituut
VU Medisch Centrum, afdeling neuropathologie
Looptijd van het onderzoek
november 2011 – november 2015
Subsidie
€ 243. 693
7.5 De
bloed-hersenvloeistof barrière: de eerste plaats van ontstekingen tijdens multiple
sclerose
(12-791 MS)
Doel van het onderzoek
Uitzoeken hoe de bloed-hersenvloeistof barrière bijdraagt aan de ziekte multiple sclerose.
Achtergrond van het onderzoek
Het binnendringen van ontstekingscellen de hersenen in zorgt voor de hersenschade en bijbehorende uitvalsverschijnselen bij mensen met MS. Om dit schadelijke proces te remmen, is het van belang om te begrijpen hoe
deze ontstekingscellen de hersenen binnenkomen. Tot nu toe werd gedacht dat dit alleen vanuit de bloedbaan
gebeurde, maar recente aanwijzingen hebben laten zien dat een speciale hersenstructuur in de holtes met hersenvloeistof, genaamd de plexus chorioides (bloed-hersenvloeistof barrière), hierbij een belangrijke maar tot op heden
nog onduidelijke rol speelt. Het is bekend dat er in hersengebieden die in contact staan met de hersenvloeistof vaak
MS-laesies voorkomen en wij denken dat het ophopen van ontstekingscellen in de hersenvloeistof komt door een
defecte bloed-hersenvloeistof barrière.
In dit project onderzoeken we of mogelijke veranderingen in de bloed-hersenvloeistof barrière bijdraagt aan het ontstaan
van MS. Voornamelijk zullen we bestuderen hoe ontstekingscellen deze barrière passeren om uiteindelijk nieuwe
aangrijpingspunten voor therapieën te vinden.
Bereikte resultaten
• Ontdekking dat een barrière versterkend eiwit (claudine-3) in de bloed-hersenvloeistof barrière afneemt in de plexus
chorioides van mensen met MS.
• Ontbreken van claudine-3 verergerde klinische verschijnselen in een model voor MS, gepaard met een sterke
toename in het aantal ontstekingscellen in hun hersenvloeistof.
• Ontdekking dat de plexus chorioides lymfeklierachtige capaciteiten bevat en dus een belangrijke rol speelt in de
immunologie van de hersenen.
Waarom is juist dit onderzoek belangrijk voor MS?
Het ontstaan van laesies in de hersenen zorgt voor uitvalsverschijnselen bij mensen met MS. Als we beter begrijpen hoe
de veroorzakers (ontstekingscellen) het brein binnendringen, dan kunnen we ook specifieke therapieën ontwikkelen om
dit proces tegen te gaan.
Onderzoeker
Susanne van der Pol (research analiste)
Begeleiders
Dr. Gijs Kooij (postdoc)
Prof.dr. Elga E. de Vries (neuro-immunoloog)
Instituut
VU medisch centrum / VUmc MS Centrum Amsterdam
57
Onderzoek naar schade bij ontsteking en littekenvorming
Hoofdstuk 7
Looptijd van het onderzoek
mei 2013 - mei 2014
Looptijd van het onderzoek
februari 2013 – februari 2014
Subsidie
€ 48.649
Subsidie
€ 48.325
7.6 Het
ophelderen van de beschermende rol van reactieve astrocyten op de bloed-hersen
barrière in
MS:
de rol van vitamine
A (12-797 MS)
Doel van het onderzoek
Onderzoeken hoe astrocyten tijdens MS bescherming kunnen bieden aan de cellen van de bloedvaten door het
aanmaken van vitamine A-zuur.
Achtergrond van het onderzoek
MS-laesies in de hersenen worden gekenmerkt door schade aan de bloedvaten, de zogenaamde bloed-hersenbarrière,
wat leidt tot de aanwezigheid van immuuncellen in de hersenen. Het is voor de goede werking van de hersenen erg
belangrijk dat deze barrière in stand wordt gehouden, aangezien de bloed-hersenbarrière ontstekingscellen tegenhoudt.
De barrière functie van de bloedvaten wordt in stand gehouden door omringende astrocyten, de steuncellen van de
hersenen.
In een MS-laesie zien we dat astrocyten die reageren op de ontsteking veranderen in zogenoemde reactieve
astrocyten. Van deze cellen is vooral bekend dat ze schadelijk kunnen zijn, terwijl er minder bekend is over de
mogelijke bescherming die deze cellen kunnen bieden. Wij hebben in dit onderzoek gekeken naar de beschermende
rol van deze reactieve astrocyten bij de bloed-hersenbarrière. In het bijzonder het omzetten van vitamine A naar
de actieve vorm, retinolzuur, door deze cellen lijkt een beschermingsmechanisme te zijn van de hersenen om
ontstekingsschade aan de bloedvaten te verminderen. Wij hebben daarom in detail gekeken naar het retinolzuur
systeem in reactieve astrocyten en cellen van de bloed-hersenbarrière.
Bereikte resultaten
• Astrocyten reageren op (hersen)ontsteking door het aanmaken en uitscheiden van lichaamseigen retinolzuur.
• Retinolzuur remt de schade aan de bloed-hersenbarrière tijdens ontsteking.
• Retinolzuur is in staat om beschermende anti-oxidanten aan te maken in de cellen van de bloed-hersenbarrière.
Waarom is juist dit onderzoek belangrijk voor MS?
We zijn constant op zoek naar nieuwe mogelijkheden voor de behandeling van MS. Ons onderzoek wijst op een
lichaamseigen manier die ontsteking en schade in MS-laesies kan tegengaan, in de vorm van retinolzuur productie.
Tot nu toe hebben wij ons gericht op de bloed-hersenbarrière, maar ook de beschermende rol van retinolzuur voor
andere hersencellen is bekend. Wanneer we beter begrijpen hoe dit systeem werkt en hoe we hier eventueel op kunnen
ingrijpen, zouden we in de toekomst bestaande therapieën kunnen uitbreiden door lichaamseigen bescherming in de
hersenen te bevorderen.
Onderzoeker
Dr. Mark Mizee (post-doc)
Begeleider
Prof. dr. Elga de Vries (neuroimmunoloog)
Instituut
VUmc MS Centrum Amsterdam
58
59
Onderzoek naar myelinevormende cellen en stoffen die deze cellen beïnvloeden
8.1 inleiding
Het centrale zenuwstelsel is opgebouwd uit zenuwcellen en begeleidende cellen. De uitlopers van zenuwcellen
worden beschermd door myeline. Myeline wordt gemaakt door een bepaald type hersencel: de oligodendrocyt. De
oligodendrocyt met daarin myeline wikkelt zich om de zenuw en vormt zo de beschermende myelinelaag. Bij MS wordt
myeline afgebroken door het ontregelde afweersysteem. Oligodendrocyten kunnen gedood worden tijdens de aanval op
myeline. Op MRI-scans is te zien dat in de aangedane gebieden soms gedeeltelijk myeline teruggevormd wordt na een
ontsteking. Er wordt veel onderzoek gedaan naar de reden dat myeline niet of slechts gedeeltelijk wordt teruggevormd.
Om deze reden wordt ook veel onderzoek verricht naar de manier waarop de oligodendrocyt myeline vormt en naar
stoffen die de cel kunnen stimuleren tot myelinevorming (myelinisatie).
Wanneer schade ontstaat aan myeline, zal het lichaam proberen om deze schade weer te herstellen door nieuw myeline
aan te maken. Microglia, de belangrijkste cellen van het afweersysteem in de hersenen, hebben mogelijk een positieve
invloed op dit herstelproces. In de studie die beschreven is in paragraaf 8.2 worden de mogelijke herstellende eigenschappen van microglia op de vorming van myeline onderzocht.
Om te begrijpen waarom oligodendrocyten niet altijd myeline aanmaken in MS-laesies is het belangrijk om te weten hoe
myeline in gezonde cellen wordt gemaakt. In het onderzoek beschreven in paragraaf 8.3 wordt speciaal gelet op één
van de bestanddelen van myeline, de stof MBP. Onderzocht wordt hoe MBP van binnen in de cel naar het oppervlak van
de cel wordt getransporteerd en welke signalen hiervoor nodig zijn.
Bij MS ontstaat er in de hersenen schade aan myeline in zowel de witte als de grijze stof. Gebleken is dat het myeline
in de grijze stof veel sneller en efficiënter herstelt dan in de witte stof. In de studie in paragraaf 8.4 wordt onderzocht
waardoor dit verschil veroorzaakt wordt.
Het eiwit galectine-4 treedt op als een schakelaar voor de aanmaak van myeline. Tijdens de ontwikkeling van de
hersenen, waarbij veel myeline wordt gevormd, moet deze schakelaar “uit” staan voor de productie van myeline. Bij MS
staat galectine-4 “aan” wat één van de redenen kan zijn waarom het herstel van myeline niet goed werkt. Waarom de
schakelaar aanstaat bij MS, alsook het schakelmechanisme, wordt in het project in paragraaf 8.5 onderzocht.
8
Een mogelijkheid om myelinevorming en daarmee herstel van myeline te bevorderen, zou het in de hersenen brengen
van extra oligodendrocyten kunnen zijn. Cellen voor implantaties worden in de regel verkregen uit zogenaamde stamcellen. Dit zijn cellen die kunnen uitgroeien tot heel veel of zelfs tot alle mogelijke verschillende type cellen. Voordat
oligodendrocyten die uit stamcellen gegroeid zijn voor behandeling van mensen met MS kunnen worden gebruikt,
zal hun veiligheid (kans op zwerven door het lichaam of tumorvorming), functionaliteit en stabiliteit na toediening
onderzocht moeten worden. Met functionaliteit wordt bedoeld of de cellen inderdaad doen wat ze moeten doen
(myeline vormen op plaatsen waar myelineafbraak heeft plaatsgevonden) en met stabiliteit of de cellen voor langere
tijd in leven en gezond blijven. Dit wordt onderzocht in het onderzoek dat beschreven is in paragraaf 8.6.
MYELINEVORMENDE CELLEN
EN STOFFEN DIE DEZE
CELLEN BEÏNVLOEDEN
Er zijn aanwijzingen dat de schade aan myeline niet alleen vanaf de buitenkant ontstaat (door het afweersysteem),
maar dat de schade ook van binnenuit kan ontstaan (vanuit de oligodendrocyt). Het is uiteraard niet mogelijk om dit
te onderzoeken op oligodendrocyten afkomstig uit de hersenen van mensen met MS. Met een nieuwe techniek kunnen
oligodendrocyten gemaakt worden vanuit cellen uit de huid. In het onderzoek beschreven in paragraaf 8.7 wordt onderzocht of deze ‘gekweekte’ oligodendrocyten ook van ‘binnenuit’ schade kunnen veroorzaken aan myeline.
Eén van de redenen dat de laag myeline rond de zenuwen niet goed kan herstellen, is de vorming van littekenweefsel
in de hersenen. Verschillende stoffen spelen een rol bij de vorming van littekens en bij de ontwikkeling van oligodendrocyten die myeline kunnen maken. Eén van deze stoffen is het enzym weefseltransglutaminase. Wat de rol van dit
enzym is in het vormen van littekens en het aanmaken van nieuw myeline wordt onderzocht in het project beschreven
in paragraaf 8.8.
Illustratie: beschadiging van myeline
61
Onderzoek naar myelinevormende cellen en stoffen die deze cellen beïnvloeden
Hoofdstuk 8
8.2 Karakterisering
MS)
van een microglia fenotype dat remyelinisatie ondersteunt
(10-723
Doel van het onderzoek
Het identificeren van microglia die remyelinisatie ondersteunen.
Achtergrond van het onderzoek
Multiple sclerose wordt gekenmerkt door verlies van myeline en de dood van myeline-producerende cellen, de
oligodendrocyten. Tijdens het beginstadium van de ziekte probeert het centrale zenuwstelsel de schade te repareren
om de functie van het zenuwstelsel te herstellen. Echter, de capaciteit is niet toereikend om progressie van MS te
voorkomen. Tijdens demyelinisatie raken oligodendrocyten beschadigd met een ontstekingsreactie als gevolg. Er zijn
aanwijzingen dat een dergelijke ontstekingsreactie belangrijk is voor het herstelproces, en lokale microglia cellen spelen
hierin een belangrijke rol. Microglia zijn de belangrijkste cellen van het immuunsysteem in het centrale zenuwstelsel.
Deze microglia raken geactiveerd op plaatsen waar demyelinisatie optreedt en recente bevindingen hebben aangetoond
dat microglia activatie het remyelinisatie proces ondersteunt. Het doel van het in dit project uitgevoerde onderzoek is
om de eigenschappen van deze microglia, die ondersteunend werken voor remyelinisatie, goed in kaart te brengen. Dit
stelt ons mogelijk in staat in te grijpen in het microglia activatie proces en zo remyelinisatie processen beter te ondersteunen.
Bereikte resultaten
• Wij hebben een goedlopende methode ontwikkeld om de microglia uit het ruggenmerg te isoleren van een model
voor MS en te onderscheiden van infiltrerende cellen (macrofagen).
• Onze resultaten duiden erop dat microglia van macrofagen verschillen in hun capaciteit om met andere immuuncellen te communiceren.
• Het lijkt erop dat microglia niet actief meedoen met de myeline afbraak en ook andere cellen niet stimuleren om
myeline af te breken.
Waarom is juist dit onderzoek belangrijk voor MS?
Deze resultaten zijn zeer hoopgevend en momenteel zijn wij bezig te onderzoeken welke rol microglia verder spelen
gedurende MS, met als aandachtspunt de mogelijke remyeliniserende capaciteit. Wij denken dat toekomstige
therapieën gericht op microglia van waarde kunnen zijn voor de behandeling van MS.
Onderzoeker
Drs. Ilia D. Vainchtein (promovendus)
Begeleiders
Dr. Bart J.L. Eggen (moleculair neurobioloog)
Prof. dr. Erik W.G.M. Boddeke (neurofysioloog)
Instituut
Universitair Medisch Centrum Groningen
Looptijd van het onderzoek
september 2011 – september 2015
Subsidie
€ 257.000
8.3 Onderzoek
naar het transport van één van de belangrijkste myeline eiwitten,
naar het myelinemembraan
(07-621 MS)
MBP,
Doel van het onderzoek
Karakterisering van de wijze waarop het myeline-eiwit MBP in de myelineschede terecht komt en welke signalen,
afkomstig van binnen of van buiten de myeline-producerende cel, daarvoor nodig zijn.
Achtergrond van het onderzoek
Myeline, gemaakt door oligodendrocyten, vormt de isolerende laag rondom de zenuwen wat zorgt voor een snelle
geleiding van signalen die nodig zijn voor het in stand houden of op gang brengen van processen in en activiteiten
van het menselijk lichaam. Bij multiple sclerose (MS) ontstaan kleine gebiedjes (‘laesies’) in de hersenen en in het
ruggenmerg waar door een nog onbekende oorzaak myeline wordt afgebroken en meestal niet meer wordt aangemaakt.
Myelin basic protein (MBP) is een eiwit dat een groot gedeelte uitmaakt van myeline en bovendien essentieel is voor de
vorming ervan. Het eiwit wordt ter plekke aangemaakt uit MBP messenger RNA (mRNA), wat na vrijkomen uit de kern,
eerst als zodanig in capsules wordt getransporteerd naar het myeline. In dit project proberen we meer inzicht te krijgen
in de processen die er voor zorgen dat MBP terecht komt in myeline, en hoe die processen worden aangestuurd door
signalen van buitenaf. Op die manier hopen we inzicht te krijgen in mogelijkheden om myelinevorming in een MS- laesie, via hernieuwde aanmaak van MBP, opnieuw mogelijk te maken.
Bereikte resultaten
• Wanneer de aanmaak van syntaxin 4, een bekend ankereiwit in transportprocessen, in voorlopercellen van
oligodendrocyten wordt geblokkeerd, kan er geen MBP eiwit meer worden aangeleverd, omdat de aanmaak van
MBP mRNA stopt.
• De ontstekingsmediator TNFα, aanwezig in MS-laesies, beschadigt het geraamte (‘cytoskelet’, betrokken bij
transport processen) van de myeline-producerende oligodendrocyten dusdanig, dat het MBP eiwit nog maar in
zeer beperkte mate in myeline terechtkomt.
• De vetachtige stof sulfatide is belangrijk voor de aanmaak van MBP in de aanwezigheid van laminine-2, een
signaalstof afkomstig van zenuwen. Fibronectine, een signaalstof aanwezig in MS-laesies en niet in gezonde
gedeeltes van de hersenen, plaatst sulfatide op een verkeerde plek in het membraan, waardoor de aanmaak van
myeline wordt verstoord.
Waarom is juist dit onderzoek belangrijk voor MS?
Om te begrijpen waarom oligodendrocyten niet altijd myeline aanmaken in MS-laesies is het belangrijk te weten hoe
onder gezonde omstandigheden de myelinemembranen worden gevormd. Immers, door te weten op welke wijze het
essentiële myeline eiwit MBP wordt aangeleverd en op de juist manier ‘ingebouwd’, kan er ook gezocht worden naar
manieren om deze processen te beïnvloeden, cq te bevorderen. Het is ook van groot belang om inzicht te krijgen hoe
dit transport van buiten de cel gestimuleerd zou kunnen worden en welke rol zenuwen en ontstekingsreacties in dat
proces (kunnen) spelen. Hiermee verwachten we gereedschap in handen te krijgen om de heraanmaak van myeline te
stimuleren.
Onderzoeker
Marjolein Bijlard MSc (promovendus)
Begeleiders
Dr. Wia Baron (biochemicus/celbioloog)
Prof. dr. Dick Hoekstra (biochemicus/celbioloog)
Instituut
Universitair Medisch Centrum Groningen, disciplinegroep Celbiologie
62
63
Onderzoek naar myelinevormende cellen en stoffen die deze cellen beïnvloeden
Hoofdstuk 8
Looptijd van het onderzoek
1 oktober 2009 - 1 oktober 2013
Instituut
Universitair Medisch Centrum Groningen, Disciplinegroep Celbiologie
Subsidie
€ 227.620
Looptijd van het onderzoek
augustus 2012 - november 2013
8.4 Grijze
Subsidie
€ 50.000
en witte stof astrocyten: onderzoek naar functionele verschillen in hun vermo-
gen om de heraanmaak van myeline te beïnvloeden
(11-766 MS)
Doel van het onderzoek
Het verkrijgen van meer inzicht in waarom het herstel van myeline in grijze stof laesies beter verloopt dan in witte stof
laesies.
Achtergrond van het onderzoek
Plaatselijke afbraak (demyelinisatie) in afwezigheid van spontane heraanmaak (remyelinisatie) van myeline - het
isolatiemateriaal rondom uitlopers van zenuwcellen (axonen) - speelt een wezenlijke rol in het ziektebeeld van multiple
sclerose (MS). De werking van zenuwen in het centrale zenuwstelsel wordt door deze blijvende demyelinisatie ernstig
gestoord. De omgeving in de aangetast gebieden, de laesies, is door de plaatselijke ontstekingsreactie dusdanig
verstoord dat de processen die nodig zijn voor de heraanmaak van myeline worden geremd of onjuist worden
gestimuleerd. De schade in MS beperkt zich in de hersenen niet uitsluitend tot de witte stof; er zijn ook afwijkingen
in de grijze stof te vinden. Opvallend is dat de heraanmaak van myeline in grijze stof laesies veel beter verloopt dan in
witte stof laesies. In dit pilotproject onderzoeken we of grijze en witte stof astrocyten – de ondersteunende cellen van
het centrale zenuwstelsel - verschillen in hun vermogen om de heraanmaak van myeline te beinvloeden.
Bereikte resultaten
• Door gebruik te maken van een speciale kweektechniek waarbij we op een voedingsbodem van astrocyten de
aanmaak van myeline laten plaatsvinden, hebben we laten zien dat de aanmaak van myeline toeneemt op een
voedingsbodem met astrocyten afkomstig uit de grijze stof.
• Bovenstaand effect is niet het gevolg van oplosbare signaalstoffen die worden uitgescheiden door astrocyten, maar
door signalen die rondom de astrocyten blijven liggen, zoals fibronectine, dat deel uitmaakt van de cellulaire matrix
waarmee de cellen zich omgeven.
• Astrocyten afkomstig uit de witte stof laten fibronectine meer samenklonteren dan grijze astrocyten. Omdat het
samenklonteren van fibronectine het herstel van myeline bij MS ernstig remt, zou dit een reële verklaring zijn
waarom remyelinisatie in grijze stof laesies effectiever verloopt.
Waarom is juist dit onderzoek belangrijk voor MS?
In dit project proberen we meer inzicht te krijgen waarom de heraanmaak van myeline in de grijze stof efficiënter
verloopt. We richtten ons daarbij op signalen afkomstig van astrocyten. Ten eerste omdat deze cellen zowel in
positieve als negatieve zin betrokken kunnen zijn bij het in goede banen leiden van het herstel na afbraak van
myeline. Bovendien verschillen de astrocyten in de witte stof van astrocyten aanwezig in de grijze stof wat betreft
hun vorm en aantal functies. Door te weten of er verschillen zijn in myeline-modulerende signaalstoffen afkomstig
van astrocyten uit verschillende gebieden, kan er ook naar mogelijkheden gezocht worden om de heraanmaak in MS
laesies te verbeteren.
Onderzoeker
Bojana Mikus (analist)
Begeleiders
Dr. Wia Baron (biochemicus / celbioloog)
Prof. dr. Dick Hoekstra (biochemicus / celbioloog)
64
8.5 Onderzoek
naar galectine-4 als mogelijk therapeutisch doel voor het opnieuw aanma-
ken van myeline in
MS (11-767 MS)
Doel van het onderzoek
In dit project onderzoeken we of galectine-4, een schakelaar voor de aanmaak van myeline, ook een rol kan spelen in
het opnieuw produceren van myeline na afbraak, zoals in het geval van MS, en welke stoffen een effect hebben op de
werking van deze schakelaar.
Achtergrond van het onderzoek
De meeste therapeutische benaderingen bij MS richten zich op het beïnvloeden van het immuunsysteem, dat nauw
betrokken is bij de afbraak van myeline. Deze keuze lijkt voornamelijk te worden ingegeven door de nog gebrekkige
kennis omtrent de redenen voor het uitblijven van de heraanmaak van myeline. Met name op cellulair gebied weten
we nog maar weinig waarom en wat er gebeurd tijdens zowel de afbraak als de (her)aanmaak van myeline. Uit
eerder onderzoek van onze groep is gebleken dat het eiwit galectine-4, afkomstig van zenuwcellen, optreedt als een
schakelaar voor de aanmaak van myeline, zoals dat geproduceerd wordt door oligodendrocyten. Tijdens de ontwikkeling
van de hersenen moet deze schakelaar “uit” staan om de productie van myeline door oligodendrocyten mogelijk te
maken. In dit project onderzoeken we of galectine-4 ook een rol kan spelen in het opnieuw aanmaken van myeline na
afbraak in gezonde omstandigheden, en of de galectin-4 schakelaar misschien “aan” staat als gevolg van MS. Daarnaast willen we ook onderzoeken hoe we deze schakelaar ‘op afstand’ zouden kunnen bedienen.
Bereikte resultaten
• Galectine-4 is verhoogd aanwezig tijdens de afbraak van myeline in de hersenen en het ruggenmerg.
• Opvallend is dat we ook galectine-4 aantreffen in microglia en macrofagen, cellen die nauw betrokken zijn bij de
ontstekingsreactie en het opruimen van myeline restanten.
• Voorlopige resultaten laten zien dat galectine-4 verhoogd aanwezig is in de aangetaste gebieden (laesies) bij MS.
Waarom is juist dit onderzoek belangrijk voor MS?
Gedetailleerde kennis over myeline vorming en het ontrafelen waarom het opnieuw aanmaken van myeline na
afbraak tijden MS uitblijft, zal bijdragen aan het ontwikkelen van nieuwe en efficiëntere therapeutische strategieën.
Opmerkelijk is dat de cellen die verantwoordelijk zijn voor de aanmaak van myeline, de oligodendrocyten, meestal
wel in de aangetaste gebieden aanwezig zijn. Kennelijk is de omgeving in deze gebieden dusdanig verstoord dat de
processen die nodig zijn voor het opnieuw aanmaken van myeline worden geremd of niet (meer) op de juiste wijze
worden geactiveerd. Zo hebben wij onlangs vastgesteld dat de aanwezigheid van galectine-4 de aanmaak van myeline
remt. Omdat deze stof ook aanwezig is in MS-laesies veronderstellen we dat galectine-4 ook een negatief effect heeft
op het opnieuw aanmaken van myeline, zoals dat in die laesies zo zeer gewenst is. Momenteel onderzoeken we waar
galectine-4 vandaan komt en wat we er tegen kunnen doen om de mogelijk negatieve werking van galectine-4 op de
aanmaak te blokkeren.
Onderzoeker
Drs. Charlotte G.H.M. de Jong (promovendus)
65
Onderzoek naar myelinevormende cellen en stoffen die deze cellen beïnvloeden
Hoofdstuk 8
Begeleiders
Dr. Wia Baron (biochemicus/celbioloog)
Prof. dr. Dick Hoekstra (biochemicus/celbioloog)
Instituut
Universitair Medisch Centrum Groningen, Disciplinegroep Celbiologie
Looptijd van het onderzoek
december 2012 – december 2016
Onderzoeker
Drs. Arun Thiruvalluvan (promovendus)
Subsidie
€ 243.532
8.6 Optimalisering van iPS celtherapie
model voor MS (09 – 694 MS)
gericht op remyelinisatie-inductie; studies in een
Doel van het onderzoek
Het uittesten en optimaliseren van een iPS celtransplantatie therapie voor MS in een model voor MS.
Achtergrond van het onderzoek
Een celvervangingstherapie voor MS om herstel van myeline te bewerkstelligen lijkt binnen bereik te zijn gekomen
door de ontwikkeling van de induced pluripotente stemcell (iPS) technologie. Met deze technologie kunnen huidcellen
veranderd worden in pluripotente stamcellen (iPS-cellen) die vervolgens gedifferentieerd kunnen worden in, in principe,
elk denkbaar celtype. Op deze manier kunnen uit mensen met MS een onbeperkt aantal “eigen” oligodendrocyten
verkregen worden die na implantatie kunnen zorgen voor myeline-herstel zonder dat zij door het immuunsysteem
worden afgebroken. In onderzoek in een model voor MS, hebben we laten zien dat uit iPS cellen verkregen jonge
oligodendrocyten na transplantatie inderdaad nieuwe myeline aan maken. Voordat we kunnen gaan testen of een
dergelijke benadering ook echt toepasbaar zou kunnen zijn voor mensen met MS, zal eerst moeten worden aangetoond
dat deze cellen veilig (met name geen tumorvorming) en werkzaam zijn in de mens; dat kan het best in een model voor
MS.
Vragen die wij onderzoeken zijn:
• Migreren uit iPS cellen verkregen jonge oligodendrocyten na implantatie direct naar de laesies in het centraal
zenuwstelsel en remyeliniseren ze daar axonen?
• Wat gebeurt er met de geïmplanteerde cellen op langere termijn, blijven ze stabiel en functioneel of vormen ze
wellicht tumoren?
Bereikte resultaten
• Uit huidcellen van modellen hebben we iPS cellen kunnen genereren; tot dusverre was de pluripotentie van deze
iPS cellen helaas beperkt en was de differentiatie tot myeline-vormende oligodendrocyten inefficiënt.
• Ondertussen zijn we erin geslaagd ook humane iPS cellen te maken en te differentiëren tot echte myelinevormende
jonge oligodendrocyten.
• In een eerste pilotstudie hebben we uit humane iPS cellen verkregen jonge oligodendrocyten via een ruggenprik getransplanteerd in een model voor MS. Het doel van deze zeer korte pilot was het optimaliseren van de
transplantatie-methode, het testen van het lot van de ingebrachte cellen (hoeveel overleven, waar komen ze terecht
en migreren ze naar de laesies?) en de veiligheid van de transplantatie. De positieve resultaten zijn aanleiding
geweest om nu lange termijn experimenten met intracerebrale implantatie van iPS oligodendrocyten te starten bij
dit model voor MS.
66
Waarom is juist dit onderzoek belangrijk voor MS?
De laatste tiental jaren hebben hoopgevende ontwikkelingen laten zien in de preventie van de infiltratie van
ontstekingscellen in het centraal zenuwcelstelsel waarmee de frequenties en de heftigheid van aanvallen in
relapsing-remitting MS gereduceerd kunnen worden. Voor al de neurologische symptomen van MS die direct
gerelateerd zijn aan het verdwijnen van myeline en het ten gronde gaan van zenuwvezels is nog steeds geen enkele
behandeling voor handen. De ontwikkelingen op het gebied van iPS cellen maken het voor het allereerst mogelijk te
onderzoeken of implantatie van (eigen) myeline-vormende cellen een optie is om myeline verlies en daarmee het ten
gronde gaan van zenuwvezels tegen te gaan.
Begeleiders
Dr. J.C.V.M. Copray (neurobioloog)
Prof. dr. B.A. ’t Hart (neuro-immunoloog)
Instituut
Universitair Medisch Centrum Groningen (UMCG)
Looptijd van het onderzoek
juli 2011 – juli 2015
Subsidie
€ 305.013
8.7 Onderzoek
MS-oligodendrocyten met behulp
van mensen met MS (12-778 MS)
aan
huidfibroblasten
van iPS cellen gegenereerd uit
Doel van het onderzoek
Onderzoek naar mogelijk intrinsieke afwijkingen in de oligodendrocyten van mensen met MS met behulp van iPS cellen.
Achtergrond van het onderzoek
Hoewel (auto) immuun mechanismes tot nu toe als de belangrijkste pathogene factoren voor het ontstaan van
MS zijn aangemerkt, zijn er in toenemende mate aanwijzingen dat er wellicht (ook) intrinsieke verschillen in de
myeline-vormende cellen (en de wijze waarop ze bijvoorbeeld op lokale stress reageren) tussen mensen met MS en
gezonde personen een (primaire?) rol spelen. Er zijn rapporten over mensen met MS waar in een vroeg stadium nog
geen sprake is van ontstekingsinfiltraten (pas secundair), maar wel al van uitgebreide oligodendrocyten dysfunctie en
degeneratie. Daarnaast is duidelijk geworden dat myeline destructie in MS van binnenuit de myeline-schede optreedt
en niet door aantasting vanaf de buitenkant. Het is uiteraard onmogelijk om onderzoek te doen aan geïsoleerde
oligodendrocyten uit de hersenen van mensen met MS. Echter, de ontwikkeling van de induced pluripotent stemcell
(iPS) technologie, maakt het nu mogelijk om via de differentiatie van iPS cellen van mensen met MS een onbeperkte
hoeveelheid “eigen” oligodendrocyten te genereren voor gedetailleerd onderzoek.
In dit pilot project willen wij onderzoeken of er intrinsieke verschillen bestaan tussen mensen met MS (ook onderling
tussen mensen met primair progressieve (PPMS)- en relapsing-remitting MS (RRMS)) en gezonde personen in de
eiwitproductie van hun oligodendrocyten en in de wijze waarop ze op normaal voorkomende lokale (oxidatieve, inflammatoire of excitatoire) stress reageren.
67
Onderzoek naar myelinevormende cellen en stoffen die deze cellen beïnvloeden
Hoofdstuk 8
Bereikte resultaten
• Van 5 RRMS-patiënten, 5PPMS- patiënten en 5 controles zijn iPS cellen gegenereerd.
• Zowel uit de controle iPS cellen als van die van mensen met MS konden oligodendrocyten gegeneerd worden die
qua fenotype identiek leken.
• Met behulp van in-vitro testen naar functionaliteit en stressreactiviteit, in combinatie met (epi)genotypering van
de verschillende MS-oligodendrocyten, wordt momenteel onderzoek verricht naar significante, mogelijke cruciale,
verschillen.
Waarom is juist dit onderzoek belangrijk voor MS?
Hoewel onderdrukking van het binnendringen van agressieve immuuncellen in de hersenen leidt tot duidelijke
verbeteringen in symptomen van RRMS, is het duidelijk geworden dat neurodegeneratieve processen, ook bij
afwezigheid van significante ontstekingen, gewoon doorgaan zoals in PP en secundair progressieve MS. De immuunonafhankelijkheid in dit stadium duidt op intrinsieke neurale processen, waaraan mogelijk intrinsieke verschillen
in oligodendrocyten (en neuronen?) ten grondslag liggen. Onderzoek daaraan kan mogelijk leiden tot nieuwe
therapeutische benaderingen in aanvulling op reeds bestaande immuungerelateerde behandelingen.
Onderzoeker
Drs. Marcin Czepiel (promovendus)
Begeleiders
Dr. J.C.V.M. Copray (neurobioloog)
Prof. dr. H.W.G.M. Boddeke (neurobioloog/fysioloog)
Instituut
afdeling Neurowetenschappen, Universitair Medisch Centrum Groningen (UMCG)
Waarom is juist dit onderzoek belangrijk voor MS?
Wij onderzoeken processen die bijdragen aan de vorming van een niet-ontvankelijke omgeving (litteken) voor myeline
vorming in de hersenen van mensen met MS. MS is een chronische ziekte waarbij littekenvorming een groot probleem
is. Als dit aspect van de ziekte beter begrepen wordt, is het mogelijk hierin in te grijpen, wat kan leiden tot myeline
herstel in de hersenen en een verhoogde kwaliteit van leven voor mensen met MS.
Onderzoeker
Nathaly Espitia Pinzon, MSc (promovendus)
Begeleiders
Dr. Anne-Marie van Dam (neuroimmunoloog)
Dr. Wia Baron (biochemicus/celbioloog)
Instituut
VU medisch centrum, Amsterdam en Universitair Medisch Centrum Groningen
Looptijd van het onderzoek
december 2010 - december 2014
Looptijd van het onderzoek
januari 2013 tot januari 2014
Subsidie
€ 242.380
Subsidie
€ 50.000
8.8 Onderzoek
Bereikte resultaten
• Astrocyten (ondersteunende cellen in het hersenweefsel) afkomstig uit een model voor MS bleken, nadat ze
behandeld waren met onstekingsregulerende stoffen om net als bij MS, in staat om meer eiwitten te maken die
onderdeel zijn van de extracellulaire matrix (fibronectine en laminine), vergeleken met niet behandelde astrocyten.
• Daarnaast bleek dat de matrix gemaakt door deze behandelde astrocyten meer samenklontering vertoonde van
dezelfde matrix eiwitten (fibronectine en laminine) vergeleken met onbehandelde astrocyten.
• Als model-astrocyten meer weefseltransglutaminase produceren heeft dat een stimulerend effect op de vorming van
myeline rond zenuwbanen.
naar de rol van het enzym weefseltransglutaminase bij littekenvorming en
bij de vorming van myeline
(09-693 MS)
Doel van het onderzoek
In dit project willen wij de rol van weefseltransglutaminase onderzoeken in astrogliose (littekenvorming) en in het
proces van myeline (beschermlaag van zenuwbanen) vorming om zo tot een beter herstel te komen.
Achtergrond van het onderzoek
Tijdens het ziekteproces van MS reizen ontstekingscellen vanuit de bloedbaan naar het centrale zenuwstelsel en
zijn daar betrokken bij de afbraak van een beschermende laag (myeline) rondom de zenuwbanen wat gepaard gaat
met ontsteking en littekenvorming. Littekenvorming bemoeilijkt het herstel van de myelinelaag omdat het o.a. de
migratie van myeline vormende cellen naar de plek van schade beperkt. Wij onderzoeken de rol van het enzym
weefseltransglutaminase in littekenvorming en in de ontwikkeling van myeline vorming, omdat van dit enzym bekend
is dat het betrokken is bij processen zoals celmigratie, celrijping en eiwitklontering die ook een rol spelen bij de
pathologie van MS. Wij zijn geïnteresseerd in hoe weefseltransglutaminase betrokken is bij de vorming van de
structuren die zich buiten cellen bevinden (extracellulaire matrix), in cel-matrix interacties en het samenklonteren
van matrix componenten tijdens de littekenvorming. Tevens onderzoeken we matrix-onafhankelijke (directe) effecten
van weefseltransglutaminase op myelinevorming.
68
69
Onderzoek naar de oorzaak van klinische symptomen en ziekteverloop
9.1 inleiding
MS kan bij verschillende personen een sterk verschillend beloop hebben. Daarnaast kunnen verschillende typen van
MS onderscheiden worden. Ook binnen deze typen kan het verloop sterk variëren. De belangrijkste typen van MS zijn
relapsing-remitting MS, primair progressieve MS en secundair progressieve MS. Ongeveer 85% van de mensen bij wie
MS wordt vastgesteld, hebben de relapsing-remitting variant. Dit is een vorm van MS waarbij periodes met klachten
(exacerbaties of schubs) worden afgewisseld met perioden van herstel waarin de klachten verminderen of verdwijnen.
Vaak gaat relapsing-remitting MS op den duur over in secundair progressieve MS. In deze tweede fase is sprake van
geleidelijke achteruitgang en treedt geen tussentijds herstel meer op. Bij 10-15% van de mensen met MS treedt er
meteen vanaf het begin verslechtering op zonder tussentijds herstel. Er is dan sprake van primair progressieve MS.
Onderzoek naar en diagnose van MS zijn lange tijd bemoeilijkt, omdat je niet bij mensen in de hersenen kunt kijken.
Sinds ongeveer 30 jaar beschikt men echter over de MRI-techniek. Door middel van magnetische velden is het met
deze techniek wel mogelijk om een beeld te maken van de hersenen van een levend persoon. De MRI-techniek is zeer
belangrijk voor zowel de diagnose van, als het onderzoek naar MS. In 2010 zijn diagnostische MRI-criteria aangepast,
zodat de diagnose MS sneller en met meer zekerheid gesteld kan worden met behulp van MRI. Bovendien wordt deze
techniek voortdurend verder ontwikkeld om op deze wijze zo veel mogelijk gegevens over de ziekte MS te kunnen
achterhalen.
Voor het maken van een MRI-scan bestaan verschillende technieken. Elke techniek levert een ander beeld op met
andere informatie over wat er in de hersenen mis gaat. Dit is min of meer te vergelijken met de verschillende beelden
die verkregen worden na het bekijken van iets zonder bril, door een gekleurde bril of met een nachtkijker. De laatste
jaren is zeer veel vooruitgang geboekt met het gebruik van MRI voor de diagnose van MS. Hoewel MRI een zeer
belangrijk hulpmiddel is om vast te stellen of iemand MS heeft, kan op dit moment uit de MRI-beelden echter niet
afgeleid worden welke vorm van MS iemand heeft en of de ziekte snel of langzaam zal verergeren. De met MRI
waargenomen beschadigingen corresponderen bovendien niet één op één met de klachten. De hoeveelheid met MRI
zichtbare schade vertoont zelfs maar in beperkte mate een verband met de mate van beperkingen van de persoon met
MS. Soms zijn er bij mensen met weinig beperkingen veel MS-laesies zichtbaar op de MRI, soms bij mensen met
veel beperkingen juist weinig. Het ontbreken van een sterk verband wordt mogelijk veroorzaakt door ziekteactiviteit en
beschadigingen buiten de MS-laesies of door ander met MRI moeilijk zichtbaar te maken schade. Daarnaast lijkt de
flexibiliteit van hersenen en ruggenmerg een rol te spelen. Door deze flexibiliteit kunnen gezonde hersengebieden soms
functies van beschadigde gebieden overnemen.
De laatste jaren is duidelijk geworden dat naast laesies van myeline in de zogenaamde witte stof, ook laesies in de
grijze stof een rol spelen bij de ontwikkeling van MS. Hoogstwaarschijnlijk spelen deze beschadigingen een belangrijke
rol in het ontstaan van blijvende schade en invaliditeit door MS. Uit de in dit katern bescheven studies en voorgaand
onderzoek blijkt dat laesies in de grijze stof veel voorkomen bij MS. Wanneer door de microscoop naar witte en grijze
stof laesies gekeken wordt, worden veel verschillen gevonden. Een belangrijk verschil is dat grijze stof laesies, in
tegenstelling tot witte stof laesies, niet of veel minder gepaard gaan met ontstekingen.
9
OORZAAK VAN
KLINISCHE SYMPTOMEN EN
ZIEKTEBELOOP
Naast lichamelijke achteruitgang kan bij MS ook achteruitgang in cognitieve functies optreden. Onder cognitieve
functies wordt alles verstaan wat met het onthouden, opnemen en verwerken van kennis te maken heeft (geheugen,
concentratie, planning, rekenen, etc.). Aangezien er geen verband gevonden is tussen lichamelijke en cognitieve
achteruitgang en tussen cognitieve achteruitgang en de hoeveelheid MS-ontstekingen is de oorzaak van cognitieve
stoornissen mogelijke gelegen in de grijze stof.
Sinds 1990 wordt veel MS-onderzoek mogelijk gemaakt door de MS-Hersenbank, die financieel wordt ondersteund door
Stichting MS Research. De MS-Hersenbank verzamelt hersenmateriaal van mensen met en zonder MS, die tijdens hun
leven een speciaal donorcodicil hebben getekend. Dit zeer goed omschreven hersenmateriaal wordt beschikbaar gesteld
aan MS-onderzoekers. Het maakt het hen mogelijk het ziekteproces en de aangedane gebieden te onderzoeken in
hersenmateriaal van mensen.
71
Hoofdstuk 9
In het onderzoek beschreven in paragraaf 9.2 wordt gekeken naar de invloed van twee gebiedjes in de hersenen, de
hypocampus en de thalamus, op het ontstaan van cognitieve problemen. Bestudeerd wordt hoe deze gebiedjes functioneren en wat er gebeurd als er ontstekingen optreden.
Paragraaf 9.3 behandelt onderzoek naar de manier waarop het brein kan compenseren voor de structurele schade die
door MS is veroorzaakt en naar het verschil in MS tussen mannen en vrouwen.
Bij mensen met MS treedt vaak neurodegeneratie op, waarbij geleidelijk hersenweefsel verloren gaat. In het onderzoek
in paragraaf 9.4 wordt gekeken of deze neurodegeneratie gemeten kan worden met behulp van MRI-beelden.
Afwijkingen die in de hersenen ontstaan, kunnen duiden op MS, maar kunnen ook erg lijken op afwijkingen die juist bij
een andere ziekte horen en dus eigenlijk niets met MS te maken hebben. Met behulp van MRI is dit onderscheid soms
erg moeilijk te maken. Het onderzoek in paragraaf 9.5 richt zich op het herkennen van de verschillen tussen mensen
met MS en mensen met vaatafwijkingen met behulp van hele gedetailleerde MRI-beelden.
Bereikte resultaten
In MS:
• De hippocampus kan ‘overwerken’ wat samengaat met behoud van cognitieve functies
• Schade aan de voorste verbinding van de thalamus is het belangrijkste in relatie tot cognitie
• Opleiding, geslacht, en hoeveelheid grijze stof zijn voorspellers voor cognitieve functie
Waarom is juist dit onderzoek belangrijk voor MS?
Cognitieve problemen bij MS komen vaak voor en kunnen een erg grote invloed hebben op de kwaliteit van leven van
mensen met MS. Deze cognitieve symptomen leiden soms zelfs tot een sociaal isolement en verlies van baan. Vanuit
de patiënten is er een grote behoefte aan interventies die cognitieve problemen zo lang mogelijk uitstellen of zelfs
voorkomen. De huidige studie heeft aanknopingspunten gegeven voor de strategie die we daarvoor moeten gebruiken.
Mogelijk is vroege interventie (voordat cognitieve klachten aanwezig zijn) noodzakelijk omdat het brein in die fase nog
kan compenseren (toegenomen activiteit in het brein) en de witte stof banen deels intact zijn (minder schade gemeten
met DTI).
De Nederlandse Hersenbank heeft in de afgelopen jaren hersenweefsel van meer dan 180 mensen met MS verzameld.
Dit weefsel wordt gebruikt voor wetenschappelijk onderzoek. Voordat het weefsel aan een onderzoeker kan worden
gegeven, is het belangrijk dat alle informatie over dit weefsel bekend is. In het project dat wordt beschreven in pragraaf
9.6 wordt al het weefel van mensen met MS onder de microscoop bekeken. Daarna wordt vastgelegd hoe de ontsteking
in de hersenen eruit ziet . Tegelijkertijd wordt ook gekeken of verschillende typen van MS ook onder de microscoop
herkend kunnen worden.
Onderzoeker
Hanneke Hulst, MSc (promovendus)
Wetenschappelijk onderzoek is nodig om het ontstaan en beloop van MS bij kinderen in de toekomst beter te kunnen
voorspellen. Hiervoor is het noodzakelijk om alle kinderen met MS systematisch in kaart te brengen en hun gegevens
op te slaan in een centrale databank. Daarnaast wordt bij veel onderzoeken naar de oorzaak van MS gebruik gemaakt
van lichaamsmateriaal. Dit lichaamsmateriaal moet opgeslagen worden in een centrale Biobank. Door zowel het
materiaal als de gegevens van kinderen met MS op een centrale plaats op te slaan, kunnen de gegevens van deze
kinderen eenvoudig samengebracht worden met laboratoriumbevindingen. In het onderzoek in paragraaf 9.7 wordt
een onderzoek naar MS bij kinderen omschreven waarvoor dit bewaarde materiaal van groot belang is.
Instituut
VU medisch centrum, Amsterdam
9.2 Cognitieve
(08-648 MS)
achteruitgang bij
MS
Begeleiders
Prof. dr. Jeroen Geurts (neurobioloog)
Prof. dr. Frederik Barkhof (neuroradioloog)
Looptijd van het onderzoek
oktober 2009 – oktober 2013
Subsidie
€ 239.026
patiënten: de hippocampus en thalamus in beeld
Doel van het onderzoek
Het beter begrijpen van cognitieve problemen die ontstaan bij multiple sclerosis (MS) door gebruik te maken van
moderne imaging technieken.
Achtergrond van het onderzoek
Problemen met cognitie (geheugen, aandacht en concentratie) komen voor bij 50-60% van de mensen met MS. In de
huidige studie willen we dit probleem onderzoeken door ons te richten op specifieke hersengebieden: de hippocampus
en de thalamus. Van deze structuren is bekend dat ze een grote rol spelen bij geheugen- en aandachtsfuncties en daarnaast weten we vanuit pathologisch onderzoek dat de hippocampus vaak is aangedaan bij mensen met MS. De functie
van de hippocampus en de thalamus wordt getest terwijl men in de MRI scanner ligt en een geheugen- of aandachtstaak uitvoert. Daarnaast wordt de diffusie van watermoleculen gemeten (DTI) wat een maat is voor hoe gezond de zenuwbanen zijn. Met deze specifieke benadering, hopen we gedetailleerdere informatie te vergaren over het functioneren
van de hersenen, waardoor we uiteindelijk het ontstaan van deze cognitieve klachten wél (beter) kunnen begrijpen.
72
Onderzoek naar de oorzaak van klinische symptomen en ziekteverloop
9.3 Functieverlies
in
MS
begrijpen
(08-650 MS)
Doel van het onderzoek
Functioneel verlies in vroege MS beter begrijpen door het gebruik van in-vivo imaging maten van functionele
connectiviteit en structurele schade
Achtergrond van het onderzoek
Toen dit onderzoek begon was er weinig bekend over de oorzaak van veelvoorkomend functioneel verlies bij mensen met
MS, zoals cognitieve stoornissen. Er is namelijk een klinisch-radiologische paradox bij MS zichtbaar: mensen met heel
veel laesies kunnen het nog steeds vrij goed doen op cognitieve testen, en andersom. Het leek dan ook erg belangrijk
om niet alleen te kijken naar de laesies in de hersenen, maar ook naar bijvoorbeeld atrofie en hersenfunctie. In dit onderzoek proberen wij functioneel verlies beter te begrijpen door geavanceerde imaging te gebruiken, met MRI maar ook
magnetoencefalografie (MEG). Dit onderzoek heeft een groot cohort van ~200 mensen met MS onderzocht, nu allemaal
rond zes jaar na diagnose. Zij kregen een uitgebreid pakket aan klinische metingen, om cognitieve en neurologische
stoornissen goed in kaart te brengen. Deze stoornissen probeerden wij te relateren aan maten van neurodegeneratie,
zoals atrofie, en ook maten van hersenfunctie, zoals functionele connectiviteit.
73
Hoofdstuk 9
Onderzoek naar de oorzaak van klinische symptomen en ziekteverloop
Bereikte resultaten
• Atrofie van de diepe grijze stof structuren zoals de thalamus is sterk gerelateerd aan cognitieve stoornissen in
vroege MS; dit effect is in deze fase van de ziekte sterker dan corticale atrofie.
• Hersenfunctie en functionele netwerken zijn ook sterk verstoord in vroege MS; dit is met zowel functionele MRI
als MEG in kaart te brengen en wederom in de thalamus maar ook in de hippocampus sterk gerelateerd aan
functioneel verlies.
• Er is een sterk geslachtseffect zichtbaar in vroege MS: mannen die zes jaar MS hebben vertonen sterkere atrofie en
ergere cognitieve stoornissen, evenals sterkere veranderingen in functionele connectiviteit.
Achtergrond van het onderzoek
Met MRI meetbare grijze stof atrofie in MS correleert met klinische en neuropsychologische achteruitgang. Om het
dichter bij de kliniek te brengen moet deze maat eerst gevalideerd worden. Hoewel het meetbaar is met MRI, weten we
nog niet of grijze stof atrofie echte veranderingen in het weefsel weerspiegelt. We hebben samen met de Nederlandse
Hersenbank een project opgezet om het pathologisch substraat van de MRI-zichtbare grijze stof atrofie te onderzoeken.
De reproduceerbaarheid en klinische relevantie worden onderzocht in-vivo in een uniforme patiëntengroep (6 jaar na diagnose). Met verschillende softwaremethoden wordt gekeken of alle mensen met MS dezelfde atrofiepatronen vertonen.
Eerdere onderzoeken laten hier nog veel onduidelijkheid over bestaan. De klinische relevantie wordt
onderzocht in dezelfde patiëntengroep, met uitgebreide cognitieve testen. We kijken of cognitieve achteruitgang per
domein, correleert met atrofie in bepaalde hersengebieden, en hoe constant deze verbanden zijn.
Waarom is juist dit onderzoek belangrijk voor MS?
Dit onderzoek heeft het functioneel verlies van mensen met MS in kaart gebracht in een groot homogeen inceptiecohort, zes jaar na diagnose. Het is vrij zeldzaam om zo’n cohort te mogen onderzoeken en dit heeft dan ook
waardevolle informatie opgeleverd over het ontstaan en het achterliggend mechanisme van bijvoorbeeld cognitieve
stoornissen. Zo weten wij nu bijvoorbeeld dat de thalamus en hippocampus een unieke positie hebben in dit
ziektebeeld, en dan met name bij mannen met MS. Zowel functioneel als structureel was bijvoorbeeld de thalamus
afwijkend bij mensen met MS met cognitieve afwijkingen. Wij hebben ook aangetoond dat de benadering van het brein
als netwerk erg waardevol is in het verklaren van klinische stoornissen in MS. Nu wij een beeld hebben van functioneel
verlies in vroege MS, kunnen wij onze bevindingen vergelijken met andere cohorten met een langere ziekteduur.
Hopelijk kunnen wij dit patiëntencohort ook blijven volgen. Wellicht kunnen wij daarna een voorspelling doen welke
mensen een slechtere prognose hebben en/of welke mensen een verhoogd risico hebben op het ontwikkelen van een
secundair progressief fenotype, wat geassocieerd is met sterker functioneel verlies en versnelde neurodegeneratie.
Onderzoeker
Dr. Menno M. Schoonheim (promovendus, neurowetenschapper)
Onderzoeker
Mw. Veronica Popescu, arts-onderzoeker
Instituut
Afdeling Radiologie en Nucleaire Geneeskunde, VU Medisch Centrum
Looptijd van het onderzoek
september 2011 - september 2014
Instituut
VU medisch centrum, Amsterdam
Subsidie
€ 248.037
Looptijd van het onderzoek
oktober 2009 – oktober 2013
9.5 Differentiatie van Multiple Sclerose
studie op 7 Tesla MRI (11-769 MS)
Subsidie
€ 280.341
atrofie van de grijze stof bij
MS
Doel van het onderzoek
De MRI-metingen van grijze stof atrofie te valideren, door het pathologisch substraat, de reproduceerbaarheid en de
klinische relevantie te onderzoeken.
74
Waarom is juist dit onderzoek belangrijk voor MS?
Grijze stof atrofie is een voorloper in de zoektocht naar een betere klinisch relevante progressiemaat in MS. Voordat het
klinisch kan worden toegepast, moet het grondig onderzocht worden en gevalideerd.
Begeleiders
Dr. ir. Hugo Vrenken, universitair docent
Begeleiders
Dr. Hugo Vrenken (fysicus)
Prof. dr. Frederik Barkhof (neuroradioloog),
Prof. dr. Jeroen Geurts (neurowetenschapper)
9.4 Kan neurodegeneratie in vivo gemeten worden?
Een onderzoek naar de relevantie van op MRI gemeten
(10-718 MS)
Bereikte resultaten
• Er is anatomische variatie in de grijze stof atrofie.
• Grijze stof atrofie is het sterkst gerelateerd aan verlies van axonen.
• De keuze van softwaremethode kan grote invloed hebben op de gemeten atrofie.
en
Cerebrovasculaire
wittestofschade: een pilot-
Doel van het onderzoek
Onderzoeken hoe we de diagnose multiple sclerose (MS) specifieker kunnen stellen, door een methode te ontwikkelen
om mensen met MS te onderscheiden van mensen met vaatafwijkingen in het brein (cerebral small vessel disease,
CSVD). We gebruiken hiervoor 7-Tesla (T) MRI scans.
Achtergrond van het onderzoek
De diagnose MS wordt gesteld op MRI aan de hand van ontstekingsplekjes (laesies) in de witte stof van het brein.
Helaas komen deze laesies ook voor bij mensen met vaatafwijkingen en bij mensen met risicofactoren voor vaatafwijkingen (hoge bloeddruk, roken). Dit is problematisch in de klinische setting, ook omdat de symptomen van deze
patiënten erg op elkaar kunnen lijken. Kleine vaatlaesies komen tevens in de gezonde populatie voor, bij toenemen van
de leeftijd.
75
Onderzoek naar de oorzaak van klinische symptomen en ziekteverloop
Hoofdstuk 9
7T MRI-scanners maken gebruik van een hoger magnetisch veld (standaard is 1.5T), hierdoor kunnen structuren en
afwijkingen in het brein in meer detail worden weergeven. In eerdere studies heeft dit geleid tot hogere detectie van
MS-laesies in witte en grijze stof van het brein. Op 7T scans is gebleken dat een MS-laesie vaak om een bloedvat heen
gelegen is. Verder zijn er MS-laesies gevonden met een donkere ring eromheen op 7T. In onze pilotstudie willen we
deze 7T fenomenen vergelijken tussen mensen met MS en mensen met CSVD. Door een betere differentiatie is er
minder onzekerheid en kunnen snellere diagnose en start van behandeling mogelijk zijn.
Bereikte resultaten
• We vergeleken 16 mensen met MS met 16 mensen met CSVD. We ontwikkelden een afbeeldserie genaamd
FLAIR*, waarin zowel laesies als bloedvaten zichtbaar zijn. Dit deden we door 2 afzonderlijke scans over elkaar
te projecteren; dit is een nieuwe methode op 7T.
• We ontdekten dat 74% van de MS-laesies om een bloedvat lag, terwijl dit gold voor slechts 47% van de vaatlaesies.
• 2.3% van de MS-laesies had een ring, tegenover geen van de vaatlaesies. Verder was 5.5% van de MS laesies
soms donker op zogenaamde 7T T2*- beelden. Dit kwam niet voor bij vaatlaesies. Ook de locatie van laesies was
verschillend tussen beide ziekten.
Aan de hand van deze bevindingen kunnen we stellen dat we met de nieuwe FLAIR* methode op 7T, een beter
onderscheid kunnen maken tussen MS en CSVD.
Waarom is juist dit onderzoek belangrijk voor MS?
Door een betere differentiatie tussen de verschillende aandoeningen is er minder onzekerheid en kunnen snellere
diagnose en start van behandeling mogelijk zijn.
Onderzoeker
Drs. Iris Denise Kilsdonk (promovendus)
Begeleiders
Prof. dr. Frederik Barkhof (neuroradioloog)
Dr. Mike Peter Wattjes (neuroradioloog)
Instituut
VUmc MS Centrum Amsterdam; VU Medisch Centrum, afd. Radiologie
Looptijd van het onderzoek
mei 2012 – mei 2013
Subsidie
€ 50.000
9.6 Karakterisatie
van
MS-laesies
van de
Nederlandse Hersenbank (09-666 MS)
Doel van het onderzoek
Uitgebreide karakterisering van meer dan 4000 MS-laesies van 180 mensen met MS van de Nederlandse Hersenbank
(NHB) teneinde verschillende typen MS te kunnen herkennen en deze stukjes MS-hersenweefsel gericht uit te kunnen
geven aan de beste MS-ondezoeksprojecten wereldwijd.
Achtergrond van het onderzoek
De NHB heeft een succesvol hersendonorprogramma voor MS. Hierdoor heeft de NHB in de afgelopen 25 jaar
weefsel van bijna 180 MS-obducties kunnen uitnemen en is een omvangrijke collectie MS-hersenweefsel opgebouwd
voor MS-onderzoek (zie ook elders in dit katern). Een deel van deze weefselblokjes is basaal getypeerd om de diagnose
van de donor te kunnen stellen en deels al uitgegeven voor onderzoek wereldwijd. Echter, een belangrijk deel van het
weefsel kan effectiever worden uitgegeven wanneer precieze informatie over demyeliniserende- en ontstekingsactiviteit, axonale schade, aanwezigheid van grijze stof laesies en beginnende activiteit e.d kan worden vastgesteld.
Een onderzoeker die een medicijn tegen afbraak van myeline zoekt heeft demyeliniserende ontstekingen nodig, terwijl
een onderzoeker die herstel van myeline onderzoekt, juist remyeliniserende laesies nodig heeft. Typering van de
weefselblokjes zal deze unieke collectie materiaal dus meer effectief ontsluiten en MS-onderzoek wereldwijd vooruit
helpen. Het ziektebeloop van MS verschilt veel van patiënt tot patiënt en waarschijnlijk zijn er verschillende typen
MS die waarschijnlijk te herleiden zijn tot verschillen in typen MS-laesies. Denk aan ontstekings- en demyeliniserende
activiteit, locatie in de grijze stof, mate van remyelinisatie e.d. Dus terwijl de collectie wordt geanalyseerd kan al
worden gezocht naar verschillende typen MS.
Bereikte resultaten
Demyeliniserende-, remyeliniserende- en ontstekingsactiviteit van alle laesies in de witte stof is volledig in kaart
gebracht en laesies in de grijze stof in zijn geidentificeerd en beschreven Er zijn foto’s gemaakt van de zeer dunne
plakjes die van de blokjes zijn gesneden en gekleurd voor myeline en macrofagen die myeline opnemen (voorbeeld in
figuur 1). De foto’s met laesie karakterisatie zijn in de NHB database opgenomen. Zodoende kunnen MS-onderzoekers
die bijvoorbeeld actieve MS-ontstekingen of grijze stof laesies nodig hebben, zelf op de foto’s kijken welke blokje het
meest geschikt is voor hun onderzoek. Vaak zitten ook meerdere typen MS-ontstekingen in één blokje. We hebben de
complete karakterisatie van alle 180 MS-hersendonoren volledig af en verwerkt. Van deze karakterisatie is al aan vele
MS onderzoeksgroepen wereldwijd weefsel op maat uitgegeven. Het DNA en de cerebrospinale vloeistof van het
merendeel van de donoren is ook al geanalyseerd en ook zijn alle klinische rapportages van de patienten geanalyseerd
op ziektebeloop. Momenteel worden nu alle genetische, neuropathologische en klinische gegevens geanalyseerd om
te onderzoeken of specifieke afwijkingen in de hersenen bij MS samengaan met een bepaald ziektebeloop en een
specifieke genetische achtergrond. Eerste resultaten laten zien dat er duidelijke verschillende pathologische typen
MS zijn te zien in de hersenen. Dat betekent dat er o.a. een groep mensen met MS met veel grijze stof laesies en veel
actieve witte stof laesies zijn, maar weinig remyelinisatie (herstel) hebben, een groep zonder grijze stof laesies, weinig
activieve laesies in de witte stof en veel remyelinisatie en een groep mensen met MS met veel actieve laesies in het
ruggenmerg en weinig laesies in de hersenen. Ook zijn er aanzienlijke verschillen tussen mannen en vrouwen met MS
gevonden.
Onderzoekers
Sabina Luchetti (post doc)
Valeria Ramaglia (post doc)
Karianne Schuurman (analist)
Joost Smolders (post doc)
Begeleider
Dr. Inge Huitinga (post doc, groepsleider neuroimmulogie onderzoeksgroep en directeur van de Nederlandse
Hersenbank)
76
77
Hoofdstuk 9
Onderzoek naar de oorzaak van klinische symptomen en ziekteverloop
Instituut
Nederlands Instituut voor Neurowetenschappen
Looptijd van het onderzoek
april 2012 – april 2016
Looptijd van het onderzoek
mei 2010 - mei 2013
Subsidie
€ 285.621 (subsidie VriendenLoterij)
Subsidie
€ 365.000 (subsidie VriendenLoterij)
9.7 Nationaal Kinder MS Centrum (12-807 MS)
Doel van het onderzoek
Studie naar prognostische factoren die na een 1ste aanval van centraal zenuwstelsel demyelinisatie bij kinderen een
beloop in de richting van multiple sclerose voorspellen.
Achtergrond van het onderzoek
In Nederland doen we in samenwerking met de kinderartsen en -neurologen een landelijk onderzoek naar MS en
verwante aandoeningen op de kinderleeftijd. Daarvoor verzamelen we gegevens van alle kinderen in Nederland die een
1ste aanval van ontsteking in het centrale zenuwstelsel hebben doorgemaakt. Een deel van deze kinderen (~20-30%)
krijgt uiteindelijk MS, terwijl het voor andere kinderen bij 1 aanval blijft. Ons onderzoek is vooral gericht op factoren
die het beloop na zo’n eerste aanval voorspellen, zoals bepaalde MRI-kenmerken, erfelijke factoren en uitslagen van
bloed- en hersenvocht onderzoek. Ook zijn we op zoek naar nieuwe stoffen in het bloed en/of hersenvocht (biomarkers)
die we zouden kunnen gebruiken om het ziektebeloop te voorspellen, of die we zouden kunnen gebruiken als maat voor
de ziekteactiviteit. Belangrijke doelstelling van ons onderzoek is het ontwikkelen van een model waarmee we het
ziektebeloop na een 1ste aanval bij kinderen kunnen voorspellen. Zodat we voor elk kind een individuele en meer
nauwkeurige voorspelling kunnen geven over het ziektebeloop.
Bereikte resultaten
• Het aantal kinderen dat na ADEM de diagnose MS krijgt is lager dan in het verleden werd aangenomen.
• Erfelijke factoren, bekend vanuit internationaal genetisch onderzoek bij volwassenen, zijn ook geassocieerd met MS
op de kinderleeftijd, maar niet met 1 aanval op de kinderleeftijd.
• Diagnose MS op de kinderleeftijd kan met nieuwe diagnostische criteria internationale werkgroep veilig en snel
worden gesteld.
Waarom is juist dit onderzoek belangrijk voor MS?
Het is belangrijk, omdat het onderzoek naar centraal zenuwstelsel demyelinisatie bij kinderen en jongeren kan leiden
tot nieuwe gezichtspunten in de pathogenese van MS. Het betreft hier een unieke en jonge populatie die in het algemeen nog aan relatief weinig verschillende omgevingsfactoren zijn blootgesteld.
Onderzoekers
Dr. I.A. Ketelslegers (AIOS neurologie)
drs. E.D. van Pelt (arts-onderzoeker)
Begeleiders
Prof. dr. R.Q. Hintzen (neuroloog)
Dr. R.F. Neuteboom (kinderneuroloog)
Dr. C.E. Catsman-Berrevoets (kinderneuroloog)
Instituut
Erasmus MC, Rotterdam
78
79
Functies binnen de wetenschap
Functies binnen de wetenschap
FUNCTIES BINNEN DE WETENSCHAP
Hematoloog: een arts die gespecialiseerd is in het bestuderen van bloed.
Onderzoekers
Immunoloog: een arts die gespecialiseerd is in het immuunsysteem, het afweersysteem van het lichaam.
AIO: (= assistent in opleiding), een meestal pas afgestudeerde bioloog, biochemicus of arts die promotieonderzoek
uitvoert. Dit promotieonderzoek duurt in de regel 4 jaar en wordt door de AIO afgesloten met het schrijven van een
proefschrift. De AIO verdedigt dit proefschrift tijdens de promotie, waarna hij of zij de doctorstitel zal krijgen.
Internist: een arts die gespecialiseerd is in geneeskunde van de inwendige organen.
OIO: (= onderzoeker in opleiding), zie AIO
Medisch fysioloog: een arts die gespecialiseerd is in het functioneren van het lichaam in geval van ziekte.
Wetenschappelijk onderzoeker: een afgestudeerde bioloog, biochemicus of arts die onderzoek uitvoert waarbij het
onderzoek niet direct bedoeld is om te leiden tot promotie van de onderzoeker.
Moleculair bioloog: een wetenschapper die gespecialiseerd is in het bestuderen van DNA (erfelijk materiaal).
Arts-onderzoeker: een (pas afgestudeerde) arts die onderzoek uitvoert dat meestal moet leiden tot promotie van de
onderzoeker.
AGIKO: (= assistent geneeskundige in opleiding tot klinisch onderzoeker), een (pas afgestudeerde) arts die promotieonderzoek combineert met een opleiding tot specialist.
Klinisch epidemioloog: een arts die gespecialiseerd is in de verspreiding van ziekten onder de bevolking.
MR-fysicus: een natuurkundige die gespecialiseerd is in MRI.
Neurofysioloog: een arts die gespecialiseerd is in het functioneren van het zenuwstelsel.
Neuro-immunoloog: een immunoloog die gespecialiseerd is in zenuwcellen.
Neuroloog: een arts die gespecialiseerd is in zenuwen (neuron = zenuw).
Analist: een persoon die is afgestudeerd aan de Hogere of Middelbare Laboratorium School en die onderzoek uitvoert.
Dit onderzoek wordt grotendeels zelfstandig uitgevoerd door de analist en staat onder leiding van een AIO, artsonderzoeker of postdoc.
Neuropatholoog: een arts die gespecialiseerd is in de bestudering van onder de microscoop zichtbare afwijkingen van
zenuwcellen en zenuwweefsel die het gevolg zijn van een ziekte.
Bursaal: een onderzoeker die niet in loondienst is, maar van een studietoelage (beurs) leeft.
Neurowetenschapper: een wetenschapper die gespecialiseerd is in het bestuderen van het zenuwstelsel.
Postdoc: een onderzoeker die tijdens een eerdere onderzoeksperiode gepromoveerd is en dus de doctorstitel bezit. Een
postdoc voert zelfstandig onderzoek uit en schrijft meestal zelf zijn onderzoeksprojecten. De meeste postdocs doen
onderzoek op projectbasis.
Patholoog: een arts die gespecialiseerd is in kennis over onder de microscoop zichtbare afwijkingen in weefsel die het
gevolg zijn van een ziekte.
Senior wetenschapper: een ervaren postdoc die meestal ook betrokken is bij het begeleiden en uitbreiden van een
onderzoeksgroep.
Psycholoog: iemand die gespecialiseerd is in (het functioneren van) de menselijke geest.
Radioloog: een arts die gespecialiseerd is in het maken van plaatjes van organen binnenin het lichaam met behulp van
technieken als MRI, röntgenfoto’s etc.
Begeleiders
Biochemicus: een wetenschapper die gespecialiseerd is in het bestuderen van eiwitten.
Bioloog: een wetenschapper die gespecialiseerd is in het bestuderen van levende wezens.
Celbioloog: een bioloog die gespecialiseerd is in het bestuderen van cellen.
Fysicus: een natuurkundige.
Fysioloog: een arts of wetenschapper die gespecialiseerd is in het functioneren van het lichaam.
Genealoog: een stamboomdeskundige.
Geneticus: een arts of wetenschapper die gespecialiseerd is in het bestuderen van erfelijke eigenschappen.
Genetisch epidemioloog: een arts die gespecialiseerd is in de verspreiding van erfelijke factoren die de gevoeligheid
voor een ziekte verhogen onder de bevolking.
80
81
Woordenlijst
Woordenlijst
WOORDENLIJST
Dendritische cellen: witte bloedcellen die met name zeer goed antigeen kunnen presenteren.
Acuut: plotseling en direct optredend, kortdurend.
Diffuus: zich over een groot gebied uitstrekkend.
Allel: een vorm van een gen. Bijvoorbeeld: mensen met blauwe, groene en bruine ogen hebben allen de genen die
verantwoordelijk zijn voor oogkleur. Zij hebben echter andere allelen van deze genen, die zorgen voor de verschillende
kleuren.
DNA: (desoxyribonucleic acid = desoxyribonucleïnezuur), het materiaal waarin de erfelijke informatie is vastgelegd.
Antigeen: een stof die een reactie van het afweersysteem oproept. Een antigeen is normaal een stof die niet in het
lichaam thuishoort. De reactie van het afweersysteem is bedoeld om het antigeen onschadelijk te maken. Voorbeelden
van antigenen zijn virussen en bacteriën.
Antigeen-presenterende cellen: cellen van het afweersysteem die een antigeen kunnen ‘presenteren’ of ‘aanbieden’
aan andere cellen van het afweersysteem. Hierdoor wordt het afweersysteem geactiveerd, waardoor het antigeen wordt
opgeruimd.
Anti-inflammatoir: ontstekingsremmend.
Antilichaam: een eiwit dat door het afweersysteem wordt gemaakt als reactie op een antigeen. Een antilichaam bindt
aan het antigeen waartegen het is opgewekt en zorgt er op deze manier voor dat dit antigeen onschadelijk wordt
gemaakt of wordt verwijderd.
Exacerbatie: een terugval in of opflakkering van MS, een periode met klachten. Wordt ook wel schub genoemd.
Extracellulaire matrix: (= buiten de cel gelegen geordend geheel), de tussen de cellen gelegen eiwitten en andere
stoffen.
Focaal: zich tot een klein gebied beperkend en scherp begrensd.
Gadolinium: stof die kan worden gebruikt als contrastvloeistof bij een MRI-scan. Dient bij MS als marker voor lekkage
van de bloed-hersenbarrière. Een gadoliniumsignaal op een MRI-beeld betekent dus dat het gadolinium via een lek in
de bloed-hersenbarrière het centrale zenuwstelsel moet zijn binnengekomen. Dit gebeurt op plekken waar nieuwe
ontstekingen en dus laesies ontstaan.
Gen: de drager van erfelijke informatie.
Astrocyt: (letterlijk: stervormige cel), een bepaald type hersencel. Bij beschadigingen aan zenuwcellen vullen astrocyten
de ontstane ruimte op en vormen hierbij een litteken.
Genetica: (=erfelijkheidsleer), de tak van de wetenschap die de erfelijkheid en erfelijke eigenschappen bestudeert.
Auto-immuniteit: een ongewenste reactie van het afweersysteem waarbij het afweersysteem het eigen lichaam aanvalt.
Glia cellen: de niet-zenuwcellen in het centrale zenuwstelsel: astrocyten, microglia en oligodendrocyten.
Autoreactief: cellen van het immuunsysteem zijn autoreactief als ze het lichaam van de persoon zelf aanvallen.
Grijze stof: de gebieden in de hersenen die met zenuwcellen gevuld zijn. Deze gebieden zien er grijs uit als je de
hersenen doorsnijdt en bekijkt.
B-cel: een bepaald soort witte bloedcel. B-cellen zijn van het immuunsysteem die als taak hebben om antilichamen te
maken. Deze antilichamen kunnen binden aan een antigeen om deze onschadelijk te maken.
Biomarker: een stof in het bloed of hersenvloeistof die informatie kan geven over de aanwezigheid, de vorm, de
activiteit of het verloop van de ziekte.
Bloed-hersenbarrière: de laag van cellen en eiwitten tussen het bloed en het centrale zenuwstelsel die ervoor zorgen
dat cellen en de meeste eiwitten niet vanuit het bloed in de hersenen en het ruggenmerg kunnen komen. De bloedhersenbarrière beschermt onder normale omstandigheden het centrale zenuwstelsel tegen schadelijke stoffen en
cellen in het bloed.
Centraal zenuwstelsel: de zenuwen in de hersenen en het ruggenmerg.
Chronisch: langdurig, aanhoudend.
Cognitief: geheugen, concentratie en leren.
Cytokine: een stof die een rol speelt in het afweersysteem. Een cytokine is een stof die geproduceerd wordt door
afweercellen. Cytokines kunnen afweercellen en hiermee dus ook ontstekingen activeren of juist remmen.
Demyelinisatie: (letterlijk: ontmyelinisering), het verdwijnen van myeline om een zenuw.
82
EDSS: (=expanded disability status scale), een schaal die gebruikt wordt om aan te geven hoe groot iemands
bewegingsbeperkingen zijn.
Histologie: (=weefselleer), de bestudering van weefsels, met name met behulp van speciale kleurreacties en de
microscoop.
(Immuno)histochemie: een techniek waarbij wordt onderzocht of en in welke mate een stof in weefsel aanwezig is door
deze stof een speciale kleur te geven.
Immunologie: (= de leer van het immuunsysteem), de tak van wetenschap die het afweersysteem van het lichaam
bestudeert.
Immunologisch: van het immuunsysteem.
Immuunglobuline: een antilichaam.
Immuunreactie: de afweerreactie van het lichaam.
Immuunsysteem: het afweersysteem van het lichaam dat beschermt tegen infectie met bacteriën, virussen of
schimmels.
Klinisch: met betrekking tot onderzoek en behandeling van patiënten.
Knock-out: een model waarin een bepaald gen uitgeschakeld of verwijderd is.
83
Woordenlijst
Kwantitatieve MRI: een vorm van MRI waarbij niet het maken van afbeeldingen, maar het verrichten van metingen de
belangrijkste rol speelt. Kwantitatieve MRI maakt het mogelijk om verschillende MRI’s beter met elkaar te vergelijken
en om kleinere verschillen waar te nemen.
Laesie: een aangedaan gebied. In MS betekent dit een gebied waarin de myeline is verminderd of verdwenen en waar
vaak een litteken is ontstaan.
Liquor: hersenvloeistof, de vloeistof die zich in de hersenen en het ruggenmerg bevindt en die de hier aanwezige cellen
van voedingsstoffen voorziet en afvalproducten afvoert.
Woordenlijst
Pro-inflammatoir: ontstekingsbevorderend, ontstekingsactiverend.
Receptor: (letterlijk: ontvanger), een eiwit dat als een soort antenne dienst doet op een cel. Een receptor kan signalen
(stoffen) van buiten de cel opvangen en doorsturen naar binnen. Elke receptor kan meestal maar één stof herkennen en
vangen. Voorbeeld: een receptor voor een groeifactor zal deze groeifactor vangen als die buiten de cel aanwezig is en
naar binnen in de cel het signaal doorgeven dat de cel moet groeien of nieuwe cellen moet gaan vormen.
Relapsing-remitting MS (RRMS): een vorm van MS waarbij perioden met klachten worden afgewisseld door perioden
van geheel of gedeeltelijk herstel. De meeste mensen met MS hebben aanvankelijk relapsing-remitting MS. Deze vorm
kan op den duur overgaan in secundair progressieve MS.
Lymfocyt: een B- of een T-cel, witte bloedcel.
Remissie: een periode van afname van klachten en mogelijk herstel bij relapsing-remitting MS.
Macrofaag: (letterlijk: grote eter), een cel van het afweersysteem die tot taak heeft om dode cellen of aan antilichaam
gebonden antigenen te verwijderen door deze ‘op te eten’.
Remyelinisatie: (letterlijk: hermyelinisering), het -gedeeltelijk- terugvormen van een myelineschede om een zenuw
waarvan de myelineschede eerder verdwenen of aangetast is.
Marker: een stof waarmee een bepaald proces in het lichaam gevolgd of aangetoond kan worden.
Microglia: (letterlijk: kleine glia), een bepaald type hersencel. De microglia maken deel uit van het afweersysteem van
de hersenen en zijn als het ware de macrofagen van de hersenen.
RNA: (ribo nucleic acid = ribonucleïnezuur), een op erfelijk materiaal (DNA) lijkende stof. Als een gen actief wordt,
worden van het DNA in het gen RNA-kopieën gemaakt. Met behulp van deze RNA-kopieën wordt vervolgens het eiwit
gemaakt.
MicroRNA: een kort stukje genetisch materiaal (RNA) dat andere genen activeert of juist remt.
Schub: een terugval in of opflakkering van MS, een periode met klachten. Wordt ook wel exacerbatie genoemd.
Monocyt: een bepaald type witte bloedcel. Monocyten zijn de voorlopercellen van macrofagen.
Secundair progressieve MS: een vorm van MS die op kan treden na relapsing-remitting MS. MS die aanvankelijk een
aanvalsgewijs karakter had, kan na verloop van tijd overgaan in secundair progressieve MS. Bij secundair progressieve
MS treedt er verslechtering op zonder tussentijds herstel.
Myelinisatie: de vorming van een myelineschede om een zenuwvezel.
MRI: (magnetic resonance imaging) een techniek waarmee met behulp van metingen met magneetvelden ‘in weefsel
gekeken kan worden’. Met behulp van MRI kunnen plaatjes van het centrale zenuwstelsel gemaakt worden die laten
zien of en op welke plaatsen schade is ontstaan en of er ontstekingen zijn.
Obductie: het onderzoeken van organen na iemands overlijden.
Oligodendrocyt: (letterlijk: cel met enkele uitlopers of vertakkingen), cellen die myeline vormen om de zenuwen in
het centrale zenuwstelsel. De cellen maken myeline en sturen dit naar hun uitlopers. Deze uitlopers wikkelen zich
vervolgens om de zenuwen en vormen zo de myelineschede.
Serum: de vloeistof uit het bloed. Bloed waaruit de cellen zijn verwijderd.
T-cel: een bepaald soort witte bloedcel. T-cellen zijn cellen van het afweersysteem die heel specifiek kleine stukjes van
indringers zoals virussen en bacteriën herkennen. Deze herkenning leidt ofwel tot het doden van geïnfecteerde cellen
ofwel tot het stimuleren van een afweerreactie.
Tolerantie: het verschijnsel dat het afweersysteem ongevoelig is (geworden) voor een bepaald antigeen waarop het
normaal gesproken wel reageert.
Transmigratie: het passeren van de bloed-hersenbarrière door witte bloedcellen.
Pathologie: (letterlijk: ziekteleer), bestudeert het ontstaan en verloop van een ziekte.
Virologie: (=virusleer), de tak van wetenschap die virussen bestudeert.
Peptide: een stukje van een eiwit.
Perivasculair: rondom de bloedvaten gelegen (peri = rondom, vasculair = de bloedvaten betreffend).
Witte stof: de gebieden van het centrale zenuwstelsel waarin de gemyeliniseerde delen van de zenuwen gelokaliseerd
zijn.
Pilot: een vooronderzoek. Een onderzoek van beperkte omvang (maximaal 1 jaar) om te bekijken of verder onderzoek
aan het onderwerp zinvol en technisch mogelijk is.
Polymorfisme: een variatie in een gen die bij een groot deel van de bevolking voor komt.
Post mortem: na overlijden.
Primair progressieve MS (PPMS): een vorm van MS waarin vanaf het begin van de ziekte verslechtering optreedt.
Ongeveer 15% van de MS-patiënten heeft deze vorm van MS.
84
85
Colofon
Grafische vormgeving: Mw. K. Zuidwijk
Illustraties: Robert van den Berg
Fotografie: VUmc MS Centrum Amsterdam
Drukwerk: Regalis B.V. Zeist
Redactie: Mw. K. Zuidwijk
Eindredactie: Mw. D. Roos
86
www.fsc.org
MIX
papier van
verantwoorde
herkomst
FSC® C009308
Stichting MS Research
Leidseweg 557-1
Postbus 200, 2250 AE Voorschoten
T 071 5 600 500
ING: NL17INBG0000006989
ABN AMRO: NL24ABNA0707070376
[email protected]
www.msresearch.nl