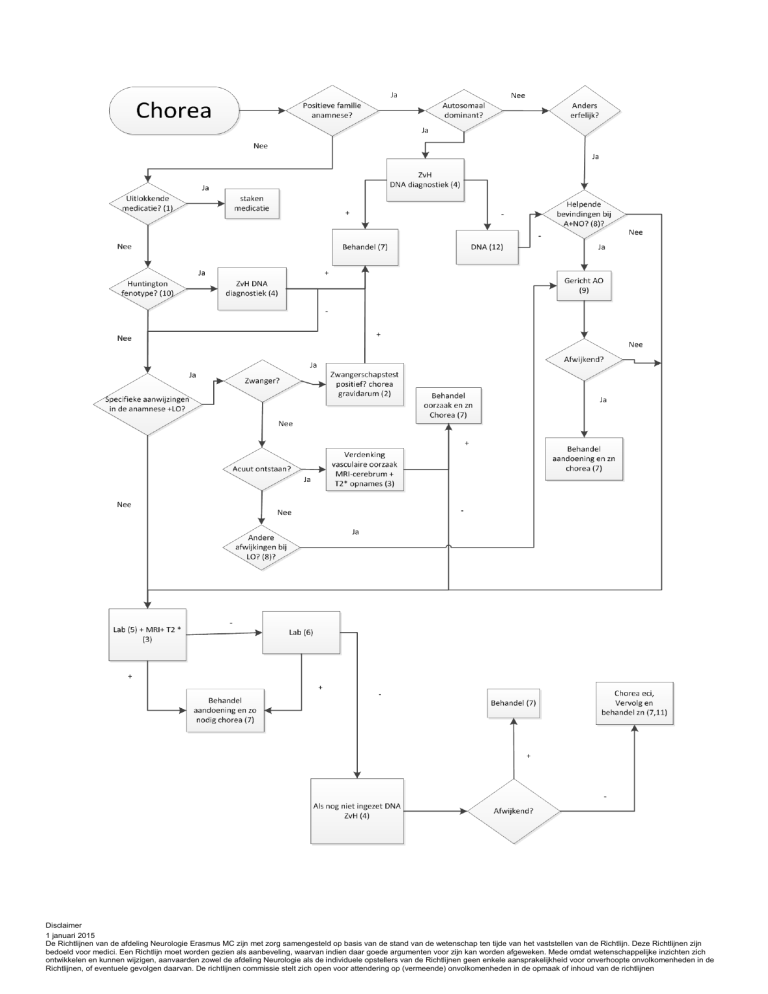
Disclaimer
1 januari 2015
De Richtlijnen van de afdeling Neurologie Erasmus MC zijn met zorg samengesteld op basis van de stand van de wetenschap ten tijde van het vaststellen van de Richtlijn. Deze Richtlijnen zijn
bedoeld voor medici. Een Richtlijn moet worden gezien als aanbeveling, waarvan indien daar goede argumenten voor zijn kan worden afgeweken. Mede omdat wetenschappelijke inzichten zich
ontwikkelen en kunnen wijzigen, aanvaarden zowel de afdeling Neurologie als de individuele opstellers van de Richtlijnen geen enkele aansprakelijkheid voor onverhoopte onvolkomenheden in de
Richtlijnen, of eventuele gevolgen daarvan. De richtlijnen commissie stelt zich open voor attendering op (vermeende) onvolkomenheden in de opmaak of inhoud van de richtlijnen
Bijlage stroomdiagram Chorea
1) Medicatie die chorea kan geven
Antipsychotica
fenothiazines, butyrofenonen, benzamiden
Antiparkinson
levodopa, dopamine agonisten, anticholinergica, amantadine
medicatie
CZS stimulantia
amfetaminen, cocaïne (crack dance), metylfenidaat, caffeine
Anti-epileptica
fenytoïne, carbamazepine, valproïnezuur, gabapentine, lamotrigine
Calciumantagonisten
cinnarizine, flunarizine, verapamil
Hormoon preparaten
Steroïden, orale anticonceptiva
H1 en H2 receptor
antihistaminica, cimetidine, ranitidine
antagonisten
Overige middelen
opiaten, lithium, metoclopramide, methyldopa, benzodiazepine, Baclofen,
digoxine, tricyclische antidepressiva, isoniazide, methadon, theofylline
2) Chorea gravidarum komt vaak voor in het eerste trimester van de zwangerschap en is self
limiting. Wel kan er een onderliggend ziekte beeld zijn, zoals bijvoorbeeld hierboven beschreven,
wat de klachten kan uitlokken. Behandeling, als nodig, is het beste nadat de foetale organen
aangelegd zijn en dient dus terughoudend te zijn.
3) Mogelijke afwijkingen op MRI-cerebrum: (vergeet niet T2 stir opnames aan te vragen voor de
ijzerstapeling!)
Vasculaire afwijkingen: bloeding, infarct, vaatmalformatie
Ruimte innemende afwijkingen: lymfoom, metastase, toxoplasmosehaard
Metabole afwijkingen: veelal in de basale kernen
Atrofie cerebellum
IJzerstapeling, ‘eye of the tiger sign’
Diffuse atrofie, focale afwijkingen in basale
kernen, hypointens op T1 en hyperintens op
T2
Atrofie van de kop van de nucleus caudatus
SCA 1,2,3,17 DRPLA, Friedreichse ataxie
NBIA genen oa PANK, FTL1
Ziekte van Wilson
Kan passen bij de Ziekte van Huntington
4) DNA HD, HTT gen in Leiden. Voor begeleiding van patiënt en familie zie het algemene deel van de
richtlijn.
5) Laboratorium onderzoek: Bloedbeeld, BSE, CRP, HT, leverfunctie, nierfunctie, glucose,
elektrolyten Na, K, Ca, Mg, fosfaat, schildklierfunctie. Als aanwijzingen voor een auto-imuun
aandoening in de anamnese: Antigliadine antilichamen, Lupus anticoagulans, Antifosfolipiden
antilichamen, Anti- SSA, Anti- SSB, ANA
6) Laboratorium onderzoek: HIV, toxoplasmose, mantoux, ACE, neurotrope virussen, lues, lyme,
acantocyten* (verse bloedfilm), Anti-Hu, Anti CRMP5/CV2, Anti-Yo, Anti- NMDA.
Patiënten jonger dan 40 jaar: ceruloplasmine, koper, koperexcretie in 24-uurs urine.
Lumbaalpunctie bij klachten minder dan 6 maanden: neurotrope virussen, 14-3-3 eiwit
*In ons lab geschaard onder echinocyten
7)
Oorzaak
Medicatie
Auto-imuun aandoening als oorzaak
Post-stroke chorea
Ziekte van Huntington (level B bewijs)
Behandeling
Staken medicatie
Deze behandelen
Neuroleptica zoals haloperidol
1e keus tetrabenazine tot max 100mg/dag
2e keus Riluzol 200mg/dag (100mg/dag heeft minder
goed effect op de lange termijn
3e keus Amantadine 300-400mg/dag
Er is geen bewijs dat clozapine zou helpen bij chorea
bij de ziekte van Huntington.
Overige chorea
8)
1e keus tetrabenazine (off label)
2e Antipsychotica zoals haloperidol, olanzapine,
risperidon, quetiapine en aripirazole
tiapride
Zelden wordt deep brain stimulation toegepast
waarbij globus pallidus doelstructuur is.
Autosomaal dominant overervingspatroon
Autosomaal recessief overerving
Begin kinderleeftijd,
geen progressie, geen
andere verschijnselen
Mogelijk bij
Afrikaanse afkomst
Benigne hereditaire
chorea
Polyneuropathie
SCA 1,2,3
Myoclone epilepsie
Dentatorubrale
pallidolysiane atrofie
Orolinguale dystonie,
polyneuropathie,
areflexie, atrofie
Cerebellaire ataxie,
polyneuropathie
kinderleeftijd
Polyneuropathie,
epilepsie,
cardiomyopathie,
psychiatrie
Kayser Fleischer ring,
ataxie, tremor,
dysartrie
Encefalopathie,
myopathie, OBM strn,
ataxie, doofheid eci
Meerdere
bewegingsstoornissen
Mentale retardatie,
epilepsie PED
Chorea, dystonie,
tremor, myoclonus,
rigiditeit, psychiatrie
Neuroferritinopathie,
Cerebellaire ataxie op
de voorgrond
Huntington’s disease
like type 2
SCA 17, 1,2,3 DRPLA
Choreaacanthocystose
Friedreichse ataxie
McLeod syndroom (xlinked)
Ziekte van Wilson
Mitochondrieel, dit
kan soms ook
autosomaal dominant
of maternaal
overerven
GLUT1 deficiëntie
C9ORF72
9) DNA onderzoek op onderliggend ziekte beeld (zie ook nummer 12), tevens ook mogelijk aanvullend
laboratorium onderzoek:
Acantocyten (Chorea-acanthocytose), Kell en KX antigeen expressie op erytrocyten (McLeod syndroom),
ceruloplasmine en 24 uurs urine op koper (ziekte van Wilson), lactaat en pyruvaat (mitochondriële
aandoeningen), alfa-foetoproteine, IgA, IgE en IgG (ataxia-telangiectasia) leverfuncties en CK, lipiden.
NBIA- panel inzetten (neuroferritinopathie)
10) Langzaam progressieve chorea beiderzijds. Tot 25% van de Huntington patiënten hebben een
negatieve of onduidelijke familie anamnese. 5-10% van de de novo patiënten met dragerschap van een
intermediaire CAG repeat bij de vader.
11) Bij een klinisch beeld gelijk aan de ziekte van Huntington maar waarbij deze diagnose is uitgesloten
door middel van genetisch onderzoek kan er maar in een paar procent van de gevallen een andere
diagnose bevestigd worden. Verder beloop kan nieuwe aanknopingspunten geven.
12) SCA1,2,3,17, HL-1, HDL-2, C9ORF72
Richtlijn chorea bij volwassenen
Meriam Braaksma, Agnita Boon en Anneke Maat, juni 2014
Definitie: Chorea komt van het griekse Choros, wat een "traditionele dans” betekent. Het is een
hyperkinetische bewegingsstoornis welke gekarakteriseerd wordt door continue ongewilde, kortdurende,
niet ritmische, vloeiende bewegingen die over het hele lichaam verspreid kunnen voorkomen.
Het verschil met dystonie is dat ze niet repetitief zijn, er verschillende spiergroepen bij betrokken zijn en
in een niet voorspelbare manier voorkomen. Een dystonie is trager, levert een afwijkende stand op en is
draaiend en wringend van aard. Het onderscheidt zich van een myoclonus doordat de bewegingen in
elkaar overlopen en vloeiend zijn. Een myoclonus is schokkerig en niet ritmisch.
Anamnese:
Ontstaanswijze:
- Acuut: Als er een acuut begin is met hemichorea dan is een vasculaire oorzaak het meest
waarschijnlijk.
-
-
Subacuut: Als de chorea binnen dagen of weken ontstaat dan kan er een metabole oorzaak aan ten
grondslag liggen, zoals een diabetische nonketonische hyperglykemie of hyperthyreoidie. Deze
kunnen zich soms ook acuut presenteren. Een subacute presentatie over weken of maanden kan,
wanneer het asymmetrisch is, passen bij tumorgroei, of als het symmetrisch is bijvoorbeeld bij
Creutzelfd Jakob of bij paraneoplastische beelden. Deze paraneoplastische beelden komen voor bij
een renaalcelcarcinoom, kleincellig longcarcinoom, mammacarcinoom, Hodgkin en non-Hodgkin
lymfomen. Daarnaast kunnen verschillende soorten medicijnen een subacuut verloop van chorea
geven.
Langzaam progressief: Hierbij moet je denken aan neurodegeneratieve oorzaken, waarvan de ziekte
van Huntington de meest bekende is. In de meeste gevallen is er dan ook sprake van cognitieve en
psychiatrische symptomen.
Niet progressieve chorea: Meest voorkomende is de benigne hereditaire chorea. Dit presenteert zich
vaak op kinderleeftijd, met een belaste familie anamnese. Tevens kan medicatie een non- progressieve
chorea geven.
Episodische chorea: Episodische fluctuerende chorea kan een uiting zijn van verstoringen van het
calcium door bijvoorbeeld hyperparathyreoïdie.
Tevens kan een behandelbare oorzaak van episodische chorea nog veroorzaakt kan worden door het
glucose transporter 1-deficientie syndroom, passend bij paroxysmale exercise induced dystonie
(PED).
Medische voorgeschiedenis
Vraag bij patiënten met chorea altijd naar de voorgeschiedenis dan wel klachten van systemische ziekten.
onderstaande tabel geeft verschillende oorzaken voor chorea weer met daarbij aanvullend
bloedonderzoek.
Oorzaak
Myeloprofileratieve
aandoeningen
Auto-immuun
Endocrien
Lab aanvraag
Verhoogd hematocriet
Ziektebeeld
Polycythemia rubra vera
Anti-SSA, Anti-SSB
Sjögren
Anti-gliadine antilichamen
Lupus anticoagulans
Antifosfolipiden antilichamen
Schildklierfuncties
Parathyroidhormoon, calcium
Zwangerschapstest
Coeliakie
SLE
Antifosfolipidensyndroom
Multiple Sclerose
Hyper/hypothyreoidie
Hyper/Hypoparathyreoidie
Chorea gravidarum*
Infectieus
Prion ziekte
Metabool
HIV
IgM antilichamen voor WNV
PCR op parvovirus
HSV PCR, ACE, mantoux
Parvovirus
Meningo-encephalitis (Herpes
simplex, TBC, sarcoïdose)
14-3-3 in liquor
Ceruloplasmine, 24uurs urine op
koper, Kreatinine fosfokinase
Echinocyten
Creutzfeld Jakob
Elektrolyten
Hypo/hypernatriemie
Hypo/hypermagnesiemie
Hypocalciemie
Kleincellig longcarcinoom,
Mammacarcinoom
Hodgkin en non hodgkin lymfoom.
niercelca,
Anti-NMDA encefalitis
Glucose
Paraneoplastisch
HIV (maar ook, toxoplasmose, PML)
West- Nile
Anti-Hu, Anti-CRMP5/CV2
Anti-Yo
Wilson’s disease
Neuroacanthocytose
Hypo/hyperglycemie
Anti-NMDA
VGKC, IGI1
Toxisch
CO-intoxicatie, methanol, cyanide, kwik, thallium
Vasculair
Hersenbloeding of infarct in basale ganglia, of bloeding in structurele afw
*Chorea gravidarum komt het vaakst voor in het eerste trimester van de zwangerschap en is self limiting.
Wel kan er een onderliggend ziekte beeld zijn, zoals bijvoorbeeld hierboven beschreven, wat de klachten
kan uitlokken. Behandeling, als nodig, is het beste nadat de foetale organen aangelegd zijn en dient dus
terughoudend te zijn.
Medicatie gebruik
In onderstaande tabel staat medicatie die chorea kan geven. Belangrijk te onthouden is, dat elk medicijn
wat dopamine vrijmaakt, chorea als een effect kan geven, dus ook drugs.
Antipsychotica
Antiparkinson medicatie
CZS stimulantia
Anti-epileptica
Calciumantagonisten
Hormoon preparaten
H1 en H2 receptor
antagonisten
Overige middelen
fenothiazines, butyrofenonen, benzamiden
levodopa, dopamine agonisten, anticholinergica, amantadine
amfetaminen, cocaïne (crack dance), metylfenidaat, caffeine
fenytoïne, carbamazepine, valproïnezuur, gabapentine, lamotrigine
cinnarizine, flunarizine, verapamil
Steroïden, orale anticonceptiva
antihistaminica, cimetidine, ranitidine
opiaten, lithium, metoclopramide, methyldopa, benzodiazepine, Baclofen,
digoxine, tricyclische antidepressiva, isoniazide, methadon, theofylline
Psychiatrische voorgeschiedenis
Veel neurodegeneratieve ziektebeelden met chorea gaan gepaard met psychiatrische afwijkingen. Vraag
dan ook naar depressie en angst.
Familie anamnese:
Ook al is de familie anamnese negatief, dan nog steeds kan er sprake zijn van de ziekte van Huntington.
Een familielid is bijvoorbeeld eerder overleden dan dat de ziekte tot uiting kwam, de ziekte is vroeger niet
juist gediagnosticeerd, is de novo of er is non-paterniteit.
Bij overerving kan er sprake zijn van autosomaal dominante of niet autosomaal dominant. Hieronder zijn
de verschillende oorzaken voor chorea naar overerving beschreven.
Erfelijk autosomaal dominant
De ziekte van Huntington:
Ziekte begint rond de 40 jaar, met een prevalentie van 4-10 per 100.000 in West Europa.
Er is een gen defect op chromosoom 4p16.3. waarbij er een geëxpandeerde trinucleotide herhaling (CAG)
optreedt. Normaliter is dit tussen de 10-26 herhalingen en bij Huntington is dit verlengd vanaf 36 of meer.
Hoe langer de repeatlengte is des te eerder de ziekte zich uit.
Motorische verschijnselen: chorea, hyperreflexie, oculomotorische afwijkingen waarbij er square wave
jerks zijn. Dit is een vertraagde initiatie van de oogbeweging en vertraging van de saccades. Later
gedurende het ziekte beloop ontstaan er balansstoornissen en extrapiramidale verschijnselen, zoals
parkinsonisme, bradykinesie en dystonie. Tevens kunnen dysartrie en dysfagie voorkomen.
Cognitieve verschijnselen: executieve functies zijn gestoord waarbij er planningsproblemen zijn, impulsief
gedrag, disorganisatie en moeite met multitasken. Patiënten verliezen vaak initiatief, worden apathisch
en verzorgen zichzelf minder.
Psychiatrische verschijnselen: depressie en angststoornis, tevens obsessieve en compulsieve gedragingen
en agressiviteit. Kans op zelfmoord is 4x zo hoog als in normale populatie.
DNA diagnostiek: HTT gen in Leiden
Huntington’s disease like type 1
Lijkt op de ziekte van Huntington, waarbij op de voorgrond de psychiatrische verschijnselen staan. Zeer
zeldzame erfelijke prion ziekte.
DNA diagnostiek: PRNP gen in Amsterdam
Huntington’s disease like type 2
Komt voor bij families uit Afrika. Lijkt erg op Huntington echter dystonie en parkinsonisme komt meer
voor.
DNA diagnostiek: JPH3 gen in Leiden
Spinocerebellaire ataxie (SCA type 1,2,3, en 17)
Hierbij zijn er voornamelijk cerebellaire verschijnselen, maar ook parkinsonisme, dystonie, chorea
kunnen optreden. SCA 17 geeft ook cognitieve stoornissen. Er is hierbij geen relatie tussen de lengte van
de repeat en de kliniek.
DNA diagnostiek:
Utrecht: SCA 17 (TBP gen)
Rotterdam, Utrecht en Groningen: SCA 1 (ATXN1 gen) SCA 2 (ATXN2 gen) SCA 3
(MJD1/ATXN3 gen) of ataxiepanel (49 genen waaronder alle genoemde) aanvragen in
Rotterdam
Dentatorubrale pallidolysiane atrofie (DRPLA)
Hierbij kunnen chorea en myoclonieën voorkomen samen met ataxie en dementie. Komt meer voor in
Japanse families. Echter zijn er nu ook case reports over westerse families.
DNA diagnostiek: Rotterdam
Neuroferritinopathie
Mutatie in verschillende genen waaronder in de lichte keten van ferritine (FTL1). Hierbij ook op MRI-c
ijzer stapeling, beste te zien op T2 gradiënt echo. Begin leeftijd is 40-55 jaar met verschillende
bewegingsstoornissen, chorea, dystonie en parkinsonisme en soms ook cognitief verval.
Er kan nu bij de klinisch genetica in Rotterdam een NBIA gen panel van 10 genen ingezet worden voor deze
groep aandoeningen
Geassocieerd met ALS en FTD
Chorea kan ook gezien worden bij patiënten met een mutatie van TDP-43, die ook wordt geassocieerd met
familiare ALS. Ook kunnen patiënten met de gedragsvariant van FTD chorea ontwikkelen.
DNA diagnostiek oa: TARDBP gen en SOD1 gen, (FTD-ALS gen pakket Utrecht)
C9ORF72
Hexanucleotide(C4G2) repeatexpansie in C9ORF72 die de belangrijkste oorzaak is van ALS en FTD.
Mutaties in dit gen blijken ook voor te komen bij patienten met een Huntington-like fenotype waarbij HTT
DNA onderzoek negatief is. Uitingen zijn bewegingsstoornissen in de vorm van chorea, dystonie, tremor,
rigiditeit en bradykinesie. Psychiatrische verschijnselen en gedragsstoornissen staan op de voorgrond.
DNA diagnostiek: C9ORF72 gen in Rotterdam, A’dam (VU), Utrecht
GLUT1 deficiëntie
Hierbij is er een mutatie in het gen SLC2A1,glucose transporter 1, waarbij glucose transport door de BBB
is verminderd. Hierdoor is er minder glucose in het brein aanwezig. Dit kan zich uiten in mentale
retardatie en epilepsie op kinderleeftijd en paroxysmale exercise induced dystonie en chorea in latere
jaren. Een ketogeen dieet kan dan helpen.
DNA diagnostiek SLC2A1 gen in Nijmegen, Utrecht en VU Amsterdam
Benigne hereditaire chorea
Ontstaat in kinderleeftijd, waarbij er geen cognitieve of psychiatrische symptomen zijn. Er kan soms wel
milde ataxie aanwezig zijn. Geen of weinig progressie van het ziekte beeld. Kan soms reageren op
levodopa. Er zijn problemen in het thyroid transcriptie factor 1, waardoor er ook
multisysteemproblematiek kan optreden zoals hypothyreoïdie, hypotonie en longproblemen.
DNA diagnostiek TITF1 gen in Amsterdam
Autosomaal recessief
Ziekte van Wilson
Presenteert zich vaak met dysartrie, dystonie, tremor en ataxie. Bij 15% van de patiënten komt ook
chorea voor. Bij lichamelijk onderzoek is er een Kayser Fleischer ring, tevens kan de MRI-cerebrum
hyperdensiteiten laten zien in de basale kernen. Verder onderzoek hiernaar staat in de tabel hierboven.
Cu en ceruloplasmineDNA diagnostiek ATP7B gen in Utrecht
Friedreichse ataxie
Begint vaak op kinderleeftijd en presenteert zich met progressieve cerebellaire ataxie, polyneuropathie,
cardiale afwijkingen en diabetes mellitus.
DNA diagnostiek: FXN gen in Rotterdam en Nijmegen(zit ook in Rotterdamse ataxie genpanel)
Ander autosomale recessieve ataxie
Ataxia-telangiectasia (-like) en ataxie met oculomotorische apraxie type 1 en 2 ,3 (AOA 1 en 2,3)
presenteren zich met ataxie met ontstaan op de kinderleeftijd.
Ataxia- telangiectasia geeft een verhoogd risico op maligniteiten ,waarbij het Alfa-foetoproteïne, albumine
en cholesterol afwijkend kunnen zijn.
DNA diagnostiek ATM gen in Amsterdam - NKI (MRE11A, APTX, SETX, PIK3R5 zit ook in Rotterdamse
ataxiepanel)
Chorea-acanthocystose
Begint op jongvolwassenleeftijd met chorea, dystonie en tics. Tevens ook psychiatrische stoornissen.
Perifere neuropathie, areflexie en spieratrofie zijn zeer kenmerkend voor dit beeld. Tevens is er bij 40%
van de patiënten epilepsie.
Karakteristiek is ook de orofaciale dystonie met tongprotusie en bijten op tong en lippen. Oorzaak is een
mutatie in VPS13A. Dit kan bevestigd worden door aanwezigheid van acanthocyten (hier: echinocyten) in
een vers bloeduitstrijkje.
Neurodegeneratieve afwijkingen door ijzerstapeling in het brein
Dit kan o.a. gevonden worden bij panthothenaat-kinase geassocieerde neurodegeneratie, eerder ook wel
Hallevorden-Spatz syndroom genoemd, komt door een mutatie in het PANK2 gen. Hierbij staan
voornamelijk dystonie en parkinsonisme op de voorgrond.
MRI laat ‘ Eye of the tiger’ beeld zien.
DNA diagnostiek: NBIA genpanel (10 genen) in Rotterdam, ANK2 gen in Groningen
Acerulplasminemie
Tevens zijn er ook neurodegeneratieve afwijkingen bij aceruloplasminemie. Dit komt door mutaties in het
gen voor ceruloplasmine. Kenmerken komen pas rondom 40e levensjaar. Ataxie, orofaciale dyskinesieen,
parkinsonisme en chorea kunnen optreden. Daarvoor kan er sprake zijn van retina degeneratie en
diabetes mellitus. DNA diagnostiek CP gen Rotterdam
X-linked chorea
McLeod syndroom
Presenteert zich hetzelfde als neuroacanthocytose maar hierbij doen er nog andere orgaansystemen mee,
zoals het hart (cardiomyopathie) en de lever (hepatoslpenomegalie). Patiënten presenteren zich vaak
eerst met psychiatrische ziekte of gedragsveranderingen en daarna ontwikkelen ze de neurologische
verschijnselen. Beeldvorming laat atrofie zien van de nucleus caudatus en putamen. Dit wordt
veroorzaakt door een mutatie op het XK gen waardoor er een verminderde expressie is van Kell en Kx
antigenen op erythrocyten.
Mitochondrieel
Ook dit kan chorea geven, echter vele verschillende vormen waarbij er ook sprake is van andere veelal
wisselende neurologische verschijnselen.
Behandeling
Behandeling van chorea is veelal symptomatisch, waarbij het van belang is dat de chorea niet interfereert
met de dagelijkse activiteiten of hinderlijk is voor de patiënt. Gezien de variëteit aan presenterende
symptomen, zoals ook psychiatrische beelden kan het zinvol zijn om patiënten multidisciplinair te
behandelen en begeleiden.
Oorzaak
Medicatie
Auto-imuun aandoening als oorzaak
Post-stroke chorea
Ziekte van Huntington (level B bewijs)
Overige chorea
Behandeling
Staken medicatie
Deze behandelen
Neuroleptica zoals haloperidol
1e keus tetrabenazine tot max 100mg/dag
2e keus riluzole 200mg/dag (100mg/dag heeft
minder goed effect op de lange termijn
3e keus amantadine 300-400mg/dag
Er is geen bewijs dat clozapine zou werken bij chorea
bij de ziekte van Huntington
1e keus tetrabenazine (off label)
2e keus antipsychotica zoals haloperidol, olanzapine,
risperidon, quetiapine aripirazole en triapride (300600mg/dag)
Zelden wordt deep brain stimulation toegepast
waarbij de globus pallidus als doelorgaan gebruikt
wordt. (bewijsklasse 3)
Ketogeen dieet bij glut1 def
In tegenstelling tot neuroleptica blokkeert tetrabenazine de vesiculaire monoamine-transporter type 2
(VMAT2) welke nodig is voor het transport van dopamine van het cytoplasma naar de synaptische
vesikels. Dit leidt tot een verminderde dopamine afgifte in de synaps.
Genetisch onderzoek bij erfelijke chorea
Diagnostisch onderzoek kan via neurologen worden verricht. Voorspellend onderzoek bij gezonde
familieleden en familieonderzoek verloopt via de klinische genetica. Voordat diagnostiek wordt ingezet is
goede voorlichting van de patiënt bij (mogelijk) erfelijke vormen van chorea van belang. Het is van belang
om te bespreken welke onderzoeken worden ingezet en dat de uitslag van dit onderzoek kan leiden tot
bevestiging van een diagnose maar ook consequenties kan hebben voor verwanten van de patiënt. De
hoogte van dit risico en welke verwanten at risk zijn is afhankelijk van het overervingspatroon van de
aandoening. De patiënt zou zijn familie over het onderzoek kunnen inlichten, zodat familieleden kunnen
anticiperen op een positieve uitslag en kunnen aangeven of zij daarover geïnformeerd willen worden.
Tevens kan er bij twijfel altijd laag drempelig overlegd worden met de klinisch genetica.
Literatuur
- Wild EJ, Tabrizi SJ The differential diagnosis of chorea. Pract neuro 2007;7;360-373
- Walker RH Differential diagnosis of chorea; curr neurol neuroschi rep 2011 11;385-395
- Walker RH Chorea, Continuum review article, oct 2013, AAN
- Amstrong M, Miyasaki Evidence based guidline: Pharmalogical treatment of chorea in Huntington
disease; Neurology 2012; 79; 597-603
- Shannon Oral presentation Chorea; Movement disorders
- www.lareb.nl
- van Vugt, Hoff, Vandenberghe; Sporadische chorea: een praktische aanpak; Tijdschr Neurol
Neurochir 2011;112:152-60
- Cardoso F, Seppi K, MAir KH; Seminar on choreas; Lancet Neurol 2006;5;589-602
- Jankovic J; Treatment of hyperkinetic movement disorders; Lancet Neurol 2009; 844-56
-
-
Hensmans Moss, Poulter; C9ORF72gen expansions are the most common genetic cause of
Huntington disease phenocopies; Neurlogy 2014;82:292-299
Miyasaki, Aldakheel, Movement disorders in pregnancy, Continuum 2014;20(1):148-161












