O
OH
A
O
O
1
O
OH
B
3
OH
2
O
HO
OH
O
O
OH
C
OH
H
N
D
O
HO
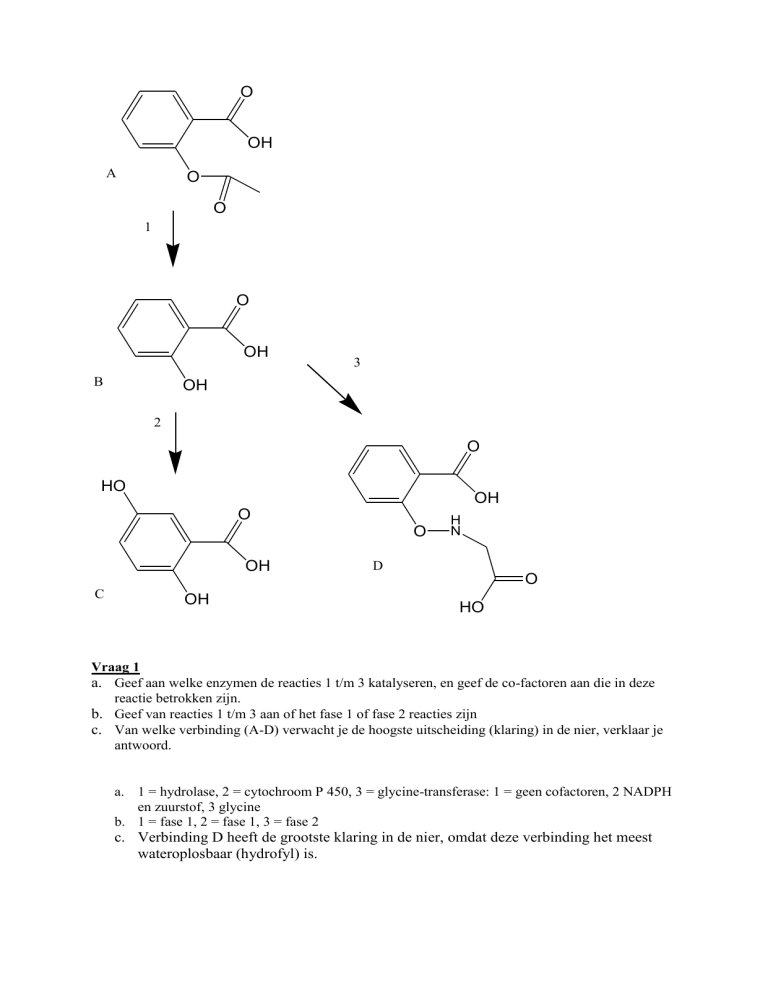
Vraag 1
a. Geef aan welke enzymen de reacties 1 t/m 3 katalyseren, en geef de co-factoren aan die in deze
reactie betrokken zijn.
b. Geef van reacties 1 t/m 3 aan of het fase 1 of fase 2 reacties zijn
c. Van welke verbinding (A-D) verwacht je de hoogste uitscheiding (klaring) in de nier, verklaar je
antwoord.
a. 1 = hydrolase, 2 = cytochroom P 450, 3 = glycine-transferase: 1 = geen cofactoren, 2 NADPH
en zuurstof, 3 glycine
b. 1 = fase 1, 2 = fase 1, 3 = fase 2
c. Verbinding D heeft de grootste klaring in de nier, omdat deze verbinding het meest
wateroplosbaar (hydrofyl) is.
Vraag 2
Proteolytische (amide-band splitsende)enzymen kunnen geremd worden door stoffen die werken
volgens het principe van het nabootsen van de overgangs-toestand (transition-state analogues). Leg dit
zo gedetailleerd mogelijk uit, met de nadruk op het nabootsingsprincipe; licht het antwoord toe
m.b.t.structuren.
Het mechanisme van de niet enzymatisch gekatalyseerde hydrolyse van de amide band moet
eerst worden beschouwd.
Vervolgens moet worden aangegeven m.b.v. een energiediagram hoe de activeringsenergie
die nodig is voor deze hydrolyse verlaagd wordt door de katalytische triade in een
proteolytisch enzym: nucleofiel (serine), een proton-donor (A ?) en een proton acceptor
(histidine). Bovendien moet worden uitgelegd dat de overgangstoestand waarbij het amide
carbonyl C-atoom van SP-2 naar SP-3 hybridisatie gaat, goed in de active-site van het enzym
past. Stoffen die de overgang van SP-2 naar SP-3 hybridisatie kunnen ondergaan door een
nucleofiele aanval, maar die niet het verbreken van een covalente band ondergaan (zoals de
C-N band in een amide
hydrolyse) zijn remmers van deze proteolytische enzymen.
Een voorbeeld is een stof met de functionele groepen -C(O)-C(O)NH-R (a-keto
amides) of de a -keto fluorverbindingen (-C(O)-CF2H).
Vraag 3
Geef een schematisch overzicht van de (verwachte) drie-dimensionale struktuur van een prototypische
“G-eiwit gekoppelde receptor” (zoals de 2-adrenerge receptor) waarin weergegeven wordt:
- ligging in de celmembraan,
- bindingsplaats voor agonisten
- bindingsplaats voor antagonisten
- delen betrokken bij de desensitisatie
- delen betrokken bij de functionele koppeling aan GTP-bindende regulator eiwitten.
Antwoord:
-
*, aminozuren die betrokken zijn bij ligand binding (agonisten en competitief
antagonisten)
$, aminozuren betrokken bij de functionele koppeling met GTP-bindende regulator
eiwitten
#, aminozuren betrokken bij “desensitisatie”
terug
Toelichting bij het antwoord:
G-eiwit gekoppelde of 7-transmembraan domein receptoren (7TM-receptoren) zijn eiwitten; ze
bestaan uit een lange keten van aminozuren (meestal >400 AZ).
Uit studies met antilichamen blijkt dat de N-terminus en de C-terminus, respectivelijk, extracellulair
en intracellulair (in het cytoplasma) gelegen zijn.
In de keten van aminozuren komen 7 zones voor met een relatief hoge densiteit van hydrofobe
aminozuren; deze zouden elk als een (anti-clockwise) -helix doorheen de celmembraan gelegen zijn
(i.e. de 7 “transmembraan” domeinen). De tussenliggende zones, met voornamelijk hydrofiele
aminozuren, bevinden zich in de extracellulaire ruimte of in het cytoplasma.
Voor het grootste deel van de nu bekende effecten en eigenschappen van 7TM-receptoren, lijkt er geen
associatie tussen de receptoren onderling plaats te vinden. 7TM-receptoren werken voornamelijk als
monomeren. [Op deze “regel” bestaan er echter uitzonderingen, bv. heterodimeren tussen
angiotensine- en bradykinine-receptoren].
In het geval van 2-adrenerge receptoren blijkt uit experimenten met chimerische receptoren en uit
experimenten met mutante receptoren (punt-mutaties) dat slechts een klein aantal aminozuren (3, drie)
bepalend zijn voor de ligand-bindings affiniteit voor agonisten. Deze “kritische” aminozuren zijn
redelijk ver uit elkaar gelegen op de keten waaruit de 7TM-receptor bestaat. Door de verwachte 3Dconfiguratie van de 7TM-receptor worden deze AZ echter in mekaars nabijheid gebracht zodat er een
bindingsplaats ontstaat waarin een (tijdelijke) associatie tussen receptor en agonist kan optreden.
[gelijkaardige resultaten werden er ook voor andere types 7TM-receptoren bekomen]. De
bindingsplaats wordt gevormd door aminozuren die in of nabij verschillende TM-domeinen gelegen
zijn ter hoogte van het extracellulaire oppervlak van de celmembraan.
De situatie met betrekking tot de binding van competitieve antagonisten en inverse agonisten (inclusief
affiniteiten) is grotendeels identiek aan die voor agonisten, al kunnen hiervoor vaak een kleiner aantal
“kritische” aminozuren volstaan.
De delen van de 7TM-receptor molecule die betrokken zijn bij desensitisatie en bij functionele
koppeling aan G-eiwitten, verschillen wezenlijk van de “ligand-bindingsplaats”. Dit blijkt uit analoge
experimenten met chimerische receptoren en mutante receptoren. Desensitisatie door fosforylering en
binding van arrestin, gebeurt ter hoogte van de C-terminale cytoplasmatische staart van de 7TMreceptor molecule. Bij de binding van de geactiveerde receptor aan het GTP-bindend regulator eiwit
zijn zowel de C-terminale staart als de cytoplasmatische “loop” tussen TM-5 en TM-6 betrokken.
De verwachte veranderingen in 7TM-receptor configuratie die zich voordoen tengevolge van de
interactie van een agonist met de bindingsplaats en die mogelijk maken dat intracellulaire delen van de
receptormolecule binden met het G-eiwit (dat uiteindelijk de activiteit van het 2nd-messenger systeem
zal beinvloeden), werden nog niet opgehelderd.
Vraag 4
Bij verschillende fysiologische processen spelen reactieve zuurstofvormen (waaronder
zuurstofradicalen) een cruciale rol. Om schade van deze reactieve zuurstofvormen te voorkomen is ons
lichaam uitgerust met een uitgebreid beschermingssysteem.
a. Kunt u aangeven welke fysiologische processen afhangen van de betrokkenheid van reactieve
zuurstofvormen?
b. Kunt u beschrijven hoe de enzymatische en niet-enzymatische bescherming is tegen de schadelijke
werking van reactieve zuurstofvormen?
c. Welke schade aan biologische moleculen door reactieve zuurstofvormen kunt u noemen?
a.
Cu-SOD katalyseert de omzetting van 2 superoxide anion radicalen en waterstofionen tot
waterstofperoxide en zuurstof. In de normale situatie wordt vervolgens het
waterstofperoxide weggevangen door catalase en het glutathionperoxidase. Indien de
aanmaak van deze enzymen uit evenwicht is en er teveel Cu-SOD is, ontstaat er een
overmaat aan waterstofperoxide dat vervolgens niet adequaat genoeg wordt
weggevangen. Waterstofperoxide met gereduceerd ijzer geeft het reactieve
hydroxylradicaal dat radicaalschade geeft.
b. GSH is instaat om het ascorbyl radicaal (of het dehydroascorbaat) te reduceren tot
gereduceerd vitamine C. In de lever wordt ook via GSH het vitamine E radicaal
gereduceerd.
Er zijn verschillende beschermende GSH afhankelijke enzymen, zoals het
GSHperoxidase (dat peroxides reduceert tot de respectievelijke alcoholen) en GSHtransferases dat reactieve metabolieten conjugeert met GSH (Ook aldehyden die ontstaan
tijdens de lipidperoxidatie worden via GSHtransferases onschadelijk gemaakt).
c. Vitamine E (met name het alfa-tocoferol) remt het lipidperoxidatie proces doordat het
reageert met lipidperoxylradicalen. Hierdoor reageert een lipidperoxylradicaal niet met
een naburig in de membraan gelegen polyonverzadigd vetzuur. Dit zou (zonder vitamine
E) leiden tot een ketting reactie van lipidperoxidatie.
Vraag 5
Er is een nieuw medicijn ontwikkeld voor de bestrijding van hoge bloeddruk. Op basis van proeven
aan geïsoleerde arteriën (contractiekracht metingen in een orgaanbad) heeft men eenduidig vastgesteld
dat het nieuwe medicijn arteriën relaxeert via een niet-adrenerg mechanisme. In de volgende fase van
het onderzoek wordt het nieuwe medicijn toegediend aan wakkere proefdieren. Bij deze proefdieren
wordt hartfrequentie (HR), slagvolume (SV), sympathische zenuwactiviteit (SNA) en arteriële
bloeddruk (MAP) gemeten. Hartminuutvolume (CO) en perifere vaatweerstand (TPR) wordt berekend.
Er worden twee experimenten uitgevoerd.
Resultaten experiment 1) Uit de metingen blijkt dat 5 minuten na een eenmalige intraveneuze injectie
de bloeddruk niet is veranderd. Twee uur na injectie is de bloeddruk meer dan 20 mmHg gedaald ten
opzichte van het uitgangsnivo.
Resultaten experiment 2). Dezelfde proef als in experiment 1 wordt uitgevoerd. Nu is echter 30
minuten van te voren een beta1-adrenerge antagonist aan de proefdieren toegediend (in werkzame
dosering). Nu blijkt na de bloeddruk wel direct te dalen na i.v. toediening van het nieuwe medicijn.
Welke farmacodynamische verklaringen (geen farmacokinetische) kun je bedenken voor de
bevindingen van experiment 1 en 2. Geef in je verklaring in detail aan welke veranderingen je in de
bovengenoemde hemodynamische parameters verwacht en hoe deze tot stand komen.
Experiment 1:
a) acuut geen bloeddruk daling door een hemodynamische (baroreflex-geinduceerde)
tegenregeling. Als volgt: verwachte TPR daling MAP daling baroreflex toename
SNA toename HR, SV en CO en mogelijk verminderde daling TPR. (MAP=CO*TPR; en
CO=SV*HR)
b) acuut: het dier wordt gestresst door de interventie: SNA stijgt waardoor via CO en TPR
stijging de TPR daling ongedaan wordt gemaakt. Later: geen stress meer.
c) na twee uur resetting van het setpoint van de baroreflex. Verminderde tegenregeling van
SNA (terugkeer naar normaal), verminderde compensatie CO. Wel daling TPR dus
MAP daling.
d) Centraal effect van het farmacon dat de bloeddruk tegenregelt (zelfde mechanismen)
e) De proeven zijn niet uitgevoerd bij weerstandsarterien. Er is geen target in de
weerstandsarterien.
Experiment 2
f) In de aanwezigheid van een beta1-blokker is er door blokkade van de SNA effecten op
het hart geen baroreflex-gemedieerde stijging van CO, daardoor kan de daling van de
TPR niet worden gecompenseerd en daalt de MAP direct.
Vraag 6
Verschillen in genexpressie tussen bijvoorbeeld gezonde en zieke individuen kunnen op mRNA
niveau ondermeer worden beoordeeld met behulp van cDNA microarrays.
a. Leg uit waarom je met behulp van deze techniek normaliter geen SNP’s (single nucleotide
polymorfisms) kunt vinden.
b. Wanneer je vermoed dat een van de DNA sequenties die zijn gebruikt op een microarray niet
specifiek is voor een enkel gen hoe zou je dat dan kunnen controleren?
a. Detectie op een microarray maakt gebruik van hybridisatie op basis van de
complementariteit van twee enkelstrengs DNA ketens. In het geval van een cDNA
array heeft de geïmmobiliseerde keten een lengte van enkele honderden basen.
Bij een dergelijk aantal bindende basen wordt de bindingssterkte normaliter niet
sterk verstoord door een verandering van een enkele base.
Je kunt een sequentie alignment doen tussen de op de array gebruikte sequentie en de gen
sequenties in een genoom database (b.v. Genbank,/EMBL Unigene). Wanneer er een hoge
mate van alignment wordt gevonden met meerdere genen is de gebruikte DNA sequentie
niet voldoende specifiek.
(NB Een deeloorzaak kan zijn dat sequenties met repeats worden gebruikt. Die vallen ook
apart op te sporen, bijvoorbeeld met repeatmasker software. Dat antwoord zou deels goed
zijn 2 pt vd 5).












