Uploaded by
Bas Broekhuijsen
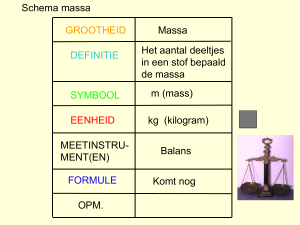
7.4 rekenen met reacties

7.4 Rekenen met Reacties Hoeveel ontstaat er? Berekenen van de molecuulmassa • • • • • Voor het bepalen van de molecuulmassa heb je nodig Een formule van een verbinding (soms) een kloppende reactie vergelijking BINAS tabel 33 rekenmachine Berekenen molecuulmassa STAPPENPLAN 1) Zet de elementen uit de verbinding onder elkaar. 2) Zet de relatieve atoommassa achter het symbool 3) Vermenigvuldig de massa met de index 4) Tel alles op 5) Als er een coëfficiënt voor staat, dan vermenigvuldig je het totaal met dat getal Voorbeeld 4 Roest = 4 Fe2O3 Fe = 55,8 u X 2 = 111,6 u O = 16,0 u X 3 = 48,0 u + 159,6 u 4 x 638,4 u Massapercentage Massa van het deel massapercentage = X 100% Massa van het geheel Voorbeeld: Hoeveel ijzer zit er in 4 Roest (Fe2O3)? Massa deel Fe = 55,8 x 2 = 111,6 u Massa geheel Fe = 55,8 x 2 = 111,6 u O = 16,0 x 3 = 48,0 u totaal = 159,6 u massa% = Omdat bij 4 x deel / 4x geheel de 4-en tegen elkaar wegvallen laat je de 4 x weg 𝟏𝟏𝟏,𝟔 x 𝟏𝟓𝟗,𝟔 100% = 69,9% Rekenen met massaverhouding • • • • • • Stoffen reageren met elkaar in een vaste verhouding. B.v. Fe : S = 7 : 4 Dit geld voor iedere reactie de getallen hebben soms een komma B.v. K : CL = 78,2 : 71 Je kunt zowel verhoudingsgetallen als de atoommassa’s gebruiken Let daarbij op: – – – – Een kloppende reactievergelijking De massa van iedere atoomsoort Het aantal atomen per soort in de verbinding (index) Het aantal moleculen per verbinding (coëfficiënt) Overmaat • Vaak stop je de stoffen niet exact in verhouding bij elkaar • Na afloop hebt je product en een beetje grondstof over. • De grondstof die overblijft is de overmaat – B.v. Fe : S = 7 : 4 als je 14 gr Fe bij 9 gr S doet blijft er 1 gr S over – S is dus in overmaat Overmaat berekenen Stappenplan • Zorg voor een kloppende reactie vergelijking • Deel de hoeveelheid gram van de stof door zijn verhoudingsgetal of molecuulmassa • Het getal dat het grootst is, is de stof in overmaat. Voorbeeld • je hebt 4 gram magnesium en 5 gram zuurstof die met elkaar reageren. • Vergelijking is 2Mg + O2 2MgO • 4/(24,3x2)=4/48,6 = 0,082 Rekenvoorbeeld • IJzer en zuurstof reageren met elkaar je hebt 16 gram ijzer hoeveel gr zuurstof heb je nodig om het ijzer te laten reageren – RV: 4Fe + 3O2 2 Fe2O3 – Atoommassa’s 4Fe = 4x 55,8 = 223,2 u 3O2 = 2x 16,0 = 32,0 x 3 = 96,0 u – Fe : O = 223,2 : 96,0 = 16 : ? – Kruistabel: ? = 16 𝑥 96,0 = 223,2 6,8 gr Rekenvoorbeeld 2 • Methaangas (CH4) en zuurstof reageren met elkaar. Men doet in een ruimte 18 gr methaan en 16 gr zuurstof. Leg met een berekening uit of er een volledige of een onvolledige verbranding plaats vindt – RV: CH4 + 2O2 CO2 + 2 H2O – Atoommassa’s CH4 = 12,0 + 4 x 1,0 = 16,0 u 2O2 = 2x 16,0 = 32,0 x 2 = 64,0 u – CH4: 2O2 = 16,0 : 64,0 = (Kies één van de gr.) 18 : ? – Kruistabel: ? = 18 𝑥 64,0 = 16,0 72 gr O2 – Je hebt 72 gr nodig om alle methaan volledig te verbranden . Je hebt maat 16 gr dus is methaan in overmaat je hebt dus een onvolledige verbranding Rekenen met diagram • Als je de verhouding weet dan kan je die uit zetten in een lijndiagram. • B.v. Fe : S = 7 : 4 • Teken de lijn door • Je kunt nu de hoeveelheid aflezen • v.b. 47 gr Fe 27gr S • Aflees fouten niet exact