Checklist METC Twente (P - Hoofdtoetsingen)
versie 13, 22-05-2017
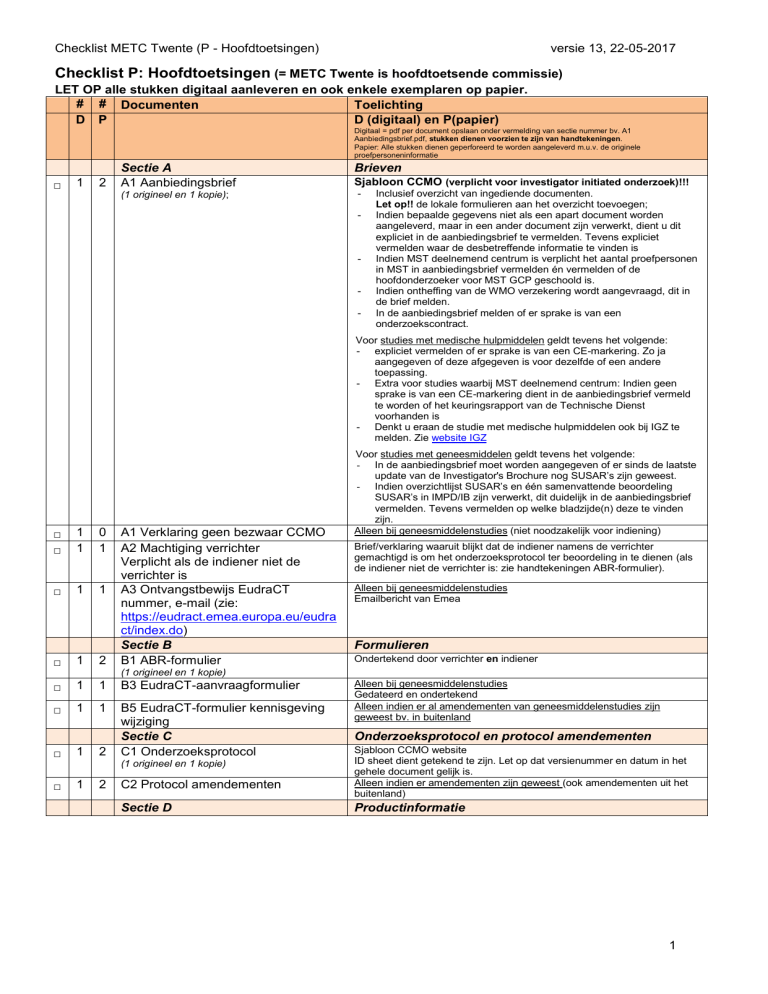
Checklist P: Hoofdtoetsingen (= METC Twente is hoofdtoetsende commissie)
LET OP alle stukken digitaal aanleveren en ook enkele exemplaren op papier.
# # Documenten
Toelichting
D P
D (digitaal) en P(papier)
Digitaal = pdf per document opslaan onder vermelding van sectie nummer bv. A1
Aanbiedingsbrief.pdf, stukken dienen voorzien te zijn van handtekeningen.
Papier: Alle stukken dienen geperforeerd te worden aangeleverd m.u.v. de originele
proefpersoneninformatie
□
1
2
Sectie A
A1 Aanbiedingsbrief
(1 origineel en 1 kopie);
Brieven
Sjabloon CCMO (verplicht voor investigator initiated onderzoek)!!!
-
-
-
Inclusief overzicht van ingediende documenten.
Let op!! de lokale formulieren aan het overzicht toevoegen;
Indien bepaalde gegevens niet als een apart document worden
aangeleverd, maar in een ander document zijn verwerkt, dient u dit
expliciet in de aanbiedingsbrief te vermelden. Tevens expliciet
vermelden waar de desbetreffende informatie te vinden is
Indien MST deelnemend centrum is verplicht het aantal proefpersonen
in MST in aanbiedingsbrief vermelden én vermelden of de
hoofdonderzoeker voor MST GCP geschoold is.
Indien ontheffing van de WMO verzekering wordt aangevraagd, dit in
de brief melden.
In de aanbiedingsbrief melden of er sprake is van een
onderzoekscontract.
Voor studies met medische hulpmiddelen geldt tevens het volgende:
- expliciet vermelden of er sprake is van een CE-markering. Zo ja
aangegeven of deze afgegeven is voor dezelfde of een andere
toepassing.
- Extra voor studies waarbij MST deelnemend centrum: Indien geen
sprake is van een CE-markering dient in de aanbiedingsbrief vermeld
te worden of het keuringsrapport van de Technische Dienst
voorhanden is
- Denkt u eraan de studie met medische hulpmiddelen ook bij IGZ te
melden. Zie website IGZ
□
□
1
1
0
1
□
1
1
□
1
2
A1 Verklaring geen bezwaar CCMO
A2 Machtiging verrichter
Verplicht als de indiener niet de
verrichter is
A3 Ontvangstbewijs EudraCT
nummer, e-mail (zie:
https://eudract.emea.europa.eu/eudra
ct/index.do)
Sectie B
B1 ABR-formulier
Voor studies met geneesmiddelen geldt tevens het volgende:
- In de aanbiedingsbrief moet worden aangegeven of er sinds de laatste
update van de Investigator's Brochure nog SUSAR’s zijn geweest.
- Indien overzichtlijst SUSAR’s en één samenvattende beoordeling
SUSAR’s in IMPD/IB zijn verwerkt, dit duidelijk in de aanbiedingsbrief
vermelden. Tevens vermelden op welke bladzijde(n) deze te vinden
zijn.
Alleen bij geneesmiddelenstudies (niet noodzakelijk voor indiening)
Brief/verklaring waaruit blijkt dat de indiener namens de verrichter
gemachtigd is om het onderzoeksprotocol ter beoordeling in te dienen (als
de indiener niet de verrichter is: zie handtekeningen ABR-formulier).
Alleen bij geneesmiddelenstudies
Emailbericht van Emea
Formulieren
Ondertekend door verrichter en indiener
(1 origineel en 1 kopie)
□
1
1
B3 EudraCT-aanvraagformulier
□
1
1
□
1
2
B5 EudraCT-formulier kennisgeving
wijziging
Sectie C
C1 Onderzoeksprotocol
(1 origineel en 1 kopie)
□
1
2
C2 Protocol amendementen
Sectie D
Alleen bij geneesmiddelenstudies
Gedateerd en ondertekend
Alleen indien er al amendementen van geneesmiddelenstudies zijn
geweest bv. in buitenland
Onderzoeksprotocol en protocol amendementen
Sjabloon CCMO website
ID sheet dient getekend te zijn. Let op dat versienummer en datum in het
gehele document gelijk is.
Alleen indien er amendementen zijn geweest (ook amendementen uit het
buitenland)
Productinformatie
1
Checklist METC Twente (P - Hoofdtoetsingen)
#
D
#
P
Documenten
versie 13, 22-05-2017
Toelichting
D (digitaal) en P(papier)
Digitaal = pdf per document opslaan onder vermelding van sectie nummer bv. A1
Aanbiedingsbrief.pdf, stukken dienen voorzien te zijn van handtekeningen.
Papier: Alle stukken dienen geperforeerd te worden aangeleverd m.u.v. de originele
proefpersoneninformatie
□
1
1
D1 Investigator’s Brochure
-
-
mag op het moment van indiening niet
ouder zijn dan 1 jaar
moet vergezeld gaan van een overzichtlijst
met de SUSAR’s die niet in het IB staan
inclusief één samenvattende beoordeling
van die SUSAR’s door de verrichter (zie
ook hieronder)
□
1
1
□
1
1
D1 Overzichtslijst SUSAR’s na IB
datum
D2 IMPD en/of SPC
□
1
1
D2 Productinformatie / IMDD
□
1
1
□
1
1
□
1
1
D2 Overzicht relevante studies met
het geneesmiddel voor onderzoek
D3 Voorbeeldetiketten in het
Nederlands
D4 relevante
verklaringen/vergunningen
□
1
1
□
1
1
□
1
3
D5 productgegevens
ziekenhuisapotheker
D6 Aanvullende productgegevens
Sectie E
E1 Informatiebrief(-ven) voor de
proefpersoon (PIF)
Alleen bij geneesmiddelenstudies;
bij gebruik van een experimenteel geneesmiddel of een geregistreerd
middel bij gebruikvoor een andere toepassing/andere dosering/andere
toedieningsvorm.
IMPD en IB mogen in 1 document verwerkt worden. Dit duidelijk aangeven
in de aanbiedingsbrief. Indien overzichtlijst SUSARS en één
samenvattende beoordeling SUSARS in IMPD/IB zijn verwerkt, dit duidelijk
in de aanbiedingsbrief vermelden. Tevens vermelden op welke bladzijde(n)
deze te vinden zijn.
Indien iedere SUSAR afzonderlijk door de verrichter is beoordeeld dan
volstaat, in plaats van een samenvattende beoordeling, een verklaring in de
aanbiedingsbrief waarin wordt aangegeven of deze SUSAR’s gevolgen
hebben voor de proefpersonen die deelnemen aan de betreffende studie.
Alleen bij geneesmiddelenstudies
Alleen bij geneesmiddelenstudies Volledig IMPD voor niet geregistreerde
middelen én voor geregistreerde middelen bij gebruik voor een andere
toepassing/andere dosering/andere toedieningsvorm.
SPC of verkort IMPD voor geregistreerde middelen
Alleen voor studies met medische hulpmiddelen
IMDD is verplicht indien hulpmiddel geen CE markering heeft of met CEmarkering bij gebruik voor een andere toepassing.
Indien het product een CE markering heeft dient ook altijd de user manual
meegestuurd te worden waarin de intended use is opgenomen.
Alleen bij geneesmiddelenonderzoek
Alleen bij geneesmiddelenonderzoek
conform GCP richtlijnen (zie CCMO toelichting in te dienen stukken)
Alleen bij geneesmiddelenstudies en studies met medische hulpmiddelen
in geval van geneesmiddelenstudies: bv.GMP-vergunning, QPverklaring
voorbeelden medische hulpmiddelenstudies: bv. bewijs van CE –
markering,
Keuringsrapport: Indien er geen CE-markering is, dient een
keuringsrapport van een Technische Dienst aangeleverd te worden.
Bij studies in MST geldt:
Keuringsrapport van de afdeling Medische Techniek MST voor studies met
medische hulpmiddelen die nog niet in MST toegelaten zijn. (Denk ook aan
het regelen van proefplaatsing bij de OK indien van toepassing) Meer
informatie op de wetenschapssite van MST.
Zoals bv. bereidingsprotocollen.
In geval van studies met medische hulpmiddelen met
geneesmiddelen/placebo (waarbij de werking van het
geneesmiddel/placebo NIET het onderwerp van de studie is), bijvoorbeeld
drug-eluting stents, inhalatieapparaten met placebo e.d.)
Informatie voor de proefpersoon
digitale versie (per PIF)
1 in WORD Met regelnummering*, paginanummering, versienummer,
datum
Op papier
2 versie Met regelnummering*, paginanummering, versienummer, datum
1 versie origineel op briefpapier van het hoofdcentrum zonder
regelnummering maar met paginanummering, versienummer, datum.
Bij multicenteronderzoek
Originele master PIF op briefpapier hoofdcentrum en indien MST ook
deelnemend centrum ook op MST briefpapier
□
□
1
1
3
3
E2 Toestemmingsformulier(en)
E3 Wervingsmateriaal
□
1
3
E4 Overig voorlichtingsmateriaal
Op de PIF dient de volledige titel van het onderzoek vermeld te worden
alsmede het NL nummer.
Als E1 en bij voorkeur doorlopend aan E1. (1 digitaal en 2 papieren versies)
Als E1, bv. Advertentieteksten voor in de krant (1 digitaal en 2 papieren
versies)
Als E1 (1 digitaal en 2 papieren versies)
2
Checklist METC Twente (P - Hoofdtoetsingen)
#
D
#
P
Documenten
versie 13, 22-05-2017
Toelichting
D (digitaal) en P(papier)
Digitaal = pdf per document opslaan onder vermelding van sectie nummer bv. A1
Aanbiedingsbrief.pdf, stukken dienen voorzien te zijn van handtekeningen.
Papier: Alle stukken dienen geperforeerd te worden aangeleverd m.u.v. de originele
proefpersoneninformatie
□
1
1
Sectie F
F1 Vragenlijst(en)
□
1
1
F2 Patiëntendagboek
□
□
1
1
1
1
F3 Patiëntenkaart
F4 Overige documenten:
Sectie G
G1 WMO-proefpersonenverzekering
□
□
□
1
1
1
1
1
1
1
1
G1 Verklaring
proefpersonenverzekering
G1 Risico-inventarisatie,
G2 Bewijs dekking aansprakelijkheid
Vragenlijsten, Patiëntendagboek, Patiëntenkaart
Voorzien van datum en versienummer
Let op dat er geen verwijzingen opstaan naar proefpersonen (namen,
initialen, geboortedatum etc), maar alleen naar studiecodes.
Voorzien van datum en versienummer
Let op dat er geen verwijzingen opstaan naar proefpersonen (namen,
initialen, geboortedatum etc), maar alleen naar studiecodes.
Verzekeringscertificaten
Verzekeringscertificaat én verzekeringspolis proefpersonenverzekering
Polis van MST kun u printen van de website
Verplicht, zie sjabloon CCMO
= Formulier D (printen van de website)
Kopie van de aansprakelijkheidsverzekering van de verrichter (de
aansprakelijkheidsverzekering moet wel het gehele onderzoek dekken) of
Kopie van de aansprakelijkheidsverzekering per centrum
Aansprakelijkheidsverzekering MST kunt u printen vanaf de website
Sectie H
□
□
1
1
1
1
H1 CV van de onafhankelijk persoon
H2 CV van de coördinerend
onderzoeker
Sectie I
□
1
1
□
1
2
I1 lijst deelnemende centra met
hoofdonderzoeker
I2 Onderzoeksverklaringen van alle
centra waarin het onderzoek verricht
zal worden.
(1 origineel en 1 kopie)
□
1
2
I3 CV incl. publicatielijst van de lokale
hoofdonderzoeker per centrum:
□
1
1
□
1
2
□
1
2
I4 Overige centruminformatie
Sectie J
J1 Informatie over vergoeding
proefpersonen
J2 Informatie over vergoeding
onderzoekers/centra
□
1
1
□
1
1
Sectie K
K1 Kopie beoordeling andere
instanties
K2 Overzichtlijst beoordeling
buitenlandse METC’s en BI’s
CV onafhankelijk persoon en coördinerende
onderzoeker
Gedateerd en ondertekend
Gedateerd en ondertekend incl. een recente publicatielijst
Informatie deelnemende centra (incl. CV
hoofdonderzoeker)
Op een aparte lijst aanleveren: naam, instelling, adres en telefoonnummer
(postadres, geen bezoekadres), gedateerd
Altijd aanleveren voor elk deelnemend centrum
Op briefpapier van de desbetreffende instelling (logo) origineel
ondertekend, de naam en functie vermelden van degene die de verklaring
heeft ondertekend.
Let op!! alle velden invullen dus ook juiste kruisje zetten bij de WMO
verzekering.
Let op: indien MST deelnemend centrum: Onderzoeksverklaring MST
aanleveren
Is CV hoofdonderzoeker (per centrum) zoals vermeld in ABR C9
Gedateerd en ondertekend incl. een recente publicatielijst (mag als bijlage
bij de onderzoeksverklaring).
Bij geneesmiddelenstudies GCP certificering hoofdonderzoeker toevoegen.
Bij studies in MST, MST hoofdonderzoeker dient een GCP-examen te
hebben afgelegd. Men dient hiervan een bewijs aan te leveren. Indien geen
bewijs overlegd kan worden, geeft de RvB MST geen toestemming voor
uitvoer van de studie in MST.
Aanvullende informatie over financiële vergoedingen
Indien de proefpersonen een vergoeding krijgen kan hier toegelicht worden
hoe deze vergoeding is opgebouwd.
Indien de onderzoekers/ het centrum vergoedingen ontvangt voor
deelname aan de studie kan hier worden toegelicht hoe deze vergoeding is
opgebouwd.
Andere relevante documenten
Indien beschikbaar/Indien van toepassing, bv subsidiegevers, buitenlandse
METC
Geldt alleen voor internationale studies;
lijst van landen waar het onderzoek verricht wordt/zal worden volstaat NIET
Overzicht van eerdere, lopende en te verwachten beoordelingen, gedateerd
3
Checklist METC Twente (P - Hoofdtoetsingen)
#
D
#
P
Documenten
versie 13, 22-05-2017
Toelichting
D (digitaal) en P(papier)
Digitaal = pdf per document opslaan onder vermelding van sectie nummer bv. A1
Aanbiedingsbrief.pdf, stukken dienen voorzien te zijn van handtekeningen.
Papier: Alle stukken dienen geperforeerd te worden aangeleverd m.u.v. de originele
proefpersoneninformatie
□
1
2
□
□
□
1
1
1
1
1
1
□
1
1
K3 Getekend onderzoekscontract
K4 Wetenschappelijke publicaties
K5 DSMB (samenstelling en charter)
K6 Andere documenten
Afhandelingskosten
Gegevens t.b.v. factuur
Specifieke formulieren voor studies
die in MST zullen lopen
Deze formulieren 1 week eerder aanleveren
bij het wetenschapsbureau
MST([email protected])
Als setje aanleveren inclusief het protocol,
het ABR-formulier, de PIF en het contract.
Zonder deze documenten worden
formulieren niet in behandeling genomen.
□
1
3
Formulier B
verplicht
(Check de website voor laatste versie =
verplicht)
Bij de indiening volstaat een versie zonder handtekeningen, echter voordat
het oordeel afgegeven kan worden, dient een volledig getekend exemplaar
ontvangen te zijn. (zie opmerking blz. 5). U dient zelf handtekeningen te
regelen.
Bij multicenter dient er een mastercontract te zijn.
wijzigingen per lokaal centrum doorgeven of
verklaring aanleveren dat alle contracten hetzelfde zijn
betreffende de publicatievrijheid en het beëindigen van de studie.
Let op: Indien MST deelnemend centrum:
U dient het contract van de studie ook ter beoordeling sturen aan:
Dhr. mr. P. Dalhuisen, ziekenhuisjurist.
Inclusief een begeleidende brief bij het contract. In de begeleidende brief
dient het volgende te worden vermeld:
Verkorte titel studie, protocolnr, naam en specialisme onderzoeker MST,
naam en adresgegevens firma
Lijst aanleveren
Sjabloon CCMO
Gegevens factuur: minimaal 2 weken vóór indiening schriftelijk (mag ook
via e-mail) verstrekken: naam bedrijf, afdeling, naam en functie
contactpersoon, adresgegevens, telefoonnummer, protocolnummer, korte
studietitel, naam en specialisme onderzoeker; deze gegevens dient u
mailen naar [email protected]
Deze formulieren zijn geen onderdeel van de METC aanvraag, maar
wel noodzakelijk voor het verkrijgen van de goedkeuring van de RvB
MST. Ze maken onderdeel van de uitvoerbaarheidstoets binnen MST.
Indien deze documenten ontbreken/onvolledig zijn, is de studie niet
uitvoerbaar in MST en zal er geen METC toetsing plaatsvinden.
Als setje aanleveren inclusief het protocol, het ABR-formulier, de PIF
en het contract. Zonder deze documenten worden formulieren niet in
behandeling genomen.
Altijd ondertekend door aanvrager én alle bij het onderzoek betrokken
toeleverende afdelingen, specialismen en professionals (röntgen, lab,
apotheek, functieafdelingen, verpleegafdelingen, specialist in consult).
LET OP: Dit geldt dus ook voor reguliere patiëntenzorg/ reguliere
verrichtingen
Alle verrichtingen (zowel regulier als niet regulier dienen vermeld te
worden).
Ook niet reguliere handelingen die tijdens een standaard procedure
plaatsvinden dienen vermeld te worden;
Er dient tevens vermeld te worden welk apparatuur en welke materialen
gebruikt worden
Alle polibezoeken en ziekenhuisbezoeken dienen vermeld te worden; er
dient tevens vermeld te worden welke polibezoeken/ziekenhuisbezoeken
regulier en welke niet regulier zijn. Indien niet regulier, hoe worden deze
geregistreerd en bekostigd.
Daarnaast dient expliciet vermeld te worden of er sprake is van een followup en welke handelingen binnen follow-up regulier of niet regulier zijn.
Indien niet regulier, hoe worden deze geregistreerd en bekostigd.
4
Checklist METC Twente (P - Hoofdtoetsingen)
#
D
#
P
Documenten
versie 13, 22-05-2017
Toelichting
D (digitaal) en P(papier)
Digitaal = pdf per document opslaan onder vermelding van sectie nummer bv. A1
Aanbiedingsbrief.pdf, stukken dienen voorzien te zijn van handtekeningen.
Papier: Alle stukken dienen geperforeerd te worden aangeleverd m.u.v. de originele
proefpersoneninformatie
□
1
3
Financiële paragraaf
verplicht
(document of documenten waaruit de
vergoeding blijkt die de opdrachtgever voor de
verrichtingen in het protocol vergoedt en in welk
gedeelte van het onderzoek de verrichtingen
plaatsvinden; bij niet-commerciële onderzoeken
een overzicht van de verwachte kosten en de
wijze van bekostiging. Deze financiële
documenten zijn nodig om de financiële
dekking van het onderzoek inzichtelijk te
maken)
Als een apart document aanleveren.
- Verplicht korte titel, protocolnummer, NL-nr en de naam van de lokale
onderzoeker MST vermelden.
- Op de stukken dient expliciet vermeld te worden dat het om een
financiële paragraaf gaat.
Minimaal dient de volgende informatie aangeleverd te worden:
1. Wie is de opdrachtgever, hoe worden de handelingen/verrichtingen
bekostigd en gefactureerd/verrekend; Daarnaast dient men informatie aan
te leveren over de vergoeding in euro’s die de opdrachtgever verstrekt voor
de verrichtingen
2. Flowchart/algemeen overzichtsschema van alle bezoeken en
verrichtingen. Hierbij dient expliciet aangegeven te worden welke
polibezoeken regulier en welke niet regulier zijn.
3. Specifiek overzicht welke verrichtingen, handelingen en/of bezoeken niet
regulier zijn.
Daarnaast expliciet vermelden welke apparatuur/welke materialen gebruikt
worden en hoe/door wie deze bekostigd worden.
Tevens hoe en door wie het personeel gefinancierd wordt.
N.B. bovenstaande nummering dient aangehouden te worden.
1
3
Formulier I
verplicht
(Check de website voor laatste versie =
verplicht)
De informatie kan worden aangeleverd met een kopie uit het protocol,
contract of andere documenten, mits voorzien van bovenstaande
nummering en expliciete vermelding financiële paragraaf..
Geldt niet voor industriestudies
Formulier Inventarisatie Financiering onderzoek
Inventarisatie bestaat uit:
Formulier I (volledig ingevuld en ondertekend). Alle vragen
dienen volledig te worden beantwoord
Protocol
ABR-formulier
Dit setje dient u minimaal 1 week van tevoren aan te leveren bij het
wetenschapsbureau p/a
Medical School Twente
ITWO
P/a M.Huntjens
!!! LET OP lees onderstaande informatie ook !!!
Deadlines
Wij houden ons zeer strikt aan de deadline, omdat de studies
nauwkeurig gecontroleerd moeten worden;
verwerkt moeten worden en;
tijdig verzonden moeten worden naar de leden van de METC.
Studies die te laat (na 12.00 uur) en/of incompleet op de dag van de deadline binnenkomen, zullen derhalve niet meegaan met de
eerstvolgende vergadering.
Digitale stukken
U dient de stukken digitaal aan te leveren. Digitaal = pdf per document opslaan onder vermelding van sectie nummer bv. A1
Aanbiedingsbrief.pdf m.u.v. de PIF en informed consent deze dient als Word bestand aangeleverd te worden. De digitale stukken
dienen ook getekend te zijn.
De stukken kunt u mailen naar de mailbox van de METC: [email protected] én ITWO: [email protected] onder vermelding van verkorte
studietitel, protocolnummer en naam van de onderzoeker. Een papieren printje van uw mail s.v.p. aan het ingezonden studiedossier
toevoegen. Naast de digitale stukken dient u nog enkele exemplaren op papier aan te leveren.
Aanleveren papieren stukken per type
U dient alle papieren stukken per type formulier/document als setje, aan elkaar geniet, geperforeerd (m.u.v. de originele PIF)
aan te leveren. Dus niet zelf alle verschillende formulieren in een bepaalde volgorde bij elkaar in een mapje doen.
Compleet aanleveren
Een studie wordt pas in behandeling genomen als alle benodigde documenten aanwezig zijn. Dit betekent dat eveneens alle benodigde
handtekeningen en tekendata van de onderzoeker(s), onafhankelijk arts, betrokken afdeling, etc. noodzakelijk zijn
Let op: t.a.v. Studies in MST: formulier B en financiële paragraaf en formulier I: Dit geldt ook voor studies, waarbij sprake is
van reguliere patiëntenzorg.
Contactgegevens bij aanleveren
Op de doos dient u aan te geven: naam van degene die het onderzoek daadwerkelijk indient, telnr,
e-mailadres.
Regelnummering, paginanummering, versie en datum
Patiënteninformatie en toestemmingformulier dienen voorzien te zijn van: regelnummering, paginanummering, versienummer en datum.
5
Checklist METC Twente (P - Hoofdtoetsingen)
versie 13, 22-05-2017
Regelnummers toevoegen:
1.
Als u regelnummers wilt toevoegen aan het hele document.
Ga naar menu Pagina-indeling en klik op submenu Regelnummers, optie Doorlopend
2.
Als u regelnummers wilt toevoegen aan een deel van een document en wilt u dat de regelnummering op iedere pagina opnieuw
begint, dan selecteert u de tekst die u wilt nummeren.
Ga naar menu Pagina-indeling, submenu Regelnummers, optie Elke pagina opnieuw beginnen.
3.
Als u regelnummers wilt toevoegen aan bestaande secties, klikt u in een sectie of selecteert u meerdere secties.
Ga naar menu Pagina-indeling, submenu Regelnummers, optie Elke sectie opnieuw beginnen.
Onderzoekscontracten
Voor alle studies die in MST zullen lopen en waarbij sprake is van een onderzoekscontract geldt dat het contract door de onderzoeker
voor beoordeling door een jurist opgestuurd dient te worden naar:
De heer P. Dalhuisen, ziekenhuisjurist ([email protected])
De door RvB MST getekende onderzoekscontracten worden na ondertekening naar ITWO gestuurd. U ontvangt de getekende
contracten dan gelijktijdig met uw oordeel/ advies en de goedkeuring van RvB MST.
Voor vragen hierover kunt u contact opnemen met secretariaat RvB MST.
Relevantie informatie
Zie ook de website http://www.metctwente.nl voor meer informatie
Voor vragen over het indienen van studies kunt u contact opnemen METC of ITWO via mailbox [email protected] of [email protected]
Voor vragen over de WMO-plichtigheid van uw studie kunt u contact opnemen met mw. S. Satink via mailbox metc [email protected]
Indien u meer informatie over de in te dienen stukken wilt kunt u op de website van de ccmo kijken, hier vindt u diverse sjablonen en
een uitgebreide toelichting.
U kunt natuurlijk ook altijd contact opnemen met ons secretariaat.
Let op: Extra toelichting voor geneesmiddelenstudies
Duale toetsing bij CCMO
Voor studies met geneesmiddelen geldt een duale toetsing:
u dient tevens een volledig onderzoeksdossier in te dienen bij de CCMO.
Voor de inhoud van het standaarddossier in te dienen bij de CCMO zie website CCMO: www.ccmo.nl (kies ‘Voor onderzoekers” en
vervolgens “Formulieren”)
Vanaf 1 januari 2009 mogen documenten alleen nog digitaal aan de bevoegde instantie worden gestuurd.
studies met (uitsluitend) geregistreerde geneesmiddelen
In geval van studies met geregistreerde middelen kunt u:
SPC-tekst / samenvatting van productkenmerken aanleveren in plaats van IMPD per middel
Productinformatietekst of bijsluitertekst aanleveren in plaats van IB per middel
In de aanbiedingsbrief expliciet vermelden dat het om de toetsing gaat van een studie met geregistreerde geneesmiddelen (in
dit geval mag u een passage over SUSARS weglaten)
Let op: extra toelichting voor studies met medische hulpmiddelen
Model Investigational Medical Device Dossier
Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) heeft in opdracht van het ministerie van VWS een model Investigational
Medical Device Dossier (IMDD) ontwikkeld voor onderzoek met medische hulpmiddelen zonder CE markering.
Het is een hulpmiddel voor opdrachtgevers (verrichters) die medisch-wetenschappelijk onderzoek met medische hulpmiddelen willen
uitvoeren. Het IMDD kan dan onderdeel uitmaken van het onderzoeksdossier (sectie D) dat de opdrachtgever indient bij de oordelende
Medisch-Ethische Toetsingscommissie (METC) of de CCMO. In de IMDD wordt met name de technische informatie over het medisch
hulpmiddel op gestructureerde wijze opgenomen en kan daarmee de beoordeling vereenvoudigen. Zie verder de toelichting bij het
model.
Denkt u eraan de studie met medische hulpmiddelen ook bij IGZ te melden. Zie website IGZ.
6












