Module 3 “Energie en Evenwichten”
Antwoorden
§ 1 – Reactiesnelheid
1
Soort stof, temperatuur, concentratie, verdelingsgraad, aanwezigheid v/e katalysator.
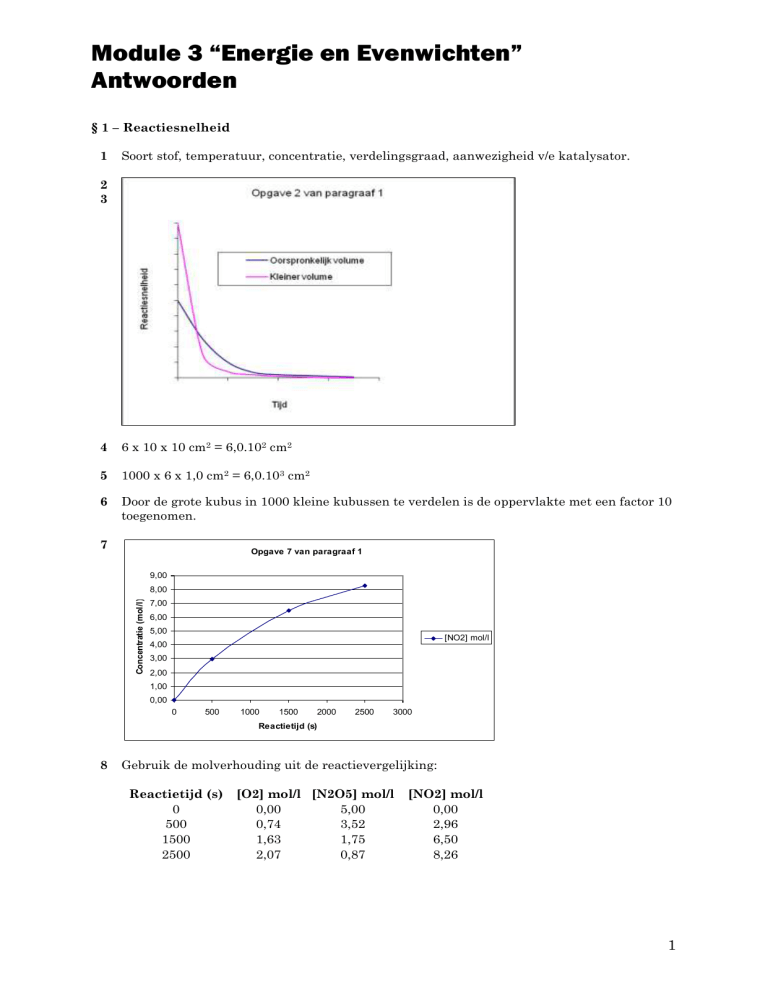
2
3
4
6 x 10 x 10 cm2 = 6,0.102 cm2
5
1000 x 6 x 1,0 cm2 = 6,0.103 cm2
6
Door de grote kubus in 1000 kleine kubussen te verdelen is de oppervlakte met een factor 10
toegenomen.
7
Opgave 7 van paragraaf 1
9,00
Concentratie (mol/l)
8,00
7,00
6,00
5,00
[NO2] mol/l
4,00
3,00
2,00
1,00
0,00
0
500
1000
1500
2000
2500
3000
Reactietijd (s)
8
Gebruik de molverhouding uit de reactievergelijking:
Reactietijd (s)
0
500
1500
2500
[O2] mol/l [N2O5] mol/l
0,00
5,00
0,74
3,52
1,63
1,75
2,07
0,87
[NO2] mol/l
0,00
2,96
6,50
8,26
1
Module 3 “Energie en Evenwichten”
Antwoorden
9
Opgave 9 van paragraaf 1
Concentratie (mol/l)
6,00
5,00
4,00
[O2] mol/l
3,00
[N2O5] mol/l
2,00
1,00
0,00
0
500
1000
1500
2000
2500
3000
Reactietijd (s)
10
De gemiddelde reactiesnelheid op interval 0-500 s: 2,96 / 500 = 0,00592 mol NO2 per sec.
op interval 500-1500 s: 3,54 / 1000 = 0,00354 mol NO2 per sec.
op interval 1500-1500 s: 1,76 / 1000 = 0,00176 mol NO2 per sec.
11
Opgave 11 van paragraaf 1
Reactiesnelheid (mol/s)
0,00700
0,00600
0,00500
0,00400
0,00300
0,00200
0,00100
0,00000
0
500
1000
1500
2000
2500
Reactietijd (s)
12
Opgave 12 van paragraaf 1
35
30
stikstof (dm3)
25
20
15
10
5
0
-5
0
20
40
60
80
100
120
tijd (millisec)
2
Module 3 “Energie en Evenwichten”
Antwoorden
13
De airbag is maximaal gevuld met 29 dm3 stikstof.
Het aantal mol stikstof is dan 29 dm3 ÷ 21 dm3 mol-1 = 1,38 mol.
Hiervoor is 2 x 1,38 = 2,76 mol Na3N nodig (zie reactievergelijking).
Dit is 2,76 mol x 82,98 g mol-1 = 2,3.102 g
14
Na 40 s is de reactie afgelopen en is er 29 dm3 stikstof gevormd.
De gemiddelde reactiesnelheid is dan 29 dm3 ÷ 30.10-3 s = 9,7.102 dm3 s-1
15
De reactiesnelheid is maximaal op tijdsinterval 10-20 ms.
De gemiddelde reactiesnelheid is daar 22 dm3 ÷ 10.10-3 s = 2,2.103 dm3 s-1
16
Er ontstaat 6 x 1,38 mol Na (zie vraag 13).
Er is 3 x 1,38 mol = 4,14 mol FeO nodig (zie onderstaande reactievergelijking).
Dit is 4,14 mol x 71,85 g mol-1 = 3,0.102 g
FeO(s) + 2 Na(s) → Fe(s) + Na2O(s)
Wat je na deze paragraaf moet weten / kunnen:
van welke vijf factoren de reactiesnelheid afhangt (zie antwoord op vraag 1)
de twee definities van reactiesnelheid
toepassen van het botsende deeltjes model
3
Module 3 “Energie en Evenwichten”
Antwoorden
§ 2 – Energie en reacties
Opmerking: maak gebruik van tabellen 56 en 57.
Zelfde temperatuur, concentratie en verdelingsgraad.
2
Rb zelfde groep als Na, K dus zeer onedel.
Sr zelfde groep als Mg, Ca dus ook zeer onedel.
Pb zelfde groep als Sn dus onedel.
3
Wolfraam heeft een zeer hoog smeltpunt (tabel 8: 3695 K)
4
Zorgen dat er in het lampje geen zuurstof aanwezig is dat met W kan reageren.
Meestal wordt het gloeilampje gevuld met het edelgas argon (Ar).
5
2 Cs(s) + 2 H2O(l) → 2 Cs+(aq) + 2 OH-(aq) + H2(g)
6
Het is een zeer onedel metaal.
7
Cesium reageert ook snel met zuurstof.
8
C(s) + O2(g) → CO2(g)
9
De vormingswarmte van CO2 staat in tabel 57: - 3,935.105 J mol-1
10
Spiritus heeft een lage ontbrandingstemperatuur, verdampt heel gemakkelijk en is
daardoor zeer brandbaar.
11
Om verwarring met de ‘drinkbare’ alcohol te voorkomen.
12
C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
13
2 CH4O(l) + 3 O2(g) → 2 CO2(g) + 4 H2O(l)
14
1,0 L x 0,80 kg dm-3 = 0,80 kg ethanol (tabel 11)
8,0.102 g ÷ 46,07 g mol-1 = 17 mol (tabel 98 of 99)
17 mol x - 13,66.105 J mol-1 = - 2,4.107 J (tabel 56)
15
1,0 L x 0,79 kg dm-3 = 0,79 kg methanol (tabel 11)
7,9.102 g ÷ 32,04 g mol-1 = 25 mol (tabel 98 of 99)
25 mol x - 7,26.105 J mol-1 = - 1,8.107 J (tabel 56)
16
energie (J) ►
1
▲
│
C2H6O(s) + 3 O2(g) │
geactiveerde toestand
│
│
│
│
│
│
│
│
│
Δ E = - 1,366.10 6 J/mol
│
│
▼
│
│
│
▼ 2 CO2(g) + 3 H2O(l)
verbranding van ethanol
4
17
energie (J) ►
Module 3 “Energie en Evenwichten”
Antwoorden
▲
│
2 CH4O(s) + 3 O2(g) │
geactiveerde toestand
│
│
│
│
│
│
│
│
│
Δ E = - 7,26.10 5 J/mol
│
│
▼
│
│
│
▼ 2 CO2(g) + 4 H2O(l)
verbranding van methanol
30oC, dus vlak boven kamertemperatuur.
19
Witte fosfor is zeer brandbaar en giftig.
20
Fosfor wordt onder water bewaard vanwege de zeer lage ontbrandingstemperatuur en
wordt onder water gesneden omdat de wrijvingsenergie de fosfor tot ontbranding kan
brengen.
21
4 P(s) + 5 O2(g) → 2 P2O5(s) of
P4(s) + 5 O2(g) → 2 P2O5(s)
22
energie (J) ►
18
P4(s) + 5 O2(g)
▲
│
geactiveerde toestand
│
│
│
│
│
│
│
│
│ ΔE
│
│
│
│
│
▼
▼ 2 P2O5(s)
verbranding van fosfor
5
23
energie (J) ►
Module 3 “Energie en Evenwichten”
Antwoorden
2 H2O2(aq)
▲
│
│
│
│
│
│
│
geactiveerde toestand
│
│
│
│
│
│
│
│
│
│
│
│
│
│
│ ΔE
│
│
│
│
│
▼
▼ 2 H2O(l) + O2(g)
energie (J) ►
zonder katalysator
2 H2O2(aq)
▲
│
geactiveerde toestand
│
│
│
│
│
│
│
│
│ ΔE
│
│
│
│
│
▼
▼ 2 H2O(l) + O2(g)
met katalysator
Wat je na deze paragraaf moet weten / kunnen:
bij iedere reactie treedt een energie effect op: de reactie energie (Δ E)
bij reacties waarbij energie vrijkomt heeft Δ E een ‘min’ teken (exotherme reacties)
bij reacties waarbij voortdurend energie moet worden toegevoerd heeft Δ E een ‘plus’ teken
(endotherme reacties)
informatie over reactie energieën kun je vinden in BINAS tabel 56 en 57
de energie is nodig om de bindingen van de beginstof(fen) te verbreken en noemt men de
activeringsenergie (Eact)
met behulp van een katalysator kan de activeringsenergie worden verlaagd; en katalysator
is een stof die de reactie snelheid vergroot zonder daarbij verbruikt te worden
energie effecten van een chemische reactie kun je weergeven in een energie diagram.
6
Module 3 “Energie en Evenwichten”
Antwoorden
§ 3 – Energiebalans bij reacties
Opmerking: maak gebruik van tabellen 56 en 57.
1
2 C(s) + 4 H2(g) + O2 (g) → 2 CH4O (l) methanol = CH3 – OH (Module 1 par 17)
2
Binas tabel 57B: - 2,40.105 J.mol-1
3
Nee, want AgBr ontstaat uit de ionen Ag+ en Br‾ en niet uit de elementen Ag(s) en Br2(l).
4
Ja, de elementen zijn inderdaad Na(s) en Cl2(g).
5
Nee, dit gaat om een ontleding in de elementen. De reactiewarmte zal de min waarde van
vormingswarmte zijn vanwege de wet van behoud van energie.
6
De vormingswarmte van calciumcarbonaat bedraagt volgens Binas tabel 57A
– 12,07.105 J.mol-1. De ontledingswarmte is dan + 12,07.105 J.mol-1.
7
2 CaCO3(s) → 2 Ca (s) + 2 C(s) + 3 O2 (g)
8
De reactievergelijking voor de vorming van SO2 is gelijk aan de vergelijking voor de
verbranding van S(s):
S(s) + O2(g) → SO2 (g)
9
CH4(g) + 2 O2(g)→ CO2 (g) + 2 H2O (l)
10
11
E reactie= ( + 0,76 – 3,935 – 2. 2,86) . 105 = - 8,90 . 105 J per mol methaan
E
(J)
CH4 (l) + 2 O2 (g)
- 8,355.105 J
CO2 (g) + 2 H2 O(l)
voor de reactie
na de reactie
12
NH4Cl(s) → NH3 (g) + HCl (g)
13
E reactie = ( + 3,15 – 0,462 – 0,923).105 = + 1,77.105 J.per mol ammoniumchloride.
7
Module 3 “Energie en Evenwichten”
Antwoorden
14
E
(J)
NH3 (g) + HCl(g)
+ 1,765.10 5 J
NH4 Cl(s)
voor de reactie
15
na de reactie
C2H4(g) + H2(g) → C2H6(g)
16 E reactie = ( - 0,51 – 0,86 ).105 = - 1,37.105 J.mol-1 ethaan.
17
E
(J)
C2 H4 (g) + H2 (g)
- 1,37.10 5 J
C2 H6 (g)
voor de reactie
na de reactie
Wat je na deze paragraaf moet weten / kunnen:
Vormingswarmte en de wet van behoud van energie gebruiken om de reactiewarmte te
berekenen.
8
Module 3 “Energie en Evenwichten”
Antwoorden
§ 4 – Evenwichtsreacties
1
C6H12O6(l) + 6 O2(g) → 6 CO2(g) + 6 H2O(l)
2
Bij deze reactie komt energie vrij, exotherm dus.
3
Bijvoorbeeld brood, pasta en rijst. Ze worden gemaakt uit granen (meel).
4
Het is de omgekeerde reactie van vraag 1: 6 CO2(g) + 6 H2O(l) → C6H12O6(l) + 6 O2(g)
5
Voor deze reactie is (voortdurend) zonlicht, endotherm dus.
6
Bij de fotosynthese reactie ontstaat zuurstofgas.
7
De enzymen werken als katalysatoren en verlagen de activeringsenergie.
8
2 SO2(g) + O2(g) 2 SO3(g)
9
Het is een heterogeen evenwicht, want koolstof bevindt zich in de vaste fase.
10
80% CO2 en 20% CO.
11
Vol % CO en CO2
100
90
80
70
Vol %
60
CO2
50
CO
40
30
20
10
0
0
2
4
6
8
10
Tijd (s)
Wat je na deze paragraaf moet weten / kunnen:
Sommige reacties zijn omkeerbaar.
Wanneer twee omkeerbare reacties gelijktijdig gaan verlopen spreken we van een
evenwichtsreactie.
De ligging van een evenwicht is afhankelijk van de temperatuur. Bij een hogere
temperatuur verschuift het evenwicht naar de endotherme kant. Toevoeren van energie is
dus in het voordeel van de endotherme reactie.
Er is een onderscheid tussen homogene en heterogene evenwichten. Bij een homogeen
evenwicht bevinden alle stoffen zich in dezelfde fase. Bij een heterogeen evenwicht zijn de
stoffen in meerdere fasen aanwezig.
9
Module 3 “Energie en Evenwichten”
Antwoorden
§ 5 – Evenwichten en reactiesnelheid
1
Toevoeren van energie is in het voordeel van de endotherme reactie: de ontleding van
ammoniak in waterstof en stikstof.
2
De botsingen tussen de waterstof en stikstof moleculen zijn niet hard (effectief) genoeg.
3
Door het verhogen gaan de deeltjes sneller bewegen, botsen de deeltjes vaker en worden de
botsingen harder.
4
Door een hogere druk nemen ook de concentraties toe en zullen de deeltjes vaker botsen.
5
De ijzerkatalysator verlaagt de activeringsenergie en vergroot daarmee de reactiesnelheid.
6
Bij een dynamisch evenwicht verlopen twee tegengestelde processen even snel. Bij een
statisch evenwicht is dit niet het geval.
7
NaCl(s) Na+(aq) + Cl-(aq)
Het is een dynamisch evenwicht want er lost evenveel natriumchloride op als dat er
neerslaat. Het evenwicht is heterogeen omdat er ook vast natriumchloride aanwezig is.
8
Het evenwicht is homogeen omdat alle stoffen zich in de gasfase bevinden.
9
Als 60% waterstof is omgezet, dan is er nog 0,040 mol H2 en ook 0,040 mol Cl2 over.
Dus [H2] = 0,040 mol / 2,0 L = 0,020 mol L-1 en [Cl2] = 0,020 mol L-1.
Uit de reactievergelijking volgt dat uit 0,060 mol H2 er 0,120 mol HCl ontstaat, dus wordt
[HCl] = 0,120 mol / 2,0 L = 0,060 mol L-1
10
Fe2+(aq) + Hg2+(aq) Fe3+(aq) + Hg+(aq)
11
Je kunt de Hg+ ionen aan het evenwicht onttrekken door een neerslagreactie, bv:
Hg+(aq) + Cl-(aq) → HgCl(s)
Wat je na deze paragraaf moet weten / kunnen:
De kenmerken van het Haber-Bosch proces (productie van ammoniak).
Bij het instellen van een evenwicht wordt de reactiesnelheid naar rechts gelijk aan de
reactiesnelheid naar links. Dit noemen we een dynamisch evenwicht.
De tijd die nodig is om de evenwichtstoestand te bereiken, noemen we de insteltijd van het
evenwicht.
Omdat in een dynamisch evenwicht de reactiesnelheid naar links is gelijk aan de
reactiesnelheid naar rechts, zullen bij evenwicht ook de concentraties van de reagerende
stoffen niet veranderen.
Een evenwicht kan aflopend gemaakt worden door een stof voor of na de pijl te onttrekken
aan het evenwicht.
Een chemisch productie proces kun je weergeven in een blokschema.
10
Module 3 “Energie en Evenwichten”
Antwoorden
§ 6 – De evenwichtsvoorwaarde
1
PbI2(s) Pb2+(aq) + 2 I-(aq)
[Pb2+] . [I-]2
2
N2(g) + O2(g) 2 NO(g)
[NO]2 / { [N2].[O2] }
3
C(s) + CO2(g) 2 CO(g)
[CO]2 / [CO2]
4
H2(g) + I2(g) 2 HI(g)
5
[HI]2 / { [H2].[I2] }
6
pHI2 / { pH2.pI2 }
7
Bij gassen is de druk recht evenredig met de concentratie.
8
pHI2 / { pH2.pI2 } = Kp
Kp = (2,2)2 / { 0,31 x 0,85 } = 18,4
9
In elk geval een temperatuur boven de 1000 K.
10
Koolstof komt niet voor in de evenwichtsvoorwaarde en heeft dus geen invloed op de ligging
van het evenwicht.
11
Door samenpersen nemen de concentraties [CO] en [CO2] beide toe.
De evenwichtsvoorwaarde luidt: [CO]2 / [CO2] = Kp
De invloed van [CO] in de teller (kwadraat) is daarbij groter dan [CO 2] in de noemer.
Het evenwicht wordt verstoord, er zal CO moeten verdwijnen. De (exotherme) reactie naar
links komt dus tijdelijk in het voordeel.
Tip: bij het verhogen van de druk verschuift het evenwicht altijd naar de kant met het (in
totaal) minste aantal deeltjes in de gasfase. In dit geval is dit de linker kant (slechts één
deeltje in de gasfase) en niet de rechter kant (twee deeltjes in de gasfase).
12
De temperatuur verlagen is in het voordeel van de exotherme reactie (naar links).
13
Een katalysator heeft geen invloed op de ligging van het evenwicht.
14
Bij het verhogen van de druk verschuift het evenwicht altijd naar de kant met het (in
totaal) minste aantal deeltjes in de gasfase. Bij het Haber-Bosch proces is dit de rechter
kant (2 deeltjes in de gasfase) en niet de rechter kant (in totaal vier deeltjes in de gasfase).
15
24 dm3 bevat 1,00 mol gasdeeltjes.
1,00 mol gasmengsel heeft een massa van 24,0 dm3 x 4,8 g dm-3 = 115,2 g
De massa van 1,00 mol HF is 20,0 g en de massa van 1,00 mol (HF) 6 is 120 g.
Er komen dus in verhouding meer (HF)6 deeltjes voor.
16
Door volumevergroting nemen de concentraties [(HF) 6] en [HF] beide af.
De evenwichtsvoorwaarde luidt: [HF]6 / [(HF)6] = K
11
Module 3 “Energie en Evenwichten”
Antwoorden
De invloed van [HF] in de teller (zesde macht) is daarbij groter dan [HF]6 in de noemer.
Het evenwicht wordt verstoord omdat de teller meer afneemt dan de noemer, er zal HF
moeten bijkomen. De reactie naar rechts komt dus tijdelijk in het voordeel.
Tip: bij het verlagen van de druk verschuift het evenwicht altijd naar de kant met het (in
totaal) grootste aantal deeltjes in de gasfase. In dit geval is dit de rechter kant (zes deeltjes
in de gasfase) en niet de linker kant (slechts één deeltjes in de gasfase).
17
Ga uit van 1,00 mol gasmengsel. Dat heeft een volume van 24,0 dm 3.
21% van de moleculen is (HF)6, dus 79% van de moleculen is HF.
Bereken met deze gegevens:
[HF] = 0,79 / 48 = 0,0165 mol dm-3
[(HF)6] = 0,21 / 48 = 0,00438 mol dm-3
Vul de evenwichtsvoorwaarde in:
K = (0,0165)6 / 0,00438 = 4,6.10-9
Wat je na deze paragraaf moet weten / kunnen:
In de evenwichtstoestand veranderen de concentraties, waardoor ook de concentratiebreuk
een bepaalde constante waarde heeft, de evenwichtsconstante (K).
In tabellenboeken kunnen we de waarden van deze evenwichtsconstanten opzoeken,
bijvoorbeeld in de tabellen 46, 47, 49, 50 en 51 van BINAS. De waarde van K (die iets zegt
over de ligging van het evenwicht) hangt alleen af van de temperatuur. Als de waarde van
de concentratiebreuk gelijk is aan de evenwichtsconstante, dan is er sprake van chemisch
evenwicht. Deze voorwaarde noemen we de evenwichtsvoorwaarde.
In de concentratiebreuk staan de concentraties van de stoffen rechts van de pijl in de teller
en de concentraties van de stoffen links van de pijl in de noemer. Verder staan de
coëfficiënten uit de reactievergelijking als exponenten bij de concentraties. In de
concentratiebreuk staan alleen de concentraties van de stoffen, waarvan de concentratie is
te meten, dus met de toestandsaanduiding (g) of (aq).
Als je aan een evenwicht stoffen onttrekt of toevoegt, of als je de druk verandert, moet je met
behulp van de concentratiebreuk nagaan of er nog sprake van evenwicht. Als de
concentratiebreuk niet meer gelijk is aan de evenwichtsconstante, dan is één van de twee
reacties in het voordeel.
12
Module 3 “Energie en Evenwichten”
Antwoorden
§ 7 – Rekenen aan evenwichten
1
2
Alle stoffen in de evenwichtsreactie bevinden zich in de gasfase.
stofbalans
stikstofmonooxide +
2 NO(g)
+
zuurstof
O2(g)
stikstofdioxide
2 NO2(g)
voor de reactie
+ 0,333 mol dm
+ 0,313 mol dm
tijdens de reactie
- 0,300 mol dm-3
- 0,150 mol dm-3
+ 0,300 mol dm-3
na de reactie
+ 0,033 mol dm-3
+ 0,163 mol dm-3
+ 0,300 mol dm-3
-3
-3
3
[NO2]2 / { [NO]2.[O2] } = K
K = (0,300)2 / { (0,033)2.(0,163) } = 507
4
Kalkwater
5
Koolstofdioxide
6
Reagens
7
Ks = 4,7.10-6 (tabel 46)
8
Stel [Ca2+] = x en dus [OH-] = 2x. Vul de evenwichtsvoorwaarde in:
[Ca2+].[OH-]2 = Ks
4x3 = 4,7.10-6 waaruit volgt dat x = 0,01055 mol L-1
Dus [Ca2+] = 0,011 mol L-1 en [OH-] = 0,021 mol L-1.
9
[Ca(OH)2] = 0,01055 mol L-1
0,01055 mol L-1 x 74,09 g mol-1 = 0,78 g L-1
10
Zie vraag 8 en 9.
Wat je na deze paragraaf moet weten / kunnen:
Bij het molberekeningen kun je bij evenwichten het beste gebruik maken van een
stofbalans.
Bij het rekenen aan een verzadigde zoutoplossing maak je gebruik van het
oplosbaarheidsproduct.
13
Module 3 “Energie en Evenwichten”
Antwoorden
§ 8 – Chemische industrie
1
Scheidingsmethode
Maakt gebruik van
verschil in
Geschikt voor soort mengsel
Filtreren
Deeltjesgrootte
Suspensie
Bezinken, centrifugeren
Dichtheid
Suspensie
Indampen
Kookpunt
Oplossing
Destilleren
Kookpunt
Oplossing of vloeistof mengsel
Extraheren
Oplosbaarheid
Vaste stof mengsel
Adsorptie
Aanhechtingsvermogen
(adhesie)
Geur- , kleur- , smaakstoffen
Chromatografie
Oplosbaarheid en
aanhechtingsvermogen
Geur- , kleur- , smaakstoffen
2
Met “een lage omzettingsgraad” wordt bedoeld, dat weinig beginstof(fen) worden omgezet in
reactieproduct(en). De reactie heeft daardoor een lage opbrengst. Een voorbeeld hiervan is een
evenwichtsreactie, waarbij het evenwicht sterk aan de linker kant ligt.
3
C2H4 (g) + H2O (g) → C2H5OH(g)
4
Alleen het probleem dat het etheen kan zijn verontreinigd met andere gassen. Het is ook niet
nodig dat de katalysator wordt teruggewonnen, want deze zit op een drager. Er ontstaan geen
bijproducten en het ethanol reageert ook niet verder.
5
Een homogeen proces, omdat het alleen om gassen gaat.
6
Een continu proces kan goed. Omdat de katalysator vastzit op een drager, is er geen scheiding
achteraf nodig voor de katalysator. Je moet wel het etheen en het ethanol scheiden om het
etheen te kunnen recirculeren.
7
Etheen heeft een veel lager kookpunt dan ethanol en water, doordat deze beiden wel
waterstofbruggen kunnen vormen en etheen niet. Destillatie is een geschikte methode.
8
9
+
10
Er wordt 40 mol etheen omgezet per uur. Per circulatie wordt er 5 % omgezet: 2 mol etheen dus
én 2 mol water. Er zijn 20 circulaties nodig in één uur om 40 mol te kunnen bereiden.
Dan wordt er 20 x 38 mol = 760 mol etheen via de recirculatielus teruggevoerd naar de reactor.
14
Module 3 “Energie en Evenwichten”
Antwoorden
De verhouding etheen : water = 1 : 0,6. Er is dus slechts 24 mol water aanwezig. Daarvan wordt
bij iedere circulatie 2 mol omgezet. Met 20 circulaties geeft dat 20 x 22 = 440 mol water die
teruggevoerd wordt per uur naar de reactor.
Alle omzettingen en recirculaties kun je ook weergeven in een stofbalans:
reactievergelijking
molverhouding
voor de reactie
5,0% omzetting
na de reactie
20 recirculaties
11
+
12
C2H4(g)
1,0
+ 40 mol
− 2,0 mol
+ 38 mol
+ 760 mol
+
:
H2O(g)
0,6
+ 24 mol
− 2,0 mol
+ 22 mol
+ 440 mol
C2H6O(g)
0,0 mol
+ 2,0 mol
+ 2,0 mol
+ 40 mol
Er wordt 40 mol ethanol gevormd. Er zal dus uiteindelijk ook 40 mol etheen en 40 mol water
omgezet.
Conclusie: er moet 40 mol etheen en 40 mol water worden toegevoegd.
13
14
CH3OH(g) + H2O(g) → 3 H2 (g) + CO2 (g)
CO (g) + H2O(g) → CO2 (g) + H2 (g)
15
hogere snelheid
snellere energie overdracht
veiliger door kleinere hoeveelheden
16
Er wordt geen zuurstof gebruikt, omdat dat ook met het waterstof kan reageren.
17
Nee, aan een blokschema is niet te zien of het om een continu proces of een batchproces gaat.
18
rendement =
praktische opbrengst
x 100%
theoretische opbrengst
(28,00 g / 34,07 g) x 100% = 82,18 %
19
200 kg / 159,7 kg kmol-1 = 1,25 kmol Fe2O3(s)
Fe2O3(s) : 2 Fe(s) = 1 mol : 2 mol
Dus ontstaat 2 x 1,25 = 2,50 kmol Fe
2,50 kmol x 55,85 kg kmol-1 = 140 kg Fe
20
160 ton = 160.103 kg / 159,7 kg kmol-1 = 1,00.103 kmol Fe2O3(s)
Fe2O3(s) : 2 Fe(s) = 1 mol : 2 mol
Dus ontstaat maximaal 2 x 1,00.103 = 2,00.103 kmol Fe
2,00.103 kmol x 55,85 kg kmol-1 = 112.103 kg = 112 ton Fe
Het rendement is dus (90 / 112) x 100% = 80%
15
Module 3 “Energie en Evenwichten”
Antwoorden
Wat je na deze paragraaf moet weten / kunnen:
Bij chemische technologie draait het om het ontwerp en onderhoud van industriële
chemische processen op grote schaal.
Bij een batchproces wordt uitgevoerd zoals in een laboratorium, alleen op grote schaal.
Alles wordt bijeengevoegd in een reactor bij de juiste omstandigheden. Nadat het zoveel
mogelijk heeft gereageerd, wordt het uit de reactor verwijderd en eventueel gezuiverd.
Vervolgens kan men de volgende batch (lading) maken. Toepassing vindt plaats bij kleine
hoeveelheden product in de fijnchemie en farmaceutische industrie.
Bij een continu proces vindt er een constante aanvoer en afvoer van uitgangsstoffen en
producten plaats. De niet gereageerde stoffen worden met een recirculatielus teruggevoerd
naar de reactor. Toepassing vindt plaats bij grote hoeveelheden product.
In een blokschema word het productieproces schematisch weergegeven, waarbij reacties
en/of scheidingen in een blok staan en tussen de blokken met lijnen de stofstromen worden
aangegeven.
In de chemische technologie wordt de 'boekhouding' voor een fabriek bijgehouden in een
massabalans en een energiebalans.
Het rendement van een chemische proces is de praktische opbrengst gedeeld door de
theoretische opbrengt x 100%.
16
Module 3 “Energie en Evenwichten”
Antwoorden
§ 10 – Voorbeeld proefwerkopgaven
1
Proef 3: hoogste verdelingsgraad (poeder) en concentratie (1,0 M).
3
C(s) + H2O(g) → CO(g) + H2(g)
4
De koolstof fijner verdelen, hogere concentratie (of druk) waterdamp, hogere temperatuur,
katalysator toevoegen.
5
energie (J) ►
2 Poeder is fijner verdeeld en heeft daardoor een groter oppervlak. Hierdoor wordt de kans op
effectieve botsingen groter.
CO(g) + H2(g)
▲
│
│
│
│
│ ΔE
│
│
│
│
C(s) + H2O(l) │
6
De reactie is endotherm (er is warmte voor nodig) en om de reactiesnelheid te vergroten.
7
CO(g) + H2(g) + O2(g) → CO2(g) + H2O(l)
8
Watergas is een mengsel van waterstof en koolstofmonooxide. Zowel bij de verbranding van
waterstof als koolstofmonooxide komt warmte vrij: exotherm dus.
9
Voor het maken van synthesegas is waterdamp nodig en bij de verbranding van synthesegas
komt weer water vrij. Als je beide reacties bij elkaar optelt en links en rechts water,
waterstof en koolstofmonooxide wegstreept, blijft alleen de verbranding van koolstof over:
C(s) + H2O(g) → CO(g) + H2(g)
CO(g) + H2(g) + O2(g) → CO2(g) + H2O(l)
C(s) + H2O(g) + CO(g) + H2(g) + O2(g) → CO(g) + H2(g) + CO2(g) + H2O(l)
10
Stikstofmonooxide en stikstofdioxide.
11
De temperatuur is te ver gedaald en de benodigde activeringsenergie te hoog om een
evenwicht te laten instellen.
12
Bij afkoelen ontleedt NO. Dit is dus de exotherme reactie, want bij hogere temperaturen
wordt juist de endotherme reactie bevoordeeld (de vorming van NO).
13
Een (geschikte) katalysator.
14
{ [N2].[O2] } / [NO]2 = K
17
Module 3 “Energie en Evenwichten”
Antwoorden
15
16
Bij een dieselmotor is [O2] groter dan in een benzinemotor. Hierdoor neemt de teller tijdelijk
toe. Om weer tot evenwicht te komen de vorming van NO bevoordeeld worden.
stofbalans
koolstofmonooxide
fosgeen
COCl2(g)
CO(g)
+
chloor
+
Cl2(g)
voor de reactie
+ 0,18 mol L
0
0
tijdens de reactie
- 0,080 mol L-1
+ 0,080 mol L-1
+ 0,080 mol L-1
na de reactie
+ 0,10 mol L-1
+ 0,080 mol L-1
+ 0,080 mol L-1
-1
{ [CO].[Cl2] } / [COCl2] = K
K = { 0,080 x 0,080 } / 0,10 = 0,064
17
Bij verhogen van de druk veranderd K niet (en blijft 0,064).
Gegeven: [Cl2] = 0,123 mol L-1 dus ook [CO] = 0,123 mol L-1
Deze gegevens invullen in de evenwichtsvoorwaarde: K = { 0,123 x 0,123 } / [COCl2] = 0,064
Daaruit volgt [COCl2] = 0,237 mol L-1
18
Bij verkleinen van het volume neemt de druk toe en verschuift het evenwicht naar de kant
met het minste (totaal) aantal deeltjes in de gasfase.
19
Er is 30 g ÷ 174,3 g mol-1 = 0,172 mol K2SO4(s) opgelost in 0,25 L water.
De oplosvergelijking luidt: K2SO4(s) ↔ 2 K+(aq) + SO42-(aq)
Dus [K2SO4] = 0,172 mol / 0,25 L = 0,69 mol L-1.
Vul in [K+] = 1,38 mol L-1 [SO42-] = 0,69 mol L-1:
Ks = [K+]2.[SO42-] = 1,382 x 0,69 = 1,3
20
Waterstofperoxide.
21
2 H2(g) + O2(g) → 2 H2O(l)
22
Ja, want stof X wordt wel gebruikt maar niet verbruikt.
23
bij 1: H2 (en X)
bij 2: H2O
bij 3: H2O en H2O2
bij 4: O2
(1 en 4 kunnen worden verwisseld)
18
Module 3 “Energie en Evenwichten”
Antwoorden
Samenvatting Module 3
1
Reactiesnelheid
Er zijn verschillende mogelijkheden om de reactiesnelheid te definiëren.
Meest gebruikt zijn de volgende eenheden:
het aantal mol van een stof dat per seconde wordt omgezet (mol s-1)
de concentratieverandering van een stof per seconde (mol L-1 s-1)
De reactiesnelheid hangt af van de volgende vijf factoren:
soort stof
temperatuur
concentratie
verdelingsgraad
aanwezigheid van een katalysator
2
Botsende deeltjes model
De reactiesnelheid is afhankelijk van het aantal effectieve botsingen dat per seconde tussen
de deeltjes kan plaatsvinden. Het aantal effectieve botsingen wordt beïnvloed door
concentratie, verdelingsgraad en temperatuur.
3
Reactie energie
Bij iedere reactie treedt een energie effect op: de reactie energie (Δ E).
Bij exotherme reacties heeft Δ E een ‘min’ teken en bij endotherme reacties heeft Δ E een
‘plus’ teken. Informatie over reactie energieën kun je vinden in BINAS tabel 56 en 57.
De benodigde energie om de bindingen van de beginstof(fen) te verbreken noemt men de
activeringsenergie (Eact). Deze energie is nodig om de reactie op gang te brengen. Met behulp
van een katalysator kan de activeringsenergie worden verlaagd. Een katalysator is een stof
die de reactie snelheid vergroot zonder daarbij verbruikt te worden.
Energie effecten van een chemische reactie kun je weergeven in een energie diagram. Hierin
zet je op het beginniveau de formules van de beginstoffen en bij het eindniveau de formules
van de reactieproducten met de coëfficiënten uit de reactievergelijking.
4
Vormingswarmte
De vormingswarmte voor een stof is de reactiewarmte van de vorming van één mol stof uit
de niet-ontleedbare stoffen.
De ontledingswarmte heeft het tegengestelde teken van de vormingswarmte.
De vormings- en ontledingswarmten van niet-ontleedbare stoffen zijn nul.
De vormingswarmten van een aantal stoffen kan je opzoeken in tabel 57.
Met behulp van de vormingswarmte en de wet van behoud van energie kun je de
reactiewarmte uitrekenen (Wet van Hess).
5
Evenwichtsreacties
Sommige reacties zijn omkeerbaar. Wanneer twee omkeerbare reacties gelijktijdig gaan
verlopen spreken we van een evenwichtsreactie. Bij een chemisch evenwicht is de reactie
snelheid naar rechts (s1) gelijk aan de reactie snelheid naar links (s2), oftewel s1 = s2. Bij een
chemisch evenwicht veranderen de concentraties van de stoffen niet en blijven dus constant.
Bij een homogeen evenwicht vindt de reactie in dezelfde fase plaats. Bij een heterogeen
evenwicht zijn de stoffen in meerdere fasen aanwezig.
De ligging van een evenwicht hangt alleen af van de temperatuur. Toevoeren van energie is
in het voordeel van de endotherme reactie. Een evenwicht kan aflopend gemaakt worden
door een stof voor of na de pijl te onttrekken aan het evenwicht.
Een chemisch productie proces kun je weergeven in een blokschema.
6
De evenwichtsvoorwaarde
In de evenwichtstoestand veranderen de concentraties, waardoor ook de concentratiebreuk
een bepaalde constante waarde heeft, de evenwichtsconstante (K). In tabellenboeken kunnen
19
Module 3 “Energie en Evenwichten”
Antwoorden
we de waarden van deze evenwichtsconstanten opzoeken, bijvoorbeeld in de tabellen 46, 47,
49, 50 en 51 van BINAS. De waarde van K (die iets zegt over de ligging van het evenwicht)
hangt alleen af van de temperatuur. Als de waarde van de concentratiebreuk gelijk is aan de
evenwichtsconstante, dan is er sprake van chemisch evenwicht. Deze voorwaarde noemen we
de evenwichtsvoorwaarde.
In de concentratiebreuk staan de concentraties van de stoffen rechts van de pijl in de teller
en de concentraties van de stoffen links van de pijl in de noemer. Verder staan de
coëfficiënten uit de reactievergelijking als exponenten bij de concentraties. In de
concentratiebreuk staan alleen de concentraties van de stoffen, waarvan de concentratie is te
meten, dus met de toestandsaanduiding (g) of (aq). Als je aan een evenwicht stoffen onttrekt
of toevoegt, of als je de druk verandert, moet je met behulp van de concentratiebreuk nagaan
of er nog sprake van evenwicht. Als de concentratiebreuk niet meer gelijk is aan de
evenwichtsconstante, dan is één van de twee reacties in het voordeel.
7
Rekenen aan evenwichten
Bij het molberekeningen kun je bij evenwichten het beste gebruik maken van een stofbalans.
Bij het rekenen aan een verzadigde zoutoplossing maak je gebruik van het
oplosbaarheidsproduct.
8
Chemische industrie
Bij chemische technologie draait het om het ontwerp en onderhoud van industriële chemische
processen op grote schaal.
9
Batch en continu proces
Bij een batchproces wordt uitgevoerd zoals in een laboratorium, alleen op grote schaal. Alles
wordt bijeengevoegd in een reactor bij de juiste omstandigheden. Nadat het zoveel mogelijk
heeft gereageerd, wordt het uit de reactor verwijderd en eventueel gezuiverd. Vervolgens
kan men de volgende batch (lading) maken. Toepassing vindt plaats bij kleine hoeveelheden
product in de fijnchemie en farmaceutische industrie.
Bij een continu proces vindt er een constante aanvoer en afvoer van uitgangsstoffen en
producten plaats. De niet gereageerde stoffen worden met een recirculatielus teruggevoerd
naar de reactor. Toepassing vindt plaats bij grote hoeveelheden product.
10
Blokschema, massabalans, energiebalans en rendement
In een blokschema word het productieproces schematisch weergegeven, waarbij reacties
en/of scheidingen in een blok staan en tussen de blokken met lijnen de stofstromen worden
aangegeven.
In de chemische technologie wordt de 'boekhouding' voor een fabriek bijgehouden in een
massabalans en een energiebalans.
Het rendement van een chemische proces is de praktische opbrengst gedeeld door de
theoretische opbrengt x 100%.
20












