Pharmaceutical Medicine: Examenvragen 2009
1. Het thalidomide drama heeft een enorme invloed gehad op de preklinische en
klinische ontwikkeling van geneesmiddelen evenals op de farmacotherapie in de
dagelijkse praktijk. Bespreek.
Thalidomide, ook bekend onder de merknaam Softenon®, was een totaal nieuw molecule, niet
vergelijkbaar met andere moleculen in de natuur, dat werd ontdekt bij de zoektocht naar een
antihistaminicum. Thalidomide werkte echter niet als antihistaminicum, maar bleek een sedatieve,
anxiolytische en pijnstillende werking te hebben. In eerste opzicht leek dit molecule ongevaarlijk en
vooruitzichten voor verder gebruik en toepassingen waren dan ook veelbelovend. In 1957 werd het
gebruik van Thalidomide voor het eerst goedgekeurd en vooral zwangere vrouwen gebruikten het als
middel tegen ochtendmisselijkheid en andere zwangerschapskwaaltjes. Echter, het gebruik van
thalidomide tijdens de zwangerschap, en dan vooral in de periode tussen dag 35 en 49 na de laatste
menstruatie, zou later dramatische gevolgen hebben, want hoewel thalidomide ongevaarlijk was voor
volwassenen, bleek het uiterst teratogeen voor de ontwikkelende foetus (gebruik van thalidomide
tijdens de zwangerschap resulteerde in focomelie). Toch werd initieel de link niet gelegd tussen
thalidomide en zijn uiterst ernstige gevolgen! Pas na enkele jaren slaagde een Duitse arts erin om het
verband te leggen tussen de misvormde baby’s en het gebruik van thalidomide.
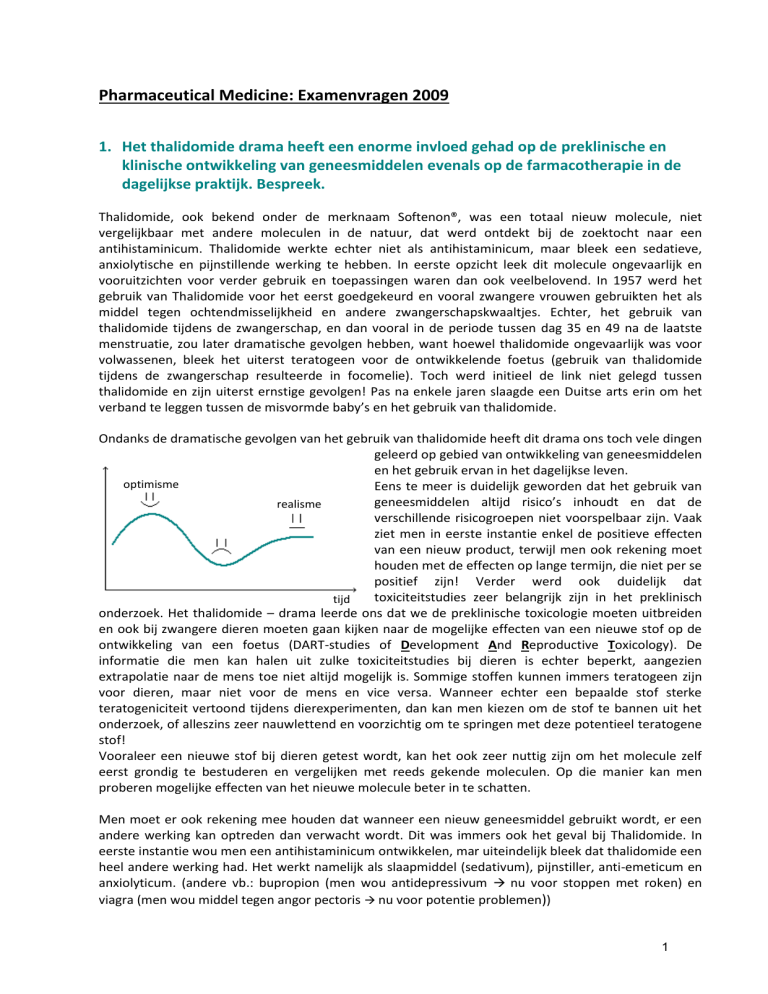
Ondanks de dramatische gevolgen van het gebruik van thalidomide heeft dit drama ons toch vele dingen
geleerd op gebied van ontwikkeling van geneesmiddelen
en het gebruik ervan in het dagelijkse leven.
optimisme
Eens te meer is duidelijk geworden dat het gebruik van
geneesmiddelen altijd risico’s inhoudt en dat de
realisme
verschillende risicogroepen niet voorspelbaar zijn. Vaak
ziet men in eerste instantie enkel de positieve effecten
van een nieuw product, terwijl men ook rekening moet
houden met de effecten op lange termijn, die niet per se
positief zijn! Verder werd ook duidelijk dat
toxiciteitstudies zeer belangrijk zijn in het preklinisch
tijd
onderzoek. Het thalidomide – drama leerde ons dat we de preklinische toxicologie moeten uitbreiden
en ook bij zwangere dieren moeten gaan kijken naar de mogelijke effecten van een nieuwe stof op de
ontwikkeling van een foetus (DART-studies of Development And Reproductive Toxicology). De
informatie die men kan halen uit zulke toxiciteitstudies bij dieren is echter beperkt, aangezien
extrapolatie naar de mens toe niet altijd mogelijk is. Sommige stoffen kunnen immers teratogeen zijn
voor dieren, maar niet voor de mens en vice versa. Wanneer echter een bepaalde stof sterke
teratogeniciteit vertoond tijdens dierexperimenten, dan kan men kiezen om de stof te bannen uit het
onderzoek, of alleszins zeer nauwlettend en voorzichtig om te springen met deze potentieel teratogene
stof!
Vooraleer een nieuwe stof bij dieren getest wordt, kan het ook zeer nuttig zijn om het molecule zelf
eerst grondig te bestuderen en vergelijken met reeds gekende moleculen. Op die manier kan men
proberen mogelijke effecten van het nieuwe molecule beter in te schatten.
Men moet er ook rekening mee houden dat wanneer een nieuw geneesmiddel gebruikt wordt, er een
andere werking kan optreden dan verwacht wordt. Dit was immers ook het geval bij Thalidomide. In
eerste instantie wou men een antihistaminicum ontwikkelen, mar uiteindelijk bleek dat thalidomide een
heel andere werking had. Het werkt namelijk als slaapmiddel (sedativum), pijnstiller, anti-emeticum en
anxiolyticum. (andere vb.: bupropion (men wou antidepressivum nu voor stoppen met roken) en
viagra (men wou middel tegen angor pectoris nu voor potentie problemen))
1
Omdat de potentiële teratogeniciteit en de uiteindelijke werking van een nieuw geneesmiddel alsook de
risicogroepen niet of alleszins moeilijk voorspelbaar zijn, heeft dit ook een aantal gevolgen voor het
uitvoeren van klinische studies. Om nieuwe drama’s zoals met thalidomide te vermijden, is het
belangrijk de personen die deelnemen aan het onderzoek voldoende te informeren over de mogelijke
risico’s en het verloop van de studie. Men spreekt ook wel van een ‘informed consent’, die de patiënt
dan ondertekend in de wetenschap dat hij geen vragen meer heeft en over alle info beschikt over de
studie waaraan hij zal deelnemen. Bovendien wordt aan de proefpersonen/ patiënten ook gevraagd om
zich dubbel te beschermen tegen een mogelijke zwangerschap (vb. condoom + pil).
Het heeft jaren geduurd vooraleer men een verband kon leggen tussen focomelie en thalidomide.
Betere en meer uitgebreide epidemiologische studies kunnen er toe leiden dat in de toekomst sneller
een causaal verband kan gevonden worden tussen het gebruik van een bepaald GM en het voorkomen
van (al dan niet) ernstige neveneffecten.
Bij het voorschrijven of gebruik van een geneesmiddel is het altijd belangrijk rekening te houden met de
risk/benifit – verhouding. Ondanks de ernstige effecten van thalidomide op de ontwikkelende foetus,
wordt deze stof toch nog gebruikt bij een aantal ernstige aandoeningen, oa. bij de ziekte van Kahler, het
syndroom van Behçet (pijnlijke zweren/ aften op mond en genitaliën) en Kaposi’s sarcoma bij AIDS.
2. Bejaarde patiënten zijn een risicopopulatie voor het gebruik van geneesmiddelen.
Bespreek.
Op hoge leeftijd moet niet alleen rekening gehouden worden met grotere verschillen in farmacokinetiek
en farmacodynamiek tussen patiënten onderling, maar ook met comorbiditeit en polyfarmacie
waardoor het risico op interacties en bijwerkingen toeneemt. Bovendien stelt zich het probleem van
langdurige behandelingen, therapietrouw en de mogelijkheid dat neveneffecten verward worden met
ouderdomsverschijnselen (incontinentie, verwardheid, vallen).
* “Aging is the progressive accumulation of more or less random changes.”
* “Aging is the result of time-related loss of functional units…and the disruption of regulatory processes
providing functional integration between cells and organs”.
Als gevolg van de toenemende leeftijd wijzigt de functie van een aantal organen (nefronen, alveoli,
neuronen,…). Dit kan een onmiddellijke weerslag hebben op de farmacokinetiek van bepaalde
geneesmiddelen. Zo is de klaring van geneesmiddelen afgenomen op oudere leeftijd waardoor vaak een
dosisverlaging nodig is. De niermassa (aantal nefronen), de renale doorbloeding en de glomerulaire
filtratiesnelheid nemen af met de leeftijd (daling van de renale klaring). Er wordt meestal wel geen
toename van plasma creatine vastgesteld omdat ook de spiermassa afneemt. De hepatische klaring
neemt ook af met toenemende leeftijd als gevolg van een afname van het levervolume. Daarnaast
treden er ook een aantal veranderingen op die een invloed kunnen hebben op de farmaceutische fase
en de distributie van een geneesmiddel: de productie van maagsap vermindert en de totale hoeveelheid
lichaamswater neemt af wat resulteert in een relatieve toename in lichaamsvet. Dit alles resulteert in
een aantal veranderen voor belangrijke farmacokinetische parameters.
-
Biologische beschikbaarheid: veroudering gaat meestal gepaard met een afgenomen First-pass
metabolisme en dus een toename in biologische beschikbaarheid van hoge extractie
geneesmiddelen (vb. propranolol, lidocaïne). De (First-pass) activatie van prodrugs is vertraagd
(vb. ACE – inhibitoren).
2
-
-
-
Distributie: polaire geneesmiddelen (kleine partitiecoefficiënt) hebben de neiging om bij
ouderen een kleiner distributievolume te bereiken dan op jonge leeftijd (vb. gentamycine,
digoxine, ethanol). Daardoor is het soms nodig de oplaaddosis te verlagen. Omdat parallel met
een afname in het distributievolume ook de klaring is afgenomen, heeft dit meestal geen of
weinig invloed op de terminale halfwaardetijd.
Voor apolaire geneesmiddelen echter is het distributievolume vaak toegenomen op hogere
leeftijd. Hierdoor zal ook de halfwaardetijd toenemen.
(t1/2 = 0,693 x Vd /Cl)
Renale klaring: een afname van de nierfunctie vertaalt zich in een afgenomen renale klaring van
goed wateroplosbare geneesmiddelen (vb. aminoglycoside antibiotica, diuretica, NSAIDs,
lithium). Voor geneesmiddelen met een smal therapeutisch venster moet hiermee rekening
gehouden worden.
Nierinsufficiëntie heeft dus ook een ongunstig effect op de metabole klaring.
Hepatische klaring: de afname van de leverdoorbloeding zal vooral geneesmiddelen met een
hoge extractieratio beïnvloeden omdat hun metabole klaring perfusie gelimiteerd is.
Cllever = doorbloeding (Q) x extractie ratio (ER) als Q daalt, daalt Cllever meer
uitgesproken bij hoge ER! (leverfunctie daalt bilirubine en AST/ALT neemt toe)
Op farmacodynamisch vlak stelt men vast dat voor meerdere klassen van geneesmiddelen de
gevoeligheid voor geneesmiddelen bij ouderen toegenomen is. Dit is vooral opvallend voor farmaca met
centraal deprimerende effecten, anticholinerge effecten en antihypertensiva of meer bepaald vooral
voor middelen die inwerken op het centraal zenuwstelsel en het cardiovasculair systeem (vb.
benzodiazepinen en antihypertensiva verminderde reflex en homeostase mechanismen)
Algemene raadgevingen bij het voorschrijven van geneesmiddelen aan ouderen:
- Start met een lage dosis (helft van normale volwassen dosis) en verhoog de dosis langzaam op
basis van klinisch beeld (start low, gow slow).
- Gebruik een eenvoudige behandeling met een zo klein mogelijk aantal verschillende medicijnen
(vermijd over- en onderbehandeling polyfarmacie)
- Schenk extra aandacht aan de informatie voor de patiënt en/of zijn omgeving over het correct
gebruik van geneesmiddelen
- Het verminderen of stoppen van medicijnen bij de bejaarde kan soms wonderbaarlijke effecten
hebben en ‘onverklaarbare ziektebeelden’ doen opklaren.
3. Geneesmiddelen, zwangerschap en lactatie: bespreek.
Thalidomide geboortedefect: FOCOMELIE
Kan veroorzaakt worden door:
- erfelijke of genetische afwijkingen (syndroom van Noonan)
- gebruik van geneesmiddelen
- virale infecties (teratogene virussen)
- invloed van GM op fertiliteit
Reeds voor de conceptie dient men rekening te houden met de mogelijks nadelige effecten van
geneesmiddelen en dit zowel bij man als vrouw. Hierbij is zowel irreversibele schade aan eicellen en/of
zaadcellen ten gevolge van cytostatica als het optreden van reversiebele ongewenste effecten
(verminderde spermatogenese bij inname salazopyrine (= NSAID)) mogelijk.
Tijdens zwangerschap en lactatie stellen zich drie essentiële vragen met betrekking tot gebruik van
geneesmiddelen:
1. Wat is het effect van het geneesmiddel op de foetus?
2. Wat zijn de gevolgen van het geneesmiddel op de neonaat?
3. Wat zijn de gevolgen voor de productie van moedermelk?
3
Effect van geneesmiddel op de foetus/neonaat? Zwangerschap: blastogenese, embryogenese en
foetogenese.
Wanneer een moeder tijdens haar zwangerschap geneesmiddelen gebruikt, bereiken deze in min of
meerdere mate de foetus. Vanaf de aanleg van de placenta dienen de geneesmiddelen immers slechts
deze lipidenmembraan te passeren. De effecten op de foetus worden bepaald door de aard van het
middel, het tijdstip van inname tijdens de zwangerschap en de concentratie ervan in de foetale
weefsels.
Tijdens de blastogenese (week 1-2) is er virtueel geen contact tussen moeder (en wat ze inneemt) en
kind. Dit is dus een +/- veilige periode (gelukkig, want men weet niet meteen dat men zwanger is).
Tijdens de embryogenese of organogenese (week 2-12) echter is het embryo zeer gevoelig voor de
teratogene effecten van geneesmiddelen. Dit trimester is cruciaal en het beste is om gewoon geen
geneesmiddelen te gebruiken. Soms is dit echter niet mogelijk, vb. als de mama lijdt aan ernstige
epilepsie – aanvallen. Men zal in dit geval de medicijnen laten doornemen, omdat het risico op een
epilepsie – aanval (die mss meer schade toebrengt dan het GM) anders te groot is. In dergelijke gevallen
moet men steeds de voor- en nadelen afwegen (risk/benefit - ratio).
Tijdens de foetogenese (de verdere groei van de foetus) blijft het CZS gevoelig voor xenobiotica. Het
gebruik van geneesmiddelen kan dus ook best nu nog beperkt worden tot het minimum. Sommige
medicijnen die de mama neemt, kunnen immers nog steeds migreren naar de baby via passieve diffusie
en op die manier ook bij de baby hun werking uitvoeren. (denk aan ACE – inhibitoren verminderde
vruchtwaterproductie groei en ontwikkeling beperkt of aan vroegtijdig sluiten ductus botalli door
NSAIDs (kunnen ook aanleiding geven tot bloedingen bij moeder, foetus en neonaat))
Het voorspellen van teratogeniciteit van geneesmiddelen via diererxperimenteel onderzoek is vrijwel
onmogelijk. Thalidomide bijvoorbeeld is bij de mens al teratogeen bij lage dosering terwijl het deze
effecten niet heeft bij muizen of ratten, wel bij primaten. Omgekeerd zijn corticosteroïden teratogeen
bij dieren, terwijl deze effecten bij de mens niet overtuigend beschreven worden. Een bijkomend,
complicerend fenomeen is de vaststelling dat teratogene effecten pas tot uiting komen jaren na de
blootstelling zoals het geval is voor DES (Diethylstilboestrol). DES is een synthetisch oestrogeen en het
zou abortus, miskramen en premature bevallingen voorkomen. Daarom wilde men het profylactisch
toedienen bij elke zwangerschap. Later zag men echter dat vrouwen die geboren werden na het gebruik
van DES door de mama op jong volwassen leeftijd (18-20 jaar) cervix - kanker ontwikkelden.
Geneesmiddelen zullen bijgevolg slechts op strikt indicatie gebruikt worden tijdens de zwangerschap en
bij potentieel zwangere vrouwen. Soms zijn de gevaren voor de moeder, indien geen geneesmiddel
gebruikt wordt, groter dan de risico’s van blootstelling voor de foetus, zodat behandeling noodzakelijk is
(vb. ernstige epilepsie bij mama).
Op basis van klinische ervaringsgegevens (in combinatie met dierexperimenteel onderzoek) werd in
Zweden een classificatiesysteem opgesteld dat moet toelaten een verantwoorde therapiekeuze te
maken tijdens de zwangerschap. In deze classificatie worden 4 zwangerschapscategorieën gedefinieerd,
4
gaande van categorie A (verondersteld veilig) tot categorie D (met zekerheid schadelijk). Een
geneesmiddel uit categorie D is niet noodzakelijk absoluut gecontraïndiceerd tijdens de zwangerschap
indien geen alternatieven bestaan (vb. anti-epileptica). Men kan ook gebruik maken van het
Amerikaanse FDA classificatiesysteem:
United States FDA Pharmaceutical Pregnancy Categories
Adequate and well-controlled studies have failed to demonstrate a risk to the fetus
Pregnancy
in the first trimester of pregnancy (and there is no evidence of risk in later
Category A
trimesters).
Animal reproduction studies have failed to demonstrate a risk to the fetus and there
Pregnancy are no adequate and well-controlled studies in pregnant women OR Animal studies
Category B have shown an adverse effect, but adequate and well-controlled studies in pregnant
women have failed to demonstrate a risk to the fetus in any trimester.
Animal reproduction studies have shown an adverse effect on the fetus and there
Pregnancy
are no adequate and well-controlled studies in humans, but potential benefits may
Category C
warrant use of the drug in pregnant women despite potential risks.
There is positive evidence of human fetal risk based on adverse reaction data from
Pregnancy
investigational or marketing experience or studies in humans, but potential benefits
Category D
may warrant use of the drug in pregnant women despite potential risks.
Studies in animals or humans have demonstrated fetal abnormalities and/or there is
Pregnancy positive evidence of human fetal risk based on adverse reaction data from
Category X investigational or marketing experience, and the risks involved in use of the drug in
pregnant women clearly outweigh potential benefits.
Wat zijn de gevolgen voor de productie van moedermelk?
De meeste medicijnen die door de moeder worden ingenomen, bereiken via passieve diffusie in min of
meerdere mate de moedermelk. De hoeveelheid hiervan die uiteindelijk bij de baby terechtkomt, is
echter beperkt en meestal klinisch niet relevant. Slechts een beperkt aantal geneesmiddelen komt in
voldoende hoge concentraties in de moedermelk en kan daardoor ongunstige effecten veroorzaken bij
de baby. Er bestaat een Zweeds classificatiesysteem (op basis van de mate waarin geneesmiddelen in de
moedermelk worden teruggevonden) waarbij geneesmiddelen ingedeeld zijn in lactatiecategorieën,
gaande van categorie I (geen overdracht in de moedermelk) tot categorie III (overdracht in de
moedermelk met mogelijk effect op het kind). Voor producten van categorie IV ontbreekt de nodige
informatie.
Sommige medicijnen kunnen daarnaast ook een remmend effect hebben op de melkproductie en
dienen daarom ook vermeden te worden (vb. oestrogenen, bromocryptine en diuretica). [daarom enkel
minipil met progestagenen als contraceptie tijdens lactatieperiode]
Praktische tips voor het gebruik van geneesmiddelen tijdens zwangerschap en lactatie:
1. uitsluitend indien het nut voor de moeder > dan het risico voor de foetus/neonaat
- behandel zo mogelijk lokaal
- indien systemische behandeling noodzakelijk is, gebruik dan bij voorkeur erkend veilige
middelen voor foetus en neonaat (cf. classificatiesystemen)
5
4. Farmacokinetiek: bespreek de berekening / meting van de farmacokinetische
parameters van een geneesmiddel uitgaande van een compartimentonafhankelijke
benadering.
De farmacokinetiek beschrijft de wetmatigheden van het concentratieverloop van een farmacon in het
lichaam als functie van de tijd. Dit concentratieverloop is het resultaat van het deels gelijktijdig, deels
consecutief optreden van Absorptie, Distributie, Metabolisme en Excretie (ADME). Aan de hand van het
plasmaconcentratieverloop van het geneesmiddel, kunnen vervolgens een aantal farmacokinetische
parameters berekend worden. In de praktijk gaat men echter geen beroep doen op de theoretische
(wiskundige) beschrijving van het plasmaconcentratieverloop, maar wordt gebruik gemaakt van de
zogenaamde concentratieonafhankelijke formules om deze farmacokinetische parameters te berekenen
(niet – compartimentele farmacokinetische analyse). Hierbij wordt uitsluitend rekening gehouden met
het laatste deel van de concentratie – tijd curve. Het aantal compartimenten en de precieze wiskundige
beschrijving van de concentratie als functie van de tijd heeft hierbij geen belang. Voor de berekeningen
wordt in dit geval gebruik gemaakt van de geschatte blootstelling (AUC). Men gaat als volgt te werk:
- meet op vaste tijden na medicijn toediening de plasmaconcentraties;
- zet de resultaten semilogaritmisch uit en bepaal, bij extravasculaire toediening, de visu (
gevolg van ‘direct zicht’) Tmax en Cmax..
- het terminale deel van de semilogaritmische plasmaconcentratiecurve heeft meestal een lineair
verloop wat overeenstemt met de terminale eliminatiefase. Bereken met behulp van een
lineaire regressieanalyse voor de terminale eliminatiefase de best passende bijhorende rechte;
uit de richtingscoëfficiënt van deze rechte (-β/2,303) wordt β berekend en kan vervolgens de
terminale eliminatiehalfwaardetijd t1/2 (t1/2z) bepaald worden uit: t1/2 = 0,693/ β.
- bereken met de trapeziumregel de AUC (al dan niet tot oneindig) als maat voor de biologische
beschikbaarheid (blootstelling aan het product).
- bereken met behulp van AUC de (schijnbare) lichaamsklaring = Cllichaam/F = D/AUC0∞
- met kennis van de klaring en β volgt het distributievolume: Vd = Cl/ β
Deze methode laat toe om na de eenmalige inname van een medicijn (intra- of extra-vasculair) op een
eenvoudige wijze een zeer goede benadering te bekomen van de meest essentiële parameters.
Uitzonderlijk doet zich een “flip-flop”-situatie voor waarbij de absorptiefase zeer langzaam verloopt en
aansleept in de eliminatiefase; in dit geval is de compartiment onafhankelijke benadering na
extravasculaire inname niet correct.
6
5. De farmacokinetiek van geneesmiddelen kan grondig verschillen tussen kinderen
en volwassenen: bespreek de factoren die bijdragen tot deze verschillen .
“Pasgeborenen zijn geen kleine kinderen, kinderen geen minivolwassenen”
Kinderen zijn geen kleine volwassenen. Zowel op gebied van farmacokinetiek als op gebied van
farmacodynamiek zijn er duidelijke verschillen tussen beide groepen. Een bepaalde ziekte kent bij
kinderen vaak een ander verloop dan bij volwassenen (de ziekte kan hetzelfde zijn, maar de
onderliggende pathofysiologie kan verschillen). Daardoor is er meestal een aangepaste behandeling
nodig. Een geneesmiddel dat werkt bij volwassen werkt immers niet altijd per se bij kinderen. (vb.
chloramphenicol werkt goed bij volwassenen mar is toxisch voor kinderen omdat ze dit niet kunnen
afbreken (leidt tot cardiovasculaire collaps))
De combinatie van ADME bepaalt de expositie en dus het tijd/concentratie profiel (= farmacokinetiek).
De expositie in combinatie met de interactie ter hoogte van het therapeutisch target (receptor) bepaalt
de concentratie/effect relatie (= farmacodynamiek).
De farmacokinetiek van geneesmiddelen bij neonaten is om meerdere redenen verschillend van deze bij
volwassenen. De lichaamssamenstelling is immers leeftijdsgebonden. De proporties veranderen
drastisch van kind volwassene:
- Een kind heeft groot hoofd, relatief grote romp en kleine ledematen
- Een volwassene heeft eerder een klein hoofd en grotere romp en ledematen. Daarnaast zal een
toegenomen hoeveelheid lichaamswater (75% bij de voldragen neonaat, 85% bij de prematuur)
en verminderde proteïnebinding resulteren in een gewijzigde distributie van geneesmiddelen.
De lichaamssamenstelling zal in functie van de leeftijd veranderen (figuur links):
Totaal lichaamswater ↓
Extracellulair water ↓
Vet: ↑ met maximum op 9 maand en dan ↓ met minimum op 20 jaar en dan terug ↑
Vd lipofiel GM: heel snel verdoofd + snel weer ontwaken (denken aan lokale anesthetica die door de
membranen willen gaan = lipofiel).
Vd hydrofiele GM (Paracetamol): Oplaaddosis nodig voor kinderen. (figuur rechts)
7
De lage metabole capaciteit van de lever en de beperkte glomulaire filtratie (30-40% van deze van een
volwassene) bieden dan weer een verklaring voor de langere halfwaardetijden en een verminderde
klaring van de meeste geneesmiddelen. Bovendien is de gevoeligheid voor tal van medicijnen
(uitgedrukt in mg/kg) bij neonaten groter dan bij volwassenen, zodat doseringsschema’s grondig dienen
aangepast te worden.
Tijdens de verdere ontwikkeling en groei van de neonaat, zal ook het biotransformatiesysteem verder
ontwikkelen. Een pasgeboren baby zal daarom slechts 1/20 van de dosis van een volwassene nodig
hebben, terwijl dit op 12 maanden al ¼ van de dosis is.
GM metabolisatie:
GM minder wateroplosbaar Makkelijker reabsorberen in nieren
Door de fase-reacties geneesmiddel meer wateroplosbaar:
- fase I: afbraak en aanpassen GM zodat meer wateroplosbaar (meestal)
- fase II: conjugatie, nog meer wateroplosbaar maken
GM Biotransformatie
GM
Fase I
Metaboliet
Fase II
CYP’s
UGTs
Esterases
NATs
Dehydrogenases
STs
Metaboliet
MEER
H20oplosbaar
MTs
CYP3A7 – CYP3A4
switch
GSTs
Ontogenese = leeftijdsgebonden rijping
Allometrie = biologische wet; Verband gewicht/metabole activiteit
Principe: Hoe kleiner het organisme, hoe hoger de nood (olifant vs. muis)
Metabolisme = rijping + (allometrisch) gewicht
Tijdens de maturatie van het biotransformatiesysteem zal de expressie van CYP3A7 afnemen, terwijl de
expressie van CYP3A4 zal toenemen. Deze switch kan aangetoond worden door de concentratie van een
metaboliet (gevormd door CYP3A4 na te gaan in de urine Hoeveel vind je terug in urine: metaboliet
CYP3A4 ↑ progressief).
De klaring van geneesmiddelen stijgt fors de eerste 40 weken (omdat tijdens deze periode de [CYPs] snel
toeneemt), daarna zien we een lichte afname
Tenslotte is er ook nog de inter-individuele variabiliteit waarmee men dient rekening te houden. Het
biotransformatiesysteem is niet voor iedereen 100% gelijk. Er zijn typische genetische verschillen tussen
verschillende individuen en men spreekt ook wel van polymorfismen. Deze verschillen uiten zich in een
snellere of tragere verwerking van geneesmiddelen en men spreekt daarbij ook wel van slow of fast
metabolizers. Een ultra-slow metabolisme kan je direct herkennen omdat dit ver onder de normale
curve ligt, maar een ultra-fast metabolisme kan je nog niet herkennen want de metabolisering ligt al
hoog bij alle kinderen.
Deze polymorfismen zijn vaak ook al bij of voor de neonaat van belang:
Vb. CYP2D6 ultra-fast polymorfisme: intoxicatie met codeïne door snelle omzetting naar morfine
neveneffecten (apnoe) Moeder = fast metabolizer behandelen met codeïne snel hoge [morfine]
morfine ook in moedermelk baby drinkt dus ook morfine heeft nog geen capaciteit om morfine
te metaboliseren omdat geen glucuronidering mogelijk is opstapeling van morfine in baby baby †.
1e levensjaar (en ouder) rekening houden met genetica, aandoeningen en gewicht!
8
Renale excretie:
GFR/ leeftijd↑
- Gem. druk volwassene = 100mmHg vs. kind = 40mmHg compensatiemechanismen nodig
afferente vasoconstrictoren ↑ (PGE2, PGI2); vasodilatoren ↑ en efferente vasoconstrictoren
↑↑ geneesmiddelen die deze compensatiemechanismen beïnvloeden problemen
(nefrotoxiciteit); vb. met COX2-inhibitor, ACE-inhibitoren en NSAIDs (syndroom van Reye)
Terwijl de renale excretiecapaciteit rond de leeftijd van 6 maanden vergelijkbaar is met deze van de
volwassene, is bij jonge kinderen vaak de metabole capaciteit van de lever toegenomen. Bijgevolg
stellen we vast dat kinderen soms grotere dosissen nodig hebben dan volwassenen (vb. digoxine). Voor
antihistaminica en benzodiazepinen daarentegen blijkt de gevoeligheid voor toxische effecten verhoogd
te zijn bij kinderen, wat kan leiden tot paradoxale agressiviteit.
Tot de leeftijd van 5 jaar verkiest men eerder een vloeibare toedieningsvorm. Geneesmiddelen met
vieze smaak worden best met een lekkere drank toegediend (niet met voedsel). Het mag echter niet de
bedoeling zijn toxische farmaca al te aantrekkelijk te maken. Naast de orale route is er ook nog de
rectale route. Hierbij is er echter meer variabiliteit in de biologische beschikbaarheid van het
geneesmiddel dan wanneer men het oraal toedient. Met betrekking tot therapietrouw neemt de rol van
de ouders af en deze van het kind toe gaande van de neonaat naar de adolescent.
[op letten voor lange termijn effecten;
- cerebral palsy spasticiteit van de darmen in het latere leven door dexamethason
- anesthetica neuro-apoptose]
Mede omwille van het feit dat bij kinderen om ethische redenen weinig geneesmiddelenonderzoek kan
verricht worden is het bepalen van de juiste dosering vaak geen eenvoudige opdracht. Vanuit praktisch
standpunt zijn er drie mogelijkheden:
- de kinderdosering is bekend: bij voorkeur wordt gebruik gemaakt van standaard tekstboeken
voor pediatrie om de dosis in functie van de leeftijd op te zoeken.
- het medicijn is formeel tegenaangewezen bij kinderen: sommige geneesmiddelen mogen niet
aan kinderen gegeven worden (vb. tetracyclines en quinolonen).
- informatie over het gebruik bij kinderen is niet beschikbaar en er bestaat geen formele contraindicatie: in dit geval is een dosering per lichaamsoppervlakte de beste maat.
6. Het metabolisme van geneesmiddelen (biotransformatie) is afhankelijk van een
aantal covariabelen. Bespreek deze covariabelen (geef voorbeelden).
GM metabolisatie:
GM minder wateroplosbaar Makkelijker reabsorberen in nieren
Door de fase-reacties geneesmiddel meer wateroplosbaar:
- fase I: afbraak en aanpassen GM zodat meer wateroplosbaar (meestal)
- fase II:
conjugatie,
nog meer wateroplosbaar maken
GM
Biotransformatie
GM
Fase I
Metaboliet
Fase II
CYP’s
UGTs
Esterases
NATs
Dehydrogenases
STs
MTs
GSTs
Metaboliet
MEER
H20oplosbaar
CYP3A7 – CYP3A4
switch
9
Ontogenese = leeftijdsgebonden rijping
Allometrie = biologische wet; Verband gewicht/metabole activiteit
Principe: Hoe kleiner het organisme, hoe hoger de nood (olifant vs. muis)
Metabolisme = rijping + (allometrisch) gewicht
Tijdens de maturatie van het biotransformatiesysteem zal de expressie van CYP3A7 afnemen, terwijl de
expressie van CYP3A4 zal toenemen. Deze switch kan aangetoond worden door de concentratie van een
metaboliet (gevormd door CYP3A4 na te gaan in de urine Hoeveel vind je terug in urine: metaboliet
CYP3A4 ↑ progressief).
De klaring van geneesmiddelen stijgt fors de eerste 40 weken (omdat tijdens deze periode de [CYPs] snel
toeneemt), daarna zien we een lichte afname
Tenslotte is er ook nog de inter-individuele variabiliteit waarmee men dient rekening te houden. Het
biotransformatiesysteem is niet voor iedereen 100% gelijk. Er zijn typische genetische verschillen tussen
verschillende individuen en men spreekt ook wel van polymorfismen. Deze verschillen uiten zich in een
snellere of tragere verwerking van geneesmiddelen en men spreekt daarbij ook wel van slow of fast
metabolizers. Een ultra-slow metabolisme kan je direct herkennen omdat dit ver onder de normale
curve ligt, maar een ultra-fast metabolisme kan je nog niet herkennen want de metabolisering ligt al
hoog bij alle kinderen.
Deze polymorfismen zijn vaak ook al bij of voor de neonaat van belang:
- Vb. CYP2D6 ultra-fast polymorfisme: intoxicatie met codeïne door snelle omzetting naar
morfine neveneffecten (apnoe)
Moeder = fast metabolizer behandelen met codeïne snel hoge [morfine] morfine ook
in moedermelk baby drinkt dus ook morfine heeft nog geen capaciteit om morfine te
metaboliseren omdat geen glucuronidering mogelijk is opstapeling van morfine in baby
baby †.
1e levensjaar (en ouder) rekening houden met genetica, aandoeningen en gewicht!
7. Wat is het doel van de Europese Wetgeving die verplicht om een Pediatrisch
Ontwikkelingsplan voor te stellen voor nieuwe geneesmiddelen: the Pediatric
Investigational Plan (PIP)?
Het ‘Pediatric Investigational Plan’ is:
- Een nieuwe Europese richtlijn ivm geneesmiddelenonderzoek bij kinderen
- Geïntroduceerd door de Europese Commissie
- Sinds 26 januari 2007 in EU van toepassing
- Farmaceutische bedrijven moeten een PIP indienen bij het pediatrisch comité van de EMEA op
het einde van fase I (worden beloond voor dit extra werk + kosten 6 maanden patentextensie
als ze goed onderzoek doen bij kinderen)
- Aantonen geen neveneffecten bij kinderen door andere data + door zelf onderzoek te doen om
te bewijzen
Het doel van het PIP is:
- De ontwikkeling en beschikbaarheid van GM voor kinderen van 0-17 jaar vergemakkelijken
- Verzekeren dat GM voor gebruik in kinderen van hoge kwaliteit zijn en ethisch onderzocht
werden
- Beschikbaarheid van info over het gebruik van GM bij kinderen verbeteren
Het PIP houdt niet in dat:
- Men kinderen onnodig gaat laten deelnemen in klinisch onderzoek (vb. bepaalde antibiotica die
gelijk zijn; niet te veel kinderen onnodig onderwerpen aan testen)
10
-
De toewijzing van GM voor volwassenen wordt uitgesteld
8. Wat is het doel van de niet-klinische / pre-klinische veiligheidsevaluatie van
geneesmiddelen (cf. ICH guideline M3)?
[ algemene principes toxicologie:
-
inzicht verwerven in causaal verband tussen blootstelling en (toxisch) effect
onderzoek naar de mechanismen die ongewenst/ongunstig effect veroorzaken in biologische
systemen (mens en dier) na blootstelling aan de chemische stof
- Risk/benefit evaluatie (farmaceutische toxicologie)
Toxisch effect (respons) =
- (niet lethale) schadelijke effecten
▪ Reversibel
▪ Irreversibel
- Dood (of tijd tussen toediening en dood)
Bepaling van dosis waarden waarbij:
- helft van de organismen (schadelijk) effect ondervindt: TD50
- helft van de organismen sterf: LD50
De goedkeuring voor commmercialisering op basis van volledig registratiedossier is ultieme doelstelling
van het geneesmiddelenonderzoek. Deze goedkeuring is uiteindelijk gebaseerd op de risk/benefit ratio.
* Benefit = doeltreffendheid (farmacologie)
Levensreddend of niet?
Indicatie-afhankelijk
* Risk = nevenwerkingen, toxiciteit
Innovatief?
Komt neer op de evaluatie van de veiligheid van het kandidaat geneesmiddel (= pre-klinische
veiligheidsevaluatie) ]
Richtlijnen voor de farmaceutische industrie:
“Guidance on nonclinical safety studies for the conduct of human clinical trials and marketing
authorization for pharmaceuticals – M3 (R2) Guideline (July 15, 2008)”
ICH M3: International Conference on Harmonisation guideline M3
Doelstellingen van de niet-klinische veiligheidsevaluatie (ICH M3):
- algemene begeleiding van geneesmiddelen ontwikkeling
- harmonisatie van richtlijnen voor niet-klinisch onderzoek
11
-
karakterisering van toxisch effecten met betrekking tot:
▪ doelorganen (‘target organs’)
▪ dosisafhankelijkheid
▪ verband met blootstelling
▪ mogelijke reversibiliteit van het effect
Deze informatie is van belang bij:
- bepaling veilige startdosis en dosisbereik voor klinische studies
- identificatie van parameters voor klinische monitoring en mogelijke nevenwerkingen
Preklinische toxicologie:
Veiligheid van een (kandidaat-) geneesmiddel documenteren
Risk/benefit – verhouding evalueren
FIH – dosis bepalen
Doelwitorganen bepalen
Preklinische farmacokinetiek (toxicokinetiek):
Toxiciteit/Doeltreffendheid begrijpen + link met blootstelling
Inzicht in mechanismen (vb. reactieve metabolieten)
Blootstelling aan geneesmiddel en metabolieten aantonen/valideren
9. Geef een overzicht van de niet-klinische veiligheidsstudies die uitgevoerd moeten
worden ter voorbereiding van klinische studies met nieuwe geneesmiddelen (cf.
ICH guideline M3).
[Toxiciteit is complex en multifactorieel. Factoren die een rol spelen bij toxiciteit zijn:
- de dosis
- de toedieningsweg en –vorm
- het geneesmiddel zelf en/of de metabolieten.
Verder kunnen we een onderscheid maken tussen doelwitorgaan en doelwitweefsel en systemische
toxiciteit en tussen chronische of acute toxiciteit.
Ondersteunde gegevens:
- CMC of Chemistry, Manufacturing and Controls
- Fysische, chemische en biologische eigenschappen van het testmateriaal moeten gevrijwaard
blijven gedurende de volledige evaluatiecyclus (formulering kan immers een belangrijke invloed
hebben op de resultaten van toxiciteitstudies)
- GLP goedkeuring voor de stof is meestal nodig voor toxiciteitstudies
12
Gegevens van vroege farmacokinetiekstudies zijn noodzakelijk voor een relevant ontwerp van de
latere toxiciteitstudies. Er is op z’n minst nood aan de AUC (Area Under the Curve) – waarde en
andere farmacokinetische parameters (zoals de Cmax en Tmax) die bekomen werden na
enkelvoudige en herhaalde toediening voor dosisbereik.
- Toxicokinetiek uit toxiciteitstudies
Het ontwerp van een toxiciteitstudie is grotendeels afhankelijk van het ontwerp van de klinische studie.
Aangepaste timing van de toxiciteitstudie ten opzichte van de plannen voor de klinische studie is
cruciaal! Daarnaast moet men ook steeds rekening houden met ICH richtlijnen en richtlijnen van de FDA,
EMEA, … .]
-
Er zijn richtlijnen in verband met het ontwerp van toxiciteitstudies die uitgevaardigd worden door FDA,
EMEA of… en internationale richtlijnen die uitgevaardigd worden door het ICH.
Toxiciteitstudie-protocols dienen op case-by-case basis rekening te houden met:
- andere studies die in parallel lopen en waaruit kritische informatie naar voren komt oa. op vlak
van farmacokinetiek, farmacodynamiek, CMC, …
- bestaande literatuur, ook aangaande andere geneesmiddelen uit dezelfde klasse
Klassificatie van niet-kinische veiligheidsstudies:
ﻫ
Safety pharmacology:
“Safety pharmacology studies are defined as those studies that investigate the potential
undesirable pharmacodynamic effects of a substance in physiological functions in relation to
exposure in the therapeutic range or above.”
Bestudeert effecten op cardiovasculair, respiratoir en neurologisch (CZS) gebied. Safety
pharmacology dient uitgevoerd te worden alvorens blootstelling in de mens!
ﻫ
Acute toxiciteit:
Vroeger single dose studies in 2 species (parenterale en klinische toedieningsweg)
Vandaag meestal maximum getolereerde dosis (MTD) bepalen aan de hand van dose
escalation studies en korte termijn dose ranging studies.
ﻫ
Repeated dose toxicity
Ter ondersteuning van klinische trials: gecontroleerde omstandigheden bij toediening van
het geneesmiddel (minder uitgebreid pakket van toxiciteitstudies). De aanbevolen duur hangt af
van de duur, therapeutische indicatie en omvang van de klinische trial.
Ter ondersteuning van introductie in de markt: relatief ongecontroleerde omstandigheden
bij gebruik van het geneesmiddel (strengere eisen). De aanbevolen duur hangt af van de duur,
therapeutische indicatie en omvang van de klinische trial.
13
ﻫ
Lokale tolerantie: Maakt deel uit van de normale toxiciteitstudies.
ﻫ
Subchronishe toxiciteitstudies:
Deze duren typisch 90 dagen en ze hebben in de eerste plaats als doel de NOAEL (No
Observable Adverse Effect Level) en LOAEL (Lowest Observable Adverse Effect Level) te bepalen.
Daarnaast probeert men hiermee ook de target organen te identificeren en een uiteindelijke
toedieningsweg te bepalen voor patiënten. Meestal worden ratten of honden als
proefdiermodel gebruikt (cf. richtlijnen). Voorafgaand aan de subchronische toxiciteitstudie,
worden zogenaamde dose-range-finding studies gedaan (vb. 14 dagen – 1 maand). De
uiteindelijke dosis selectie gebeurt als volgt:
▪ Hoogste dosis: toxische dosis
▪ Midden dosis: marginale toxiciteit of LOAEL
▪ Laagste dosis: NOEL/NOAEL
Op basis hiervan kunnen dan vervolgens beslissingen genomen worden voor dosissen (vb. MTD)
in langdurige (vb. carcinogeniciteit-) studies. Zo wordt bijvoorbeeld de First In Human (FIH) –
dosis bepaald aan de hand van niet-klinische gegevens: de farmacologische dosis-respons, het
farmacologisch/toxicologisch profiel en de farmacokinetiek. De NOAEL (gebaseerd op klinische
studies in het meest relevante en gevoelige dierspecies) is vaak bepalend hierbij. Een alternatief
is MABEL (Minimally Active Biological Effect Level) en ook veiligheidsmarges dienen in acht
genomen te worden.
ﻫ
Genotoxiciteit:
Het doel van deze studies is het detecteren van stoffen die genetische schade veroorzaken,
ongeacht het onderliggende mechanisme. Hieronder verstaat men blijvende DNA schade onder de
vorm van genmutaties, chromosomale schade of recombinatie. De mogelijke impact situeert zich op
2 niveaus: erfelijke effecten of kwaadaardige celgroei (‘malignancies’). Stoffen die positief testen in
deze studies zijn potentieel carcinogeen en/of mutageen in de mens. Voorbeelden zijn:
- Single Dose Clinical Trial assay voor genmutatie
- Multiple Dose Clinical Trial “two batteries of tests, option 1 and 2 described in ICHS2. Each
option includes at least one in vivo genotox test”
- Ames test stoffen die mutageen zijn in deze test, zijn meestal carcinogeen in knaagdieren en
bij de mens.
- Bijkomende genotox testen in vitro en in zoogdiercellen en in vivo.
14
ﻫ
Carcinogeniciteit (chronische studies):
Om mogelijke carcinogene effecten na te gaan. Ze worden standaard in knaagdieren uitgevoerd
(duur = +/- 2 jaar). De dosisbepaling is hierbij cruciaal en meestal wordt uitgegaan van de MTD
(Maximum Tolerated Dose) die verkregen werd uit subchronische studies. [MTD > 10% afname in
lichaamsgewicht, geen sterfte, geen effecten die levensduur negatief beïnvloeden, toch zekere
toxiciteit]
De MTD is de hoogste dosis, de midden en lage dosis is respectievelijk ½ en ¼ van de MTD.
Recent worden ook transgene dieren gebruikt om de carcinogeniteit te bepalen(kan duur studie
beperken tot 6 maanden).
Algemeen gezien dienen de resultaten van een carcinogeniciteitstudie niet bekend te zijn vooraleer
klinische studies kunnen worden gestart, tenzij er een zwaar vermoeden is op risico voor
carcinogeniciteit. Voor de marktintroductie zijn deze resultaten echter wel nodig!
ﻫ
Reproductietoxiciteit:
DART of Developmental And Reproductive Toxicity. In deze studies worden de mogelijke effecten op
fertiliteit in mannelijke en vrouwelijke dieren nagegaan. Hiervoor worden zwangere dieren
behandeld met het te onderzoeken molecule. De behandeling start 14 dagen voor de paarperiode
en loopt door gedurende de paarperiode tot de innesteling en de vroege embryonale ontwikkeling.
Ook teratogeniciteit kan op deze manier worden nagegaan (Sommige stoffen zoals ethanol
(alcoholische dranken), sigarettenbestanddelen of virussen worden niet tegengehouden door de
placenta en kunnen, afhankelijk van het tijdstip in de zwangerschap, de vrucht blijvend beschadigen;
dit wordt teratogeniciteit genoemd).
De effecten van het de nieuwe stof op de pre- en postnatale ontwikkeling worden nagegaan door
drachtige, vrouwelijke dieren te behandelen met deze nieuwe stof tussen implantatie en het einde
van de lactatie. De nakomelingen worden vervolgens geëvalueerd, inclusief de fertiliteit.
Timing van reproductiviteitsstudie ten opzichte van klinische studies:
ﻫ
Bijkomende studies, ‘case-by-case’ basis:
-
Juvenile animal toxicity
Immunotoxicity
Photo toxicity
Non-clinical abuse liability
Fixed combination drug non-clinical testing
10. Wat bestudeert de toxicokinetiek? Welke parameters hanteert ze?
Toxicokinetiek is het farmacokinetisch onderzoek als onderdeel van de toxiciciteitstudie.
15
De dosis bepaald het gif, maar daarenboven is de dosisfrequentie samen met de behandelingsduur in
verhouding tot de eliminatiesnelheid bepalend voor het al dan niet bereiken van de toxische
concentraties en de snelheid waarmee de concentraties bereikt worden.
Het levert een belangrijke bijdrage tot de interpretatie van de resultaten en het helpt om nieuwe
toxiciteitstudies te plannen. Zo kan men aan de hand van toxicokinetiek concentratie-tijdprofielen
opstellen (figuur links), de blootstelling berekenen in functie van de dosis (figuur rechts) en een
vergelijking maken tussen verschillende geneesmiddelen. Ook kan een verband tussen de toxiciteit en
de plasmaconcentratie van het geneesmiddel (eventueel metabolieten inclusief) achterhaald worden.
Tenslotte helpt het ook bij de validatie van de blootstelling aan behandelde groepen versus geen
blootstelling aan de controle groep (contaminatie!).
De parameters die belangrijk zijn bij de toxicokinetiek zijn de AUC en andere farmacokinetische
parameters zoals Cmax en Tmax.
Effect van herhaalde toediening:
Autoinductie is een proces waarbij een geneesmiddel zijn eigen eliminatie kan versnellen door het
induceren van de expressie van enzymen en transporteiwitten. Aangezien een verhoogde klaring kan
leiden tot suboptimale blootstelling aan een middel kan dit proces uiteindelijk resulteren in de
ontwikkeling van zogenaamde farmacokinetische resistentie, waarbij patiënten een hogere dosis nodig
hebben om de beoogde therapeutische effecten te verkrijgen.
Aan de hand van toxicokinetiek kan ook een zogenaamde exposure-based safety margin bepaald
worden. Deze exposure-based safety margin is een veiligheidsmarge die gebaseerd is op de
16
blootstelling bij NOAEL (AUCNOAEL) in plaats van op de NOAEL zelf. Men zal dus enkel rekening houden
met de AUC (cf. blootstelling) in plaats van met de dosis zelf. De typische ‘farmaceutische’ safety margin
is 100-200. Hoe hoger de marge, hoe beter! Verschillen met een factor 10 weerspiegelen de interindividuele variabiliteit bij de mens. Een verschil van een factor 10 toont bijvoorbeeld ook aan dat de
mens 10 keer gevoeliger is dan de meest gevoelige diersoort getest.
11. Welke technieken worden gebruikt voor het bestuderen van distributie,
metabolisme en excretie van een geneesmiddel in ontwikkeling tijdens de
preklinische evaluatie bij dieren in vivo?
Preklinische farmacokinetiek omvat in vivo en in vitro farmacokinetisch onderzoek. Bij het in vivo
onderzoek wordt de absorptie (inclusief biologische beschikbaarheid), distributie (concentraties in
organen zoals hersenen en lever, quantitative whole body autoradiography), metabolisme (snelheid van
metabolisme en identificatie van metabolieten) en excretie (adhv radioactief gemerkte stof,
massabalans) van de te onderzoeken stof nagegaan. Het in vitro farmacokinetisch onderzoek bestudeert
onder andere het metabolisme in subcellulaire fracties, de plasmaproteïnebinding en het transport
doorheen cellagen.
Metabolisme, excretie en eventueel absorptie van een geneesmiddel kunnen in vivo nagegaan worden
aan de hand van studies met een 14C-gemerkte stof (in ratten, honden of zelfs de mens, eventueel ook
muis en konijn), men spreekt van 14C-AEM studies. Men bestudeert hierbij de metabole stabiliteit van
een 14C-label in de teststof (metabole kooi, rat) en tracht zo de excretiewegen en het metabolisme
profiel volledig in kaart te brengen hiertoe wordt een 14C (of 3H)-gemerkte teststof oraal toegediend.
Vervolgens worden urine en faeces verzameld gedurende 7 dagen na de toediening en ook plasmastalen
worden op regelmatige tijdstippen gecollecteerd. Staalanalyse zal tenslotte gebeuren via radio-HPLC, LCMS/MS en/of NMR. De gevonden massabalans kan vervolgens volledig in kaart gebracht worden een
geeft het metabool profiel (eventueel in verschillende species, inclusief de mens).
Distributiestudies worden meestal uitgevoerd in de rat. Weefseldistributie kan nagegaan worden aan
de hand van dissecties of via QWBA of Quantitative Whole Body Autoradiography. Het doel van een
QWBA -studie is het visualiseren en kwantificeren van een radioactief gemerkte stof in kleine dieren.
Hiertoe wordt de 14C-gemerkte stof oraal toegediend. De proefdieren worden op vaste tijdstippen (tot
meerdere weken) na de dosering opgeofferd en ingevroren, waarna ze ingebed worden in 2%
carbomellose. Weefselcoupes worden overlangs bereid aan een dikte van 0,02mm. De radioactiviteit in
de weefselcoupes worden tenslotte gevisualiseerd via phosphor-imaging.
Radioactief gemerkte stoffen kunnen enkel gerelateerd zijn aan de teststof (<-> endogene stoffen)
dit leidt tot een kwantificatie van al de metabolieten, zelfs de onbekende! De analytische respons
voor 14C is onafhankelijk van de context van de chemische structuur.
Eventueel kan excretie ook nagegaan worden aan de hand van galexcretiestudies in de rat of hond.
Metaboliet profilering is belangrijk in het toxicologisch/farmacologisch onderzoek. Veiligheidsstudies
zijn grotendeels gebaseerd op toxiciteitstudies in dieren, maar de resultaten van deze studies kunnen
slechts relevant zijn wanneer ook ‘humane’ metabolieten gevormd worden in de proefdieren (tijdens
de toxiciteitstudies). Er moet dus blootstelling zijn aan humane metabolieten zodanig dat potentieel
reactieve metabolieten gedetecteerd kunnen worden (zo niet ‘unique human metabolites’, FDA
MIST document (Metabolites In Safety Testing))!
17
12. Fase I en fase II onderzoek: bespreek.
[Een
klinische studie is een wetenschappelijke en ethisch verantwoorde studie waarbij mensen
betrokken zijn. Een dergelijke studie wordt uitgevoerd door onderzoekers en dit om de kennis van ziekten
en mogelijke behandelingen te verbeteren. Een klinische studie evalueert de doeltreffendheid en
veiligheid van 1 of meerdere medicinale producten voor een specifieke ziekte. Het ultieme doel is een
vermindering in ziekte - gerelateerde morbiditeit en/of mortaliteit.]
Een fase I klinische trial omvat de eerste veiligheidstesten op een nieuw medicijn. Deze testen worden
doorgaans uitgevoerd in gezonde, mannelijke (‘elke ♀ is zwanger tot het tegendeel bewezen is’)
vrijwilligers met als voornaamste doel het bepalen van het dosisbereik (dose range, MTD) dat
getolereerd wordt door de vrijwilligers zowel na enkelvoudige als meervoudige toediening. Ook
farmacokinetische en in mindere mate farmacodynamische parameters worden bepaald. Fase I klinische
testen worden soms ook in ernstig zieke vrijwilligers (*) uitgevoerd of minder zieke patiënten bij
farmacokinetische problemen. De gemiddelde duur is 6 tot 12 maanden, afhankelijk van de indicatie van
het geneesmiddel (acuut vs. Chronisch vb. hoofdpijn vs. antidepressivum).
(*) soms wordt een geneesmiddel in fase I al aan ernstig zieke patiënten gegeven, vb. cytostatica. Ethisch
verantwoord? Risk/benefit afwegen: patiënt heeft kanker en met rug tegen muur, terminale fase kan
ethisch nu wel; als werkt OK, als niet werkt ook OK, want nu wel alles geprobeerd!
Enkele voorbeelden van typische fase I studies zijn:
- First in Man (FIM) – studies ‘dose escalation’ (= A preliminary clinical trial in which the
amount of the drug is either periodically increased or increased with each new trial arm that is
added. Used to determine how a drug is tolerated in people).
- Farmacokinetische studies (single of multiple dose)
- Bio-equivalentie studies
- Interactie-studies
- Farmacokinetische/farmacodynamische studies
Vb. Medicijn voor migraine: Δ kinetiek van geneesmiddel tijdens aanval in vergelijking met buiten
aanval? = fase I (hier nog niet kijken naar werking geneesmiddel)
Daarnaast zijn er in de loop van de jaren ook een aantal nieuwe studievormen ontwikkeld (new concepts
are needed for an early “go/no-go” decision and earliest identification of the most promising
candidate.):
18
-
Fase 0 studies (oa. microdosing en PET-studies)
[Phase 0 is a recent designation for exploratory, FIM trials conducted in accordance with the
United States FDA 2006 Guidance on Exploratory Investigational New Drug (IND) Studies. Phase
0 trials are also known as human microdosing studies and are designed to speed up the
development of promising drugs or imaging agents by establishing very early on whether the
drug or agent behaves in human subjects as was expected from preclinical studies. Distinctive
features of Phase 0 trials include the administration of single sub-therapeutic doses of the study
drug to a small number of subjects (10 to 15) to gather preliminary data on the agent's
pharmacokinetics (how the body processes the drug) and pharmacodynamics (how the drug
works in the body). A Phase 0 study gives no data on safety or efficacy, being by definition a dose
too low to cause any therapeutic effect. Drug development companies carry out Phase 0 studies
to rank drug candidates in order to decide which has the best pharmacokinetic parameters in
humans to take forward into further development. They enable go/no-go decisions to be based
on relevant human models instead of relying on sometimes inconsistent animal data.]
-
exploratory Clinical Trial Applications (eCAT)
-
Proof-of-Concept studies (Proof of Principle) (PoC/PoP)
Een trial om klinische doeltreffendheid aan te tonen met een klein aantal strikt geselecteerde
patiënten. Het doel van dit type studie is:
▪ validatie van de relevantie van het nieuwe therapeutische doelwit en in vivo
preklinische modellen voor de mens.
▪ Potentiële biologische merkers voor klinische doeltreffendheid of toxiciteit definiëren
▪ Reeds vroeg in het onderzoek bewijs leveren van het potentieel om klinische
doeltreffendheid aan te tonen
▪ Snel potentiële falingen/problemen van de baan helpen
▪ Voorzien in een beoordeling van het commercieel potentieel van de kandidaat
moleculen
-
Translationele modellen (method validation studies)
-
Fase Ib/IIa studies
Fase Ib ?
Fase IIa is specifiek ontworpen om dosis vereisten te beoordelen (welke concentratie van het
geneesmiddel moet gegeven worden?)
Fase IIb is specifiek ontworpen om de doeltreffendheid na te gaan (hoe goed werkt het
geneesmiddel bij de voorgeschreven dosis?).
Vooraleer een fase I klinische studie gestart mag worden, moeten een aantal testen gebeurd zijn (zgn.
preklinische studies of non-klinische ontwikkeling):
- safety pharmacology
- toxiciteitstudies
- farmacokinetische studies
- lokale tolerantie studies
- genotoxiciteit (in vitro & in vivo)
19
[Carcinogeniciteit- en DART-studies zijn geen noodzakelijke voorwaarde. Wel vermijden dat een
vrouw zwanger wordt indien toch vrouwen aan de fase I studie zullen deelnemen dubbele
bescherming!]
Fase I onderzoek is belangrijk om het nemen van efficiënte en effectieve beslissingen mogelijk te
maken! Veiligheid binnen het onderzoek is vanzelfsprekend van groot belang, daarom zijn er in de loop
van de jaren ook een aantal richtlijnen opgesteld:
- 7 december 2006: Duff report
- 19 juli 2007: EMEA guideline over FIH klinische trials
- Augustus 2007: Association of the British Pharmaceutical Industry of ABPI guidelines voor fase I
klinische trials
- 28 augustus 2007: Medicines and Healthcare products Regulatory Agency of MHRA voorstel
voor een vrijwillig accreditatie schema voor fase I klinische trial units in Groot-Brittannië.
Een fase II klinische trial omvat studies die de doeltreffendheid en veiligheid evalueren van een
potentieel nieuw geneesmiddel in een geselecteerde populatie van patiënten met als doel een ziekte te
behandelen, diagnosticeren of verhinderen. Ook wel ‘pivotal trial’ genoemd. Het onderwerp van een
fase II klinische studie is dus een bepaalde doelwitpopulatie die zowel mannen als vrouwen (DART nu
wel beschikbaar) bevat (n = 100-500). Het doel van een fase II onderzoek is om in de eerste plaats de
doeltreffendheid van de nieuwe stof na te gaan. Daarnaast zal ook de tolerantie bestudeerd worden
(MED vs. MTD) alsook de veiligheid (therapeutisch venster / index), farmacokinetiek en
farmacodynamiek van de nieuwe stof. Ook in deze fase van het onderzoek is het opnieuw belangrijk om
de farmacokinetiek na te gaan, aangezien dit voor een geneesmiddel sterk kan verschillen tussen
gezonde vrijwilligers en patiënten. Een migraineaanval kan bijvoorbeeld aanleiding geven tot een
tragere maaglediging. Dit kan ertoe leiden dat de Cmax (maximale plasmaconcentratie) pas na 6h bereikt
wordt. Omdat dit niet erg efficiënt is, kan men nu al beslissen om niet verder te gaan met het
geneesmiddel!
De duur van een fase II onderzoek is gemiddeld 12 tot 24 maanden.
[ fase IIa kleine groep // fase IIb bevestiging van initiële bevindingen in grote groep]
Het feit dat in een fase II onderzoek de werkzaamheid van de nieuwe stof wordt nagegaan, maakt dat
deze studies erg belangrijk zijn voor een bedrijf! Ze zijn een mijlpaal in de ontwikkeling van het
potentieel nieuw geneesmiddel en hier wordt vaak de beslissing gemaakt van verder ontwikkelen of
niet. Immers, wanneer de ontwikkeling van een nieuw geneesmiddel faalt, gebeurt dit doorgaans tijdens
fase II trials doordat ontdekt wordt dat de nieuwe stof niet werkt zoals verwacht of toch toxische
bijwerkingen heeft.
13. Fase III onderzoek: bespreek.
Een fase III klinische trial wordt uitgevoerd in een patiëntenpopulatie voor wie het nieuwe medicijn
bedoeld is, nadat de doeltreffendheid ervan eerder werd aangetoond in een kleinere groep patiënten
(fase II). Men wil hiermee bijkomende data verzamelen omtrent doeltreffendheid, werkzaamheid en
veiligheid in relatief grote groepen van patiënten. Men gaat hier ook vergelijken met wat al bestaat.
Een fase III onderzoek wordt soms onderverdeeld in een fase IIIa en een fase IIIb trial:
- fase IIIa wordt uitgevoerd voordat een NDA (New Drug Application) is ingediend. Een fase IIIa is
nodig om een registratiedossier te kunnen indienen.
- fase IIIb wordt uitgevoerd nadat een NDA werd ingediend, in de periode tussen indiening en
goedkeuring voor marketing. Fase IIIb kan ook beschouwd worden als extra onderzoek bij
risicopopulaties zoals jongeren of ouderen of bij personen met nier – of leverinsufficiëntie. Fase
IIIb is nodig om het nieuwe geneesmiddel op de markt te kunnen brengen!
Het onderwerp van de fase III klinische trial is de ‘real-life’ populatie (n = 500-5000). Fase III klinische
studies hebben als doel om doeltreffendheid, indicatie, dosis en veiligheid te bevestigen in een grote
20
populatie. Ook de effecten in de risicopopulaties worden nagegaan. De gemiddelde duur van een fase III
onderzoek is 2 tot 7 jaar.
Vb. antihypertensivum, makkelijk te meten en niet invasief: bloeddruk meten. Maar je wil ook weten
of dit op termijn zorgt voor een daling in morbiditeit en/of mortaliteit. Discussie Wat moeten we
onderzoeken? Tegenstrijdige belangen:
De overheid wil ‘onderdanen’ beschermen en dus
zo veel mogelijk informatie en gegevens
verzamelen zodat men zo zeker mogelijk is. Ze
willen met andere woorden zgn. harde
eindpunten (overleving, kwaliteit van leven?).
Een Bedrijf daarentegen wil een nieuw
geneesmiddel zo snel mogelijk op de markt
brengen want ‘time is money’. De industrie wil
met andere woorden zachte eindpunten (Soft
endpoints). De maatschappij is dan weer zeer
ongeduldig en wil zo snel mogelijk nieuwe
medicijnen tegen ernstige (levensbedreigende) aandoeningen (vb. AIDS).
Een mogelijke oplossing voor deze tegenstrijdige belangen is het opstellen van surrogaat eindpunten.
Ze kunnen klinisch zinvolle eindpunten vervangen. Therapiegeïnduceerde veranderingen van een
surrogaat eindpunt weerspiegelen veranderingen in een klinisch zinvol eindpunt.
Bijvoorbeeld het bestrijden van een HIV-infectie. Vroeger was elk geneesmiddel goed, nu zijn er
echter al een 20-tal op de markt en is men op zoek naar beter middelen, die de infectie beter kunnen
bestrijden. Er is dus veel onderzoek nodig en de vraag die hierbij centraal staat is ‘Is dit molecule beter
dan het beste dat er al bestaat?’. Een hard eindpunt hierbij is bijvoorbeeld overleving (Leven of dood?).
Een surrogaat eindpunt zou kunnen zijn het meten van de concentratie CD4.
Maar, een surrogaat eindpunt is ook maar een surrogaat… .
Bijvoorbeeld Vesnarinone, een fosfodiësterase-inhibitor. Het geeft een betere contractiliteit van het
hart en kan zo oedeemvorming verminderen en zo de levenskwaliteit verbeteren. Langs de andere kant
is het wel gerelateerd aan een hogere mortaliteit. De vraag die men dan eigenlijk zou moeten stellen is:
‘Wat is het belangrijkste? Een kort en goed leven of een lang, maar slecht leven?’.
Harde eindpunten zijn relatief!
Het trial design van een fase III klinische studie is als volgt:
- Superiority trial:
Heeft als doel een verschil te detecteren tussen behandelingen. Een statistische test hiervoor
is eenzijdig (groter of beter dan), maar een verschil aantonen is moeilijk, omdat er ondertussen
al zo veel goeds bestaat.
- Equivalence trial:
Heeft als doel de afwezigheid van een verschil te bevestigen. Statistische bevestiging van het
resultaat is echter moeilijker, het is een tweezijdige test waarbij het ene niet beter of slechter
mag zijn dan het andere. Er zijn dus grote studies nodig met veel vrijwilligers waardoor het
kostenplaatje dus wel eens hoog kan oplopen!
- Non-inferiority trial:
Heeft als doel aan te tonen dat de nieuwe therapie op z’n minst zo goed is als de reeds
bestaande therapie en zeker niet slechter. Dit is opnieuw een eenzijdige test en dus makkelijker
om uit te voeren.
21
14. RCT studie ontwerp: cross-over onderzoek versus parallel groep onderzoek.
Bespreek.
Een fase IV klinische studie omvat de opvolging van de veiligheid van het nieuwe geneesmiddel, eens
het op de markt werd gebracht. Iets dat zeer zeldzaam is, wordt niet gedetecteerd in fase I, II en III,
daarom is de fase IV zeker zo belangrijk om ook uit te voeren (denk maar aan Vioxx® (Rofecoxib).
Rofecoxib is een NSAID dat werd gebruikt bij de behandeling van artritis en andere acute of chronische
pijnen. Het veelvuldig en langdurig gebruik van dit geneesmiddel aan een hoge dosis verhoogde echter
het risico op hartfalen en hartstilstand. Bijgevolg werd Vioxx® alsnog van de markt genomen, wat leidde
tot een enorm verlies!)!
Het trial design van een fase IV klinische studie is een Randomized Controlled Trial (RCT). Er is een
actieve groep, die de te testen behandeling ondergaat en een controle groep, die een placebo of
standaardbehandeling krijgen. De blootstelling gebeurt in feite at random (willekeurige onderverdeling
in actieve of controle groep), maar wel gecontroleerd door de onderzoeker. RCT-studies zijn altijd
prospectieve studies en ze worden beschouwd als de gouden standaard. Het nadeel aan RCT-studies is
dat ze duur zijn.
De types van controle die gebruikt worden in een RCT-studie zijn:
- placebo (tablet zonder actieve stof) vs. Nieuw geneesmiddel
- geen behandeling vs. Nieuwe behandeling (ethisch niet verantwoord)
- lage dosis waarbij geen respons vs. Dosis waarbij respons
- reeds bestaande (alternatieve) therapie vs. Nieuwe therapie
- Extern?
Mogelijke behandelingssequenties binnen een RCT-studie zijn:
- een enkelvoudige behandeling:
-
een behandeling van parallelle groepen:
-
Groep 1 (lichtgrijs) krijgt van begin tot einde behandeling A, groep 2 (blauw) krijgt van begin tot
einde behandeling B. Als een RCT-studie 3 jaar duurt, zal men ook tussentijdse analyse uitvoeren
(interim-analyses), bijvoorbeeld elke 6 maand. Zoveel te meer interim-analyses echter, zoveel te
groter het probleem van multiple testing (als je maar genoeg testen doet, krijg je toevallig wel
eens een positief resultaat). Dus zoveel te meer interim-analyses gepland zijn, zoveel te groter
de groepen moeten zijn en zoveel te langer de analyses duren.
Daarnaast is het ook zo dat er variabiliteit mogelijk is tussen de twee groepen (vb. meer
vrouwen in groep 1, meer oudere mensen in groep 2, …).
een cross-over behandeling:
Elke patiënt krijgt behandeling A en behandeling B, maar telkens in een verschillende sequentie.
Het voordeel van deze studie is dat je naar de effecten van A en B gaat kijken binnen eenzelfde
persoon (= intrasubject). Hierdoor is de variabiliteit veel kleiner.
22
Deze studie is echter moeilijker uit te voeren en mogelijke problemen die zich kunnen voordoen
zijn:
▪ CARRY-OVER: wanneer behandeling A een langdurig effect heeft en nog doorwerkt
wanneer behandeling B gestart wordt. Er is geen baseline en dus geen zuivere analyse van
behandeling B. Men kan dit echter wel proberen vermijden door een voldoende lange
‘wash-out’ (witte lijn) periode in te lassen.
▪ PERIODE EFFECT: bij een niet-stabiele aandoening (vb. migraineaanval) zijn de verschillende
aanvallen niet vergelijkbaar. Een chronische aandoening is vaak progressief. De ziekte is dus
niet vergelijkbaar tussen de twee periodes en een vergelijking tussen de twee verschillende
behandelingen is dus niet mogelijk.
Een cross-over studie wordt daarom enkel uitgevoerd voor stabiele aandoeningen. Voordelen
zijn de beperkte variabiliteit en het feit dat relatief kleine groepen van vrijwilligers gebruikt
kunnen worden. Langs de andere kant maakt dit de statistiek wel weer meer gecompliceerd.
15. Bespreek “interne” versus “externe” validiteit” in de context van klinische studies.
Interne validiteit Werd de studie op een wetenschappelijk correcte manier uitgevoerd?
Door interne validatie tracht men verwarring en bias (vertekening) uit te sluiten. Dit doet men aan de
hand van (blinde) randomizatie en het gebruik van placebo’s in de studie. Door middel van
randomisatie zullen personen willekeurig onderverdeeld worden in groepen. Deze groepen zouden zo
gelijk mogelijk moeten zijn. Door toeval zou het kunnen dat vb. al de vrouwen in groep 1 terechtkomen.
In dit geval kan men dus beter de groepen opnieuw indelen (opnieuw willekeurig natuurlijk!). Om via
randomisatie aan zo gelijk mogelijke groepen te komen, kan men minimisatie (stratificatie) toepassen.
Zo kan men bijvoorbeeld rekening houden met het geslacht, het rookgedrag, … en zo de groepen een
beetje (minimaal) bijsturen om zo identiek mogelijk groepen te verkrijgen. Men geeft voornamelijk de
aandacht aan die factoren die ook een invloed (kunnen) hebben op de output. Bij een goede studie zal
men de demografie tussen de twee groepen vergelijken en een samenvattende tabel hierover
publiceren samen met de bekomen data! Randomisatie kan blind gebeuren of gecontroleerd. Bij een
gecontroleerde randomisatie spreken we van een non-blinded of open trial. Zowel de patiënt als de
arts kent de behandeling die gegeven wordt. Doordat de gegeven therapie gekend is, is beïnvloeding
van de resultaten mogelijk, wat een sterk nadeel is van open trials. Zo veel te subjectiever de parameter
is die wordt bestudeerd, zo veel te belangrijker blinding wordt. Wanneer randomisatie blind gebeurt,
spreken we van een blinded trial. We onderscheiden hierbij:
- Single blind: 1 partij (meestal de patiënt) is geblindeerd
- Double blind: zowel patiënt als arts is geblindeerd
Double dummy: Wanneer men op geblindeerde wijze twee behandelingen wil evalueren die
op een verschillende wijze worden toegediend, moeten beide groepen een placebo krijgen. Een
voorbeeld: bij de vergelijking van een oraal en een subcutaan toegediend anticoagulans zal de
groep die met het orale product wordt behandeld, ook subcutaan een placebo krijgen en zal de
groep die met het subcutane product wordt behandeld, een oraal placebo krijgen.
- Triple blind: arts, patiënt en evaluator zijn geblindeerd (vb. bij RX van thorax bij TBC)
- Quadruple blind: arts, patiënt, evaluator en ook statisticus zijn geblindeerd. Dit is de meest
correcte vorm van onderzoek
- Quintuple blind: code verloren niemand weet nog wat A of B was studie opnieuw
uitvoeren. Te veel van het goede is ook niet goed.
Wanneer de werkzaamheid van een nieuwe therapie nagegaan wordt, moet men de behandelde groep
patiënten kunnen vergelijken met een controle groep, die niet behandeld werd met de nieuwe therapie.
Deze controle groep zal ook een behandeling ondergaan, maar dan met een placebo. Een placebo is een
inactieve stof die van uitzicht gelijkaardig is aan de te testen therapie of actieve stof (als twee
verschillende therapieën double dummy). Op deze manier is blinding mogelijk en moeten de
23
patiënten in de controle groep dezelfde handelingen ondergaan of doen als de patiënten in de actieve
groep (vb. tablet inslikken, injectie krijgen, …).
Placebo effect: ‘non-interventie’ resulteert in voordelige effecten, ook op de uiteindelijke uitkomst van
het onderzoek door positieve verwachtingen. Het is inherent menselijk dat men van iets nieuws
verwacht dat het gaat werken, ook al is dit niet per se zo.
Nocebo effect: negatieve verwachtingen resulteren in negatieve resultaten. Doordat geen therapie
gegeven wordt, verwacht de patiënt ongewenste effecten.
vb. in Nederland onderzoek naar behandeling van pancreatitis met probiotica. In de controle groep,
waarin de patiënten behandeld werden met een placebo, stierven 15 patiënten. In de actieve groep
waren dit er 24. De geteste therapie bleek dus waardeloos, maar was niet de oorzaak van het hoger
aantal doden in de actieve groep, dit was gewoon toeval.
Is het gebruik van placebo’s altijd verantwoord?
Dit is afhankelijk van de ernst van de aandoening (vb. lethaal of niet) waarvoor een behandeling wordt
gezocht en of er al een werkende therapie voor bestaat of niet (als er wel al een behandeling zou
bestaan, is het gebruik van placebo’s ethisch veel minder verantwoord). Dit is een vraag die niet
algemeen beantwoord kan worden, maar case by case bekeken moet worden. Het FDA eist harde
eindpunten, EMEA is wat ‘softer’. Als er al een effectieve therapie bestaat, moet deze gebruikt worden
om de controle groep te behandelen in plaats van een placebotherapie.
Externe validiteit selectie criteria Wie mag deelnemen aan de studie?
Lasagna’s law onderzoekers overschatten steeds het aantal patiënten dat beschikbaar is om deel te
nemen
aan
het
onderzoek.
Voordat vrijwilligers of patiënten kunnen deelnemen aan een klinische studie, moeten ze voldoen aan
een aantal criteria, de zgn. inclusie en exclusie criteria (vb. enkel niet rokende mannen tussen 18 en 50
jaar). In fase I gaat men bijvoorbeeld op zoek naar supergezonde mensen. Omdat er zo veel criteria
opgelegd worden, zijn er onvoldoende geschikte personen om deel te nemen aan de studie. Dit
weerspiegelt de wet van Lasagna bijvoorbeeld bij het zoeken naar een behandeling voor migraine.
Ongeveer 10% van de bevolking leidt aan migraine. Theoretisch gezien zou men deze 10% laten
deelnemen aan de studie, maar uiteindelijk blijft er maar een kleine fractie over. Uiteindelijk is er geen
echte overeenkomst meer met de ‘normale’ persoon in de maatschappij. De groep personen die
deelnemen aan de studie is niet meer representatief voor de maatschappij en vaak worden een
24
heleboel doelgroepen ondervertegenwoordigd, bijvoorbeeld bejaarden, kinderen, vrouwen, gekleurde
mensen,… .
De groepen van vrijwilligers die deelnemen aan een klinische studie zouden dus zo goed mogelijk
de gehele populatie moeten vertegenwoordigen!
16. Welke alternatieve benaderingen worden toegepast om de vroege klinische
ontwikkelingsfase van geneesmiddelen te optimaliseren?
* Microdosing of Fase 0:
In een fase 0 klinische studie zal men slechts een dosis van 100 μg of minder toedienen in de
veronderstelling dat het heel onwaarschijnlijk is dat deze dosis een farmacodynamisch effect zal
veroorzaken. Daarom is er minder informatie nodig vanuit de toxicologie waardoor het onderzoek
veel sneller kan gaan (minder preklinische toxicologische onderzoeken). Aan de hand van deze
microdosing studies kan men de farmacokinetiek bestuderen. Als men het molecule labelt met een
radioactief isotoop, kan men aan de hand van bloedstalen de farmacokinetiek bestuderen (of bv.
adhv PET-scan: radioactief gemerkt molecule dat bindt aan doelwitreceptor toedienen, PET-scan
nemen, GM toedienen, PET-scan nemen, als dan radioactief signaal weg is, dan wil dit zeggen dat
het GM bindt aan de doelwitreceptor). Naast farmacokinetiek kan men ook de biodistributie
bestuderen en de bindingseigenschappen.
* US eIND & EU eCTA:
[normaal fase I starten met lage dosis en dan stilletjes aan stijgen tot subjectieve maximaal
tolereerbare dosis (MTD). Hiervoor is echter veel preklinische informatie nodig. Wanneer men echter
de fase I start met een zeer lage dosis en zo eerst de farmacokinetiek bestudeerd, dan is er minder
toxicologie nodig en is er bv minder dierenleed.]
In de USA is er een wetgeving die toelaat de klinische fase I al te starten zonder dat de volledige
toxicologische informatie bekend is als je je beperkt tot een enorm lage dosis. Men gaat hierbij dus
niet zoeken naar de meest veilige of getolereerde dosis. Er is een beperkte blootstelling en normaal
zouden deze studies veiliger moeten zijn aangezien een lagere dosis gebruikt wordt.
exploratory Investigational New Drug (eIND), goedgekeurd door de FDA in 2006
In Europa is hiervoor ondertussen ook al een richtlijn die toelaat de studies in de mens al vroeger te
starten. Op die manier kan men snel verschillende moleculen screenen, wat dan weer interessant is
voor de industrie.
exploratory Clinical Trial Application (eCTA), goedgekeurd door het FAGG in 2007
Single dose studies gebeuren met een subfarmacologische dosis en kan uitgebreid worden tot een
farmacologische dosis onder de MTD. eCTA studies hebben als doel bepaalde farmacokinetische
parameters te bestuderen of een andere vooraf bepaalde, specifieke merker. Multiple dose studies
duren ongeveer 14 dagen en het dosis niveau bereikt farmacologische activiteit. In dit type van
studie nemen bij voorkeur gezonde vrijwilligers deel of personen die praktisch niet ziek zijn. Als
25
startdosis neemt men de MRSD of Maximum Recommended Starting Dose. De MRSD is gebaseerd
op het NOAEL, die werd omgezet naar een HED of Human Equivalent Dose. Deze HED wordt dan nog
eens aangepast aan de hand van een veiligheidsfactor (≥ 10x). Een alternatief voor de MRSD is
MABEL of Minimal Anticipated Biological Effect Level. Dit is de laagst verwachte Farmacologisch
Actieve Dosis (FAD). Wanneer de MRSD, gebaseerd op NOAEL, verschillend is van MABEL, dan kiest
men voor de laagste dosis.
Deze studies maken het mogelijk om veelbelovende compounds reeds vroeg in het onderzoek te
ontdekken en differentiëren van de rest. Dit zorgt ervoor dat er minder geld moet uitgegeven moet
worden aan faciliteiten, personeel en ook ‘tijd’. Er is een gereduceerde API (Active Pharmaceutical
Ingredient, = de substantie in een geneesmiddel die farmaceutisch actief is) vereiste en minder
algemene kosten om ‘losers’ te elimineren. Door mensen bloot te stellen aan veelbelovende
compounds kan het beëindigen van een studie als gevolg van ‘non-translatie tussen dierlijke en
menselijke data voorkomen worden. Daarnaast kan men ook meer focussen op specifieke vragen
voor 1 bepaalde compound, waardoor minder studies en dus ook minder dieren nodig zijn.
* Surrogate markers & biomarkers:
Een ‘surrogate marker’ is een substituut voor een klinisch betekenisvol eindpunt.
Therapiegeïnduceerde veranderingen van een surrogaat eindpunt reflecteren veranderingen in een
klinisch betekenisvol eindpunt.
Een biomarker is een substantie die gebruikt wordt als een indicator voor een biologische status.
Het is een karakteristiek die objectief gemeten en geëvalueerd als een indicator voor normale
biologische processen, pathogene processen of farmacologische reacties op een therapeutische
interventie.
Aan de hand van biomarkers kan men nagaan of het werkingsmechanisme dat gedefinieerd werd in
non-klinische modellen ook in mensen kan geobserveerd worden (translationeel onderzoek). Op
deze manier is het mogelijk om een beslissing te nemen voor verdere ontwikkeling, eventueel
gebaseerd op veiligheid, tolereerbaarheid en farmacokinetische data samen met translationele
resultaten en dit op een zo vroeg mogelijk stadium in het onderzoek.
[Er is discussie tussen de Association of the British Pharmaceutical Industry of ABPI en het Medicines
and Healthcare products Regulatory Agency of MHRA over studies in mensen waarbij er geen
formeel IMP (Investigational Medicinal Product) betrokken is maar mogelijks wel farmacologisch
actieve stoffen gebruikt worden.]
Aan de hand van Biomarker validation studies kan men potentieel bruikbare biomarkers valideren.
Voor dit type van studie is geen CTA nodig omdat geen IMP betrokken wordt in de studie.
Daaropvolgende studies in mensen zullen gebruik maken van deze biomarker in een fase I setting
met IMP. Gevalideerde NIMP methoden kunnen gebruikt worden in een fase 1 in combinatie met
een IMP. Hierbij heeft men meestal als doel om de ‘on-target’ biologische activiteit na te gaan of
soms ook om sommige aspecten van veiligheid te evalueren. Voor het IMP is wel een CTA vereist!
Er zijn twee categorieën van studies die geen CTA vereisen:
- Categorie 1 passieve, observationele studies die de onveranderde, normale fysiologie meten
onder experimentele omstandigheden. Bv. het nemen van biologische stalen van bloed of
weefsel of imaging (vb. PET).
- Categorie 2 methode validatie studies waarbij een biologisch systeem farmacologisch wordt
uitgedaagd of veranderd en de respons op een stimulus gemeten wordt (meestal om het
26
gebruik van een potentiële fase I biomarker te valideren). Deze categorie test de methode
zonder dat een IMP betrokken is!
* Human models/ experimental medicine/ translational medicine:
Meer de nijging om bij gezonde mensen te beginnen = stom want dan kan je toch niet weten of het
GM werkt?
EMEA richtlijnen voor FIH studies en Belgische eCTA richtlijn: achtergrond:
Duff verslag (7 dec 2006): Alle 6 personen met actieve stof op intensieve zorgen is’t niet
gevaarlijk?! Incidentie = laag: 2/1000 bij fase 1 ernstige ongevallen.
Als reactie hierop een beetje later door EMEA, ABPI en MHRA (UK) richtlijnen met betrekking tot
fase 1 studies.
17. Bespreek de Verklaring van Helsinki.
De Verklaring van Helsinki is een verklaring van ethische principes die door de World Medical
Association (WMA), een wereldwijde artsenorganisatie, is opgesteld in juni 1964 in Helsinki, en die
naderhand een aantal malen is aangepast [6 revisies (laatste in oktober 2008) en 2 verduidelijkingen (in
2002 en 2006)]. In de verklaring worden richtlijnen en basisprincipes gegeven voor het verrichten van
wetenschappelijk, geneeskundig onderzoek op mensen en de omstandigheden waaronder dit is
toegestaan. Deze verklaring is van toepassing op al de personen die betrokken zijn bij het klinisch
onderzoek, maar is niet wettelijk bindend in de internationale wetgeving.
De belangrijkste elementen in de verklaring van Helsinki zijn:
- Kwaliteit van de experimentele setting:
▪ Studie protocol (eindpunten en doelen)
▪ Wetenschappelijke standaarden
▪ Onafhankelijke beoordeling en goedkeuring
▪ Geen misbruik maken van vrijwilligers of bronnen
- Evaluatie van de voordelen en risico’s (risk/benefit):
▪ Doelen zijn evenredig aan risico’s
▪ Risico’s of gevaren zijn voorspelbaar
▪ Belang van de vrijwilligers staat voorop
▪ Stoppen als de risico’s > dan de voordelen
- Kwalificaties van de onderzoekers:
▪ Onderzoekers hebben wetenschappelijke kwalificaties
▪ Onderzoekers en vrijwilligers staan onder medisch toezicht
▪ De eindverantwoordelijkheid van de vrijwilligers ligt bij medisch gekwalificeerd
personeel
- Kwaliteit van de data:
▪ Verzekeren van nauwkeurigheid van de data
▪ Geen misleidende resultaten publiceren (vermijden)
▪ Doorzichtigheid (‘transparancy’)
- Bescherming van de vrijwilligers (‘subjects’) informed consent:
▪ Deelname aan de studie is vrijwillig
▪ Verdere zorg is zonder dwang of voorbedachtheid
▪ Vrijwilligers mogen op eender welk moment stoppen met de studie zonder daarvoor
een reden te moeten geven
▪ Identiteit wordt nooit vrijgegeven
Dus, kortweg wil de verklaring van Helsinki dat het belang van de patiënt altijd voorop staat en zwaarder
weegt dan het belang van het onderzoek. Deelname aan een klinische studie moet strikt vrijwillig zijn en
27
de arts moet steeds het belang van de patiënt voorop stellen en zo nodig de patiënt tegen zichzelf
beschermen. Onderzoek is alleen toegestaan als de resultaten ook gepubliceerd worden en als de
onderzoeksopzet wetenschappelijk verantwoord is zodat de conclusies ook geldigheid hebben. Het
onderzoek mag alleen als het niet op een andere minder riskante of minder belastende manier kan
worden verricht en als er niet al een betere behandeling of methode bekend is. Of aan al deze
voorwaarden voldaan wordt moet worden getoetst door commissies die zelf geen belang hebben bij het
onderzoek.
De verklaring van Helsinki vormt dé basis voor de Good Clinical Practices (GCP), maar is zelf ontwikkeld
naar aanleiding van een aantal gebeurtenissen in de geschiedenis. Vroeger werden potentiële
geneesmiddelen getest op gevangenen of geestelijk zieke patiënten. Ook tijdens de oorlog werden veel
misdaden gepleegd op gebied van testen van medicijnen (tijdens WOII werden 23 Duitse artsen
opgepakt wegens illegaal testen van medicijnen op onethische wijze). Dit alles leidde in 1947 tot het
opstellen van de Nuremberg Code (Neurenberg code), een nieuwe standaard voor ethisch medisch
gedrag met 10 basisprincipes waaraan voldaan moest zijn vooraleer een klinische test kon uitgevoerd
worden. Deze 10 basisprincipes zijn:
- vrijwillige informed consent
- productieve resultaten in het voordeel van de maatschappij
- trials zijn ontworpen, gebaseerd op dierproeven
- al het medische en mentale leed moet vermeden worden
- er mogen geen voorafgaande indicaties zijn dat verwondingen of dood kan optreden
- voordelen > risico’s
- goede voorbereiding en uitrusting
- enkel uitgevoerd door wetenschappelijk gekwalificeerde personen
- vrijwilliger moet op ieder moment kunnen stoppen met de test
- het experiment moet beëindigd worden op elk stadium dat mogelijks kan leiden tot een
verwonding of dood
Later heeft men als respons op het thalidomidedrama in de US een aantal procedures opgesteld die
gerespecteerd moesten worden vooraleer een klinische trial opgestart kon worden. Men spreekt van de
zogenaamde IND procedures (1962). Deze procedures vermelden de specifieke informatie die moet
worden ingediend bij de FDA om een goedkeuring te krijgen. Het FDA verwacht al de mogelijke
gegevens over:
- de protocols die zullen gebruikt worden
- de kwalificaties van de klinisch(e) onderzoeker(s)
- de preklinische en bestaande data
- resultaten over doeltreffendheid
- informed consents van de vrijwilligers
- studies over de mogelijke bijwerkingen/neveneffecten en eventuele rapportering hierover
De IND procedures wijzen ook op de verantwoordelijkheden van de sponsors en onderzoekers
betrokken bij de studie.
De Nuremberg code samen met de IND procedures liggen aan de basis van de verklaring van Helsinki,
die in 1964 werd opgesteld.
28
18. De CHMP vaardigde in september 2007 een richtlijn uit met strategieën om de
risico’s in FIM studies te identificeren en te beperken. Welke bezorgdheden
werden er in het bijzonder weerhouden in deze richtlijn met betrekking tot het
werkingsmechanisme en de aard van het aangrijpingspunt van nieuwe moleculen
evenals de relevantie van diermodellen.
Elke vroege onderzoek en development organisatie heeft dezelfde doelen, nl. het identificeren van
nieuwe targets en compounds voor deze targets, ervoor zorgen dat deze compounds zo efficiënt en
veilig mogelijk gebruikt worden in FIH (First-in-Human) en PoC (Proof of Concept) trials en om nieuwe
compounds die potentieel gevaarlijk zijn zo snel mogelijk te elimineren voordat ze te veel kosten. Deze
doelen zijn er wel, maar toch zijn er al een aantal fouten gebeurd die hebben geleid tot ‘dramatische’
gebeurtenissen. Zo was er bijvoorbeeld het TeGenero incident in maart 2006 waarbij 6 vrijwilligers in
kritieke toestand kwamen na het gebruik van een nieuw monoklonaal antilichaam. Dit antilichaam bleek
een superagonist te zijn die een cytokinestorm veroorzaakte die niet gezien werd bij de dierproeven.
Om in de toekomst dergelijke omstandigheden nog beter te kunnen vermijden, werd in september 2007
een richtlijn opgesteld voor FIH trials, de Committee for Human Medicinal Products (CHMP) Guideline.
Deze richtlijn omvat strategieën om mogelijke risico’s voor FIH trials met IMPs (Investigational Medicinal
Products) te identificeren en ‘verzachten’. Voor sommige nieuwe medicinale producten is het nonklinisch veiligheidsprogramma misschien niet voldoende voorspellend. Ongerustheid zou kunnen
voortkomen uit bepaalde kennis, of gebrek daaraan, en dit omtrent:
- het werkingsmechanisme
- de aard van het doelwit
- de relevantie van diermodellen
Ongerustheid betreffende het werkingsmechanisme:
Een nieuw mechanisme zou niet noodzakelijk aan het risico zelf kunnen toevoegen, maar de kennis van
het veronderstelde werkingsmechanisme is belangrijk, vooral in het geval van targets met pleiotrope
effecten (meerdere mogelijke effecten), superagonisten, mogelijke amplificatie, … . Het kan daarnaast
ook bepalend zijn voor het type en de helling van de dosis-respons curve (non-lineair, U-vormig, … ).
Ongerustheid betreffende de aard van het doelwit:
Het is belangrijk na te denken over de target structuur, de weefseldistributie, cel- en ziektespecificiteit,
de functie van het target, inclusief downstream effecten en de mogelijke polymorfismen van het target
in de relevante diermodellen en in mensen.
Ongerustheid betreffende de relevantie van diermodellen:
Ga na welke relevante species gebruikt werden voor de safety pharmacology en toxicologie. Vergelijk de
target structuur, de weefseldistributie, signaaltransductie en farmacodynamiek (dosis/concentratie vs.
respons) in verschillende dieren. Wanneer de relevantie van het diermodel in vraag getrokken wordt,
dan neemt het risico van de studie toe en moet men opteren voor een meer voorzichtige aanpak.
[opmerking: specifieke humane proteïnen kunnen een immuunrespons uitlokken en zo geneutraliseerd
worden in dieren. Transgene dieren en diermodellen voor een bepaalde ziekte kunnen een goed
alternatief vormen voor toxiciteitstudies in ‘normale’ dieren.]
Er zijn dus een aantal belangrijke, klinische aspecten waarmee men rekening moet houden:
- veilige startdosis
- het interval tussen verschillende doseringen in een cohort-studie moet lang genoeg zijn.
- Dosis toenames i cohort-studies zouden niet te groot mogen zijn
- Duidelijke regels voor uitbreiding of stoppen van de studie
- Gebruik van gepaste fase I - faciliteiten en goed getrainde onderzoekers en personeel
- De studie wordt bij voorkeur in eenzelfde centrum uitgevoerd, wat de communicatie bevorderd!
- ICU faciliteiten (Intensive Care Units) moeten te allen tijde beschikbaar zijn
29
19. Bespreek de principes die gehanteerd worden bij de berekening van een MRSD
met oog op de uitvoering van een FIM studie (cf. ondermeer FDA guideline, 2005).
Een MRSD of Maximum Recommended Starting Dose wordt meestal berekend nadat de data van de
toxiciteitstudies werden geanalyseerd. Voor normale compounds vormt de NOAEL (No Observed
Adverse Effect Level) de basis voor de MRSD-berekening. Voor risico-compounds wordt de MRSD
berekend op basis van de NOAEL én MABEL (Minimum Anticipated Biological Effect Level).
[NOAEL
= het hoogste dosisniveau dat geen significante verhoging van neveneffecten induceert in
vergelijking met de controle groep.]
De eerste stap in het bepalen van de MRSD is het evalueren van de data uit dierproeven zodat een
NOAEL kan bepaald worden voor elke studie. Er zijn essentieel drie types van bevindingen in de nonklinische toxicologie die gebruikt kunnen worden voor het bepalen van de NOAEL:
1. ‘onverbloemde’ (overt) toxicologie klinische tekens, macro- en microscopische laesies
2. surrogaat merkers van toxicologie serum lever enzymniveaus
3. overdreven farmacodynamische effecten
Algemeen: een neveneffect, geobserveerd in non-klinische toxicologische studies en gebruikt voor het
definiëren van NOAEL met als doel een dosis te bepalen, moet gebaseerd zijn op een effect dat
onaanvaardbaar is als het veroorzaakt wordt door de initiële dosis van de te testen stof in een fase I
klinische trial, uitgevoerd in gezonde, volwassen vrijwilligers.
Stap 2: nadat de NOAEL (in mg/kg) berekend werd voor de verschillende relevante dierstudies, moeten
deze waarden omgezet worden naar de overeenkomstige Human Equivalent Dose (HED). Voor de
meeste systemisch toegediende therapeutica gebeurt deze conversie op basis van de normalisatie van
de dosis naar de lichaamsoppervlakte (mg/m²). Hierbij wordt een correctiefactor van W0,67 (W = gewicht)
gebruikt. Deze voorgaande methode wordt het meest gebruikt, maar in sommige gevallen kan het
aangewezen zijn om een andere dosisnormalisatie benadering te gebruiken, bijvoorbeeld de humane
dosis direct gelijkstellen aan de NOAEL in mg/kg. Welke methode precies gebruikt moet worden hangt af
van iedere individuele studie. Voor de normalisatie naar lichaamsoppervlakte en extrapolatie van de
dierlijke dosis naar de humane dosis moet de NOAEL voor ieder species bestudeerd gedeeld worden
door de gepaste conversiefactor (BSA-CF of Body Surface Area-Conversion Factor). Deze BSA-CFs zijn
afhankelijk van het gewicht van het dier (afgeleid van W0,67) en analyses hebben aangetoond dat een
heel aantal gewichten van dieren geschat kan worden door een standaardfactor. De BSA-CFs zijn dus
gestandaardiseerd naar de zogenaamde Km-waarden en in plaats van te delen door de BSA-CF, gaat men
nu vermenigvuldigen met de Km (= conversiefactor in kg/m²).
Rekenvoorbeeld: NOAEL voor hond is 30 mg/kg : HED (mg/m²) = NOAEL (mg/kg) x Km (kg/m²)
(Km hond = 20 kg/m²)
HED = 30 mg/kg x 20 kg/m²
HED = 600 mg/m²
Stap 3: eens de HED gekend is voor de NOAELs van elke toxicologische studie relevant voor de
voorgestelde fase I trial, kan men bepalen welke HED gebruikt zal worden voor het berekenen van de
MRSD. De HED die men hiervoor kiest zou afgeleid moeten zijn van het meest toepasselijke species. In
de afwezigheid van data over de relevantie van de species, stelt men dat het meest gepaste species, het
meest gevoelige species is, namelijk het species met de laagste HED. Het gebruik van de laagste HED
waarde zal in dit geval leiden tot de meest conservatieve startdosis! Wanneer voorafgaande studies
hebben aangetoond dat een bepaald diermodel meer geschikt is voor de beoordeling van de veiligheid
voor die bepaalde klasse van geneesmiddelen, dan moet de HED van deze species gebruikt worden voor
de verdere berekening van de MRSD.
30
Stap 4: Bij het berekenen van de MRSD wordt ook rekening gehouden met een veiligheidsfactor, die
zorgt voor een extra veiligheidsmarge en dus bescherming voor de vrijwilligers die zullen deelnemen aan
de fase I trial. Deze veiligheidsfactor laat een bepaalde variabiliteit toe bij de extrapolatie vanuit
toxiciteitstudies in dieren naar de mens. Variabiliteit kan het gevolg zijn van:
- onzekerheden als gevolg van verhoogde gevoeligheid aan de farmacologische activiteit bij
mensen in vergelijking met dieren
- moeilijkheden bij het detecteren van bepaalde neveneffecten in dieren (bv hoofdpijn)
- verschillen in receptordensiteit of affiniteit
- onverwachte neveneffecten
- interspecies verschillen in ADME
In de praktijk wordt de MRSD voor een klinische trial bepaald door de HED te delen door deze
veiligheidsfactor. De default veiligheidsfactor die normaal gebruikt wordt is 10. In bepaalde gevallen is
het aangewezen om deze veiligheidsfactor te verhogen (en dus MRSD te verlagen) of verlagen (en dus
MRSD te verhogen).
De veiligheidsfactor kan verhoogd worden bij:
- een steile dosis/respons-curve ( kan een indicatie zijn voor een groter risico voor mensen)
- ernstige, irreversibele toxiciteit ( indicatie voor hoger risico en kans op permanente letsels door
toxiciteit)
-
niet-opvolgbare toxiciteit ( bv histopathologische veranderingen die niet meteen gedetecteerd
kunnen worden door klinisch pathologische merkers)
-
toxiciteit of zelfs mortaliteit zonder voorafgaande, onverklaarbare tekens ( als het begin van
significante neveneffecten niet kan herkend worden door voorafgaande tekens, kan het moeilijk zijn
om te weten wanneer de toxische dosis bereikt wordt bij mensen in een trial)
variabele biologische beschikbaarheid tussen species of niet-lineaire farmacokinetiek ( grotere
kans om de toxiciteit bij mensen te onderschatten)
variabele plasmaniveaus of dosis-respons relatie ( minder mogelijkheden om de toxische dosis
voor mensen te voorspellen, moeilijk om dosis-respons curve te karakteriseren)
nieuwe doelwitten ( verhogen de onzekerheid om op preklinische data te vertrouwen)
gelimiteerde bruikbaarheid van het diermodel ( gelimiteerd bereik van data uit de diermodellen
en interpreteerbaarheid door gelimiteerde interspecies crossreactiviteit of immunogeniciteit)
De veiligheidsdosis kan verlaagd worden indien:
- De kandidaat geneesmiddelen behoren tot een zeer goed gekende en gekarakteriseerde klasse
van geneesmiddelen. Het potentieel nieuwe geneesmiddel moet dan wel toegediend worden
volgens dezelfde route, duur en schema en moet een gelijkaardig metabool en toxisch profiel
hebben over al de species die getest werden alsook de mens en ook de biologische
beschikbaarheid moet hetzelfde zijn.
- De toxiciteit geproduceerd door de nieuwe stof goed opvolgbaar is, omkeerbaar en
voorspelbaar, en als het geneesmiddel en milde tot matige dosis-respons relatie vertoond met
beperkte toxiciteit die gelijkaardig is onder de geteste species.
Na de HED gedeeld te hebben door een veiligheidsfactor, wordt de MRSD verkregen:
MRSD = HED/veiligheidsfactor.
Zie ook Appendix E van de FDA guideline van 2005
31
20. Bespreek de preklinische gegevens die ter beschikking moeten zijn alvorens een
studie op basis van een eCTA kan gestart worden. Maak een onderscheid tussen
microdosering, eCTAs met enkelvoudige en eCTAs met meervoudige dosering (cf.
ICH guideline M3).
De exploratory IND/CTA is vooral bruikbaar als:
- je verschillende compounds wil testen in 1 trial
- als je biomarkers wil testen, farmacokinetiek en farmacodynamiek wil nagaan en doelwit
bezetting
- je vragen kan beantwoorden met een minimum aantal deelnemers, een minimale
blootstellingduur of zonder de MTD te bereiken
- de studie van tolerantie en langdurige doeltreffendheid niet de primaire doelen zijn
Bij een gelimiteerd pakket van toxicologische data, kan men aan de hand van eCTA of eIND vroege, maar
gelimiteerde klinische testen uitvoeren. Dit bespaard tijd vooraleer beslissingen genomen kunnen
worden (8-9 maanden), leidt tot minder verbruik van API (600g tot 2,5kg minder) en minder FTE (FullTime Equivalent, = een manier om de betrokkenheid van een werknemer (onderzoeker) in een project
te meten) (1-2,5 FTEs minder).
De preklinische gegevens die beschikbaar moeten zijn alvorens een studie op basis van eCTA gestart kan
worden, zijn weergeven in de ICH guideline M3, sectie 7. Hierbij wordt een onderscheid gemaakt tussen:
- Microdosing:
Laat toe om in een vroeg stadium compounds te differentiëren op basis van PK (ADME,
biologische beschikbaarheid, T1/2, …) of receptorbezetting (PET-scans).
Vereisten voor totale dosis van 100 μg (met maximaal 5 toedieningen):
▪ Uitgebreide single-dose toxiciteitstudie in 1 relevant species met opoffering op dag 2 en dag
14
▪ Safety pharmacology
▪ Maximale, totale dosis ≤ 1/100 van de NOAEL en ≤ 1/100 van de PAD (Pharmacologically
Active Dose)
Vereisten voor totale dosis van 500 μg (met maximaal 5 toedieningen en wash-out tussenin):
▪ Volledige 7-dagen toxiciteitstudie in 1 relevant species (meestal in knaagdieren)
▪ Safety pharmacology
▪ SAR (Structure-Activity Relationship) beoordeling voor genotoxiciteit
▪ Elke maximale dosis < 100μg, ≤ 1/100 van de NOAEL en ≤ 1/100 van de PAD
[opmerking: radiofarmaceutica hebben in België toestemming nodig van het FANC (Federaal
Agentschap voor Nucleaire Controle)]
-
Single-dose exploratory trials:
Vereisten:
▪
▪
▪
▪
▪
-
Uitgebreide single-dose toxiciteitstudie in 2 relevante species, met een dosis tot MTD.
Ames test
Safety pharmacology + farmacologie om het bepalen van een menselijke dosis te
ondersteunen
MRSD enkel vaag bepalen: gebaseerd op toxiciteit en PAD
Maximale dosis tot 1/2 van de NOAEL van de meest gevoelige species
Multiple-dose exploratoru trials:
Tot 14 dagen, zonder de intentie om tot aan de MTD te gaan
‘The 4th approach’ (‘overage’ approach): vereisten
▪
2 weken toxiciteitstudie in 2 relevant species (knaagdier en niet-knaagdier). Enkel gaan tot
multiple (3x, 6x, 10x) toediening van vooraf gedefinieerde klinische blootstelling (AUC)
32
▪
▪
▪
▪
Als de MTD bereikt wordt: doorgaan zoals anders
Als de MTD niet bereikt wordt: kijken naar vooraf gedefinieerde blootstelling
Safety pharmacology: kan een deel vormen van toxiciteittrials
Genotoxiciteit: Ames test + in vivo micronucleus test en in vitro chromosomale aberratie
test
▪ Startdosis = 1/50 van de NOAEL (of MABEL?)
[opmerking: het is niet altijd gemakkelijk om de vereiste klinische blootstelling te voorspellen
nodig voor farmacologische activiteit!]
‘The 5th approach’ (FDA approach): vereisten
▪ 2 weken toxiciteitstudie in 1 relevant species (knaagdier) gaande tot de MTD +
bevestigingstrial in een niet-knaagdier (n=3) met een maximale duur die gelijk is aan de
klinische duur
▪ Maximale blootstelling: NOAEL voor niet-knaagdieren of ½ van de NOAEL voor knaagdieren
(laagste van de twee)
▪ Safety pharmacology: kan een deel vormen van toxiciteittrials
▪ Genotoxiciteit: Ames test + in vivo micronucleus test en in vitro chromosomale aberratie
test
▪ Startdosis = 1/50 van de NOAEL (of MABEL?)
21. Bespreek de verschillende soorten study/trial design met hun voor- en nadelen.
Mogelijke indelingen voor de verschillende soorten studie of trial design:
- Fase van ontwikkeling (Fase 0 – Fase IV)
- Beschrijvende trials vs. Analytische trials
Beschrijvende trials: Case report (casus), case series (gevallenreeks)
▪ Case report:
» Rapportering van 1 casus/observatie
» Vaak zeldzame of ongewone observatie (bv thalidomide)
» Concept: challenge, dechallenge, rechallenge
» Pro: goedkoop, eenvoudig en hypothese genererend
» Contra: weinig evidentie voor causaliteit (tenzij extreem zeldzaam) en geen hypothese testing
mogelijk
▪ Case series:
» Pooling van casussen (bv thalidomide)
» Pro: incidentie bepaling (cf. fase IV) en hypothese genererend
» Contra: weinig evidentie voor causaliteit (tenzij extreem zeldzaam) en geen controlegroep,
dus geen hypothese testing mogelijk
Analytische trials: Case-control studie, cohort studie en RCT (Randomized Control Trial)
▪ Case-control studie:
»
Pro:
o
o
o
Kan zeldzame en laattijdige reacties bestuderen
Kan meerdere blootstellingen onderzoeken
Eenvoudig, snel en goedkoop
33
»
-
Contra:
o Gevoelig voor vertekening (bias, afwijking van de waarheid) door selectie (selection
bias), informatie (information bias), herinnering (recall bias) of gevolg (classification
bias)
o Verwarrende variabelen (confounding)
▪ Cohort studie:
Een ‘cohort’ is een groep van personen die verder gaan in de tijd van blootstelling naar 1 of
meerdere ‘gevolgen’.
Een cohort studie is een vergelijking van blootgestelde patiënten met niet-blootgestelde
patiënten. Indien de blootgestelde patiënten een hogere of lagere frequentie vertonen van een
gevolg, dan is een associatie tussen blootstelling en gevolg waarschijnlijk.
» Pro:
o Kan meerdere reacties onderzoeken
o Kan zeldzame blootstellingen bestuderen
o Geen historische controles (indien prospectief)
o Gegevens over incidentie beschikbaar
» Contra:
o Grote groepen vereist
o Selectie bias
o Langdurig en duur bij zeldzame en laattijdige respons (indien prospectief)
▪ RCT:
» Pro:
o Controle voor onbekende en onmeetbare verwarrende variabelen
o Statistisch meest krachtig onderzoek (associatie ≈ causaal verband)
» Contra:
o Beperkt aantal deelnemers
o Beperkte blootstelling en opvolging in de tijd
o Inclusie en exclusie criteria (externe validiteit, wet van Lasagna)
o Artificieel
o Duur
o Logistiek veeleisend
o Ethische bezwaren
Observationele (of epidemiologische, niet-experimentele) trials vs. Experimentele trials
Indeling op basis van timing: retrospectieve, cross-sectionele of prospectieve studies
Indeling op basis van rekrutering: studies op basis van oorzaak (cohort) of gevolg (case-control)
VOORBEELDEN UIT DE OPDRACHTEN:
Case - controle studie (Groep 1)
[studie waarbij twee groepen vergeleken worden - retrospectief longitudinale studie - theoriegericht kwantitatief bekeken ]
Sterke punten:
Snel en goedkoop, aantal personen nodig voor studie is klein, historische data beschikbaar in klinische
records, cases gemakkelijk beschikbaar, goed voor minder voorkomende en zeldzame cases, uitvoering
door clinici in klinische faciliteiten, causale hypothese ondersteunen maar niet bewijzen
Zwakke punten:
Klinische data zijn onvolledig of niet betrouwbaar, antecedenten zijn niet altijd gekend, ‘’case group’’
kan niet homogeen zijn (criteria voor diagnose kan verschillen), klinische cases zijn selectieve survivors,
data geeft geen volledige populatie weer want soms zijn mensen met DM niet gediagnosticeerd
34
Retrospectieve cohortstudie (Groep 2, met dank aan Madam Michielsen)
Retrospectief onderzoek; een grote ziekenhuispatiënt database wordt gebruikt voor de analyse tijdens
deze studie. Bovendien gaat het hier om een cohortstudie. In een retrospectieve cohortstudie tracht
men een groep van een groep personen met een bepaalde ziekte (mortaliteit) de relevante gegevens
over blootstelling aan risicofactoren uit het verleden te achterhalen.
VOORDELEN:
* Je kan de incidenties berekenen en het relatieve risico en het verschil in risico
* Je kan de 2 groepen matchen ten opzichte van elkaar
NADELEN:
* In dit medisch onderzoek werden de data in de databank niet vergeleken met de originele gegevens
* Wanneer je gebruik maakt van een gegevensbank, kan je nadien geen extra metingen doen en
bijkomende parameters bepalen. Zo kan bij de vraag van blootstelling geen dosis-respons curve
opgesteld worden omdat de gewichten van de patiënten niet gegeven zijn
Prospectieve, gerandomiseerde studie (groep 3 met dank aan Madam Stappers)
Een studie waarin de methoden voor het analyseren van de data reeds gespecificeerd worden in het
protocol voordat de studie begint. De patiënten worden at random in twee groepen verdeeld, waarbij 1
groep behandeld wordt met het te bestuderen geneesmiddel en de andere (controle) groep met een
placebo. Noch patiënten, noch arts weten welke behandeling aan welke patiënt wordt toegewezen.
Voordelen: de patiënten de mogelijkheid krijgen om een behandeling te volgen die beter kan zijn dan
de reeds bestaande behandeling en die niet beschikbaar is voor patiënten buiten de studie. Patiënten
worden daarnaast ook regelmatig opgevolgd door een research team van professionele
gezondheidsmedewerkers, dokters en andere onderzoekers. Personen mogelijks als eerste genieten van
het voordeel van de bestudeerde nieuwe therapie en de resultaten van de studie kunnen anderen
helpen in de toekomst.
Nadelen: nieuwe therapie niet altijd beter werkt dan de reeds bestaande therapie en dat er mogelijks
nevenwerkingen kunnen optreden, die niet verwacht of voorspeld kunnen worden. Patiënten die
deelnemen aan een gerandomiseerde studie kunnen ook niet zelf kiezen welke therapie ze krijgen
(placebo of het echte geneesmiddel). Daarnaast kan het ook zijn dat de verzekering en voorziene zorg
niet al de kosten dekt voor de patiënten in de studie en dat patiënten meer raadplegingen bij een dokter
moeten bijwonen dan het geval zou zijn wanneer ze niet aan de klinische trial zouden deelnemen.
Meta-analyse (groep 4 met dank aan de sokke)
Doet beroep op voorgaande studies en documenten. Gegevens worden dan samengevoegd om een
concreter en betrouwbaarder besluit te vormen.
Sterke punten:
- verschillende onderzoeken over hetzelfde onderwerp leiden tot een krachtiger besluit
- duur van deze studie is korter aangezien enkel gegevens uit vroegere onderzoeken moeten worden
opgevraagd en dus geen nieuw onderzoek moet worden opgestart
Zwakke punten:
- nieuwe statistische analyse uitvoeren
- omstandigheden waarin verschillende onderzoeken werden uitgevoerd kunnen verschillen en daarom
niet altijd betrouwbaar vergeleken worden
- onderzoek waar geen significante uitkomst uit naar voren is gekomen wordt vrij vaak niet
gepubliceerd, waardoor bij het metaonderzoek een onevenredig groot aandeel significante
onderzoeksuitkomsten verkregen wordt wat het effect kan vertekenen
- niet objectief: één en dezelfde dataset kunnen in verschillende handen tot geheel verschillende
conclusies leiden
35
22. Wat is GCP, op wie is het van toepassing, wat is het doel van de implementatie van
GCP en wie heeft er belang bij GCP in klinisch onderzoek?
GCP staat voor Good Clinical Practice en is een term die gebruikt wordt voor de verzameling van regels,
aanbevelingen en richtlijnen over ‘HOE’ goed, klinisch onderzoek zou moeten gebeuren. GCP is een
onderdeel van de ICH guidelines (ICH guideline E6) en wordt daarin omschreven als: ‘ Een internationale
ethische & wetenschappelijke kwaliteitsstandaard voor het ontwerpen, uitvoeren, opnemen en
publiceren van trials die de participatie van menselijke deelnemers omvatten.’. De richtlijnen in GCP zijn
gebaseerd op de verklaring van Helsinki en de volgende 13 principes staan centraal:
- Volg de ethische principes
- Voordelen > risico’s
- Bescherming van de patiënten en veiligheid
- Adequate informatie over het te onderzoeken product (Investigational Product, IP)
- Wetenschappelijk protocol
- Goedkeuring verkregen van het IRB/IEC (Institutional Review Board / Independent Ethics
Committee)
- Volg het protocol tot in de details
- Gekwalificeerde arts is verantwoordelijk voor de studie en medische beslissingen
- Vrijwillig gegeven informed consent verkrijgen
- Accurate klinische studiedocumenten bijhouden
- Vertrouwelijkheid respecteren en gegevens privacy wetten
- GMP en protocols volgen in verband met het IP
- Quality Assurance procedures volgen
De GCP richtlijnen zijn van toepassing op iedereen die betrokken is bij een klinische studie, nl. de
monitor, onderzoeker, personeel (arts, verpleegkundigen), deelnemers, sponsor en ethisch comité.
- De monitor of Clinical Research Associate (CRA) wordt aangeduid door de sponsor om de
klinische trial te begeleiden (5 peilers voor een CRA: train, check en controleer, vind en
corrigeer, geef feedback en evalueer).
- De onderzoeker (‘investigator’) is de persoon die verantwoordelijk is voor het uitvoeren van de
klinische trial. Als de trial uitgevoerd wordt door een team van individuen (‘sub-investigators’),
dan is de onderzoeker de verantwoordelijke leider van het team en wordt dan de
hoofdonderzoeker (‘principle investigator’) genoemd.
- De sponsor is een individu, bedrijf, instituut of organisatie die de verantwoordelijkheid neemt
voor de initiatie, het management en/of de financiering van een klinische trial. De sponsor kan
een CRO (Contract Research Organization) inschakelen, die er dan voor zal zorgen dat de trial
opgevolgd en begeleid wordt. Een sponsor is niet per se een bedrijf dat geneesmiddelen
produceert. Kan ook een ziekenhuis zijn (bv arts wil een bestaand geneesmiddel gebruiken voor
een nieuwe toepassing (vb. viagra voor pulmonale hypertensie). De sponsor is dan het
ziekenhuis waarvoor de arts werkt.)
- Het Ethisch comité (zie vraag 25)
- Het personeel, zoals artsen en verpleegkundigen die betrokken zijn bij de klinische studie
- De deelnemers (gezonde vrijwilligers, patiënten), GCP beschermt de deelnemers en probeert te
verhinderen dat ze worden blootgesteld aan te hoge risico’s!
De implementatie van GCP heeft als doel ervoor te zorgen dat:
- deelnemers (vrijwilligers) voldoende beschermd worden
- klinische trials gebaseerd zijn op goede wetenschap
- de studie procedures goed gevolgd en gedocumenteerd worden
- de verkregen gegevens compleet, accuraat en zonder fouten verwerkt en bewaard worden
Wanneer de GCP richtlijnen niet worden opgevolgd:
36
-
worden deelnemers mogelijks blootgesteld aan te hoge risico’s
worden de rechten van de deelnemers mogelijks overtreden
is de verkregen data mogelijks onbetrouwbaar
zal de studie afgekeurd worden door de overheid
Zowel de onderzoeker, sponsor als de deelnemers ondervinden voordelen van de GCP richtlijnen. De
onderzoeker verwerft wetenschappelijke geloofwaardigheid en verantwoordelijkheden, de sponsor
krijgt internationale, regulatorische goedkeuring, kwaliteitsgoedkeuring en accurate data om verder
beslissingen te maken. De deelnemers dan tenslotte zijn er zeker van dat hun rechten niet geschonden
worden en wat hen gevraagd wordt te doen ethisch verantwoord is.
23. Wat is ICH? Wat zijn de doelstellingen ervan en op welke topics heeft het
betrekking?
ICH staat voor International Conference on Harmonization of technical requirements for registration of
pharmaceuticals for human use. Het is een gezamenlijk tripartiet initiatief waarbij zowel regulatorische
groepen als industrie betrokken zijn, om wetenschappelijke en technische discussies te voeren over
testprocedures die nodig zijn om de veiligheid, kwaliteit en doeltreffendheid te beoordelen en
verzekeren en om richtlijnen te creëren voor humaan onderzoek. Het brengt de overheden van Europa,
Japan en de US samen met deskundigen van farmaceutische industrie in deze 3 regio’s om te
discussiëren over de wetenschappelijke en technische aspecten van productregistratie. De doelen van
het ICH zijn:
- behoud van veiligheid, kwaliteit en doeltreffendheid
- regulatorische verplichtingen om de publieke gezondheid te beschermen
- aanbevelingen maken over manieren om een beter harmonisatie te bereiken
- economisch gebruik van menselijke, dierlijke en materiële bronnen
- eliminatie van onnodige vertraging in de globale ontwikkeling en beschikbaarheid van nieuwe
geneesmiddelen
De ICH topics zijn onderverdeeld in 4 grote categorieën en elke topic heeft een eigen, specifieke code.
De ICH Topic Codes werden toegewezen volgens deze categorieën. De topics waarop de ICH guidelines
betrekking hebben, zijn de volgende:
- Kwaliteit (Quality): chemische en farmaceutische kwaliteit verzekering (vb. code: ICH Guideline
Q5)
- Veiligheid (Safety): in vitro en in vivo preklinische testen (vb. code: ICH Guideline S7)
- Doeltreffendheid (Efficacy): klinische studies bij mensen (vb. code: ICH Guideline E6)
- Multidisciplinariteit (Multidisciplinarity): standaardisatie van medische terminologie voor
regulatorische doeleinden, elektronische standaarden voor de overdracht van regulatorische
gegevens en algemene documenten, non-klinische veiligheidstudies (vb. code: ICH Guideline
M8)
Deze richtlijnen kunnen opgenomen worden in nationale en/of regionale interne procedures.
24. Bespreek de procedure voor het bekomen van een geïnformeerde toestemming
voor deelname aan een klinische studie (i.e. the “Informed Consent” proces).
De procedure om een geïnformeerde toestemming voor deelname aan een klinische studie te verkrijgen
is een stapsgewijs proces. In de eerste plaats moet de onderzoeker, of een persoon aangesteld door de
onderzoeker, de deelnemers volledig informeren over de klinische studie waaraan ze zullen deelnemen.
Al de relevante aspecten, doeleinden en gegevens over de studie moeten meegedeeld en uitgelegd
worden zodat dit duidelijk is voor de deelnemers (zoals de behandelingen en procedures,
37
verantwoordelijkheden van de deelnemers, experimentele set-ups, de risico’s en ongemakken, de
verwachte voordelen, mogelijke compensatie, mogelijke kosten, dat deelname vrijwillig is, duur van de
studie/deelname, …) . Een geschreven document (‘informed consent form’) dat goedgekeurd werd
door het IRB/IEC moet aan elke deelnemer gegeven worden. Dit document moet geschreven zijn met
simpele woorden, duidelijk en praktisch, met zo min mogelijk technische termen. Het document moet
begrijpbaar zijn voor de deelnemers. Wanneer een deelnemer niet kan lezen, moet het voorgelezen en
uitgelegd worden door de onderzoeker (of iemand aangeduid door de onderzoeker) in het nabij zijn van
een onafhankelijke getuige. Voordat het informed consent form ondertekend wordt, moet men de
deelnemers de tijd en mogelijkheden geven om meer informatie te verzamelen over de details van de
studie en om te beslissen of ze al dan niet willen deelnemen aan de studie. Als er nog vragen zijn,
moeten deze zo goed mogelijk beantwoord worden zodanig dat de deelnemers tevreden zijn met het
antwoord. Al de vragen die er zijn over de trial, moeten beantwoord worden. Voordat vrijwilligers
mogen deelnemen aan de trial, moet het informed consent form ondertekend zijn door de deelnemer
zelf en door de persoon die bij de gesprekken was over mogelijke deelname. Daarbij wordt ook de
datum van ondertekening vermeld. Na de ondertekening, moet een kopie van het document
meegegeven worden aan de deelnemers. Deelnemers mogen niet onder druk gezet worden om deel te
nemen of onder eender welke omstandigheden omgepraat worden. Het geschreven informed consent
document mag ook geen taal bevatten waarin geïnsinueerd wordt dat een deelnemer moet afstaan van
zijn rechten. Wanneer nieuwe informatie beschikbaar is die relevant is voor de deelnemer en zijn
bereidheid om deel te nemen aan de studie kan beïnvloeden, moet deze op tijd doorgegeven worden
en de communicatie van deze informatie moet gedocumenteerd worden.
Het verkrijgen van een informed consent is een belangrijke eerste stap in het opstarten van een
klinische trial. Het bevestigt dat de deelnemers vrijwillig deelnemen aan de studie. Het moet
ondertekend worden VOORDAT een studieprocedure gestart wordt!
25. Wat is een IRB /
verantwoordelijkheden.
IEC?
Bespreek
haar
functie,
samenstelling
en
IRB/ IEC staat voor Institutional Review Board / Independent Ethics Committee. Het is een
onafhankelijk comité van medische, wetenschappelijke en niet-wetenschappelijke leden die de
rechten, veiligheid en het welzijn van de deelnemers van een klinische trial beschermen. Ze doen dit
onder andere door (continue) herziening en goedkeuring van trial protocols, amendementen en
methoden en materialen die gebruikt worden in het verkrijgen en documenteren van een informed
consent.
Het IRB/IEC bestaat uit een redelijk aantal leden, die collectief de kwalificaties en ervaring hebben om
de wetenschap, medische aspecten en ethiek van de voorgestelde trial te beoordelen en evalueren. Het
comité telt minstens 5 leden, waarvan minstens 1 niet wetenschappelijk lid, 1 onafhankelijk lid (van
het centrum waar de trial wordt uitgevoerd) en 3 IRB leden. Van deze IRB leden krijgt 1 persoon de
verantwoordelijkheid van voorzitter van het comité.
De verantwoordelijkheden van het IRB/IEC zijn de volgende:
- Ze staan in voor de bescherming van de rechten, veiligheid en het welzijn van de deelnemers en
geven hierbij extra aandacht aan trials waaraan kwetsbare personen deelnemen
- Ze moet volgende documenten krijgen en beoordelen:
▪ Trial protocols/amendementen
▪ Geschreven informed consent formulieren
▪ Rekruteringsprocedures
▪ Geschreven informatie die zal worden meegegeven aan de deelnemers
▪ Onderzoekerbrochure
38
-
-
▪ Veiligheidsinformatie
▪ Informatie over betalingen en compensaties voor de deelnemers
▪ Curriculum Vitae van de onderzoeker en eventuele andere documenten hieromtrent
Ze evalueren de voorgestelde trial en documenten en ze blijven dit doen gedurende het verloop van
de studie (minstens 1 keer per jaar). Zo kunnen ze afwijkingen of veranderingen waarnemen en
beoordelen, veiligheidsrapportering en nieuwe informatie over veiligheid evalueren en
studievooruitgang en berichtgevingen over beëindiging van de studie controleren. Ze verzekeren
hierbij dat enkel leden die onafhankelijk zijn van de opdrachtgever deelnemen aan de stemming.
het IRB/IUC moet zijn advies uitgeven in een geschreven document
Ze evalueren de kwalificaties van de onderzoekers
Ze maken beslissingen tijdens aangekondigde vergaderingen (waarop een minimum aantal leden
aanwezig is (= quorum))
Ze behouden adequate verslagen
Ze evalueren de methode en hoeveelheid van betaling aan de deelnemers
Ze moeten hun functie uitoefenen volgens de geschreven SOPs van de opdrachtgever, volgens GCP
en volgens de toepasbare regulatorische vereisten
Ze moeten al de relevante documenten en registraties gedurende ten minste drie jaar na het
beëindigen van de trial bijhouden en beschikbaar stellen voor de overheid wanneer hierachter
gevraagd wordt
Dankzij het IRB/IEC is er meer vertrouwen om een klinische trial uit te voeren en is er een garantie dat
het onderzoek de potentiële risico’s voor de deelnemers tot een minimum beperkt.
26. Wat is het verschil tussen: monitoring, auditing en inspectie van een klinische
studie?
De monitor of Clinical Research Associate (CRA) wordt aangeduid door de sponsor om de klinische trial
te begeleiden (5 peilers voor een CRA: train, check en controleer, vind en corrigeer, geef feedback en
evalueer). De monitor zal nagaan of de rechten en het welzijn van de deelnemers worden beschermd,
dat de gerapporteerde trial data accuraat, volledig en verifieerbaar zijn met de brondocumenten en dat
de trial wordt uitgevoerd volgens de protocols, amendementen, GCP en de toepasbare regulatorische
vereisten die op dat moment van toepassing zijn! Hij zal hiervoor specifiek de volgende processen
opvolgen en begeleiden indien nodig:
- verzekeren dat het protocol gevolgd wordt
- het informed consent proces
- verificatie van de brondata
- medische stock nakijken en de manier waarop stalen behandeld worden
- beoordeling van het laboratorium
De monitor is ook verantwoordelijk voor de communicatie tussen de onderzoeker en de sponsor en zal
nagaan of de onderzoeker de juiste documenten bijhoudt. De monitor zal tenslotte ook een rapport (of
meerdere) schrijven na elk bezoek aan de trial site of na communicatie met de onderzoeker of het
trialpersoneel. Dit rapport omvat een samenvatting van wat gecontroleerd werd, de bevindingen van de
monitor daaromtrent, eventuele afwijkingen en tekortkomingen, de conclusies van de monitor en
aanbevelingen om het goed opvolgen van de regels te verzekeren.
Een audit is een systematisch en onafhankelijk onderzoek van de trialgerelateerde activiteiten en
documenten om te bepalen of deze activiteiten wel degelijk werden uitgevoerd en dat de data
geregistreerd, geanalyseerd en accuraat gerapporteerd werden, volgens het protocol, de SOPs
(Standard Operating Procedures) van de sponsor, GCP en de toepasselijke regulatorische vereisten. Een
audit is verschillend van de job van een monitor. Het gebeurt immers maar 1 keer tijdens het verloop
van de trial en tijdens de audit zal heel de studie tot op dat punt geëvalueerd worden. De focus van een
39
audit ligt vooral op de processen van de studie en de persoon die de audit komt doen is onafhankelijk en
heeft niets met de studie te maken, maar wordt wel gestuurd door de sponsor. Men spreekt daarom
van interne auditeurs en een interne kwaliteitscontrole.
Hier ligt dan weer het verschil met een inspectie van een klinische studie. Een inspectie wordt immers
uitgevoerd in opdracht van de overheid. Dit is een officiële evaluatie van de documenten, faciliteiten,
registraties en elke andere bron die verondersteld wordt gerelateerd te zijn aan de trial en die
gelokaliseerd zijn op de plaats waar de trial wordt uitgevoerd of in de faciliteiten van de sponsor.
Inspecteurs kijken of de studie wordt uitgevoerd volgens de GCP richtlijnen, de procedures van het
bedrijf en de industrie. Men spreekt in dit geval van externe, regulatorische inspecteurs.
Een audit is dus in opdracht van de sponsor en is een eenmalige evaluatie van een onafhankelijk
persoon om zeker te zijn dat alles gebeurt volgens de regels. Een inspectie is ook een eenmalige
evaluatie, maar dit keer in opdracht van de overheid. Dit is dus een officiële evaluatie van heel de trial
zodat ook de overheidsinstanties overtuigd zijn van de goede uitvoering van de trial. Een monitor is dan
weer een persoon die de trial continu opvolgt en begeleid om zo goed mogelijk de regels op te volgen.
27. Belgische wet inzake experimenten op de menselijke persoon: bespreek
experiment versus proef? Tussen welke soorten experimenten en proeven maakt
de Belgische wet een onderscheid?
Definities volgens de Belgische wet inzake experimenten op de menselijke persoon:
Een experiment is volgens deze wet elke op de mens uitgevoerde proef, studie of onderzoek met het oog
op de ontwikkeling van biologische of medische kennis.
Een (klinische) proef is onderzoek bij de mens bedoeld om farmacokinetische en/of farmacodynamische
effecten van een geneesmiddel te bestuderen of te bevestigen en/of eventuele bijwerkingen te
signaleren om zo de veiligheid en/of werkzaamheid van dit geneesmiddel vast te stellen.
[ = interventionele proef]
Deze Belgische wet onderscheidt daarnaast volgende proeven en experimenten:
Een proef van fase I is volgens deze wet dan weer onderzoek zonder therapeutisch doeleinde bij gezonde
vrijwilligers of bepaalde patiënten bedoeld om veiligheid, tolerantie, werkzaamheid, farmacokinetische
en/of farmacodynamische effecten van een geneesmiddel te bestuderen. (bv antihypertensivum bij klein
aantal personen, maar niet met doel bloeddruk te verlagen, al hoopt men natuurlijk wel op dit effect!)
Een proef zonder interventie is onderzoek waarbij de geneesmiddelen worden voorgeschreven op de
gebruikelijke wijze. Het besluit om een geneesmiddel voor te schrijven staat geheel los van het besluit om
een patiënt te laten deelnemen aan het onderzoek. De patiënt in kwestie hoeft geen extra diagnostische
of controleprocedure te doorlopen en voor de analyse van de verkregen resultaten worden
epidemiologische methodes gebruikt. (bv een bloeddruk verlagend geneesmiddel dat al lang op de markt
is en waarvan vermoed wordt dat het leidt tot een te snelle daling van de bloeddruk waardoor meer
personen vallen en heup breken. Gegevens registreren en prospectieve, epidemiologische opvolging.
Men hoeft hiervoor geen toestemming te vragen aan de overheid, enkel aan de ethische commissie)
Een monocentrisch experiment is een experiment uitgevoerd volgens een enkel protocol en op een
enkele locatie.
40
Een multicentrisch experiment is een experiment dat volgens 1 bepaald protocol, maar op verschillende
locaties en derhalve door meerdere onderzoekers wordt uitgevoerd.
Een niet-commercieel experiment is elk experiment waarbij:
- de opdrachtgever een ziekenhuis is, het Fonds National de la Recherche Scientifique, het Fonds voor
Wetenschappelijk Onderzoek, een fonds dat van beide voorgaande Fondsen afhangt, een dienst van
een ziekenhuis of een ander daartoe erkende organisatie.
- De houder van het octrooi van een geneesmiddel of van een gedeponeerd merk van een medisch
hulpmiddel waarop de experimenten betrekking hebben, noch rechtstreeks, noch onrechtstreeks de
opdrachtgever van het experiment is.
- De opdrachtgever de intellectuele eigendomsrechten uitoefent op het concept van een experiment,
de uitvoering ervan en de wetenschappelijke gegevens die eruit voortvloeien.
28. Bespreek de samenstelling en verantwoordelijkheden van de Ethische commissie
voor klinisch onderzoek zoals beschreven in de Belgische wetgeving. Stemt dit
overeen met de vereisten zoals beschreven in ICH-GCP?
Volgends de Belgische wet inzake experimenten op de menselijke persoon is het ethisch comité een
onafhankelijke instantie die is samengesteld uit minimum 8 en maximum 15 leden. Hierbij zijn de twee
geslachten vertegenwoordigd en is er een meerderheid aan geneesheren. Ook is er ten minste 1 jurist
lid van de ethische commissie. De ethische commissie heeft de goedkeuring van de minister van
Volksgezondheid (minister Laurette Onkelinx). Om gemachtigd te zijn om zijn opdrachten uit te voeren
zoals bedoeld door deze wet, kan het ethisch comité aantonen (aan de minister) dat het ten minste 20
nieuwe protocollen analyseert per jaar. De leden van het comité bezorgen aan de minister een
verklaring die de directe of indirecte banden vermeldt die zij hebben met de opdrachtgevers van het
onderzoek, met uitzondering de opdrachtgevers van niet-commerciële experimenten. Leden van de
ethische commissie kunnen niet geldig deelnemen aan een stemming indien ze niet onafhankelijk zijn
van de opdrachtgever.
De verantwoordelijkheden van de ethische commissie volgens de Belgische wetgeving:
Het ethisch comité is bevoegd advies over een klinische trial en houdt hierbij rekening met de volgende
elementen:
- de relevantie van het experiment en de opzet ervan
- de toereikendheid van de beoordeling van de verwachte voordelen en risico’s alsook de
gegrondheid van de conclusies (zowel op therapeutisch vlak als op gebied van volksgezondheid)
- het protocol
- de bekwaamheid van de onderzoeker en zijn medewerkers
- het onderzoeksdossier
- de geschiktheid van de faciliteiten
41
-
-
de adequaatheid en de volledigheid van de te verstrekken informatie en de procedure om de
toestemming vast te leggen om deel te nemen. Dit betreft ook de motivering van onderzoek met
personen die geen toestemming kunnen geven of wiens toestemming niet kan verkregen worden
omwille van de hoogdringendheid wat hun deelname aan experiment betreft.
De regelingen voor compensatie en/of schadevergoeding wanneer een deelnemer ten gevolge van
een experiment een letsel oploopt of sterft
Verzekeringen of andere waarborgen om de aansprakelijkheid van de onderzoeker en de
opdrachtgever te dekken
De eventuele bedragen en regels inzake de betaling, vergoeding en schadeloosstelling van de
onderzoekers en deelnemers, alsook de relevante elementen uit de overeenkomst tussen de
opdrachtgever en de locatie
IRB/ IEC staat voor Institutional Review Board / Independent Ethics Committee. Het is een
onafhankelijk comité van medische, wetenschappelijke en niet-wetenschappelijke leden die de
rechten, veiligheid en het welzijn van de deelnemers van een klinische trial beschermen. Ze doen dit
onder andere door (continue) herziening en goedkeuring van trial protocols, amendementen en
methoden en materialen die gebruikt worden in het verkrijgen en documenteren van een informed
consent.
Het IRB/IEC bestaat uit een redelijk aantal leden, die collectief de kwalificaties en ervaring hebben om
de wetenschap, medische aspecten en ethiek van de voorgestelde trial te beoordelen en evalueren. Het
comité telt minstens 5 leden, waarvan minstens 1 niet wetenschappelijk lid, 1 onafhankelijk lid (van
het centrum waar de trial wordt uitgevoerd) en 3 IRB leden. Van deze IRB leden krijgt 1 persoon de
verantwoordelijkheid van voorzitter van het comité.
De verantwoordelijkheden van het IRB/IEC zijn de volgende:
- Ze staan in voor de bescherming van de rechten, veiligheid en het welzijn van de deelnemers en
geven hierbij extra aandacht aan trials waaraan kwetsbare personen deelnemen
- Ze moet volgende documenten krijgen en beoordelen:
▪ Trial protocols/amendementen
▪ Geschreven informed consent formulieren
▪ Rekruteringsprocedures
▪ Geschreven informatie die zal worden meegegeven aan de deelnemers
▪ Onderzoekerbrochure
▪ Veiligheidsinformatie
▪ Informatie over betalingen en compensaties voor de deelnemers
▪ Curriculum Vitae van de onderzoeker en eventuele andere documenten hieromtrent
- Ze evalueren de voorgestelde trial en documenten en ze blijven dit doen gedurende het verloop van
de studie (minstens 1 keer per jaar). Zo kunnen ze afwijkingen of veranderingen waarnemen en
beoordelen, veiligheidsrapportering en nieuwe informatie over veiligheid evalueren en
studievooruitgang en berichtgevingen over beëindiging van de studie controleren. Ze verzekeren
hierbij dat enkel leden die onafhankelijk zijn van de opdrachtgever deelnemen aan de stemming.
- het IRB/IUC moet zijn advies uitgeven in een geschreven document
- Ze evalueren de kwalificaties van de onderzoekers
- Ze maken beslissingen tijdens aangekondigde vergaderingen (waarop een minimum aantal leden
aanwezig is (= quorum))
- Ze behouden adequate verslagen
- Ze evalueren de methode en hoeveelheid van betaling aan de deelnemers
- Ze moeten hun functie uitoefenen volgens de geschreven SOPs van de opdrachtgever, volgens GCP
en volgens de toepasbare regulatorische vereisten
42
-
Ze moeten al de relevante documenten en registraties gedurende ten minste drie jaar na het
beëindigen van de trial bijhouden en beschikbaar stellen voor de overheid wanneer hierachter
gevraagd wordt
Het akkoord van een IRB/IEC moet op papier staan, het akkoord van de overheid niet, maar dit gebeurt
meestal wel.
Ethische commissie:
- goedkeuring
- goedkeuring mist aanpassing (meestal van informed consent)
- afkeuring [ eens het op 1 plaats is afgekeurd (bv Leuven) kan je niet nog eens proberen op een
andere plaats (bv Brussel)]
29. Belgische wet inzake experimenten op de menselijke persoon: bespreek het
toepassingsgebied van deze wet. In welke mate stemt dit toepassingsgebied
overeen met het toepassingsgebied van de Europese Directieve van 2001?
De Europese Directieve is meer dan een richtlijn, maar nog geen wet. Het is een richtlijn op weg naar
een wet (krijtlijn), elk land mag bij implementatie deze directieve nog strenger maken, maar niet losser.
De Europese Directieve is alleen van toepassing op klinische trials, terwijl de Belgische wetgeving
verder uitgebreid is en ook van toepassing is op experimenten buiten klinische trials (dus niet enkel
experimenten voor geneesmiddelenonderzoek). De Belgische wetgeving heeft dus een breder bereik
dan de Europese Directieve.
De Belgische wet inzake experimenten op de menselijke persoon hebben betrekking op:
- Alle experimenten bij de menselijke persoon (ook experimenten waarbij geen geneesmiddelen
worden gebruikt):
▪ geneesmiddelenonderzoek
▪ experimenten met medische hulpmiddelen (bv plaatsen van stent bij coronaire
vernauwing)
▪ onderzoek met chirurgische technieken
▪ epidemiologisch (prospectief) onderzoek
▪ …
- uitgezonderd ‘wetenschappelijk onderzoek’ met:
▪ embryo’s in vitro
▪ humaan biologisch materiaal gescheiden van het lichaam
▪ lijken
▪ retrospectief onderzoek
De Europese Directieve heeft betrekking op:
- de uitvoering van klinische trials (waarbij medische producten betrokken zijn) op menselijke
deelnemers
- de opvolging van de internationaal erkende ethische en wetenschappelijke kwaliteitsvereisten
5GCP
- bescherming van de personen die deelnemen aan een klinische trial
- exclusief niet-interventionele proeven
Een klinische studie kan enkel opgestart worden na positief advies van een ethische commissie en
wanneer er geen grote tegenstand is vanuit de bevoegde overheidsinstanties.
43
30. Belgische wet inzake experimenten op de menselijke persoon: beschrijf de
procedure die moet doorlopen worden alvorens een interventionele proef in
België mag gestart worden.
Een klinische (interventionele) proef mag niet gestart worden zonder:
- een uniek advies van de ethische commissie over de trial
- een advies van de ethische commissie van elk hospitaal dat deelneemt aan de trial
- het indienen van een klinische trial applicatie bij de bevoegde overheidsinstanties (CA of
Competent Authority)
- geen afkeuring te hebben ontvangen binnen de behandelingsperiode (wettelijke vertragingen)
van de aanvraag (applicatie)
[ ‘legal delays’ omvatten over het algemeen 28 dagen en 15 dagen voor een monocentrische fase I
proef en deze delay-periode start van het moment dat een VOLLEDIG aanvraagdossier werd ontvangen.
Wanneer informatie ontbreekt, wordt deze periode stilgelegd tot de ontbrekende informatie wordt
opgestuurd en ontvangen (clock-stop).]
De procedure die doorlopen moet worden om een klinische proef te kunnen starten is hieronder
schematisch weergegeven:
In de eerste plaats moet een Europees registratie formulier ingediend worden opdat een Europees
EudraCT ( European union drug regulating authorities Clinical Trials) nummer kan verkregen worden.
EudraCT is de Europese klinische trial database waarin al de klinische trials in Europa terug te vinden
zijn. Elke klinische trial met ten minste 1 trialcentrum in Europa ontvangt een identificatienummer, het
EudraCT nummer. Dit identificatienummer moet inbegrepen worden in al de klinische trial applicaties
(CTA of Clinical Trial Application) binnen de Europese gemeenschap en moet ook vermeld worden op al
de documenten gerelateerd aan de klinische trial.
Nadat een identificatienummer is verkregen, moet nationale aanvraag ingediend worden bij de
bevoegde overheidsinstanties (CA of Competent Authorities). Hiertoe wordt een CTA ingediend bij het
FAGG of Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten (cf. FAMHP of Federal
Agency of Medicines and Health Products). Een CTA bevat:
- een ‘cover letter’
- het protocol
44
-
de onderzoeksbrochure (Investigator ’s Brochure, IB of Clinical Investigator ’s Brochure, CIB)
het Europees applicatie formulier (EudraCT)
een IMPD of Investigational Medicinal Product Dossier (chemisch-farmaceutisch dossier) voor
elk IMP (Investigational Medicinal Product). Aan de hand van het IMPD kan het FAGG een
beoordeling maken over de kwaliteit van het geneesmiddel.
- informatie over het productieproces (GMP of Good Manufacturing Practices)
Op basis van dit CTA zal het FAGG dan al dan niet een goedkeuring geven voor het starten van de
klinische trial. Het FAGG geeft:
- een stilzwijgende toelating (Tacit approval) indien er geen gemotiveerde bezwaren zijn. Voor
fase I wordt een advies gegeven maximum 15 (kalender)dagen na het indienen van de aanvraag
(inclusief 3 dagen validatieperiode), voor andere dan fase I proeven gebeurd dit binnen een
periode van maximum 28 (kalender)dagen (inclusief 3 dagen validatieperiode).
- Een schriftelijke toelating voor trials betreffende:
▪ Gen- of celtherapie
▪ Producten op basis van biotechnologische processen
▪ Cf. concept van ‘advanced therapies’ ( wat wordt hiermee bedoeld?)
Tenslotte moet het CTA ook ingediend worden bij de ethische commissie. Voor een monocentrische
studie moet de aanvraag ingediend worden bij de lokale ethische commissie (van het centrum waar de
trial uitgevoerd wordt). Bij een multicentrische studie moet de aanvraag ingediend worden bij een
centrale (leidende) ethische commissie en bij de lokale ethische commissie(s). Deze lokale ethische
commissie beoordeelt het CTA enkel op de kwalificaties van de onderzoeker en de kwaliteit van de
faciliteiten en het informed consent proces. De lokale commissie zal vervolgens haar advies doorgeven
aan de leidinggevende commissie, die dan tenslotte 1 algemeen, geschreven advies zal doorgeven aan
de sponsor van de klinische trial. Als leidinggevende commissie wordt bij voorkeur gekozen voor een
universitaire ethische commissie. Als er meerdere mogelijke keuzes zijn, ligt de keuze bij de
opdrachtgever (sponsor). De ethische commissie zal in geval van een monocentrische studie haar advies
geven binnen een periode van maximum 15 dagen. In geval van een multicentrische studie is het
tijdsverloop als volgt:
De aanvraag wordt gelijktijdig ingediend bij al de commissies (d.i. de leidinggevende commissie plus
de lokale ethische commissies van de verschillende centra die deelnemen aan de trial).
De leidinggevende commissie heeft vervolgens 20 dagen de tijd om een advies te formuleren en door
te geven aan de lokale commissies
De lokale commissies hebben dan 5 dagen de tijd om een antwoord te formuleren
(ja/neen/opmerkingen) en dit door te geven aan de leidinggevende commissie
Daarna heeft de leidinggevende commissie nog 3 dagen de tijd om een enkele, geschreven opinie te
formuleren
31. Geef een overzicht van de fysicochemische parameters die in de preformulatie fase
van een geneesmiddel bestudeerd worden.
Een geneesmiddel is een combinatie van een actief bestanddeel en een aantal hulpstoffen, die er mee
voor zorgen dat het actief bestanddeel op de juiste plaats in het lichaam terechtkomt (dus de plaats
waar het werkzaam moet zijn). Vele behandelingen vragen dan ook specifieke toedieningsvormen
waarmee men bij de ontwikkeling van geneesmiddelen dan ook rekening moet houden.
De fysicochemische parameters die in de preformulatiefase van een geneesmiddel belangrijk zijn, zijn
hieronder weergegeven:
- De oplosbaarheid bepaalt mede de doseervorm en de formuleringsstrategie voor een bepaalde
toedieningsweg.
45
BCS (Biopharmaceutics Classification System) - classificatie:
Class I – High Permeability, High Solubility
o Those compounds are well absorbed and their absorption rate is usually higher than
excretion.
Class II - High Permeability, Low Solubility
o The bioavailability of those products is limited by their solvation rate. A correlation
between the in vivo bioavailability and the in vitro solvation can be found.
Class III - Low Permeability, High Solubility
o The absorption is limited by the permeation rate but the drug is solvated very fast. If the
formulation does not change the permeability or gastro-intestinal duration time, then
class I criteria can be applied.
Class IV - Low Permeability, Low Solubility
o Those compounds have a poor bioavailability. Usually they are not well absorbed over
the intestinal mucosa and a high variability is expected.
Klasse II en IV zijn de ergste nachtmerrie om geneesmiddelen te ontwikkelen.
De oplosbaarheid wordt bepaald in water bij verschillende temperaturen (37°C, 4°C hier heeft
H2O de grootste dichtheid, als er een probleem is, zal dat hier zeker duidelijk worden), in functie van
de pH en ionische sterkte, in buffers, in organische solventen (invloed polariteit nagaan, ethanol is
bv heel polair, chloroform is heel apolair) en in lipofiele vloeistoffen. Daarnaast gaat men ook kijken
naar de invloed van oplosbaarheidverhogers in water. We onderscheiden hierbij cosolventen (bv
cyclodextrines (CD) zoals hydropropyl-β-CD), complexvormers en surfactants (= algemene term
voor verbindingen die de eigenschap hebben de oppervlaktespanning tussen twee onmengbare
vloeistoffen te verlagen).
Analytische technieken: UV spectroscopie, HPLC (High Performance Liquid Chromatography), …
De meeste geneesmiddelen zijn zwakke basen.
-
De intrinsieke oplossnelheid geeft weer hoe snel een bepaalde concentratie bereikt wordt bij
welbepaalde hydrodynamische omstandigheden en temperatuur. De intrinsieke oplossnelheid is
relevant voor de orale biologische beschikbaarheid.
De oplossnelheid wordt beschreven door de Noyes-Whitney vergelijking:
Hierin stelt dM/dt de oplossnelheid voor, D de diffusiecoëfficiënt, A de
oppervlakte van de vaste stof, h de dikte van de diffusielaag (de laag van de
statische stroom rond het molecule), Cs de verzadigingsoplosbaarheid en Ct
de concentratie na een bepaalde tijd t.
-
Het ionisatiegedrag wordt weerspiegeld door de pKa. Deze kan bepaald worden aan de hand van
potentiometrische titratie of UV spectroscopie. Men kan proberen de oplosbaarheid van een
geneesmiddel te doen stijgen door de pH te manipuleren.
Amfotere stoffen kunnen zowel met een base als een zuur interageren:
46
Men kan mogelijks zoutvorming overwegen. Wanneer men het ionisatiegedrag in vivo kan
beïnvloeden, kan men misschien ook de biologische beschikbaarheid beïnvloeden.
-
De partitiecoëfficiënt/distributiecoëfficiënt geeft een indicatie over de lipofiliciteit/hydrofobiciteit
en over het in vivo absorptiegedrag.
Log P, Log D (afhankelijk van pH)
n-Octanol wordt het meest gebruikt als olieachtige stof.
Het partitiegedrag hangt af van eigenschappen van het
partitiesolvent.
-
De eigenschappen van een vaste stof zijn zeer belangrijk! Is het actieve product kristallijn of amorf
(glas)? Er zijn wel degelijk wezenlijke verschillen tussen kristallijn en amorf:
▪ Kristallijn is opgebouwd uit een driedimensionale ordening van de moleculen in de ruimte
(“long range order”), wordt gekenmerkt door een smeltpunt en is thermodynamisch
stabiel. Het is een ‘echte’ vaste stof en krijgt de voorkeur.
▪ Amorf staat voor chaotische ordening in de ruimte, vergelijkbaar met de vloeistoftoestand,
er is geen 3D-ordening. Het zijn eigenlijk vloeistoffen, maar ze hebben een zodanig hoge
viscositeit dat ze lijken op een vaste stof. Ze hebben daardoor een hoge oplosbaarheid en
hoge oplossnelheid, wat een sterk voordeel is (ondanks de vele nadelen!). Amorfe stoffen
hebben geen smeltpunt, maar een glastransitietemperatuur (overgang van een toestand
van hoge naar lage moleculaire mobiliteit), zijn chemisch reactiever, meestal
hygroscopischer (nemen water op uit de omgeving) en thermodynamisch metastabiel ten
opzichte van kristal (amorfe stoffen kunnen omvormen tot kristal wat een belangrijk
probleem is!).
Het verschil tussen kristallijne en amorfe stoffen kan (kwalitatief en kwantitatief) bepaald worden
via:
▪ Differentiële Scanning Calorimetrie (DSC). Hierbij wordt de warmte gemeten die
geproduceerd of opgenomen wordt door een materiaal wanneer dit opgewarmd wordt
(Smelten is immers warmte opnemen, het is een endotherm proces). De eerste piek in
onderstaande figuur geeft weer dat het hier om een amorfe stof gaat. We zien dit doordat
er een piek is en een verschuiving van de basislijn. De tweede piek geeft weer dat het gaat
om een kristallijn, aangezien er enkel een piek is en geen verschuiving van de basislijn.
▪
X-stralen diffractie. Een kristallijne stof geeft een aantal typische reflecties (kristalvlakken),
een amorf stof (glas) geeft een halo.
47
Kristallijne stoffen kunnen voorkomen onder verschillende wijzen van ordening in de ruimte. Men
spreekt van polymorfie (conformationele of stapelingsoorzaak).
Solventmoleculen kunnen ingebouwd worden in het kristalrooster. Men spreekt dan van
pseudopolymorfie (solvaten, hydraten). Afhankelijk van de inter-moleculaire interacties worden de
solventen sterker of zwakker gebonden.
De verschillende vormen hebben een verschillende stabiliteit, oplosbaarheid, oplossnelheid,
smeltpunt,…, maar de eigenschappen in de vloeistoffase en gasfase zijn dezelfde. Er zijn alleen
verschillen in vaste fase.
Dit heeft een invloed op de biologische beschikbaarheid, verwerkbaarheid,… . Men gaat kiezen voor
de ontwikkeling van de meest stabiele vorm. Dit moet men uitgebreid onderzoeken! Men moet
kijken naar de mogelijke kristalvormen.
[conformationele polymorfie andere stapelingen in de ruimte]
Vaste stoffen (kristallijn of amorf) kunnen een bepaalde hoeveelheid water sorberen. Dit heeft ook
weer een invloed op de stabiliteit (fasetransities). Men kan dit nagaan aan de hand van een Dynamic
Vapour Sorption (DVS)-systeem. Men gaat hierbij het sorptiegedrag van waterdamp onderzoeken
door de gewichtstoename te meten.
-
De stabiliteitstudie. De stabiliteit in de vaste toestand wordt nagegaan door te kijken naar de
invloed van warmte (bewaren tussen 4° en 16°, worden er afbraakproducten gevormd?), licht
(fotostabiliteit) en water (hydrolyse).
De stabiliteit in een oplossing wordt nagegaan door te kijken naar de invloed van warmte
(sterilisatieprocessen), licht, pH, sterk zure omstandigheden, sterk basische omstandigheden en
oxiderende stoffen. Deze laatste drie weerspiegelen extreme condities en op deze manier tracht
men te anticiperen op latere problemen.
Men gaat hier ook al kijken naar de compatibiliteit van de actieve stof met excipiënten (hulpstoffen,
deze zijn afhankelijk van de gekozen doseervorm) en bepaalde verpakkingsmaterialen.
32. Geef een overzicht van de biofarmaceutische aspecten die in de preformulatie fase
van een geneesmiddel bestudeerd worden.
De biofarmaceutische aspecten die in de preformulatiefase van een geneesmiddel belangrijk zijn, zijn
de permeabiliteit en het absorptiepotentiaal. Een actief bestanddeel moet kunnen worden opgenomen
in het systeem om actief te zijn. Men kan dit nagaan aan de hand van een aantal in vitro, in vivo en in
situ methoden, bijvoorbeeld:
-
Parallel Artificial Membrane Permeation Assay (PAMPA) (in vitro)
Het is geen bio-analyse, er zijn geen proefdieren bij nodig, het is een high throughput screening,
relatief goedkoop en er zijn verschillende lipidensamenstellingen mogelijk. Nadelen zijn dat het
enkel voorspellend is voor een deel van het absorptieproces (geen actief transport), er een
membraanretentie is van lipofiele stoffen en het sterk afhankelijk is van de lipidensamenstelling
(afhankelijk van ionisatie van moleculen) en de pH.
-
Caco-2 cellijn (in vitro). Het is een goed screening model, men kan op korte termijn informatie
krijgen over verschillende geneesmiddelen. Het is geen bio-analyse, er is geen extractie nodig uit
bloed of plasma. Er is evaluatie mogelijk van transportmechanismen en absorptiestrategieën
(stoffen toevoegen die absorptie verhogen). Men kan toxiciteit evalueren en dit zonder dat er
proefdieren voor nodig zijn. De cellijn is van humane oorsprong.
Nadelen zijn dat:
▪
er geen mucusproductie is (slijm kan in vivo een fysische barrière vormen)
▪ de zogenaamde ‘unstirred water layer’ in vitro een extra barrière kan vormen
48
▪
▪
▪
het een hechtere monolaag is dan de dunne darm (hechtere tight junctions in colon
dan in dunne darm minder paracellulair transport dan in vivo)
er een lage expressie is van bepaalde uptake transporters (maar er is al wel expressie,
wat al beter is dan bij PAMPA)
het een statisch model is
33. Farmaceutische ontwikkeling: een farmacologisch actief product ≠ een
geneesmiddel. Verduidelijk deze stelling aan de hand van het voorbeeld van een
tablet als orale toedieningsvorm.
Een geneesmiddel is een combinatie van een actief bestanddeel en een aantal hulpstoffen, die er mee
voor zorgen dat het actief bestanddeel op de juiste plaats in het lichaam terechtkomt (dus de plaats
waar het werkzaam moet zijn). Vele behandelingen vragen dan ook specifieke toedieningsvormen
waarmee men bij de ontwikkeling van geneesmiddelen dan ook rekening moet houden.
80 % van al de geneesmiddelen zijn tabletten. De opbouw van een tablet als doseervorm bevat naast
het farmacologisch actief bestanddeel ook nog een aantal andere hulpstoffen:
- Vulmiddel om het tabletgewicht aan te passen. Dit gebeurt met inerte stoffen, bijvoorbeeld lactose
(soms intolerantie, daarom ook andere stoffen!) of cellulose. [ het is fysisch niet mogelijk om van 0,5mg
geneesmiddel een tablet te maken, daarom hulpstoffen nodig]
- Bindmiddel om de deeltjes bij elkaar te houden na compactie. Hiervoor gebruikt men onder andere
zetmeel, cellulosederivaten en polyvinylpyrolidone (PVP).
- Disintegrans om de tablet tijdig uit elkaar te laten vallen in de maag. Voorbeelden zijn vernette
(gecrosslinkte) polymeren en zetmeel.
- Vloeiverbeteraar om het compressiemengsel gelijkmatig te laten vloeien, zoals talk of colloïdaal SiO2.
- Bevochtiger (oppervlakteactieve stoffen) om het contact tussen water (gastro-intestinaal stelsel) en de
poederdeeltjes te verbeteren. Hiervoor gebruikt men bijvoorbeeld polysorbaat 80 of Na-laurylsulfaat.
- Lubrifieermiddel om de wrijving tijdens het compactieproces te verminderen. Bijvoorbeeld Mgstearaat.
- Filmcoating wordt eventueel ook aangebracht voor een homogeen uitzicht van de tablet te krijgen
alsook van de kleur, smaak en andere factoren. Voorbeelden zijn cellulosederivaten, weekmakers en
kleurstoffen. De filmcoating vormt een polymeer rond de tablet.
34. Bespreek de voor- en nadelen van orale toedieningsvormen met een
gecontroleerde vrijstelling.
Orale toedieningsvormen met een gecontroleerde vrijstelling zijn systemen die voorzien in een
continue toevoer van het geneesmiddel voor een vooraf bepaalde periode nadat ze oraal werden
toegediend. Ze worden gekenmerkt door voorspelbare en reproduceerbare kinetiek. Het zijn systemen
die voorzien in een controle over de verblijftijd van de toedieningsvorm in de gastro-intestinale tractus
en/of die het geneesmiddel afleveren ter hoogte van een specifiek gebied in de gastro-intestinale
tractus voor ofwel een lokaal of systemisch effect.
Ze bestaan onder andere in de vorm van tabletten of capsules gevuld met pellets of granules.
49
Voordelen:
- verminderde dosisfrequentie (1x/dag)
- makkelijker voor de patiënt om de dosisfrequentie na te leven en met
groter gemak
- minder neveneffecten ter hoogte van het gastro-intestinaal stelsel en
andere toxische effecten
- controleerbare vrijzettingskinetica minder schommelingen in de
plasmaspiegels en een meer uniform effect
Nadelen:
- hogere kosten
- mogelijks gereduceerde biologische beschikbaarheid
- kan leiden tot ‘dose dumping’ alles in 1 keer vrijzetten, dosis > onmiddellijke vrijstelling (kan
bv door fout in productieproces)
- verminderde mogelijkheid om de dosis te veranderen of om het geneesmiddel terug te trekken
wanneer er sprake is van toxiciteit
- verhoogd First-pass effect door lever metabolisme voor bepaalde geneesmiddelen
35. Geef een overzicht van de verschillende mogelijke strategieën om de transittijd
van een orale doseervorm in het gastro-intestinale traject te verlengen.
Het Density-based systeem (de densiteit is verschillend tussen de doseervormen in de waterige
maaginhoud). Doordat de densiteit van deze systemen verlaagd is, kunnen ze drijven op de
maagvloeistoffen. We onderscheiden:
- Systemen met een hydrofiele matrix (figuur links). Dit zijn meestal tabletten die
natriumbicarbonaat bevatten dat CO2 zal vormen na contact met de maagvloeistof. Dit
natriumbicarbonaat zit in een viskeuze matrix dus wanneer CO2 gevormd wordt, zal dit
gedurende een langere periode in de matrix weerhouden worden. Hierdoor verlaagt de
densiteit en zal de tablet gaan drijven op het maagvocht.
-
Hydrodynamisch gebalanceerde systemen (figuur rechts). Dit zijn tabletten die omgeven zijn
met polymeren met een hoog moleculair gewicht (PEO met HPC of hydroxypropylcellulose).
Wanneer ze in het maagvocht terechtkomen, zullen deze polymeren water opnemen. Daardoor
ontstaat er een soort van gelatinebarrière rond de tablet waardoor het geneesmiddel trager
diffundeert uit het systeem.
Systemen met een lipofiele matrix.
Het Sized-based systeem. We onderscheiden:
- de ‘Shape memory’ polymeer, een opplooibaar molecule dat in het maagvocht terug open
plooit. Daardoor wordt het enorm groot waardoor het niet meer uit de maag kan diffunderen
tot het is opgelost.
50
-
Capsules met kleine ‘elleboogjes’ die ervoor zorgen dat het delivery systeem niet voorbij de
pylorus geraakt. Hierdoor wordt het geneesmiddel continu op die plaats vrijgesteld tot de
elleboogjes opgelost zijn. Wanneer dit gebeurt, is het geneesmiddel echter al volledig vrijgezet!
Tenslotte zijn er ook nog de systemen die beroep doen op bioadhesie. Het delivery systeem zal ergens
vasthechten en op die manier op diezelfde plaats het geneesmiddelcontinu vrijzetten gedurende een
bepaalde periode. Mechanismen die kunnen tussenkomen in het bioadhesieproces zijn elektronische
mechanismen, diffusie, adsorptie en bevochtiging. De systemen kunnen volgende interacties aangaan;
covalente interacties, waterstofbruggen, elektrostatische interacties, hydrofobe interacties of Van der
Waals interacties.
36. Farmacovigilantie: wat is het verschil tussen een “ongewenst verschijnsel/voorval”
(i.e. adverse event) en een “bijwerking” (i.e. adverse drug reaction) in het kader
van geneesmiddelenontwikkeling? Geef enkele voorbeelden. (vergelijk ook met de
definities in de Belgische wetgeving).
Een ongewenst verschijnsel of voorval (adverse event) is elk ongewenst medisch verschijnsel in een
patiënt of deelnemer van een klinisch onderzoek waaraan een farmaceutisch product werd toegediend
en dat niet noodzakelijk veroorzaakt wordt door de behandeling. Het kan elk onaangenaam en
onbedoeld teken, symptoom of ziekte zijn die tijdelijk geassocieerd wordt met het gebruik van het
medisch product en is al dan niet gerelateerd aan het product. De causaliteit tussen het effect en het
geneesmiddel staat niet vast, maar men kan best altijd spreken van een mogelijk causaal verband,
omdat het heel moeilijk is om dit verband echt vast te stellen (eventueel met re-challenge, maar dit
gebeurt zelden).
Een bijwerking (adverse drug reaction) wordt op verschillende manieren gedefinieerd, afhankelijk van
het product dat aanleiding geeft tot de bijwerkingen:
- voor producten nog in het klinisch onderzoek verstaat men onder een bijwerking al de
schadelijke en ongewenste reacties op een medisch product gerelateerd aan eender welke
dosis. Reacties op een medisch product betekent dat een oorzakelijk verband niet uit te sluiten
valt en een aannemelijke mogelijkheid is!
- voor producten op de markt verstaat men onder een bijwerking een reactie op een
geneesmiddel dat schadelijk en ongewenst is en dat optreedt bij een dosis die normaal gebruikt
wordt voor profylaxis (het voorkomen van een ziekte), diagnose of therapie voor een ziekte of
als modificatie van fysiologische functies. Ook nu gaat men er vanuit dat het causaal verband
impliciet is.
Voorbeelden:
- Immunologische bijwerkingen:
▪ Anaphylaxis (= overgevoeligheidsreactie) door β-lactam antibiotica
▪ Hemolytische anemie door penicilline
51
▪ Serumziekte door anti-thymocyte globuline
▪ Contactdermatitis door topisch antihistamine
▪ Stevens-Johnson syndroom
▪ Toxisch epidermale necrolyse (huid laat los)
Laatste twee vaak bij HIV.
- Non-immunologische, voorspelbare bijwerkingen:
▪ Overdreven farmacologische effecten
▪ Off-target farmacologisch effect
▪ Toxiciteit van het geneesmiddel
▪ Interacties tussen geneesmiddelen
▪ Overdosis
▪ Teratogeniciteit
- Non-immunologische, onvoorspelbare bijwerkingen:
▪ Intolerantie
▪ Idiosyncratische reacties (bv agranulocytosis door clozapine)
Definities volgens de Belgische wetgeving:
Een bijwerking is elke schadelijke en ongewenste reactie op een geneesmiddel voor onderzoek of op
een experiment en, wanneer het om een geneesmiddel voor onderzoek gaat, ongeachte de toegediende
dosis.
Een onverwachte bijwerking is een bijwerking waarvan de aard of de ernst niet overeenkomt met de
informatie over het experiment en, wanneer het om een proef gaat, met de informatie over het
product.
Een ongewenst voorval is een schadelijk verschijnsel bij een patiënt of een deelnemer aan de
behandelde groep tijdens een experiment, dat niet noodzakelijk met die behandeling verband houdt.
37. Farmacovigilantie: in welke situaties is een versnelde rapportering (i.e. expedited
reporting) van bijwerkingen / ongewenste effecten in een klinische studie vereist?
Versnelde rapportering moet in de eerste plaats uitgevoerd worden voor elk ongewenst voorval dat
zowel ernstig als onverwacht is en oorzakelijk gerelateerd. [SUSAR of Suspected Unexpected Serious
Adverse Reaction]
Een ernstig ongewenst voorval of ernstige bijwerking is een ongewenst voorval of bijwerking die
dodelijk is, levensgevaar oplevert voor de proefpersonen, opname in het ziekenhuis of verlenging van de
opname noodzakelijk maakt, blijvende of significante invaliditeit of arbeidsongeschiktheid veroorzaakt,
dan wel zich uit in een aangeboren afwijking of misvorming en dit, wanneer het om een proef gaat,
ongeacht de dosis.
Een onverwachte bijwerking is een bijwerking waarvan de aard of de ernst niet overeenkomt met de
informatie over het experiment en, wanneer het om een proef gaat, met de informatie over het
product. Bijvoorbeeld, de Investigator ’s brochure verwijst enkel naar hepatitis en fulminante hepatitis
treedt onverwacht op of enkel nierfalen wordt vermeld, maar interstitiële nefritis treedt onverwacht op.
Klinische trial cases vereisen een beoordeling voor causaliteit. Wanneer de rapporterende
gezondheidszorgspecialist of de sponsor oordeelt dat er bij een case een aannemelijk causaal verband is
met het medisch product wordt de case gekwalificeerd als een ongewenst voorval (d.i. als er feiten of
argumenten zijn die een causaal verband suggereren).
52
In geval van geblindeerde trials moet de sponsor de blindering verbreken voor ernstige bijwerkingen die
versneld gerapporteerd moeten worden. Maar, wanneer een fatale afloop of een ander ernstig resultaat
het primair doeltreffend eindpunt is in een klinische trial, kan bias geïntroduceerd worden en de
integriteit van de trial gecompromitteerd worden als de blindering verbroken wordt. Daarom kan het in
sommige gevallen aangewezen zijn tot een akkoord te komen met de autoriteiten om een ernstige
bijwerking te beschouwen als ziektegerelateerd en daarom dus niet in aanmerking komt voor versnelde
rapportering. (bv bij oncologische studie: primair eindpunt is de dood, als dan voor elke patiënt de code
doorbroken wordt, ontstaat bias bij onderzoeker)
Andere situaties waarbij versnelde rapportering vereist is:
- informatie die mogelijks materieel de benefit-risk beoordeling van het product beïnvloeden
- informatie die mogelijks voldoende is om veranderingen in de uitvoering van de klinische trial te
overwegen
Voorbeelden:
- Een verhoging in de snelheid van optreden van een ernstige, verwachte bijwerking die klinisch
belangrijk is
- Bij een significant gevaar voor de patiëntenpopulatie, bv bij een tekort aan een product gebruikt
voor de behandeling van een levensbedreigende ziekte
- Belangrijke veiligheidsbevindingen vanuit dierproeven, bv carcogeniciteit
38. Welke informatie moet minimaal gerapporteerd worden en hoe/wanneer wordt
deze gerapporteerd in geval van een versnelde rapportering (i.e. expedited
reporting) van bijwerkingen / ongewenste effecten in een klinische studie?
(vergelijk ook met de vereisten volgens de Belgische wetgeving).
De minimale informatie die gerapporteerd moeten worden is de volgende (als je deze criteria niet hebt,
heb je geen case):
- een identificeerbare gezondheidszorgmedewerker (meestal onderzoeker, om eventueel extra
informatie te kunnen vragen)
- een identificeerbare patiënt (initialen, geslacht, geboortedatum, lengte, gewicht)
- het verdachte medisch product (naam specialiteit en/of actief bestanddeel, schema en duur van
de behandeling, indicatie)
- de verdachte bijwerking die kan geïdentificeerd worden als ernstig, onverwacht en causaal
gerelateerd aan het (verdacht) medisch product [begindatum, beschrijving (bv via
hospitalisatierapport), testresultaten, evaluatie]
Deze informatie wordt gerapporteerd aan de hand van een CIOMS I formulier dat over het algemeen
wordt geaccepteerd als standaard (CIOMS staat voor Council for International Organizations of Medical
Sciences, het is een internationale non-profit organisatie waarbij de overheid niet betrokken is). De
rapporten moeten verstuurd worden naar de regulatorische autoriteiten van de landen waar het
geneesmiddel is onderzoek is of geregistreerd. In het CIOMS I formulier moet onder andere informatie
vermeld worden over de reactie, over het verdachte geneesmiddel, over eventuele bijkomende
geneesmiddelen en de geschiedenis en over de fabrikant van het geneesmiddel.
De onderzoeker moet onmiddellijk elke ernstige bijwerking melden aan de sponsor en het rapport dat
onmiddellijk geschreven werd na het optreden van de bijwerking zal gevolgd worden door meer
gedetailleerde, geschreven verslagen. Ongewenste voorvallen en/of abnormale laboratoriumwaarden
die volgens het protocol van cruciaal belang zijn voor de veiligheidsvoorwaarden worden aan de
opdrachtgever gerapporteerd binnen de in het protocol vermeldde termijnen. De onderzoeker zal al de
gevraagde informatie over gerapporteerde sterfgevallen verstrekken aan de opdrachtgever en de
erkende ethische commissie
53
Het tijdsschema voor versnelde rapportering:
De overheidsinstanties moeten op de hoogte gebracht worden van al de fatale of levensbedreigende,
onverwachte bijwerkingen per telefoon, fax of email en dit zo snel mogelijk, maar niet later dan 7
kalenderdagen na de eerste kennis van een bedrijf dat een case in aanmerking komt voor versnelde
rapportering. De klok start van het moment dat een (eender welk) personeelslid van het bedrijf bewust
is van het optreden van een ernstige, onverwachte bijwerking. Een volledig verslag moet, indien
mogelijk, binnen de 8 kalenderdagen afgewerkt worden, inclusief een beoordeling of het belang en de
implicatie van de bevindingen en relevante voorafgaande ervaringen met hetzelfde of een gelijkaardig
medisch product. Follow-up verslagen zijn onderworpen aan hetzelfde tijdschema.
De overheidsinstanties moeten op de hoogte gebracht worden van al de andere ernstige, onverwachte
bijwerkingen, dus deze die niet fataal of levensbedreigend zijn. Dit moet ook zo snel mogelijk gebeuren
en zeker niet later dan 15 kalenderdagen na de eerst kennis van het bedrijf dat een case in aanmerking
komt voor versnelde rapportering.
Belgische wetgeving:
- Rapportering van ongewenste voorvallen:
De onderzoeker rapporteert al de ernstige, ongewenste voorvallen onmiddellijk aan de
opdrachtgever, behalve wanneer hierover geen rapportering vereist is volgens het protocol of
het onderzoeksdossier. Hierna volgen latere, meer gedetailleerde, schriftelijke rapporteringen.
De deelnemers zullen in elk rapport aangeduid worden met een codenummer.
Ongewenste voorvallen en/of abnormale laboratoriumwaarden die volgens het protocol van
cruciaal belang zijn voor de veiligheidsvoorwaarden worden aan de opdrachtgever
gerapporteerd binnen de in het protocol vermeldde termijnen.
De onderzoeker zal al de gevraagde informatie over gerapporteerde sterfgevallen verstrekken
aan de opdrachtgever en de erkende ethische commissie.
De opdrachtgever houdt gedetailleerde registers bij van al de ongewenste voorvallen.
-
Rapportering van ernstige bijwerkingen:
De opdrachtgever zorgt ervoor dat al de relevante informatie over vermoedens van
onverwachte, ernstige bijwerkingen die tot de dood van een deelnemer hebben geleid of
kunnen leiden worden geregistreerd en gerapporteerd aan de minister en de bevoegde
overheden van al de betrokken lidstaten in geval van een klinische proef, alsook aan het
bevoegde ethische comité. Dit gebeurt in elk geval uiterlijk 7 dagen nadat de opdracht van het
geval kennis heeft gekregen. Relevante informatie over de gevolgen daarvan worden vervolgens
binnen een termijn van 8 dagen meegedeeld.
Alle vermoedens van ernstige, onverwachte bijwerkingen worden zo snel mogelijk
gerapporteerd aan de minister, de bevoegde overheden van al de betrokken lidstaten in geval
van een klinische proef en aan het bevoegde ethische comité en dit uiterlijk binnen 15 dagen
nadat de opdrachtgever voor het eerst op de hoogte werd gesteld.
De minister registreert al de vermoedens van ernstige, onverwachte bijwerkingen waarvan hij
op de hoogte werd gebracht en de onderzoeker brengt ook andere onderzoekers op de hoogte.
Eenmaal per jaar, tijdens de volledige duur van het experiment, verstrekt de opdrachtgever aan
de minister en het ethisch comité in België evenals aan die van de betrokken lidstaten in geval
van een klinische proef een lijst van al de vermoedens van ernstige bijwerkingen die zich in die
periode hebben voorgedaan, alsook een rapport betreffende de veiligheid van de deelnemers.
54
39. Bespreek de beperkingen / nadelen van de veiligheidevaluatie (i.e.
farmacovigilantie) van een geneesmiddel (i) tijdens de klinische ontwikkelingsfase
en (ii) na het commercieel beschikbaar komen van het geneesmiddel.
Beperkingen van de veiligheidsevaluatie van een geneesmiddel tijdens de klinische ontwikkelingsfase:
- korte duur van de trials: effecten van chronisch gebruik of met lange latentie zijn niet
detecteerbaar.
- Beperkte populatie: speciale groepen, meestal beperkt in aantal. De trial populaties zijn niet
altijd representatief voor het druggebruik door de maatschappij na goedkeuring. De
trialgroepen zijn zo zuiver en homogeen mogelijk. Hierdoor kan men de resultaten niet altijd
extrapoleren naar de hele populatie.
- Beperkte indicaties: de goedgekeurde indicaties weerspiegelen niet altijd het uiteindelijke
gebruik van het geneesmiddel na goedkeuring. Bijvoorbeeld een geneesmiddel dat werd
goedgekeurd voor Schizofrenie werd later ook gebruikt voor de behandeling van bipolaire
stoornis, gedragsproblemen en dementie. Dit leidde tot het opduiken van onverwachte
bijwerkingen.
- Klein aantal van blootgestelde patiënten: zeldzame druggerelateerde effecten worden mogelijks
niet gedetecteerd.
Beperkingen van de veiligheidsevaluatie van een geneesmiddel na het commercieel beschikbaar komen
van het geneesmiddel:
- Er is een onzekerheid van causaliteit.
- Er is het probleem van onderrapportering! De meeste artsen doen de moeite niet om ernstige
bijwerkingen te rapporteren.
- Er komt daarnaast ook vaak rapporteringbias voor doordat plots iedereen zegt dat ze ook een
bepaalde bijwerking gezien hebben wanneer A persoon een bijwerking rapporteert. Dit leidt dan
weer tot over-rapportering.
- Het vergelijken van geneesmiddelen is vaak moeilijk
40. Wat zijn de doelstellingen van de geneesmiddelenbewaking en hoe is deze in
België georganiseerd?
De voornaamste doelstelling van de geneesmiddelenbewaking is de veiligheid van de patiënten
verzekeren. Hiervoor gaan ze:
- Informatie opsporen over onbekende of onvoldoende gedocumenteerde bijwerkingen
- De kennis verbeteren van het veiligheidsprofiel van geneesmiddelen
- Permanent de risico/baten-verhouding van een geneesmiddel herbeoordelen, rekening houdens
met:
▪ Doeltreffendheid
▪ Veiligheid
▪ Beschikbaarheid/resultaat van aanverwante therapieën
▪ Doelgroep
▪ Ernst van de ziekte of de toestand waarvoor men het geneesmiddel wenst te
gebruiken
Ondanks deze doelstellingen van de geneesmiddelenbewaking, kan de veiligheid van de patiënten toch
niet voor 100% verzekerd worden, want ‘absolute veiligheid’ bestaat niet. De voorschrijver dient bij elke
patiënt de risico’s van de behandeling met het geneesmiddel af te wegen ten opzichte van de
voordelen.
55
[OPMERKINGEN:]
* Hoe zeldzamer de bijwerking, hoe meer patiënten aan het geneesmiddel moeten worden blootgesteld
om de bijwerking te detecteren.
* Hoe groter de achtergrondincidentie van een bepaalde afwijking (hoe meer deze voorkomt in de
afwezigheid van het betreffende geneesmiddel), hoe meer patiënten aan het geneesmiddel moeten
worden voorgestel om de afwijking als bijwerking te herkennen.
Geneesmiddelenbewaking in België wordt gestuurd door het Belgisch Centrum voor
Geneesmiddelenbewaking voor geneesmiddelen voor Humaan gebruik of het BCGH, dat werd opgericht
in 1979 na erkenning door de Wereld Gezondheidszorg Organisatie (WGO). Het BCGH is een onderdeel
van de afdeling Vigilantie van de ‘WG POST vergunning’ van het FAGG en maakt deel uit van het
Europees netwerk betreffende vigilantie (EudraVigilance). Er is een directe samenwerking op het vlak
van geneesmiddelenbewaking tussen de verschillende lidstaten binnen de Europese Economische
Ruimte via de Pharmacovigilance Working Party (PhWP).
Gezondheidszorgbeoefenaars (apothekers,
artsen en tandartsen) zouden spontaan alle
bijwerkingen moeten melden aan het BCGH.
Dit gebeurt via de zogenaamde gele fiches
(hierbij
kan
eventueel
ook
het
hospitalisatierapport, de ontslagbrief en het
laboratoriumverslag ingesloten worden) of
voorlopige, elektronische meldingsformulieren.
Daarnaast moeten ook de betrokken
farmaceutische bedrijven op de hoogte
gebrachte worden. Dit gebeurt via een medisch
afgevaardigde of rechtstreeks naar het bedrijf.
De farmaceutische industrie is verplicht om bijwerkingen te melden (binnen de 7-15 dagen). Elk
farmaceutisch bedrijf heeft een persoon die verantwoordelijk is voor de farmacovigilantie (Qualified
Person responsible for PharmacoVigilance of QPPV). Deze persoon probeert op de hoogte te blijven van
spontane meldingen van bijwerkingen en van bijwerkingen gerapporteerd in klinische studies en zal
daarnaast ook in de wetenschappelijke literatuur kijken naar eerder vermeldde bijwerkingen van de
geneesmiddelen vervaardigd door dat bedrijf. De QPPV zal in het bedrijf een systeem voor
geneesmiddelenbewaking oprichten zodanig dat gegarandeerd wordt dat el de informatie over
vermoedelijke bijwerkingen verzameld en behandeld wordt in minstens 1 specifieke plaats in Europa. Hij
zal veiligheidsverslagen opstellen ter attentie van de bevoegde instanties:
- ICSRs of Individual Case Safety Reports: meldingen van ernstige bijwerkingen
- PSURs of Periodic Safety Update Reports: periodieke verslagen die op regelmatige tijdstippen
worden opgesteld (om de 6 maanden in de eerste 2 jaar na commercialisatie, de volgende 2 jaar
elk jaar en nadien om de 3 jaar). Ze bevatten een overzicht van de wereldwijde
veiligheidsinformatie en een kritische evaluatie van de risico/baten verhouding met vermelding
of verder onderzoek of aanpassing van de VHB (formulier dat je geneesmiddel op de markt mag
brengen) of SKP (Samenvatting van de Kenmerken van het Product)/bijsluiter nodig is.
- PASS of Post Authorization Safety Studies: verslagen over postautorisatie veiligheidsstudies
Een QPPV zal ook op vraag van BCGH al de noodzakelijke informatie beschikbaar stellen voor de
evaluatie van de risico/baten verhouding van de geneesmiddelen. Daarnaast voert hij continu evaluaties
uit van de geneesmiddelenbewaking en hij fungeert als een uniek contactpunt voor de autoriteiten en
dit 24h/24h, ook betreffende inspecties van de geneesmiddelenbewaking.
56
41. Farmacovigilantie: de melding van een vermoedelijke bijwerking van een
geneesmiddel kan leiden tot een “signaal” na grondige evaluatie van het
oorzakelijk verband tussen geneesmiddel en bijwerking. Welke elementen maken
deel uit van deze evaluatie?
Bij de evaluatie van het oorzakelijk verband tussen het geneesmiddel en de bijwerking gaat men in de
eerste plaats na of het geneesmiddel deze bijwerking kan veroorzaken. Men gaat hiervoor diverse
informatiebronnen raadplegen, zoals de wetenschappelijke literatuur, databanken van Eudravigilance en
BCGH, Micromedex, SKP, ‘Meyler’s Side Effects of Drugs, … . Indien de bijwerking nog niet werd
beschreven voor het geneesmiddel in kwestie, kan men nagaan of de vermoedelijke bijwerking al
beschreven werd voor de klasse waartoe het behoord (klasseneffect).
In een volgende stap probeert men verder te onderzoeken of het geneesmiddel daadwerkelijk de
bijwerking heeft veroorzaakt bij die patiënt. Men kijkt hierbij eerst naar de tijdsrelatie en het beloop:
- Is de tijdsrelatie duidelijk of niet (bv treedt de bijwerking onmiddellijk op, of enkele uren, dagen,
weken, maanden, jaren na inname van het verdacht geneesmiddel)?
- Beloop: resultaat dechallenge –rechallenge?
Een ‘positieve rechallenge’ kan als volgt nagegaan worden:
» Stopzetten van het verdachte geneesmiddel: ‘dechallenge’
» Optreden van verbetering/herstel van de bijwerking: ‘positieve dechallenge’
» Opnieuw toedienen van het verdachte geneesmiddel: ‘rechallenge’
[een geneesmiddel wordt vaak toevallig opnieuw toegediend, bewuste rechallenge is vaak niet
ethisch aanvaardbaar]
» Opnieuw optreden van de bijwerking: ‘positieve rechallenge’
» Indien niet opnieuw optreden van de bijwerking: ‘negatieve rechallenge’
Een positieve rechallenge is een sterk argument voor het bestaan van een oorzakelijk verband. Een
positieve rechallenge is vooral waardevol bij objectiveerbare verschijnselen zoals rash of hepatitis.
Een negatieve rechallenge sluit een oorzakelijk verband niet per se uit, bijvoorbeeld door het
gebruik van een lagere dosis, een desensibilisatie-effect of een te kortdurende blootstelling.
Men gaat vervolgens kijken naar de specificiteit van het klinisch-pathologisch beeld. Men analyseert
hiervoor het klinisch beeld en de laboratoriumwaarden, de lokalisatie van de bijwerking (bv
injectieplaats), de dosis/effect – relatie en de farmacologische eigenschappen. Men onderzoekt of het
hier gaat om een specifiek klinisch-pathologisch patroon (bv fixed-drug eruption met tetracyclines) of
om een weinig of niet-specifiek klinisch-pathologisch patroon (bv diarree, hoofdpijn, spierpijn).
Tenslotte zal men eventuele andere oorzaken van de bijwerking uitsluiten. De ‘bijwerking’ kan immers
ook veroorzaakt worden door:
- Onderliggende aandoeningen
- De aanwezigheid van risicofactoren (bv renale of hepatische insufficiëntie, genetische
voorbeschiktheid)
- Antecedenten (voorafgaande gebeurtenissen) van de aandoening
- Concomitante geneesmiddelen (interacties)
De evaluatie van een mogelijk causaal verband tussen een geneesmiddel en een bijwerking is een
complex, wetenschappelijk proces. Zelden wordt een monocausaal verband gevonden, meestal gaat het
om multicausale verbanden. Een oorzakelijk verband is daarom soms moeilijk te evalueren (bv bij
polytherapie, comorbiditeit). Bij de evaluatie van een causaal verband is de kwaliteit van de gegevens
zeer belangrijk: hoe meer informatie en hoe nauwkeuriger deze informatie is, zoveel te betrouwbaarder
is de evaluatie.
57
42. Farmacovigilantie: welke reglementaire maatregelen kunnen genomen worden
indien naar aanleiding van signaaldetectie en evaluatie blijkt dat een bijwerking
van een reeds gecommercialiseerd geneesmiddel bevestigd wordt?
-
-
Wanneer een bijwerking van een bepaald
geneesmiddel bevestigd wordt, kunnen
volgende
reglementaire
maatregelen
genomen worden:
- Informatie verspreiden naar de
gezondheidsbeoefenaars
- Informatie aanpassen in de SKP en de
bijsluiter
Voorbeeld: Gardasil (zie onderaan)
- Aanpassing
van
het
afleveringsstatuut (bv Isotretinoïne
en het ‘pregnancy prevention
program’)
Schorsing van de Vergunning voor het in Handel Brengen (VHB) (bv Acomplia wegens ernstige
psychiatrische bijwerkingen, Prexigem wegens ernstige hepatotoxiciteit of Trasylol wegens
verhoogde mortaliteit)
Intrekking van het VHB (bv Mesulid wegens ernstige hepatotoxiciteit)
Voorbeeld: Gardasil
43. Bespreek de verschillende types/soorten vaccin die men kan ontwikkelen met
telkens hun karakteristieken, voordelen en nadelen.
We kunnen volgende soorten vaccins onderscheiden:
-
Live attenuated vaccines: bevatten levende micro-organismen die verzwakt zijn en daardoor
geen pathogeniciteit meer vertonen. Deze micro-organismen kunnen repliceren in de gastheer
en leiden daardoor tot de productie van antilichamen door de gastheer en lokken een cellulaire
immuunrespons (CMI of Cell Mediated Immunity) uit.
Voordelen van dit type vaccin:
▪ Ze kunnen leiden tot een meer bredere immuunrespons
▪ Er zijn mogelijks minder dosissen nodig
▪ Ze geven meestal een langere bescherming
58
Uitdagingen in verband met dit type vaccin:
▪ Onzekerheid over de mate van verzwakking
▪ Onzekerheid over de veiligheid voordat ze op grote schaal gebruikt worden
▪ Stabiliteit
▪ Analyse
-
Inactivated vaccines/ Recombinant subunit vaccines: bevatten geïnactiveerde (dode) microorganismen die niet meer kunnen repliceren in de gastheer. Ze lokken voornamelijk de productie
van antilichamen uit. Voordelen van dit type vaccin:
▪ de micro-organismen kunnen niet meer vermenigvuldigen of terugkeren naar
pathogeniciteit
▪ ze zijn meestal minder reactief
▪ de micro-organismen kunnen niet doorgegeven worden (geen transmissie)
▪ meestal technisch beter uitvoerbaar
Nadelen van dit type vaccin:
▪ soms nood aan een adjuvant
▪ immunogenische potentie
▪ variabele doeltreffendheid
59
-
Gene-based vaccines: stimuleren de synthese van antigenen in de cellen en ze lokken daarbij
meestal een celgemedieerde immuunrespons uit. Voorlopig is nog geen enkel gene-based vaccin
goedgekeurd, de voorgestelde vaccins zijn allemaal nog in ontwikkeling. We kunnen een
onderscheid maken tussen:
▪ Vaccins gebaseerd op recombinant plasmide DNA: expressievectoren van mammalia
brengen een antigen tot expressie in getransfecteerde cellen na intramusculaire of
intradermale toediening
▪ Vaccins gebaseerd op levende virale vectoren: verzwakte virusvectoren (bv
Adenovirus) ondergaan transiënte replicatie na injectie en geven aanleiding tot
expressie van antigenen.
Voordelen van dit type vaccin:
▪ Er bestaan gestandaardiseerde methoden voor productie en analyse
▪ Ze leiden tot een aanhoudende immuunstimulatie
Nadelen van dit type vaccin:
▪ Immunogenische potentie
-
Peptide vaccines
Dendritic cell vaccines
Niet besproken in de les!!
44. Bespreek: weesgeneesmiddelen.
Weesgeneesmiddelen (internationale term ‘orphan drugs’ ook wel eens afgekort als OD) zijn
geneesmiddelen die bestemd zijn voor de diagnose, preventie of behandeling van zeldzame
aandoeningen (beïnvloedt niet meer dan 5/10.000 personen in de Europese Unie). Een product kan ook
de Europese status van weesgeneesmiddel krijgen wanneer een nieuw product van grote waarde is,
maar zonder extra inspanning niet op de markt zou komen.
De aandoeningen waar deze geneesmiddelen voor nodig zijn, zijn per definitie ernstige,
levensbedreigende of chronisch invaliderende aandoeningen die de kwaliteit van leven ernstig
aantasten.
Malaria en multiresistente TBC zijn voorbeelden van weesaandoeningen in Europa, terwijl dit niet het
geval is voor de rest van de wereld (waar de incidentie dus hoger is dan 5/10.000). In Europa zijn
ongeveer 1 miljoen potentiële patiënten.
Wet en regelgeving om de ontwikkeling van weesgeneesmiddelen te stimuleren was noodzakelijk
omdat de te verwachten opbrengsten gering zijn en er hoge ontwikkelings- en registratiekosten zijn voor
een kleine groep patiënten. Dit maakt het niet aantrekkelijk voor onderzoek en bedrijven. De groep
zeldzame aandoeningen zijn als het ware een wees: ze hebben geen ouders en hebben behoefte aan
extra zorg; vandaar de term weesgeneesmiddelen (vertaald van Orphan Drugs).
60
De Europese Unie heeft met de invoering van de Europese Verordening inzake Weesgeneesmiddelen
op 16 december 1999 een eerste stap gezet om deze ontwikkeling van weesgeneesmiddelen in Europa
te bevorderen. Dit in navolging van de Verenigde Staten, die in 1983 de Orphan Drug Law invoerde.
Met de invoering van de Europese Verordening wordt 10 jaar marktexclusiviteit, centrale registratie in
de Europese Unie, advies bij opstellen van onderzoeksprotocollen en registratieaanvragen, en reductie
van registratiekosten voor het nieuwe middel geïntroduceerd. Daarnaast moeten de individuele
lidstaten nationale stimuleringsmaatregelen nemen. Op deze manier hoopt men de farmaceutische
industrie te stimuleren om meer weesgeneesmiddelen op de markt te brengen.
In vroege fases van de studie moet een aanvraag ingediend worden bij EMEA om de benoeming van
weesgeneesmiddel te verkrijgen (‘Orphan designation’). Bovendien moet het bedrijf kunnen aantonen
dat aan de vereiste criteria voldaan is. EMEA zal dan zijn goedkeuring of afkeuring geven.
Criteria voor benoeming:
Een actieve substantie die momenteel niet in de maatschappij wordt goedgekeurd
Een actieve substantie dat al wel goedgekeurd is in de maatschappij, maar voor een andere
indicatie.
Er zijn tot nu toe meer dan 250 geneesmiddelen met een ‘orphan designation’ (een etiket al vroeg in de
ontwikkeling om aan te geven dat het ene weesgeneesmiddel KAN worden). Meer dan 30
weesgeneesmiddelen hebben ondertussen de goedkeuring om op de markt gebracht te worden (Market
Authorization Approval of MAA) en de meerderheid van deze geneesmiddelen worden terugbetaald in
België. Voor verschillende weesgeneesmiddelen met een MAA werd nog geen terugbetaling
aangevraagd.
45. Welke mogelijkheden bestaan er om een geneesmiddel gratis ter beschikking te
stellen van een patiënt?
Geneesmiddelen kunnen gratis ter beschikking gesteld worden voor de volgende redenen:
-
Compassionate Use (CU): het om redenen van medeleven ter beschikking stellen van een
geneesmiddel dat nog niet commercieel beschikbaar is aan patiënten die leiden aan een
chronische, zeer invaliderende of levensbedreigende aandoening die niet op afdoende wijze
behandeld kan worden (met een geneesmiddel dat al wel in de handel is in België). Voor het
geneesmiddel dat gratis ter beschikking wordt gesteld, moet een aanvraag ingediend zijn voor
een VHB of moeten de klinische proeven nog gaande zijn. Het ter beschikking stellen van
geneesmiddelen voor ‘compassionate use’ valt strikt genomen niet onder de wet. Het is wel
aanbevolen om voor het ter beschikking stellen van het geneesmiddel een aanvraag te doen bij
het ethisch comité. Indien een positief advies gegeven wordt, kan het bedrijf een aanvraag
indienen bij het FAGG. Wanneer een arts een geneesmiddel wil voorschrijven voor
‘compassionate use’, moet eerst een aanvraag ingediend worden bij het betrokken bedrijf.
Bv patiënten in een klinische studie waarbij de onderzochte actieve stof beter werkt dat de
geneesmiddelen die al op de markt zijn. Het ethisch onverantwoord om deze patiënten het
geneesmiddel te ontzeggen tot het uiteindelijk op de markt beschikbaar is (dit kan een aantal
jaren duren). Daarom gaat men dit geneesmiddel ook na fase III nog geven aan deze patiënten
en hen verder opvolgen.
-
Medical Need Program (MNP): het ter beschikking stellen van een geneesmiddel voor menselijk
gebruik teneinde tegemoet te komen aan de medische noden van patiënten die leiden aan een
chronische of levensbedreigende ziekte of een ziekte die de gezondheid ondermijnt en die niet op
61
een bevredigende wijze kunnen behandeld worden men een geneesmiddel dat in de handel is en
dat vergund is voor die aandoening.
Het betrokken geneesmiddel voor menselijk gebruik moet het onderwerp uitmaken van een
aanvraag voor het in de handel brengen, maar de indicatie voor de behandeling van deze
aandoening (VHB) is echter niet toegelaten of het geneesmiddel voor menselijk gebruik is nog
niet op de markt op een daadwerkelijke manier met deze indicatie.
Voor geneesmiddelen met een VHB:
▪ Een aanvraag is lopende voor deze nieuwe indicatie
▪ Een VHB is toegestaan, maar het GM is nog niet beschikbaar voor de nieuwe toepassing
▪ Indien de klinische studie nog lopende is voor de nieuwe indicatie
Het geneesmiddel wordt gratis ter beschikking gesteld van de patiënt en wordt verpakt in een
buitenverpakking met daarop “MNP-Mag niet verkocht worden”. Vooraleer een geneesmiddel
ter beschikking mag gesteld worden voor een medisch nood programma, moet het bedrijf een
aanvraag indienen bij de overheid (FAGG) en bij de ethische commissie. Wanneer een arts een
geneesmiddel wil voorschrijven in het kader van een MNP, dient hij een schriftelijke aanvraag in
bij het betrokken bedrijf.
Het Medisch Noodprogramma valt onder de wet van 1 mei 2006 (Europees reglement
726/2004) en het KB van 14 december 2006 (artikel 106 tot en met 108).
-
Medische monsters (stalen): om medische monsters te kunnen vrijgeven of voorschrijven moet
aan een aantal voorwaarden voldaan zijn:
▪ het kan enkel voor geneesmiddelen in de handel
▪ het monster mag niet groter zijn dan de kleinste verpakking
▪ op de buitenverpakking moet vermeld worden: ‘Gratis monster – mag niet worden
verkocht’
▪ men mag geen stalen weggeven van verdovende middelen, psychotrope stoffen of
geneesmiddelen voor oraal gebruik met isotretinoïne (= afgeleide van vitamine A en is
teratogeen)
Het gratis ter beschikking stellen van medische monsters valt onder het KB van 11 januari 1993.
Indien een arts een medisch monster wil voorschrijven, dient hij een schriftelijke aanvraag in bij
het betrokken bedrijf. Een arts mag maximum 600 medische monster voorschrijven per jaar en
maximum 8 per geneesmiddel per voorschrijver. Deze beperkingen gelden niet in het kader van
een proeftherapie.
Het bedrijf dient een administratie bij te houden omtrent het gebruik van medische monsters
van de geproduceerde geneesmiddelen. Hierin moet onder andere het aantal stalen per
voorschrijver bijgehouden worden. Jaarlijks moet men het aantal gebruikte monsters meedelen
aan het FAGG.
46. Bespreek de mogelijkheden tot het geven van “informatie” en / of het
communiceren over geneesmiddelen aan de patiënt en de bevolking.
De informatie over geneesmiddelen kan aan de hand van
verschillende mogelijkheden verspreid worden. Men kan
beroep doen op wetenschappelijke tijdschriften, de
media en het internet en tenslotte is er ook nog de
bijsluiter die in elke verpakking aanwezig is.
De inhoud van een wetenschappelijke bijsluiter (SKP of
Samenvatting van de Kenmerken van het Product) wordt
bepaald door de overheid op basis van het
registratiedossier (in de US door het FDA, in Europa door
62
EMEA (European Medicines Agency, in België is dit het FAGG). Eventuele aanpassingen worden eerst
gemeld bij de overheid. De wetenschappelijke bijsluiter bevat volgende elementen:
- een beschrijving van de producent, de samenstelling, de mogelijke vormen, verpakkingen,…
- farmacologie
- indicaties
- posologie (= de wetenschap van het doseren van geneesmiddelen), wijze van gebruik
- contra-indicaties, bijwerkingen, interacties, overdosering
- zwangerschap en lactatie
- verenigbaarheden, stabiliteit
- datum van laatste bijwerking van de bijsluiter
[De bijsluiters van de firma’s die aangesloten zijn bij pharma.be worden gebundeld in het compendium.
Niet al de firma’s zijn aangesloten bij pharma.be, bijvoorbeeld Baxter.]
Een patiëntenbijsluiter is aangepast aan de patiënten, maar nog altijd moeilijk leesbaar! Men tracht
patiënt vriendelijke informatie te verschaffen die wel beter leesbaar is. Deze is vaak echter onvolledig
(mede door het beter leesbaar te maken).
De overheid heeft een belangrijke rol in het verspreiden van informatie over geneesmiddelen. Ze moet
ervoor zorgen dat de juiste informatie beschikbaar is voor zorgverstrekkers [via RIZIV
consensusvergaderingen, het BCFI ( Belgisch Centrum voor Farmacotherapeutische Informatie) en via
het internet (www.BCFI.be)]. Daarnaast moet de informatie ook doorgegeven worden naar de
bevolking. Dit gebeurt doorgaans via de media (bv antibioticacampagnes of gebruik van NSAIDs) of via
het internet (BCFI).
Het BCFI werd in 1970 opgericht en wordt financieel gesteund door de overheid. Het heeft als doel
systematisch onafhankelijke informatie te verstrekken met betrekking tot geneesmiddelen.
Het BCFI:
- Geeft maandelijks een tijdschrift uit met betrekking tot geneesmiddelen (Folia
Pharmacotherapeutica)
- Verspreid geneesmiddelenfiches met daarop informatie over recent geregistreerde actieve
bestanddelen
- Geeft jaarlijks het ‘Gecommentarieerd Geneesmiddelenrepertorium’ uit met daarin informatie over
al de geneesmiddelen in de ambulante sector (openbare markt)
- Verspreid transparantiefiches met behandelingsopties voor een specifieke pathologie onderling te
vergelijken
- Heeft een website: www.BCFI.be
Reclame naar de bevolking toe is verboden voor voorschriftplichtige geneesmiddelen volgens de
Europese richtlijn 92/28/EEC art. 3.1 (in de US en Nieuw-Zeeland is reclame wel toegestaan). Reclame is
wel toegestaan voor ‘Over-the-Counter’(OTC)-producten of geneesmiddelen die verkrijgbaar zijn
zonder voorschrift. Communicatie naar het grote publiek mag als:
- er geen directe overhandiging is van monsters aan niet-medici
- geen suggestie is van gelijk of beter effect dan bij een andere behandeling
- men zich niet naar kinderen richt (dit is verboden!)
- de boodschap duidelijk herkenbaar is als reclame
- men niet inspeelt op een andere motivatie dan preventie of verzorging van ziekte (dit is verboden!)
- in de reclame vermeldt: “Lees de bijsluiter aandachtig.”
Wet KB 1995 heeft betrekking op:
- reclame naar publiek
- reclame naar artsen, tandartsen en apothekers
- medisch afgevaardigden
63
- premies of voordelen voor gezondheidswerkers
- sponsoring van wetenschappelijke congressen
Deze wet heeft geen betrekking op informatie over de gezondheid of ziekten op voorwaarde dat die
geen verwijzing bevat (zelfs niet indirect) naar een geneesmiddel.
Rol van Europa in deze informatiestromen?
Europa is bezorgd om de kwaliteit van de geneesmiddeleninformatie, streeft in eerste instantie naar
bescherming van de patiënt, verbied reclame van voorschriftplichtige geneesmiddelen, maar laat wel
gecontroleerde informatie toe van deze voorschriftplichtige geneesmiddelen.
47. Bespreek de “financiële levenscyclus” van het geneesmiddel.
Evolutie van de prijs van een GM in België
- Voor het in handel brengen:
▪ Minister van Volksgezondheid
▪ Registratie en wetenschappelijke bijsluiter
- Bepaling van de prijs:
▪ Op basis van de procedure
▪ Goedkeuring Federale Overheid Economie
- Vaststelling van de maximumprijs:
▪ Minister van Economische Zaken
▪ Vergoedbare geneesmiddelen Advies van de Prijzencommissie voor de Farmaceutische
specialiteiten
▪ Niet-vergoedbare al dan niet voorschriftplichtige geneesmiddelen Advies van het
Bestendig Comité van de Commissie tot Regeling Der Prijzen
- Evolutie van de prijs van een geneesmiddel:
▪ Geen indexaanpassingen
▪ Langer dan 12 jaar terugbetaald: prijs -14%
▪ Langer dan 15 jaar terugbetaald: prijs nog eens -2,3% (dus in totaal -16,3%)
▪ Uitzonderlijk worden er prijsverhogingen toegestaan
64
48. Bespreek de vergoedbaarheid van geneesmiddelen volgens categorie.
Terugbetalingprocedure van geneesmiddelen in het kort:
-
-
-
Mag het geneesmiddel in de handel?
= registratie van het geneesmiddel
De Minister van Volksgezondheid en het FAGG zijn betrokken bij de beslissing omtrent
registratie. Criteria houden de veiligheid, effectiviteit en kwaliteit van het geneesmiddel in en
doorgaans gebeurt de registratie volgens een Europees proces.
Aan welke (maximale) prijs?
Dit is een kwestie voor de minister van Economische Zaken en de Prijzencommissie voor de
Farmaceutische specialiteiten
Moet het worden terugbetaald?
Dit wordt dan weer bepaald door de minister van Sociale Zaken en Volksgezondheid, in
samenspraak met het CTG, op basis van de registratie-indicaties. Het bedrijf dient hiervoor een
gemotiveerd dossier in bij het CTG. Het CTG geeft vervolgens op basis van dit dossier een advies
aan de minister van Sociale Zaken en Volksgezondheid die dan uiteindelijk een beslissing neemt
over een mogelijke terugbetaling.
Terugbetalingprocedure is een NATIONAAL PROCES!
Het geneesmiddelenbudget voor vergoedbare geneesmiddelen wordt jaarlijks vastgelegd door de
overheid. Er zijn geen beperkingen in deelbudgetten. De verzekering voor de ‘kosten’ van een
geneesmiddel kan in handen zijn van een privé maatschappij of vanuit de gemeenschap geregeld
worden (RIZIV Rijksinstituut Voor Ziekte en Invaliditeitsuitkering, mutualiteiten, minister van Sociale
Zaken en Volksgezondheid).
Kalmeermiddelen, slaapmiddelen en pijnstillers zijn voorbeelden van niet-vergoedbare
geneesmiddelen. De vergoedbare geneesmiddelen worden weergegeven in een bijlage van de KB van
21 december 2001, samen met de prijs, de basis voor de tegemoetkoming, het remgeld (= het bedrag
dat uw ziekenfonds niet terugbetaald, dus dat u zelf betaalt) en de vergoedbaarheid op basis van
erkende indicaties.
Voor de vergoedbaarheid van de geneesmiddelen wordt een onderscheid gemaakt tussen 4
categorieën:
- Categorie A: levensnoodzakelijke specialiteiten, zoals insuline, antidiabetica, anti-epileptica,
cytostatica
- Categorie B: therapeutisch belangrijke, farmaceutische specialiteiten, zoals antibiotica en
antihypertensiva
- Categorie C, Cs en Cx: geneesmiddelen bestemd voor symptomatische behandelingen, zoals
acetylcysteïne, anticonceptiepil, antihistaminica
- Categorie D: niet vergoedbare geneesmiddelen, zoals pijnstillers, kalmeermiddelen en
slaapmiddelen
De toewijzing van geneesmiddelen aan categorie A, B, C, Cs of Cx gebeurt door de minister van Sociale
Zaken en Volksgezondheid op voorstel van de Commissie Tegemoetkoming Geneesmiddelen (CTG).
De voorwaarden voor vergoedbaarheid zijn:
- vergoedbaarheid van erkende indicaties (bijsluiter), zoals antibiotica, insuline, antihypertensiva,
antihistaminica
- indicaties op basis van ‘Evidence Based Medicine’ (EBM), zoals cholesterolremmers, protonpompinhibitoren, behandeling van astma
65
-
beperking indicaties omwille van medische en/of budgettaire redenen (bepaald door de minister op
voordracht van het CTG), zoals voor bepaalde antibiotica, antischimmelmiddelen, stollingsfactoren,
bepaalde cytostatica, …
49. Bespreek: het systeem van referentieterugbetaling.
niet vergoed
referentievergoedingsniveau
vrijwillige prijsreductie of
supplement door patiënt betaald
vergoed
remgeld patient
vóór opname in
referentievergoedingssysteem
na opname in
referentievergoedingssysteem
Sinds 1 juni 2001 wordt de terugbetaling van elk origineel geneesmiddel waarvoor een goedkoop
alternatief bestaat [GENERISCH GM of KOPIE] met hetzelfde werkzaam bestanddeel, dosering en
toedieningsvorm met 30% verminderd. De patiënt die toch het originele geneesmiddel blijft gebruiken,
zal meer zelf moeten betalen. Wanneer de patiënt overschakelt op het goedkope alternatief, vermijdt
hij die extra kost. Vanaf 1 januari 2009 wordt de terugbetalingsbasis van een originele specialiteit die
twee jaar opgenomen is in het referentieterugbetalingssysteem nog bijkomend met 2,5 % verminderd.
Een generisch geneesmiddel heeft/is in vergelijking met het originele geneesmiddel:
- hetzelfde werkzame bestanddeel of bestanddelen
- dezelfde sterkte per eenheid
- dezelfde farmaceutische vorm
- dezelfde toedieningswijze
- bio-equivalent de biologische beschikbaarheid (snelheid en hoeveelheid) is na toediening van
eenzelfde dosis vergelijkbaar en geeft dezelfde effecten (gewenst en ongewenst)
- ≥ 30% goedkoper dan het originele geneesmiddel (op het moment van aanvaarding van
terugbetaling)
Wanneer men een kopie van een bepaald geneesmiddel op de markt wil brengen, moet aan een aantal
vereisten voldaan zijn. Zo kan men een:
- kopie op de markt brengen voor het verstrijken van het alleenrecht op de markt na goedkeuring van
de oorspronkelijke fabrikant als het kopiegeneesmiddel dezelfde prijs heeft als het
referentiegeneesmiddel. In dit geval spreekt men van co-marketing.
- Kopie op de markt brengen na de beschermde periode op de markt zonder goedkeuring van de
oorspronkelijke fabrikant als het kopiegeneesmiddel niet precies identiek is aan het
referentiegeneesmiddel (kopie heeft bv een andere sterkt), maar het al wel gedurende geruime tijd
(minstens 10 jaar) systematisch gebruikt en gedocumenteerd is in de EU. De aanvrager moet
daarvoor een gedetailleerde verwijzing kunnen geven naar de literatuur waaruit blijkt dat het GM
reeds lang in gebruik is in de medische praktijk en documentatie over de veiligheid, werkzaamheid
en relevante literatuur indienen. Het kopiegeneesmiddel moet daarenboven goedkoper zijn dan het
referentiegeneesmiddel, maar niet per se 30% of meer.
66
50. Geef uitleg bij het registratienummer met als voorbeeld 2003 IS 287 F 3?
-
Het eerste getal [2003] staat voor de verantwoordelijke voor de farmaceutische kwaliteit, dus
het bedrijf dat het geneesmiddel produceert.
- IS staat voor: volledig verpakt ingevoerd uit het buitenland [als enkel S fabricage in het
binnenland // soms ook EU in plaats van S of IS, dan geregistreerd via Europese Centrale
Procedure]
- Het tweede getal [287] is het rangnummer, bv hier is dit het 287ste geneesmiddel dat door het
bedrijf wordt geproduceerd
- F staat voor Farmaceutische vorm
- Het getal achter de letter F [3] geeft de nummer aan van de farmaceutische vorm, bv poeder,
tabletten, ampullen
Dit is het registratienummer voor Dafalgan®
51. Geef een overzicht van de procedures die kunnen gevolgd worden om een
geneesmiddel te registreren in Europa, inclusief de voor- en nadelen van de
verschillende procedures.
De Minister van Volksgezondheid is bevoegd voor het in de handel brengen van geneesmiddelen (voor
gebruik bij mens of dier). Dit proces wordt kortweg "registratie" genoemd. Teneinde de
Volksgezondheid te bewaken, moet een geneesmiddel voldoen aan een aantal vereisten op het vlak van
kwaliteit, veiligheid en werkzaamheid. Het bedrijf dat verantwoordelijk is voor het in de handel brengen
van een geneesmiddel moet hiervoor een aanvraag indienen. Registratie kan zowel nationaal als
Europees aangevraagd worden. Wanneer men Europees een registratieproces wil starten, zijn er
verschillende procedures mogelijk: Hiervoor zijn verschillende procedures mogelijk:
- Gecentraliseerde procedure (CP of Centralized Procedure)
Hiervoor dient het bedrijf 1 enkele applicatie in bij het EMEA (European Agency for the
Evaluation of Medicinal product). Deze aanvraag wordt vervolgens geanalyseerd door het CHMP
(Committee for Human Medicinal Products) waarvan twee leden verantwoordelijk worden
gesteld voor het uitbrengen van een wetenschappelijke opinie over de evaluatie van het
medicinaal product. Deze twee leden zijn twee landen van de Europese Unie die door EMEA
aangesteld worden als rapporteur en corapporteur. Het bedrijf dat de aanvraag heeft ingediend
bij EMEA kan suggesties geven over welke landen het graag als rapporteur wil, maar EMEA hoeft
hiermee geen rekening te houden.
Het advies van de CHMP wordt doorgegeven aan EMEA, waar vervolgens zal gestemd worden
om het advies te aanvaarden. Wanneer de meerderheid de aanvraag goedkeurt, is dit bindend
voor al de lidstaten, ook voor de landen die tegen gestemd hebben.
Wanneer de aanvraag goedgekeurd wordt, zal 1 enkele vergunning toegekend worden voor de
hele EU, met 1 enkele merknaam, 1 identieke SKP (Samenvatting van de Kenmerken van het
Product of wetenschappelijke bijsluiter, SmPC of Summary of Product Characteristics) en 1
identieke bijsluiter voor de patiënt (PL of Patient Leaflet) vertaald in de talen van de EUlidstaten. De legaal voorziene termijn bedraagt 277 dagen plus eventuele clock stops.
De gecentraliseerde procedure is binden (mandatory) voor:
▪ Biotechnologische producten en hoog technologische processen
▪ Al de menselijke medicijnen bedoeld voor de behandeling van HIV/AIDS,
neurodegeneratieve aandoeningen, kanker, diabetes, auto-immune ziekten en andere
immuundysfuncties en virale ziekten
▪ Al de weesgeneesmiddelen voor de behandeling van zeldzame ziektes
67
Voordelen:
» 1 applicatie
» 1 goedkeuring voor de hele EU
» 10 jaar exclusiviteit in al de landen van de EU
» consensus bij meerderheid
Nadelen:
» ‘alles-of-niets’
» Rapporteurs worden geselecteerd door het CHMP
» Merknaam moet hetzelfde zijn in al de landen
» Zeer beperkte tijd voor PCO om vertalingen af te leveren
-
Wederzijdse Erkenningsprocedure (MRP of Mutual Recognition Procedure) of
Gedecentraliseerde procedure (DCP of Decentralized Procedure)
Hierbij onderscheiden we een nationale fase en een MR (Mutual Recognition) fase:
▪ NATIONALE FASE: het bedrijf dient 1 applicatiedossier in, in 1 enkele lidstaat, de
referentielidstaat (Reference Member State, RMS). Deze voert een eerste evaluatie door
(binnen een termijn van maximum 210 dagen) en zal dan een advies doorgeven. Indien dit
advies positief is (en dus een registratie wordt toegekend, First authorization), zal een
beoordelingsrapport (European Public Assessment Report, EPAR) uitgegeven worden.
▪ MR FASE: het beoordelingsrapport wordt eerst gevalideerd (maximum 10 dagen) en
vervolgens zullen de andere lidstaten (Concerned Member States, CMS) hun advies geven
binnen een termijn van maximum 90 dagen, gebaseerd op dit EPAR (Mutual Recognition).
Na goedkeuring wordt een nationale goedkeuring (national authorization) toegekend
voor iedere lidstaat die een positief advies heeft gegeven. Dit leidt tot 1 identieke Engelse
bijsluiter (SmPC, SKP). De patiënteninformatie en informatie van de labels wordt in elk
land afzonderlijk behandeld. Er zijn verschillende merknamen in verschillende lidstaten
mogelijk. Indien een land of aanvrager niet akkoord gaat met een bepaalde beslissing is er
arbitrage (rechtspraak) mogelijk bij het CHMP.
Voordelen:
» De mogelijkheid om de referentielidstaat te kiezen
» Mogelijkheid om te onderhandelen over het registratiepakket met de RMS om zo te
bepalen wat voordelig is voor het verkrijgen van een MAA (Market Authorization
Approval)
» Mogelijkheid om het medisch product al vroeg te lanceren in de RMS (zelden)
» De mogelijkheid om de aanvraag in een bepaalde CMS terug te trekken zonder dat dit
een invloed heeft op de aanvragen in de andere lidstaten
» Mogelijkheid om verschillende merknamen te gebruiken
Nadelen:
» In plaats van een pure wederzijdse erkenning door de RMS beoordeling, moeten de CMS
opnieuw het registratieformulier beoordelen, wat kan leiden tot het ontstaan van
verschillende vragen en tegenstand
» Een belangrijke tegenstand in 1 of meerdere CMS kan leiden tot een terugtrekking in die
landen
-
Conditional Marketing Authorization (CMA) ‘early acces’
Een CMA kan worden toegekend aan een bepaalde categorie van medische producten om
tegemoet te komen aan een bepaalde medische nood van patiënten en dat in het voordeel is van
de publieke gezondheid. Een CMA kan daarom toegediend worden op basis van minder
68
complete gegevens dan normaal het geval is. Een CMA kan enkel toegediend worden aan
medische producten bedoeld voor de diagnose, preventie of behandeling van ernstig
invaliderende of levensbedreigende aandoeningen, aan geneesmiddelen die gebruikt kunnen
worden in spoedsituaties (wanneer er gevaar is voor de publieke gezondheid, erkend door de
WHO of de gemeenschap) of aan geneesmiddelen benoemd als weesgeneesmiddel. Een CMA
kan wel enkel worden toegediend als de risk/benifit-verhouding positief is, de voordelen van het
onmiddellijk beschikbaar stellen van het geneesmiddel > de risico’s door ontbrekende gegevens
en er enkel gegevens ontbreken van het klinische deel van het applicatiedossier. Incomplete
preklinische of farmaceutische gegevens mogen enkel geaccepteerd worden voor medische
producten die gebruikt moeten worden en spoedsituaties, als een reactie op gevaren voor
publieke gezondheid.
Het aanvraagdossier bevat alle relevante informatie met betrekking tot de werkzaamheid van het
product. Het betreft de resultaten van analytische, toxicologische, farmacologische en klinische proeven.
Deze officiële registratie is een basisvoorwaarde om een geneesmiddel in België in de handel te brengen
52. Welke taken heeft het FAGG in het geneesmiddelenbeleid?
Het FAGG is het Federaal Agentschap voor Geneesmiddelen en Gezondheidszorg
Het FAGG bewaakt, in het belang van de volksgezondheid, de kwaliteit, de veiligheid en de
doeltreffendheid van geneesmiddelen en gezondheidsproducten, in klinische ontwikkeling en op de
markt.
De missie van het FAGG is:
Het verzekeren, vanaf hun ontwikkeling tot hun gebruik, van de kwaliteit, veiligheid en doeltreffendheid
van:
- Geneesmiddelen voor menselijk en diergeneeskundig gebruik, met inbegrip van homeopathische
geneesmiddelen en geneesmiddelen op basis van planten, magistrale en officinale bereidingen
- gezondheidsproducten waaronder medische hulpmiddelen en hulpstukken en grondstoffen bestemd
voor de bereiding en de productie van geneesmiddelen
Het verzekeren, vanaf hun wegneming tot hun gebruik, van de kwaliteit, veiligheid en doeltreffendheid
van:
- alle operaties met bloed, cellen en weefsels, die eveneens gedefinieerd zijn als gezondheidproducten
De nationale agentschappen hebben een zeer belangrijke rol in:
- Het vervullen van 1 van de plaatsen als lid van het CHMP (CHMP bestaat uit één vertegenwoordiger
van elke lidstaat + 1 vervanging) en het EU-Panel van deskundigen (zowel van het agentschap en
extern)
- Het optreden als rapporteur/corapporteur
- De beoordeling van nationale toepassingen (MRP-DCP) en variaties van reeds geregistreerde
geneesmiddelen
- Evaluatie van preklinische gegevens om FIH-trials toe te staan
- Toezicht op klinische proeven in overeenstemming met MEC
53. Welke informatie wordt ingediend bij een aanvraag tot registratie van een
geneesmiddel en hoe wordt de inhoud van de wetenschappelijke bijsluiter ook na
registratie up-to-date gehouden?
Het registratiedossier bevat alle relevante informatie met betrekking tot de werkzaamheid van het
product. Het betreft de resultaten van analytische, toxicologische, farmacologische en klinische proeven
die overtuigend zijn voor de kwaliteit, veiligheid en doeltreffendheid van het medische product. Sinds 1
69
november 2003 bevat het registratiedossier 5 modules (algemene standaard voor de 3 grote regio’s,
Japan, EU en US):
- Module 1: bevat de (landspecifieke) Administratieve gegevens
- Module 2: bevat een Inhoudstabel van het dossier alsook een samenvatting van de
kwaliteitsgegevens en de preklinische en klinische studies.
- Module 3: bevat de kwaliteitsgegevens
- Module 4: bevat de gegevens van de preklinische studies
- Module 5: bevat de gegevens van de klinische studies
Naast het registratiedossier moeten ook nog een aantal bijhorende documenten bijgevoegd worden:
- De wetenschappelijke bijsluiter(SmPC, SKP), die informatie bevat over:
▪ De naam, vorm en samenstelling van het GM
▪ De indicaties, dosering en toedieningswijze
▪ Bijzondere waarschuwingen en voorzorgen
▪ Mogelijke interacties
▪ Gebruik bij zwangerschap en lactatie
▪ Invloed op rijvaardigheid, mogelijke bijwerkingen
▪ Overdosering
▪ PK en PD gegevens
▪ Houdbaarheidstermijn
▪ …
- De Patiëntenbijsluiter (PL) en het label: de inhoud van de PL is vergelijkbaar met die van de
SmPC, maar dan vereenvoudigd en in een verstaanbare taal voor de patiënt (minstens vertaald
in 3 nationale talen). Het label is de informatie die op de verpakking moet staan. Hiertoe
behoort onder andere informatie over:
▪ De naam en het actief bestanddeel
▪ Hulpstoffen, vorm en inhoud
▪ Wijze van gebruik en toediening
▪ Speciale waarschuwingen [buiten bereik en zicht van kinderen]
▪ Vervaldatum, lotnummer, registratienummer
▪ Bewaringsomstandigheden
▪ Adres van de vergunninghouder
Nadat een registratie is goedgekeurd, wordt het dossier nog verder opgevolgd door de
geneesmiddelenbewaking. Er is een permanente controle en opvolging van het veiligheidsprofiel
(meldingen van bijwerkingen, interacties,…) PSURs (Periodic Safety Update Reports)
Op deze manier kunnen de geregistreerde gegevens up-to-date blijven van eventuele nieuwe indicaties,
variaties en kan ook regelmatig een update van de labels doorgevoerd worden. Door de continue
opvolging van de bijwerkingen wereldwijd en soms op aanvraag van de overheid ([nieuwe] wettelijke
regels of opmerkingen) kunnen de bijsluiters aangepast worden op basis van de nieuwe informatie en
veiligheidsgegevens. Een bijsluiter wordt immers slechts goedgekeurd voor 5 jaar en om de 5 jaar
gebeurt ook een hernieuwing van de registratie. De bijsluiter wordt dan aangepast op basis van de
nieuwe gegevens die op dat moment beschikbaar zijn.
Voor de verdere opvolging van het registratiedossier, is het bedrijf verplicht om:
- een verantwoordelijke voor de geneesmiddelenbewaking (QPPV) en medische informatie (arts)
en een verantwoordelijke apotheker in dienst te nemen.
- Een elektronisch systeem te hebben om de distributie van de stalen te volgen
- Jaarlijks een rapport uit te brengen over het totaal aantal verdeelde stalen
- Over een systeem te beschikken dat de snelle terugtrekking van het geneesmiddel mogelijk
maakt in geval van ernstige veiligheids- of kwaliteitsproblemen (= Recall, in samenwerking met
de groothandelaars, apothekers, … maar het bedrijf blijft verantwoordelijk)
70
54. Bij de terugbetaling van geneesmiddelen wordt een onderscheid gemaakt tussen
verschillende klassen en categorieën van geneesmiddelen. Bespreek.
Terugbetalingprocedure van geneesmiddelen in het kort:
-
-
-
Mag het geneesmiddel in de handel?
= registratie van het geneesmiddel
De Minister van Volksgezondheid en het FAGG zijn betrokken bij de beslissing omtrent
registratie. Criteria houden de veiligheid, effectiviteit en kwaliteit van het geneesmiddel in en
doorgaans gebeurt de registratie volgens een Europees proces.
Aan welke (maximale) prijs?
Dit is een kwestie voor de minister van Economische Zaken en de Prijzencommissie voor de
Farmaceutische specialiteiten
Moet het worden terugbetaald?
Dit wordt dan weer bepaald door de minister van Sociale Zaken en Volksgezondheid, in
samenspraak met het CTG, op basis van de registratie-indicaties. Het bedrijf dient hiervoor een
gemotiveerd dossier in bij het CTG. Het CTG geeft vervolgens op basis van dit dossier een advies
aan de minister van Sociale Zaken en Volksgezondheid die dan uiteindelijk een beslissing neemt
over een mogelijke terugbetaling.
Terugbetalingprocedure is een NATIONAAL PROCES!
Enkel geneesmiddelen die geregistreerd zijn, komen in aanmerking voor terugbetaling en dan enkel bij
gebruik voor de geregistreerde indicatie: bv een GM voor neuropathische pijn als enkel getest bij en
geregistreerd voor diabetici, kan het enkel terugbetaald worden voor deze patiënten, hoewel het
misschien ook effectief is voor andere indicaties.
Het bedrijf zelf moet een aanvraag indienen voor terugbetaling. Hierbij moet het zelf voorstellen in
welke meerwaardeklasse het geneesmiddel terecht zou moeten komen. Deze meerwaardeklassen zijn
bepalend voor de prijs die mag gevraagd worden voor het geneesmiddel en hebben op die manier ook
een invloed op de mate van terugbetaling. Dit is dus een moeilijke situatie voor het bedrijf, omdat het
zelf beperkingen moet inwerken in het voorstel. Men moet haalbaarheid en optimale toegankelijkheid
afwegen en het geneesmiddel plaatsen ten opzichte van bestaande behandelingen. Een bedrijf gaat
eigenlijk een suggestie doen voor de patiënten die in aanmerking komen voor een terugbetaling van het
geneesmiddel. De volgende klassen kunnen onderscheiden worden:
- KLASSE 1: het geneesmiddel heeft een meerwaarde in vergelijking met wat nu op de markt is
(het is helemaal nieuw, dus er zijn meer gegevens nodig in het dossier). Geneesmiddelen van
klasse 1 krijgen een voorwaardelijke terugbetaling (18-36 maanden krediet), nadien volgt
opnieuw een evaluatie op basis van de ‘real-life-data’. Het CTG bepaalt de tijdsperiode en de
gegevens die het bedrijf moet verzamelen en legt de elementen vast die geëvalueerd moeten
worden. Daarnaast wordt ook een farmaco-economische evaluatie gedaan voor klasse 1
geneesmiddelen. ‘Quality of Life’ (QoL) en ‘Quality of Adjusted Life Years’ (QALY) wordt ook
nagekeken [sociale welwilligheid om te betalen; drempel rond 40.000 € per QALY].
- KLASSE 2: het geneesmiddel heeft geen bewezen meerwaarde in vergelijking met wat nu op de
markt is (de zogenaamde “me-too’s”). Het heeft een vergelijkbare waarde. Bv de zoveelste ACEinhibitor of β-blokker.
- KLASSE 3: geregistreerde generische geneesmiddelen en kopieën.
Voor de vergoedbaarheid van de geneesmiddelen wordt een onderscheid gemaakt tussen 4 categorieën
(deze komen niet noodzakelijk overeen met de meerwaardeklasse):
- Categorie A: levensnoodzakelijke specialiteiten, zoals insuline, antidiabetica, anti-epileptica,
cytostatica
71
Categorie B: therapeutisch belangrijke, farmaceutische specialiteiten, zoals antibiotica en
antihypertensiva
- Categorie C, Cs en Cx: geneesmiddelen bestemd voor symptomatische behandelingen, zoals
acetylcysteïne, anticonceptiepil, antihistaminica
- Categorie D: niet vergoedbare geneesmiddelen, zoals pijnstillers, kalmeermiddelen en
slaapmiddelen
De toewijzing van geneesmiddelen aan categorie A, B, C, Cs of Cx gebeurt door de minister van Sociale
Zaken en Volksgezondheid op voorstel van de Commissie Tegemoetkoming Geneesmiddelen (CTG).
-
55. Bespreek: registratieprocedure versus terugbetalingprocedure. Waarin verschillen
beide procedures van elkaar?
Zie vraag 51 en 56 voor vergelijking registratie- en terugbetalingprocedure. Verschillen tussen
procedures:
- Het registratiedossier bevat niet altijd de nodige gegevens voor de positionering van een GM
ten opzichte van zijn alternatieven.
- In het registratieproces wordt geen rekening gehouden met economische waarden/argumenten
(kosten/effectiviteit-verhouding, kosten/benifit-verhouding)
- Terugbetaling is een nationale zaak (en dus verschillend van land tot land, nationaal omdat ook
tussenkomst van minister van sociale zaken)
Reimbursement
MAA
decision
•
•
European Centralised or MRP
or DCP (or national procedure)
Evaluation based on
•
•
•
•
•
•
Pharmaceutical
quality
Safety
Efficacy
Benefit/risk balance of the drug
on its own
•
•
Per member state
Evaluation goes beyond MAAelements:
+ Effectiveness
+ Convenience
+ others
Relative therapeutic value as
compared to alternatives
Relative economic value as
compared to alternatives ∆C/
∆E
72
56. Geef een overzicht van de terugbetalingprocedure in België met bijzondere
aandacht voor de rol van de Commissie Tegemoetkoming Geneesmiddelen.
Terugbetalingprocedure van geneesmiddelen in het kort:
-
-
-
Mag het geneesmiddel in de handel?
= registratie van het geneesmiddel
De Minister van Volksgezondheid en het FAGG zijn betrokken bij de beslissing omtrent
registratie. Criteria houden de veiligheid, effectiviteit en kwaliteit van het geneesmiddel in en
doorgaans gebeurt de registratie volgens een Europees proces.
Aan welke (maximale) prijs?
Dit is een kwestie voor de minister van Economische Zaken en de Prijzencommissie voor de
Farmaceutische specialiteiten
Moet het worden terugbetaald?
Dit wordt dan weer bepaald door de minister van Sociale Zaken en Volksgezondheid, in
samenspraak met het CTG, op basis van de registratie-indicaties. Het bedrijf dient hiervoor een
gemotiveerd dossier in bij het CTG. Het CTG geeft vervolgens op basis van dit dossier een advies
aan de minister van Sociale Zaken en Volksgezondheid die dan uiteindelijk een beslissing neemt
over een mogelijke terugbetaling.
Terugbetalingprocedure is een NATIONAAL PROCES!
Enkel geneesmiddelen die geregistreerd zijn, komen in aanmerking voor terugbetaling en dan enkel bij
gebruik voor de geregistreerde indicatie: bv een GM voor neuropathische pijn als enkel getest bij en
geregistreerd voor diabetici, kan het enkel terugbetaald worden voor deze patiënten, hoewel het
misschien ook effectief is voor andere indicaties.
Het bedrijf dient zelf een gemotiveerde aanvraag in voor terugbetaling bij het CTG. Hierbij moet het
zelf voorstellen in welke meerwaardeklasse het geneesmiddel terecht zou moeten komen. Deze
meerwaardeklassen zijn bepalend voor de prijs die mag gevraagd worden voor het geneesmiddel en
hebben op die manier ook een invloed op de mate van terugbetaling. Dit is dus een moeilijke situatie
voor het bedrijf, omdat het zelf beperkingen moet inwerken in het voorstel. Men moet haalbaarheid en
optimale toegankelijkheid afwegen en het geneesmiddel plaatsen ten opzichte van bestaande
behandelingen. Een bedrijf zal dus een suggestie doen voor de patiënten die in aanmerking komen voor
een terugbetaling van het geneesmiddel.
De volgende klassen kunnen onderscheiden worden:
- KLASSE 1: het geneesmiddel heeft een meerwaarde in vergelijking met wat nu op de markt is
(het is helemaal nieuw, dus er zijn meer gegevens nodig in het dossier). Geneesmiddelen van
klasse 1 krijgen een voorwaardelijke terugbetaling (18-36 maanden krediet), nadien volgt
opnieuw een evaluatie op basis van de ‘real-life-data’. Het CTG bepaalt de tijdsperiode en de
gegevens die het bedrijf moet verzamelen en legt de elementen vast die geëvalueerd moeten
worden. Daarnaast wordt ook een farmaco-economische evaluatie gedaan voor klasse 1
geneesmiddelen. ‘Quality of Life’ (QoL) en ‘Quality of Adjusted Life Years’ (QALY elk extra
levensjaar in goede gezondheid) wordt ook nagekeken [sociale welwilligheid om te betalen;
drempel rond 40.000 € per QALY].
- KLASSE 2: het geneesmiddel heeft geen bewezen meerwaarde in vergelijking met wat nu op de
markt is (de zogenaamde “me-too’s”). Het heeft een vergelijkbare waarde. Bv de zoveelste ACEinhibitor of β-blokker.
- KLASSE 3: geregistreerde generische geneesmiddelen en kopieën.
Nadat de aanvraag voor terugbetaling van een geneesmiddel is ingediend, zal het CTG hierover een
advies doorgeven aan de minister van Sociale Zaken en Volksgezondheid.
73
De Commissie Tegemoetkoming Geneesmiddelen (CTG) is samengesteld uit 30 leden, waarvan 22 leden
stemrecht hebben. Hieronder bevinden zich 7 academici, 8 vertegenwoordigers van de ziekenfondsen, 4
artsen en 3 apothekers. De andere 8 leden hebben een adviserende functie. Hieronder bevinden zich 4
vertegenwoordigers van de ministers, 1 verantwoordelijke van het RIZIV (Rijksinstituut voor Ziekte en
InvaliditeitsVerzekering), 2 vertegenwoordigers van Pharma.be en 1 verantwoordelijke van FeBelGen
(Federatie van de Belgische fabrikanten van Generische geneesmiddelen).
Het CTG geeft advies over de opname van een geneesmiddel in de lijst van terugbetaling, de klasse
waarin het hoort, de aanpassing of het stopzetten van een terugbetaling en veranderingen van de
referentiebasis betreffende terugbetaling.
Tijdens het analyseren van de aanvraag voor terugbetaling, herhaalt het CTG het registratieproces, maar
houdt daarbij extra rekening met:
- de kosten/effectiviteit en kosten/benefit verhouding
- de risk/benefit verhouding in het dagelijkse leven (buiten de studieopzet)
- relatieve therapeutische waarde ten opzichte van alternatieven
- relatieve economische waarde ten opzichte van alternatieven
- ‘real-life-data’ bijkomende (samenvallende) ziekten, gegevens van oudere patiënten, …
Wanneer een bedrijf een geneesmiddel wil laten opnemen in klasse I wordt een bijkomende analyse
gedaan van de therapeutisch toegevoegde waarde van het geneesmiddel.
Maximum 60 dagen na het indienen van de aanvraag wordt een beslissing gemaakt over de
therapeutische waarde van een geneesmiddel en in welke klasse het zal terechtkomen. Hiervoor zal een
interne specialist van het CTG een evaluatierapport opstellen op basis van het ingediende dossier,
bijkomende literatuur en mogelijks ook met referenties naar evaluatierapporten gemaakt door andere
organisaties. Dit evaluatierapport wordt vervolgens besproken binnen het CTG een aangepast
afhankelijk van de input en/of bijkomende vragen van de andere leden aan het bedrijf. Wanneer het
definitieve evaluatierapport wordt goedgekeurd, spreekt men van een rapport van het CTG (ook Day 60
Report, het is geen rapport meer van 1 enkel lid, maar van de hele commissie). Nadat het rapport is
goedgekeurd door de commissie, kunnen geen nieuwe elementen meer toegevoegd worden. Op basis
van dit rapport wordt vervolgens een stemming gedaan voor de toekenning van klasse I aan de
geneesmiddelen die volgens de producent hiertoe behoren.
Het ‘Day 60 post-CTG’ rapport wordt verstuurd naar het bedrijf voor commentaren en antwoorden op
vragen. Het bedrijf stuurt dit rapport terug met de nodige antwoorden en zijn bedenkingen. Dit
aangepast rapport wordt opnieuw bediscussieerd binnen de commissie, waarbij een voorstel voor
terugbetaling en klasse wordt gedaan, en er zal opnieuw een stemming plaatsvinden. Wanneer het
dossier een positief advies krijgt van 2/3 van de leden, wordt het opnieuw verzonden naar het bedrijf.
Het bedrijf kan eventueel een ander voorstel doen, als hij akkoord gaat, is het voorstel definitief en doet
het CTG een finale stemming. Als er geen 2/3 meerderheid is voor het voorstel, dan kan het CTG het
rapport onmiddellijk doorsturen naar de minister die dan een beslissing zal nemen. Wanneer er een 2/3
meerderheid is voor de afkeuring van het voorstel en de minister gaat hiermee niet akkoord, dan kan hij
een beslissing nemen die afwijkt van het advies van het CTG.
Nadat het CTG een positief advies heeft doorgegeven aan de minister en deze het advies heeft
aanvaard, zullen de ministers van Financiën en Budget op de hoogte gebracht worden. Het bedrijf wordt
ten laatste 180 dagen na het indienen van de aanvraag op de hoogte gebracht van het advies (als dit
niet gebeurd, wordt het meest recente voorstel van het bedrijf gepubliceerd). De uiteindelijke
(positieve) beslissing wordt (na advies van de Raad van State) gepubliceerd in het Belgisch Staatsblad en
is van toepassing op de eerste dag van de maand die volgt op een periode van 10 dagen na de
publicatie.
74
Het ‘Day 60 post-CTG’ rapport wordt online gepubliceerd, samen met de commentaren van het bedrijf
op dit rapport en de evaluatie van deze commentaren door het CTG.
57. Welk organisatiemodel lag aan de basis van de Belgische gezondheidszorg? Op
welk alternatief model is de gezondheidszorg in het Verenigd Koninkrijk
gebaseerd? Vergelijk beide modellen.
Het ‘Bismarck’ model ligt aan de basis van de Belgische gezondheidszorg. In dit model is de
gezondheidszorg een onderdeel van de sociale zekerheid. Het is gegroeid vanuit de solidariteit voor
arbeiders bij ziekte, binnen gilden en vakbonden. Het is ontstaan in Duitsland en was enkel bedoeld voor
mensen die werkten. Het was een ‘win-win’-situatie: arbeiders bleven bij het bedrijf en begonnen zo
snel mogelijk terug te werken. Zo was er minimale economische schade. In dit model wordt de
gezondheidszorg gefinancierd door afdracht van sociale lasten op de arbeid (werkgever en werknemer)
en paritair beheerd (in overleg tussen werknemers en werkgevers).
Het alternatief model is het ‘Beveridge’ model waarin de gezondheidszorg een staatsorganisatie is. dit
model is gegroeid vanuit een politieke keuze (WOII): iedereen moest kosteloos verzorgd kunnen
worden. De gezondheidszorg wordt hierbij gefinancierd vanuit directe belastingen en rechtstreeks
beheerd door de overheid. Het is bedoeld voor iedereen, of je n werkt of niet. Alle artsen, apothekers,
gezondheidszorgers werken voor de staat.
Organisatie van de gezondheidszorg in België:
-
-
er is een brede toegankelijkheid tot de zorg: ruim aanbod (veel artsen, apothekers)
geen ‘gate keeping/echelonnering’: je moet niet eerst via huisarts voor je naar specialist gaat
er is ‘Remunering per acte’ hoe meer patiënten bij een arts komen, hoe meer hij verdiend. Dit
leidt tot onderlinge competitie bij de artsen waardoor er praktisch geen wachtlijsten zijn. De vraag
blijft echter wel of de kwaliteit van de zorg daarbij even hoogstaand blijft?. Dit is moeilijk formeel te
meten, maar er is nog altijd de perceptie van de patiënt.
Er is een ruime dekking voor iedereen via het stelsel van verplichte ziekteverzekering. Bijna alles
wordt terugbetaald (behalve bv esthetische ingrepen zoals een liposuctie).
Lage eenheidsprijs, hoog omzetvolume [ hoge tevredenheid bij patiënten]
75
58. Bespreek het principe van de forfaitarisering van geneesmiddelen in het
ziekenhuis.
Sinds 1 juli 2006 is de forfaitarisering van de terugbetaalde geneesmiddelen van start gegaan.
Deze geldt voor alle acute ziekenhuizen in België (algemene, niet chronische en psychiatrische
ziekenhuizen) en is enkel van toepassing op de gehospitaliseerde patiënten. Forfaitisering geldt
(voorlopig) enkel voor klassieke hospitalisaties (minstens 1 nacht in het ziekenhuis, geen forfait bij
daghospitalisaties, consultaties of dialyses).
Het betreft een "enveloppe"-systeem waarbij het ziekenhuis een vast bedrag per opname krijgt.
Bij de berekenen van het ‘forfait per opname’ gaat men uit van een nationaal gemiddeld bedrag
aan uitgaven voor een geneesmiddel per pathologie (APR-DRG) en per graad van ernst. Elk verblijf
in het ziekenhuis wordt gefinancierd op basis van dit gemiddelde (bedrag voor enveloppe wordt
berekend door deze gemiddelden te vermenigvuldigen met het aantal opnames per pathologie).
Niet al de geneesmiddelen komen in aanmerking voor forfaitisering. Uitsluiting van bepaalde
geneesmiddelen kan gebeuren op basis van:
- de klasse van het geneesmiddel:
▪ weesgeneesmiddelen
▪ klasse I geneesmiddelen
▪ Hoofdstuk IVbis geneesmiddelen (moeten ingevoerd worden vanuit het buitenland)
▪ Cytostatica, groeifactoren en hormonen, stollingsfactoren, immunoglobulines en
Antiretrovirale middelen
Deze geneesmiddelen worden nog terugbetaald zoals vroeger, anders zouden
ziekenhuizen de dure patiënten doorverwijzen.
- Individuele geneesmiddelen:
▪ Op advies van de werkgroep onder koepel van het CTG
▪ Op basis van volgende criteria:
» Duur
» Behandeling van zeldzame ziekte
» Ziekte die als comorbiditeit voorkomt
Andere uitzonderingen zijn verblijven die beschouwd worden als ‘outliers’ in termen van
verblijfsduur. Zij worden gefinancierd op basis van de reële kostprijs. Een outlier is een persoon
met een heel hoge behandelingskost in vergelijking met het gemiddelde in een gelijke
pathologiegroep en gelijk niveau van ernst of bv ook een persoon met lange verblijfsduur.
De forfaitaire financiering van ziekenhuizen is een verpleegdagprijs. Hierbij zijn de honoraria,
farmaceutische specialiteiten, infusen, prothesen en implantaten niet inbegrepen. Hiervoor krijgt
het ziekenhuis een vergoeding per verstrekking. Forfaitiare financiering is er ook enkel voor
vergoedbare geneesmiddelen
Het forfait moet 75% van het verbruik van de terugbetaalde geneesmiddelen dekken. De overige
25% mag doorgerekend worden aan het RIZIV en wordt volledig terugbetaald.
De patiënt zelf betaalt een persoonlijk aandeel van 0,62 euro per dag, ongeacht de hoeveelheid
medicatie die verbruikt wordt, als ook alle niet vergoedbare farmaceutische specialiteiten.
76











