NEDERLAND MAAKT ZICH OP VOOR BIOSIMILARS VAN TNF-ALFAREMMERS
Publicatiedatum: 4 februari 2015
Bron: Axon
Deze maand verloopt het patent van Remicade in de meeste Europese landen, waaronder
Nederland. Daarnaast dienden Samsung en Biogen een vergunningsaanvraag in voor een
biosimilar van Enbrel. De uptake van biosimilars ging in 2014 grotendeels aan de
Nederlandse markt voorbij, maar daar lijkt in 2015 verandering in te komen. Axon zet de
ontwikkelingen op een rij.
Door Sytse Buruma
In Europa kwam de uptake van biosimilars het afgelopen jaar langzaam op gang. In Amerika lijkt op
korte termijn de eerste biosimilar te worden goedgekeurd: Zarxio (Sandoz), een biosimilar van
Neupogen. In emerging markets hebben biosimilars een groter aandeel, maar autoriteiten stellen daar
relatief weinig eisen. Dit artikel richt zich uitsluitend op Europese markten.
EMA
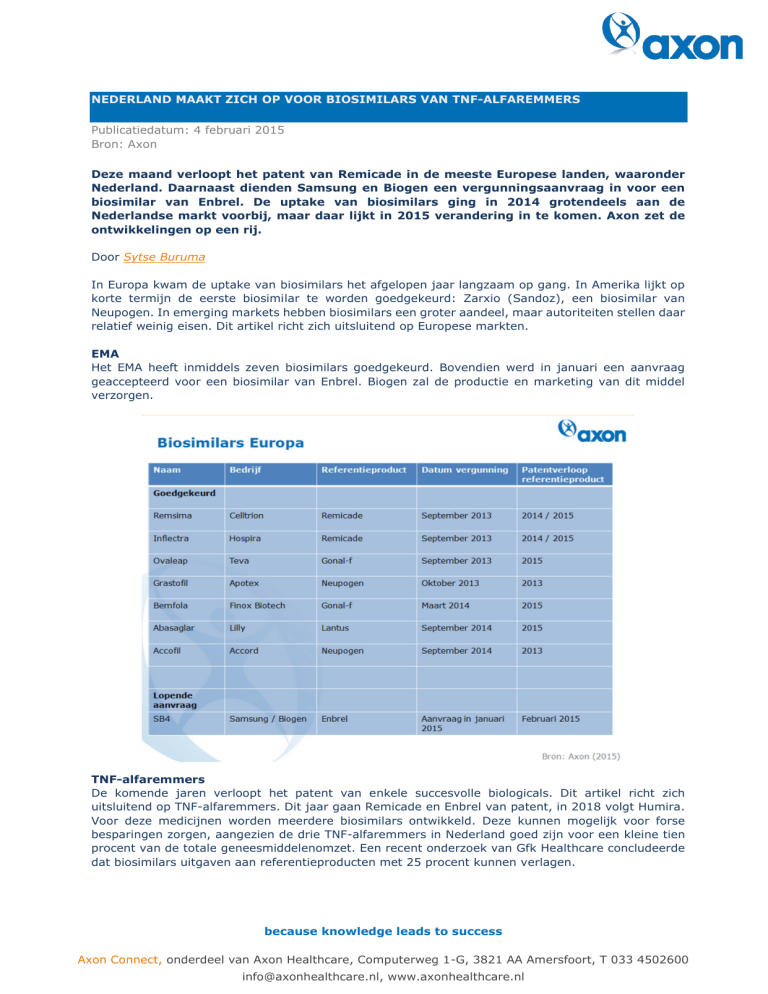
Het EMA heeft inmiddels zeven biosimilars goedgekeurd. Bovendien werd in januari een aanvraag
geaccepteerd voor een biosimilar van Enbrel. Biogen zal de productie en marketing van dit middel
verzorgen.
TNF-alfaremmers
De komende jaren verloopt het patent van enkele succesvolle biologicals. Dit artikel richt zich
uitsluitend op TNF-alfaremmers. Dit jaar gaan Remicade en Enbrel van patent, in 2018 volgt Humira.
Voor deze medicijnen worden meerdere biosimilars ontwikkeld. Deze kunnen mogelijk voor forse
besparingen zorgen, aangezien de drie TNF-alfaremmers in Nederland goed zijn voor een kleine tien
procent van de totale geneesmiddelenomzet. Een recent onderzoek van Gfk Healthcare concludeerde
dat biosimilars uitgaven aan referentieproducten met 25 procent kunnen verlagen.
because knowledge leads to success
Axon Connect, onderdeel van Axon Healthcare, Computerweg 1-G, 3821 AA Amersfoort, T 033 4502600
[email protected], www.axonhealthcare.nl
Richtlijnen
Het EMA kent drie overkoepelende algemene richtlijnen voor biosimilars. Deze zijn de afgelopen
maanden geactualiseerd. Een richtlijn over kwaliteitseisen is sinds afgelopen december van kracht. In
april en juli volgen richtlijnen over respectievelijk het aantonen van gelijkwaardigheid aan het
referentieproduct en het doen van onderzoek naar farmacotoxicologie, farmacokinetiek,
farmacodynamiek en effectiviteit.
Discussiepunten
Bij de introductie van biosimilars zullen autoriteiten een antwoord moeten vinden op een aantal
discussiepunten.
Extrapolatie
Remicade is in Europa goedgekeurd voor zes indicaties. Celltrion onderzocht Remsima in fase III alleen
bij reuma en de ziekte van Bechterew, maar kreeg toch een vergunning voor alle indicaties van
Remicade. Dit wordt extrapolatie van indicaties genoemd. Het EMA bekijkt per biosimilar of dit mogelijk
is, maar staat hier in het algemeen positief tegenover. Extrapolatie van indicaties maakt biosimilars
commercieel interessanter, maar stuit op weerstand bij artsen. In een enquête van FirstWord onder
112 Europese reumatologen en gastro-enterologen zegt twee derde van de artsen moeite te hebben
met extrapolatie. Zo wordt Remicade in zestig procent van de gevallen ingezet bij ontstekingsziekten
van de darmen, maar zijn voor deze indicaties nog geen fase III-gegevens beschikbaar.
Switchen
Het voorschrijven van biosimilars aan nieuwe patiënten stuit op relatief weinig weerstand onder artsen,
maar het overzetten (switchen) van bestaande patiënten is een ander verhaal. Zo financierde de
Noorse overheid een onderzoek waarin patiënten van Remicade werden overgezet op een biosimilar.
Artsen kwamen publiekelijk in verzet en de uptake van biosimilars kwam in het Scandinavische tot
stilstand.
INN
Fabrikanten van biologicals betogen dat biosimilars niet dezelfde stofnaam (INN) mogen gebruiken als
het referentieproduct. In tegenstelling tot generieke middelen zijn biosimilars immers niet identiek
maar gelijkwaardig aan het referentieproduct. Ook zou daarmee voorschrijven op stofnaam onmogelijk
worden gemaakt. Dit is een belangrijk instrument voor het stimuleren van generieke substitutie. Het
EMA lijkt vooralsnog niet vatbaar voor dit betoog.
because knowledge leads to success
Axon Connect, onderdeel van Axon Healthcare, Computerweg 1-G, 3821 AA Amersfoort, T 033 4502600
[email protected], www.axonhealthcare.nl
Inflectra en Remsima
De biosimilars van Remicade werden aanvankelijk in twaalf Europese markten gelanceerd: Bulgarije,
Finland, Hongarije, Ierland, Kroatië, Letland, Noorwegen, Polen, Portugal, Roemenië, Slowakije en
Tsjechië. Deze landen zijn verantwoordelijk voor nog geen vijftien procent van de twee miljard dollar
die Remicade in Europa genereert. In overige Europese markten verloopt één van de patenten van
Remicade pas deze mand. De verwachting is dat de biosimilars hier de komende maanden worden
gelanceerd. Hospira brengt Inflectra zelf op de markt, terwijl Celltrion bij Remsima
samenwerkingsverbanden sloot met Mundipharma, BioGaran, Kern Pharma, Napp Pharmaceuticals en
Orion Pharma. In Nederland zal Mundipharma Remsima op de markt brengen.
Noorwegen
Analisten keken het afgelopen jaar met interesse naar de uptake van Remsima en Inflectra in
Noorwegen. Het zorgstelsel van dit land kent de meeste overeenkomsten met de grote Europese
markten. Daarnaast probeerde de Noorse overheid de uptake van biosimilars te stimuleren. Na
lancering in januari 2014 werd eind februari een marktaandeel van acht procent gerealiseerd (gemeten
in volume). Dit percentage steeg naar zestien procent in maart, maar blijft vanaf de zomer steken op
twintig procent. In Hongarije zijn de middelen korter op de markt, maar zijn de eerste maanden
vergelijkbaar met Noorwegen. In overige landen blijft de uptake achter. Dit verschil wordt niet alleen
verklaard door de verschillen in zorgstelsels, maar ook door het feit dat alleen Noorwegen en Hongarije
extrapolatie van indicaties toestaan.
Korting
In Noorwegen waren de biosimilars 39 procent (Celltrion) en 33 procent (Hospira) goedkoper dan
Remicade. In de enquête van FirstWord stellen artsen dat percentages beneden de dertig procent
onvoldoende prikkels bieden om een biosimilar voor te schrijven. Volgens analisten dalen de
winstmarges van biosimilars boven de veertig procent echter rap. De ontwikkelingskosten van
biosimilars liggen volgens Nefarma op 60 tot 200 miljoen euro en daarnaast moeten fabrikanten fors
investeren in marketing. Mede daardoor is de markt steeds meer in handen komen te liggen van
innovatieve farmaceuten. In tegenstelling tot generieke collega’s beschikken zij wel over een fors
onderzoeks- en marketingbudget.
Verdedigen
Volgens Barclays heeft MSD (producent van Remicade) de afgelopen maanden de nadruk gelegd op
de uitgebreide ervaring van artsen met Remicade. Het zwaartepunt van de marketing lag op indicaties
because knowledge leads to success
Axon Connect, onderdeel van Axon Healthcare, Computerweg 1-G, 3821 AA Amersfoort, T 033 4502600
[email protected], www.axonhealthcare.nl
waar biosimilars nog geen fase III-resulaten kunnen overleggen. MSD kan daar een groot aantal
onderzoeksgegevens en patiëntenregistraties tegenover zetten. Bovendien startte MSD
praktijkondersteunende programma’s. Vooralsnog voerde MSD geen prijsverlaging door, maar werden
waar nodig wel kortingen geboden. De Noorse registratieautoriteit NoMA benadrukt dat
prijsverlagingen niet waarschijnlijk zijn zolang switchen op zoveel weerstand stuit. Medical director
Steinar Madsen: ‘new initations for branded Remicade will probably fall, but there will be a nice income
from presently treated patients. Switching will be a crucial factor. I guess [MSD] will increase activities
to minimize switching’.
Uptake
Analisten van Barclays verwachten in de nieuwe markten een bescheiden uptake voor Remsima en
Inflectra. Bij een korting van dertig procent op Remicade zullen zij gezamenlijk jaarlijks ongeveer vier
procent van de markt veroveren (gemeten in volume). Dit zou in 2020 een marktaandeel van ruim
twintig procent betekenen. Mogelijk verbetert de uptake wanneer er onderzoeksresultaten over nieuwe
indicaties en switchen verschijnen.
72 procent
Bovenstaande schatting kan mogelijk de prullenbak in, want Orion Pharma zette de biosimilarmarkt
vorige week op zijn kop. Het bedrijf brengt Remsima in Noorwegen op de markt en besloot wegens de
stagnerende uptake tot een forse prijsverlaging. Remsima werd daardoor 72 procent goedkoper dan
Remicade. Als dit voorbeeld in andere Europese landen wordt gevolgd, an dit grote gevolgen hebben.
Allereerst wordt de financiële prikkel om biosimilars voor te schrijven fors groter. Uit de enquête van
FirstWord blijkt dat ongeveer zeventig procent van artsen (enigszins) vatbaar is voor dergelijke druk.
Anderzijds worden biosimilars voor farmaceuten commercieel veel minder interessant, omdat er weinig
overblijft van de winstmarges. Een analist vertelt aan FirstWord: ‘if other payers in Europe use this
[discount] as a benchmark, it has just killed the current biosimilar monoclonal antibody business model
in the EU completely’.
Nederland
Ook in Nederland zullen biosimilars van Remicade de komende maanden hun intrede doen.
Zorgverzekeraars lieten al weten de uptake van biosimilars te willen stimuleren. Achmea, VGZ, Menzis
en CZ zijn bijvoorbeeld betrokken bij de Initiatiefgroep Biosimilars Nederland (IBN) die door Achmea
werd opgericht. Hierin werken apothekers, medisch specialisten, wetenschappers en zorgverzekeraars
samen aan een ‘verantwoord biosimilarklimaat in Nederland’. Ook Henk Eleveld van Menzis sprak zich
in een interview met Axon uit voor biosimilars. Overheid en verzekeraars verwachten dat een dergelijk
stimuleringsbeleid nodig is omdat er geen grote kortingen mogelijk zijn ten opzichte van het
referentieproduct. Bovenstaande zet van Orion zal deze zienswijze mogelijk veranderen.
Niet-medische redenen
Het voorschrijven van biosimilars bij nieuwe patiënten zal waarschijnlijk voor weinig controverse
zorgen, maar dit ligt anders bij het switchen van patiënten. Zowel het toenmalige CVZ (inmiddels
Zorginstituut) als het CBG lieten weten dat dit alleen onder strenge voorwaarden mag gebeuren. De
afgelopen jaren is er echter een forse budgetdruk gecreëerd bij ziekenhuizen. Ziekenhuisuitgaven
mogen de komende jaren jaarlijks met maximaal één procent groeien. Groeien de uitgaven aan
medicijnen harder, dan dienen deze te worden teruggebracht of moet elders gekort worden. De
overheid hoopt dat ziekenhuizen hierdoor doelmatig gaan voorschrijven: goedkoop waar het kan, duur
waar het moet. Het kan voor ziekenhuizen dus financieel interessant worden om voor biosimilars te
kiezen, zeker als zij daarin gestimuleerd worden door verzekeraars. Mogelijk komen dan ook
bestaande patiënten in beeld. Het switchen van patiënten om niet-medische redenen is in Nederland
een heikel thema. Het was zelfs een van de redenen om de overheveling te temporiseren, alhoewel
de geconstateerde problemen volgens veldpartijen wel meevielen. De kans is groot dat de komst van
biosimilars dit discussiepunt weer naar de voorgrond brengt.
because knowledge leads to success
Axon Connect, onderdeel van Axon Healthcare, Computerweg 1-G, 3821 AA Amersfoort, T 033 4502600
[email protected], www.axonhealthcare.nl










