Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
■■
16 Stereochemie
■■
16.1 Ruimtelijke structuren
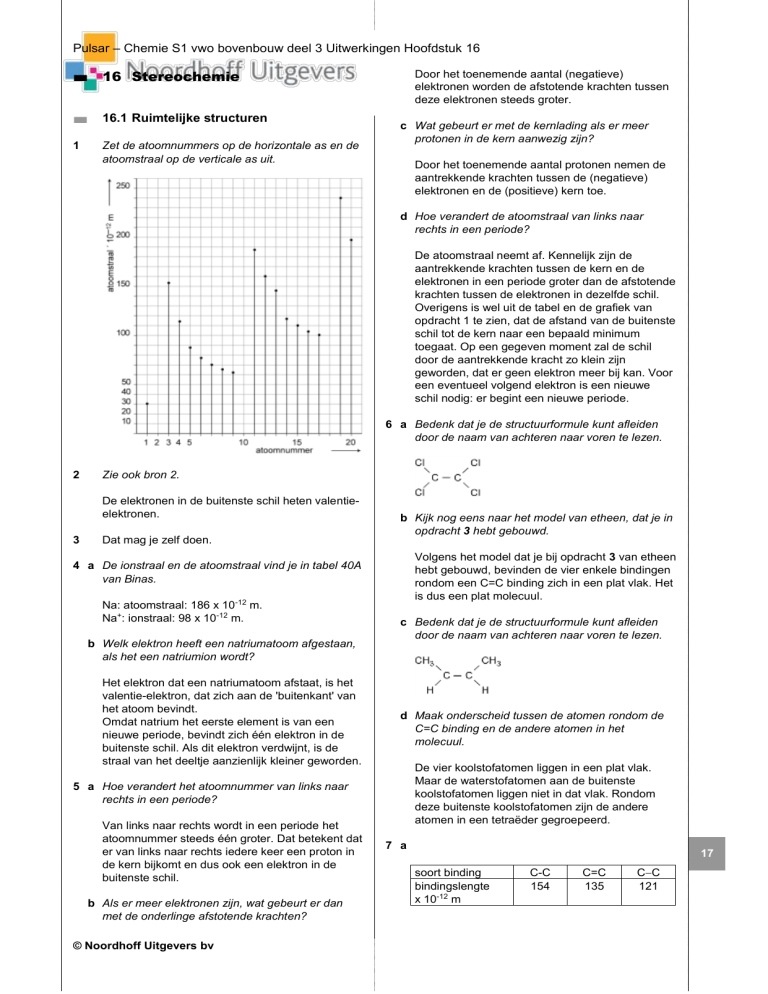
1
Zet de atoomnummers op de horizontale as en de
atoomstraal op de verticale as uit.
Door het toenemende aantal (negatieve)
elektronen worden de afstotende krachten tussen
deze elektronen steeds groter.
c Wat gebeurt er met de kernlading als er meer
protonen in de kern aanwezig zijn?
Door het toenemende aantal protonen nemen de
aantrekkende krachten tussen de (negatieve)
elektronen en de (positieve) kern toe.
d Hoe verandert de atoomstraal van links naar
rechts in een periode?
De atoomstraal neemt af. Kennelijk zijn de
aantrekkende krachten tussen de kern en de
elektronen in een periode groter dan de afstotende
krachten tussen de elektronen in dezelfde schil.
Overigens is wel uit de tabel en de grafiek van
opdracht 1 te zien, dat de afstand van de buitenste
schil tot de kern naar een bepaald minimum
toegaat. Op een gegeven moment zal de schil
door de aantrekkende kracht zo klein zijn
geworden, dat er geen elektron meer bij kan. Voor
een eventueel volgend elektron is een nieuwe
schil nodig: er begint een nieuwe periode.
6 a Bedenk dat je de structuurformule kunt afleiden
door de naam van achteren naar voren te lezen.
2
Zie ook bron 2.
De elektronen in de buitenste schil heten valentieelektronen.
3
Dat mag je zelf doen.
b Kijk nog eens naar het model van etheen, dat je in
opdracht 3 hebt gebouwd.
Volgens het model dat je bij opdracht 3 van etheen
hebt gebouwd, bevinden de vier enkele bindingen
rondom een C=C binding zich in een plat vlak. Het
is dus een plat molecuul.
4 a De ionstraal en de atoomstraal vind je in tabel 40A
van Binas.
Na: atoomstraal: 186 x 10-12 m.
Na+: ionstraal: 98 x 10-12 m.
b Welk elektron heeft een natriumatoom afgestaan,
als het een natriumion wordt?
Het elektron dat een natriumatoom afstaat, is het
valentie-elektron, dat zich aan de 'buitenkant' van
het atoom bevindt.
Omdat natrium het eerste element is van een
nieuwe periode, bevindt zich één elektron in de
buitenste schil. Als dit elektron verdwijnt, is de
straal van het deeltje aanzienlijk kleiner geworden.
c Bedenk dat je de structuurformule kunt afleiden
door de naam van achteren naar voren te lezen.
d Maak onderscheid tussen de atomen rondom de
C=C binding en de andere atomen in het
molecuul.
De vier koolstofatomen liggen in een plat vlak.
Maar de waterstofatomen aan de buitenste
koolstofatomen liggen niet in dat vlak. Rondom
deze buitenste koolstofatomen zijn de andere
atomen in een tetraëder gegroepeerd.
5 a Hoe verandert het atoomnummer van links naar
rechts in een periode?
Van links naar rechts wordt in een periode het
atoomnummer steeds één groter. Dat betekent dat
er van links naar rechts iedere keer een proton in
de kern bijkomt en dus ook een elektron in de
buitenste schil.
b Als er meer elektronen zijn, wat gebeurt er dan
met de onderlinge afstotende krachten?
© Noordhoff Uitgevers bv
7 a
17
soort binding
bindingslengte
x 10-12 m
C-C
154
C=C
135
CC
121
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
b Wat gebeurt er met de grootte van de lading
tussen de atoomresten als er meer bindende
elektronen zijn?
Er zijn steeds meer (negatieve) elektronen
betrokken bij de binding tussen de twee positieve
atoomresten. Deze groter wordende negatieve
lading zal de positieve atoomresten sterker naar
elkaar toetrekken.
c
elektronen betrokken bij de binding. Je zou je
kunnen voorstellen dat twee elektronen nodig zijn
voor de binding en het derde elektron vrij kan
bewegen en zorgen voor stroomgeleiding.
8
–
■■
16.2 Cis-trans isomerie
9
Dat mag je zelf doen.
10 a
b De volgorde van de koolstofatomen is anders. Het
zijn dus structuurisomeren.
d Welke rangschikking hoort bij een bindingsafstand tussen de koolstofatomen van
154 x 10-12 m?
11 a Is een dubbele binding draaibaar?
Omdat een dubbele binding niet vrij draaibaar is,
zal de drievoudige binding dat zeker ook niet zijn.
Volgens de bindingsafstand zijn in diamant
uitsluitend enkele C-C bindingen aanwezig. Dat
betekent dat de atomen in tetraëders rondom
elkaar gerangschikt zijn.
b Let nog eens op de ruimtelijke structuur, zoals je
die bij het model van ethyn in opdracht 1 hebt
gebouwd.
Aan weerszijden van de CC groep is nog plaats
voor één ander atoom of atoomgroep. Voor cistrans isomerie heb je aan beide kanten twee
andere atomen of atoomgroepen nodig.
e Kijk in de grafiek om het aantal bindende
elektronen bij een bindingsafstand van 142 x 10-12
m te vinden.
Uit de grafiek blijkt dat een bindingsafstand van
142 x 10-12 m overeenkomt met drie bindende
elektronen. Tussen de atomen in de plaat heerst
als het ware een 1,5 binding. Vergelijkbaar met de
benzeenring.
De bindingsafstand van 340 x 10-12 m komt
overeen met minder dan één elektron. Tussen de
platen onderling heerst enkel de zwakke
vanderwaalsbinding.
12
–
13
Teken eerst de structuurformules. Aan welke
voorwaarden moet een molecuul voldoen, als cistrans isomerie mogelijk is?
f Welk verband denk je dat er bestaat tussen de
sterkte van de binding en de bindingsafstand?
Als de bindingsafstand groter wordt, neemt de
sterkte van de binding af. Je zou dus kunnen
concluderen dat de bindingssterkte te maken heeft
met het aantal bindende elektronen. Dat betekent
dat de binding tussen de atomen in een plaat veel
groter is, dan de binding tussen de platen onderling.
18
ab Deze structuurformules voldoen niet aan de
voorwaarde dat aan weerszijden van de starre
binding verschillende groepen voorkomen.
c
g Hoeveel elektronen zijn minimaal nodig voor
atoombinding tussen twee C atomen?
Volgens ons model zijn voor een
gemeenschappelijk elektronenpaar twee
elektronen nodig. In de platen van koolstof zijn drie
© Noordhoff Uitgevers bv
Uit deze structuurformule blijkt dat geen starre
binding aanwezig is.
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
d
Bij 1,3-dichloorcyclobutaan zijn voor de beide
chlooratomen ten opzichte van de koolstofring
twee posities mogelijk. Er is dus sprake van cistrans isomerie.
Aan weerszijden van de dubbele binding zitten
drie dezelfde groepen. Er is geen sprake van cistrans isomerie.
14
b Let op de positie van de atomen rondom de C=C
groep.
Let op de positie van de chlooratomen ten
opzichte van elkaar.
a
Bij 1,2-dichloorcyclobuteen liggen de twee
chlooratomen in hetzelfde vlak als de vier
koolstofatomen van de cyclobuteenring, waardoor
de groepen niet boven of onder het vlak kunnen
liggen. Cis-trans isomerie komt dus niet voor.
b Het hangt af naar welke groepen je kijkt. Als je in
de structuurformule in a naar de twee
chlooratomen kijkt, staan die aan verschillende
zijden tegenover elkaar. Dit heet trans-1-broom1,2-dichlooretheen.
Als je naar het broomatoom aan de ene kant en
het chlooratoom aan de andere kant kijkt, staan
deze aan dezelfde kant. Dit is dan de cisvorm.
Dat betekent dat je er bij moet zeggen op welke
atoomgroepen trans en cis betrekking heeft.
15
c De chlooratomen zijn nu aan andere
koolstofatomen van de ring gebonden!
Bedenk dat je de structuurformule kunt afleiden
door de naam van achteren naar voren te lezen.
a
b
Bij 3,4-dichloorcyclobuteen is dat anders. De
chlooratomen zijn niet meer gebonden aan de
twee koolstofatomen van de C=C groep. De
chlooratomen liggen dus boven of onder het vlak
van de cyclobuteenring. Net zoals bij opdracht a is
cis-trans isomerie mogelijk.
d Let op de positie van het chlooratoom, dat aan de
C=C groep gebonden is.
16 a Aan welke twee voorwaarden moet een molecuul
voldoen om cis-trans isomerie mogelijk te maken?
Teken eerst de structuurformules.
a
Het chlooratoom dat aan de C=C groep is
gebonden, bevindt zich in het platte vlak van de
koolstofring. De positie van het andere
koolstofatoom ligt niet in het vlak, maar het maakt
niet uit of deze er boven of er onder ligt. Je kunt
het hele molecuul dan als het ware gewoon
omdraaien.
17
Bij een ring is sprake van een starre binding. Aan
de eerste voorwaarde voor cis-trans isomerie is
dus voldaan.
© Noordhoff Uitgevers bv
–
19
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
■■
16.3 Optische activiteit
18
Dat mag je zelf doen.
19
Werk systematisch. Er zijn twee groepen stoffen
met deze molecuulformule.
23
Iedere keer als het licht moleculen van een optisch
actieve stof passeert, wordt de trillingsrichting van
het licht een beetje verder gedraaid. Dus dan is
het logisch dat de draaiingshoek afhankelijk is van
de lengte van de lichtweg en van de concentratie
van de optisch actieve stof. Omdat het licht bij een
langere lichtweg en een hogere concentratie meer
moleculen passeert.
24
Waarop slaat het woord `draaien' bij optisch
actieve stoffen?
Het draaien heeft betrekking op een proef. Als je
een oplossing van deze stroop in een polarimeter
zou onderzoeken, dan zul je constateren, dat de
polarimeter een uitslag vertoont, die overeenkomt
met een draaiing van de trillingsrichting van het
gepolariseerde licht naar rechts.
25
Kijk naar het bijschrift van de illustratie van
dieetyoghurt.
Rechtsdraaiend melkzuur is een stof, die ook in
het lichaam voorkomt. Daarom denkt men dat
yoghurt die juist dat melkzuur bevat, beter is voor
je lichaam.
■■
26
16.4 Asymmetrisch C atoom
Vragen bij de proef
1 Er moet een koolstofatoom zijn met aan alle
bindingen iets verschillends.
Je kunt ook zeggen dat geen inwendig spiegelvlak
aanwezig is.
20
Zie bron 7. Optische isomeren hebben maar
enkele verschillen.
2 Bij 1-butanol is geen koolstofatoom aanwezig met
vier verschillende groepen om zich heen. Er is dus
een inwendig spiegelvlak in het molecuul
aanwezig. Als dat het geval is, dan is het
spiegelbeeld identiek met het origineel.
Bij 2-butanol komt wel een koolstofatoom voor (het
tweede) waarbij aan alle bindingen verschillende
groepen zijn gebonden (-H, -OH, -CH3 en -C2H5).
Hierbij is het spiegelbeeld niet identiek met het
origineel. Je kunt dus twee verschillende
structuren bouwen.
Het andere isomeer is linksdraaiend, met een
draaiingshoek van 30o linksom.
21
Dat zijn:
– het verschil in draaiing van de trillingsrichting
van gepolariseerd licht,
– het gedrag bij proeven met bacteriën.
22
Kun je met een thermometer een mengsel van
twee vloeistoffen scheiden? Anders gezegd: wat is
het verschil tussen scheiden en onderscheiden?
Nee, je kunt alleen de eigenschap ten opzichte
van gepolariseerd licht waarnemen. Als je een
mengsel van twee optische isomeren in dezelfde
concentratie in een polarimeter stopt, zul je
constateren dat de polarimeter niet uitslaat, omdat
de ene isomeer de trillingsrichting van het licht
naar rechts draait en de andere isomeer draait de
trillingsrichting dan over dezelfde hoek naar links.
20
27
Probeer de formules ruimtelijk te tekenen. Dan
komen de verschillen tussen twee spiegelbeeldisomeren beter uit.
28
Waaruit bestaat een racemisch mengsel?
De twee componenten die samen het racemisch
mengsel vormen, verschillen alleen in gedrag ten
opzichte van gepolariseerd licht en ten opzichte
van reacties met bacteriën of enzymen. De kooken smeltpunten zijn gelijk. Je kunt het mengsel
dus niet scheiden door destillatie.
© Noordhoff Uitgevers bv
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
29
Teken eerst de structuurformule.
33 a Je mag dus alleen als hoofdketen onvertakt
butaan gebruiken.
Dit molecuul heeft een asymmetrisch
koolstofatoom. Aan koolstofatoom nummer 3 is
gebonden: -Br, -H, -CH2-CH=CH en -CH=CH-CH2.
Dat zijn vier verschillende groepen.
30
b Wat kun je met een polarimeter zichtbaar maken?
Teken eerst de structuurformules. Je moet nagaan
of er in het molecuul een asymmetrisch
koolstofatoom aanwezig is. Markeer dat atoom
met een sterretje *.
1-butanol is niet optisch actief. Dat kun je met
behulp van een polarimeter zien. De
trillingsrichting van het gepolariseerde licht
verandert niet.
Van de twee spiegelbeeldisomeren van 2-butanol
zal de ene de trillingsrichting naar rechts en de
andere naar links draaien. Ook dat is met een
polarimeter waar te nemen.
a
b
34
Waarin komen spiegelbeeldisomeren overeen en
waarin verschillen ze?
Alleen de draaiing van de trillingsrichting van
gepolariseerd licht is anders; deze bedraagt 155o
naar rechts. De andere eigenschappen zijn gelijk.
c
35 a
d
e
f
Uit de tekeningen van de structuurformules kun je
afleiden dat bij de formules van 2-chloorpentaan
en 1,2-propaandiol een asymmetrisch
koolstofatoom aanwezig is. Bij die stoffen komt
dus spiegelbeeldisomerie voor.
31
–
32
In de structuurformule moet een asymmetrisch C
atoom voorkomen. Begin daarmee en “plak” er
dan vier verschillende groepen aan.
Het moet wel 2-methylbutaanzuur zijn.
© Noordhoff Uitgevers bv
b Tel het aantal C, H en O atomen.
Alle drie de molecuulformules voldoen aan de
formule C6H12O6.
c Let op de posities van de -OH groepen ten
opzichte van de ring.
De verschillen zitten vooral in de positie van de OH groepen ten opzichte van de ring. We noemen
het C-atoom rechts naast het zuurstofatoom in de
ring C-atoom nummer 1.
De formules van D-glucose en van D-galactose
verschillen van elkaar door de posities van de
-OH groepen op koolstofatoom nummer 1 en 4.
In D-fructose komt een vijfring voor in plaats van
een zesring.
21
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
36 a Bedenk dat je de structuurformule kunt afleiden
door de naam van achteren naar voren te lezen.
Eerste mogelijkheid: bij deze additie ontstaat
alleen 1-butanol. Hierbij is geen optische isomerie
mogelijk dus ook geen optische activiteit.
Tweede mogelijkheid: bij deze additie ontstaat
alleen 2-butanol. Hierbij zijn twee optische
isomeren mogelijk. Deze isomeren ontstaan in
dezelfde concentraties, omdat de kans op het
ontstaan van beide isomeren even groot is. Er
ontstaat dus een racemisch mengsel, waardoor er
ook geen optische activiteit is.
Derde mogelijkheid: een combinatie van deze
beide mogelijkheden.
38 a Het ibuprofenmolecuul is in deze reactie een zuur,
omdat het een H+ ion afstaat.
Welke groep van het ibuprofenmolecuul is daarbij
dus betrokken?
b Is er een asymmetrisch koolstofatoom?
Bij chloorcyclobutaan is geen asymmetrisch
koolstofatoom aanwezig. Dus zijn er geen optische
isomeren.
c Is er een asymmetrisch koolstofatoom?
Bij 1,2-dichloorcyclobutaan komen zelfs twee
asymmetrische koolstofatomen voor. Daarvan
zullen dus enkele optische isomeren kunnen
voorkomen.
d Er zijn twee voorwaarden voor optische activiteit
– één of meer asymmetrische C atomen
– er is geen inwendig spiegelvlak.
cis-1,2-dichloorcyclobutaan heeft een inwendig
spiegelvlak en is dus niet optisch actief.
trans-1,2-dichloorcyclobutaan heeft geen inwendig
spiegelvlak. Er zijn dus twee optisch actieve
stereo-isomeren van trans-1,2-dichloorcyclobutaan. Ze zijn elkaars spiegelbeeld.
b Alle stoffen, of deeltjes staan gegeven. Zet die dus
in de juiste volgorde voor en achter de pijl. Let dan
op of de vergelijking wel klopt.
37 a Welke groep is bij een additiereactie betrokken?
c Is in het molecuul van het keteen een
asymmetrisch koolstofatoom aanwezig?
b Welke twee butanolen ontstaan volgens opdracht a?
22
Als 2-butanol ontstaat, heb je te maken met
moleculen met een asymmetrisch koolstofatoom.
Het is dan mogelijk dat de linksdraaiende en/of de
rechtsdraaiende stof ontstaat.
c Wanneer is er wel en wanneer is er geen
optische activiteit?
Hier zijn verschillende antwoorden mogelijk.
© Noordhoff Uitgevers bv
Doordat in het molecuul van het keteen een C=C
groep aanwezig is, verliest het molecuul ten
opzichte van een molecuul ibuprofen het
asymmetrisch koolstofatoom. Er zijn dus geen
spiegelbeeldisomeren.
d Als je de structuurformules van
2-hydroxypropaanzuur en ethanol tekent, zet deze
dan zó naast elkaar dat de twee OH groepen die
bij de vorming van een ester betrokken zijn,
tegenover elkaar staan. Als je van die twee OH
groepen een molecuul H2O afsplitst, kom je
vanzelf op de gevraagde formule.
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
e Komt in het molecuul van ethyllactaat een
asymmetrisch koolstofatoom voor?
c Let op de voorbeeldreactie in bron 15.
Als je met een racemisch mengsel van 2chloorbutaan begint, dan zul je ook een racemisch
mengsel van 2-butanol krijgen. Dat betekent, dat
het reactieproduct geen optische activiteit zal
vertonen.
In de gegeven structuurformule is het tweede
koolstofatoom asymmetrisch. Aan dat atoom zijn
immers vier verschillende groepen gebonden: CH3, -H, -OH en -COOC2H5. Dat betekent dat de
stof ethyllactaat optisch actief is.
f Het proces komt in principe op het volgende neer:
– water onttrekken aan ibuprofen,
– water laten adderen aan het keteen.
Bij de vorming van het optisch zuivere ibuprofen
komt het op de volgende twee stappen neer.
– Je onttrekt water aan de ibuprofenmoleculen.
Hierbij doet het er niet toe of dat bij de
linksdraaiende of de rechtsdraaiende isomeer
gebeurt. In beide gevallen ontstaat hetzelfde
molecuul: het keteen. Dit keteen is niet optisch
actief.
– Daarna wordt aan de C=C groep in het keteen
onder invloed van optisch zuiver ethyllactaat weer een
H atoom en een OH groep aan de koolstofatomen
gekoppeld. Er moet aan de C=C van keteen links een
H en rechts een OH koppelen. Normaal is het 50%
kans dat deze additie aan de ene kant en 50% dat dit
aan de andere kant plaats vindt. Door de ruimtelijke
structuur van het optisch zuivere ethylacetaat
gebeurt dit 100% aan één kant (sterische hindering),
waardoor er alleen rechtsdraaiend ibuprofen
ontstaat.
39
–
40
–
41
–
■■
16.5 Reactiemechanismen
42
Een reactiemechanisme beschrijft precies hoe een
reactie van stap tot stap verloopt. Een
reactievergelijking geeft alleen het totaalresultaat.
43
–
45
Je moet allereerst bedenken dat de
substitutiereactie zoals die in opdracht 44 tussen
Cl en OH heeft plaatsgevonden ook mogelijk is
van de OH groep van 2-butanol met de OH groep
van natronloog. Als een dergelijke vervanging
optreedt, kun je dat niet zien aan de formule van
het reactieproduct. Steeds blijft dat 2-butanol. Bij
de vervanging vindt echter een omkering van het
molecuul plaats, waardoor dat molecuul van de
rechtsdraaiende isomeer overgaat in de
linksdraaiende isomeer. Op den duur is van beide
isomeren evenveel aanwezig; je hebt een racemisch mengsel gekregen.
46 a Geef eerst de vergelijking van stap 1: het
afsplitsen van het Cl- ion.
Daarna de vergelijking van stap 2: het hechten van
een OH- ion.
b Wat voor soort mengsel ontstaat, als de kans dat
het OH- ion van links of van rechts koppelt even
groot is?
44 a Wanneer heb je met een asymmetrisch
koolstofatoom te maken?
b Kijk in bron 15 welk deeltje bij deze reactie vervangen wordt.
© Noordhoff Uitgevers bv
Ga er vanuit dat ook bij de reactie van 2-butanol
met natronloog OH groepen worden uitgewisseld.
Als het OH- ion de ene keer van de linkerkant en
de andere keer van de rechterkant komt, ontstaan
de twee spiegelbeeldisomeren. De kans op beide
is even groot. Na afloop heb je dus een racemisch
mengsel, dus je meet geen optische activiteit.
47
Ga na dat in een sterk polair oplosmiddel stap 1
van het mechanisme gemakkelijker verloopt.
23
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
Door het sterk polaire oplosmiddel is het mogelijk
dat van 2-broommethylpropaan een Br- ion wordt
afgesplitst. Dat komt, omdat de Br- ionen door de
dipoolmoleculen van het oplosmiddel omringd
kunnen worden. Op die manier verloopt de eerste
stap in het reactiemechanisme in een polair
oplosmiddel gemakkelijker.
24
© Noordhoff Uitgevers bv
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
48 a Kijk in bron 15 welk deeltje bij deze reactie vervangen wordt.
Onder welke voorwaarde zijn optische isomeren
mogelijk?
a
b Kijk in bron 15 na hoe de tweede orde reactie verloopt.
Bij de tweede orde reactie hecht een OH- ion of
een Cl- ion zich aan het koolstofatoom, dat een
beetje positief geladen is. Dus daar vindt een
koppeling van een OH- ion of een Cl- ion plaats
onder gelijktijdige afsplitsing van een halogenideion. Dat betekent dat bij deze reactie naast een
natriumjodide-oplossing ethanol en chloorethaan
ontstaat.
Er is een asymmetrisch koolstofatoom aanwezig
dus zijn er optische isomeren. Er komen geen cistrans isomeren voor, omdat aan één kant van de
dubbele binding twee dezelfde groepen (-H)
voorkomen.
b
In de structuurformule tref je een asymmetrisch
koolstofatoom aan; er zijn optische isomeren
mogelijk. Bovendien komt een C=C groep voor.
Rondom deze groep zijn verschillende groepen
aanwezig, zodat ook cis-trans isomerie mogelijk is.
c Kijk in bron 15 na hoe de eerste-orde reactie verloopt.
Bij een eerste orde reactie wordt eerst het jodideion aan joodethaan onttrokken. Daarna hecht een
(ander) negatief ion zich aan het ontstane
positieve ion. Dat kan dus zowel het OH- als het
Cl- of zelfs het I- ion zijn. Dan krijg je uiteindelijk
een mengsel van joodethaan, chloorethaan en
ethanol.
49
c
Ga na waarom in sommige gevallen een tweede
orde reactie niet mogelijk is en een eerste orde
reactie wel.
Bij 3-chloorpentaan wordt het koolstofatoom
waaraan het chlooratoom is gebonden
afgeschermd door twee ethylgroepen. Daardoor is
de nadering van het OH- ion moeilijk. We zullen
daar dus een eerste orde reactie aantreffen.
Bij 2-chloorpropaan is deze hindering minder
aanwezig, zodat daar ook een tweede orde reactie
mogelijk is.
■■
Op weg naar het proefwerk
1
Cis-trans isomerie kan optreden bij moleculen
– die star zijn vanwege een dubbele binding of
een cyclisch deel.
– die aan iedere zijde van de dubbele binding
twee verschillende atomen of groepen hebben
of die aan twee C atomen in de ring twee
verschillende groepen hebben.
Rondom de C=C groep zijn verschillende groepen
aanwezig. Er is cis-trans isomerie mogelijk.
d
Er komen geen optische- en geen cis-trans
isomeren voor.
e
Er komen geen optische- en geen cis-trans
isomeren voor.
f
2
Er is sprake van optische isomerie als er in de
moleculen van een stof:
– één of meer asymmetrische C atomen zijn;
– geen inwendig symmetrievlak voorkomt.
3
–
4
Teken in alle gevallen eerst de structuurformule.
Onder welke voorwaarden treedt cis-trans
isomerie op?
© Noordhoff Uitgevers bv
25
Er is cis-trans isomerie mogelijk, omdat bij de
cyclopentaanring de positie van de broom- en
chlooratomen zowel aan dezelfde kant als aan
verschillende kanten van de ring kan zijn. Bovendien zijn er twee asymmetrische koolstofatomen,
dus er is ook optische isomerie mogelijk.
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
5 a In paragraaf 13.6 heb je geleerd hoe alkanolen
met een oxidator reageren. Raadpleeg ook tabel
66D van Binas.
Een mengsel van maleïnezuur en fumaarzuur kun
je van elkaar scheiden, omdat de cis-vorm (maleïnezuur) zeer waarschijnlijk een ander kookpunt
zal hebben dan de trans-vorm (fumaarzuur). Te
verwachten is dat maleïnezuur een sterkere dipool
zal zijn dan fumaarzuur. Als de kookpunten dus
behoorlijk verschillen, kun je ze door middel van
destillatie van elkaar scheiden.
g Welke binding is bij een additiereactie betrokken?
b Ga na of bij deze reactie een asymmetrisch
koolstofatoom ontstaat of verdwijnt.
Door de reactie verdwijnt het asymmetrische C
atoom. De optische activiteit zal dus verdwijnen bij
deze reactie. Met een polarimeter kun je dat goed
volgen.
6 a Bedenk dat je de structuurformule kunt afleiden
door de naam van achteren naar voren te lezen.
h Ontstaan bij deze reactie moleculen met
asymmetrische koolstofatomen?
Bij deze reactie ontstaan moleculen met twee
asymmetrische koolstofatomen. Het ligt dus voor
de hand dat hierbij optische isomeren ontstaan.
b Noteer water als H-OH
7 a Bij een dizure ester van glycerol zijn twee OH
groepen van een glycerolmolecuul veresterd. Om
aan drie isomeren te komen moet je ook op
stereo-isomeren letten!
c Is fumaarzuur optisch actief?
Bij de additiereactie met het enzym ontstaat een
optisch zuivere isomeer. Omdat fumaarzuur zelf
niet optisch actief is, zul je met een polarimeter
kunnen waarnemen dat de reactie verloopt.
d In de opgave staat, wat er bij de reactie onder
invloed van H+ ionen ontstaat. Zoek dat in de tekst
op.
Omdat bij de additie van water met behulp van H+
ionen een racemisch mengsel ontstaat, kun je die
reactie niet met een polarimeter volgen.
e Wat is de systematische naam van fumaarzuur
ook al weer?
Fumaarzuur heeft als systematisch naam: transbuteendizuur. De stereo-isomeer hiervan met de
naam maleïnezuur heeft dus als systematische
naam: cis-buteendizuur.
26
f Ga na dat fumaarzuurmoleculen andere
dipoolmoleculen kunnen zijn dan de moleculen
van maleïnezuur.
© Noordhoff Uitgevers bv
b Waarin verschillen structuur- en optische isomeren
van elkaar?
Er zijn dus drie isomeren. De di-ester met de
estergroepen naast elkaar heeft een asymmetrisch
koolstofatoom. Hierbij is dus spiegelbeeld-isomerie
mogelijk. Deze twee isomeren zullen wel hetzelfde
kookpunt hebben. Optische isomeren verschillen
alleen in de draaiing van het gepolariseerde licht
en reacties ten opzichte van enzymen.
c Welke reactie verloopt als een ester met loog
wordt behandeld?
Bij de reactie met loog wordt de ester verzeept. Er
ontstaat weer glycerol en het zuurrestion van
azijnzuur. Je zult bij de drie esters geen verschil
merken.
Pulsar – Chemie S1 vwo bovenbouw deel 3 Uitwerkingen Hoofdstuk 16
d Bij een voorzichtige reactie met een oxidator kan
in dit geval een alkanol reageren (zie paragraaf
13.6).
Bij de voorzichtige reactie met een oxidator
reageert de resterende OH groep. Als de OH
groep aan koolstofatoom 1 is gebonden, ontstaat
een aldehyde. Is de OH groep aan koolstofatoom
2 gebonden, dan ontstaat een keton.
8 a Doordat de wetenschap zich verder heeft
ontwikkeld, kan het geneesmiddel steeds
zuiverder worden bereid. Ballaststoffen hoeven
niet meer gezien te worden als een niet te
vermijden bijproduct bij het geneesmiddel.
b De ene soort bestaat uit vul-, kleur- en
conserveringsstoffen. De andere soort bestaat uit
niet-werkzame stereo-isomeren
c Met stereo-isomeren worden in dit artikel optische
isomeren bedoeld.
d Zo'n mengsel heet een racemisch mengsel.
e
f Dat zul je echt zelf moeten doen.
g De bereidingswijze waarbij alleen het werkzame
optische isomeer ontstaat, is waarschijnlijk
duurder. De fabrikant gaat in het algemeen pas
over op een duurdere bereidingswijze als de
consument bereid is daarvoor te betalen.
27
© Noordhoff Uitgevers bv