Isomeren
Scheikunde
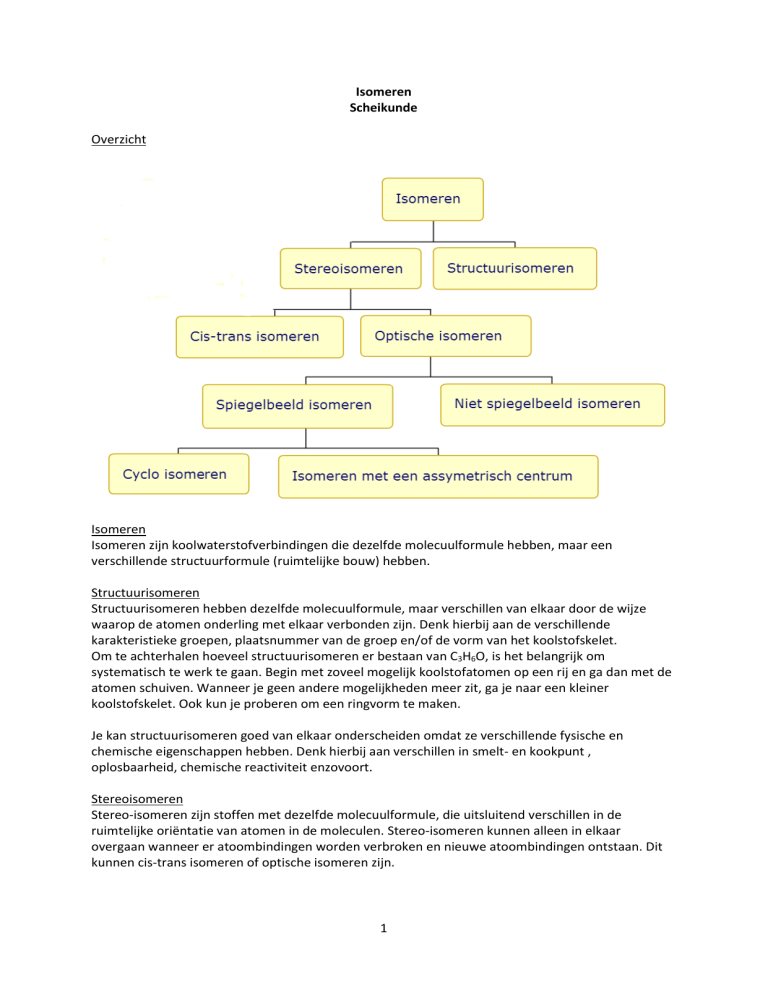
Overzicht
Isomeren
Isomeren zijn koolwaterstofverbindingen die dezelfde molecuulformule hebben, maar een
verschillende structuurformule (ruimtelijke bouw) hebben.
Structuurisomeren
Structuurisomeren hebben dezelfde molecuulformule, maar verschillen van elkaar door de wijze
waarop de atomen onderling met elkaar verbonden zijn. Denk hierbij aan de verschillende
karakteristieke groepen, plaatsnummer van de groep en/of de vorm van het koolstofskelet.
Om te achterhalen hoeveel structuurisomeren er bestaan van C3H6O, is het belangrijk om
systematisch te werk te gaan. Begin met zoveel mogelijk koolstofatomen op een rij en ga dan met de
atomen schuiven. Wanneer je geen andere mogelijkheden meer zit, ga je naar een kleiner
koolstofskelet. Ook kun je proberen om een ringvorm te maken.
Je kan structuurisomeren goed van elkaar onderscheiden omdat ze verschillende fysische en
chemische eigenschappen hebben. Denk hierbij aan verschillen in smelt- en kookpunt ,
oplosbaarheid, chemische reactiviteit enzovoort.
Stereoisomeren
Stereo-isomeren zijn stoffen met dezelfde molecuulformule, die uitsluitend verschillen in de
ruimtelijke oriëntatie van atomen in de moleculen. Stereo-isomeren kunnen alleen in elkaar
overgaan wanneer er atoombindingen worden verbroken en nieuwe atoombindingen ontstaan. Dit
kunnen cis-trans isomeren of optische isomeren zijn.
1
Cis-trans isomeren
Cis-trans isomerie komt voor bij bindingen waarbij de rotatie tussen twee atomen belemmerd is. Dit
kan worden veroorzaakt door een dubbele binding of door de ringstructuur van een molecuul. Door
een dubbele binding of een ringstructuur is er geen vrije draaibaarheid tussen de koolstofatomen.
Bij een cis-isomeer zitten de groepen met de hoogste prioriteit aan dezelfde kant van de dubbele
binding of ring.
Bij een trans-isomeer zitten de groepen met de hoogste prioriteit aan de tegenovergestelde kant van
de dubbele binding of ring.
Optische isomeren
Stoffen met dezelfde molecuulformule, maar een andere structuurformule. Optische isomeren
hebben één of meer asymmetrische koolstofatomen. Optische stoffen kunnen gepolariseerd licht
draaien.
Je kunt berekenen in hoeveel optische isomeren een stof kan voorkomen. Dit kan met de formule 2n
waarin n de asymmetrische koolstofatomen voorstellen. Wanneer je echter te maken hebt met een
inwendig spiegelvlak, dan moet je per spiegelvlak één isomeer minder rekenen. Dit komt omdat een
molecuul met een inwendig spiegelvak gelijk is aan zijn spiegelbeeld.
Alle chemische en fysische eigenschappen van spiegelbeeldisomeren zijn gelijk. Alleen de
permanente ruimtelijke rangschikking van atomen binnen het molecuul verschilt.
Spiegelbeeldisomeren
Stereo-isomeren waarvan de twee isomeren elkaars spiegelbeeld zijn. De spiegelbeeldisomeren
veroorzaken dezelfde draaiing van het licht, maar dan tegenovergesteld. Er wordt dan geen optische
activiteit gemeten. Spiegelbeeldisomeren veroorzaken een racemisch mengsel.
Cycloisomeren
Soms kan een molecuul als geheel asymmetrisch zijn, zonder een
asymmetrisch koolstofatoom te bevatten.
Isomeren met asymmetrisch koolstofatoom
Dit worden optische isomeren genoemd, aangezien ze optische activiteit
vertonen.
Geen spiegelbeeldisomeer
Stereo-isomeren waarvan de twee isomeren niet elkaars spiegelbeeld zijn. Zij bevatten wel een
asymmetrisch koolstofatoom en vormen geen racemisch mengsel. Dat betekent dat er wel optische
activiteit wordt gemeten.
2