AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
1. Bespreek de polariserende cytokines, masterregulator genen en
effector cytokines van de T helper 1 cellen, T helper 2 cellen,
regulatoire T cellen en folliculaire helper T cellen
Begrippen
Polariserende cytokines = Cytokines die bepalen welke subset van T helpercellen tot
ontwikkeling komen.
Masterregulator genen = Gen dat de expressie regelt van een set van effectorcytokines
Effector cytokines = Cytokines die een functie uitoefenen op immuuncellen.
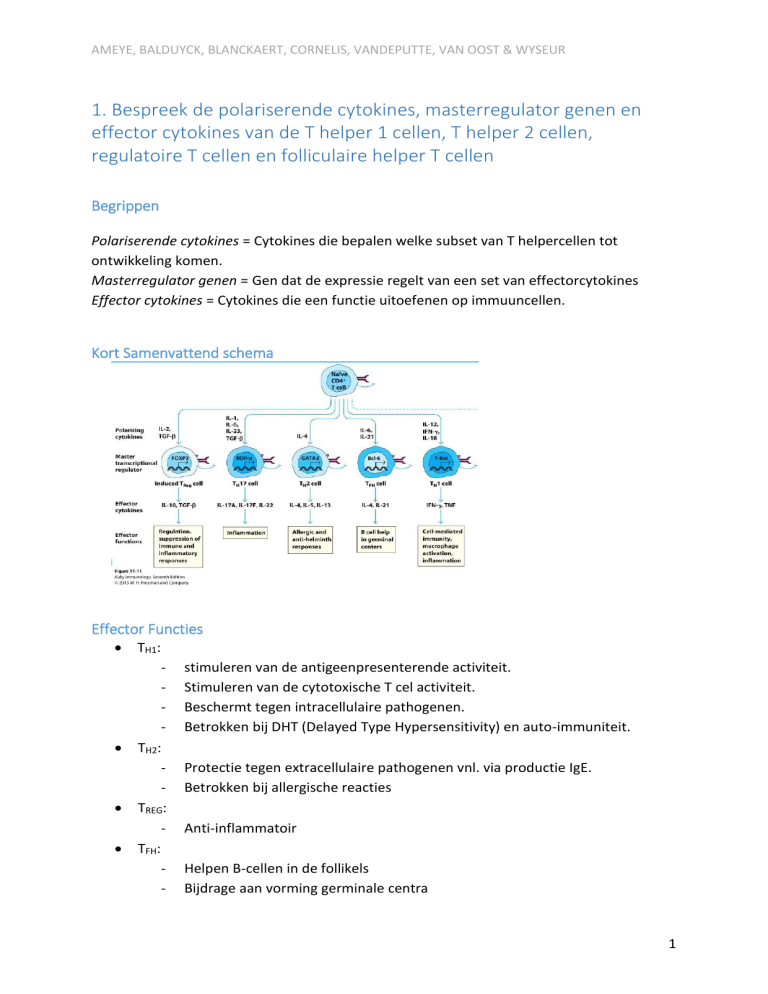
Kort Samenvattend schema
Effector Functies
TH1:
TH2:
TREG:
TFH:
-
stimuleren van de antigeenpresenterende activiteit.
Stimuleren van de cytotoxische T cel activiteit.
Beschermt tegen intracellulaire pathogenen.
Betrokken bij DHT (Delayed Type Hypersensitivity) en auto-immuniteit.
Protectie tegen extracellulaire pathogenen vnl. via productie IgE.
Betrokken bij allergische reacties
Anti-inflammatoir
Helpen B-cellen in de follikels
Bijdrage aan vorming germinale centra
1
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
2. Bespreek het 2-signaal model van T cel activatie
Signaal 1: antigen-specifieke TCR signalisatie
Herkenning van cognate antigen, aangeboden op een APC, door de mature naïeve T-cel leidt
tot een immuunsynaps
TCR/MHC-peptide complexen en co-receptoren vormen het cSMAC (centraal
Supramoleculair Activerend Complex)
Adhesie moleculen/liganden vormen het pSMAC (perifeer Supramoleculair
Activerend Complex)
NIET voldoende
Signaal 2: contact met co-stimulatoire liganden
Positieve(+) co-stimulatoire receptoren: activatie
CD28
o Expressie op T-cellen
o versterkt TCR-geïnduceerde proliferatie en overleving
o Bindt B7-1 (CD80) en B7-2 (CD86) op APCs
o Initieert activatie van T-cellen via inductie expressive van IL-2 en bcl-xl
ICOS
o bindt ICOS-ligand op APC
o tot expressie gebracht op geheugen en effector T cellen
o onderhoudt activatie van reeds gedifferentieerde T-cellen
Negatieve (-) co-stimulatoire receptoren: inactivatie
CTLA-4
o Bindt B7-1 en B7-2 met een hogere affiniteit dan CD28
o negatieve feedback mechanisme
PD-1
o aanwezig op B- en T-cellen
o Bindt PD1-L1/2 (PD1-L1 rol in T-cel tolerantie non-lymfoide weefsels)
BTLA
o Aanwezig op T-cellen, NK cellen, macrofagen, DCs en B-cellen
o Bindt HVEM
o anti-inflammatoir en anti-autoimmuniteit
Clonale anergie is het resultaat van afwezige co-stimulatoire signalen
(draagt bij tot perifere tolerantie)
2
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Signaal 3: cytokines die T-cel differentiatie tot verschillende effector subsets sturen
T cel activatie wordt bijkomend beïnvloed door de activiteit van cytokines die geproduceerd
worden door APC en T-cellen
geven aanleiding tot proliferatie en verlengde overleving na hun binding met receptoren
bvb. IL-2, een autocrien cytokine:
T cellen produceren zowel IL-2 als zijn receptor (IL-2R α-keten - CD25)
voorziet zeer sterk proliferatie signaal
3
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
3. Bespreek de verschillende types van effector T cellen
Effector T-cellen zullen op directe of indirecte wijze meehelpen aan de eliminatie van
pathogenen
CD8+ cytotoxische T-cellen
verlaten secundaire lymfoïde organen en migreren naar plaats van infectie
Herkennen peptide-MHC klasse 1 (intracellulaire infecties, tumoren)
CD4+ helper T-cellen
Produceren cytokines die de immuunreactie stimuleren
effect op B-cellen, T-cellen en macrofagen = orchestren de immuunrespons vanuit
secundaire lymfoïde organen of ter plaatse
Er zijn verschillende subsets van CD4+ helper T-cellen naargelang de polariserende cytokine
dat erop inwerkt:
EFFECTOR FUNCTIES:
TH1:
- stimuleren van de antigeenpresenterende activiteit.
- Stimuleren van de cytotoxische T cel activiteit.
- Beschermt tegen intracellulaire pathogenen.
- Betrokken bij DHT (Delayed Type Hypersensitivity) en auto-immuniteit.
TH2:
- Protectie tegen extracellulaire pathogenen vnl. via productie IgE.
- Betrokken bij allergische reacties
TREG:
- Anti-inflammatoir
TFH:
- Helpen B-cellen in de follikels
- Bijdrage aan vorming germinale centra
4
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
4. Bespreek T-dependente B cel responsen
Kritisch afh van CD4 helper T-cel signalen aan B-cellen
Gemedieerd door B-2 B-cellen die binden aan T-dependente antigenen
Twee verschillende signalen nodig voor activatie B-cel:
o Signaal 1:
Multivalent antigeen dat bindt aan immunoglobuline receptor op B-cel.
Deel van antigen zal geïnternaliseerd worden in de B-cel en zal
geprocessed en geëxprimeerd worden op het oppervlak van de B-cel
samen met MHC klasse 2 moleculen.
T-cellen specifiek voor identieke cognate antigen worden op hetzelfde
moment geactiveerd door antigen-dragende dendritische cellen.
o Signaal 2:
Geactiveerde T-cellen zullen cytokines secreteren die voor volledige
activatie van de B-cel zorgen
De interactie tussen T-cellen en B-cellen is kritisch afhankelijk van
signalen tussen T- en B-cel via CD40Ligand (CD40L of CD154) op T-cel
oppervlak dat bindt aan CD40 op het B-cel oppervlak en CD28 op T-cel
oppervlak dat bindt met CD80 en 86 op het B-cel oppervlak.
De B-cel krijgt dus signalen:
- via antigenreceptor
- signalen via cytokines en co-receptoren
Deze geactiveerde B-cellen verplaatsen zich dan binnenin lymfeklier of milt: naar
gespecialiseerde regio voor differentiatie -> antistof-secreterende cel te ondergaan.
Lymfocyten komen de lymfeknoop binnen thv de T-cel zone. Een deel van antigengeactiveerde B-cellen zal zich dan verplaatsen naar een regio op de overgang van T-cel en Bcel zone waar zij zullen differentiëren in clusters van geactiveerde B-cellen (= primaire foci)
differentiatie tot plasmacel na 4 dagen: migratie naar de medullaire cord zone id
lymfeklier of andere delen vd rode pulpa id milt dichtbij de T-cel zones. Hier zullen ze grote
hoeveelheden antistoffen secreteren.
Primaire foci leveren grotere hoeveelheid van IgM antistoffen in de vroege fase van B-cel
respons.
Sommige antigen-gestimuleerde B-cellen zullen 4 tot 5 dagen na TD B-cel activatie naar de
follikels van de lymfeklieren en de milt migreren (ipv naar de primaire foci) om daar verdere
differentiatie te ondergaan. Vele antigen-specifieke lymfocyten verzamelen in follikels en
5
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
veranderen van uitzicht = germinale centra. (verdere uitleg over germinale centra: zie
somatische hypermutatie, class-switch recombinatie en germinale center respons)
6
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
5. Bespreek de germinale center B cel respons en somatische
hypermutatie
4 tot 5 dagen na TD B-cel activatie migreren sommige antigenspecifieke B-cellen naar de
follikel. Daar ondergaan zij snelle proliferatie vorming van grote clusters van
antigenspecifieke B-cellen en daarnaast ook Tfh cellen en folliculaire dendritische cellen.
De follikel wordt groter door proliferatie van deze cellen germinale centra (GC). Hier treden
processen van somatische hypermutatie en class switch recombinatie op (zie volgende vraag).
Zowel folliculaire dendritische cellen en Tfh cellen produceren overlevingssignalen voor GC Bcellen. B-cel proliferatie zal initieel resulteren in vermindering van IgD-expressie op het
celopp. van B-cellen. De expressie van IgM daarentegen is initieel behouden. Wanneer het GC
expandeert zullen de niet-geactiveerde B-cellen verplaatst worden naar de rand van de follikel
en deze vormen de zogenaamde corona van naïeve B-cellen (= folliculaire mantelzone). De
germinale centervorming vereist aanwezigheid van verschillende cytokines zoals lymfotoxin𝛼 die geproduceerd worden door zowel folliculaire dendritische cellen als Tfh cellen.
Signalisatie via deze cytokines zorgt voor repressie van genen zoals blimp-1 en bevorderen
expressie van genen zoals AID, die nodig zijn voor de verdere ontwikkeling van het germinale
center.
Wanneer het GC verder matureert worden twee zones zichtbaar
- Lichte zone: minder dense aanwezigheid van B-cellen (centrocyten) binnen een
netwerk van folliculaire dendritische cellen.
- Donkere zone: meer dense aanwezigheid van snel prolifererende B-cellen
(centroblasten) Folliculaire dendritische cellen zijn nagenoeg afwezig van de donkere
zone.
De verdeling van de B-cel tussen de lichte en de donkere zone wordt bepaald door de
expressie van chemokine receptoren die interageren met chemokines die preferentieel
voorkomen in één van de twee zones.
- CXCR4: in centroblasten (donkere zone)
- CXCR5: in centrocyten (lichte zone)
7
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
6. Bespreek somatische hypermutatie en class switch recombinatie
Somatische hypermutatie
Somatische (=mutationeel proces buiten de germline cellen) hypermutatie (=extreem veel
mutaties) treedt enkel op na antigencontact en enkel thv variabele regio’s van zware en lichte
ketens. Dit vereist ook de hulp van T-cellen dmv interactie door CD40L en CD40.
Het AID (activation-induced cytidine deaminase) zorgt ervoor dat aminogroepen van cytidine
residu’s verloren gaan thv mutatiehotspots -> resulteert in de vorming van uridine -> leidt tot
U-G mismatchen -> opgevangen worden door een mechanisme:
Een eerste: deoxyU wordt aanzien als deoxytT door DNA-replicatie apparaat -> dochtercellen
AT ipv GC.
Tweede mechanisme: mismatched uridine wordt verwijderd
door DNA uridine glycosylase enzyme Gap wordt ingevuld door
een DNA polymerase.
Derde mechanisme: een groter gebied van DNA in de buurt van
de mismatch wordt verwijderd. DNA-polymerase vult dit maar geeft aanleiding tot
verschillende mutaties.
Door dit proces zullen B-cel afstammelingen ontstaan met BCR’en met een andere (hogere of
lagere) affiniteit dan de BCR aanwezig in de oudercel deze dochtercellen ondergaan
affiniteitsselectie BCR’en met een hogere affiniteit voor het originele antigen worden
geselecteerd bijkomende rondes van proliferatie, mutatie en affiniteitsselectie.
Class switch recombination
Naïeve B-cellen exprimeren simultaan zowel membraangebonden IgM als IgG. Dit gebeurt
op het niveau van RNA splicing.
Class switch recombinatie = switch van IgM naar een ander antistof isotype (gebeurt op het
niveau van DNA recombinatie) en vindt plaats thv germinaal centrum oiv interleukines (van
Tfh cellen).
De vorming van 𝛾, 𝜀 en 𝛼 zware ketens genen vereist het knippen en terug samenvoegen van
het zware keten DNA op een dusdanige manier dat de vereiste constante regio’s onmiddellijk
volgend op de herschikte VDJ-regio’s komen te liggen.
8
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Class switch gebeurt door de inductie van recombinatie tussen donor en acceptor switch (S)
regio’s die gelokaliseerd zijn upstream van elke constante zware keten regio.
De donor S- regio is de S-regio upstream van de antistof zware keten regio gen
geëxprimeerd voor class switch.
De acceptor S-regio is de S-regio upstream van de antistof zware keten constante regio dat
de B cel daaropvolgend tot expressie zal brengen.
Deze regio’s bevatten de target sites voor het AID-enzyme. Tijdens het proces van class
switch recombinatie zal het AID aan deze essentiële sequensmotieven binden.
Het proces van class switch recombinatie wordt gestart na het ontvangen van costimulatoire signalen via CD40 of zeldzaam via TLR receptoren.
Gebeurt door het enzyme AID. AID deamineert verschillende cytosines binnenin de donor en
acceptor S-sites. Dit zal aanleiding geven tot single-stranded DNA breaks en vervolgens
double-stranded DNA-breaks. De ontstane double strand breaks zullen vervolgens hersteld
worden en de twee switchregio’s zullen verbonden worden met elkaar: dit geeft aanleiding
tot het verlies van het tussenliggend DNA.
Het proces van class switch recombination kan verschillende keren plaatsvinden tijdens het
leven van eenzelfde B-cel. Zo is het bijvoorbeeld mogelijk dat tijdens een eerste episode van
class switch recombination een B-cel zal switchen van IgM synthese naar IgG1 synthese terwijl
tijdens een volgende class switch recombination episode een switch gemaakt wordt naar IgE
of IgA.
9
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
7. Bespreek T-independente B cel responsen
Geen T-cel hulp vereist
TI-antigenen zijn antigenen die dit type respons uitlokken
Twee verschillende klassen van TI-antigenen:
1. TI-1 antigenen:
o Bv lipopolysachariden (LPS)
LPS in hoge dosis: aanleiding geven tot sterke activatie van het
immuunsysteem -> septische shock
LPS in lage concentraties: aanleiding tot activatie van B-cellen via hun
BCR
o Aanwezig in celwand van gram bacteriën
o Binden aan innate immuunreceptoren aanwezig op het celoppervlak van Bcellen.
o In hoge concentraties: mitogeen voor B-cellen die deze receptoren exprimeren.
B-cel activatie en stimulatie gebeurt in deze setting via TLR4.
o Aanleiding tot cross-linking van BCR’en en innate receptoren waardoor er een
activatie van de B-cel kan optreden zonder T-cel hulp. Onder deze
omstandigheden worden antistoffen gesecreteerd die specifiek zijn voor het
TI-1 antigen.
2. TI-2 antigenen:
o Bv bacteriële kapsel polysachariden
o Niet mitogeen
o Gekenmerkt door aanwezigheid van multiple antigenen determinanten op een
multivalente manier -> zorgt dat er een uitgesproken cross-linking van BCR’en
gebeurt door TI-2 antigenen
o In staat om complement fragmenten zoals C3d en C3dg te binden -> Hierdoor
kunnen TI-2 antigenen B-cellen activeren via cross-linking van BCR’en en ook
CD21 receptoren op het opp van B-cellen actief te maken.
o Additionele hulp van monocyten, macrofagen en dendritische cellen (allen
mogelijkheid om B-cel responsen te faciliteren)
o Deze cellen brengen BAFF tot expressie. BAFF is een membraangebonden lid
van de TNF-familie die bindt aan zijn receptor TACI aanwezig op het celopp van
mature B-cellen. Deze interactie activeert transscriptiefactoren dewelke B-cel
survival, maturatie en antistofsecretie bevorderen.
10
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
De meeste TI B-cel responsen worden gemedieerd door B-1 B-cellen en marginale zone Bcellen.
B-1 B-cellen
Functionele cellen
Bevinden zich in de overgang van innate en adaptief immuunsysteem
Gekenmerkt door expressie van CD5 antigeen op hun celopp. AID-enzyme wordt nooit
geactiveerd omdat de B-1 B-cellen antistoffen secreteren onafhankelijk van T-hulp,
hierdoor secreteren zij vnl. IgM antistoffen met een relatief lage affiniteit.
Antistoffen gesecreteerd door B-1 B-cellen zijn vooral betrokken in de herkenning van
antigeen determinanten geëxprimeerd door bacteriën aanwezig in het GI-stelsel en
respiratoir stelsel.
o Ze zijn gericht tegen zich herhalende antigenen zoals fosfatidylcholine, LPS en
influenza virussen.
Marginale zone B-cellen
Bevinden zich in de marginale zone van milt
Gekenmerkt door een zeer hoge expressie van CD21 (CR2).
o Dit CD21 is de receptor voor complementfactoren zoals C3d en C3dg. De
gelijktijdige signalisatie via de BCR en covalente vinding van C3d of C3dg via
CD21 geeft aanleiding tot activatie van deze marginale zone B-cellen en de
productie van TI antistoffen na herkenning van TI-2 antigenen.
Gespecialiseerd in respons van blood-born antigenen die het immuunsysteem
binnentreden via marginale zone van de milt migratie van de marginale zone nar de
bridging channels en rode pulpa proliferatie ° foci van plasmablasten in de
lymfeknoop produceren grote hoeveelheden van antigen-specifiek IgM antistoffen
binnen 3 tot 4 dagen na antigenenstimulatie.
11
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
8. Bespreek antistof-gemedieerde effectorfuncties
Extracelullaire pathogenen
Antistoffen geproduceerd en gesecreteerd door geactiveerde B cellen beschermen de
gastheer tegen pathogenen op 4 verschillende manieren:
1) Neutralisatie: antistof bindt pathogeen/toxine en voorkomt zo invasie van de
gastheercel. Antistof-pathogeen complexen worden verwijderd
2) Opsonisatie: Antistof bindt pathogeen en vervolgens Pc receptoren op facocytaire
cellen. Binding van Fc receptoren veroorzaakt internalisatie en destrucite van
antigen-antistof complex
3) Complement fixatie: Antigen-antistof complex bindt aan complement factoren in
bloed en wordt vervolgens:
a. Gefagocyteerd door cellen die C3 receptoren exprimeren
b. Gelyseerd door pore-vorming door MAC complex
4) ADCC: Antigen-antistof complex wordt gebonden door Fc receptoren op NK cellen en
granulocyten. Op deze manier wordt cytotoxiciteit van deze cellen gericht naar het
antigen-exprimerende organisme (resulterend in apoptose)
12
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
9. Bespreek cel-gemedieerde effectorfuncties
Intracellulaire pathogenen ( tumoren )
3 subsets van cytotoxische effector cellen
- mechanisme van doding verschilt licht tussen de verschillende effector cellen maar
inductie van apoptose is gemeenschappelijk
- gericht tegen geïnfecteerde cellen en tumor cellen
1) CTL (CD8+): Release van granules met cytotoxische enzymes + Fas-FasL interacties
adaptief
2) NKT cel: Fasl interacties via activatie van NK cellen
tussen innatie en adaptief
3) NK cel: Release van granules met cytotoxische enzymes + Fas-FasL interacties
innate
13
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
10. Bespreek de effectormechanismen van NK en NKT cellen
NK cellen:
NK cellen herkennen en doden geïnfecteerde/getransformeerde cellen door de afwezigheid
van MHC klasse 1
5-10% van circulerende lymfocyten
Geen ag-specifieke receptor
Secteteren cytokines en beïnvloeden adaptieve en innate immuunrespons
Herkennen en doden geïnfecteerde/getransformeerde cellen
Proliferen sneller dan CTLs gedurende een infectie
Eerste lijns-defensie
Lymfoïde cellen die ontstaan in beenmerg vanuit CLPs ( geen thymus nodig )
Ondergaan receptor gen-herschikking
Expressie van CD56
Inhiberende (MHC1) receptoren en activerende receptoren
Missing self
NK cellen moeten gelicensed worden vooraleer ze kunnen doden: interactieve NK cel
met normaal MHC klasse 1 via inhiberende NK cel receptor
Mogelijks NK cel geheugen
NKT cellen
Brug tussen het innate en adaptieve immuunsysteem
Geen NK cellen – geen T cellen
Hebben een TCR maar invariant
Productie van cytokines ( helper functie ) of directe celdoding (T cel functie )
NKT cellen doden hun targetcellen voornamelijk via Fas-FasL interactie
Zowel CD4+ als CD4- NKT cellen
Geen geheugen cellen
NKT cellen brengen typische markers van T lymfocyten niet tot expressie.
Daarentegen hebben zij verschillende karakteristieken van NK-cellen
14
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
11. Bespreek en vergelijk de overgevoeligheidsreacties
Reactie
Type 1
Allergie en
atopie
Type 2
Antilichaamgemedieerde
hypersensitiveit
IgG of IgM
Immuun
mediator
Mechanisme
IgE
Ag induceert
cross-linking van
IgE gebonden
aan mastcellen
en basofielen
met release van
vasoactieve
mediatoren
Ab die gericht
zijn tegen
celoppervlak
antigenen,
medieert cel
vernietiging via
complement
activatie of via
ADCC
Typische
symptomen
Systemische
anafylaxis en
gelokaliseerde
anafylaxis
(hooikoorts,
astma,
voedselallergie,
eczema…)
Bloed transfusie
reacties,
erythroblastosis
fetalis, autoimmune
hemolytische
anemie
Type 3
Immuuncomplex
gemedieerde
hypersensitiviteit
Immuun
complexen
Ag-Ab complexen
slaan neer in
weefsels en
induceren
complement
activatie en zo een
ontstekingsreactie
gemedieerd door
massieve infiltratie
van neutrofielen
Gelokaliseerde
arthus reactie en
gegeneraliseerde
reacties (serum
ziekte,
necrotiserende
vasculitis,
glomerulonephritis,
reumatoïde artritis,
systemische
lupus…
Type 4
DHT (Delayed
type
hypersensitiviteit)
T cellen
T cellen (TH1,
TH2…) laten
cytokines vrij die
macrofagen of TC
cellen activeren
die directe
cellulaire schade
toerichten
Contact
dermatitis,
tuberculaire
laesies,
transplantatie
afstoting
15
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
12. Bespreek de type 1 overgevoeligheidsreactie (etiologie, verloop,
verschillende presentaties, behandeling)
Etiologie
-
-
Allergieën ontstaan door de interactie van een IgE antistof met een multivalent
antigen
Normale serumconcentratie van IgE is heel laag
!! indien verhoogd: meer risico op allergie
50% van de bevolking heeft allergie, aantal stijgt nog
Vele allergenen kunnen type 1 uitlokken
Gezonde individuen maken IgE aan in respons op parasitaire infecties
Atopische personen produceren IgE tegen veel voorkomende antigenen (allergenen)
o Meestal eiwitten of glycoproteïnen
o Meestal meerdere epitopen per eiwit
Moleculen die aanleiding geven tot IgE productie: gemeenschappelijke kenmerken
o Vaak intrinsieke enzymatische activiteit: proteasen
Afbraak van celmembraan (epitheliale celjuncties, bij kakkerlakken en
stofmijt) of activatie C’
Binden protease receptoren en activeren immuun systeem
o Bevatten (mogelijks) PAMPs (= pathogen-associated molecular patterns) die
het innate immuunsysteem activeren
o Dringen binnen in mucosale weefsels aan zeer lage concentraties en
veroorzaken TH2 respons (B cel activatie en IgE-productie)
Verloop
IgE antistoffen
-
Zijn op zich niet schadelijk
Zeer kort halfleven in serum, stuk langer bij binding aan receptor
Veroorzaken cross-linking van Fc receptoren aanwezig op het oppervlak van innate
immuuncellen (mestcellen, basofielen, eosinofielen)
Leidt tot
o Degranulatie en vrijzetting van
Histamine
Heparine
Proteasen
o Synthese van
Leukotriënen
16
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
-
Prostaglandines
Chemokines
Mediatoren hebben effect op de omgevende weefsels en cellen allergische
symptomen en weefselschade
Binding:
o Cross-linking van receptorne
o Aggregatie en migratie in lipid rafts
o Fosforylatie en ITAM motieven
Er zijn 2 types IgE receptoren
- Hoge-affiniteits IgE receptor: FcRI
o Verantwoordelijk voor de meeste allergische symptomen
o Aanwezig op basofielen en mastcellen (in mindere mate ook op eosinofielen,
Langerhans cellen en monocyten)
- Lage-affiniteits IgE receptor: FcRII (CD23)
o Verantwoordelijk voor IgE productie door B cellen
o Aanwezig op B cellen (+ inductie op andere cellen oiv IL-4)
o Ook in oplosbare vorm
o Bindt IgE en CD21
IgE receptor signalisatie is strikt geregeld
- Co-clustering met inhibitorische receptoren
o Mast cellen exprimeren FcRI (activerend) als FcRIIB (inhiberend) Ig
receptoren
17
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
-
o Als cel zowel IgE als IgG bindt: inhiberend signaal van IgG heeft overhand
o Inductie van IgG in atopische personen: desensitisatie therapie (behandeling)
Inhibitie van downstream signaal moleculen
o Lyn kan ook ITIMs en FcRIIB fosforyleren inhiberende signalen
o Signalen via FcRI activeren E3 ubiquitine c-Cbl
degradatie van Lyn, Syk en FcRI door proteasoom
Mediatoren geproduceerd door innate immuuncellen
-
-
-
Algemeen
o Beïnvloeden weefsel en andere cellen (eosinofielen, neutrofielen, T
lymfocyten, monocyten en thrombocyten)
o Leidt tot vasodilatatie en verhoogde vasculaire permeabiliteit
Normale respons bij parasitaire infectie: immuuncellen kunnen
pathogeen bereiken
Respons bij allergie: onnodige weefselschade en immuunactivatie
Primaire mediatoren
o Aanwezig bij activatie, directe release (degranulatie)
o Vb. Histamine, heparine, serotonine…
Secundaire mediatoren
o Synthese bij activatie: expressie van inflammatoire cytokines en omzetting
van arachidonzuur (in leukotriënen en prostaglandines)
o Komt heel snel na activatie
o Vb. Prostaglandines, leukotriënen, bradykinine…
Histamine
- Product van decarboxylatie van histidine
- 10% van gewicht granule
- 4 histamine receptoren (H1-4)
o Verschillende weefseldistributie verschillende effecten van histamine
o H1
Contractie van intestinale en bronchiale gladde spieren ( astma)
Toegenomen permeabiliteit van venulen (gezwollen ogen, verstopte
neus)
Toegenomen mucosale secreties ( tranende ogen, lopende neus)
Medicatie hierop gebaseerd: H2 reageert niet overal op
o H2
Toegenomen vasopermeabiliteit en vasodilatatie
Stimulatie exocriene klieren
Verhoogde maagzuursecretie
18
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Onderdrukt verdere degranulatie van mestcellen en basofielen (=
negatieve feedback)
Leukotriënen en prostaglandines
- Secundaire mediatoren (synthese na activatie van mestcellen, release na 30-60 sec)
- Zeer effectief
o 1000x krachtigere bronchoconstrictie dan histamine
o Zeer potente stimulatie van vasculaire permeabiliteit en mucus secretie
o Belangrijkste mediatoren van astma symptomen (verlengde bronchospasmen
en mucussecretie)
Cytokines en chemokines
- Vrijzetting door mast cellen en basofielen (zetten meerdere cyto-/chemokines vrij)
- Reactie
o Veranderingen in locale milieu
o Recrutering van inflammatoire cellen (neutrofielen en eosinofielen)
- IL-4 en IL-13: stimulatie TH2 respons toegenomen IgE productie door B cellen
- IL-5: rekrutering en activatie eosinofielen
- TNF-: bijdragen tot symptomen van shock bij anafylaxie
- IL-8: rekrutering immuuncellen
- GM-CSF: stimulatie van productie en activatie van myeloïde cellen (oa. granulocyten)
Type 1 respons bestaat uit 2 (of 3) fases (vroeg + meerdere late fases)
-
-
Vroege fase
o Enkele minuten na expositie aan allergeen
o Degranulatie van mediatoren vanuit geactiveerde mestcellen
o Gelocaliseerde inflammatie initiatie late fase
Late fase
o Uren na allergeen expositie
o Na rekrutering van bijkomende immuuncellen
Mastcellen: vrijzetting cytokines
expressie van celadhesie moleculen aan oppervlak van veulaire
endotheleale cellen
influx van eosinofielen, neutrofielen en TH2 cellen
Eosinofielen
Rekrutering via mastcellen door vrijzetting eosinofiele
chemotactische factor (ECF)
Release cytokines inflammatoire reactie en weefselschade
Neutrofielen
Rekrutering via mastcellen door vrijzetting
neutrofielchemotactic factor
19
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
-
o Gemedieerd door neutrofielen en andere immuuncellen
Derde fase
o Start 3 dagen na allergeen expositie, maximaal effect op dag 4
o Massieve infiltratie vna eosinofielen en aanwezigheid van basofielen
o Secretie van bijkomende cytokines en proteasen die leiden tot rekrutering
van eosinofielen en neutrofielen bijkomende weefselschade
Verschillende presentaties
Variatie in ernst, afhankelijk van
- Wijze van contact tussen allergeen en lichaam
- Concentratie
- Eventuele vroegere expositie
Systemische overgevoeligheidsreactie
-
Anafylaxis
o Zeer snel na expositie aan Ag (via bloedbaan of absorptie via huid/GI)
o Geïnjecteerd allergeen (beet, medicatie) of voeding
o Bij wesp, penicilline, zeevruchten, noten
o Levensbedreigend
Snelle antistof-gemedieerde degranulatie
Systemisch effect van mediatoren
20
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
o Symptomen
Dyspnee, moeilijke en versnelde ademhaling
Bloeddrukval (anafylactische shock)
Contractie gladde spieren stoelgangs-/urineverlies,
bronchoconstrictie
Dood door verstikking
o Behandeling: adrenaline IM
Gelokaliseerde overgevoeligheidsreacties
-
-
-
-
Reactie is beperkt tot een bepaald weefsel of orgaan (vaak na contact met epitheliale
oppervlakken)
o Allergische rhinoconjunctivitis (hooikoorts)
o Astma
o Atopische dermatitis / eczeem
Symptomen: gevolg van lokale vrijstelling van mediatoren ter hoogte van plaats van
expositie aan allergeen
Allergische rhinitis
o = hooikoorts
o Symptomen na inhallatie van pollen, stof, virale antigenen
o Binding aan mastcellen in conjunctiva en nasale mucosa histamine en
heparine
o Vasodilatatie, verhoogde capillaire permeabiliteit, toegenomen secreties thv
ogen en bovenste respiratoire tractus tranende ogen, loopneus, hoesten
Allergische astma
o Lagere respiratoire tractus (mucosa)
o Symptomen na inhallatie pollen, stof, virale antigenen (of niet-allergisch:
inspanning, koude)
o Contractie bronchiale gladde spiercellen, mucus secretie en lokale zwelling
weefsel bronchiale constrictie en luchtwegobstructie
o Genetische factor
Atopische dermatitis
o Vooral jonge kinderen met gestegen IgE
o Inflammatoire aandoening van huid: rode huidletsels die kunnen
surinfecteren
o TH2 cellen en eosinofielen in de huidletsels
Voedselallergie
-
Frequentie stijgt (vooral bij baby’s en kleuters)
Allergie
o Bij kinderen: koemelk, ei, soja, vis, schelpdieren
21
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
-
-
o Bij volwassenen: noten, vis, schaaldieren
Allergenen: meestal water-oplosbare glycoproteïnen weerstandig aan warmte, zuur
en
proteasen geen afbraak in maag
Cross-linking van IgE receptoren in GI stelsel
Symptomen tgv contractie van gastro-intestinale gladde spieren en vasodilatatie
braken en diarree
Mastceldegranulatie in darm:
o Verhoogde doorlaatbaarheid van mucosa in darm allergenen in
bloedstroom
o Aanleiding tot sensitisatie
o Verklaring waarom vooral kinderen: meer doorlaatbare mucosa bij ouder
worden: allergie verdwijnt vaak
Behandeling
Diagnose
- Anamnese
- Klinisch onderzoek
- Huidtest
o Veilig en goedkoop
o Intradermale injectie / oppervlakkig aanbrengen van kleine hoeveelheid van
allergeen (rug of onderarm)
o Resultaat aflezen: zwelling en roodheid door mastcel degranulatie
o Ook positieve controle (met histamine: altijd reactie) en negatieve controle
(met water: normaal geen controle)
- Bloedtest voor totaal of allergeen-specifiek IgE in serum (ELISA of Western blot)
Behandeling
- Algemeen
o Vermijden contact
o Symptomatische behandeling
- Desensitisatie
o Herhaaldelijke toediening van lage, oplopende concentraties van het
allergeen: tolerantie induceren (verminderen of verdwijnen van klachten)
o Mechanisme?
Inductie van regulatoire T cellen
Productie van niet-inflammatoire IgG4 antistoffen in competitie
met IgE voor binding van FC receptoren
22
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Afname van allergeenspecifieke TH2 cellen en vermindering
eosinofielen, mastcellen, basofielen, neutrofielen (thv target orgaan)
o Lukt niet bij iedereen
-
Medicatie
o Antihistaminica
Phenergan, zyrtec, aerius, xyzall
Binding en blokkeren van H1 receptoren op immuuncellen
Eerste generatie: gepaard met slaperigheid (over bloed-hersenbarrière
naar CZS)
Tweede generatie: minder neveneffecten
o Leukotrieënen antagonisten
Montelukast
Blokkeren secundaire mediatoren
Even effectief als antihistaminica
o Inhalatie steroïden
Brede immuun-inhiberende effecten
Behandeling van astma
-
Andere
o Anti-IgE antistoffen
Voorkomen de binding van IgE aan FcR moleculen en activatie van
immuuncellen
Zeer duur, effectiviteit vergelijkbaar met 2e generatie anti-histaminica
23
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
13. Bespreek de type 2 overgevoeligheidsreactie
Algemeen
-
Antistof gemedieerde destructie van cellen (niet IgE!)
Inductie celdood
o Activatie van complement systeem vorming membraanattackcomplex
o Celdestructie door ADCC (antistof-dependente cel-gemedieerde
cytotoxiciteit): cytotoxische T cellen binden via FC receptor aan FC-regio van
antistof op targetcel
o Antistoffen fungeren als opsonine lysis door fagocytaire cellen
Transfusiereactie
-
-
-
Volledige uitleg over ABO bloedgroepen normaal al gekend: p75 in cursus
o Glycoproteïnen op RBC: verschillende allelische vormen, andere herkennen
als vreemd
o Antigen A, B, H (leidt tot bloedgroep A, B, O)
o Antigen H op andere cellen ook aanwezig
o Bloedgroep antigen: suikers
o Antistoffen: isohemaglutinines
o Volwassenen bezitten IgM-antistoffen gericht tegen bloedgroepen die ze niet
hebben (gelijkaardig aan suikergroepen in darm, geëxprimeerd door microorganismen)
o B cellen met antistoffen tegen eigen ABH negatieve selectie
Foutieve bloedtransfusie: antistoffen vallen de donor aan (complement activatie)
Symptomen: massieve intravasculaire hemolyse (door antistoffen en complement)
o Vroegtijdige reactie: meestal door ABO-incompatibiliteit
Hemoglobunurie
Afbraak door bilirubine (koorts, rillen, misselijkheid, thrombose, lage
rugpijn, hemoglobine in urine)
Vrijkomen van afbraakproducten nierblokkade
o Laattijdige reactie: bij Rhesusfactor (vooral D is belangrijk): IgG-antistoffen
2-6 dagen na transfusie
IgG minder effectief minder erge lysis: geen detecteerbaar vrij Hb
Extravasculaire vernietiging door agglutinatie, opsonisatie en
fagocytose
Symptomen: koorts, gestegen bilirubine, beperkte geelzucht, anemie
Behandeling
o Transfusie stop
o IV vocht
o Indien nodig dialyse
24
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Hemolytische ziekte van de pasgeborene
- Gevolg van maternele IgG antistoffen (kunnen placenta overbruggen) specifiek voor
Rh D die aanwezig zijn op foetale RBC (rhesus incompatibiliteit moeder-kind: mild
verloop)
o Eerste zwangerschap: niet voldoende expositie
o Bevalling: B-cell gemedieerde respons Rh-specifieke plasmacellen en
geheugen B cellen (sensitisatie)
o Tweede zwangerschap: activatie IgG secreterende geheugencellen
- Destructie van foetale RBC en activatie van complement systeem
- Toxische afbraakproducten (Hb: bilirubine) neurologische schade want kruist BHB
- Meestal milde presentatie (geezucht) maar kan fataal zijn
o Ernstige vorm: erythroblastosis foetalis (verschillend rhesus antigen)
- Behandeling
o Ernstige gevallen: intra-uteriene wisseltransfusie (elke 2-3 weken)
o Meestal relatief mild (door ABO incompatibiliteit): licht verhoogd bilirubine
met geelzucht UV bevordert afbraak van toxische afbraakproducten
- Preventie: Rhogam (antistoffen gericht tegen rhesus factoren: niet zichtbaar voor
moeder)
o Toediening: na 28 weken zwangerschap OF 24-48 na eerste bevalling (+
amniocentese)
Hemolytische anemie kan veroorzaakt worden door medicatie
- Medicatie kan zich vasthechten aan oppervlak RBC
vorming van antistoffen tegen eiwit/medicatie complexen
antistoffen binden RBC bij inname medicatie: afbraak RBC
25
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
14. Bespreek de type 3 overgevoeligheidsreactie
Overgevoeligheidsreactie: gevolg van immuuncomplexen (IC)
- Normaal: vorming van IC met snelle afbraak
o Antigen-antistof immuuncomplex herkend door Fc-receptoren + verwijdering
o Lysis door complement
- Als IC niet verwijderd worden (continue aanmaak, geen afbraak)
immuuncomplexen: depositie van IC in weefsels of bloedvaten
gelokaliseerde inflammatoire respons: productie van anafylatoxines (C3a, C5a…)
complement activatie en rekrutering van neutrofielen en mastcellen
weefseldestructie
- Grootte van reactie afhankelijk van
o Grootte IC
o Distributie in lichaam
o Efficiëntie van fagocytair systeem
- Oorzaak
o Antigenen die grote complexen kunnen vormen (Ag die vorming stimuleren)
o Hoge affiniteit van antigen voor weefsel (nier, gewricht)
o Zeer positief of negatief geladen antigenen
o Deficiënt fagocytair systeem
- IC geven aanleiding tot release van inflammatoire mediatoren en vaso-actieve
mediatoren
o Proteasen: weefseldestructie
o Bloedklonters door IC-gemedieerde activatie van bloedplaatjes
- Symptomen
o Koorts, huiduitslag (urticiaria), lymfeklierzwelling
o Vasculitis: neerslag IC in bloedvatwand
o Glomerulonefritis (eiwit en RBC in urine): neerslag IC in nier
o Artritis: neerslag IC in gewrichten
IC binden via Fc receptoren aan mestcellen, basofielen, macrofagen
- Vrijstelling inflammatoire mediatoren
- Gestegen vaatpermeabiliteit
- IC depositie in weefsels
- C’ activatie en aantrekken van meer inflammatoire cellen
- Weefselschade
26
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Uitkomst is afhankelijk van oorzakelijk antigen
- Antigen verwijderen IC verdwijnen symptomen verdwijnen
o Poststreptokokken GN: thv glomerulaire basale membraan
o Monoclonale antistoffen van niet-humane origine (reactie tegen antistofdeel
muis)
- Antigen kan niet verwijderd worde, (vb. Auto-antigen) blijvende IC vorming,
weefselschade en symptomen (chronisch: gewrichtspijn, nierschade, huidletsel)
o SLE (systematische lupus erythematodes)
27
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
15. Bespreek de type 4 overgevoeligheidsreactie
Type 4 is volledig celgemedieerd
-
Initiatie door T cellen
Delay vooraleer de reactie ontwikkelt (1-2 weken)
Gekenmerkt door infiltratie van macrofagen thv plaats ontsteking na enkele dagen
Vb. poison ivy contact dermatitis, TBC
2 fases
-
-
Sensitisatie fase (eerste expositie)
o Bacterie wordt opgenomen transport naar regionale lymfeklierenen
gepresenteerd door APC (macrofagen, Langerhans cellen)
o Ontwikkeling + activatie DTH-gemedieerde cellen: CD4+ TH1 (soms TH17,
TH2, CD8+)
Effector fase (tweede expositie)
o Reactie na 24u, piek na 2-3 dagen: cytokines hebben tijd nodig voor influx en
activatie van macrofagen (grootste effect, nochtans maar 5% van alle cellen)
o TH1 secretie
Cytokines: IFN-, TNF-, IL-2…
Chemokines: IL-8/CXCL8…
o Activatie macrofagen en inflammatoire cellen
Meer klasse II MHC moleculen
Meer TNF receptoren
Meer zuurstof radicalen
Meer NO
o Vorming van meerkernige giant cel (uit meerdere macrofagen)
Diagnose van delayed-type hypersensitivity door een huidtest
-
Kleine hoeveelheid antigen intradermaal ingespoten (vb. detectie van TBC)
Evaluatie roodheid en induratie na 48-72 uur
Positief: individu heeft gesensitizeerde TH1 cellen specifiek voor het antigen
(betekent NIET dat er een actieve infectie is, kan ook door vaccinatie)
28
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Contactdermatitis (meest frequent)
-
Sensitisatie = chemisch bestanddeel bindt huideiwitten
Gemodifieerde eiwitten worden gepresenteerd aan T cellen
Geïnduceerd door medicatie, cosmetica, metalen, chemicaliën, actieve allergenen…
Kan aanleiding geven tot sterke cel-gemedieerde reacties thv huid: huidrash, blaren…
Behandeling
o Voormijden van causale antigen
o Topische of systemische steroïden
29
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
16. Bespreek centrale en perifere tolerantie
Tolerantie = geheel van mechanismen die voorkomen dat het immuunsysteem een
reactie ontwikkelt ten opzichte van zelf-antigenen. De indeling verwijst naar de locatie
van de tolerantiemechanismen.
Centrale tolerantie
Deletie van T of B cellen die reactiviteit vertonen tov. zelf-antigenen met een hoge
affiniteit. Dit vindt plaats in de primaire lymfoïde organen (beenmerg en thymus). Dit
is echter niet perfect, vandaar bestaat er een perifeer mechanisme om deze zelfreactieve lymfocyten onder controle te houden. Reden van falen : niet alle zelf-Ag
worden geëxprimeerd in centrale lymfoïde organen en deletie wordt bepaald door
affiniteit waarbij lymfocyten met lage affiniteit het proces kunnen ontglippen.
Belangrijkste mechanisme is deletie van lymfocyten die reactiviteit vertonen tov. zelfcomponenten in vroege stadia van ontwikkeling. Door de genherschikking bij TCR en
BCR ontstaan er multiple variabele regio’s met potentiële reactiviteit tov. zelfantigenen.
- T-celontwikkeling negatieve selectie in thumus
- B-celontwikkeling receptorediting (Ag-specifieke V-regio’s swichen met andere
V-regio via V(D)J-recombinatie), klonale deletie en apoptose van zelf-reactieve B
cellen
Perifere tolerantie
3 mechanisme voor perifere tolerantie:
1. een lymfocyt heeft nood aan 2 signalen voor omvorming tot actieve T-lymfocyt :
i. herkenning van zijn respectievelijke Ag. (context MHC- moleculen + TCR)
ii. co-stimulatoire signaal :
positief : CD28 (T-cel oppervlak) + CD80/86 (APC-oppervlak)
negatief : CTLA-4 (geactiveerde T-cel oppervlak) + CD80/86
(APC_oppervlak) negatieve feedbackloop om immuunsysteem
onder controle te houden
2. B cellen hebben nood aan herkennen van overeenkomstige Ag (via BCR) en
tergelijkertijd nood aan hulp van T-cel.
3. Suppressie van immuunreactie door regulatoire immuuncellen (Tregs). Deze
zorgen voor een downregulatie van de immuunrespons bij herkennen van Ag in
periferie.
30
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
i.
ii.
Natuurlijk voorkomende :
Gevormd in thymus
T-cellen met zeer hoge affiniteit voor zelf-Ag maar worden
omgevormd tot Tregs en ondergaan geen negatieve selectie
Hoge expressie IL-2R alfa keten (CD25)
Expressie transcriptiefactor FoxP3
auto-immuniteit voorkomen in periferie
Geinduceerde Tregs :
Door inductie van FoxP” in naïeve Tcellen in periferie ontstaan
regulatoire functie
Controle van reacties tov. goedaardige vreemde Ag thv. mucosale
oppervlakten
31
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
17. bespreek auto-immuunziekten
Deze ziekten zijn het gevolg van het falen van de tolerantiemechanismen, waardoor een
immuunrespons ontwikkelt tov. lichaamseigen cellen, weefsels en/of organen en kunnen
gemedieerd worden door auto-antistoffen en/of zelf-reactieve T cellen.
-
-
Orgaan-specifieke auto-immuunziekten
Door lymfocyten of antistoffen tov. zelf-componenten
weefselbeschadiging en/of een inflammatoire respons
Lange duur vorming littekenweefsel en functieverlies orgaan
Immuunrespons gemedieerd tov. een target-Ag dat uniek is voor het
orgaan of de endocrinologische klier
o Rechtstreekse beschadiging
o Wijziging functie (overstimulatie of blokkade)
Vbn. Hasimoto thyroïditis, type 1 diabetes mellitus, myasthenia gravis
Systemische auto-immuunziekten
Immuunrespons tov. een brede rangen zelf-Ag
Treft verschillende weefsels en organen
Gevolg van veralgemeend deffect in immuunregulatie overactivatie
van T/B cellen
Vbn. Systemische lupus erythematosis (SLE), Multiple sclerose (MS),
Reumatoïde arthritis (RA)
Een andere mogelijke indeling is op basis van de oorzakelijke onderliggende
immuunreactie : T-cel of antistoffen-gemedieerd.
Wat extra info over auto-immuunziekten (geen idee of dit ook echt bij de vraag vereist is
als antwoord…) :
Deze ziekten kunnen ontstaan door de invloed van bepaalde factoren zoals
omgevingsfactoren en genetishe factoren (zowel intrinsieke als extrinsieke factoren). (zie
punt 7.2.5 voor extra info hierover)
Behandelingen zijn specifiek of niet-specifiek.
-
niet-specifiek :
o steroïden, azathioprine, cyclofosfamide
o sterk anti-inflammatoir, onderdrukken lymfocyten
o neveneffecten ! (cytotoxiciteit, infectie-vatbaarheid, kanker-risico
32
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
-
-
-
specifiek :
(ziekten veroorzaakt door auto-antistoffen of immuuncomplexen)
o monoclonale antistoffen tegen B-cellen (CD20)
o monoclonale antistoffen tegen T-cellen (CD3, CD4,…)
anti-inflammatoire therapieën : gericht op inflammatoire reacties of tegen
chemokines en adhesiemoleculen
gericht op co-stimulatie : interferentie met co-stimulatie zodat T-cellen apoptose
ondergaan of anerg worden mbv. een fusieproteïne (extracellulair domein van
CTLA-4 + humane IgG1 Fc-regio)
Ag-specifieke immunotherapie = ultieme doel, herinductie van tolerantie tov. autoantigen
33
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
18. Bespreek de afstotingsreactie van getransplanteerde organen
Er zijn verschillende types van transplantatie (autogreffe, isogreffe, allogreffe en
xenogreffe) en in de cursus wordt allogreffe besproken.
De snelheid van zo’n reactie hangt af van het weefsel dat getransplanteerd is (huid sneller
dan hart of nier), maar de onderliggende immunologische mechanismen zijn gelijkaardig:
- dag 3 – 7 : Verhoogde vascularisatie + ontwikkeling inflammatoir filtraat
- dag 7 – 10 : Vascularisatie neemt af
- dag 10 – 14 : Necrose en volledige rejectie
Belangrijk :
- immunologisch geheugen is specifiek
- T – cellen zijn de belangrijkste effectorcellen (CD4 en CD8), ook dendritische cellen
zijn van belang (inductie van tolerantie of rejectie)
- Weefsels die gelijkaardig zijn qua MHC zijn histocompatibel en zijn dus ideaal voor
transplantatie
allereerst ABO-compatibiliteit achterhalen, dan MHC-comptabiliteit
mineure histocompatibiliteitsantigenen : andere Ag naast MHC-complex
betrokken bij optreden van rejectie
Verschillende fasen :
Algemeen :
humorale en cel-gemedieerde immuunresponsen en antistofgemedieerde immuunreacties + delayed type hypersensitivity + cel-gemedieerde
cytotoxiciteit = weefseldestructie
1.
SENSITISATIE FASE = proliferatie van alloantigen-specifieke lymfocyten na
herkenning alloantigenen in de greffe
CD4 en CD8 T cellen herkennen alloantigen op de cellen van het
getransplanteerde
orgaan.
De
respons
tov.
mineure
histocompatibiliteitsantigenen is zwak, die tov. majeure is sterk ken opgedeeld in
directe en indirecte presentatie.
34
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Directe presentatie bestaat uit receptor T cellen die donor MHC herkennen en
geactiveerd worden waardoor rejectie veroorzaakt wordt. De donor MHC bevindt
zich in de drainerende lymfeknopen nadat donor dendritische cellen ernaartoe
gemigreerd zijn na transplantatie.
Indirecte presentatie is de herkenning van allopeptiden in combinatie van zelfMHC moleculen wat zorgt voor activatie van receptor T lymfocyten. Dit gebeurt
in het getransplanteerde orgaan; antigenpresenterende cellen zijn hiernaartoe
gemigreerd en nemen donor antigenen op dmv. endocytose. Hierbij worden
antigenpresenterende geactiveerd en presenteren zij alloantigen tesamen met
zelf-MHC moleculen.
2.
EFFECTOR FASE = destructie getransplanteerde orgaan
O.a. door celgemedieerde rejecties, antistof-gemedieerde complementactivatie
en antistof-dependente cel cytotoxiciteit. Dit allemaal zorgt voor een massieve
influx van immuuncellen (CD4 T cellen, antigenpresenterende cellen en
macrofagen) in het getransplanteerde orgaan.
Cytokines (IL-2 en interferon gamma zijn de belangrijkste) zorgen voor T cel
proliferatie, delayed type hyperinsensitivity respons, productie van IgG
antistoffen door B cellen en verhoogde expressie van MHC 1 en 2 moleculen.
Er zijn ook verschillende vormen afhankelijk van de snelheid : hyperacuut (voorgevormde
antistoffen), acuut (T cellen) en chronisch. (zie cursus p. 98 – 99).
35
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
19. Bespreek primaire immunodeficiëntiesyndromen
Deze zijn een gevolg van een genetisch defect of een ontwikkelingsdefect van het
immuunsysteem. De meeste van deze aandoeningen zijn monogenetisch en zeer
zeldzaam. Door de complexe interacties in het immuunsysteem, kan een defect in het
adaptief imuunsysteem leiden tot symptomen in het innate immuunsysteem en
verschillende genetische defecten kunnen leiden tot eenzelfde ziektefenotype.
De gevolgen van de genetische afwijking hangen af van de plaats die het
overeenkomstige genproduct inneemt in het immuunsysteem. Bij reticulaire
dysgenese is er een defect in de vroege hematopoëtische celontwikkeling waardoor
alle afgeleide cellen aangetast zullen zijn. Bij selectieve immunoglobulinedeficiënties
zijn er meer specifieke gevolgend doordat de defecten gelocaliseerd zijn in
gedifferentieërde cellen van het immuunsysteem. Bv. deficiëntie in adenosine
deaminase treft zowel B als T cellen. Bij de T cellen kan dit leiden tot afwijkingen in
antistofproductie, dysregulatie van cytokine-expressie en een verstoorde cellulaire
cytotoxiciteit.
Deze immunodeficiëntiesyndromen kunnen leiden tot auto-immuniteit, recurrente
bacteriële infecties, verhoogde vatbaarheid voor bactieriële en schimmelinfecties.
Zie kleine vragen hoofdstuk 8 voor extra uitleg over voorbeelden van primaire
immunodeficiëntiesyndromen.
36
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
20. Bespreek secundaire immunodeficiëntiesyndromen
Dit zijn verworven immunodeficiëntiesyndromen (bv AIDS als gevolg van HIV-infectie)
en kunnen ontstaan door verschillende factoren zoals medicaties metabole ziekten en
malnutritie. De meeste symptomen zijn verhoogde vatbaarheid voor bepaalde
infectieuze pahtogenen alsook opportunistische infecties. Symptomen variëren van
bijna geen klinische symptomen tot een veralgemeende immunosuppressie.
Een voorbeeld is verworven hypogammaglobulinemie waarbij patiënten een zeer lage
maar nog detecteerbare serumspiegels van immunoglobulines hebben met een
normaal T cel aantal en functie. Belangrijk: kinderen van moeders met deze ziekte
vertonen geen immunoglobulines. Bij normale moeders worden de maternele
immunoglobulines normaal placentair overgedragen.
Voorbeelden van medicatie :
- steroïden
- cytotoxische medicatie of bestraling
tijdelijke immuundeficiëntie, verwijderen van agens (medicatie) is de
oplossing
Ook leeftijd speelt een rol :
- zeer jong : er is tijd nodig voor volledige maturatie van het innate en het
adaptief immuunsysteem (ookal zijn alle componenten bij geboorte reeds
aanwezig)
rijping immuunsysteem bij blootstelling aan verschillende infecties
Voorbeelden van ondervoeding :
- eiwit/calorie arme diëten verminderd T cel aantal en functie
- tekort aan micronutriëten (zink, vitamine C,…) systemische
immunodeficiëntie + verhoogde susceptibiliteit voor opportunistische
infecties.
Impact is groter bij combinatie met chronische infectie zoals HIV,
tuberculose of cholera.
Zie kleine vragen hoofdstuk 8 (laatste vraag) voor extra uitleg over voorbeelden van
secundaire immunodeficiëntiesyndromen.
37
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
21. Bespreek de verdedigingsmechanismen ten opzichte van infecties
(virussen, bacteriën, parasieten en schimmels)
Lichaam heeft fysische en chemische barrières die voorkomen dat pathogenen het
lichaam binnendringen
De belangrijkste barrières: de epitheliale cellen ter hoogte van de huid en de darm en
chemische factoren
de maag secreteert maagenzymes
cellen in het maag-darmstelsel produceren antibacteriële eiwitten
normale bacteriële darmflora vormt een competitieve inhibitie voor de binding
van pathogenen
Indien deze barrières worden doorbroken innate immuunsysteem
Activatie van innate wordt bepaald door type pathogeen
Sommige bacteriën produceren endotoxines via toll-like receptor 4 een
activatie van macrofagen en endotheliale cellen
Deze geactiveerde cellen produceren cytokines en bevorderen de fagocytose van
bacterien
Gram + bacteriën bevatten peptidoglycanen in celmembraan activeren
alternatieve complement pathway. Dit zorgt voor opsonisatie, fagocytose en lysis
van het pathogeen
Virus infecties vaak gepaard met productie van interferonen. Deze inhiberen de
virale replicatie
Daarnaast worden ze ook onder controle gehouden door NK cells
meestal zorgt de activatie van innate immuunrespons tot een resolutie van
infectie
Activatie innate zorgt voor activatie van een meer specifieke adaptieve
immuunrespons
Adaptieve immuunrespons
Pathogeen specifieke immuunreactie die leidt tot een eradicatie van het
pathogeen
Gepaard met een geheugenrespons
Sommige pathogenen ontsnappen aan het adaptief immuunsysteem
Virusinfecties
Kleine segmenten van nucleinezuren omgeven door eiwit of lipoproteinemantel
38
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Essentieel afhankelijk van gastheercellen voor hun replicatie
Cel binenkomen via celoppervlakreceptor
Maakt gebruik van biosynthese apparaat om zich te repliceren aanleiding tot
mutaties in het virus. Meest resistent virus overleeft
Latentieperdiode: replicatie maar geen symptomen bij gastheer
Niet specifieke immuunresponsen:
Aanwezigheid van epitheliale barrières ter hoogte van respiratoire , genitourinaire en gastro-intestinale tractus
Specifieke immuunresponsen
De immuunrespons ten opzichte van virussen bestaat initieel uit een innate
immuunrespons die wordt geïnitieerd door de herkenning van pathogenassociated molecular patterns (PAMP)
dit geeft aanleiding tot het genereren van antivirale response
Innate: productie interferonen (IFN-α en IFN-β), de assemblage van intracellulaire
inflammasoom-complex en de activatie van natural killer cellen
Type 1 interferonen induceren antivirale respons of resistentie tov virale
replicatie door binding aan interferron α/β receptoren
JAK-STAT pathway + productie van enzyme die viraal RNA degraderen
Binden van type 1 IFN aan NK cellen zal lytische activiteit van de NK cellen
verhogen
Antistoffen voor virale oppervlak antigenen zijn crucial om verder verspreiding vh
virus af te remmen
Antistoffen zijn effectief wanneer ze aanwezig zijn thv de plaats van virale entry.
Antistoffen kunnen de virale penetratie in de gastheercel verhinderen door de
binding van epitopen die noodzakelijk zijn om fusie van de virale enveloppe met
het plasmamembraan te blokkeren
Cel-gemedieerde immuniteit: CD8 Tc cellen en CD4 helper T cellen
Geactiveerde TH1 cellen produceren cytokines (IL-2, IFN-γ en TNF-α)
Deze bieden een bescherming tegen de virusinfectie
Bv. IL-2 zal de vorming van cytotoxische T lymfocyten bevorderen/ IL-2 en IFN-γ
activeren natural killer cellen
Specifieke cytotoxische lymfocytn ontstaan binnen 3à4 dagen na infectie en
pieken rond dag 7à10 contractie Tc lymfocyten
Verschillende virussen hebben een resistentie ontwikkeld tegen IFN-α en IFN-β
Andere hebben mechanismen ontwikkeld om antigenpresentatie door geïnfecteerde
gastheercellen tegen te gaan. Bv. het herpes simplex virus is in staat om het TAP
eiwit te blokkeren zodat de antigenpresentatie in combinatie met MHC klasse I
molecule in HSV-geïnfecteerde cellen verminderd is
Andere secreteren proteinen die complementfactoren binden geen activatie van
complement geen opsonisatie en destructive van virus geïnfecteerde cellen
39
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Andere ontwijken het immuunsysteem door continu hun oppervlakantigenen te
veranderen Bv. HIV en influenza
Antigene shift en antigene drift
Influenza muteert zeer frekwent
nieuwe stammen geven aanleiding tot epidemies
antigene drift
RNA polymerase heeft geen proofreading capaciteit
kleine verschillen in HA of NA
elke jaar nieuwe influenza vaccin
antigene shift
gebeurt wanneer verschillende virus types dezelfde cel infecteren
RNA genome segment uitgewisseld
nieuwe HA/NA combinaties
oorzaak van pandemieën omdat populatie geen bescherming heeft tov de
nieuwe combinatie
Cel-gemedieerde immuniteit is belangrijk voor doding en eliminatie van virus
• antistoffen kunnen niet de geïnfecteerde cellen opruimen
CD4 + T H cellen secreteren antivirale cytokine
IFN-γ induceert een antivirale status van de aangrenzende cellen
IL-2 induceert CTL
CD8 + CTL herkennen en vernietigen virus-geïnfecteerde cellen
Bacteriële infecties
Voornamelijk gemedieerd via antistoffen
Voor intracellulaire bacteriën is delayed type hypersensitivity van belang
Dringen binnen via natuurlijke routes (luchtwegen, gastro-intestinale en genitourinaire tractus) of abnormale routes (defecten in mucosale membranen of huid)
Een infectie zal enkel optreden wanneer aantal organismen dat lichaam binnendringt
groot genoeg is + hun virulentie groot genoeg om verdedigingsmechanismen te
kunnen overwinnen
Bij veel microorganismen met grote virulent zullen antigenspecifieke adaptieve
immuunresponsen in gang gezet worden
Symptomen geassocieerd met bacteriële infecties zijn deels het gevolg van het
immuunsysteem tov deze pathogenen
40
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Herkenning van pathogenen leidt tot productie van cytokinen kan geasscocieerd
zijn met septische shock
Symptomen van voedselvergiftiging
Gram- bacteriën bevatten LPS
Vrijzetting van de LPS geeft aanleiding tot de activatie van macrofagen
secretie grote hoeveelheden van IL-1 en TNF-α zullen secreteren
deze cytokines zijn geassocieerd met de ontwikkeling van septische shock
Stafylococcengemedieerde voedselinfectie en toxic shock syndroom gepaard met de
productie van exotoxines door de stafylococcen bacterie
Exotoxine: superantigen dat T cellen activeert via een welbepaald Vβ domein
systemische productie cytokines door activatie van vele TH cellen
gepaard met toxic shock syndroom
1) Immuun reacties tov extracellulaire bacteriën
Productie antistoffen door plasmacellen
Deze plasmacellen zijn aanwezig in de regionale lymfeknopen en submucosa
van respiratoir en gastro-intestinale tractus
Humorale respons is belangrijkst Antistoffen bieden tegen extracellulaire
bacteriën op verschillenden manieren
Verwijderen van bacterie en inactivatie van bacteriële toxines
Antistoffen die binden op antigenen op het celoppervlak opsonisatie +
fagocytose
Complementactivatie directe lysis van de bacterie
Productie C3a en C5a effectieve inflammatoire respons met
recrutering van lymfocyten en neutrofielen naar het weefsel
2) Immuunreacties tov intracellulaire bacteriën
Cel-gemedieerd immuunresponsen belagnrijker dan antistoffen
CD4+ T cellen pikken intracellulaire bacteriën op en produceren vervolgens
cytokines zoals IFN-γ activatie macrofagen
De 4 belangrijkste stappen in bactiële infectie:
41
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
1)
2)
3)
4)
het vasthechten van een bacterie aan de gastheercel,
proliferatie
invasie van het gastheerweefsel
toxische beschadiging van de gastheercel
Verdedingingsmechanismen proberen in te grijpen thv van deze stappen. Toch hebben
bacterien mechanismen ontwikkeld om deze verdediging te ontglippen.
Exprimeren molecules die het vasthechten van de bacterie aan de cel bevorderen
Exprimeren bijvoorbeeld pilli (lange haarvormige uitstulpingen), dewelke in staat zijn
om zich vast te hechten aan het membraan van de intestinale of genitourinaire
tractus. Gesecreteerde IgA antistoffen die specifiek zijn voor deze bacteriële
structuren kunnen de aanhechting van de bacterie aan de gastheercel tegengaan
Sommige bacteriën echter hebben de mogelijkheid ontwikkeld om proteasen te
secreteren die het gesecreteerde IgA zullen afbreken ter hoogte van de hinge region
Ontsnappen aan de immuunrespons door hun oppervlak antigenen voortdurend te
veranderen
Bv. In Neisseria gonorrhoeae bijvoorbeeld is er een zeer variabele expressie van pilli.
Deze bacterie beschikt over een mechanisme van genherschikkingen om
voortdurend veranderingen aan te brengen ter hoogte van de pilli locus vergroot
de kans dat het geëxprimeerde pilli niet herkend wordt door de geproduceerde
antistoffen
Exprimeren ook oppervlakmoleculen die phagocytose tegen gaan. Bv. Streptococcus
pneumoniae dat een polysacharidekapsel bevat dat phagocytose zeer efficiënt
tegengaat. Stafylococcen gaan phagocytose tegen door het vormen van een
protectieve mantel van gastheer bloedeiwitten. Deze mantel maakt de bacterie
onzichtbaar voor het immuunsysteem en voorkomt phagocytose.
Ontsnappen aan het complementsysteem Zo exprimeren sommige grambacteriën lange zijketens die complement-gemedieerde lisis voorkomen.
Pseudomona baceteriën secreteren een enzyme, elastase, dat aanleiding geeft tot de
inactivatie van C3a en C5a.
Nog andere bacteriën hebben de mogelijkheid verworven om te overleven binnenin
phagocytaire cellen.
Andere bacteriën zoals mycobacteriën, blokkeren de lysosomale fusie met
phagolysosomen of zijn resistent ten opzichte van afbraak door oxydatieve radicalen
en overleven zo binnenin phagocytaire cellen.
42
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Parasitaire Infecties
Veroorzaakt door
Protozoa: unicellulaire eukaryote organismen die leven en vermenigvuldigen zich
in de gastheercel
Wormen: multicellulaire organismen die overleven en zich vermenigvuldigen
buitend de gastheer. Leven in het GI stelsel van de gastheer. Ze
vermeningvuldigen zich niet in de gastheer wat er voor zorgt dat er slechts een
beperkte immuunrespons zich ontwikkelt. Ag expressie op het wormoppervlak
tot minimum beperkt of worm omhult zich met mantel van gastheer eiwitten.
Immuunrespons bestaat uit de productie van IgE antistoffen en recruitment van
eosinofielen inductie van TH1 IFN-gamma macrofaag is meer efficient
Verschillende manieren om ah immuunsysteem te ontsnappen
Belangrijkste infecties: malaria, ziekte van Chagas, Leishmaniasis en toxoplasmose
Belangrijkste worminfectie: schistosomiase
Weinige immuniteit bij kinderen onder de 14j
Intracellulaire fase is resistent tegen antistof respons
Korte bloedfase waarbij vrije parasieten in bloedbaan toegankelijk is voor
immuunsysteem
Antistof respons verder voorkomen door aanwezigheid buitenste laag van parasiet
Toenemend probleem van drug-resistentie
43
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Schimmelinfecties
Veel voorkomend
Infecties van huid, subcutaan of diepe infecties
Diepe mycosen kunnen de longen, centraal zenuwstelsel, de botten en de
abdominale organen aantasten deze treden oop door het binnendringen van de
schimmel via de gastro-intestinale tractus, de respiratoire tractus of via de bloedbaan
Ernstige schimmelinfecties bij personen met onderdrukt immuunsysteem. Vb.
cryptococcus neoformans, aspergillus fumigatus, coccidioides, histoplasma
capsulatum en blastomyces dermatitidis
Schimmelinfecties komen meer voor sinds het gebruik van immuunsuppressieve
medicatie
Innate immuunsysteeem beschermt tegen schimmelinfecties
Aanwezigheid van commensale organismen helpt om de proliferatie van potentiële
pathogenen onder controle te houden
daarom treden schimmelinfecties typisch op na langdurig gebruik van breedspectrum antibiotica
Fagocytose door neutrofielen
Fungi worden herkend doordat ze PAMPs exprimeren op hun celoppervlak. Deze
PAMPs worden herkend door pattern recognition receptoren (PRR). Afwijkingen in
deze PRRs geeft aanleiding tot een verhoogde vatbaarheid voor mycosen.
Herkenning van deze PAMPs geeft aanleiding tot complementactivatie, inductie van
phagocytose en destructie van de fungale cel.
Ontsnappen aan immuunsysteem: cryptococcus neoformans producer bijvoorbeeld
een kapsel dat de binding door PRR inhibeert.
Adaptief immuunsysteem: antistoffen onstaan in de loop van een primo-infectie en
bieden langdurige immuniteit tov herinfectie
Patiënten met AIDS verhoogde susceptibiliteit voor fungale infecties. Tijdens
fungale infectie zal er een sterk TH1 respons ontwikkelen dewelke aanleiding geeft
tot de productie van IFN-γ. IFN-γ is belangrijk om optimale macrofagenactivatie te
bekomen.
Ook TH17 cellen zijn betrokken bij schimmelinfecties
44
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
22. Bespreek de verschillende vormen van vaccinatie
Actieve of passieve immunisatie
Immunisatie: het proces waarbij een status van lange termijnsverdediging ten
opzichte van een pathogeen wordt ontwikkeld
Vaccinatie: intentionele blootstelling aan een variant van het pathogeen dat geen
ziekte veroorzaakt (vaccin) is een andere manier om immuniteit te bekomen
Tijdens immunisatie: activatie van antigen-specifieke lymfocyten generatie van
geheugencellen en langdurige bescherming
Passieve immunisatie
Door toediening van voorgevormde antistoffen
Vb. Wanneer maternele IgG antistoffen transplacentair naar de foetus gaan.
Maternele antistoffen tegen bijvoorbeeld difterie, tetanos, polie bieden passieve
bescherming ad foetus. Deze maternele antistoffen zijn ook aanwezig in de
moedermelkpassieve immuniteit pasgeborene
Verkregen door injectie van voorgevormde antistoffen of antiserum (afkomstig van
immune individuen). Indicaties hiervoor:
immunodeficiënties
expositie aan toxine of gif dat onmiddellijk levensbedreigend is (geen tijd voor
vaccinatie)
expositie aan pathogenen die sneller tot de dood kunnen leiden dan dat een
effectieve immuunrespons zich kan ontwikkelen
Het effect van passieve immunisatie is transiënt en verdwijnt samen met het
verdwijnen van de antistoffen
kan aanleiding geven tot type 1 en 3 overgevoeligheidsreacties
Actieve immunisatie
actieve immunisatie om immuniteit en geheugen te induceren
Door natuurlijke infectie met het pathogeen of artificieel dmv vaccinatie
Naas bescherming van individu ook “herd immunity”
ganse populatie beschermd tov een pathogeen, wanneer een voldoende hoog
aantal individuen in deze populatie beschermd is op een individueel niveau
Verminderde vaccinatiegraad verminderde herd immunity
uitbraak van mazelen de afgelopen jaren zijn het gevolg van
laksheid in verband met vaccinatie
verdwijnen van protectieve maternele antistoffen
45
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Verschillende vormen van vaccins
Normen:
a. veiligheid van het vaccin
b. effectief in de preventie van infecties
c. haalbaarheid van vaccinatie in een bepaalde populatie
bescherming moet bekomen worden op relevante plaatsen van infectie
immunologisch geheugen moet bekomen worden
Verschillende vormen van vaccins
Vaccins bestaande uit volledige organismen:
Levend afgezwakte vaccinslevenslange immuniteit
Afgezwakte pathogenen: de microorganismen behandeld zodat ze pathogeniciteit
verminderd wordt. Toch moet het organisme de capaciteit van transiënte groei
behouden
behouden hun vermogen om te repliceren en lokken bijgevolg een krachtige
humorale en cellulaire immuunrespons uit
46
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
vaak geen booster vaccinatie nodig
Moeten bewaard worden in koele omstandigheden
Kunnen muteren tijdens productieproces nieuwe infecties
kunnen door mutaties transformeren tot de pathogene vorm
mogelijks meer neveneffecten en complicatie
kunnen niet toegediend worden aan immuungecompromiteerde mensen
om de stabiliteit te bewaren gedurende transport is er noodzaak aan een “cold
chain”
Vb. Vaccinia virus ontwikkeld door Jenner.
Of het Oraal polia vaccin/ Sabin vaccin deze virussen kolonosiren het intestinaal
stelsel en geven lokaal aanleiding tot productie van IgA antistoffen. + geven ook
aanleiding tot productie van IgM en IgG antistoffen
Bij eerste immunisatie: één subthpe predominant en zal immuniteit tov dit subtype
ontwikkelen
Bij tweede immunisatie zal de immuniteit gegeneerd tijdens vorige vaccinatie het
voorheen predominante subtype onderdrukken en zal de uitgroei van één van twee
overblijvende subtypes optreden. Ten opzichte van dit subtype zal dan vervolgens
immuniteit ontwikkeld worden. Tijdens de derde en laatste immunisatie zal
immuniteit zich ontwikkelen ten opzichte van het overblijvende subtype.
Geïnactiveerde of gedode vaccins
onmogelijk voor de pathogenen om zich te vermenigvuldigen
laat wel toe dat zich een immuunrespons ontwikkelt ten opzichte van de antigenen
aanwezig in het gedode organisme
noodzakelijk dat de structuur van de epitopen van de oppervlakantigenen van het
organisme zo veel mogelijk bewaard blijven tijdens de inactivatie
verwarmde of chemisch-geïnactiveerde pathogenen
geen transformatie naar pathogene vorm mogelijk
vaak nood aan booster vaccinaties
vermenigvuldigen niet in de gastheer en induceren geen cel-gemedieerde
immuunrespons
meestal predominant een humorale antistofrespons en in veel mindere mate een
cel-gemedieerde immuunrespons
gevaarlijk productieproces
vaak nood aan adjuvans
mogelijks gevaarlijk als niet alle pathogenen gedood zijn tijdens productieproces
Vbn. vaccins voor cholera, influenza, hepatitis A, plaag, polio (Salk vaccin) en rabiës
47
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Vaccins bestaande uit gezuiverde macromoleculen,
Toxine vaccinaties
Toediening van geinactiveerd exotoxine waartegen zich een immuunrespons
ontwikkelt
Voordeel: het immuunsysteem ontwikkelt een reactie tov bacteriële toxines.
Bijvoorbeeld: difterie en tetanus
De bacteriele exotoxines worden tijdens het productieproces geïnactiveerd dmv
formaldehyde leidt tot vorming van toxoïd
Vaccinatie van het toxoïd induceert anti-toxoïd antistoffen deze kunnen
bacteriële toxines binden en activeren
Subunit vaccinaties
Voordeel: toedienvan specifieke antigenen lagere kans op neveneffecten
Nadeel: deze vaccins zijn moeilijk te ontwikkelen
Vb. Hep B, pertusis, streptococcus pneumoniae
Conjugaat of multivalent vaccin (bv. Haemophilus influenza type B)
geeft aanleiding tot betere immunogeniciteit en resultaat
Kunnen toegediend worden aan jonge kinderen
Immuunrespons creëren tov bepaalde bacteriën
goed om antistoffen te generen maar niet om CTL respons op te wekken
om CTL respons op te wekken heb je ag presentatie in context van MHC klasse 1
nodig
lipid carriers (?)
koppeling van zwak aan sterk antigen of zwakke vaccin immunogenen gemixt met
een hoeveelheid eiwitten
Bv. Haemophilus influenza type B: combinatie van type B kapsel polysacharide
samen met tetanos toxoïd
Polysacharide vaccins leiden normaliter enkel tot activatie B cellen op een
T-independente manier IgM productie zonder class switching,
affiniteitsmaturatie en weinig ontwikkeling van geheugen B cellen.
Bij conjugatie van deze vaccins met bijvoorbeeld het tetanos toxoïd ook
een TH celrespons ontwikkelen met vorming van IgG antistoffen +
ontwikkeling van geheuen B cellen
Recombinant vector vaccins: individuele genen die coderen voor belangrijke
antigenen van het pathogeen geintroduceerd in afgezwakte virussen of bacterieen.
Deze afgezwakte organismen dienen als vector.
deze expressie leidt tot een immuunrespons en ontwikkeling immunologisch
geheugen
Bij 129DNA vaccins: wordt een plasmide DNA coderen voor antigene eiwitten
rechstreek geinjecteerd in de spieren van het individu
48
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
productie van immunogene eiwitten
gevolgd door antigen presentatie in combinatie met MHC klasse I moleculen en Tc
cel responsen.
Naast opname door spiercellen wordt het DNA ook opgenomen door dendritische
cellen
Adjuvants
Adjuvants worden gebruikt om een versterkte immuunrespons te genereren. Dit is van
belang wanneer gebruik wordt gemaakt van een subunit van een pathogeen of ander nietlevende vormen van het organisme waarbij de immunogeniciteit laag.
meer inflammatie uitlokken om meer immuuncellen te recruteren
vertragen van ag vrijstelling om langere interactie met immuunsysteem te verkrijgen
welke adjuvans
aluminium – goed om TH2 respons te genereren (en niet T H1 respons)
zorgt voor trage vrijsteling van immunogeen thv injectieplaats verlengde
stimulatie immuunsysteeem
MF59 – olie in water emulsie, vertraagd ag vrijzetting
AS04 – aluminium en een TLR4 agonisti are included to enhance the immune
response to a vaccine
49
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
23. Bespreek de immuunediting theorie en belang van tumor
micromilieu
Immunoediting verdedigt tegen kanker maar bevordert eveneens tumorgroei
Anti-tumor immuunrespons selecteert uiteindelijk de meest resistente kanker cel
3 fases:
Eliminatie
Equilibrium
Ontsnapping
Ongecontroleerde immuunactivatie aanleiding tot pathologische inflammatie en
auto-immuniteit
Inflammatoire respons kunnen aanleiding geven tot eliminatie van kanker maar is
ook in staat om de ontwikkeling van kanker de versnellen door de creatie van een
pro-kanker omgeving
Sommige inflammatoire responses promoten tumorontwikkeling
Chronisch inflammatie
Cellulaire stress
Inductie van mutaties
Groeifactoren/cytokines die proliferatie induceren
Pro-angiogeen
Tumor-stimulerende anti-tumor antistoffen
Binden en verbergen van ag dat anders target zou zijn van CTLs
Vorming van complexen met vrij tumor-antigen: binding van FcR op NK cellen en
macrofagen en verstoorde anti-tumor activiteit
Actieve immuunsuppressie van tumor micro-omgeving
Soluble immuunsuppressie factoren: TGF-β, IDO, IL-10
Inductie van Tregs en MDSCs
Suppressie verhindert efficientie anti-tumor respons
50
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
51
AMEYE, BALDUYCK, BLANCKAERT, CORNELIS, VANDEPUTTE, VAN OOST & WYSEUR
Vraag 24 Bespreek co-stimulatie in context van tumortherapie
Sommige tumorcellen ontsnappen aan immuunherkenning en activatie
Verminderde co-stimulatoire signalen door tumorcellen
Mutatie of downregulatie van co-stimulatoire moleculen (B7, CD28)
Afwezig 2de signaal geeft aanleiding tot anergie en tolerantie ten opzichte van
tumorcellen
Recente therapieen gericht op herstel van co-stimulatoire signalen
52










