voor de praktijk
Diabetes mellitus: eenvoudige classificatie en bijpassende behandeling
S.Simsek, M.Diamant, E.M.W.Eekhoff en R.J.Heine
– Het classificeren van diabetes mellitus is niet altijd eenvoudig, maar is van klinisch belang wegens de
verschillen in behandeling, prognose en overerving.
– Bij jonge patiënten met acute symptomen van hyperglykemie en een lage ‘body mass index’ (BMI)
is de diagnose ‘diabetes mellitus type 1’ evident en moet men zo snel mogelijk beginnen met insulinetherapie.
– De aanwezigheid van doofheid bij patiënten met geringe klachten en een zeer positieve familieanamnese doet denken aan een maternale dan wel mitochondriale vorm van diabetes: ‘maternal inherited
diabetes and deafness’ (MIDD).
– Indien doofheid niet aanwezig is, moet bij dezelfde groep patiënten gedacht worden aan ‘maturityonset diabetes of the young’ (MODY).
– Bij een niet-acute presentatie van hyperglykemie en een niet-uitgesproken familieanamnese kan de
BMI van de patiënt helpen bij de te nemen volgende stappen.
– Een voorgesteld stroomdiagram kan in de praktijk eenvoudig worden toegepast voor de classificatie
en de behandeling van patiënten met hyperglykemie.
Ned Tijdschr Geneeskd. 2006;150:1007-12
Diabetes mellitus (DM) wordt volgens de huidige classificatie ingedeeld in type 1 (DM1), type 2 (DM2) en zwangerschapsdiabetes (GDM). Daarnaast bestaat er een klein aantal erfelijke vormen, zoals ‘maturity-onset diabetes of the
young’ (MODY) en ‘maternal inherited diabetes and deafness’ (MIDD).1 Regelmatig is het echter niet eenvoudig om
patiënten bij wie eenmaal de diagnose ‘DM’ is gesteld vervolgens nader te classificeren. In dit tijdschrift is reeds aandacht geschonken aan de moeilijkheden die een behandelend arts kan tegenkomen bij het classificeren van DM.2 3
Aangezien de behandeling, de prognose en de overerving
van de diverse vormen van DM mede worden bepaald door
een juiste classificatie, is het van groot belang om de diagnose correct te stellen. Vaak wordt een diagnose heroverwogen wanneer er onvoldoende therapierespons of een
onverwacht beloop is. Een praktische beslisboom kan een
eenvoudig hulpmiddel zijn bij het classificeren van DM.4
In dit artikel beschrijven wij de stappen die genomen dienen te worden om patiënten met DM juist te classificeren.
Wij stellen een richtlijn voor die uitgaat van de ‘body mass
index’ (BMI uitgedrukt in kg/m2), ook wel queteletindex
genoemd, en van de familieanamnese.
VU Medisch Centrum, afd. Endocrinologie/Diabetescentrum, Postbus
7057, 1007 MB Amsterdam.
Hr.dr.S.Simsek en mw.dr.M.Diamant, internisten-endocrinologen (tevens:
vasculair geneeskundigen); mw.dr.E.M.W.Eekhoff, internist-endocrinoloog; hr.prof.dr.R.J.Heine, internist-diabetoloog.
Correspondentieadres: hr.dr.S.Simsek ([email protected]).
criteria voor het diagnosticeren van
diabetes mellitus
Voor het stellen van de diagnose ‘DM’ zijn er diverse nationale en internationale criteria en richtlijnen beschikbaar,
onder andere die van de Wereldgezondheidsorganisatie
(WHO) (http://whqlibdoc.who.int/hq/1999/who_ncd_ncs_
99.2.pdf ).1 5 6 Volgens de standaard ‘Diabetes mellitus type
2’ van het Nederlands Huisartsen Genootschap (NHG)
wordt van DM gesproken als de nuchtere bloedglucoseconcentratie bij herhaling > 6,0 mmol/l bedraagt in capillair
vol bloed en/of > 6,9 mmol/l in veneus plasma. Eveneens is
er DM als bij de patiënt een niet-nuchtere bloedglucoseconcentratie wordt gemeten van > 11,0 mmol/l in capillair
vol bloed en/of veneus plasma.5
classificatie van diabetes mellitus
De NHG-standaard vermeldt niet welke stappen er genomen moeten worden om te komen tot een juiste classificatie. Het blijkt lastig om een eenmaal vastgestelde DM verder
te classificeren of in categorieën in te delen. In 1979 publiceerde de National Diabetes Data Group een classificatie
van DM waarin 5 typen DM werden onderscheiden: (a) insulineafhankelijke DM (DM1), (b) niet-insulineafhankelijke
DM (DM2), (c) GDM, (d) aan wanvoeding gerelateerde DM
en (e) andere typen DM.7 Deze classificatie was gebaseerd
op behandeling (voor DM1 en DM2) en pathogenese (voor
GDM, aan wanvoeding gerelateerde DM en voor andere
typen van DM).
In 1995 nam de American Diabetes Association de classi-
Ned Tijdschr Geneeskd. 2006 6 mei;150(18)
1007
ficatie en de diagnostische criteria onder de loep. De classificatie berustte op de veronderstelde oorzaak van DM,1 in
tegenstelling tot de vroegere classificatie, gehanteerd door
de National Diabetes Data Group en de WHO, die gebaseerd
was op oorzaak én behandeling.5 7
belangrijkste typen van diabetes mellitus bij
volwassenen
Auto-immune diabetes mellitus. Tot de auto-immune diabetes
mellitus worden gerekend DM1 en latente auto-immune diabetes van volwassenen (LADA). Bij auto-immune DM vindt
er vernietiging plaats van de insulineproducerende cellen
(β-cellen) van de alvleesklier, hetgeen uiteindelijk leidt tot
een absoluut insulinetekort. De patiënten met DM1, die
meestal vóór het 18e levensjaar wordt ontdekt, hebben een
absolute behoefte aan behandeling met insuline. Bij gebrek
aan insuline zijn deze patiënten niet in staat glucose als
brandstof voor de cellen te gebruiken en zijn zij daarvoor
met name aangewezen op de afbraak van vrije vetzuren.
Het stellen van de diagnose ‘DM1’ is dikwijls niet moeilijk, aangezien de meeste patiënten geen overgewicht hebben (BMI B 25 kg/m2) en zich presenteren met acute verschijnselen van insulinedeficiëntie: hyperglykemie, gewichtsverlies en de aanwezigheid van ketonen in de urine. Bij een late
presentatie kan bij deze patiënten zelfs verzuring gevonden
worden door een overmaat aan vetzuren. Overigens komt
een ketoacidotische ontregeling niet alleen voor bij DM1,
maar kan deze bij sommige, vooral niet-blanke patiënten
met DM2 onder bepaalde omstandigheden ook voorkomen;
dit is meestal het geval bij een combinatie van infectie en
het niet gebruiken van de diabetesmedicatie (zie verder).
Ook oudere patiënten kunnen DM1 krijgen, zelfs tot op
bejaarde leeftijd. Het kan dan eveneens gaan om een acute
presentatie met hyperglykemie en belangrijk gewichtsverlies, waarbij een ketotische ontregeling overigens zelden
voorkomt.
LADA wordt op dit moment gediagnosticeerd op basis
van 3 klinische criteria: (a) manifestatie van DM op een latere leeftijd dan 18 jaar, (b) aanwezigheid van autoantistoffen gericht tegen de eilandjes van Langerhans, tegen glutamaatdecarboxylase (GAD65) in het bijzonder – hetgeen een
onderscheid is met DM2 – en (c) insulineonafhankelijkheid
op het moment dat de diagnose wordt gesteld – hetgeen een
onderscheid is met DM1. Volgens deze criteria worden de
LADA-patiënten klinisch ingedeeld tussen DM1- en DM2patiënten. LADA wordt ook wel ‘langzame DM1’ (‘slow progressive insulin-dependent diabetes mellitus’; SPIDDM)
of ‘DM type 11/2’ genoemd. Sommige auteurs beweren dat
LADA-patiënten, in tegenstelling tot DM2-patiënten, beter
meteen met insulinetherapie kunnen starten om verdere
β-celachteruitgang te voorkomen,8-10 maar hiervoor is geen
bewijs geleverd.
1008
Continuüm. Onlangs is de vraag gesteld of LADA wel
een klinisch relevante term is.11 Dit werd geïllustreerd aan
de hand van 2 denkbeeldige patiënten: mannen van middelbare leeftijd, die beiden antistoffen hadden tegen de eilandjes van Langerhans. De aanwezigheid van deze antistoffen
kan wijzen op een proces van β-celdestructie. Patiënt X had
een niet-afwijkend postuur (BMI < 25 kg/m2), terwijl patiënt
Y met overgewicht (BMI > 25 kg/m2) relatief resistent
was tegen insuline. Bij patiënt X zal DM manifest worden
(= hyperglykemie) als hij nauwelijks of geen β-cellen meer
heeft, resulterend in een directe behoefte aan insulinetherapie. Patiënt Y daarentegen zal ten tijde van de manifestatie
van de hyperglykemie nog insulineproductie hebben, echter
onvoldoende om tegemoet te komen aan de hoge insulinebehoefte die het gevolg is van de insulineresistentie.
Normaliter zal de behandeling van patiënt Y aanvankelijk
bestaan uit metformine, uit sulfonylureumderivaten of uit
beide. Patiënt X zal beschouwd worden als iemand met een
late vorm van DM1 en bij patiënt Y zal de diagnose ‘LADA’
worden gesteld, terwijl het enige verschil tussen beide
vormen de insulinegevoeligheid is.
Volgens de auteur van het artikel is het beter om autoimmune diabetes als een continuüm te zien dan energie en
tijd te steken in het kunstmatig onderscheid maken tussen
de diverse manifestatievormen.11 Dit wordt geïllustreerd
aan de hand van kinderen met een hoge BMI en een langzame vorm van DM1.12 Ons inziens moeten LADA en ‘latent
autoimmune diabetes of the young’ (LADY) derhalve worden beschouwd als een continuüm van dezelfde ziekte,
waarbij er autoantistoffen aanwezig zijn en er een nietacute presentatie is van hyperglykemie, onafhankelijk van
de leeftijd ten tijde van de presentatie. De met overgewicht
verband houdende insulineresistentie zorgt er vermoedelijk
voor dat de hyperglykemie geleidelijk manifest wordt zonder dat de meeste insulineproducerende cellen reeds teloor
zijn gegaan.
Welke van de diverse conventionele therapieën (insuline,
metformine, sulfonylureumderivaten, thiazolidinedionen
en de verschillende combinaties daarvan) er bij LADApatiënten voor zorgen dat de insulineproducerende functie
van de β-cel zo lang mogelijk behouden blijft, moet in toekomstige studies onderzocht worden.
Diabetes mellitus type 2. DM2 heeft als belangrijkste pathofysiologische kenmerken een progressieve β-celdisfunctie
en insulineresistentie. Het betreft patiënten met overgewicht (BMI > 25 kg/m2) of obesitas (BMI > 30 kg/m2) van
wie de meesten naast hyperglykemie een clustering van
diverse risicofactoren voor hart- en vaatziekten hebben, zoals hypertensie, hypertriglyceridemie, een verlaagde HDLcholesterolwaarde en een grote middelomvang.13-15 Veelal
betreft het oudere patiënten, hoewel vetzucht tegenwoordig steeds vaker voorkomt in jongere leeftijdsgroepen.
Desalniettemin zal het stellen van de diagnose ‘DM2’, die
Ned Tijdschr Geneeskd. 2006 6 mei;150(18)
veelal familiair voorkomt, niet tot grote problemen leiden
(tabel 1).
Het onderscheid met DM1 kan moeilijker te maken zijn
bij jongvolwassenen met overgewicht. Door de toename van
het aantal mensen met overgewicht in de algemene bevolking kunnen obese patiënten met DM1 ook een clustering
van diverse risicofactoren voor hart- en vaatziekten hebben.
Bovendien komt er ook een vorm van DM2 voor, voornamelijk bij niet-blanke populaties, die gepaard gaat met ketoacidose. Deze vorm van diabetes wordt thans ‘DM2 met
neiging tot ketoacidose’ genoemd (‘ketosis-prone type 2 diabetes’).16
Andere monogenetische vormen van diabetes mellitus. Er zijn
ook verschillende monogenetische vormen van DM die gekenmerkt worden door een defecte β-celfunctie (tabel 2).
Een uitgebreide beschrijving van de monogenetische vormen van DM is eerder in het Tijdschrift verschenen.17-19
laboratoriumtests voor de classificatie van
diabetes mellitus
Zoals wij hierboven hebben uiteengezet, is het bij sommige
volwassen patiënten niet eenvoudig om op klinische gronden onderscheid te maken tussen DM1 en DM2. Welke laboratoriumbepalingen kunnen bij het maken van dat onderscheid nuttig zijn? Veelal wordt er gebruikgemaakt van de
C-peptideconcentratie als een maat voor het al dan niet
aanwezig zijn van endogene insulineproductie. Echter, het
meten van een al of niet nuchtere C-peptideconcentratie is
meestal weinig zinvol, omdat deze bepaling mede afhankelijk is van de momentane bloedglucosewaarden. Bovendien
kan de C-peptideconcentratie bij patiënten in de beginjaren
van DM1, de zogenaamde ‘honeymoon’-fase, nog binnen de
normale waarden liggen.20
DM1 gaat samen met de aanwezigheid van diverse autoantistoffen, die onder meer gericht zijn tegen de eilandjes
van Langerhans (‘islet cell antibodies’; ICA), tegen het enzym dat de decarboxylatie katalyseert van glutamaatzuur
naar γ-aminoboterzuur (glutamaatdecarboxylase; GAD65),
tegen tyrosinefosfatase IA-2 en IA-2β en tegen insuline. Bij
85-90% van de DM-patiënten wordt er 1 autoantistof gevonden, maar meestal zijn er meerdere autoantistoffen aanwezig. De aanwezigheid van deze autoantistoffen is een bewijs
voor DM1; men spreekt van DM type 1A: immuungemedieerde diabetes mellitus. Bij DM type 1A is er een sterke
samenhang met de HLA-DQA- en HLA-DQB-genen en is er
beïnvloeding door de HLA-DRB-genen.
Idiopathische DM1. Er bestaat ook een zeldzame vorm van
DM1, idiopathische DM1, ook wel DM type 1B genoemd,
met name bij patiënten van Aziatische of Afrikaanse afkomst, bij wie geen autoantistoffen kunnen worden aangetoond. Deze vorm wordt verder gekenmerkt door een permanent insulinetekort, gepaard gaande met ketoacidotische
ontregelingen, en een sterke erfelijke component, echter
zonder dat er een verband is met HLA.
Verschillende bevolkings- en cohortstudies onder pa-
tabel 1. Belangrijkste typen van diabetes mellitus, klinische kenmerken en behandeling
DM type 1
LADA
MODY
leeftijd van manifestatie
< 25 jaar
> 25 jaar
< 25 jaar
BMI (in kg/m2)
andere cardiovasculaire
risicofactoren*
belaste familieanamnese
erfelijkheid
B 25
nee
B 25
nee
zelden
zelden
zelden
zelden
ja
ja
insuline
nee
zelden
onbekend (orale
middelen of
insuline)
penetrantie
acute eerste presentatie‡
ketoacidose
initiële voorkeursbehandeling
MIDD
DM type 2
B 25
nee
> 25 jaar
(gemiddeld rond
38 jaar)
meestal B 25
nee
> 25 jaar
(meestal vanaf
40 jaar)
> 25
ja
meerdere generaties
monogenetisch
autosomaal dominant†
95%
nee
nee
sulfonylureumderivaten
meerdere generaties
monogenetisch
autosomaal dominant
100%
nee
nee
metformine
gecontraïndiceerd
meerdere generaties
polygenetisch
10-40%
nee
soms
metformine
(leefstijladviezen)
DM = diabetes mellitus; LADA = latente auto-immune diabetes van volwassenen; MODY = ‘maturity-onset diabetes of the young’; MIDD = ‘maternal inherited diabetes and deafness’; BMI = ‘body mass index’.
*Clustering van cardiovasculaire risicofactoren: hypertensie, hypertriglyceridemie, insulineresistentie, verlaagde HDL-cholesterolconcentratie,
gepaard gaande met een grote middelomvang.
†Drie opeenvolgende generaties.
‡Acute eerste presentatie: hyperglykemie met gewichtsverlies en ketonen in de urine.
Ned Tijdschr Geneeskd. 2006 6 mei;150(18)
1009
tabel 2. Verschillende tot nu toe bekende typen van monogenetische diabetesvormen
gen/eiwit
frequentie
ernst van DM
overige bevindingen naast hyperglykemie
MODY 1
MODY 2
MODY 3
MODY 4
MODY 5
HNF4α
glucokinase
HNF1α
IPF1
HNF1β
zeldzaam
1%
2%
< 1%
zeldzaam
ernstig
gering
ernstig
gering
ernstig
verlaagde concentratie triglyceriden
MODY 6
MODY 7
MODY X
MIDD
NeuroD1
Isl-1
•
MtDNA
zeldzaam
zeldzaam
zeldzaam
1%
onbekend
nierafwijkingen, met name cysten, vaak leidend tot
niet-DM-gerelateerde nierinsufficiëntie
progressief
doofheid, retinale pigmentatie, maternale overerving
DM = diabetes mellitus; MODY = ‘maturity-onset diabetes of the young’; MIDD = ‘maternal inherited diabetes and deafness’; MtDNA = mitochondriaal DNA.
tiënten bij wie DM2 was gediagnosticeerd, hebben aangetoond dat 4-10% van deze patiënten positief was voor één of
meerdere van de bovengenoemde autoantistoffen.21-29 Volgens de criteria van de American Diabetes Association en de
WHO moet DM bij deze patiënten geclassificeerd worden
als LADA of DM type 1A, het immuungemedieerde type van
DM1. De volwassen patiënten met deze vorm van DM, die
aanvankelijk geen insuline nodig hebben en bij wie toch
antilichamen worden aangetoond, onderscheiden zich van
de klassieke DM2-patiënten met name door een lagere
BMI.
diagnostisch en classificerend
stroomdiagram met een daaraan gekoppelde
behandeling
Op basis van het voorgaande stellen wij een praktisch
stroomdiagram voor, waarbij wij niet streven naar volledigheid, maar waarin wij in ieder geval de in de praktijk vaakst
voorkomende vormen van DM noemen (figuur).
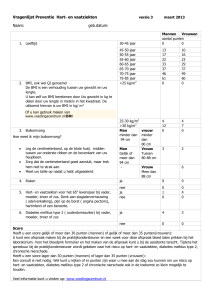
Bij een patiënt die zich presenteert met acute hyperglykemie gepaard gaande met gewichtsverlies, de aanwezigheid
van ketonen in de urine en eventueel verzuring, en met een
hyperglykemie
belaste familieanamnese?
nee
ja
BMI > 25 kg/m2?
autosomaal dominant?
ja
ja
hyperglykemische
klachten?*
nee
ja
nee
nee
BMI > 25 kg/m2?
doofheid
ja
nee
nee
ja
DM1
DM2
MIDD
MODY
DM1
DM2
insuline
metformine
contra-indicatie
voor metformine
sulfonylureumderivaat
insuline
metformine
Stroomdiagram voor het onderscheiden van de meest voorkomende vormen van diabetes mellitus bij patiënten met hyperglykemie.
BMI = ‘body mass index’; DM1 = diabetes mellitus type 1; DM2 = diabetes mellitus type 2; MIDD = ‘maternal inherited diabetes and
deafness’; MODY = ‘maturity-onset diabetes of the young’. *De genoemde hyperglykemische klachten zijn: polyurie, polydipsie, nycturie
en gewichtsverlies.
1010
Ned Tijdschr Geneeskd. 2006 6 mei;150(18)
onbelaste familieanamnese voor DM en een BMI B 25 kg/
m2, lijkt de diagnose ‘DM1’ evident. Een (volwassen) patiënt
komt dan in principe bij de internist terecht voor verdere behandeling met insuline. Eventueel kunnen autoantistoffen
bepaald worden om de diagnose te bevestigen. Het stroomdiagram noemt geen patiënt met een BMI B 25 kg/m2 zonder belaste familieanamnese die zich niet presenteert met
acute hyperglykemie, dat wil zeggen een patiënt zonder directe noodzaak voor behandeling met insuline. Als er autoantistoffen aanwezig zijn, zou bij die patiënt de diagnose
‘LADA’ volgens de bovenstaande criteria gesteld kunnen
worden.
Indien een patiënt een BMI > 25 kg/m2 heeft zonder belaste familieanamnese en er bij presentatie klachten zijn van
hyperglykemie (polydipsie, polyurie, nycturie, gewichtsverlies) lijkt er DM1 in het spel te zijn en dient patiënt in ieder
geval in het begin met insuline te starten. Om de diagnose
te bevestigen kan eventueel de aanwezigheid van autoantistoffen bepaald worden. Bij een patiënt zonder belaste familieanamnese met een BMI > 25 kg/m2 zonder hyperglykemische klachten lijkt het te gaan om DM2 (β-celdisfunctie
en insulineresistentie); in dat geval kan men de patiënt met
metformine behandelen en hem leefstijladviezen geven, zoals adviezen voor een dieet en voor lichaamsbeweging. Wanneer de familieanamnese onbelast is bij een patiënt met een
BMI > 25 kg/m2 en er positieve autoantistofuitslagen zijn, is
er veel voor te zeggen om deze patiënt aanvankelijk met
orale middelen te behandelen.
Bij patiënten met hyperglykemie bij wie het niet gaat om
een acute eerste presentatie en die wel een sterk belaste
familieanamnese hebben, dat wil zeggen DM in 3 opeenvolgende generaties oftewel een autosomaal dominant overervingspatroon, en die een lage BMI hebben, lijkt het te
gaan om een monogenetische vorm van DM. Als er bovendien, eventueel bilaterale, slechthorendheid bestaat, is de
waarschijnlijkheidsdiagnose een mitochondriale dan wel
maternale vorm van diabetes: MIDD. Bij MIDD bestaat er
een contra-indicatie voor het gebruik van metformine
wegens het vergrote risico op een lactaatacidose.30 De insulinopenie is bij deze patiënten meestal progressief en de
meesten zullen snel met insuline behandeld moeten worden.
Bij een hyperglykemische patiënt zonder doofheid, maar
met een autosomaal dominante overerving bij een belaste
familieanamnese en een BMI B 25 kg/m2 dient men sterk
rekening te houden met een vorm van MODY, waarbij behandeling met een sulfonylureumderivaat geïndiceerd is.
Indien men MODY veronderstelt, kan men overwegen een
genetisch onderzoek uit te voeren, omdat de prognose en
de behandeling bepaald worden op basis van het type DM
(zie tabel 2). Tevens zou men een nader familieonderzoek
kunnen overwegen.
Indien de hyperglykemische patiënt een BMI > 25 kg/m2
heeft, maar zich de eerste keer niet met een acute hyper-
glykemie presenteert, hij of zij wel een belaste familieanamnese heeft, maar geen autosomaal dominant overervingspatroon, en als hij of zij een clustering heeft van risicofactoren voor hart- en vaatziekte kan de diagnose ‘DM2’ gesteld
worden. Naast het geven van leefstijladviezen bestaat de
primaire voorkeursbehandeling uit metformine.
Dit voor de praktijk simpele schema voorziet in een eerste handzame classificatie van een patiënt met hyperglykemie bij een DM de novo en bij reeds bestaande DM; daarin zijn de uitzonderlijke vormen van DM niet opgenomen –
hierop moet men wel bedacht blijven.
conclusie
DM is een steeds vaker voorkomende ziekte die vooral samenhangt met de toename van obesitas onder de algemene
bevolking. Hoewel een verschil tussen DM1 en DM2 meestal gemakkelijk gemaakt kan worden, zijn er door het voortschrijdende inzicht in de etiologie en de pathogenese andere typen DM gekarakteriseerd, die vaak verschillend behandeld moeten worden. Het aangegeven stroomschema geeft
de meest voorkomende vormen van DM weer in de vorm van
een eenvoudige richtlijn voor diagnostiek en de daarbij behorende classificatie en therapie.
Prof.dr.J.C.Netelenbos, internist-endocrinoloog, becommentarieerde
een eerdere versie van dit artikel.
Belangenconflict: geen gemeld. Financiële ondersteuning: geen gemeld.
Aanvaard op 24 februari 2006
Literatuur
1
2
3
4
5
6
American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2005;28:S37-42.
Hoekstra JBL, Koning EJP de. Diabetes mellitus, maar welk type? Ned
Tijdschr Geneeskd. 2004;148:761-4.
Diamant M, Eekhoff EMW, Heine RJ, Simsek S. Diabetes mellitus,
maar welk type? Ned Tijdschr Geneeskd. 2004;148:1265-6.
Simsek S, Diamant M, Eekhoff EM, Heine RJ. Waarom wordt bij de
start van orale therapie bij diabetes mellitus type 2 niet altijd begonnen met metformine in plaats van sulfonylureumderivaten, ook bij
patiënten die een QI hebben van < 27? In: De meest gestelde vragen
over: diabetes mellitus. Vademecum permanente nascholing huisartsen. Houten: Bohn Stafleu van Loghum; 2005.
Rutten GEHM, Verhoeven S, Heine RJ, Grauw WJC de, Cromme PVM,
Reenders K, et al. NHG-standaard Diabetes mellitus type 2. Huisarts Wet. 1999;42:67-84.
Houweling ST, Kleefstra N, Ballegooie E van, Miedema K, Rischen R,
Heeg JE. Diagnostiek van diabetes mellitus: beperkte plaats voor
draagbare glucosemeters. Ned Tijdschr Geneeskd. 2005;149:694-7.
Ned Tijdschr Geneeskd. 2006 6 mei;150(18)
1011
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
National Diabetes Data Group. Classification and diagnosis of diabetes mellitus and other categories of glucose intolerance. Diabetes.
1979;28:1039-57.
Gottsater A, Landin-Olsson M, Fernlund P, Lernmark A, Sundkvist G.
Beta-cell function in relation to islet cell antibodies during the first
3 yr after clinical diagnosis of diabetes in type II diabetic patients.
Diabetes Care. 1993;16:902-10.
Szepietowska B, Szelachowska M, Kinalska I. Do latent autoimmune
diabetes of the adult (LADA) patients require insulin at diagnosis?:
response to Pozzilli and di Mario. Diabetes Care. 2002;25:1662-3.
Maruyama T, Shimada T, Kanatsuka A, Kasuga A, Takei I, Yokoyama
J, et al. Multicenter prevention trial of slowly progressive type 1 diabetes with small dose of insulin (the Tokyo study): preliminary report.
Ann N Y Acad Sci. 2003;1005:362-9.
Gale EAM. Latent autoimmune diabetes in adults: a guide for the
perplexed. Diabetologia. 2005;48:2195-9.
Lohmann T, Nietzschmann U, Kiess W. ‘Lady-like’: is there a latent
autoimmune diabetes in the young? Diabetes Care. 2000;23:1707-8.
Olijhoek JK, Martens FMAC, Banga JD, Visseren FLJ. Het metabool
syndroom: een cluster van vasculaire risicofactoren. Ned Tijdschr
Geneeskd. 2005;149:859-65.
Dekker JM, Diamant M, Nijpels G, Heine RJ. Het metabool syndroom:
beperkte meerwaarde voor de klinische praktijk. Ned Tijdschr Geneeskd. 2005;149:855-8.
Expert Panel on Detection, Evaluation, and Treatment of High Blood
Cholesterol in Adults. Executive summary of the third report of
the National Cholesterol Education Program (NCEP) Expert Panel
on Detection, Evaluation, and Treatment of High Blood Cholesterol
in Adults (Adult Treatment Panel III). JAMA. 2001;285:2486-97.
Sobngwi E, Gautier JF. Adult-onset idiopathic type I or ketosis-prone
type II diabetes: evidence to revisit diabetes classification. Diabetologia. 2002;45:283-5.
Maassen JA, Lemkes HHPJ, Losekoot M. Van gen naar ziekte; ‘maturity-onset diabetes of the young’ (MODY), monogenetisch overervende vormen van diabetes mellitus. Ned Tijdschr Geneeskd. 2001;145:
1352-3.
Losekoot M, Broekman AJ, Breuning MH, Koning EJP de, Romijn JA,
Maassen JA. Moleculaire diagnostiek bij aanwijzingen voor ‘maturity
onset diabetes of the young’; resultaten bij 184 patiënten. Ned Tijdschr Geneeskd. 2005;149:139-43.
Maassen JA, Ouweland JMW van den, Losekoot M, Lemkes HHPJ.
Van gen naar ziekte; mutatie in mitochondrieel DNA en maternaal
overervende diabetes mellitus met doofheid (MIDD). Ned Tijdschr
Geneeskd. 2001;145:1153-4.
Heinze E, Thon A. Honeymoon period in insulin-dependent diabetes
mellitus. Pediatrician. 1983-85;12:208-12.
Ruige JB, Batstra MR, Aanstoot HJ, Bouter LM, Bruining GJ, Neeling
JN de, et al. Low prevalence of antibodies to GAD65 in a 50- to
74-year-old general Dutch population. The Hoorn study. Diabetes
Care. 1997;20:1108-10.
Tuomi T, Carlsson A, Li H, Isomaa B, Miettinen A, Nilsson A, et al.
Clinical and genetic characteristics of type 2 diabetes with and without
GAD antibodies. Diabetes. 1999;48:150-7.
1012
23 Isomaa B, Almgren P, Henricsson M, Taskinen MR, Tuomi T, Groop
L, et al. Chronic complications in patients with slowly progressing
autoimmune type 1 diabetes (LADA). Diabetes Care. 1999;22:1347-53.
24 Pozzilli P, di Mario U. Autoimmune diabetes not requiring insulin
at diagnosis (latent autoimmune diabetes of the adult): definition,
characterization, and potential prevention. Diabetes Care. 2001;24:
1460-7.
25 Landin-Olsson M. Latent autoimmune diabetes in adults. Ann N Y
Acad Sci. 2002;958:112-6.
26 Takeda H, Kawasaki E, Shimizu I, Konoue E, Fujiyama M, Murao S,
et al. Clinical, autoimmune, and genetic characteristics of adult-onset
diabetic patients with GAD autoantibodies in Japan (Ehime study).
Diabetes Care. 2002;25:995-1001.
27 Zinman B, Kahn SE, Haffner SM, O’Neill MC, Heise MA, Freed MI,
et al. Phenotypic characteristics of GAD antibody-positive recently
diagnosed patients with type 2 diabetes in North America and Europe.
ADOPT Study Group. Diabetes. 2004;53:3193-200.
28 Maioli M, Alejandro E, Tonolo G, Gilliam LK, Bekris L, Hampe CS,
et al. Epitope-restricted 65-kilodalton glutamic acid decarboxylase
autoantibodies among new-onset Sardinian type 2 diabetes patients
define phenotypes of autoimmune diabetes. Study Group for the
Genetics of Diabetes in Sardinia. J Clin Endocrinol Metab. 2004;89:
5675-82.
29 Hamaguchi K, Kimura A, Kusuda Y, Yamashita T, Yasunami M, Takahasi M, et al. Clinical and genetic characteristics of GAD-antibody
positive patients initially diagnosed as having type 2 diabetes. Diabetes Res Clin Pract. 2004;66:163-71.
30 Maassen JA. Mitochondrial diabetes: pathophysiology, clinical presentation, and genetic analysis. Am J Med Genet. 2002;115:66-70.
Abstract
Diabetes mellitus: simple classification and corresponding treatment
– The classification of diabetes mellitus is not always straightforward
but is of clinical importance in view of the differences in treatment,
prognosis and inheritance.
– In young patients with acute signs of hyperglycaemia and a low bodymass index (BMI), diabetes type 1 is the evident diagnosis, and insulin therapy should be initiated as quickly as possible.
– Deafness in patients with mild symptoms and a highly positive family
history suggests the presence of a mitochondrial or maternally inherited type of diabetes: maternally inherited diabetes and deafness
(MIDD).
– In the absence of deafness, maturity onset diabetes of the young
(MODY) should be suspected in the same group of patients.
– In case of a non-acute presentation of hyperglycaemia without an
evident family history of diabetes, the BMI can be helpful in the next
steps of the diagnostic process.
– In practice, the proposed flow chart can readily be applied for the
classification and treatment of patients with hyperglycaemia.
Ned Tijdschr Geneeskd. 2006;150:1007-12
Ned Tijdschr Geneeskd. 2006 6 mei;150(18)