AUDITS VAN HET KWALITEITSBEHEER
IN DE NUCLEAIRE GENEESKUNDE
UITGEBREIDE AUDIT
AUDITS VAN HET
KWALITEITSBEHEER IN DE
NUCLEAIRE GENEESKUNDE
AUTEURSRECHT
Alle wetenschappelijke en technische publicaties van het IAEA zijn auteursrechterlijk
beschermd door de bepalingen van de Universele Auteursrechtconventie die werden
goedgekeurd in 1952 (Bern) en herzien in 1972 (Parijs). Het auteursrecht is sindsdien door de
Wereldorganisatie voor de Intellectuele Eigendom (Genève) uitgebreid met elektronische en
virtuele intellectuele eigendom. Voor het gebruik van volledige of gedeeltelijke teksten uit
IAEA-publicaties in gedrukte of elektronische vorm moet de toestemming worden verkregen
die gewoonlijk is onderworpen aan royaltyovereenkomsten. Voorstellen voor nietcommerciële reproducties en vertalingen zijn welkom en zullen geval per geval worden
overwogen. Aanvragen dienen te worden gericht aan de uitgeverijafdeling van het IAEA:
Sales and Promation, Publishing Section
International Atomic Energy Agency
Wagramer Strasse 5
P.O. Postbus 100
1400 Wenen, Oostenrijk
fax: +43 1 2600 29302
tel.: +43 1 2600 22417
e-mail: [email protected]
http://www.iaea.org/books
Disclaimer A:
MAG NIET VERKOCHT WORDEN
Disclaimer B:
Dit is een vertaling van de Quality Management Audits in Nuclear Medicine Practices©
International Atomic Energy Agency, [2008]
Deze vertaling werd voorbereid door het Belgisch Federaal Agentschap voor Nucleaire
Controle. De authentieke versie hiervan is de Engelstalige versie die door of uit name
van de IAEA werd verspreid door hiertoe naar behoren gemachtigde personen. De
IAEA geeft geen garanties en kan op geen enkele wijze aansprakelijk worden gehouden
voor de accuraatheid, de kwaliteit, de authenticiteit of het vakmanschap van deze
vertaling en de publicatie ervan en sluit alle aansprakelijkheid uit voor enig verlies of
schade die voortvloeit uit, of in enig opzicht, rechtstreeks of onrechtstreeks, verband
houdt met het gebruik van deze vertaling.
Disclaimer C:
AUTEURSRECHTELIJKE MEDEDELING: Toestemming om de informatie vervat in
deze publicatie te reproduceren of te vertalen kan op schriftelijk aanvraag worden
verkregen bij de Internationale Organisatie voor Atoomenergie, PO Box 100, 1400
Wenen, Oostenrijk.
VOORWOORD
Een doeltreffend beheersysteem met geïntegreerd kwaliteitsbeheer (QM, quality
management) is essentieel binnen de hedendaagse afdelingen nucleaire geneeskunde in de
lidstaten. Het IAEA heeft in zijn “Safety Standard Series”, veiligheidsvoorschriften (GS-R-3)
en een veiligheidsgids (GS-G-3.1) gepubliceerd over beheersystemen voor alle inrichtingen.
Deze publicaties behandelen de toepassing van een geïntegreerd beheersysteem dat ook van
toepassing is op organisaties voor nucleaire geneeskunde.
Kwaliteitsbeheersystemen worden gehandhaafd om de doeltreffendheid en efficiëntie
voortdurend te verbeteren, zodat de nucleaire geneeskunde in staat is te voldoen aan de
verwachtingen van haar kwaliteitsbeleid en bijgevolg haar klanten tevreden te stellen. Het
IAEA biedt zijn lidstaten al jarenlang bijstand op het gebied van nucleaire geneeskunde.
Regelmatige kwaliteitsaudits en –evaluaties zijn essentieel voor de hedendaagse
afdelingen nucleaire geneeskunde. Belangrijker nog, het volledige QM- en auditproces moet
systematisch, patiëntgericht en resultaatgebaseerd zijn. Het beheer van diensten moet ook
rekening houden met de diversiteit van de diensten voor nucleaire geneeskunde over de hele
wereld en met de multidisciplinaire inbreng die klinische, technische, radiofarmaceutische en
medische fysica procedures omvat. Aspecten van stralingsveiligheid en patiëntenbescherming
moeten ook een wezenlijk deel uitmaken van het proces. Dergelijke benadering garandeert
consistentie in het leveren veilige en kwaliteitsvolle en superieure diensten aan de patiënten.
De diensten voor nucleaire geneeskunde nemen meer en meer hun toevlucht tot een
gestandaardiseerd klinisch protocol en evidence-based geneeskunde, waarvan een aantal in
talrijke IAEA-publicaties wordt aanbevolen, bijvoorbeeld de Nuclear Medecine Resources
Manual. Er dient ook te worden verwezen naar andere IAEA-publicaties zoals de reeks van
het IAEA over veiligheidsstandaarden, waaronder de wettelijke voorschriften voor het veilige
transport van nucleair materiaal en afvalstoffenbeheer, aangezien deze een impact hebben op
het verstrekken van nucleairgeneeskundige diensten.
Het hoofddoel van deze publicatie is het invoeren van een routinematig, jaarlijks,
systematisch auditproces in de klinische arena. Elke paragraaf omvat een reeks vragen die
betrekking hebben op specifieke elementen van diensten voor nucleaire geneeskunde. Deze
vragen zijn niet exhaustief en een professioneel oordeel is essentieel om een adequate aanpak
te garanderen. Het is niet de bedoeling om alle vragen te behandelen. De QMauditmethodologie die in deze publicatie wordt geïntroduceerd is ontworpen voor toepassing
in uiteenlopende economische omstandigheden. Een belangrijk resultaat moet een cultuur zijn
van beoordeling van essentiële elementen van de klinische dienst voor voortdurende
verbetering binnen de nucleaire geneeskunde.
Deze publicatie is niet alleen bestemd voor artsen in de nucleaire geneeskunde,
radiologen, radiofarmaceuten, medische stralingsfysici, medische technologen en docenten
maar ook voor diegenen die zich bezighouden met QM- en auditsystemen. De bijgevoegde
cd-rom bevat de controlelijsten voor zelfbeoordeling uit deze publicatie. Ze kunnen ook
worden gebruikt door multidisciplinaire teams die betrokken zijn bij de jaarlijkse QMcontroles en –audits.
Het IAEA is dankbaar voor alle bijdragen van de auteurs en revisoren die deze
publicatie mogelijk hebben gemaakt.
De voor deze publicatie verantwoordelijke IAEA-medewerkers zijn K.K. Solanki en
M. Dondi van de afdeling Humane Gezondheid.
REDACTIONELE OPMERKING
Dit rapport behandelt geen wettelijke of andere verantwoordelijkheden voor
handelingen of weglatingen door wie dan ook.
Hoewel veel aandacht is besteed aan de nauwkeurigheid van de informatie in deze
publicatie, nemen het IAEA noch zijn lidstaten de verantwoordelijkheid op zich voor de
gevolgen die kunnen voortvloeien uit het gebruik ervan.
Het gebruik van specifieke namen van landen of territoria houdt niet het oordeel in
van de uitgever, het IAEA, wat betreft de rechtspositie van dergelijke landen of territoria, of
hun overheidsinstanties en instellingen of de afbakening van hun grenzen.
De vermelding van namen van specifieke bedrijven of producten (al dan niet
geregistreerd) impliceert niet de intentie om eigendomsrechten te schenden, en mag niet
worden geïnterpreteerd als een goedkeuring of aanbeveling vanwege het IAEA.
INHOUD
1. INLEIDING ........................................................................................................................... 1
1.1. Achtergrond ............................................................................................................. 1
1.2. Doel ......................................................................................................................... 2
1.3. Toepassingsgebied ................................................................................................... 2
1.4. Structuur .................................................................................................................. 2
1.5. Doel van een QM-beoordeling en auditteam........................................................... 2
1.6. Algemeen stroomdiagram van de auditprocedure voor de nucleaire geneeskunde 3
1.7. Prioriteiten stellen .................................................................................................... 5
1.8. Beperkingen ............................................................................................................. 5
1.8.1. Regelgevende doeleinden ......................................................................... 6
1.8.2. Onderzoek van ongevallen ....................................................................... 6
1.8.3. Klinisch onderzoek ................................................................................... 6
1.8.4. Interdepartementale vergelijking .............................................................. 6
1.8.5. Controlelijstbeperkingen........................................................................... 6
1.8.6. Verantwoordelijkheid voor verandering ................................................... 7
2. STRUCTUUR VAN DE INTERNE BEOORDELING......................................................... 7
2.1. Doel ......................................................................................................................... 7
2.2. Voorbereiding van de audit: Verantwoordelijkheden van de gecontroleerde
instelling ......................................................................................................................... 7
2.3. Samenstelling van het auditteam ............................................................................. 8
2.4. Leidende beginselen en procedures ......................................................................... 9
2.4.1. Eerste briefing ........................................................................................... 9
2.4.2. Evaluatie ................................................................................................... 9
2.4.3. Minimumvereisten .................................................................................... 9
2.4.4. Conformiteits- en non-conformiteitsverklaring ...................................... 10
2.4.5. Leidraad voor auditvragenlijsten ............................................................ 11
2.4.6. Laatste briefing ....................................................................................... 12
2.5. Conclusie en rapport .............................................................................................. 12
2.6. Verspreiding van het rapport ................................................................................. 13
3. BEHEER EN ONTPLOOIING VAN DE HUMAN RESOURCES .................................... 13
3.1. Strategie en doelen ................................................................................................ 13
3.2. Administratie en beheer ......................................................................................... 15
3.3. Ontplooiing van de human resources .................................................................... 16
4. RISICOBEHEER ................................................................................................................. 18
4.1. Conformiteit met voorschriften betreffende straling, regelgeving en veiligheid . 18
4.2. Stralingsbescherming van de patiënt ..................................................................... 20
4.3. Evaluatie en kwaliteitsbewakingssysteem ............................................................. 22
4.4. Kwaliteitscontrole voor beeldvormingsapparatuur ............................................... 24
4.5. Computersystemen en gegevensverwerking ......................................................... 26
4.6. Acceptatietests ....................................................................................................... 26
5. ALGEMENE KLINISCHE DIENSTEN ............................................................................. 29
5.1. Algemene aspecten – Klinische diensten .............................................................. 30
5.2. Klinische procedures – Diagnostiek ...................................................................... 31
5.2.1. Beeldvormingsprocedures ...................................................................... 31
5.2.2. Evaluatie van klinische beeldvormingsonderzoeken .............................. 31
5.2.3. Beoordeling van klinische praktijken ..................................................... 32
5.2.4. Diagnostische beeldvormingsprocedures – Eindoverzichtstabel............ 32
5.2.5. Klinische procedures – Niet-beeldvormingsprocedures ......................... 34
5.2.5.1. Evaluatie van klinische niet-beeldvormingsonderzoeken ............ 34
5.2.5.2. Diagnostische niet-beeldvormingsprocedures –
Eindoverzichtstabel ..................................................................... 34
5.3. Radionuclidentherapie ........................................................................................... 36
5.4. Klinische evaluatie ................................................................................................ 37
5.5. Klinische radionuclidentherapie – Eindoverzichtstabel ........................................ 38
6. RADIOFARMACIE............................................................................................................. 40
6.1. Operationele leidraad van het IAEA voor ziekenhuisradiofarmacie ..................... 40
6.2. Ziekenhuisradiofarmacie – Operationeel niveau 1 ................................................ 42
6.3. Ziekenhuisradiofarmacie – Operationeel niveau 2 ................................................ 44
7. DIENST TUMORMARKERBEPALING MET BEHULP VAN RADIOIMMUNOASSAY .................................................................................................................... 47
7.1. Elementen van de dienst tumormarkerbepaling met behulp van radioimmunoassay ................................................................................................................ 48
8. AUDITRAPPORT ............................................................................................................... 51
8.1. Lijst van cruciale prioriteiten................................................................................. 51
8.2. Lijst van belangrijke prioriteiten ........................................................................... 51
8.3. Lijst van ondergeschikte prioriteiten ..................................................................... 52
8.4. Controlelijst voor de inhoud van het auditrapport ................................................. 52
REFERENTIES ........................................................................................................................ 55
BIBLIOGRAFIE ...................................................................................................................... 55
AUTEURS EN REVISOREN .................................................................................................. 57
1. INLEIDING
1.1.
ACHTERGROND
Het IAEA biedt zijn lidstaten al jarenlang bijstand op het gebied van nucleaire
geneeskunde. Nadat werd beslist om een handleiding op te stellen voor een
kwaliteitsbeheeraudit in de nucleaire geneeskunde, heeft het IAEA in 2006 een
deskundigengroep bijeengeroepen die samengesteld was uit artsen in de nucleaire
geneeskunde, medische stralingsfysici en radiofarmaceuten. Het doel was een routinematig
jaarlijks, systematisch auditproces in de klinische arena aan te moedigen.
De evaluatiemethodologie moet worden ontworpen en toepasbaar zijn voor
uiteenlopende economische omstandigheden. De deskundigen waren het erover eens dat
nieuwe hulpmiddelen nodig waren voor het behoud van een globale benadering van QMaudits bij de diagnose, de follow-up en behandeling van patiënten die een beroep doen op
nucleaire geneeskunde. Bestaande lokale of nationale auditrichtlijnen zijn toepasselijker. In
dit geval kan deze handleiding ze versterken of een internationaal perspectief bevorderen.
Niettemin was men van mening dat een beoordelingscultuur essentieel is voor een positieve
groei binnen de diensten nucleaire geneeskunde. Belangrijker nog, het volledige
kwaliteitsauditproces moet patiëntgericht, systematisch en resultaatgebaseerd zijn.
Het auditproces moet bestaan uit een regelmatige interne controle, evaluatie en
beoordeling. Dit zal een cultuur van regelmatige beoordeling en herziening aanmoedigen.
Daarenboven zal dit het documentatiesysteem in een drukke klinische setting versterken. Alle
gedocumenteerde evaluaties kunnen nuttig zijn voor externe beoordelingsprocessen zoals de
organisatorische audit van het IAEA. Onafhankelijke externe audits (peer reviews) dienen
regelmatig te worden uitgevoerd om een adequate kwaliteit van diagnose, behandeling en
andere nucleairgeneeskundige diensten te kunnen garanderen.
Om het werkelijke competentieniveau van een afdeling te bepalen moeten de interne
en externe audits rekening houden met de beschikbare uitrusting, infrastructuur en werking
die verband houden met de klinische praktijk. De webdatabase van het IAEA over nucleaire
geneeskunde
(http://www-naweb.iaea.org/nahu/NMDatabase/default.asp)
verstrekt
basisinformatie en essentiële details over operationele en technische aspecten. Elke paragraaf
omvat een reeks vragen die betrekking hebben op specifieke elementen van de dienst
nucleaire geneeskunde.
Deze vragen zijn niet exhaustief en een professioneel oordeel is essentieel om een adequate
aanpak te garanderen. Het is niet de bedoeling om alle vragen te behandelen. De
kwaliteitsaudits kunnen van een verschillend type en niveau zijn. Ze beoordelen specifieke
cruciale onderdelen van het proces van nucleaire geneeskunde (gedeeltelijke audit) of
evalueren het volledige proces (uitgebreide audit).
1
1.2.
DOEL
Het ultieme doel van QM-audits in de nucleaire geneeskunde is een middel ter
beschikking te stellen van inrichtingen voor nucleaire geneeskunde waarmee deze het niveau
van de verstrekte patiëntenzorg kunnen aantonen door een proces van zelf- en externe
evaluatie te volgen. Dit impliceert een verbintenis tot kwaliteitsvolle zorg.
1.3.
TOEPASSINGSGEBIED
Om kwaliteit en dienstverlening van hoog niveau te handhaven, is een jaarlijkse,
uitgebreide audit aanbevolen. Rekening houdend met het multidisciplinaire team binnen de
diensten voor nucleaire geneeskunde, behandelt deze publicatie de volgende hoofdgebieden:
1.4.
-
Beheer en ontplooiing van de human resources;
-
Risicobeheer;
-
Algemene klinische diensten;
-
Radiofarmacie;
-
Diensten tumormarkerbepaling
STRUCTUUR
Na een korte inleiding over QM-audits, stelt deze publicatie een reeks auditlijsten
voor. Diegenen die werkzaam zijn binnen de nucleaire geneeskunde behoeven hierover
weinig of geen toelichting. De auditlijst kan sequentieel of onafhankelijk worden gevolgd.
Niettemin is een samengesteld auditrapport, dat prioriteiten uitzet samen met een actieplan,
aanbevolen.
1.5.
DOEL VAN EEN QM-BEOORDELING EN AUDITTEAM
Kwaliteitsaudits hebben tot doel de kwaliteit te evalueren van alle elementen die
verband houden met de toepassing van nucleaire geneeskunde in een instelling, inclusief de
professionele bekwaamheid, om de kwaliteit te verbeteren. Een multidisciplinair team,
bestaande uit ervaren artsen in de nucleaire geneeskunde, een medische stralingsfysicus, een
radiofarmaceut en een senior beheerder, moet interne en externe audits uitvoeren. In sommige
gevallen kan het nodig zijn om, voor bijkomende ondersteuning, het auditteam uit te breiden
met een laboratoriumspecialist in radio-immunoassay of een röntgenlaborant. Dergelijke
auditteams kunnen interne en/of externe audits uitvoeren. De definitieve samenstelling en
omvang van het auditteam moeten voor de eigenlijke audit worden bepaald. Een gelijkaardig
team kan ook nodig zijn voor follow-up.
2
Het doel van een kwaliteitsauditproces binnen de nucleaire geneeskunde is de
afdelingen nucleaire geneeskunde/laboratoria bij te staan in het behoud of de verbetering van
de kwaliteit van de dienstverlening voor hun patiënten. De audit moet de kwaliteit beoordelen
en evalueren van alle betrokken elementen, inclusief personeel, uitrusting en procedures,
patiëntenbescherming en –veiligheid, de globale prestatie van de afdeling nucleaire
geneeskunde en de interactie met externe dienstverleners.
Via zijn technisch samenwerkingsprogramma heeft het IAEA een groot aantal
aanvragen gekregen van ontwikkelingslanden om kwaliteitsaudits uit te voeren van hun
diensten nucleaire geneeskunde. Verschillende Afrikaanse landen hebben al deelgenomen aan
dergelijke audits. De audits van het IAEA worden gewoonlijk uitgevoerd op nationaal niveau,
niettemin zijn routineaudits van individuele instellingen essentieel. Het IAEA adviseert dat de
afdelingen nucleaire geneeskunde deze publicatie gebruiken als een hulpmiddel om
zelfbeoordelingen uit te voeren om goede klinische praktijken toe te passen door
verbeteringen te identificeren die kunnen worden uitgevoerd met hun eigen middelen.
1.6.
ALGEMEEN STROOMDIAGRAM VAN DE AUDITPROCEDURE NUCLEAIRE
GENEESKUNDE
Figuur 1 toont een algemeen stroomdiagram van de auditprocedure voor de nucleaire
geneeskunde. Het interne auditproces dient jaarlijks te worden uitgevoerd [1, 2]. In
uitzonderlijke gevallen kan het om een periodieke gebeurtenis gaan, maar die moet altijd een
wezenlijk deel uitmaken van het QM-programma. Het bepalen van een regelmatig tijdschema
voor interne en externe audits moet een onderdeel worden van de agenda van de afdelingen
nucleaire geneeskunde. Het ontwikkelen van een cultuur van voortdurende evaluatie is een
veel grotere uitdaging. Een drukke klinische omgeving mag geen uitvlucht zijn om het
auditproces op te geven. Een QM-programma is van wezenlijk belang voor een betere
patiëntenzorg en is een essentieel hulpmiddel binnen het huidige gezondheidszorgsysteem.
Het biedt ook een objectief hulpmiddel voor prioriteitsstelling en rationele rechtvaardiging in
een wereld met beperkte middelen. De hoofdprioriteit moet altijd zijn het in de klinische
praktijk brengen van de behoeften en de veiligheid van de patiënt.
De verklarende opmerkingen bij het stroomdiagram (Fig. 1) moeten het volgende
omvatten:
(a)
De afdelingen nucleaire geneeskunde moeten jaarlijks worden beoordeeld.
(b)
Individuele elementen van het proces kunnen op verschillende tijdstippen worden
uitgevoerd.
3
Auditteam
Managementbeoordeling
Veiligheids- en risicoevaluatie
Klinische beoordeling
QM-beoordeling
Routine
nucleairgeneeskundige
activiteiten
Ja
Aan de standaard
voldaan ?
Nee
Preventieve/corrigerende acties
Nee
Aan de follow-up
standaard voldaan ?
Ja
FIG 1. Auditelementen
(c)
Een kwaliteitshandleiding of operationele standaardprocedures (SOP’s) moeten
duidelijk en formeel worden opgesteld (bv. schriftelijke operationele procedures,
tabellen van kwantitatief meetbare referentieparameters).
(d)
Wanneer er geen SOP’s zijn, moet het opstellen ervan een prioriteit zijn.
(e)
Er moet een intern auditteam worden samengesteld bestaande uit verschillende
personeelsleden uit uiteenlopende disciplines.
4
(f)
De auditvragenlijst die deel uitmaakt van deze publicatie is zo ontworpen dat interne
en externe revisoren de prestatie van de afdeling kunnen vergelijken met de bestaande
standaarden.
(g)
Na het invullen van de vragenlijst moeten, zoals in deze publicatie gesuggereerd, de
details worden geanalyseerd en samengevat.
(h)
Indien gebreken of non-conformiteiten worden vastgesteld, moeten follow-up acties
en een uitvoeringsschema worden opgesteld. Alle acties moeten worden bepaald en
gedocumenteerd. Afhankelijk van de aard van de vastgestelde problemen, moet
dienovereenkomstig actie worden gepland.
(i)
Dit uitvoeringsplan moet preventieve of corrigerende acties omvatten, die tijdig en
volgens prioriteit moeten worden geïmplementeerd. Indien een mogelijkheid voor
verbetering wordt vastgesteld, moeten overeenstemmende acties worden overwogen
en opgezet als departementale doelen.
(j)
Indien aan de standaarden voldaan is, of preventieve/corrigerende acties met succes
werden uitgevoerd, worden de routineactiviteiten voortgezet tot de volgende geplande
periodieke interne beoordeling wordt uitgevoerd. Dit is niet noodzakelijk de volgende
jaarlijkse beoordeling, maar vroeger indien noodzakelijk (bv. een belangrijke
verandering of de invoering van nieuwe procedures).
(k)
Voor de implementatie van corrigerende acties kan externe hulp/beoordeling nodig
zijn.
(l)
Bovendien moeten een periodieke externe, onafhankelijke beoordeling en evaluatie
deel uitmaken van het QM-systeem van de afdeling nucleaire geneeskunde.
1.7.
PRIORITEITEN STELLEN
Indien mogelijk moeten alle, en niet alleen categorie “A”-vragen worden behandeld.
Alle vastgestelde tekortkomingen of gebreken zijn belangrijk. Om de individuele prioriteiten
voor verandering te helpen bepalen wordt de correctieve samenvatting in drie categorieën
ingedeeld: “Cruciaal”, “Belangrijk” en “Ondergeschikt”. Tekortkomingen die ernstige
implicaties kunnen hebben voor de patiënt krijgen automatisch de prioriteit “Cruciaal” of
“Belangrijk”.
1.8.
BEPERKINGEN
De hierboven vermelde punten zijn niet bestemd voor:
5
1.8.1. Regelgevende doeleinden
De QM-auditteams kunnen niets opleggen maar verstrekken alleen onpartijdig advies
over kwaliteitsverbetering en dit in samenwerking met de afdeling.
1.8.2. Onderzoek van ongevallen
De QM-auditteams onderzoeken geen ongevallen of te melden medische voorvallen
(toedieningsfout). Onderzoek van deze specifieke aspecten vereist een gerichter onderzoek.
1.8.3. Klinisch onderzoek
Dit rapport heeft niet tot doel de geschiktheid van instellingen te evalueren voor
deelname aan klinische onderzoeksstudies, aangezien deze evaluatie wordt uitgevoerd door
collega’s uit de groep die bij de studie betrokken zijn. Deze collega’s richten zich integendeel
op de strikte naleving door een instelling van één enkel, gespecificeerd klinisch protocol
binnen een geselecteerde groep patiënten.
1.8.4. Interdepartementale vergelijking
Deze publicatie is niet bestemd voor interdepartementale vergelijking. Door de
extreme diversiteit op internationaal niveau, moeten de beoordelaars antwoorden in de context
van de verstrekte nucleairgeneeskundige diensten. Het feit dat een afdeling alle vragen van de
evaluatieformulieren beantwoordt, betekent niet dat haar dienst voor nucleaire geneeskunde
beter is dan die van afdelingen die van elke vragenlijst slechts een aantal vragen hebben
kunnen beantwoorden. Niet het aantal maar de kwaliteit van de antwoorden is belangrijk. De
globale kwaliteit hangt af van de sterke en zwakke punten, samen met de kritische
beoordeling van de in de praktijk waargenomen “variabelen”.
1.8.5. Controlelijstbeperkingen
Deze publicatie verstrekt veeleer essentiële controlelijsten dan uitgebreide lijsten.
Daarom moeten de gebruikers de richtlijnen van professionele verenigingen voor nucleaire
geneeskunde raadplegen. Alleen een professioneel oordeel garandeert een adequaat
evaluatieniveau.
6
1.8.6. Verantwoordelijkheid voor verandering
Hoewel het de verantwoordelijkheid van het auditteam is om de tekortkomingen in de
diensten van de gecontroleerde instelling te bespreken, is het niet aan de “overheid”
(ziekenhuisdirectie, nationale overheid, het IAEA) om deze vastgestelde tekortkomingen recht
te zetten.
2. STRUCTUUR VAN DE INTERNE BEOORDELING
2.1.
DOEL
Een interne beoordeling is essentieel om de goede werking van een afdeling nucleaire
geneeskunde te garanderen. Audits moeten regelmatig worden uitgevoerd, minstens eenmaal
per jaar voor interne audits en minstens om de drie jaar voor externe audits. Een uitgebreide
beoordeling van de dienst omvat:
(a)
Het evalueren van belangrijke veranderingen in de structuur en werking van de
afdeling;
(b)
Het helpen bij projectplanning;
(c)
Het helpen bij prebudgettaire planning.
Ze kan ook een wezenlijk deel uitmaken van het goedgekeurde QM-programma.
2.2.
VOORBEREIDING VAN DE AUDIT: VERANTWOORDELIJKHEDEN VAN DE
GEAUDITEERDE INSTELLING
Het welslagen van een audit hangt in hoge mate af van een grondige voorbereiding
door alle betrokken partijen. De webdatabase van het IAEA over nucleaire geneeskunde
(http://www-naweb.iaea.org/nahu/NMDatabase/default.asp)
kan
essentiële
details
verstrekken, maar voor een correcte evaluatie zijn meer operationele en praktijkdetails nodig.
De geauditeerde instelling moet:
-
Gegevens, kwaliteitshandleidingen en relevante documentatie voorbereiden en vóór de
audit voorleggen aan het auditteam zodat de auditeurs hun evaluatie kunnen uitvoeren
volgens het formaat van deze publicatie;
7
-
De volledige afdeling, het ziekenhuisbestuur en andere betrokken relevante personen
en/of instellingen op de hoogte brengen van de audit en het tijdstip ervan;
-
De voor de audit noodzakelijke personeelsleden identificeren en hun deelname
garanderen, hoewel het auditteam vrij is om alle personeelsleden te ondervragen die het
nodig acht;
-
Het auditteam toegang verlenen tot alle voor de audit relevante zones en lokalen;
-
Door het auditteam gevraagde dossiers verstrekken, hoewel het auditteam vrij is alle
gegevens te beoordelen, zelfs vertrouwelijke patiëntengegevens;
-
Klinische, zelfs vertrouwelijke, dossiers van buiten de afdeling verstrekken, die
betrekking hebben op de beoordeelde gevallen;
-
Vergaderingen organiseren met belanghebbenden die noodzakelijk zijn voor een
succesvolle uitvoering van de audit.
2.3.
SAMENSTELLING VAN HET AUDITTEAM
De medisch verantwoordelijke van de afdeling nucleaire geneeskunde (“manager”) is
verantwoordelijk voor het opstellen van de auditprocedure, inclusief de selectie van het hoofd
van het auditteam (Quality Control Administrator of QCA). De QCA selecteert de andere
leden van het auditteam. Het auditteam bestaat uit personeelsleden van de afdeling met een
grondige kennis van de huidige procedures en protocollen binnen de afdeling. Een auditteam
kan uit de volgende leden bestaan: QCA, het hoofd van de afdeling nucleaire geneeskunde,
het hoofd medische stralingsfysica, hoofdtechnoloog (en/of röntgenlaborant), een
vertegenwoordiger van het ziekenhuisbestuur (idealiter van interne beoordeling), een
radiofarmaceut en een vertegenwoordiger van het verplegend personeel. Het is raadzaam om
een onafhankelijke persoon van een andere afdeling van de instelling in het team op te nemen
als vertegenwoordiger van de eindgebruikersgroep (medisch oncoloog, cardioloog,
endocrinoloog, nefroloog, enz.). Een auditteam moet uit minstens drie leden bestaan.
De teamleden moeten over de nodige deskundigheid beschikken en, indien mogelijk,
een basisopleiding hebben gevolgd en een briefing hebben gekregen over audittechnieken.
Het team en het hoofd van de afdeling nucleaire geneeskunde moeten een tijdschema voor de
audit afspreken.
Het is de verantwoordelijkheid van het interne auditteam om alle management- en
operationele informatie te verzamelen, inclusief documentaire bewijzen van de geëvalueerde
punten, bv. voorbeelden van SOP’s en studierapporten, kopieën van gegevens over de
wachttijden van de patiënten, recente informatie over wachtlijsten, kopieën van
kwaliteitscontrolegegevens voor relevante uitrusting, kopieën van waarderings-/
klachtenbrieven, enz.
8
2.4.
LEIDENDE BEGINSELEN EN PROCEDURES
Het volgende is vereist: gestandaardiseerde auditpraktijken, inclusief een eerste
briefing, observatiestijl, garanderen minimumstandaarden, systematische follow-up van de
vragenlijsten, samenvattende bevindingen, een laatste briefing en rapportering.
2.4.1. Eerste briefing
De eerste briefing is nodig om over de te behandelen punten te beslissen, de
auditoriëntatie en verschillende personeelsleden te selecteren en de methoden, doelen en de
details van de audit te bespreken. Indien de gastheer dit vereist, moet het auditteam een
vertrouwelijkheidsdocument ondertekenen. De auditeurs moeten de afdeling geruststellen dat
de vertrouwelijkheid (inclusief van de patiënt) zal worden nageleefd.
2.4.2. Evaluatie
De infrastructuur van de afdeling en het globale programma voor nucleaire
geneeskunde zullen worden gecontroleerd. De infrastructuur omvat het personeel, de
uitrusting en de lokalen. Verder zal de volledige afdeling nucleaire geneeskunde worden
geëvalueerd, van de initiële doorverwijzing van de patiënt, de bereiding van de radiofarmaca,
het voorbereiden van de patiënt, de uitvoering van de procedure en gegevensanalyse tot de
rapportering en follow-up.
Een reeks controlelijsten in deze publicatie is ontworpen om de auditeurs te helpen bij
het organiseren van het auditprogramma om zeker te zijn dat alle relevante punten worden
behandeld. De audit kan tot doel hebben om één of meer elementen van de activiteiten van de
nucleaire geneeskunde te evalueren. De beschikbare hulpmiddelen omvatten:
-
Een volledige rondleiding in de lokalen;
-
De beoordeling en evaluatie van procedures en alle relevante documentatie, inclusief
behandelingsgegevens;
-
Observatie van de praktische implementatie van werkprocedures;
-
Gesprekken met het personeel;
-
Vergadering met het bestuur van de instelling en/of geassocieerde onderwijsinstelling.
2.4.3. Minimumvereisten
Essentieel binnen elke afdeling is de toepassing van gestandaardiseerde praktijken en
professioneel goedgekeurde standaarden. Onlangs heeft het IAEA in de handleiding Nuclear
Medecine Resources [3] een aantal basispraktijken gepubliceerd.
9
TABEL 1. MINIMUMBEROEPSVEREISTEN
Beroep
Vereisten
Specialist in de nucleaire geneeskunde
Diploma geneeskunde en erkende arts met
een postgraduaat van minstens twee jaar
(hoofdvak nucleaire geneeskunde), of
idealiter een masterdiploma (bv. MSc) in
nucleaire geneeskunde.
Technoloog in nucleaire geneeskunde
Bachelor in wetenschappen (BSc) plus een
jaar praktijkkwalificatie of minstens drie
jaar praktijkkwalificatie plus een IAEADAT-certificaat.
Röntgenoloog
BSc met hoofdvak nucleaire geneeskunde.
Medisch stralingsfysicus
Postgraduaat
(MSc)
in
medische
stralingsfysica met hoofdvak nucleaire
geneeskunde.
Hot lab assistent zonder ondersteuning van Nationaal/professioneel erkende opleiding
een bevoegde radiofarmaceut
of
minstens
deelname
aan
een
bekwaamheidsprogramma van het IAEA
met co-assistentschap van drie maanden.
Radiofarmaceutische
wetenschapper
en
radiofarmaceut voor grote instellingen voor
nucleaire
geneeskunde,
inclusief
positronemissietomografiecentra (PET)
Bevoegde en erkende apotheker, idealiter
met postgraduaatsdiploma en ervaring met
radiofarmaca
of
radiofarmaceutisch
wetenschapper met MSc erkend als
vergund of bevoegd persoon.
Verpleegkundige
Bevoegde en erkende verpleegkundige met
een
co-assistenschap
in
nucleaire
geneeskunde
De minimumvereisten voor een inrichting nucleaire geneeskunde omvatten een
duidelijk afgebakende “koude” en “warme” zone. De toegang tot de warme zone moet
beperkt zijn tot bevoegde personen en omvat een hot lab, een injectieruimte, een afzonderlijke
wachtruimte met toiletten voor radioactief geïnjecteerde patiënten, een kamer voor
afvalstoffenbeheer, een kamer voor de hartstresstest (indien van toepassing), een in
vitro/radio-immunoassay laboratorium (indien van toepassing), een diagnosekamer en een
afzonderlijke gemeenschappelijke kamer voor technologen/röntgenologen. Tabel 1 vermeldt
de minimumvereisten voor beroepsprofielen.
2.4.4. Conformiteits- en non-conformiteitsverklaring
Bepaalde onderdelen van het auditformulier zijn zo opgevat dat de geauditeerde
afdeling nucleaire geneeskunde kan worden vergeleken met externe standaarden. Deze
standaarden zijn in drie niveaus ingedeeld:
10
(1)
“A”-standaarden zijn vereist door de wetgeving, technische publicaties van het IAEA
of andere externe standaardiseringsorganen. Daarom wordt het niet halen van een
“A”-standaard als ernstig beschouwd en vereist dit een dringende corrigerende actie.
(2)
“B”-standaarden zijn niet verplicht maar worden verwacht door alle afdelingen te
worden gehaald. Wanneer de standaard niet wordt gehaald is een corrigerende actie
aanbevolen.
(3)
“C”-standaarden zijn wenselijk maar niet essentieel. Corrigerende acties kunnen de
algemene werking van de afdeling verbeteren.
Deze publicatie biedt een werkformaat voor zelfbeoordeling en moedigt een
systematische aanpak aan. Niet alle vragen, zelfs die van categorie “A”, moeten worden
behandeld. Het is veel belangrijker om alle vragen te behandelen die informatie over de
werking en/of dienst verstrekken. Daarom is een antwoord “niet van toepassing (n.v.t.)”
perfect aanvaardbaar en dient dit niet als een slechte prestatie te worden beschouwd.
2.4.5. Leidraad voor auditvragenlijsten
Het best wordt de digitale auditvragenlijst ingevuld. De eigenlijke vragenlijst begint
normaal met algemenere vragen en richt zich vervolgens op specifiekere punten. In de meeste
gevallen moeten opmerkingen worden ingevuld. Specifieke opmerkingen of punten moeten in
de kolom “Opmerkingen/geplande actie” worden vermeld. Vereiste veranderingen kunnen
ook in deze kolom worden vermeld.
Alle gevallen van non-conformiteit moeten worden genoteerd maar de
prioriteitsstelling berust op de impact van deze non-conformiteit op de patiënten. De patiënten
blijven het belangrijkste aandachtspunt van de QM-audit. Onder de rubriek “Overzicht” ziet
de lezer/auditeur de volledige lijst van punten en problemen en kan hij een praktischere
prioriteitenlijst opstellen. De prioriteit kan worden gedefinieerd als “cruciaal”, “belangrijk” of
“ondergeschikt”, wat verschilt van conventionele QM-rapportering, vooral omdat de criteria
gericht zijn op het risico voor de patiënt. De relatieve risico’s en hoe deze risico’s moeten
worden aangepakt worden zeer belangrijk. Om deze risico’s te verminderen zijn duidelijke
oplossingen vereist en daarom is een dergelijke kritische beoordeling noodzakelijk.
De laatste kolom “Realisatiedatum” moet worden ingevuld nadat alle problemen zijn
opgelost en een specifieke actie werd ondernomen. Deze stappen moeten zich lenen tot een
zelfevaluatieproces dat waardevol is voor QM.
11
2.4.6. Laatste briefing
Het is essentieel dat de voorafgaande feedback van de auditeurs wordt
gedocumenteerd en aan iedereen van de afdeling wordt voorgesteld. Na de audit zullen de
auditeurs en het betrokken personeel van de afdeling dat voorafgaand werd ondervraagd,
samenkomen voor een interactieve laatste briefing. Deze laatste briefing voorziet tijd om
vragen te stellen en voor een gedetailleerde en open bespreking van alle bevindingen van de
deskundigen. De instelling moet worden aangemoedigd om onmiddellijk op de evaluatie te
reageren. De stappen die de instelling van plan is te nemen als reactie op de aanbevelingen en
om de activiteiten van de afdeling te verbeteren moeten ook worden besproken en genoteerd.
Vooral bij een geval van non-conformiteit met een “A”-standaard moet het auditteam
duidelijk maken dat dringend een schriftelijk corrigerend actieplan moet worden voorbereid
en naar het auditteam moet worden gezonden voor verdere interactie en advies. Indien van
toepassing, moet de afdeling op de hoogte worden gebracht van haar verantwoordelijkheid om
de regelgevende instanties te verwittigen.
Metingen uitgevoerd als onderdeel van de audit, kopieën van de ingevulde formulieren
en berekeningen moeten in het dossier van de instelling worden bewaard.
2.5.
CONCLUSIE EN RAPPORT
Een nuttig rapport bevat ondubbelzinnig geformuleerde conclusies en duidelijke en
praktische aanbevelingen. Het moet aan de interne vereisten voldoen.
De algemene conclusie van het auditteam kan een van de volgende elementen zijn of
een combinatie ervan:
-
Identificeren van zaken die gemakkelijk kunnen worden verbeterd. Dit kunnen
gemakkelijk te implementeren veranderingen zijn, of belangrijke veranderingen waarvoor
een infrastructuuraanpassing van de instelling nodig is, maar die voor de afdeling
haalbaar zijn. Deze voorstellen zullen in de gedetailleerde aanbevelingen van het
auditteam worden opgenomen.
-
Identificeren van belangrijke problemen die door de afdeling nucleaire geneeskunde niet
kunnen worden opgelost zonder significante hulp en/of bijdrage van andere instellingen
buiten het ziekenhuis of zonder significante middelen.
De ontvangers van het rapport (het hoofd van de afdeling nucleaire geneeskunde)
moeten, idealiter via de ziekenhuisdirecteur, aan het auditteam bevestigen hoe ze plannen het
overeengekomen actieplan te rapporteren om een “A”-non-conformiteit op te lossen.
Aangezien deze gebreken verwijzen naar wettelijke, regelgevende of belangrijke
veiligheidsvereisten, moeten de ontvangers eraan worden herinnerd dat het hun professionele
plicht is een corrigerende actie te ondernemen. Dit kan een beoordeling door de regelgevende
instanties inhouden.
12
Wanneer de afdeling haar expertisegebieden wenst uit te breiden, moeten bijkomende
aanbevelingen worden geformuleerd. Elk dossier moet afzonderlijk worden behandeld.
Hoewel het de verantwoordelijkheid is van het auditteam om de tekortkomingen in de
diensten van de geauditeerde instelling te benadrukken, is het auditteam niet verantwoordelijk
voor het rechtzetten van de vastgestelde gebreken.
2.6.
VERSPREIDING VAN HET RAPPORT
Het volledige rapport moet naar de mensen worden verstuurd die tijdens de laatste
briefing werden geïdentificeerd, bijvoorbeeld de ziekenhuisdirecteur, het hoofd van de
afdeling, het hoofd medische stralingsfysica en andere personeelsleden die belangrijk waren
voor deze audit. De samenvatting van dit rapport kan verschillen van het volledige rapport in
zoverre dat het alleen verwijst naar essentiële, controleerbare feiten en niet naar subjectieve
oordelen. Indien de audit werd uitgevoerd in opdracht van lokale of nationale overheden,
moet het auditrapport hen worden bezorgd voor verspreiding volgens hun voorwaarden. De in
het rapport geformuleerde aanbevelingen moeten aan de respectievelijke instelling en haar
nationale overheid worden gericht. Aanbevelingen aan de overheid moeten beperkt blijven tot
algemene verklaringen, bijvoorbeeld de noodzaak van een follow-upbezoek. Alleen wanneer
de audit wordt uitgevoerd in de context van een lokaal of nationaal ontwikkelingsprogramma,
moeten specifieke interventies voor opleiding of uitrusting worden aanbevolen.
3. BEHEER EN ONTPLOOIING VAN DE HUMAN RESOURCES
3.1. STRATEGIE EN DOELEN
Een duidelijke strategie en doeltreffend beheer zijn essentieel voor het welslagen van
elke onderneming, en nucleaire geneeskunde vormt hier geen uitzondering op.
13
CONTROLELIJST 1. STRATEGIEËN EN BELEID
Nr.
Element
Cat.
3.1.1.
Wordt de dienst voor nucleaire
geneeskunde geleid door specifieke
objectieven ontwikkeld op nationaal
niveau ?
B
3.1.2
Wordt de dienst voor nucleaire
geneeskunde geleid door specifieke
objectieven
ontwikkeld
door
de
ziekenhuisdirectie ?
B
3.1.3
Is de coördinatie met radiologie, oncologie
en cardiologie adequaat ?
C
3.1.4
Beschikt
de
afdeling
nucleaire
geneeskunde
over
een
schriftelijk
organigram ? Is het up-to-date ?
B
3.1.5
Geeft
het
organigram
communicatiekanalen
aan en een hiërarchische structuur binnen
de afdeling nucleaire geneeskunde ?
B
3.1.6
Zijn de specifieke diagnostische beeldvorming en de therapeutische diensten
nucleaire geneeskunde aangepast aan de
grootte en het toepassingsgebied van de
klinische dienst van het ziekenhuis ?
B
3.1.7
Omvatten de doelstellingen van de dienst
nucleaire geneeskunde het behandelen van
dringende aanvragen ?
B
3.1.8
Omvatten de doelstellingen van de dienst
nucleaire geneeskunde het verstrekken en
de handhaving van hogekwaliteitszorg via
klinische audit en kwaliteitscontrole ?
A
3.1.9
Heeft de afdeling een businessplan ?
B
3.1.10
Heeft de afdeling een strategie betreffende
nieuwe ontwikkelingen in behandeling en
diagnose ?
B
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
14
CONTROLELIJST 1. STRATEGIEËN EN BELEID (vervolg)
Nr.
Element
Cat.
3.1.11
Indien het ziekenhuis zelf niet het
volledige gamma aan diensten in de
nucleaire geneeskunde aanbiedt, heeft de
afdeling dan een strategie/beleid om
patiënten door te verwijzen naar andere
diagnostische onderzoeken ergens anders,
zoals vereist voor een adequate
patiëntenzorg ?
B
3.1.12
Waar diensten worden aangeboden in
satellietcentra (bv. technische en klinische
ondersteuning voor andere ziekenhuizen),
is de verantwoordelijkheid hiervoor
duidelijk bepaald?
B
3.2.
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
ADMINISTRATIE EN BEHEER
Administratie en beheer zijn essentieel voor een doeltreffende en succesvolle
onderneming; dit geldt ook voor de nucleaire geneeskunde.
CONTROLELIJST 2. ADMINISTRATIE EN BEHEER
Nr.
Element
Cat.
3.2.1
Worden de werkprocedures in de
onthaalruimten regelmatig nagekeken ?
B
3.2.2
Bestaat er een protocol voor de
behandeling
van
onvolledige
aanvraagformulieren ?
B
3.2.3
Welke kwaliteitsfactoren zijn van kracht
om aanvraagpieken het hoofd te bieden ?
B
3.2.4
Worden alle aanvragen beoordeeld,
gerechtvaardigd en goedgekeurd door een
arts in de nucleaire geneeskunde ?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
15
CONTROLELIJST 2. ADMINISTRATIE EN BEHEER (vervolg)
Nr.
Element
Cat.
3.2.5
Beschikt de afdeling over schriftelijke
SOP’s voor alle taken, inclusief
operationele, administratieve, technische
en klinische taken ?
A
3.2.6
Identificeren de SOP’s het niveau van
bekwame operators/professionals ?
A
3.2.7
Ligt de eindverantwoordelijkheid voor een
procedure voor nucleaire geneeskunde bij
een speciaal bevoegde arts ?
A
3.2.8
Is er een regelmatig nazicht van het QM
door
een
aangestelde
medische
stralingsfysicus ?
A
3.2.9
Is er een regelmatig nazicht van het QM
door een erkende apotheker ?
A
3.2.10 Is er een mechanisme om tekortkomingen
of gebreken aan te pakken ?
B
3.3.
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
ONTWIKKELING VAN DE HUMAN RESOURCES
De human resources zijn de werknemers van een onderneming met hun kennis,
vaardigheden, creatieve mogelijkheden, talenten en aanleg. De human resources zijn de spil
van een onderneming en sturen alle andere middelen van het bedrijf. Dit geldt ook voor de
nucleaire geneeskunde.
16
CONTROLELIJST 3. ONTPLOOIING VAN DE HUMAN RESOURCES
Nr.
Element
Cat.
3.3.1.
Hebben alle personeelsleden een passende
opleiding genoten en zijn ze bevoegde
specialisten voor hun functiebeschrijving ?
B
3.3.2.
Bezitten alle personeelsleden van de
afdeling
een
schriftelijke
functiebeschrijving waarin hun taken en
verantwoordelijkheden
duidelijk
omschreven staan ?
B
3.3.3.
Is er een permanente professionele
opleiding en ontwikkeling voor alle
personeelscategorieën ?
B
3.3.4.
Zijn
er
gespecialiseerde
opleidingsprogramma’s voor technologen
in de nucleaire geneeskunde of
röntgenologen om in de nucleaire
geneeskunde te werken ?
B
3.3.5.
Zijn alle personeelsleden van het “hot lab”
opgeleid in de veilige manipulatie van
radiofarmaca ?
B
3.3.6.
Zijn
er
geschikte
hulpmiddelen
beschikbaar voor objectieve controle van
de opleidingen ?
B
3.3.7.
Vindt
er
een
regelmatige
prestatiebeoordeling
plaats
om
opleidingsbehoeften te identificeren ?
B
3.3.8.
Is er een regelmatige professionele
opleiding in stralingsveiligheid en
-bescherming ?
B
3.3.9.
Hebben de werknemers toegang tot online
leren, up-to-date boeken en tijdschriften ?
B
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
17
4. RISICOBEHEER
4.1. CONFORMITEIT MET VOORSCHRIFTEN
REGELGEVING EN VEILIGHEID
BETREFFENDE
STRALING,
De naleving van alle relevante wettelijke voorschriften en een goede stralingspraktijk
zijn van het allergrootste belang in de nucleaire geneeskunde.
CONTROLELIJST 4. CONFORMITEIT MET VOORSCHRIFTEN BETREFFENDE
STRALING, REGELGEVING EN VEILIGHEID
Nr.
Element
Cat.
4.1.1.
Is de afdeling formeel gemachtigd door
een erkende nationale overheidsinstantie ?
A
4.1.2.
Verwijzen de stralingsvoorschriften naar
nationale richtlijnen of maken ze een
kruisverwijzing
naar
internationale
voorschriften ?
A
4.1.3.
Hebben alle personeelsleden getekend om
te bevestigen dat ze de lokale
voorschriften gelezen en begrepen hebben
?
A
4.1.4.
Zijn
alle
radioactieve
bronnen
geïdentificeerd en op een adequate manier
gestockeerd ?
A
4.1.5.
Worden
ingekapselde
ijkbronnen
periodiek gecontroleerd en gecontroleerd
op lekkage ?
A
4.1.6.
Wordt het personeel van de afdeling
nucleaire
geneeskunde
routinematig
gecontroleerd op stralingsblootstelling
inclusief:
- Thermoluminescentiedosimetriebadges;
- Hand-/vingercontrole van het personeel
belast met de injecties;
- Hand-/vinger- en af en toe oogcontrole
van het hot lab personeel ?
A
4.1.7.
Zijn
er
beschermende
kleding,
handschoenen,
spuithulzen,
manipulatietangen, enz. beschikbaar?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
18
CONTROLELIJST 4. CONFORMITEIT MET VOORSCHRIFTEN BETREFFENDE
STRALING, REGELGEVING EN VEILIGHEID (vervolg)
Nr.
Element
Cat.
4.1.8.
Zijn er geschikte voorzieningen voor de
toediening van radiofarmaca, therapie en
radioactieve aerosols ?
B
4.1.9.
Zijn er ruimtes geclassificeerd als
“ingedeeld” of “gecontroleerd” volgens de
basisnormen inzake de bescherming tegen
straling (BSS) [4] en/of lokale wettelijke
voorschriften ?
A
4.1.10. Is er een procedure voor mors- of
contaminatie-incidenten ?
A
4.1.11. Zijn er middelen om toegang van
onbevoegde personen tot ingedeelde en
gecontroleerde ruimtes te voorkomen ?
A
4.1.12. Zijn aan de ingang van ingedeelde en
gecontroleerde ruimtes duidelijk zichtbare
stralingssymbolen aangebracht (in de
lokale taal/talen) ?
A
4.1.13. Krijgt al het personeel van de afdeling
wanneer het op de dienst nucleaire
geneeskunde begint te werken instructies
en een opleiding over de lokale procedures,
veiligheidsvoorzorgsmaatregelen voor de
bescherming van de patiënt en het
personeel ?
A
4.1.14. Worden formele risicoanalyses en/of
-controles uitgevoerd van de afdeling en de
uitrusting door aangewezen personeel?
A
4.1.15. Zijn er geschikte geijkte en functionele
stralingsmeetapparatuur beschikbaar ?
A
4.1.16. Zijn er gedetailleerde procedures voor de
manipulatie van patiëntenstalen (bloed,
urine, enz.) ?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
19
CONTROLELIJST 4. CONFORMITEIT MET VOORSCHRIFTEN BETREFFENDE
STRALING, REGELGEVING EN VEILIGHEID (vervolg)
Nr.
Element
Cat.
4.1.17. Zijn er formele procedures voor het
verwijderen van vloeibaar en vast
radioactief afval?
A
4.1.18. Wordt de hoeveelheid afval routinematig
gecontroleerd tegenover de toegestane
hoeveelheid?
A
4.1.19. Is er een beleid inzake het transport van
radioactief materiaal?
A
4.2.
Ja/
Neen
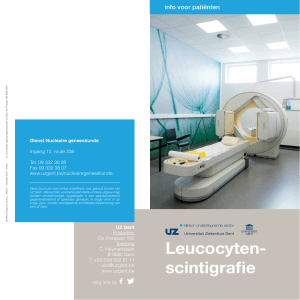
Opmerkingen/
geplande actie
Realisatie
datum
STRALINGSBESCHERMING VAN DE PATIËNT
Patiëntgerichte dienstverlening is fundamenteel voor het welslagen van nucleaire
geneeskunde en omvat alle gepaste overwegingen inzake stralingsbescherming van de patiënt.
CONTROLELIJST 5. STRALINGSBESCHERMING VAN DE PATIËNT
Nr.
Element
Cat.
4.2.1.
Zijn er SOP’s om patiënten correct te
identificeren vóór de toediening van
radiofarmaca?
A
4.2.2.
Zijn er SOP’s om te informeren of
vrouwen die kinderen kunnen krijgen
zwanger zijn of borstvoeding geven?
A
4.2.3.
Krijgen
patiënten
schriftelijke
en
mondelinge instructies vóór en na de
toediening van radiofarmaca?
B
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
20
CONTROLELIJST 5. STRALINGSBESCHERMING VAN DE PATIËNT (vervolg)
Nr.
Element
Cat.
4.2.4.
Wordt de activiteit in elke patiëntendosis
gemeten vóór toediening en genoteerd in
het patiëntendossier ?
A
4.2.5.
Is er een SOP om na te gaan of de
activiteitsdosissen niet hoger zijn dan de
referentiewaarden in de BSS [4], de
nationale of internationale voorschriften of
richtlijnen ?
A
4.2.6.
Is er in de instelling een adequaat
opgeleide persoon beschikbaar die de
effectieve stralingsdosis voor patiënten
kan berekenen na toediening van
radiofarmaca ?
C
4.2.7.
Zijn voor het personeel schriftelijke
instructies beschikbaar om te beslissen
wanneer patiënten te ontslaan na
toediening van de therapie ?
B
4.2.8.
Zijn er adequate SOP’s om het risico van
een verkeerde toediening van radiofarmaca
tot een minimum te herleiden ?
B
4.2.9.
Zijn er adequate SOP’s om het risico van
multiple blootstellingen tot een minimum
te herleiden ?
B
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
21
4.3.
EVALUATIE EN KWALITEITSBEWAKINGSSYSTEEM
Kwaliteitshandleidingen en –systemen moeten regelmatig worden herzien om hun
conformiteit met de standaarden te garanderen.
CONTROLELIJST 6. EVALUATIE EN KWALITEITSBEWAKINGSSYSTEEM
Nr.
Element
Cat.
4.3.1.
Zijn er standaarden bepaald voor de dienst
nucleaire geneeskunde, bij voorkeur onder
de vorm van een kwaliteitshandboek
(omvat operationele stroomdiagrammen,
SOP’s, enz.) ?
B
4.3.2.
Zijn er systemen om de conformiteit met
standaarden
te
controleren,
met
gedefinieerde aanvaardbaarheidscriteria ?
B
4.3.3.
Voert
de
afdeling
zelfevaluaties/audits uit ?
regelmatig
B
4.3.4.
Is er een systeem om de klanttevredenheid
en de tevredenheid van de doorverwijzende
artsen te evalueren ?
B
4.3.5.
Is er een SOP om gevallen van nonconformiteit aan te pakken, inclusief
noteren en correctie/preventie ?
B
4.3.6.
Is er een mechanisme voor het monitoren
van gegevens om kwaliteitsverbetering te
garanderen ?
B
4.3.7.
Zijn alle personeelsleden betrokken bij de
formele beoordeling en controle van de
kwaliteit ?
B
4.3.8.
Wordt alle apparatuur aangekocht na
vergelijking met technische specificaties
opgesteld door een bevoegd persoon in
samenspraak met de gebruikers ?
B
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
22
CONTROLELIJST 6. EVALUATIE EN KWALITEITSBEWAKINGSSYSTEEM (vervolg)
Nr.
Element
Cat.
Worden deze specificaties gebruikt voor de
acceptatietests van de apparatuur ?
B
4.3.10. Is er een kwaliteitsbewakingsprogramma,
met regelmatige ijking en inspectie van alle
uitrusting (bv. dosiscalibrator, bèta- en
gammatellers,
stralingscontrolemonitors,
planaire en tomografische gammacamera’s,
PET- en PET/computertomografie (CT)scanners, schildkliertellers, gammasondes,
aerosoltoedieningssystemen, enz.) conform
de BSS [4], internationale en lokale
standaarden en voorschriften ?
A
4.3.11. Worden de resultaten van alle hierboven
vermelde QM-programma’s geregistreerd,
geëvalueerd en regelmatig nagezien ?
B
4.3.12. Is er een procedure om te garanderen dat
apparatuur of materiaal dat voor een
kwaliteitstest faalt, niet wordt gebruikt
tenzij specifiek toegestaan door een
aangewezen personeelslid ?
A
4.3.13. Zijn
er
actieniveaus
en
verantwoordelijkheden gedefinieerd om te
bepalen wanneer apparatuur moet worden
hersteld, vervangen of uit dienst worden
genomen ?
A
4.3.14. Zijn er onderhouds-, herstellings- en
vervangingsplannen voor alle belangrijke
apparatuur (extern of intern) ?
B
4.3.15. Neemt de afdeling deel aan externe QMprogramma’s ?
B
4.3.9.
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
23
4.4.
KWALITEITSCONTROLE VOOR BEELDVORMINGSAPPARATUUR
In de nucleaire geneeskunde is een uitgebreid kwaliteitscontrolesysteem voor alle
beeldvormingsapparatuur
essentieel
voor
optimale
nucleairgeneeskundige
patiëntenonderzoeken. De onderstaande lijst is niet volledig maar is veeleer een essentiële
controlelijst.
CONTROLELIJST 7. KWALITEITSCONTROLE VOOR
BEELDVORMINGSAPPARATUUR
Nr.
Element
Cat.
4.4.1.
Zijn er beleidsdocumenten en protocollen
inzake de bediening, de kwaliteitscontrole
en
-bewaking
voor
alle
beeldvormingsapparatuur voor klinisch
gebruik?
B
4.4.2.
Zijn deze beleidsdocumenten conform de
handleidingen van de fabrikanten?
A
4.4.3.
Zijn er documenten die de werkelijke
resultaten van kwaliteitscontrole en
metingen van de prestatie van de
gammacamera nauwkeurig beschrijven ?
B
4.4.4.
Is er een beleidsdocument voor het
specificeren, het aankopen en testen van
nieuwe beeldvormingsapparatuur ?
B
4.4.5.
Is er een regelmatige fysieke controle van
de hardware inclusief de detectorkop(pen),
bescherming, enz. ?
A
4.4.6.
Is er een regelmatige controle, beoordeling
van resultaten en trendanalyse van:
- Uniformiteit;
- Intrinsieke uniformiteit;
- Intrinsieke uniformiteit versus
energievensters;
- Intrinsieke uniformiteit voor
verschillende energieën;
- Systeemuniformiteit ?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
24
CONTROLELIJST 7. KWALITEITSCONTROLE VOOR
BEELDVORMINGSAPPARATUUR (vervolg)
Nr.
4.4.7.
Element
Is er een regelmatige controle, nazien van
resultaten en trendanalyse van:
- Spatiale resolutie;
- Intrinsieke spatiale resolutie (kwalitatief);
- Intrinsieke spatiale resolutie
(kwantitatief);
- Spatiale systeemresolutie (kwalitatief);
- Spatiale systeemresolutie (kwantitatief)?
4.4.8. Is er een regelmatige controle, nazien van
resultaten en trendanalyse van:
- Spatiale lineariteit (distorsie);
- Intrinsieke spatiale lineariteit;
- Spatiale systeemlineariteit?
4.4.9. Is er een regelmatige controle, nazien van
resultaten en trendanalyse van:
- Telsnelheid;
- Intrinsieke telsnelheid;
- Max. telsnelheid;
- Systeemtelsnelheid;
4.4.10. Is er een regelmatige controle, nazien van
resultaten en tendensanalyse van:
- Systeemgevoeligheid;
- Gevoeligheid voor een puntbron;
- Gevoeligheid voor een vlakke bron
4.4.11. Is er een regelmatige controle, nazien van:
- Spatiale registratie van verschillende
energievensters;
- Hoekafhankelijkheid;
- Spatiale resolutie van een volledige
lichaamsscan?
Cat.
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
A
A
A
A
A
25
4.5.
COMPUTERSYSTEMEN EN GEGEVENSVERWERKING
Computers nemen al jarenlang een centrale plaats in in de nucleaire geneeskunde,
vooral omdat het bekomen van functionele informatie gewoonlijk de beeldanalyse van de
patiënt vereist.
CONTROLELIJST 8. COMPUTERSYSTEMEN EN GEGEVENSVERWERKING
Nr.
Element
Cat.
4.5.1.
Is er een beleid voor de aankoop en het
installeren van computers en de acceptatie
van hardware en software?
B
4.5.2.
Is er een schriftelijk beleid inzake
computer hardware- en software-upgrades?
B
4.5.3.
Is er een schriftelijke procedure voor de
evaluatie van gegevensintegriteit na een
belangrijke softwarerevisie voor:
- Telverliezen;
- Dataframing;
- Beeldkwantificatie;
- Beeldberekening;
- Berekening tijd-activiteitscurve?
B
4.5.4.
Is er een QM-beleid voor interne software?
B
4.6.
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
ACCEPTATIETESTS
De eerste cruciale stap na de installatie van de beeldvormingsapparatuur is de initiële
evaluatie of acceptatietest. Dit omvat niet alleen de bevestiging dat het instrument werkt
volgens de specificaties, maar ook de evaluatie van zijn prestatie onder omstandigheden die
zich voordoen in de klinische praktijk. Deze tests moeten onafhankelijk van de tests van de
fabrikant worden uitgevoerd. Ondersteunende elementen bevinden zich in de Nuclear
Medicine Resources Manual van het IAEA [3].
Deze tests moeten onmiddellijk na de installatie worden uitgevoerd. De gebruiker mag
geen instrument aanvaarden dat niet conform is aan zijn specificaties. Instrumenten die na
acceptatietests niet optimaal blijken te werken mogen niet routinematig worden gebruikt. Op
voorwaarde dat de apparatuur werkt volgens de specificaties en veilig blijkt, moet een beperkt
aantal patiëntenonderzoeken worden uigevoerd als onderdeel van de acceptatieprocedure.
26
Acceptatietests vereisen speciale testapparatuur, fantomen en evaluatiesoftware.
Testmetingen zijn essentieel om de resultaten met de specificaties te vergelijken en
aanvangswaarden te verkrijgen voor toekomstige vergelijking. Daarom is het aanbevolen dat
de verkoper gespecialiseerde instrumenten en software voorziet om de acceptatietests uit te
voeren, en dat deze tests ter plaatse worden uitgevoerd door de ingenieur van het bedrijf onder
toezicht van de gebruiker. De gebruiker kan verkiezen om bijkomende tests uit te voeren om
de prestaties van de apparatuur te bevestigen. Hij kan deze resultaten gebruiken als referentie
voor toekomstige kwaliteitscontroles.
Indien nodig, dient de gebruiker een competente deskundige uit te nodigen om aan de
acceptatietests en de evaluatie van de resultaten deel te nemen. De onderstaande lijst is niet
volledig maar is veeleer een essentiële controlelijst.
CONTROLELIJST 9. ACCEPTATIETESTS
Nr.
Element
Cat.
4.6.1.
Is er een beleid voor de aankoop van CEgemarkeerde apparatuur of apparatuur die
door een nationale instantie (vergelijkbaar
met het FDA) is beoordeeld?
A
4.6.2.
Is dit beleid conform met publicaties van
het IAEA/International Electrotechnical
Commission (IEC)/National Electrical
Manufacturers Association (NEMA) en de
handleiding van de fabrikant?
A
4.6.3.
Is er documentatie die de offerte vergelijkt
met de eigenlijke levering?
B
4.6.4.
Hoe doorstaan de testresultaten van de
fabrikant de vergelijking met de
onafhankelijke acceptatietests?
B
4.6.5.
Worden intrinsieke NEMA-procedures
uitgevoerd voor:
- Energieresolutie;
- Flood field-uniformiteit;
- Spatiale resolutie;
- Spatiale lineariteit;
- Telsnelheid (incl.maximale telsnelheid);
- Spatiale registratie van verschillende
energievensters
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
27
CONTROLELIJST 9. ACCEPTATIETESTS (vervolg)
Nr.
Element
Cat.
4.6.6.
Worden extrinsieke (systeem) NEMAprocedures uitgevoerd voor:
- Flood field-uniformiteit;
- Spatiale resolutie met en zonder
strooistraling;
- Gevoeligheid vanelke collimator;
- Shielding van de detectorkop ?
A
4.6.7.
Worden de volgende acceptatietests voor
enkelvoudige
fotonemissiecomputertomografie (SPECT)
(non-NEMA) uitgevoerd voor:
- SPECT-rotatiecentrum;
- Angulaire lineariteitsfouten;
- Uniformiteit;
Uniformiteit tomografische coupes;
Rotatie-uniformiteit;
- Systeemvolumegevoeligheid (NEMA);
- Tomografische resolutie;
Tomografische resolutie in lucht
(NEMA);
Tomografische resolutie in een
verstrooiingsmedium (NEMA);
- Coupediktetest (IAEA);
- Controle van het totale
prestatievermogen (spectrumfantoom
(American Association of Physicists in
Medicine (AAPM))):
Tomografische uniformiteit;
Tomografische resolutie (bolvormig,
staafvormig);
Contrast ?
A
4.6.8.
Worden specifieke tests uitgevoerd voor
multipele detectorsystemen voor:
- Multipele detectorregistratie;
- Vergelijking gevoeligheid;
- Vergelijking beeldpuntkalibratie
- Vergelijking rotatiecentrum?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
28
5. ALGEMENE KLINISCHE DIENSTEN
Diensten nucleaire geneeskunde verschillen van land tot land, maar cardiologische en
nucleair oncologische onderzoeken worden gewoonlijk het meeste uitgevoerd. In bepaalde
regio’s zijn nieronderzoeken, infectielocalisaite en zelfs lever-miltscans nog altijd zeer
belangrijk. Een groot aantal hiervan wordt vermeld in de Nuclear Medicine Resources Manual
van het IAEA [3] (paragraaf 5).
Het plannen van een afdeling nucleaire geneeskunde moet worden voorafgegaan door
een onderzoek van de bevolkingsdemografie en de ziekteprevalentie in het land. Deze
gegevens en analyse laten toe prioriteiten te stellen en een aan de behoeften aangepaste dienst
voor nucleaire geneeskunde te plannen. Aangezien op een afdeling nucleaire geneeskunde
zowel gehospitaliseerde als ambulante patiënten worden behandeld, moet de inrichting voor
beide groepen goed toegankelijk zijn.
De volgende richtlijnen zijn nuttig voor de werking van een afdeling nucleaire
geneeskunde:
(a)
Het beleid van de afdeling moet schriftelijk vastgelegd worden en uitgelegd worden
aan het personeel. Er moet een duidelijke hiërarchische structuur zijn die zichtbaar
moet gemaakt worden.
(b)
Een kopie van de procedurehandleiding moet beschikbaar zijn in alle
beeldvormingszalen en het technische personeel moet over deze procedures worden
gebriefd.
(c)
De voorbereidingsformulieren voor de patiënten moeten gemakkelijk toegankelijk zijn
voor de receptionist en de persoon die de onderzoeken plant.
(d)
Aanvraagformulieren voor nucleaire geneeskunde omvatten: patiënteninformatie
(inclusief naam, leeftijd, geslacht, ziekenhuisidentificatienummer, adres en
telefoonnummer); het medische profiel van de patiënt (inclusief naam, adres en
telefoonnummer van de verwijzende arts, klinische achtergrond en klinische
gegevens) en voorafgaande diagnosen en vereiste tests. Artsen in de nucleaire
geneeskunde moeten de kwaliteit van elke aanvraag onderzoeken. Vóór uitvoering van
het onderzoek moeten ze het rechtvaardigen en goedkeuren en, indien van toepassing,
aanpassen na overleg met de verwijzende arts. Op de aanvraagformulieren moet een
ruimte voorzien zijn voor de goedkeuring van het onderzoek door de arts, gebruikte
radiofarmaca evenals de dosering en de toedieningsweg. Het formulier moet worden
ondertekend door de betrokken persoon/personen. Tijdens het gesprek moeten de
patiënten, in aanwezigheid van een getuige, het correcte toestemmingsformulier
(indien van toepassing – specifiek voor de therapiedosis) ondertekenen. De gegevens
van de patiënt moeten worden nagekeken en de bevindingen van andere
beeldvormingsmodaliteiten worden gecontroleerd. Iedere speciale technische
wijziging moet op het aanvraagformulier worden vermeld voor nazicht door het
technisch personeel.
29
5.1.
ALGEMENE ASPECTEN – KLINISCHE DIENSTEN
De bedoeling van deze paragraaf is het nazien van de aspecten van klinische diensten.
CONTROLELIJST 10. ALGEMENE ASPECTEN – KLINISCHE DIENSTEN
Nr.
Element
Cat.
5.1.1.
Worden de BSS-principes toegepast in de
klinische diensten nucleaire geneeskunde ?
A
5.1.2.
Is er een regelmatig nazicht van de
tijdslijnen van boeking tot uitvoering van
de scan en rapportering ?
B
5.1.3.
Zijn er artsen beschikbaar om de vragen
van de patiënt te beantwoorden ?
B
5.1.4.
Is er een patiëntenbewakingssysteem
tijdens het verblijf van de patiënt op de
afdeling nucleaire geneeskunde ?
B
5.1.5.
Is er een specifiek beleid voor pediatrische
patiënten op de afdeling nucleaire
geneeskunde inclusief dosisaanpassing,
verdoving, enz. ?
A
5.1.6.
Is er een gepaste medische supervisie
tijdens
de
nucleairgeneeskundige
interventies
zoals
diuretica, ACEremmers, enz. ?
A
5.1.7.
Wordt er medisch advies verstrekt vόόr het
verkrijgen
van
de
geïnformeerde
toestemming van de patiënt – meer
specifiek voor therapie ?
B
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
30
5.2.
KLINISCHE PROCEDURES - DIAGNOSTIEK
5.2.1. Beeldvormingsprocedures
De instelling moet het auditteam gedetailleerde informatie verstrekken over hetgeen
volgt voor elk type klinische procedure, bv. planaire, dynamische of tomografische
onderzoeken. Verschillende voorbeelden van minstens de volgende onderzoeken moeten
worden opgenomen: schildklierscan (en/of andere planaire scintigrafie), botscan van het
volledige lichaam, renografie, verschillende soorten tomografische onderzoeken (bv. bot,
tumor) myocardiale perfusie met planaire en/of SPECT-scan. Voor bijkomende details zie
hoofdstuk 5 van de Nuclear Medecin Resources Manual [3].
5.2.2. Evaluatie van klinische beeldvormingsonderzoeken
-
Klinisch probleem. Bij de evaluatie van deze parameter moeten de auditeurs met minstens
één van de volgende punten rekening houden: de geschiktheid van de klinische aanvraag;
informatie over vroegere interventies en diagnostische onderzoeken.
-
Voorbereiden van de patiënt. Bij de evaluatie van deze parameter moeten de auditeurs
met minstens de volgende punten rekening houden: werd de juiste informatie verstrekt ?
Werd informatie verkregen over zwangerschap/borstvoeding, hydratatie, vasten, enz. ?
Problemen in verband met de therapie die het onderzoek zouden kunnen beïnvloeden
moeten worden genoteerd. Werd een geïnformeerde toestemming verkregen, vooral voor
radionuclidentherapie ?
-
Radiofarmaca. Bij de evaluatie van deze parameter moeten de auditeurs met minstens één
van de volgende punten rekening houden: werd het correcte radiofarmacon gekozen ? Is
de activiteit conform de nationale/internationale richtlijnen ? Welke QC-procedures
worden uitgevoerd ? Welke maatregelen waren van kracht, bijvoorbeeld
patiëntenidentificatie, lezen van het etiket op de spuit, enz. om verkeerde toediening te
voorkomen (radiofarmacon en activiteit) ?
-
Acquisitieparameters. Bij de evaluatie van deze parameter moeten de auditeurs met
minstens de volgende punten rekening houden: soort onderzoek (planair versus SPECT,
statisch versus dynamisch, enz.); apparatuuropstelling (collimator, matrixgrootte, totaal
aantal tellen/acquisitietijd, enz.).
-
Parameterverwerking, indien van toepassing. Bij de evaluatie van deze parameter moeten
de auditeurs met minstens het volgende punt rekening houden: werd het correcte
gevalideerde algoritme voor beeldreconstructie en analyse gekozen ?
-
Beelden. Bij de evaluatie van deze parameter moeten de auditeurs met minstens de
volgende punten rekening houden: volledigheid van het uitgevoerde onderzoek; artefacts
ten gevolge van de camera-acquisitietechniek; patiëntgerelateerde factoren; algemene
kwaliteit; en onverwachte biologische distributie van het radiofarmacon.
31
-
Eindrapport. Bij de evaluatie van deze parameter moeten de auditeurs met minstens het
volgende punt rekening houden: Evalueren of het rapport conform is met de
nationale/internationale richtlijnen en beantwoordt aan de klinische vraag.
-
Feedback, indien beschikbaar. (correlatieve beeldvorming, andere klinische onderzoeken,
definitieve klinische en/of histopathologische diagnose enz.).
5.2.3. Beoordeling klinische praktijken
Klinische procedures moeten worden geëvalueerd met toepassing van de criteria van
evidence-based geneeskunde, conform internationaal goedgekeurde standaarden, gepubliceerd
in richtlijnen en up-to-date literatuur. De onderzoeken moeten aan de hand van deze
standaarden worden geëvalueerd en in de volgende categorieën ingedeeld:
-
Graad I: Volledig conform met de gepubliceerde (nationale, internationale) richtlijnen;
-
Graad II: Aanvaardbaar, maar kan worden verbeterd om aan Graad I te voldoen;
-
Graad III: Niet conform de criteria van goede klinische praktijk.
Gebruik voor interne audits deze evaluaties om de kwaliteit van uw klinische
onderzoeken te beoordelen. Externe auditeurs volgen hetzelfde proces om de hen
voorgestelde onderzoeken te evalueren.
Aanbevelingen: Voor diagnostische procedures moeten voor graad III verbeteringen
aangebracht worden binnen vier weken en voor graad II moeten verbeteringen aangebracht
worden binnen zes maanden.
5.2.4. Diagnostische beeldvormingsprocedures – Eindoverzichtstabel
Om de goede klinische praktijk te evalueren moet een selectie van elk verschillend
type onderzoek worden gemaakt.
32
33
Typestudie
Schildklier
Bot
Renografie
Bvb bot
MPS
Typeonderzoek
Planair
Planair volledig
lichaam
Dynamisch
SPECT
Cardiale SPECT
Klinisch
probleem
Voor
bereiding
patiënt
Radiofar
macon en
activiteit
Acquisitie
parameters
Verwer
kingspar
ameters
Beelden
CONTROLELIJST 11. SAMENVATTING BEELDVORMINGSDIAGNOSEPROCEDURES
Eindrapport
Aanbeve
lingen
5.2.5. Klinische procedures – Niet-beeldvormingsprocedures
Indien niet-beeldvormingsprocedures worden uitgevoerd, moeten onderzoeken
beschikbaar worden gesteld met informatie over hetgeen volgt voor elk type procedure. Meer
specifiek moeten de volgende onderzoeken worden opgenomen: glomerulaire
filtratiesnelheidsbepaling (GFR), bloedvolumes, Schilling test en lymfoscintigrafie van de
sentinel node.
5.2.5.1.
Evaluatie van klinische niet-beeldvormingsonderzoeken
-
Klinisch probleem. Bij de evaluatie van deze parameter moeten de auditeurs met minstens
de volgende punten rekening houden: de geschiktheid van de klinische aanvraag;
informatie over vroegere interventies en diagnostische onderzoeken, enz.
-
Voorbereiden van de patiënt. Bij de evaluatie van deze parameter moeten de auditeurs
met minstens de volgende punten rekening houden: werd de juiste informatie verstrekt ?
Werd informatie verkregen over zwangerschap/borstvoeding, hydratatie, vasten, enz. ?
Problemen in verband met de therapie die het onderzoek zouden kunnen beïnvloeden
moeten worden genoteerd. Werd een geïnformeerde toestemming verkregen (indien van
toepassing) ?
-
Radiofarmaca. Bij de evaluatie van deze parameter moeten de auditeurs met minstens de
volgende punten rekening houden: correcte keuze van het radiofarmacon; toegediende
activiteit
conform
de
nationale/internationale
richtlijnen;
QC-procedures;
patiëntidentificatie; voorkomen van verkeerde toediening (radiofarmacon en toegediende
activiteit).
-
Studieprotocol. Bij de evaluatie van deze parameter moeten de auditeurs met minstens het
volgende punt rekening houden: leeft het studieprotocol de nationale/internationale
richtlijnen na?
-
Berekeningsmethoden, indien van toepassing. Bij de evaluatie van deze parameter moeten
de auditeurs met minstens het volgende punt rekening houden: correcte keuze van
gevalideerd algoritme voor gegevensanalyse.
-
Eindrapport. Bij de evaluatie van deze parameter moeten de auditeurs met minstens het
volgende punt rekening houden: is het rapport conform met de nationale/internationale
richtlijnen en beantwoordt het aan de klinische vraag?
-
Feedback, indien beschikbaar. (bijvoorbeeld andere klinische onderzieken, definitieve
klinische en/of histopathologische diagnose, enz.).
5.2.5.2.
Diagnostische niet-beeldvormingsprocedures – Eindoverzichtstabel
Om de goede klinische praktijk te evalueren moet een selectie van elk verschillend
type van niet-beeldvormingsonderzoek worden gemaakt.
34
35
IJzerkinetiek
Schildwachtklier
Rodeceloverleving
Bloedvolumes
Test van Schilling
GFR
Type studie
Klinisch
probleem
Voor
bereiding
patiënt
Radiofar
macon en
activiteit
Studieprotocol
Berekenings
methoden
Eind
rapport
CONTROLELIJST 12. SAMENVATTING NIET-BEELDVORMINGSDIAGNOSEPROCEDURES
Aanbevelingen
5.3.
RADIONUCLIDENTHERAPIE
De bedoeling van deze paragraaf is het nazien van de essentiële aspecten van de dienst
radionuclidentherapie.
CONTROLELIJST 13. ALGEMENE ASPECTEN – DIENST
RADIONUCLIDENTHERAPIE
Nr.
Element
Cat.
5.3.1.
Worden de BSS-principes toegepast in de
dienst voor radionuclidentherapie van de
afdeling nucleaire geneeskunde?
A
5.3.2.
Is er een schriftelijke SOP voor de dienst
radionuclidentherapie?
B
5.3.3.
Wordt de juistheid van de klinische indicaties
voor de vereiste therapie beoordeeld en
goedgekeurd door de afdeling nucleaire
geneeskunde of een equivalente specialist?
A
5.3.4.
Wordt de aan de patiënt toe te dienen
radioactieve dosis bepaald in samenspraak
met een medisch stralingsfysicus (berekening
van de effectieve geabsorbeerde dosis), arts
in de nucleaire geneeskunde of een
equivalente specialist?
A
5.3.5.
Wordt de toegediende activiteit individueel
gemeten
en
gecontroleerd
in
een
gestandaardiseerde dosiscalibrator waarvan
de kwaliteit gecontroleerd is met het
betrokken radionuclide?
A
5.3.6.
Zijn er geschikte voorzieningen (specifieke
ruimte) voor gehospitaliseerde en ambulante
patiënten beschikbaar?
B
5.3.7.
Is er een multidisciplinaire klinische followup van deze patiënten?
B
5.3.8.
Zijn er schriftelijke regels beschikbaar voor
het ontslag van patiënten?
B
Wordt de activiteit/uitgezonden dosis
gemeten en genoteerd in het patiëntendossier
vóór ontslag uit de afdeling?
5.3.10. Zijn er schriftelijke instructies beschikbaar
voor het ontslag van de patiënt?
B
5.3.9.
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
B
36
5.4.
KLINISCHE EVALUATIE
Voor drie therapeutische procedures moet de gecontroleerde instelling de volgende
informatie verstrekken:
-
Klinisch probleem. Bij de evaluatie van deze parameter moeten de auditeurs met minstens
de volgende punten rekening houden: geschiktheid van de therapieaanvraag. Werd
informatie verkregen over voorafgaande therapieën, interventies, diagnostische
onderzoeken, enz.?
-
Voorbereiden van de patiënt. Bij de evaluatie van deze parameter moeten de auditeurs
met de volgende punten rekening houden: werd de voldoende informatie verstrekt ? Werd
rekening gehouden met informatie over zwangerschap/borstvoeding, hydratatie, vasten
enz.? Werd een geïnformeerde toestemming verkregen? Werden andere punten
betreffende de therapie die de vermelde radionuclidentherapie kunnen beïnvloeden
genoteerd ? Werd het patiëntidentificatieprotocol strikt gevolgd om verkeerde toediening
te voorkomen ?
-
Radiofarmacon. Bij de evaluatie van deze parameter moeten de auditeurs met de
volgende punten rekening houden: correcte keuze van het radiofarmacon. Toegediende
activiteit conform de nationale/internationale richtlijnen; QC-procedures.
-
Therapieprotocol. Bij de evaluatie van deze parameter moeten de auditeurs met het
volgende punt rekening houden: is het toegepaste studieprotocol conform met de
nationale/internationale richtlijnen?
-
Berekeningsmethoden. Bij de evaluatie van deze parameter moeten de auditeurs met het
volgende punt rekening houden: correcte keuze van gevalideerd algoritme voor
dosimetrische berekeningen.
-
Ontslagrapport. Bij de evaluatie van deze parameter moeten de auditeurs met het
volgende punt rekening houden: zijn de ontslagbrieven en andere documenten (bv.
stralingscontroleverslag) conform met de nationale/internationale richtlijnen?
-
Posttherapiefollow-up. Bijvoorbeeld, doeltreffendheid van de therapie; klinisch resultaat.
Therapeutische procedures moeten worden geëvalueerd volgens de volgende
categorieën:
-
Graad I: Volledig conform met de gepubliceerde (nationale, internationale) richtlijnen;
-
Graad II: Aanvaardbaar, maar kan worden verbeterd om aan Graad I te voldoen;
-
Graad III: Niet conform de criteria van goede klinische praktijk.
37
Gebruik voor een interne audit deze evaluatie om de kwaliteit van uw therapeutische
procedures te beoordelen. Externe auditeurs volgen hetzelfde proces om de hen voorgestelde
therapeutische procedures te evalueren.
Aanbevelingen: Voor therapeutische procedures moeten voor graad III onmiddellijk
verbeteringen worden aangebracht, voor graad II moeten verbeteringen binnen zes maanden
worden aangebracht.
Voor meer informatie zie hoofdstuk 6 van de Nuclear Medecin Resources Manual [3].
5.5.
KLINISCHE RADIONUCLIDENTHERAPIE – EINDOVERZICHTSTABEL
Om de goede klinische praktijk te evalueren moet een selectie van elk verschillend
soort onderzoek worden gemaakt.
38
39
Radiosyno
vectomie
Tumor
Pijn
verlichting
Schildklier
Type
therapie
Klinisch
probleem
Voorberei
ding
patiënt
Radiofar
maceuticum
Activiteit
Behandelings
protocol
Berekenings
methoden
CONTROLELIJST 14. SAMENVATTING THERAPEUTISCHE PROCEDURES
Ontslag
rapport
Post
therapie
follow-up
Aanbeve
lingen
6. RADIOFARMACIE
Het gamma van vereiste voorzieningen verschilt sterk afhankelijk van de operationele
categorie van het laboratorium. De radiofarmacie moet over de nodige uitrusting beschikken
om radiofarmaca te verstrekken van de gewenste kwaliteit voor toediening aan patiënten. De
inrichtingen moeten aangepast zijn aan de radioactieve aard van het product; vele
radiofarmaca zijn ook injecteerbaar en moeten bijgevolg steriel zijn. De radiofarmacie moet
over QC-procedures beschikken en ruimten voor de ontvangst en de opslag van radioactief
materiaal en afval vóór verwijderen. Het is essentieel dat laboratoria de operator, het product
en de omgeving beschermen, ongeacht de uitgevoerde taken.
De operator moet worden beschermd tegen straling van de producten, en de
inrichtingen moeten het risico van externe straling en interne straling ten gevolge van
ongewilde ingestie van radioactief materiaal, vooral door inhalatie van vluchtige producten,
tot een minimum herleiden. Bovendien kan het product chemische risico’s veroorzaken. Het
merken van bloed kan een biologisch risico inhouden voor de operator.
Het product moet worden beschermd tegen ongewilde besmetting tijdens zijn
bereiding. Het kan gaan om een chemische, radionuclidische, deeltjes of microbiële
besmetting.
De omgeving moet worden beschermd tegen ongewilde lozingen van radioactief
materiaal van de radiofarmacie. De meerderheid van de radioactiviteit wordt gemanipuleerd
in de vorm van open bronnen met een bestaande kans op ongevallen en morsen.
Sinds kort wordt meer de klemtoon gelegd op het proactief zijn en de ontwikkeling
van een cultuur van permanente evaluatie en controle. Dit onderdeel van de audit moedigt
deze hedendaagse, dagelijkse praktijken aan die essentieel zijn voor een veilige bereiding van
radiofarmaca.
6.1.
IAEA OPERATIONELE RICHTLIJN INZAKE ZIEKENHUISRADIOFARMACIE
De publicatie van het IAEA over de operationele richtlijn inzake
ziekenhuisradiofarmacie: Een veilige en doeltreffende benadering [5] (IOG) categoriseert de
activiteiten van hot labs volgens drie niveaus. Ze verstrekt essentiële details (personeel,
activiteiten, uitrusting, personeelskwalificatie, gegevensbewaring, QM- en QC-niveau) op elk
operationeel niveau (Tabel 2).
Dit auditproces heeft vooral tot doel de vereisten voor IOG operationele niveaus 1 en 2
te dekken. Vele afdelingen nucleaire geneeskunde werken op IOG-niveaus 1 en 2 omdat ze
niet altijd over een geschoolde radiofarmaceut beschikken. Bij IOG operationeel niveau 1 en
2 kunnen de bereide radiofarmaca niet buiten het ziekenhuis worden verspreid. In de meeste
gevallen geeft de verantwoordelijke arts een overzicht van de wettelijke regelingen.
40
TABEL 2. ESSENTIËLE OPERATIONELE NIVEAUS ZIEKENHUISRADIOFARMACIE
Operationeel
niveau
Toepassingsgebied
1a
Alle radiofarmaca worden in hun eindvorm aangekocht bij een
erkende/goedgekeurde fabrikant of centrale radiofarmacie. Het kan
gaan om eenheidsdosissen of flacons met multiple dosissen
radiofarmaca. In geen geval is verdere bereiding vereist.
1b
Radiojodiumpreparaten, in vloeibare of tabletvorm, worden
aangekocht bij erkende/goedgekeurde fabrikanten. Typisch is geen
verdere bereiding vereist. Het product moet worden verdund
volgens de productspecificaties.
2a
Dit niveau verwijst naar de bereiding van radiofarmaca uit bereide
en goedgekeurde reagenskits, generatoren en radionucliden voor
diagnostische of therapeutische doeleinden (gesloten procedure). Dit
is de hoofdactiviteit van de meeste afdelingen nucleaire
geneeskunde,
met
routinematig
gebruik
van
een
technetiumgenerator en reconstitutie van vooraf gesteriliseerde
radiofarmaceutische koude kits.
2b
Dit
niveau
beschrijft
de
laboratoriumpraktijken
en
omgevingsomstandigheden nodig voor een veilige manipulatie en
het radioactief merken van autologe bloedcellen en bestanddelen
voor herinjectie in de oorspronkelijke donor/patiënt.
3a
Dit niveau verwijst naar de bereiding van radiofarmaca uit
radionucliden voor diagnostische doeleinden; wijziging van
bestaande commerciële kits en productie ter plaatse van reagenskits
uit bestanddelen (inclusief vriesdrogen). Onderzoek en ontwikkeling
ressorteert vaak onder operationeel niveau 3a.
3b
Dit niveau verwijst naar de bereiding van radiofarmaca uit
basisbestanddelen of niet-goedgekeurde tussenproducten en
radionucliden voor therapeutische toepassing (open procedure) en/of
gerelateerd onderzoek en ontwikkeling.
3c
Dit niveau verwijst naar:
• Synthese van PET-radiofarmaca;
• De bereiding van radiofarmaca geproduceerd uit niet-toegestane of
niet geregistreerde langlevende generatoren zoals (68Ga) gallium
of (188Re) rhenium. Plus gerelateerd onderzoek en ontwikkeling.
Belangrijkste
punten/
opmerkingen
41
Bij IOG operationeel niveau 3 is een radiofarmaceut, radiochemicus of een “bevoegde
persoon” vereist omdat vele gespecialiseerde producten en diensten worden verstrekt inclusief
het beheer van een centrale radiofarmacie en PET-radiofarmaca. Op dit niveau zijn de
wettelijke vereisten aanzienlijk complexer en bijgevolg ook het auditproces. Dit valt buiten de
scope van deze publicatie
6.2.
ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 1
CONTROLELIJST 15. ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 1
Nr.
Element
Cat.
6.2.1.
Is het hoofd van de radiofarmacie-eenheid
een persoon met de juiste opleiding zoals
bepaald door de lokale of nationale
wettelijke voorschriften ?
A
6.2.2
Zijn er schriftelijke opleidingshandboeken
voor alle niveaus aan personeel ?
B
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
Personeel
Inrichtingen
6.2.3.
Beschikt de eenheid over goed afgewerkte
kamers (inclusief juiste verlichting, juiste
afwerking van muren, vloeren, plafonds en
ventilatie) en een beschermde verdeelpost?
A
6.2.4.
Voor operationeel niveau 1b: Is er een
goed geventileerde ruimte of een
beschermde
verdeelpost
voor
radiojodiumtabletten?
A
42
CONTROLELIJST 15. ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 1
(vervolg)
Nr.
Element
Cat.
6.2.5.
Is er een gevalideerde (jaarlijkse controle
van
luchtstroom,
veiligheid
en
houdbaarheidstest)
afzuigkast
met
geschikte filters voor de manipulatie van
radiojodiumoplossingen ?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
Aankoop van materiaal
6.2.6.
Zijn er geschikte protocols en opgeleid
personeel
voor
de
aankoop
van
goedgekeurde
radiofarmaca
of
radiofarmaca met een vergunning voor het
in de handel brengen ?
A
6.2.7.
Worden alle ontvangen goederen genoteerd
en vergeleken met de bestelling ?
B
Verdeelprotocollen
6.2.8.
Onder operationeel niveau 1a: Zijn er
schriftelijke procedures voor de aseptische
verdeling en het etiketteren van
eenheidsdosissen
van
gebruiksklare
radiofarmaca ?
B
6.2.9.
Voor operationeel niveau 1b: Is er een
beschermde verdeelpost en/of afzuigkast
beschikbaar? (is er een afzuigkast met
geschikte filters voor vluchtig radioactief
materiaal zoals 131I-oplossingen ?)
(Wanneer alleen radiojodiumtabletten
worden
gemanipuleerd,
wordt
de
verpakking geopend in een goed verluchte
ruimte ?)
A
6.2.10. Voor operationeel niveau 1b: Bevatten de
schriftelijke
procedures
duidelijke
veiligheids- en controle-instructies voor de
verdeling van radiojodiumoplossingen of –
tabletten?
A
43
CONTROLELIJST 15. ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 1
(vervolg)
Nr.
Element
6.2.11. Kunnen de audit en de documentatie voor
elke partij radiofarmaca worden getraceerd
van het voorschrift tot de eigenlijke
toediening
van
individuele
patiëntendosissen?
Cat.
Ja/
Neen
Opmerkingen/g Realisatie
eplande actie
datum
A
QA/QC
6.2.12. Wordt de kwaliteit van de radiofarmaca
regelmatig gecontroleerd?
B
6.2.13. Is er een schriftelijke procedure voor het
omgaan met producten die niet voldoen
aan de vereiste standaarden en/of
waarover een klacht werd ontvangen?
B
Afval
6.2.14. Zijn er schriftelijke procedures voor het
verwijderen van radioactief afval en nietradioactief afval specifiek voor de
radiofarmacie?
6.3.
A
ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 2
Het is essentieel dat op operationeel niveau 2 ook aan de voorwaarden van
operationeel niveau 1 wordt voldaan.
44
CONTROLELIJST 16. ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 2
Nr.
Element
Cat.
6.3.1.
Is er op operationeel niveau 2 een specifieke
personeelsopleiding
en
competentieevaluatie, inclusief in aseptische praktijk?
A
6.3.2.
Is er een opleiding voor personeel dat de
eindcontroles uitvoert van alle bereide
producten
vóór
afgifte
voor
patiëntengebruik?
A
6.3.3.
Is er bevestiging van opleiding voor afgifte
van radioactief gemerkte RBC (rode
bloedcellen) en labeling van WBC (witte
bloedcellen)?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
Personeel
Inrichtingen
6.3.4.
Voor operationeel niveau 2: Zijn er
regelmatige controles van gevalideerde
klasse II Type B microbiologische
veiligheidskasten in een specifieke kamer?
A
6.3.5.
Voor negatievedrukisolatoren: Worden vóór
bereiding
de
handschoenen
of
kaphandschoenen visueel gecontroleerd en
integriteitstests uitgevoerd en geregistreerd?
B
Bereidingsprotocollen
6.3.6.
Zijn in de praktijk alle werksystemen en
documentatie in verband met de bereiding en
verwerking van radiofarmaca formeel
goedgekeurd?
B
6.3.7.
Hebben alle producten, kits en generatoren
een productgoedkeuring, een vergunning
voor het in de handel brengen of een
vergunningsnummer?
A
45
CONTROLELIJST 16. ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 2
(vervolg)
Nr.
Element
Cat.
6.3.8.
Wordt de bereiding van 99mTc radiofarmaca
uit kits en generatoren uitgevoerd in een kast
met laminaire luchtstroom (LAF) ?
A
6.3.9.
Kan
elke
individuele
patiëntendosis
getraceerd worden naar een specifieke
generator en kitbatchnummer ?
A
6.3.10. Voor operationeel niveau 2b: Omvatten de
schriftelijke procedures voor autologe
preparaten, bv. RBC’s en WBC’s, duidelijke
veiligheids-,
reinigingsen
ontsmettingsinstructies ?
A
6.3.11. Zijn er schriftelijke procedures voor de
bereiding en verdeling van radioactief
gemerkte
biologische
middelen,
bv.
monoclonale antilichamen, peptiden uit
goedgekeurde kitformuleringen?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
QA/QC
6.3.12. Zijn er vastgelegde prevrijgave QC-criteria
voor bereiding vóór patiëntengebruik?
A
6.3.13. Wordt een goedkeurings/afgiftedocument
opgesteld door een bevoegde persoon voor
een product aan een patiënt wordt
toegediend?
A
6.3.14. Voor operationeel niveau 2: Wordt de
doorbraak van 99Mo molybdeen berekend in
het eerste eluaat van elke 99mTc
technetiumgenerator en herhaald wanneer de
generator wordt verhuisd?
A
6.3.15. Wordt de doorbraak van aluminiumion
gecontroleerd in het eerste eluaat van een
99m
Tc-technetiumgenerator?
A
46
CONTROLELIJST 16. ZIEKENHUISRADIOFARMACIE – OPERATIONEEL NIVEAU 2
(vervolg)
Nr.
Element
Cat.
6.3.16. Worden
vóór
patiëntengebruik
radiochemische zuiverheidstests uitgevoerd
op alle nieuwe batchen of nieuw geleverde
radiofarmaceutische kits?
B
6.3.17. Is er een routinematige microbiologische
controle van het preparaat en aseptische
verdeelruimte in de radiofarmacie?
A
6.3.18. Worden veranderingen in het gebruik van
kits, verdunningsmiddelen of oplosmiddelen,
naalden, spuiten, watten en naaldcontainers
genoteerd?
B
6.3.19. Worden regelmatig pH-tests uitgevoerd?
B
6.3.20. Worden snelle alternatieve methoden
toegepast voor snelle prospectieve QC, bv.
om de radiochemische zuiverheid te bepalen
van 99mTc-HMPAO?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
7. DIENST TUMORMARKERBEPALING MET BEHULP VAN
RADIO-IMMUNOASSAY
Deze paragraaf van de audit richt zich op het klinische gebruik van de dienst
tumormarkerbepaling met behulp van radio-immunoassay. Een grote verscheidenheid aan
diensten en niveaus worden verstrekt gebruik makend van radio-immunoassay of
geassocieerde medische laboratoria. Enkele laboratoria zijn erkend door de Internationale
Organisatie voor Standaardisering (ISO) en de meeste zijn officieel erkend onder nationale
erkenningssystemen. In ontwikkelingslanden werken veel laboratoria evenwel zonder
erkenning of certificatieprocedure.
Deze audit gebeurt vanuit het oogpunt van de patiënt en is daarom in drie onderdelen
ingedeeld: preanalytisch; analytisch en postanalytisch. De nadruk wordt gelegd op het interne
kwaliteitsprogramma en het belang van deel uit te maken van een extern
kwaliteitsevaluatieprogramma.
47
Medische laboratoria die een externe erkenning nastreven voor de kwaliteit van hun
diensten moeten ervoor zorgen dat regelmatig volledige interne en externe audits worden
uitgevoerd. Veranderingen dienen tijdig te worden geïmplementeerd. Deze auditcontrole dient
veel van de problemen aan te pakken die verband houden met de handhaving van hoogstaande
dienstverlening.
De publicatie van IAEA’s “Screening of Newborns for Congenital Hypothyroidism —
Guidance for Developing Programmes [6]” is een nuttige leidraad voor goede praktijken voor
de screening van pasgeborenen met behulp van radio-immunoassay. Deel III van deze
publicatie biedt nuttige tips om de kwaliteitsprogramma’s te verbeteren in laboratoria in het
algemeen.
7.1. ELEMENTEN VAN DE DIENST TUMORMARKERBEPALING DOOR RADIOIMMUNOASSAY
Een essentiële beoordeling
tumormarkerbepaling is noodzakelijk.
van
CONTROLELIJST
IMMUNOASSAY
TUMORMARKERBEPALING
Nr.
17.
DIENST
goede
Element
laboratoriumpraktijken
Cat.
Ja/
Neen
en
DOOR
Opmerkingen/
geplande actie
diensten
RADIO-
Realisatie
datum
Goede laboratoriumpraktijken
7.1.1.
Heeft de dienst radio-immunoassay een
formele goedkeuring van een erkende
nationale instantie ?
A
7.1.2.
Is er een duidelijk schriftelijk protocol
voor alle radio-immunoassay-, IRMA- en
ELISA-analyten die in het laboratorium
worden gebruikt ?
A
7.1.3.
Is er een duidelijk protocol waarin de
vereiste acties vermeld staan bij de followup van vermoedelijk foute resultaten in het
laboratorium ?
A
7.1.4.
Is er een mechanisme om te controleren
waarom recente resultaten 20% lager zijn,
terwijl alle vorige resultaten binnen 10%
van de doelwaarde waren ?
B
48
CONTROLELIJST 17. DIENST
IMMUNOASSAY (vervolg)
TUMORMARKERBEPALING
Nr.
Element
Cat.
7.1.5.
Is er een mechanisme om toevallige
afwijkingen op te volgen, bv. verkeerd staal
op
analysator,
verkeerd
specimen
geanalyseerd, per ongeluk verkeerd resultaat
gemeld ?
B
7.1.6.
Is er een mechanisme voor dubbele controle
van gerapporteerde “niet-detecteerbaar”
resultaten wanneer het verwachte resultaat
klinisch significant was ?
B
Ja/
Neen
DOOR
RADIO-
Opmerkingen/
geplande actie
Realisatie
datum
Preanalytische fase
7.1.7.
Is er een procedure die moet worden gevolgd
wanneer de klinische gebruiker niet de
nodige informatie of het correcte staal
verstrekt ?
B
7.1.8.
Is er een periodieke beoordeling om
preanalytische afwijkingen te voorkomen,
bv.
het
gebruik
van
ongeschikte
specimenbuisjes, door elkaar halen van
specimen of verkeerd geëtiketteerd of door
elkaar gehaalde aanvragen van de
aanvragende eenheid of laboratorium ?
B
7.1.9.
Is er een periodieke beoordeling van de
geschiktheid en integriteit van het
transportsysteem voor stalen ?
A
7.1.10. Is er een periodieke beoordeling om te
garanderen dat de vertrouwelijkheid van de
patiëntresultaten wordt gehandhaafd ?
A
7.1.11. Is er een periodieke beoordeling om de
biologische veiligheid te garanderen ?
A
Analytische fase
7.1.12. Zijn er gegevens over regressielijnanalyse
met een bekende hoeveelheid van de
internationale standaard in serum?
B
7.1.13. Zijn er gegevens over recovery experimenten
om een nieuwe methode te valideren?
B
49
CONTROLELIJST 17. DIENST TUMORMARKERBEPALING DOOR RADIOIMMUNOASSAY (vervolg)
Nr.
Element
Cat
7.1.14. Is
er
voor
elk
type
analyse/
gegevensverzameling vermelding van het
berekende gemiddelde, standaardafwijkingen
en een variatiecoëffiënt ?
B
7.1.15. Is er een Levey-Jennings-grafiek, inclusief
controles en standaarden voor elke analyse ?
A
7.1.16. Is er een duidelijk schriftelijk protocol voor
wanneer punten zich buiten de 2
standaardafwijkingsgrenzen bevinden ?
A
7.1.17. Is er een systeem van kracht om de veilige
verwijdering van stalen te garanderen en
worden stalen behandeld als besmettelijk
afval ?
A
Ja/
Neen
Opmerkingen/
geplande actie
Realisatie
datum
Postanalytische fase
7.1.18. Is er een standaardformaat voor de
rapportering van laboratoriumresultaten met
vermelding van de naam van het
laboratorium, de patiëntengegevens, de
aanvragende
persoon,
testbeschrijving,
staaltype (serum, urine, enz.), resultaten (+
referentiewaarden), interpretatie (indien van
toepassing), handtekening van bevoegde
deskundige ?
A
7.1.19. Is er een lijst van bevoegde personeelsleden
die aangewezen zijn om patiëntnota’s of
patiëntrapporten te verbeteren en voor het
bekendmaken van de resultaten ?
A
7.1.20. Zijn referentiewaarden, gebaseerd op
nationale of regionale bevindingen, voor elk
type analyse beschikbaar ?
B
7.1.21. Is de feedback van klinische interpretatie
diensten gedocumenteerd ?
B
50
8. AUDITRAPPORT
Het stellen van prioriteiten is belangrijk en in deze publicatie worden drie niveaus
beschouwd – “Cruciaal”, “Belangrijk” en “Ondergeschikt”. Het stellen van de prioriteiten
moet patiëntgericht zijn.
8.1.
LIJST VAN CRUCIALE PRIORITEITEN
CONTROLELIJST 18. LIJST VAN CRUCIALE PRIORITEITEN
Nr.
8.2.
Opmerking/actie
Termijn
Realisatie
datum
LIJST VAN BELANGRIJKE PRIORITEITEN
Belangrijke prioriteiten zijn slechts secundair aan cruciale prioriteiten omdat ze een
kleinere impact hebben op de behandeling van de patiënt. Ze moeten evenwel tijdig worden
aangepakt.
CONTROLELIJST 19. LIJST VAN BELANGRIJKE PRIORITEITEN
Nr.
Opmerking/actie
Termijn
Realisatie
datum
51
8.3.
LIJST VAN ONDERGESCHIKTE PRIORITEITEN
Ondergeschikte prioriteiten zijn essentieel voor een goed kwaliteitsbeheer.
CONTROLELIJST 20. LIJST VAN ONDERGESCHIKTE PRIORITEITEN
Nr.
8.4.
Opmerking/actie
Termijn
Realisatie
datum
CONTROLELIJST VOOR INHOUD AUDITRAPPORT
Gestandaardiseerde auditrapporten zijn essentieel voor alle belanghebbenden. De
onderstaande lijst kan als leidraad worden gebruikt.
CONTROLELIJST 21. INHOUD AUDITRAPPORT
Inhoud
Inbegrepen
Ja/Neen
Opmerkingen
Inleiding
Achtergrond, demografie,
volksgezondheidssysteem, nationale financiering
Beschrijving van de opdracht
Activiteiten van het auditteam
Regelgevende instantie en
wettelijke voorschriften
Vergunning voor het gebruik van radioactief
materiaal,
stralingsbescherming
en
veiligheidsprogramma, stralingsdosis werknemers,
ijkingscertificaat.
Infrastructuur
nucleaire
geneeskunde
inclusief
beeldvormingssystemen
Algemeen, human resources, medische opleiding,
grondplan,
uitrusting,
prestatie
beeldvormingsuitrusting, computersystemen en
gegevensverwerking,
uitgevoerde
diensten,
kwaliteitsgarantie
52
CONTROLELIJST 21. INHOUD AUDITRAPPORT (vervolg)
Inhoud
Inbegrepen
Ja/Neen
Opmerkingen
Klinisch nucleaire
geneeskunde
Aanvragen voor toediening van radiofarmaca,
voorbeelden
van
scintigrafieën
en
rapportvoorschrijfformulier
voor
radiofarmaceutische behandeling, geïnformeerd
toestemmingsformulier van de patiënt, in vitro
technieken en radionuclidentherapie
Radiofarmacie
De prestatie moet voornamelijk worden
vergeleken met de Operational Guidance on
Hospital Radiopharmacy [5] van het IAEA.
Diensten radio-immunoassay
Goede laboratoriumpraktijken,
analytisch en postanalytisch
Belangrijkste sterke punten
en gebreken
Gebreken moeten in de auditprocedure worden
geregistreerd, met vermelding hoe en wanneer,
verbeteringen zullen worden uitgevoerd.
Samenvatting audit follow-up
Details van overeengekomen veranderingen
moeten worden vermeld. Er moet ook een akkoord
worden bereikt over een follow-upmechanisme
Aanbevelingen
Deze moeten duidelijk worden verwoord, idealiter
in één zin; afdeling nucleaire geneeskunde,
geaudit ziekenhuis, overheid, IAEA.
preanalytisch,
Bijlage
53
54
REFERENTIES
[1]
INTERNATIONAL ATOMIC ENERGY AGENCY, The Management System for
Facilities and Activities, IAEA Safety Standards Series No. GS-R-3, IAEA, Vienna
(2006). http://www-ns.iaea.org/standards/documents/default.asp?sub=130
[2]
INTERNATIONAL ATOMIC ENERGY AGENCY, Application of the Management
System for Facilities and Activities, IAEA Safety Standards Series No. GS-G-3.1,
IAEA,
Vienna
(2006).
http://wwwns.iaea.org/standards/documents/default.asp?sub=130
[3]
INTERNATIONAL ATOMIC ENERGY AGENCY, Nuclear Medicine Resources
Manual, IAEA, Vienna (2006).
[4]
FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS,
INTERNATIONAL ATOMIC ENERGY AGENCY, INTERNATIONAL LABOUR
ORGANIZATION, NUCLEAR ENERGY AGENCY OF THE OECD, PAN
AMERICAN HEALTH ORGANIZATION, WORLD HEALTH ORGANIZATION,
International Basic Safety Standards for Protection against Ionizing Radiation and for
the Safety of Radiation Sources, Safety Series No. 115, IAEA, Vienna (1996).
[5]
INTERNATIONAL ATOMIC ENERGY AGENCY, Operational Guidance on
Hospital Radiopharmacy: A Safe and Effective Approach, IAEA, Vienna (2008).
[6]
INTERNATIONAL ATOMIC ENERGY AGENCY, Screening of Newborns for
Congenital Hypothyroidism: Guidance for Developing Programmes, IAEA, Vienna
(2005).
BIBLIOGRAFIE
BURNETT, D., A Practical Guide to Accreditation in Laboratory Medicine, ACB Venture
Publications, London (2002).
INTERNATIONAL ATOMIC ENERGY AGENCY (Vienna)
Quality Control of Nuclear Medicine Instruments, IAEA-TECDOC-602 (1991).
Radiological Protection for Medical Exposure to Ionizing Radiation, IAEA Safety Standards
Series No. RS-G-1.5 (2002).
IAEA Quality Control Atlas for Scintillation Camera Systems (2003).
Applying Radiation Safety Standards in Nuclear Medicine, Safety Reports Series No. 40
(2005).
Quality Assurance for Radioactivity Measurement in Nuclear Medicine, Technical Reports
Series No. 454 (2006).
Safe Transport of Radioactive Material, 4th edn, Training Course Series No. 1 (2006)
Storage of Radioactive Waste, IAEA Safety Standards Series No. WS-G-6.1 (2006).
55
56
WERKTEN MEE AAN HET OPSTELLEN EN DE HERZIENING VAN HET
RAPPORT
Amaral, H.
Clinica Alemana de Santiago, Chile
Bouyoucef, S.E.
CHU Bab El Oued, Algeria
Dondi, M.
International Atomic Energy Agency
Elliott, A.T.
Western Infirmary, United Kingdom
Ellmann, A.
Tygerberg Hospital and Stellenbosch University, South Africa
Fettich, J.
University Medical Centre, Slovenia
Marengo, M.
Policlinico S. Orsola – Malpighi, Italy
Mut Bastos, F.L.
Hospital de Clínicas, Uruguay
Solanki, K.K.
International Atomic Energy Agency
Consultantvergaderingen
Wenen, Oostenrijk, 16-19 januari 2006, 13-15 december 2006
57
Kwaliteitsbeheerssystemen hebben tot doel de doeltreffendheid en efficiëntie voortdurend te
verbeteren, waardoor de nucleaire geneeskunde in staat is de verwachtingen van zijn
kwaliteitsbeleid te bereiken en zijn klanten tevreden te stellen. Het IAEA biedt zijn lidstaten
al jarenlang bijstand op het gebied van nucleaire geneeskunde.
Het hoofddoel van deze publicatie is het introduceren van een routinematig jaarlijks,
systematisch auditproces in de klinische arena. De QM-auditmethodologie die in deze
publicatie wordt geïntroduceerd is ontworpen voor toepassing in uiteenlopende economische
omstandigheden. Een belangrijk resultaat moet een cultuur zijn van de beoordeling van
essentiële elementen van de klinische dienst voor voortdurende verbetering binnen de
nucleaire geneeskunde.
58