Werkblad 3.6: Atoomtheorie (auteur: Leo van Dijk)
Project Moderne Natuurkunde
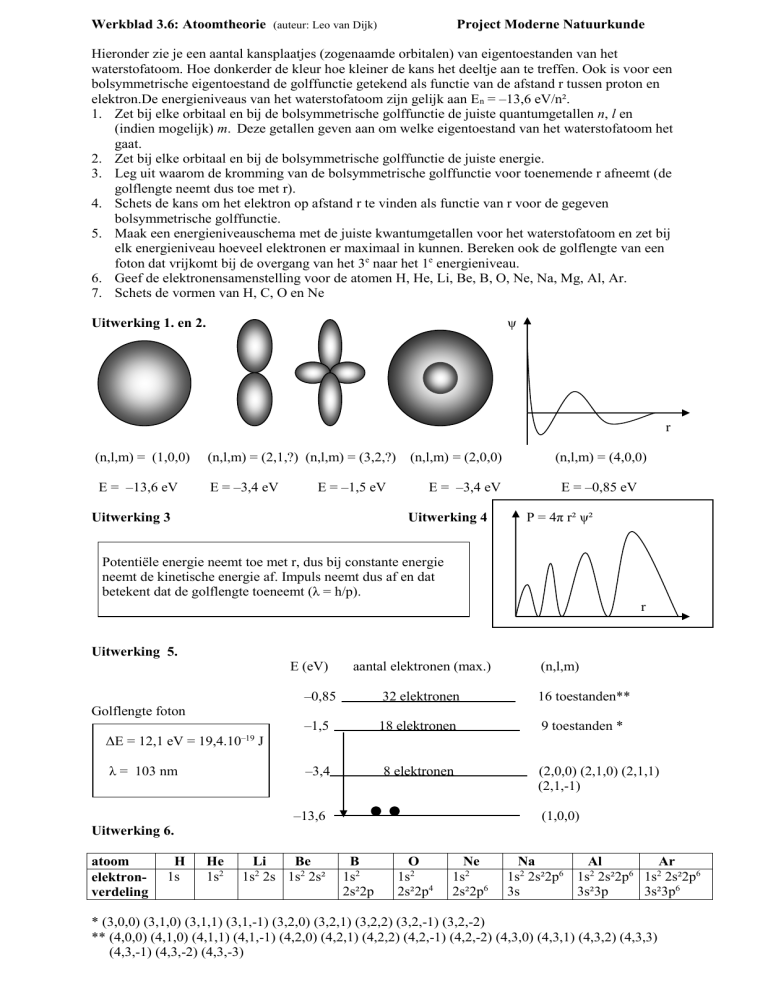
Hieronder zie je een aantal kansplaatjes (zogenaamde orbitalen) van eigentoestanden van het
waterstofatoom. Hoe donkerder de kleur hoe kleiner de kans het deeltje aan te treffen. Ook is voor een
bolsymmetrische eigentoestand de golffunctie getekend als functie van de afstand r tussen proton en
elektron.De energieniveaus van het waterstofatoom zijn gelijk aan En = –13,6 eV/n².
1. Zet bij elke orbitaal en bij de bolsymmetrische golffunctie de juiste quantumgetallen n, l en
(indien mogelijk) m. Deze getallen geven aan om welke eigentoestand van het waterstofatoom het
gaat.
2. Zet bij elke orbitaal en bij de bolsymmetrische golffunctie de juiste energie.
3. Leg uit waarom de kromming van de bolsymmetrische golffunctie voor toenemende r afneemt (de
golflengte neemt dus toe met r).
4. Schets de kans om het elektron op afstand r te vinden als functie van r voor de gegeven
bolsymmetrische golffunctie.
5. Maak een energieniveauschema met de juiste kwantumgetallen voor het waterstofatoom en zet bij
elk energieniveau hoeveel elektronen er maximaal in kunnen. Bereken ook de golflengte van een
foton dat vrijkomt bij de overgang van het 3e naar het 1e energieniveau.
6. Geef de elektronensamenstelling voor de atomen H, He, Li, Be, B, O, Ne, Na, Mg, Al, Ar.
7. Schets de vormen van H, C, O en Ne
ψ
Uitwerking 1. en 2.
r
(n,l,m) = (1,0,0)
(n,l,m) = (2,1,?) (n,l,m) = (3,2,?) (n,l,m) = (2,0,0)
E = –13,6 eV
E = –3,4 eV
E = –1,5 eV
Uitwerking 3
E = –3,4 eV
Uitwerking 4
(n,l,m) = (4,0,0)
E = –0,85 eV
P = 4π r² ψ²
Potentiële energie neemt toe met r, dus bij constante energie
neemt de kinetische energie af. Impuls neemt dus af en dat
betekent dat de golflengte toeneemt (λ = h/p).
r
Uitwerking 5.
E (eV)
aantal elektronen (max.)
(n,l,m)
–0,85
32 elektronen
16 toestanden**
–1,5
18 elektronen
9 toestanden *
–3,4
8 elektronen
Golflengte foton
ΔE = 12,1 eV = 19,4.10–19 J
λ = 103 nm
–13,6
(2,0,0) (2,1,0) (2,1,1)
(2,1,-1)
(1,0,0)
Uitwerking 6.
atoom
elektronverdeling
H
1s
He
1s2
Li
Be
1s2 2s 1s2 2s²
B
1s2
2s²2p
O
1s2
2s²2p4
Ne
1s2
2s²2p6
Na
Al
Ar
1s2 2s²2p6 1s2 2s²2p6 1s2 2s²2p6
3s
3s²3p
3s²3p6
* (3,0,0) (3,1,0) (3,1,1) (3,1,-1) (3,2,0) (3,2,1) (3,2,2) (3,2,-1) (3,2,-2)
** (4,0,0) (4,1,0) (4,1,1) (4,1,-1) (4,2,0) (4,2,1) (4,2,2) (4,2,-1) (4,2,-2) (4,3,0) (4,3,1) (4,3,2) (4,3,3)
(4,3,-1) (4,3,-2) (4,3,-3)












