Populaire samenvatting.
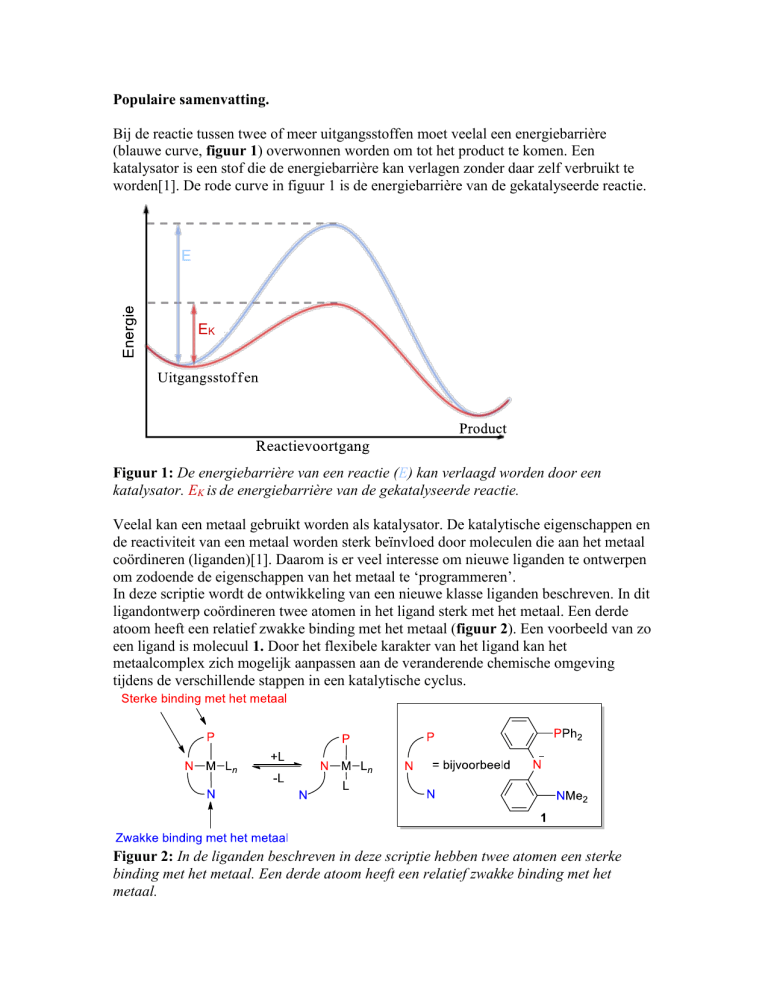
Bij de reactie tussen twee of meer uitgangsstoffen moet veelal een energiebarrière
(blauwe curve, figuur 1) overwonnen worden om tot het product te komen. Een
katalysator is een stof die de energiebarrière kan verlagen zonder daar zelf verbruikt te
worden[1]. De rode curve in figuur 1 is de energiebarrière van de gekatalyseerde reactie.
E
EK
Figuur 1: De energiebarrière van een reactie (E) kan verlaagd worden door een
katalysator. EK is de energiebarrière van de gekatalyseerde reactie.
Veelal kan een metaal gebruikt worden als katalysator. De katalytische eigenschappen en
de reactiviteit van een metaal worden sterk beïnvloed door moleculen die aan het metaal
coördineren (liganden)[1]. Daarom is er veel interesse om nieuwe liganden te ontwerpen
om zodoende de eigenschappen van het metaal te ‘programmeren’.
In deze scriptie wordt de ontwikkeling van een nieuwe klasse liganden beschreven. In dit
ligandontwerp coördineren twee atomen in het ligand sterk met het metaal. Een derde
atoom heeft een relatief zwakke binding met het metaal (figuur 2). Een voorbeeld van zo
een ligand is molecuul 1. Door het flexibele karakter van het ligand kan het
metaalcomplex zich mogelijk aanpassen aan de veranderende chemische omgeving
tijdens de verschillende stappen in een katalytische cyclus.
Figuur 2: In de liganden beschreven in deze scriptie hebben twee atomen een sterke
binding met het metaal. Een derde atoom heeft een relatief zwakke binding met het
metaal.
Een reactie waarvoor metaalcomplexen met deze liganden mogelijk gebruikt kunnen
worden is de koppeling van amines met alkenen; de hydroaminering van alkenen (figuur
3). De eerste stap in deze reactie is de activering van een N-H binding.
Figuur 3: De hydroaminering van alkenen.
De syntheses voor verschillende liganden zijn in deze scriptie beschreven. Verder zijn de
eigenschappen van verschillende iridium- en rhodiumcomplexen met deze liganden
beschreven. Tot slot is onderzocht hoe goed rhodium- en iridiumcomplexen met deze
liganden N-H bindingen kunnen activeren.
Referentie:
[1]
P.W.N.M. van Leeuwen, Homogeneous Catalysis, Kluwer Academic Publishers.








