Syllabus Celbiochemie (2015-2016)
Deel I: Eigenschappen van eiwitten
De Cel (Lehninger 6, pag. 6,7)
Levende organismen zijn opgebouwd uit cellen. Een volwassen mens bestaat uit zo’n 100
miljard cellen, die tezamen de specifieke weefsels van ons lichaam vormen. Elk van die cellen
bevat dezelfde genetische informatie (DNA) in de kern. Toch kunnen wij in ons lichaam zo’n
200 verschillende celtypen onderscheiden, waaronder hartspiercellen, zenuwcellen, huidcellen
en oogcellen. Deze cellen verschillen van elkaar doordat zij andere gedeelten van het DNA
aflezen tot RNA en eiwit. Een menselijke cel heeft een diameter van ongeveer 10 µm. In de
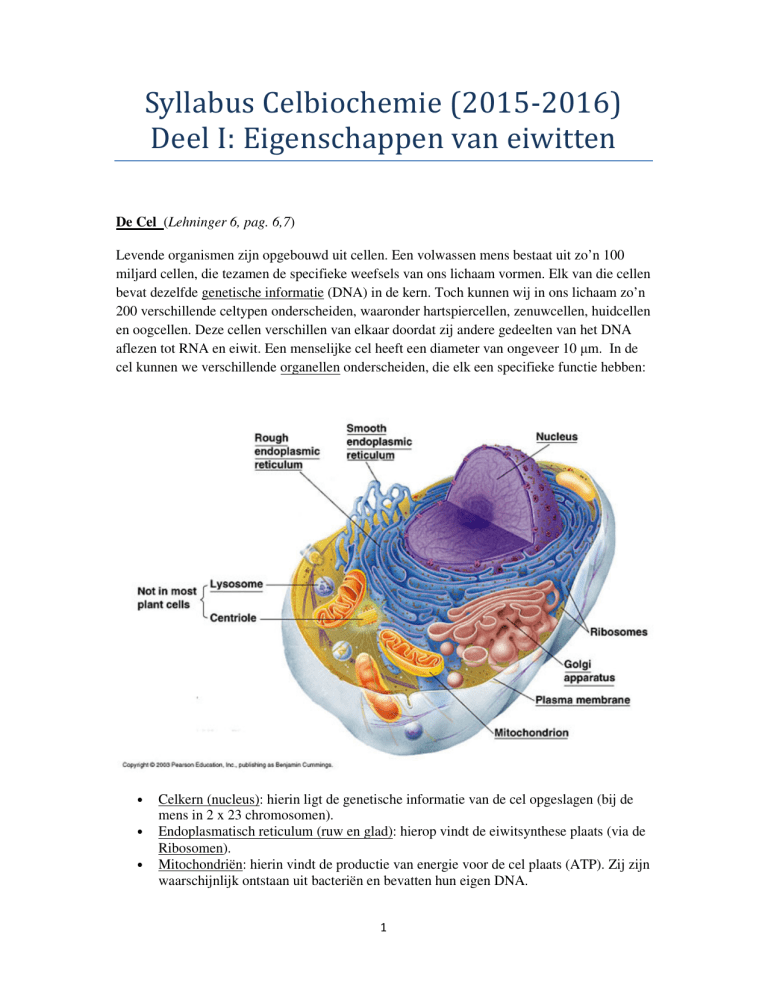
cel kunnen we verschillende organellen onderscheiden, die elk een specifieke functie hebben:
•
•
•
Celkern (nucleus): hierin ligt de genetische informatie van de cel opgeslagen (bij de
mens in 2 x 23 chromosomen).
Endoplasmatisch reticulum (ruw en glad): hierop vindt de eiwitsynthese plaats (via de
Ribosomen).
Mitochondriën: hierin vindt de productie van energie voor de cel plaats (ATP). Zij zijn
waarschijnlijk ontstaan uit bacteriën en bevatten hun eigen DNA.
1
•
•
•
•
Golgi-apparaat: hierin worden eiwitten bewerkt die gesynthetiseerd zijn in het
endoplasmatisch reticulum, en die vervolgens naar plaatsen binnen en buiten de cel
worden getransporteerd.
Lysosomen: hierin worden afvalstoffen van de cel afgebroken.
Plasma-membraan: vetachtige bilaag die het binnenste van de cel (Cytoplasma)
afscheidt van de buitenwereld. Aan de binnenkant van de plasma-membraan zitten
eiwitten die de cel hun vorm en stevigheid geven (Cytoskelet).
Centriool: buisjes van eiwitten (microtubuli) die van belang zijn bij de celdeling.
Chemische Bindingen (Lehninger 6, pag. 54)
Atomen kunnen met elkaar een chemische binding aangaan door electronenparen met elkaar
te delen. Wij spreken dan van een covalente binding, en deze wordt aangegeven met een
streepje tussen de atomen. Covalente bindingen zijn sterk en kunnen niet eenvoudig worden
verbroken door de temperatuur te verhogen, of door zouten of apolaire stoffen (zoals
organische oplosmiddelen) toe te voegen.
Daarnaast bestaan er niet-covalente
interacties, waarbij het ene molecuul
door een ander moleculen wordt
aangetrokken of afgestoten.
Voorbeelden zijn:
- ionen in oplossing (Na+ en Cl-)
- H2O moleculen die onderling
H-bruggen vormen waarbij de
δ- van het O-atoom een
interactie aangaat met de δ+
van de H-atomen.
- Zeepmoleculen waarvan de
vetachtige gedeelten bij elkaar
gaan zitten om zich van water
af te keren.
Niet-covalente interacties zijn niet
permanent, en daardoor juist erg
gevoelig voor temperatuur, ionen en
apolaire stoffen.
Voor de structuur en functie van biologische macromoleculen zoals eiwitten, spelen nietcovalente interacties een belangrijke rol (zie bovenstaande figuur). Polaire groepen kunnen Hbruggen met elkaar vormen (vooral O-H en N-H met C=O), geladen groepen kunnen elkaar
via ionogene interacties aantrekken (bijv. NH3+ en COO-) of juist afstoten (bijv. NH3+ en
NH3+ ), terwijl apolaire groepen (bevatten vooral C en H-atomen) zich gezamenlijk van de
waterige omgeving kunnen afkeren (hydrofobe interactie). H2O speelt zelf een belangrijke rol
bij niet-covalente interacties: het kan zelf H-bruggen met macromoleculen vormen, het
verzwakt ionogene interacties door zijn hoge diëlectrische constante (wat nog versterkt wordt
als er ionen zijn opgelost), en maakt hydrofobe interacties mogelijk.
2
Biologische Macromoleculen (Lehninger 6, pag. 15)
Cellen bevatten naast water (H2O) en ionen (Na+, K+, Cl-, Ca2+, etc) ook organische
verbindingen. Deze organische verbindingen kunnen lange ketens vormen (covalente binding)
of spontaan clusters vormen (niet-covalente interactie), waardoor functionele macromoleculen
ontstaan. De belangrijkste biologische macromoleculen met hun functie zijn:
Eiwitten
(aminozuren)
Suikers
(koolwaterstoffen)
Nucleotiden
(suiker, base, fosfaat)
Lipiden
(vetten en vetzuren)
Structuur cel; enzymen voor chemische
reacties
Energiebron; structuur bacteriën en
plantencellen
Informatie (DNA, RNA); Energieoverdracht
(ATP)
Energiebron; Structuur membranen (nietcovalent)
Functie van eiwitten
Eiwitten zijn de belangrijkste regelmoleculen van ons lichaam. Zij bestaan uit lineaire ketens
van aminozuren. In de natuur worden slechts 20 verschillende aminozuren gebruikt om alle
eiwitten mee te maken. De belangrijkste functies van eiwitten zijn:
1.
2.
3.
4.
5.
6.
7.
Katalytische activiteit (enzym)
Transportfunctie (transport stoffen over membranen)
Structurele functie (cytoskelet: binnenkant cel; matrix-eiwitten: buitenkant cel)
Beweging (spierwerking)
Immuunsysteem (afweer tegen lichaamsvreemde stoffen)
Signaalmoleculen (eiwithormonen zoals insuline)
Signaaltransductie (herkenningseiwitten op het celoppervlak die signalen van buiten
de cel in kunnen sturen)
Aminozuren (Lehninger 6, pag. 76, 86)
De 20 aminozuren waaruit eiwitten zijn opgebouwd, zijn zogenoemde L-α-aminozuren. Zij
bestaan uit een centraal C-atoom met daaraan een –H, een –NH2, een –COOH groep, en een
restgroep (R). Deze restgroep is voor ieder aminozuur verschillend. Het centrale C-atoom van
de meeste aminozuren bindt vier verschillende chemische groepen, en is daarom
asymmetrisch. Er bestaan dan ook twee vormen van deze aminozuren (D en L). De natuur
gebruikt voor de opbouw van eiwitten uitsluitend de L-vorm.
Eiwitten zijn lineaire ketens van aminozuren. Zij worden gevormd doordat de –COOH
groep van het ene aminozuur een covalente binding aangaat met de –NH2 groep van een ander
aminozuur. Er ontstaat dan een peptide binding (O=C-N-H) onder afsplitsing van H2O.
Uiteindelijk zal in de ontstane eiwitketen altijd één aminozuur een vrije -NH2 groep bevatten
(N-terminaal), en één aminozuur een vrije –COOH groep (C-terminaal). De aminozuur-
3
volgorde van een eiwit wordt altijd aangegeven van N-terminaal naar C-terminaal. Kleinere
eiwitten worden ook wel (poly-)peptiden genoemd.
Chemische structuur van aminozuren (Lehninger 6, pag. 79, 81)
De R-groep van aminozuren, ook wel zijketen genoemd, kan in vijf subgroepen worden
onderverdeeld (apolair; aromatisch; polair; positief geladen; negatief geladen). Restgroepen
die een -COOH of -NH2 groepen bevatten, kunnen een H+ kunnen afstaan of opnemen (zgn.
ioniseerbare groep; zie pKR in onderstaande tabel). Aspartaat is de zoutvorm van
Asparaginezuur, Glutamaat van Glutaminezuur. Asparagine en Glutamine (met een O=C-NH2
groep) zijn niet ioniseerbaar. Geladen en polaire zijketens zijn doorgaans hydrofiel, apolaire
en aromatische zijketens hydrofoob (zie hydropathy index in onderstaande tabel).
4
Fysisch-chemische eigenschappen van aminozuren (Lehninger 6, pag. 77)
5
De lading van aminozuren hangt af van de pH (Lehninger 6, pag. 64, 65)
Alle 20 aminozuren die in eiwitten voorkomen, bevatten een –COOH groep en een –NH2
groep aan het centrale C-atoom (behalve Pro). Daarnaast kunnen zij een –COOH groep (Glu;
Asp) of een –NH2 groep (Lys; Arg) in de zijketen bevatten. Een –COOH groep kan als zuur
een H+ afstaan; een –NH2 groep kan als base een H+ opnemen. De ligging van elk zuur-base
evenwicht hangt af van de pH volgens de Henderson-Hasselbalch vergelijking. Met behulp
van deze vergelijking is bij iedere pH te bepalen voor hoeveel procent een zure of basische
groep is geïoniseerd.
6
Berekening van het iso-electrisch punt van losse aminozuren en peptiden (Lehninger 6,
pag. 81, 83-85)
Van een klein eiwit (peptide) kan voor elke ioniseerbare groep (-COOH of –NH2) de netto
lading als functie van de pH berekend worden. Belangrijk daarvoor is eerst te bepalen hoeveel
ioniseerbare groepen een peptide heeft, en wat de pK waarde van ieder van die groepen is (zie
bovenstaande tabel). Op basis daarvan kan berekend worden bij welke pH de netto lading van
een los aminozuur of van een peptide nul is (iso-electrisch punt, afgekort IEP of pI).
Onderstaand een uitgewerkt voorbeeld voor het peptide Met-Lys-Leu (pK afgerond op een
gehele pH waarde).
7
Modificatie van aminozuren in eiwitten (Lehninger 6, pag. 82)
Als eenmaal een eiwit is gemaakt door aminozuren in een specifieke volgorde achter elkaar te
zetten, kunnen sommige aminozuren nog veranderd worden (post-translationele modificatie):
1. Aan een aminozuur met een –OH groep in de zijketen kan een fosfaat-groep
gekoppeld worden (fosforylatie); bij: Ser, Thr, Tyr
2. Aminozuren met een –SH groep in de zijketen kunnen met elkaar reageren en een S-S
brug vormen; bij: Cys
3. Van het N-terminale aminozuur kan de vrije –NH2 groep met azijnzuur (CH3-COOH)
reageren tot –NH-CO-CH3 (acetylering)
4. Een –NH2 groep in de zijketen kan gemethyleerd worden tot –NH-CH3; bij: Lys
Eiwitstructuren (Lehninger 6, pag. 96,97)
Eiwitten kunnen hun functie doorgaans alleen uitoefenen als zij op een bepaalde manier zijn
opgevouwen (conformatie of drie-dimensionale structuur). Verlies van deze functionele
conformatie wordt denaturatie genoemd. Denaturatie kan reversibel zijn, namelijk als het
eiwit zich weer opnieuw tot de juiste conformatie kan opvouwen, of irreversibel als het verlies
van drie-dimensionale structuur niet meer hersteld kan worden (voorbeeld irreversible
denaturatie: koken van een ei; voorbeeld reversibele denaturatie: eiwit dat neerslaat door
verandering in pH of ionsterkte).
Bij de structuur van eiwitten worden vier processen onderscheiden:
1. Primaire structuur: dit is de volgorde van de aminozuren zoals die genetisch is
vastgelegd in het DNA.
2. Secundaire structuur: deze ontstaat doordat eiwitten zich zodanig kunnen opvouwen
dat er H-bruggen ontstaan tussen de C=O en de N-H groepen van de peptide-binding
(voorbeelden van secundaire structuur zijn de α-helix en de β-sheet).
3. Tertiaire structuur: deze ontstaat doordat zijketens van verschillende aminozuren nietcovalente interacties met elkaar aangaan; deze kan plaatsvinden door de vorming van
H-bruggen, door electrostatische interactie (+ en – lading), of door hydrofobe
interactie (apolaire ketens die bij elkaar gaan zitten om zich van water af te
schermen). Ook de (covalente) vorming van S-S bruggen speelt een belangrijke rol bij
de tertiaire structuur.
4. Quaternaire structuur: eiwitten kunnen complexen vormen die bestaan uit meerdere
eiwitketens (subunits). De eiwitketens in zo’n complex zijn niet-covalent aan elkaar
gebonden, maar gaan een interactie met elkaar aan via H-bruggen, ionogene interactie
of hydrofobe interactie (voorbeeld: hemoglobine, het zuurstof-transporterend eiwit in
ons bloed, bestaat uit vier niet-covalent gebonden subunits: twee α-ketens en twee βketens).
Men gaat er van uit dat de optimale drie-dimensionale structuur van een eiwit vastligt in de
genetisch bepaalde primaire structuur (aminozuurvolgorde). De juiste vouwing van eiwitten in
de cel vindt plaats in het endoplasmatic reticulum.
8
Voorbeelden van eiwitstructuren (Lehninger 6, pag. 115-125)
1. Primaire structuur
(bijv. H2N- Ala (aa1)- Leu (aa2)- Ser (aa3)-COOH). Merk op dat de restgroepen (R1,
R2, R3) om en om de andere kant op wijzen (nummering R2 en R3 onjuist).
2. Secundaire structuur
Alpha-helix
Beta-sheet
9
Bij de α-helix (links) heeft de eiwitketen de vorm van een rechtsdraaiende spiraal,
waarbij de C=O van een peptide-binding (in de figuur bijv. van aa2) een H-brug
vormt met een N-H groep van een peptide-binding vier aminozuren verderop in de
keten (in dit geval van aa6).
Bij de β-sheet (rechts) heeft de eiwitketen een vlakke structuur met een haarspeldachtige bocht, waarbij een C=O van een peptide-binding aan de ene kant van de bocht
(rood), een H-brug kan vormen met een N-H groep van een peptide-binding aan de
andere kant van de bocht (blauw), en vice versa.
3. Tertiaire structuur
De uiteindelijke conformatie van een eiwit ontstaat doordat er niet alleen H-bruggen
gevormd worden tussen de peptide-bindingen, maar er ook covalente (S-S bruggen) en
niet-covalente (H-bruggen; ionogeen; hydrofoob) interacties ontstaan tussen de Rgroepen. Als gevolg daarvan zullen sommige gedeelten van een eiwit een α-helix
structuur hebben, andere gedeelten een β-sheet, en weer andere gedeelten een structuur
hebben die niet als α-helix of β-sheet te omschrijven is. De conformatie van een eiwit
is te bepalen met Röntgen diffractie (X-ray) van eiwitkristallen of met NMR analyse
van (kleine) eiwitten in oplossing. In de uiteindelijke conformatie (figuur links)
worden de α-helix gedeelten aangegeven met een spiraal, en de β-sheet gedeelten met
een pijl (gericht van N-terminaal naar C-terminaal)
4. Quaternaire structuur
Drie-dimensionale structuur van hemoglobine (rechts), bestaande uit het twee αketens (rood) en twee β-ketens (blauw). Alle vier ketens bevatten gedeelten met een
α-helix structuur.
10
Eiwitten als enzymen (Lehninger 6, pag. 192-193,200-210)
Anders dan in een reageerbuis vinden chemische reacties in ons lichaam alleen plaats als er
een specifiek enzym aanwezig is dat werkt als een katalysator. Als resultaat van de evolutie
codeert ons DNA alleen maar voor enzymen die ons lichaam ook echt nodig heeft.
Een chemische reactie kan alleen plaatsvinden als er netto energie (reactie-warmte ∆E) bij vrij
komt. Een enzym beïnvloedt niet de waarde van ∆E voor een chemische reactie, en dus ook
niet de ligging van een chemisch evenwicht. De snelheid waarmee een chemische reactie
plaatsvindt, hangt af van de activeringsenergie. De kinetische energie die vrijkomt bij de
botsing van moleculen kan gebruikt worden om de activeringsenergie te overwinnen. Een
enzym is in staat om de activeringsenergie te verlagen, waardoor de reactiesnelheid sterk
toeneemt. Kortom, de omzetting van A en B naar C en D zal zonder enzym op zijn hoogst
zeer traag verlopen (hoge activeringsenergie), terwijl de reactie met enzym zeer snel zal
verlopen (lage activeringsenergie).
Michaelis-Menten kinetiek
Wil een enzym E de chemische reactie S(ubstraat) => P(roduct) mogelijk maken, dan zullen
het enzym en het substraat-molecuul in oplossing eerst met elkaar moeten botsen. Dit gebeurt
door de zgn. Brownse of warmte-beweging van moleculen in zowel gassen als vloeistoffen.
Als E en S op een juiste manier met elkaar botsen, kan er tijdelijk een enzym-substraatcomplex ES gevormd worden (associatie-proces). In de korte tijd dat dit complex bestaat, kan
S door E worden omgezet in P. Gebeurt dat niet, dan gaan E en S weer uit elkaar (dissociatieproces). In onderstaand schema wordt voor elk van deze deelprocessen een snelheidsconstante
(k) gegeven.
k1
k2
E + S ⇄ ES ⟶ E + P
k-1
Volgens de formules van de reactie-kinetiek wordt de snelheid waarmee E en S associëren tot
ES, gegeven door k1 [E].[S], terwijl de snelheid waarmee ES weer uiteenvalt in E en S wordt
11
gegeven door k-1 [ES]. Het meest interessant is echter de snelheid waarmee ES wordt omgezet
in E en P, omdat dat de snelheid is waarmee het product P wordt gevormd. Volgens het
reactieschema is deze omzettingssnelheid v0 gelijk aan k2 [ES].
Uit bovenstaande volgt dat de snelheid waarmee het complex ES gevormd wordt, gegeven
wordt k1 [E].[S], terwijl de snelheid waarmee het weer afgebroken, ofwel in de vorm van E en
S, ofwel in de vorm van E en P, gegeven wordt door (k2 + k-1) [ES]. Indien we er van uitgaan
dat de snelheid waarmee ES wordt gemaakt gelijk is aan de snelheid waarmee het wordt
afgebroken (zgn. steady state conditie), geldt k1 [E].[S] = (k2 + k-1) [ES]. Van de toegevoegde
hoeveelheid enzym (Et) zal een deel in vrije vorm voorkomen (E) en een deel als ES complex.
In bovenstaande formule geldt dus dat [E] = [Et] – [ES]. Vullen we dit voor [E] in, dan blijkt
.
/
[ES] =
Aangezien de omzettingssnelheid waarmee het product P gevormd wordt, evenredig is met de
concentratie van ES (v0 = k2 [ES]), geldt
v0 =
..
In deze formule is Km de Michaelis-Menten constante, die gedefinieerd is als (k2 + k-1)/ k1. Uit
bovenstaande formule blijkt dat de omzettingssnelheid (v0) afhangt van de aangeboden
substraatconcentratie (S). Aangezien door de enzymreactie de hoeveelheid substraat
geleidelijk zal afnemen, meten wij de omzettingssnelheid altijd direct na toevoegen van
substraat, omdat alleen dan de waarde van S precies bekend is. De v0 in de formule wordt dan
ook de initiële omzettingssnelheid genoemd. Een enzym werkt op zijn hardst (v0 = Vmax) als
S in zeer hoge concentratie aanwezig is. Uit de formule blijkt dat als [S] >> Km, v0 = k2.[Et],
en dus geldt dat k2.[Et] = Vmax. Dit leidt tot de zgn. Michaelis-Menten vergelijking:
v0 =
.
De waarden van Vmax en Km hangen af van het aard van het enzym, de aard van het
substraat, de temperatuur en pH, maar niet van de substraat-concentratie S. Vmax neemt
lineair toe met de toegevoegde enzym-concentratie Et, terwijl Km onafhankelijk is van Et. Uit
de Michaelis-Menten vergelijking blijkt verder dat als [S] = Km, v0 = ½ Vmax. De MichaelisMenten constante Km kan dan ook gedefinieerd worden als de substraatconcentratie waarbij
de omzettingssnelheid v0 de helft is van de maximale omzettingssnelheid Vmax. Hoe hoger de
Km, des te hoger de substraat-concentratie die nodig is om het enzym maximaal te laten
werken.
12
Bepaling van Vmax en Km
Om de waarden van Vmax en Km te bepalen, meten we de omzettingssnelheid v0 als functie
van de substraatconcentratie [S]. In onderstaande grafiek is de waarde van v0 uitgezet bij
toenemende concentraties van [S], gebaseerd op waarden van Vmax=1 en Km=1.
Michaelis-Menten plot
1
0,9
0,8
0,7
0,6
Vo 0,5
0,4
0,3
0,2
0,1
0
0
2
4
6
8
10
12
[S]
Stel dat we op basis van deze Michaelis-Menten plot de waarden van Vmax en Km zouden
willen vaststellen. Ook bij de hoogst weergegeven waarde van [S] (hier 10 x Km) is v0 nog
maar 90% van Vmax, en op het oog extrapoleren wat de waarde van Vmax zal zijn, is erg
onnauwkeurig. Daar komt nog bij dat zolang Vmax niet bekend is, ook Km, zijnde de waarde
van [S] waarbij v0 half-maximaal is, niet eenduidig bepaald kan worden. De waarden van
Vmax en Km kunnen wel eenduidig bepaald als de meetgegevens eerst dusdanig worden
uitgezet dat de punten op een rechte lijn liggen. Deze rechte lijnen kunnen dan geëxtrapoleerd
worden om de waarden van Vmax en Km te berekenen. Wij zullen twee manieren beschrijven
om de Michaelis-Menten vergelijking in een lineaire vorm om te zetten, de Lineweaver-Burk
plot en de Eadie-Hofstee plot.
De Michaelis-Menten vergelijking kan wiskundig herschreven worden tot
=
(
) + (
)
Door nu 1/v0 (op de Y-as) uit te zetten tegen 1/[S] (op de X-as) zullen de meetpunten op een
rechte lijn liggen. Deze rechte lijn kan lineair doorgetrokken worden naar de Y-as, hetgeen
een waarde oplevert voor 1/Vmax, terwijl de helling (trendlijn) van de rechte lijn gelijk is aan
(Km/Vmax). Uit deze twee waarden kan dan berekend worden hoe groot Vmax en Km zijn.
Deze manier van uitzetten van enzymkinetiek-gegevens staat bekend als de Lineweaver-Burk
plot. Deze plot heeft als voordeel dat alle meetpunten bijdragen aan het bepalen van de
waarden van Vmax en Km. Nadeel is echter dat de waarden van 1/[S] doorgaans niet
13
gelijkmatig verdeeld zijn over de X-as (ophoping meetpunten bij lage 1/[S] waarden).
Daardoor is de Lineweaver-Burk plot is erg gevoelig voor meetfouten bij met name lage [S]waarden.
Lineweaver-Burk plot
3,5
3
2,5
2
1/V0
1,5
1
0,5
0
0
0,5
1
1,5
2
2,5
1/[S]
De Lineweaver-Burk plot gebaseerd op bovenstaande meetgegevens geeft aan dat bij [S]=∞
(ofwel 1/[S] = 0) de waarde 1/Vmax = 1, terwijl de helling van de lijn (=Km/Vmax) ook
gelijk is aan 1. (Door extrapolatie van de rechte lijn kan ook het afgesneden stuk met de X-as
bepaald worden; dit komt overeen met -1/Km).
De problemen van de Lineweaver-Burk plot kunnen grotendeels opgelost worden met de
Eadie-Hofstee plot. De Michaelis-Menten vergelijking wordt daartoe herschreven tot
v0 = Vmax – Km. (
)
Door nu v0 (op de Y-as) uit te zetten tegen v0/[S] (op de X-as) zullen de meetpunten op een
rechte lijn liggen, met als helling (-Km) en als afgesneden stuk met de Y-as Vmax.
De Eadie-Hofstee plot gebaseerd op bovenstaande meetgegevens (zie onderstaande figuur)
laat geëxtrapoleerd een afgesneden stuk op de Y-as (Vmax) van 1 zien, terwijl de helling (Km) een waarde heeft van -1 (Het afgesneden stuk met de X-as komt overeen met Vmax/Km).
In de Eadie-Hofstee plot liggen de meetpunten doorgaans gelijkmatiger verdeeld over de X-as
dan in de Lineweaver-Burk plot. Let er op dat zowel in de Lineweaver-Burk als in de EadieHofstee plot het meetpunt met [S]=0 niet wordt meegenomen.
14
Eadie-Hofstee plot
1
0,9
0,8
0,7
0,6
V0 0,5
0,4
0,3
0,2
0,1
0
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
V0/[S]
Reversibele en irreversibele remming van enzymen
Er zijn veel stoffen die de werking van enzymen kunnen remmen. Wij spreken dan van
inhibitors. Daarbij wordt een onderscheid gemaakt tussen irreversibele en reversibele
inhibitors. Een irreversibele inhibitor bindt met een bepaalde snelheid aan het enzym en
eenmaal gebonden laat het niet meer los. Zodra het enzym de inhibitor gebonden heeft, is het
inactief. Irreversibele inhibitors binden vaak covalent aan aminozuren in het actief centrum
van het enzym (voorbeeld: het neurotoxine DFP dat het enzym acetylcholine-esterase remt).
Reversibele inhibitors binden het enzym met een bepaalde snelheid (associatie), maar na
zekere tijd laten ze weer los (dissociatie). In de periode dat de inhibitor aan het eiwit
gebonden is, is het enzym inactief; maar zodra de inhibitor dissocieert, kan het enzym weer
substraat in producten omzetten. Binnen de reversibele inhibitors onderscheiden wij
competitieve inhibitors en non-competitieve inhibitors. Een competitieve inhibitor bindt het
enzym op dezelfde plaats waar ook het substraat bindt. Verschil is alleen dat het substraat
door de enzymreactie kan worden omgezet in een product, terwijl de inhibitor niet kan
worden omgezet. Competitieve inhibitors lijken qua structuur vaak erg op substraatmoleculen. Non-competitieve inhibitors binden het enzym op een andere plaats dan het
substraat. Door binding van de non-competitieve inhibitor verandert de conformatie van het
enzym, waardoor deze geen substraat meer kan binden. De site waar de non-competitieve
inhibitor aan het enzym bindt, wordt de allostere site genoemd.
(Voorbeelden: het enzym hexokinase kan glucose in de aanwezigheid van ATP omzetten in
glucose-6-fosfaat. Het glucose-analoog 2-deoxy-glucose kan wel door het enzym worden
gebonden, maar niet in product worden omgezet, en werkt dus als competitieve inhibitor. Het
enzym carbonic anhydrase is van belang voor de afvoer van CO2 uit ons bloed.
Acetazolamide bindt carbonic anhydrase op een andere site dan CO2, maar verandert de
conformatie van het enzym dusdanig dat CO2 vervolgens niet meer kan binden. Het werkt dus
als een non-competitieve inhibitor).
15
Kinetiek van competitieve inhibitors
Stel dat het enzym E de keus heeft om ofwel het substraat S te binden en het om te zetten in
product P, ofwel de inhibitor I te binden die het niet kan omzetten in producten. Dit zal
aanleiding geven tot onderstaand reactie-schema:
k1
k2
E + S ⇄ ES ⟶ E + P
k-1
k3
E + I ⇄ EI
k-3
Omdat S en I concurreren voor dezelfde binding site, zal er meer S nodig zijn om de halfmaximale omzettingssnelheid te bereiken. I zal dus de waarde van Km verhogen. Als wij
echter een grote overmaat S toevoegen, zal de kans dat het enzym de inhibitor I bindt
verwaarloosbaar klein worden. I heeft dus geen effect op de Vmax van de reactie. Indien wij
in de aanwezigheid van een vaste concentratie I de omzettingsnelheid v0 als functie van [S]
bepalen, zal de reactie aan de Michaelis-Menten kinetiek voldoen, alleen zal de verkregen
waarde van Km' mede bepaald worden door de aanwezige concentratie I, alsmede de snelheid
waarmee het enzym de inhibitor I bindt en weer loslaat. Dit laatste wordt uitgedrukt in een
constante Ki = k-3/k3.
Aangetoond kan worden dat in de aanwezigheid van een competitieve inhibitor geldt:
v0 =
.
=
.
Uit deze formule blijkt dat de reactie aan de Michaelis-Menten kinetiek voldoet, maar dat de
verkregen waarde van Km' wordt bepaald door de Km-waarde van de enzym-substraat binding
en de Ki-waarde van de enzym-inhibitor binding, gegeven door Km' = Km (1 + [I]/Ki).
16
In onderstaande Michaelis-Menten (MM) plot is de waarde van v0 uitgezet bij toenemende
concentraties van [S], gebaseerd op waarden van Vmax=1 en Km=1, maar dan in de
aanwezigheid van een competitieve inhibitor I met een Ki=5, die getest is bij concentraties 0;
5; 10 en 15. Uit de plot blijkt dat de Vmax niet verandert door de aanwezigheid van I, maar
wel de concentratie van [S] waarbij het enzym op half-maximale snelheid werkt (Km'). Dit is
nog duidelijker in de Eadie-Hofstee (EH) plot. Alle lijnen zijn lineair, en snijden na
extrapolatie de Y-as bij 1 (=Vmax). De helling van de lijn (-Km') is afhankelijk van de
concentratie inhibitor. Het afgesneden stuk van de X-as (Vmax/Km) blijkt af te nemen met
toenemende [I]. Om nu de grootte van Ki te bepalen, kan de gemeten waarde van Km' uitgezet
worden tegen de betrokken waarde van [I]. Volgens de formule Km' = Km (1 + [I]/Ki) levert
dit levert een rechte lijn op, met helling Km/Ki en afgesneden stuk op de Y-as gelijk aan Km.
Competitieve inhibitor in MM plot
1
0,9
0,8
0,7
0,6
V0 0,5
0,4
0,3
0,2
0,1
0
[I]=0
[I]=5
[I]=10
[I]=15
0
2
4
6
8
10
12
[S]
Competitieve inhibitor in EH plot
1
0,9
0,8
0,7
0,6
V0 0,5
0,4
0,3
0,2
0,1
0
[I]=0
[I]=5
[I]=10
[I]=15
0
0,2
0,4
0,6
V0/[S]
17
0,8
Kinetiek van non-competitieve inhibitors
Stel dat een enzym E het substraat S en de inhibitor I op een andere site bindt. Zodra I
gebonden is, kan S niet meer binden of, als het al gebonden is, in ieder geval niet meer
worden omgezet in P. Dit zal aanleiding geven tot onderstaand reactie-schema:
k1
k2
E + S ⇄ ES ⟶ E + P
k-1
k3
E + I ⇄ EI
k-3
k3
ES + I ⇄ ESI
k-3
Het gedeelte van het enzym dat I gebonden heeft, zal geen productvorming geven. Als gevolg
hiervan zal de voor de enzymreactie beschikbare concentratie enzym (Et) verlaagd zijn, en dus
zal Vmax = k2. [Et] afnemen met toenemende inhibitor-concentratie. Die enzym-moleculen
die geen I gebonden hebben, zullen echter het substraat op normale binden en omzetten. De
Km van de reactie zal door de aanwezigheid van een non-competitive inhibitor dus niet
veranderen.
Aangetoond kan worden dat in de aanwezigheid van een non-competitieve inhibitor geldt:
v0 =
.
=
./
18
Uit deze formule blijkt dat de reactie aan de Michaelis-Menten kinetiek voldoet, maar dat de
verkregen waarde van Vmax' afneemt met toenemende concentratie en mate van affiniteit van
het enzym voor de inhibitor, gegeven door Vmax' = Vmax / (1+ [I]/Ki).
In onderstaande Michaelis-Menten plot is de waarde van v0 uitgezet bij toenemende
concentraties van [S], gebaseerd op waarden van Vmax=1 en Km=1, maar dan in de
aanwezigheid van een non-competitieve inhibitor I met een Ki=5, die getest is bij
concentraties 0; 2.5; 5 en 10.
Non-competitieve inhibitor in MM plot
1
0,9
0,8
0,7
0,6
V0 0,5
0,4
0,3
0,2
0,1
0
[I]=0
[I]=2.5
[I]=5
[I]=10
0
2
4
6
8
10
12
[S]
Non-competitieve inhibitor in EH plot
1
0,9
0,8
0,7
0,6
V0 0,5
0,4
0,3
0,2
0,1
0
[I]=0
[I]=2.5
[I]=5
[I]=10
0
0,2
0,4
0,6
V0/[S]
19
0,8
Uit de Michaelis-Menten plot blijkt dat de waarde van Vmax' sterk afneemt met toenemende
concentratie I. De helling van de Eadie-Hofstee plot verandert niet door de non-competitieve
inhibitor, hetgeen inhoudt dat de Km niet wordt beïnvloed door een degelijke remmer. Om de
grootte van Ki te bepalen, kan uit het afgesneden stuk van de Y-as voor elke waarde van [I]
een waarde van Vmax' bepaald worden. Gebruik makend van de formule Vmax' = Vmax /
(1+ [I]/Ki) kan vervolgens 1/Vmax' uitgezet worden tegen [I], hetgeen een rechte lijn oplevert
met afgesneden stuk 1/Vmax en helling 1/Vmax.Ki.
Gemengde inhibitie
Om experimenteel te bepalen of een inhibitor competitief of non-competitief werkt, zal de
Michaelis-Menten plot bepaald moeten worden bij verschillende concentraties van de
inhibitor. Blijkt dat in de Eadie-Hofstee plot de helling wel wordt beïnvloed, maar niet het
afgesneden stuk op de Y-as, dan hebben wij te maken met competitieve inhibitie. Blijkt juist
dat de helling van de Eadie-Hofstee plot niet wordt beïnvloed, maar wel het afgesneden stuk
van de Y-as, dan hebben wij te maken met non-competitieve inhibitie.
Veel inhibitors blijken zowel de Vmax als de Km van de enzymreactie te beïnvloeden. Wij
spreken dan van gemengde inhibitie. Dit kan onder andere gebeuren als de Ki-waarde voor de
reactie E+I↔EI anders is dan voor ES+I↔ESI. In dat geval zal in de Eadie-Hofstee plot
zowel de helling als het afgesneden stuk van de Y-as door de inhibitor beïnvloed worden.
Spectrofotometrische analyse: de wet van Lambert-Beer (Lehninger 6, pag. 80)
Veel stoffen in oplossing zijn in staat om licht van een bepaalde golflengte te absorberen.
Gekleurde stoffen doen dit bij een golflengte waar onze ogen gevoelig voor zijn, maar
eiwitten zijn bijvoorbeeld in staat om ultraviolet licht met een golflengte van 280 nm te
absorberen. Dit komt met name door de aanwezigheid van aromatische aminozuren, zoals
tyrosine en tryptophan. Er blijkt een eenduidige relatie te bestaan tussen de concentratie van
een stof in oplossing en de mate waarin die oplossing licht van een bepaalde golflengte kan
absorberen. Dit staat geformuleerd in de wet van Lambert-Beer.
20
Stel dat in een cuvet met diameter d zich
een eiwitoplossing bevindt met
concentratie c. Laten wij nu licht van in
dit geval 280 nm met een intensiteit I0 op
de cuvet vallen, dan zal een deel van het
licht door het eiwit geabsorbeerd worden,
zodat de intensiteit van het licht dat uit de
cuvet komt, lager dan I0 zal zijn. Deze
wordt I1 genoemd. Het deel van het licht
dat doorgelaten wordt (I1/I0) staat dan
bekend als de transmissie (T).
Wil een eiwit een lichtdeeltje kunnen absorberen, dan moeten beide in de oplossing eerst met
elkaar botsen. De kans daarop is evenredig met de lichtintensiteit ter plaatse en met de
eiwitconcentratie (die in de gehele oplossing constant is). De lichtintensiteit neemt echter
geleidelijk af tijdens de doorgang door de cuvet, met als gevolg dat er in de eerste helft van de
cuvet meer licht zal worden geabsorbeerd dan in de tweede helft. Het gevolg is dat de afname
van de lichtintensiteit niet lineair is met de cuvetdiameter (d) en eiwitconcentratie (c), maar
logaritmisch. In formule:
T=
= 10!"#
In deze wet van Lambert-Beer is ε een constante, die afhangt van de aard van de gemeten stof
en de gebruikte golflengte. Deze constante wordt de extinctie-coëfficient genoemd. Meestal
wordt niet de transmissie (T = I1/I0) gemeten, maar de absorptie (A), ook wel extinctie (E)
genoemd, die gedefinieerd is als A = - 10log T = ε.c.d. Het voordeel van het werken met A is
dat deze evenredig is met de concentratie van de stof in oplossing. Als wij van diverse
bekende concentraties van een stof (c) de waarde van A bepalen, kunnen wij een zogenoemde
ijklijn maken, waarin A staat uitgezet tegen c. Uit het verkregen lineaire verband kan dan de
waarde voor ε bepaald worden. Is ε eenmaal bekend, dan kan bij iedere gemeten waarde van
A de bijbehorende concentratie berekend worden. De waarde van ε voor eiwitten is relatief
constant, en daardoor kan voor eiwitten de ijklijn met een standaard-eiwit gemeten worden
(bijvoorbeeld bovine serum albumine) en de verkregen waarde van ε ook gebruikt worden om
de concentratie van andere eiwitten in oplossing te bepalen. De grootheid A is een
dimensieloos getal (exponent van een 10e macht), en dus wordt de dimensie van ε bepaald
door de eenheden waarin c en d staan uitgedrukt.
21
Eigenschappen van eiwitten
Ons lichaam bevat honderden verschillende eiwitten die elk een specifieke functie hebben.
Aangezien alle eiwitten uit lineaire ketens van aminozuren bestaan, wordt de functie van een
eiwit bepaald door het aantal aminozuren in de eiwitketen, en de specifieke opeenvolging van
R-groepen. Gebaseerd hierop kunnen aan elk eiwit drie karakteristieke eigenschappen
worden toegekend:
1. Molmassa (M): deze komt overeen met het aantal gram eiwit dat nodig is voor 1 mol
(getal van Avogadro) aan moleculen, en wordt uitgedrukt in Daltons (Da). Voor 1 mol
H-atomen is 1 gram nodig, en dus is de molmassa van een H-atoom 1 Da. Voor
eiwitten wordt de molmassa meestal uitgedrukt in kDa (1000 Da). De molmassa van
een eiwit wordt bepaald door het aantal aminozuren in de eiwitketen. De waarde kan
experimenteel worden bepaald (zie chromatografie) of worden berekend door de
molmassa van alle ingebouwde aminozuren op te tellen, verminderd met het aantal
H2O moleculen dat tijdens de vorming van het eiwit is afgesplitst.
2. Iso-electrisch punt (IEP of pI): dit is de pH van de oplossing waarbij de netto lading
van een eiwit nul is. De pI kan experimenteel worden bepaald (zie chromatografie) of
berekend worden uit de pK waarden van de vrije –NH2 en –COOH groepen in het
eiwit. Een lage pI waarde duidt op een relatief overschot aan aminozuren met een COOH groep (Glu, Asp), terwijl een hoge pI waarde duidt op een relatief overschot
van aminozuren met een –NH2 groep (Lys, Arg).
3. Apolair karakter: dit wordt bepaald door de relatieve bijdrage aan apolaire en
aromatische aminozuren in het eiwit.
Theoretisch kan het apolair karakter van een eiwit
worden bepaald door de waarden voor de hydropathyindex van de individuele aminozuren op te tellen (zie
tabel; hoe sterker positief de waarde, des te meer apolair
het eiwit) . Experimenteel kan het apolair karakter
worden bepaald door het verdelingsevenwicht (Kap) van
een eiwit tussen een waterfase en een niet- mengbare
organische vloeistof (bijv. n-octanol) te bepalen (zie
figuur). De beide fasen worden geroerd in de
aanwezigheid van het eiwit, en na ontmenging wordt de
concentratie van het eiwit in zowel de apolaire als de
polaire fase gemeten. De verhouding van deze twee
concentraties is de verdelingscoëfficiënt Kap.
Hoe meer apolaire zijketens een eiwit bevat, des te hoger zal de concentratie in
hexaan bedragen (hoge Kap waarde). Hoewel de hydrophathy-index en Kap op
dezelfde eigenschap berusten, zijn de getalwaarden niet onderling te vergelijken.
22
Oplosbaarheid van eiwitten (Lehninger 6, pag. 143,144)
De netto lading van een eiwit hangt af van de pH van het waterig medium. Indien wij een
zuiver eiwit in oplossing hebben, zullen alle eiwitmoleculen dezelfde netto lading hebben en
elkaar dus afstoten, hetgeen de oplosbaarheid verhoogt. Bij het iso-electrisch punt zal de
oplosbaarheid van zuivere eiwitten het laagst zijn, omdat de eiwitten dan een netto lading nul
hebben en elkaar dus het minst zullen afstoten.
Als we een netto positief (pH < pI) en een netto negatief (pH > pI) eiwit gezamenlijk in
oplossing brengen, kunnen deze twee eiwitten elkaar aantrekken en samen een complex
vormen dat onoplosbaar is (neerslag). Door het toevoegen van ionen kunnen dergelijke
complexen weer oplossen. Dit komt omdat ionen in oplossing geladen groepen afschermen,
waardoor positief en negatief geladen groepen elkaar minder goed kunnen aantrekken.
In de afwezigheid van ionen lossen veel eiwitten slecht op omdat zij dan geen goede
conformatie kunnen aannemen. Maar ook bij heel hoge zoutconcentraties (bijv. in 6M
ammonium-sulfaat) slaan de meeste eiwitten neer, omdat de ionen dan het water binden dat
nodig om de eiwitten in een goede conformatie te houden. Door in dat laatste geval water toe
te voegen, neemt de ionconcentratie af en zal het eiwit weer in oplossing gaan (reversibele
denaturatie).
Chromatografische scheiding van eiwitten
Eiwitscheidingstechnieken worden ook wel aangeduid met de term chromatografie (letterlijk:
het schrijven/scheiden van gekleurde stoffen). Eiwitten kunnen van elkaar gescheiden worden
op basis van hun verschillen in molmassa, iso-electrisch punt of apolair karakter.
Er wordt onderscheid gemaakt tussen:
1. Analytische technieken: Deze zijn bedoeld om te identificeren welke eiwitten zich in
een monster bevinden en wat hun eigenschappen zijn (M, pI). De analyse vindt plaats
op een klein deel van het testmonster en kan onder denaturerende omstandigheden
plaatsvinden (voorbeelden: SDS gel-electroforese; iso-electric focussing).
2. Preparatieve technieken: Deze zijn bedoeld om eiwitten zuiver en in actieve vorm in
handen te krijgen. De analyse-methoden zijn grootschalig en vinden plaats onder nietdenaturerende condities (voorbeelden: gelpermeatie-chromatografie; ion-uitwisselingschromatografie; reversed-phase chromatografie; affiniteits-chromatografie).
SDS gel-electroforese (SDS-PAGE) (Lehninger 6, pag. 93,94)
Dit is een analytische techniek waarbij eiwitten op grootte worden gescheiden. De techniek
wordt gebruikt om de eiwitten te identificeren die zich in een testmonster bevinden en om de
molmassa van eiwitten experimenteel te bepalen. SDS (sodium dodecyl sulphate) vormt
micellen in water, doordat de apolaire ketens zich gezamenlijk afwenden van water (figuur
links). Eiwitten opgelost in SDS worden lineair uitgerekt (irreversibele denaturatie) en
23
vormen aldus een gemengd micel (figuur rechts). Hoe groter het eiwit, door des te meer SDS
moleculen het omringd zal worden. Door de negatieve lading van de SDS moleculen wordt
zowel de grootte als de lading van de SDS-eiwit complex uitsluitend bepaald door de
molmassa van het eiwit. SDS-eiwit complex worden op een poly-acrylamide gel (figuur
midden) gebracht, en door middel van een electrisch veld (positieve lading onder) de gel
ingetrokken. Door wrijving bewegen kleinste eiwitten zich het snelst door de gel. Kleuring
van de eiwitten op gel vindt plaats met Coomassie blue of zilver staining. De molmassa van
een onbekend eiwit kan bepaald door parallel een aantal ijkeiwitten met bekende molmassa op
te brengen (zie figuur midden).
Iso-electric focusing (Lehninger 6, pag. 95,96)
Dit is een analytische techniek waarbij eiwitten op lading worden gescheiden. De techniek
wordt gebruikt om het iso-electrisch punt van een eiwit experimenteel te bepalen. Meestal
wordt iso-electric focussing in combinatie met SDS electroforese uitgevoerd, waardoor
complexe eiwitmengsels twee-dimensionaal van elkaar gescheiden kunnen worden.
24
In een buisje met acrylamide gel kan met behulp van zgn. ampholytes en een tijdelijk
aangelegd electrisch veld een stabiele pH gradient worden aangelegd (boven hoge pH, onder
lage pH). Het eiwitmonster wordt nu zonder SDS op de gel gebracht, waarna de eiwitten door
een electrisch veld (beneden positief) de gel worden ingetrokken. Tijdens het bewegen in de
gel verandert de lokale pH, en daarmee ook de netto lading van het eiwit. Als een eiwit bij een
pH komt die gelijk is aan zijn pI, zal zijn netto lading nul worden en zal het eiwit niet verder
meer de gel in bewegen (figuur links boven).
Na iso-electric focusing kan de gel, met daarin de op lading gescheiden eiwitten, horizontaal
op een SDS gel gebracht worden en kunnen de eiwitten vervolgens verticaal op molmassa
worden gescheiden (figuur rechts). Alle eiwitten in het testmonster zijn dan 2-dimensionaal
op zowel lading als grootte van elkaar gescheiden. Van individuele eiwitspotjes kan dan een
gedeeltelijke aminozuur-volgorde worden bepaald met behulp van massaspectrometrie,
waarna aan de hand van de bekende DNA sequentie van het menselijk genoom van elk spotje
kan worden bepaald om welk eiwit het gaat (“proteomics”).
Preparatieve chromatografie (Lehninger 6, pag. 89-92)
Bij preparatieve chromatografie wordt gebruik gemaakt van een kolom (cylindrische buis),
die gevuld is met cellulose-korreltjes (“beads”). Afhankelijk van de soort chromatografie
wordt er aan deze beads een bepaalde chemische groep gehecht, die bepaalt of eiwitten al dan
niet aan de kolom gaan binden. De kolom met beads wordt doorgespoeld met een buffer, die
via een bovenstaand vloeistofreservoir wordt toegevoegd. Indien er een mengsel van eiwitten
op een met beads gevulde kolom wordt gebracht, zullen door de eigenschappen van het
kolommateriaal sommige eiwitten snel en andere langzaam door de kolom heen lopen (groen
> rood > blauw> bruin).
Onderaan de kolom staan reageerbuisjes waarin de buffer en de eiwitten die van de kolom
afkomen (elueren), worden opgevangen. Na een vastgestelde tijd schuift een volgende buis
25
(fractie) onder de kolom en vangt de volgende hoeveelheid buffer op. Of er eiwit van de
kolom afkomt, kunnen we meten aan de mate van lichtabsorptie bij 280 nm (A280). In het
kolom-elutieprofiel staat de A280 uit tegen de tijd (t) of tegen het fractie-nummer (zie figuur
boven rechts). Bij sommige vormen van kolom-chromatografie blijft de buffer gedurende de
elutie dezelfde (isocratische elutie), terwijl bij andere vormen van kolom-chromatografie de
buffer tijdens de elutie verandert (gradiënt-elutie). Een eventuele gradiënt wordt in het kolomelutieprofiel aangegeven,
Beads voor gelpermatie-chromatografie (links), ion-uitwisselingschromatografie (midden) en
reversed phase chromatografie (rechts)
Gelpermeatie-chromatografie
1. Scheiding op grootte (molmassa).
2. Beads bevatten poriën van een bepaalde grootte, waarin kleine eiwitten (P1) wel en
grote eiwitten (P2) niet kunnen binnendringen.
3. De eiwitten binden niet aan de beads.
4. Isocratische elutie zonder gradient (licht gebufferde zoutoplossing).
5. Grootste eiwitten elueren het eerste.
Ion-uitwisselings-chromatografie
1. Scheiding op lading.
2. Aan de beads zijn zure (-COOH) of basische (-NH2) groepen gekoppeld (bijv. CM:
carboxy-methyl cellulose; DEAE: di-ethyl-amino-ethyl cellulose). Deze beads werken
alleen als ionenwisselaar bij een pH waarbij deze ioniseerbare groepen geladen zijn
(COO- of NH3+).
26
3. Eiwitten met eenzelfde lading als de beads worden niet gebonden en elueren snel van
de kolom.
4. Eiwitten met tegengestelde lading als de beads worden gebonden en elueren niet
spontaan van de kolom.
5. Gebonden eiwitten kunnen van de beads geëlueerd worden door de zoutsterkte van de
buffer te verhogen (gradiënt-elutie). Bij de geleidelijke verhoging van de zoutsterkte
zullen de minst geladen eiwitten het eerste elueren.
Reversed-phase-chromatografie
1.
2.
3.
4.
Scheiding op apolair karakter.
Aan de beads zijn lange apolaire ketens gekoppeld (bijv. C8 of C18-silica).
Eiwitten worden in een waterig milieu op de kolom gebracht.
Alle eiwitten binden met hun apolaire zijketens aan de kolom, zodat deze zich van het
water kunnen africhten (hydrofobe interactie).
5. Eiwitten worden geëlueerd door een gradiënt aan te leggen van een apolaire vloeistof
(ethanol, acetonitril (MeCN), propanol). Deze apolaire “oplosmiddelen” zijn volledig
mengbaar met water.
6. Eiwitten met het minste aantal apolaire groepen (lage Kap) zullen het eerst elueren.
7. Door het gebruik van apolaire vloeistoffen bestaat het risico op eiwit-denaturatie.
Affiniteitschromatografie (Lehninger 6, pag. 92, 326)
1. Aan beads zijn chemische stoffen gekoppeld, die specifiek een bepaald eiwit binden
(voorbeeld: antilichamen; GST; protein A)
2. Alle eiwitten zullen door kolom lopen, alleen het specifiek herkende eiwit zal binden
(1-stap zuivering)
3. Elutie van gebonden eiwit door verhoging van de zoutsterkte (gradiënt-elutie of
stapsgewijs)
4. Antilichamen zijn immunoglobuline–moleculen die bestaan uit twee zware en twee
lichte ketens, aan elkaar gebonden via S-S bruggen. Een deel van het antilichaammolecuul is variabel (herkent specifieke antigen), een ander deel is vast (specifiek
27
voor de diersoort waarin antilichaam is gemaakt). Het Fc gedeelte van
immunoglobuline-molecuul bestaat uit twee ketens (dimeer), terwijl het Fab gedeelte
uit vier ketens bestaat (tetrameer).
Voorbeelden van gelpermeatie-chromatografie, ion-uitwisselingschromatografie en
reversed-phase chromatografie voor het scheiden van een mengsel van vier modeleiwitten
28
Stapsgewijs zuiveren van eiwitten (Lehninger 6, pag. 95,96)
Bij complexe eiwitmengsels is het doorgaans niet mogelijk om met een enkele
chromatografie-kolom het eiwit van interesse geheel gezuiverd in handen te krijgen. De kans
is namelijk groot dat er verontreinigende eiwitten aanwezig zijn met vergelijkbare molmassa,
iso-electrisch punt of apolair karakter. In dat geval kunnen ion-uitwisselingschromatografie,
gelpermeatie-chromatografie en reversed phase chromatografie successievelijk achter elkaar
gebruikt worden. Bij elke chromatografiestap worden alleen die fracties van de vorige kolom
meegenomen, waarin het eiwit van interesse zich bevindt. Het tussenresultaat kan na iedere
kolomstap met SDS electroforese zichtbaar worden.
1.
2.
3.
4.
5.
Cel-extract
Laan 1 na ion-uitwisselingschromatografie
Laan 2 na gelpermeatie-chromatografie
Laan 3 na reversed phase chromatografie
Eiwit markers (molmassa)
Het is essentieel dat men bij iedere kolomstap de fracties kan identificeren, waarin het eiwit
van interesse zich bevindt. Voor het opzuiveren van een enzym kan dit door in de
kolomfracties de enzym-activiteit te meten. Voor een eiwit-hormoon kan dit door in de
kolomfracties de hormoon-activiteit te meten. De mate van zuivering van elke kolomstap kan
bepaald worden door de specifieke activiteit (SA) van het eiwit van interesse te meten. De SA
van een preparaat is gedefinieerd als de aanwezige hoeveelheid van het te zuiveren eiwit,
gedeeld door de totale hoeveelheid aanwezig eiwit; ofwel, voor een hormoon of enzym, als
de aanwezige activiteit van het te zuiveren eiwit, gedeeld door de totale hoeveelheid aanwezig
eiwit. Hoe hoger SA, des te hoger de mate van opzuivering van het eiwit. Als het eiwit
eenmaal volledig zuiver is, bereikt het een maximale SA waarde.
Aantonen van een specifieke eiwit via immunoblotting (Lehninger 6, pag. 178,179)
Coomassie blue en zilver staining zullen alle eiwitten op een SDS gel aankleuren. Als men
beschikt over een specifiek antilichaam tegen een bepaald eiwit, is het mogelijk in het SDS
patroon van een complex eiwitmengsel alleen dit specifieke eiwit aan te tonen. Antilichamen
kunnen echter niet een polyacrylamide gel binnendringen. Daarom moeten de eiwitten op de
SDS gel (zonder aankleuren) eerst “overgeblot” worden cellulose-papier. Dit gebeurt door een
stuk cellulose-papier op de gel te leggen en aan de papierkant een positieve spanning aan te
leggen. De negatief geladen eiwit-SDS complexen zullen dan vanuit de gel het papier in
29
bewegen. Het cellulose-papier kan nu geïncubeerd worden met het specifieke antilichaam.
Om de plaats zichtbaar te maken waar het antilichaam bindt, moet het antilichaam gelabeld
worden met 125I (radio-actief) of met het enzym peroxidase. Dit enzym kan ter plaatse een
kleurloos substraat omzetten in een gekleurd product. Deze techniek heet immunoblotting of
ook wel Western blotting.
De meeste antilichamen worden in konijn gemaakt (zgn. polyclonale antilichamen) en hebben
dus alle hetzelfde konijn-specifieke Fc fragment. Hiervan kan gebruik gemaakt worden om
binding van een specifiek antilichaam op een blot zichtbaar te maken, zonder dat ieder
antilichaam individueel gelabeld hoeft te worden. Commercieel is een peroxidase-gelabeld
antilichaam beschikbaar dat gericht is tegen konijn Fc. Dat staat bekend goat-anti-rabbitperoxidase (GARPO). De blot kan nu eerst geïncubeerd worden met het specifieke
antilichaam (dat zelf niet eerst gelabeld hoeft te worden) en vervolgens met GARPO om de
plaats waar het specifieke antilichaam is gebonden, zichtbaar te maken.
Links: SDS gel van markereiwitten en complex eiwit-mengsel, gekleurd met Coomassie Blue.
Midden: Eiwitblot geïncubeerd met 125I-antilichaam tegen 48 kDa eiwit.
Rechts: Prinicipe van kleuring met een peroxidase-gelabeld secondair antilichaam (GARPO)
30
Syllabus Celbiochemie (2013-2014
2014)
Deel II:
I: Bioenergetica van de Cel
De Bioenergetica
energetica bestudeert hoe cellen aan hun energie komen en hoe zij deze energie
kunnen
nen gebruiken om processen mogelijk te maken die op zich energie kosten. Een centrale
rol hierbij speelt het molecuul ATP (adenosine triphosphate). Verbranding van suikers en
vetten levert energie op in de vorm van ATP, terwijl transportprocessen die energ
energie kosten
ATP verbruiken.
Lehninger 6, pag. 244-245)
244
Structuur van suikers (Lehninger
Suikers,, ook wel koolhydraten genaamd, bestaan uit een koolstofketen met daaraan alcohol
alcohol-,
aldehyde-, keton- en/of carbonzuurgroepen. Wij onderscheiden aldose-suikers en ketosesuikers. De simpelste aldose-suiker
suiker is glyceraldehyde, de simpelste ketose-suiker
ketose suiker is
dihydroxy-aceton.
aceton. Deze twee suikers hebben evenveel C-,
C H- en O-atomen,
atomen, en kunnen door
het enzym isomerase in elkaar worden omgezet (aldose-ketose omzetting).
Merk op dat het tweede C-atoom
atoom van glyceraldehyde een asymmetrisch C-atoom
atoom is.
31
Asymmetrische C-atomen (D/L regel)
32
Wij spreken dus af dat de in de platte structuur van glyceraldehyde de -H en -OH naar voren
het blad uitsteken, en de -CHO en -CH2OH naar achteren het blad insteken.
Per definitie tekenen wij in D-glyceraldehyde de –CHO omhoog, de -CH2OH omlaag, en de –
OH aan het middelste C-atoom naar rechts. Alle verbindingen in de natuur die met behoud
van asymmetrie uit D-glyceraldehyde gemaakt kunnen worden, noemen wij D-verbindingen.
Hiertoe behoren alle in de natuur voorkomende suikers.
Per definitie tekenen wij in L-glyceraldehyde de –CHO omhoog, de -CH2OH omlaag, en de –
OH aan het middelste C-atoom naar links. Alle verbindingen in de natuur die met behoud van
asymmetrie uit L-glyceraldehyde gemaakt kunnen worden, noemen wij L-verbindingen.
Hiertoe behoren alle in de natuur voorkomende aminozuren.
De D/L-regel is een kwestie van afspraak en heeft dus niets met links- of rechtsdraaiend te
maken.
Enkelvoudige chemische bindingen, zoals een C-C, C-O of C-H, zijn vrij draaibaar. In een
tetraëder kun je één groep vasthouden en de andere drie ten opzichte van elkaar draaien,
met behoud van asymmetrie. Onderstaande verbindingen zijn dus gedraaide vormen van Dglyceraldehyde (links) en L-glyceraldehyde (rechts). Je mag echter niet alle vier groepen in de
vlakke projectie ten opzichte van elkaar draaien, want dan krijg je de andere isomeer.
Asymmetrische C-atomen (R/S regel) (Lehninger 6, pag.18)
Voor complexe organische verbindingen met een asymmetrisch C-atoom is het vaak moeilijk
te bepalen of dit in de natuur uit D-glyceraldehyde of L-glyceraldehyde is ontstaan. Vandaar
dat er naast de D/L-regel de meer rationele R/S-regel bestaat, waarmee de absolute
configuratie van een stof kan worden vastgelegd.
33
N.B. Er is geen relatie tussen D/L en R/S configuratie. In de citroenzuurcyclus zullen wij zien
dat sommige enzymen ook niet-asymmetrische C-atomen als asymmetrisch kunnen
behandelen.
34
Aldose suikers (Lehninger 6, pag. 246-248)
Rechts staat de algemene structuur van een
aldose-suiker. De aldehyde-groep wordt altijd
naar boven getekend (C-atoom nummer 1). De –
OH op het voorlaatste C-atoom staat altijd naar
rechts (want alle natuurlijke suikers zijn Dsuikers). Elk extra ingevoegd C-atoom bevat een
–H en een –OH groep, en is asymmetrisch.
Aangezien de –OH op het voorlaatste C-atoom
altijd naar rechts staat, zijn bij de andere Catomen de vorm met –OH naar rechts en –OH
naar links niet elkaars spiegelbeeld. Zij hebben
daarom ieder een eigen naam (zgn. epimere
vormen).
Binnen
Binnende
dealdose-suikers
aldose-suikersbestaan
bestaan
ererdan
danook
ooktwee
tweetetrose
tetrose suikers
suikers(4(4
C-atomen;
C-atomen;erythrose
erythroseen
enthreose),
threose),
vier
vierpentoses
pentoses(5(5C-atomen;
C-atomen;bijv.
bijv.
ribose),
ribose),en
enacht
achthexoses
hexoses(6(6CCatomen;
atomen;bijv.
bijv.mannose,
mannose,glucose
glucose
en
engalactose).
galactose).Zie
Ziebijgevoegde
bijgevoegde
structuren.
structuren.
35
Ketose suikers
Ketose-suikers hebben als eerste C-atoom een CH2OH groep, en op het tweede C-atoom een
keto-groep. Op het voorlaatste C-atoom hebben zij een –OH groep naar rechts (D-suiker) en
op het laatste C-atoom wederom een CH2OH groep. In tegenstelling tot glyceraldehyde heeft
dihydroxy-aceton geen asymmetrisch C-atoom. Die ontstaan pas als er extra C-atomen met –
H en –OH groep worden ingebouwd. Daarvan heeft het voorlaatste C-atoom altijd de –OH
naar rechts.
Er is dus maar één ketose-suiker met 4 C-atomen, 2 met 5 C-atomen en 4 met 6 C-atomen.
Daarvan is de belangrijkste het D-fructose (zie onderstaande structuur). D-fructose is de
ketose-vorm van D-glucose, en beide vormen kunnen enzymatisch in elkaar omgezet worden
(aldose-ketose omzetting).
(Links: algemene structuur van ketose-suikers, rechts fructose, de belangrijkste 6C-ketose)
Ringstructuur van suikers
Suikers met 5 of 6 C-atomen kunnen ringstructuren vormen. Dit komt doordat de -OH groep
op het voorlaatste C-atoom met zijn δ- aanvalt op de δ+ van het C-atoom van de aldehydegroep (C1 bij aldose-suikers) of keto-groep (C2 bij ketose-suikers). Er ontstaat dan een
heterocyclische verbinding van ofwel 5 C-atomen en 1 O-atoom (pyranose), ofwel van 4 Catomen en 1-O-atoom (furanose). Onderstaand is de ringstructuur van D-glucose aangegeven.
Door de ringsluiting gaat de aldehyde-groep op C1 over in een –OH groep. Het gevolg is dat
C1 nu een nieuw asymmetrisch C-atoom wordt, waarbij deze –OH ofwel aan dezelfde kant
van de ring komt te staan als de -CH2OH groep (β-vorm) ofwel aan de tegenovergestelde
kant van de ring (α-vorm). Zolang er aan deze –OH groep op C1 geen andere chemische
groep gezet wordt, kan glucose zowel in de open structuur (1%), de α-vorm (33%) of de βvorm (66%) voorkomen. We spreken hier van een dynamisch evenwicht, waarbij een enkel
glucose-molecuul steeds van een open structuur overgaat naar een van de beide
ringstructuren, dusdanig dat het molecuul zich netto 1% van de tijd in de open structuur
bevindt, 33% in de α-vorm en 66% in de β-vorm.
36
De ringstructuur van glucose in
de α-vorm heet α-Dglucopyranose, die in de β-vorm
β-D-glucopyranose. Zodra de –
OH groep op C1 door een
chemische reactie wordt omgezet
in een andere groep (bijv. –
OCH3), kan de suiker niet meer
overgaan in de open structuur, en
zit hij dus vast in ofwel de αvorm ofwel de β-vorm van de
ringstructuur.
Fructose kan een 5-ring vormen waarbij de
keto-groep op C2 overgaat in een –OH
groep. Ook hierbij ontstaat weer een nieuw
asymmetrisch C-atoom, en onderscheiden
we naast de open structuur de ringstructuren
α-D-fructofuranose en β-D-fructofuranose.
Zolang de –OH op C2 niet in een andere
groep is omgezet, zijn de drie vormen in een
dynamisch evenwicht met elkaar. Overigens
kan fructose ook een 6-ring vormen, als niet
de –OH op C5, maar die op C6 aanvalt op
de keto-groep van C2. Aldose-suikers met 5
C-atomen, zoals ribose, kunnen een vijfring
vormen, en door die ringen aan elkaar te
koppelen vormt dit de backbone van het
RNA.
37
Suikers vormen polymeren (Lehninger 6, pag. 252-253)
De meeste in de natuur voorkomende suikers bestaan uit ketens van hexose of pentoseeenheden. De bekendste voorbeelden hiervan zijn de disacchariden sucrose (zoetstof) en
lactose (melksuiker).
Sucrose bestaat uit een glucose, gebonden aan een fructose. De binding is ontstaan doordat
een –OH groep van glucose een ether-binding is aangegaan met een –OH van fructose (C-OH
+ HO-C ↔ C-O-C + H2O). Doordat in glucose de –OH van C1 en bij fructose de –OH van C2
bij deze etherbinding zijn betrokken, zit zowel de glucose- als de fructose eenheid in het
sucrose-molecuul vast in de ringstructuur en kunnen zij niet overgaan in een open structuur.
Lactose bestaat uit een galactose, die via een etherbinding verbonden is aan een glucose. Bij
deze etherbinding is de –OH van C1 van galactose betrokken, maar de –OH van C4 van
glucose. De –OH van C1 van glucose is dus onveranderd, en vandaar dat de glucose-ring in
lactose in zowel de open structuur, de α-vorm als de β-vorm kan voorkomen.
Als energiebron worden suikers vaak opgeslagen in langere ketens. Voorbeelden hiervan zijn
glycogeen (in spieren), zetmeel en cellulose (in planten). Ook bevatten veel eiwitten die door
de plasmamembraan heen steken, suikergroepen. Wij spreken dan van glycoproteinen.
Dergelijke, vaak complexe, suikergroepen op eiwitten spelen onder andere een rol bij afweerreacties van het lichaam. Voorbeeld hiervan zijn de A-, B- en O- bloedgroepen.
38
Energie en entropie (Lehninger 6, pag. 22-27; 506-508)
De eerste hoofdwet van de thermodynamica (warmteleer) zegt dat energie wel van de ene in
de andere vorm kan overgaan, maar dat energie niet gemaakt kan worden of verloren kan
gaan. Een pen die wij op een meter afstand boven de grond houden, heeft potentiële energie.
Zodra wij de pen loslaten, zal deze door de zwaartekracht steeds sneller naar beneden vallen,
waarbij de potentiële energie wordt omgezet in kinetische energie. Eenmaal op de grond
wordt deze kinetische energie omgezet in warmte, waarbij de moleculen van de pen en van de
vloer iets sneller zullen gaan bewegen. Volgens de eerste hoofdwet van de thermodynamica is
het theoretisch ook mogelijk dat bewegende moleculen in de vloer hun energie op de pen
overdragen, waardoor deze een meter de lucht ingeschoten wordt. Dit vereist echter dat alle
moleculen in de vloer zich tegelijk in dezelfde richting (omhoog) bewegen. De kans dat dit
gebeurt is echter zo onwaarschijnlijk klein, dat in de praktijk een “omhoogvallende” pen nooit
wordt waargenomen. Bovenstaand voorbeeld geeft aan dat van alle processen die volgens de
wet van behoud van energie mogelijk zijn, sommige wel en andere niet waarschijnlijk zijn.
De waarschijnlijkheid waarmee processen optreden,
kunnen wij bestuderen aan de hand van 20 kaarten, elk
met een rode en een blauwe kant. Als wij deze kaarten
in de lucht gooien, is de kans erg klein dat alle kaarten
met de rode of juist met de blauwe kant naar boven
komen te liggen. Veel waarschijnlijker is het dat 10
kaarten met de blauwe en 10 met de rode kant naar
boven komen te liggen. Dat komt doordat er maar 1
configuratie mogelijk is met 20 rode (of 20 blauwe)
kaarten omhoog, terwijl er wel 184756 vergelijkbare
configuraties zijn met 10 rode en 10 blauwe kaarten
omhoog. Als rode kaarten luchtmoleculen zijn die
naar links bewegen en blauwe naar rechts, dan is het
even (on-)waarschijnlijk dat 20 luchtmoleculen zich op
een gegeven ogenblik allemaal één kant op bewegen.
Wij kunnen deze waarschijnlijkheid kwantificeren met het begrip entropie (S). Volgens de
Boltzmann vergelijking wordt deze gegeven door S = k. ln W, waarin k de Boltzmann
constante is (gasconstante R gedeeld door getal van Avogadro) en W het aantal mogelijke
configuraties dat leidt tot eenzelfde uitkomst (vergelijkbare configuraties). W is veel groter
voor 10 rood/10 blauw dan voor 20 rood/0 blauw of 0 rood/20 blauw, en dus kunnen wij
zeggen dat van alle mogelijke configuraties 10 rood/ 10 blauw de hoogste entropie heeft. Dus
hoe hoger de entropie, des te waarschijnlijker is het dat een bepaalde situatie zich zal
voordoen.
39
Gibbs energie
De natuur streeft naar een zo laag mogelijke potentiële energie. Dat betekent dat bij spontaan
optredende processen potentiële energie via andere energievormen uiteindelijk wordt omgezet
in warmte. De potentiële en kinetische energie van een systeem die beide in warmte omgezet
kunnen worden, worden gezamenlijk aangeduid met de term enthalpie (H). Bij processen
waarbij energie in de vorm van warmte vrij komt, neemt de waarde van H af (ofwel ∆H<0).
Toch kan de natuur niet alleen verklaard worden met een streven naar een zo laag mogelijke
potentiële energie. Immers, dan zouden alle luchtmoleculen onder invloed van de
zwaartekracht op het aardoppervlak moeten liggen. Als wij in een 3-dimensionale box een
aantal moleculen willekeurig een plaats laten innemen, is de kans echter erg klein dat zij
toevallig allemaal in de linker of allemaal in de rechter helft terechtkomen; of allemaal onder
in of allemaal boven in de box. Kortom, een situatie waarin op willekeurige wijze alle
luchtmoleculen op het aardoppervlak zouden liggen, komt overeen met een lage entropie. Om
een zo hoog mogelijke entropie te krijgen, zouden de luchtmoleculen zo gelijkmatig mogelijk
over de atmosfeer verdeeld moeten zijn, want op die manier kan het grootste aantal
vergelijkbare configuraties gerealiseerd worden. In de praktijk ontstaat een balans tussen het
streven naar minimale enthalpie en maximale entropie, waarbij de luchtmoleculen nabij het
aardoppervlak de hoogste dichtheid hebben en van het aardoppervlak af de dichtheid steeds
minder wordt (zgn. Boltzmann verdeling).
Wij kunnen de combinatie van enthalpie en entropie onderbrengen in een nieuwe vorm van
energie, de Gibbs energie (G), ook wel vrije energie of arbeidsenergie genoemd. Per definitie
is G = H – T.S, waarbij T de absolute temperatuur is. Aangezien H naar een minimum streeft
en S naar een maximum, zal (door het minteken) G naar een minimum streven. Wij kunnen
zeggen dat de Boltzmann verdeling van de atmosfeer (hoe verder weg van het aardoppervlak,
des te geringer de dichtheid aan moleculen) de situatie vertegenwoordigt met de laagste G,
waarbij een optimale balans is verkregen tussen een minimale H en een maximale S. Meestal
zijn wij niet in absolute waarden van G geïnteresseerd, maar in het verschil tussen twee
situaties, waarbij bovenstaande formule overgaat in ∆G = ∆H – T.∆S
Wanneer wij een sterk zuur als HCl oplossen in water, zal het volledig dissociëren in H+ en
Cl-, en zal de oplossing warm worden (door de interactie van H+ met H2O). Kennelijk is dus
∆H<0, terwijl er meer deeltjes gevormd worden en dus ∆S>0. Zowel het verlies aan enthalpie
als de toename aan entropie dragen hier dus bij aan een lagere Gibbs energie. Maar indien wij
NaCl oplossen in water, waarbij de moleculen uiteenvallen in Na+ en Cl-, blijkt de oplossing
kouder te worden. Kennelijk is nu dus ∆H>0, maar omdat ∆S>0 (en ook T.∆S>0) zorgt het
toch voor een ∆G<0. Ondanks het feit dat Na+ en Cl- tegengestelde lading hebben en het
energie kost om ze uit elkaar te trekken, valt NaCl toch uiteen in zijn losse ionen, omdat dit
winst aan entropie oplevert.
Als wij een zwak zuur als azijnzuur in water oplossen, zal er zich een evenwicht instellen
volgens HAc ↔ H+ + Ac-. De enthalpie zal dissociatie van HAc willen tegengaan, omdat een
positief en een negatief geladen deeltje van elkaar gescheiden moeten worden. De entropie
40
streeft er juist naar om zoveel mogelijk deeltjes te laten ontstaan. Het evenwicht dat ontstaat
heeft de minimale Gibbs-energie, waarbij een balans wordt gevonden tussen de
tegenwerkende enthalpie en de stimulerende entropie. Per definitie zeggen wij dat twee
situaties die met elkaar in evenwicht zijn, hetzelfde niveau aan Gibbs energie hebben (∆G=0).
Gibbs energie en evenwichtsconstante
Voor een stof in oplossing geldt G = G° + RT ln X, waarin G° een voor die stof constante
waarde is en X de molaire concentratie van die stof is in water (R is de gasconstante en T de
absolute temperatuur). Indien wij A en B bij elkaar voegen en die volledig laten reageren tot
C en D, dan resulteert dit in een winst aan Gibbs-energie van ∆G = (G°c + RT ln [C] + G°d +
RT ln [D] - G°a - RT ln [A] - G°b - RT ln [B]), waarin [A] en [B] de toegevoegde
concentraties en [C] en [D] de gevormde concentraties zijn. Dit betekent dat als 1 mol A en 1
mol B samen volledig reageren tot 1 mol C en 1 mol D, dit een winst aan Gibbs-energie
oplevert van ∆G° (=G°c+ G°d- G°a - G°b).
Indien bij de reactie A + B ↔ C + D een evenwicht ontstaat, dan zullen tijdens evenwicht A
en B samen dezelfde Gibbs-energie hebben als C en D samen, ofwel G(A+B) = G(C+D). ∆G
kan uitgeschreven worden tot ∆G° + RT ln ([C].[D]/[A].[B]), waarin ([C].[D]/[A].[B]) gelijk
is aan de evenwichtsconstante Keq. En aangezien onder evenwichtscondities ∆G=0, volgt
hieruit dat voor evenwichtssituaties geldt:
∆G°= - RT ln Keq.
Dat betekent dat de ∆G° van een chemische reactie de evenwichtsconstante bepaalt, en
daarmee dus de concentraties van stoffen onder evenwichtscondities.
Als H2O of H+ deel uitmaakt van een chemische reactie, wordt hun concentratie meestal niet
meegenomen om de evenwichtconstante te berekenen, aangezien hun concentratie onder
fysiologische condities altijd constant is ([H2O] = 55 M; [H+] = 10-7 M). Wij definiëren dan
ook meestal een Keq’, hetgeen de evenwichtsconstante Keq is bij die vaste concentraties van
H2O en H+. Bijvoorbeeld voor het evenwicht: ATP + H2O ↔ ADP + Pi + H+ (waarin Pi een
anorganische fosfaatgroep is) kunnen wij Keq definiëren als [ADP].[Pi].[H+]/[ATP][H2O],
maar aangezien [H+] en [H2O] constant zijn, definiëren wij meestal Keq’ = Keq.[H2O]/[H+] =
[ADP].[Pi]/[ATP]. In combinatie daarmee definiëren wij dan ook een ∆G’° bij [H2O] = 55 M
en [H+] = 10-7 M, zodat ∆G’°= -RT ln Keq’. Voor een groot aantal biochemische reacties
zijn de waarden van ∆G’° getabeleerd (kJoule/mol), waaruit Keq’ (bij 37°C) berekend kan
worden volgens ∆G’°= -5.9 log Keq’ (R = 8.31 J.K-1.mol-1; T = 310 K; ln 10 = 2.30)
Uit bovenstaande formule blijkt dat ∆G’° = 0 overeenkomt met Keq ’= 1, hetgeen inhoudt dat
het chemisch evenwicht voor 50% naar links en voor 50% naar rechts ligt. Is ∆G’° > 0, dan
ligt het evenwicht naar links (reactie verloopt niet goed) en is ∆G’° < 0 dan ligt het
evenwicht naar rechts (reactie verloopt wel goed). In de praktijk kunnen wij ∆G’°-waarden
41
op twee manieren interpreteren. Voor een geïsoleerd systeem (bijv. in een reageerbuis)
bepaalt ∆G’° de ligging van het chemisch evenwicht. Bij een cascase van reacties bepaalt
∆G’° de hoeveelheid Gibbs-energie die vrijkomt als 1 mol A en 1 mol B geheel omzet
worden in 1 mol C en 1 mol D.
Hoog-energetische verbindingen (Lehninger 6, pag. 521-523)
ATP (adenosine-triphosphate) is de centrale energiedrager in ons lichaam. Bij processen
waarbij energie vrijkomt (bijv. de verbranding van suiker) zal de cel proberen om zoveel
mogelijk van de vrijkomende energie om te zetten in ATP eenheden. Aan de andere kant
kunnen processen in de cel die energie vereisen, alleen plaatsvinden dankzij de inzet van ATP
moleculen. Voor 90% van alle energie-vragende processen in de cel wordt ATP gebruikt,
maar sommige processen zijn afhankelijk van GTP (guanidide-triphosphate) of UTP (uridinetriphosphate).
ATP (zie afbeelding) heeft achter elkaar drie negatief geladen fosfaat-groepen en het
afsplitsen van de laatste fosfaat-groep, waardoor ADP (adenosine-diphosphate) ontstaat,
levert veel energie op (∆G’° = - 30 kJ/mol). Dat wil niet zeggen dat in waterig milieu ATP
spontaan in ADP en Pi uiteenvalt, want de activeringsenergie voor deze reactie is zeer hoog en
vindt zonder enzym niet plaats. Bindingen waarbij bij afsplitsing (meestal door hydrolyse met
water) tenminste 30 kJ/mol vrijkomt, noemen wij per definitie hoog-energetische
verbindingen. Wij geven een dergelijke binding aan met een ∿ in plaats van met een —.
Chemisch gezien is een hoog-energetische binding overigens niet anders dan een gewone
binding (namelijk: een gedeeld electronenpaar), alleen komt er bij deze hydrolyse relatief veel
energie vrij. Andere voorbeelden van stoffen met een hoog-energetische binding zijn:
phospho-enol-pyruvaat (∆G’° = - 60 kJ/mol) en acetyl-CoA (∆G’° = - 30 kJ/mol). Het
Coenzym A is en groot molecuul dat een acetyl-groep in de vorm van een hoog-energetische
thiol-ester kan binden.
Acetyl- Coenzyme A
42
Voor processen waarbij meer dan 30 kJ/mol vereist is, kunnen twee fosfaat-groepen van ATP
tegelijk worden afgesplitst, waarbij AMP (adenosine mono-phosphate) en PPi (pyrofosfaat)
onstaan. De eerste hydrolyse-stap heeft op zich al een ∆G’° = - 30 kJ/mol, maar vervolgens
kan PPi gesplitst worden in twee losse Pi groepen, ook met een ∆G’° = - 30 kJ/mol. In totaal
heeft de reactie ATP → AMP + PPi, met daarop volgend PPi → 2Pi, dus een ∆G’° = - 60
kJ/mol. Bij berekeningen hoeveel ATP eenheden een proces kost, gaan wij uit van een
energie-inzet van -30 kJ/mol per ATP molecuul (dus equivalent van ATP naar ADP). Indien
voor een reactie de pyrofosfaat-reactie wordt gebruikt (inzet - 60 kJ/mol) zullen wij dit als 2
ATP eenheden aanmerken. Dat blijkt ook uit het feit dat het gevormde AMP met ATP zal
kunnen reageren tot 2 ADP, zodat in totaal 2 ATP moleculen bij de pyrofosfaat-reactie
betrokken zijn.
Gekoppelde chemische reacties (Lehninger 6, pag. 24, 510-511)
Chemische reacties die Gibbs energie opleveren (∆G’° < 0) worden exergone reacties
genoemd, reacties die Gibbs energie kosten (∆G’° > 0) worden endergone reacties
geneoemd. Afbraakreacties van complexe stoffen (bijv. suikers) zijn meestal exergoon, de
opbouw van complexe moleculen in ons lichaam is een endergoon proces. Aangezien
endergone reacties niet spontaan kunnen plaatsvinden, moet de cel hiervoor hoogenergetische verbindingen inzetten.
Als voorbeeld, voor de afbraak van glucose is het nodig dat deze suiker eerst gefosforyleerd
wordt. Echter de reactie waarbij glucose een los fosfaat-molecuul uit de oplossing opneemt en
bindt, is sterk endergoon: glucose + Pi → glucose-6-fosfaat (∆G’° = +14 kJ/mol). Indien
echter tegelijkertijd de reactie ATP → ADP + Pi optreedt (∆G’° = - 30 kJ/mol), kunnen deze
twee processen gecombineerd worden tot ATP + glucose → ADP + glucose-6-fosfaat, met een
∆G’° = - 16 kJ/mol.
Het enzym dat deze reactie kan verzorgen, heet glucokinase of hexokinase. Het bindt zowel
glucose (geel) als ATP (groen), en draagt een hoog-energetische fosfaatgroep over van ATP
naar glucose. De exergone deelreactie (ATP →ADP) en endergone deelreactie (glucose →
glucose-6-fosfaat) zijn vinden dus gekoppeld plaats en worden door hetzelfde enzym
verzorgt. In conclusie, endergone reacties in de cel worden mogelijk gemaakt de inzet van
hoog-energetische verbindingen en gekoppelde enzymatische reacties.
43
Mechanismen van ATP vorming (Lehninger 6, pag. 516; 528-529; 544-548; 563-565; 637639; 647-651; 671-675)
Er zijn drie verschillende manieren waarop ATP in de natuur gegenereerd kan worden:
Fotosynthese
Onder invloed van licht kan in planten rechtstreeks ATP gevormd worden. Dit proces vindt
niet plaats in dierlijke cellen.
Substraat-fosforylatie
Een hoogenergetische verbinding kan zijn energie overdragen op ADP, waardoor deze wordt
omgezet in ATP. Een dergelijke kan reactie kan altijd plaatsvinden, ook als er geen O2
aanwezig is (dus zowel onder aerobe als anaerobe omstandigheden).
Voorbeeld: phospho-enol-pyruvaat + ADP → pyruvaat + ATP
Oxidatieve fosforylering
Veel stappen bij de afbraak van suikers zijn oxidatie-reacties. Oxidaties (ox) zijn per definitie
reacties waarbij electronen-donoren (zoals suikers) electronen afstaan. Deze electronen
kunnen niet in vrije vorm voorkomen, maar moeten door een electronen-acceptor worden
opgenomen (voorbeelden: FAD en NAD+). Door de opname van electronen worden deze
stoffen gereduceerd (tot FADH2 en NADH). Reducties (red) zijn per definitie reacties waarbij
electronen worden opgenomen. Gereduceerde electronen-acceptors dragen hun electronen
vervolgens in een aantal stappen over op O2, waarbij uiteindelijk ATP wordt gevormd. Dit
proces van zogenoemde oxidatieve fosforylering kan dan ook alleen plaatsvinden onder
aerobe omstandigheden. Oxidatie-reacties zijn doorgaans exergoon, en reductie-reacties
endergoon.
Voorbeeld 1: ethaan → etheen + 2H+ + 2e (ox)
(∆G’° < 0)
+
FAD + 2H + 2e → FADH2 (red) (∆G’° > 0)
(de gekoppelde reactie is exergoon)
FADH2 draagt opgenomen electronen over op O2 (→ 2 ATP)
Voorbeeld 2: ethanol → ethanal + 2H+ + 2e (ox) (∆G’° < 0)
NAD+ +H++2e→NADHred (∆G’° > 0)
(de gekoppelde reactie is exergoon)
NADH draagt opgenomen electronen over op O2 (→3ATP
De reductie van NAD+ is sterker endergoon dan die van FAD. NAD+ kan dan ook alleen maar
als electronen-acceptor worden gebruikt, als de bijbehorende oxidatie-reactie voldoende
exergoon is. Dat is wel het geval bij de oxidatie van een alcohol tot een aldehyde (voorbeeld
2), maar niet bij de oxidatie van een alkaan naar een alkeen (voorbeeld 1). 44
Oxidatieschema van koolwaterstoffen I
algemeen
- bij oxidatie-reacties komen electronen vrij
- bij reductie-reacties worden electronen opgenomen
- oxidatie-reacties kunnen resulteren in:
* andere metaal-valentie: Fe2+
Fe3+ + e
* dehydrogenatie: C2H6
C2H4 + 2H+ + 2e
(R1/1) alkaan naar alkeen en alcohol
H H
R C C H
H H
alkaan
ox
FAD +2H+ +2e
red
+H2O
R C C H
hydraH H
tatie
alkeen
R C C H +2H+ +2e
H H
alkeen
FADH2
2 ATP
H H
H H
R C C H of R C C H
H OH
OHH
primaire
alcohol
secundaire
alcohol
(R1/2a) primaire alcohol naar aldehyde
H H
R C C H
H OH
primaire
alcohol
NAD+ +H+ +2e
ox
red
H
H
R C C
O
H
aldehyde
+2H+ +2e
NADH
3 ATP
(R1/2b) secundaire alcohol naar keton
H H
R C C H
OHH
secundaire
alcohol
NAD+ +H+ +2e
ox
red
H
R C C H +2H+ +2e
O H
keton
NADH
45
3 ATP
Oxidatieschema van koolwaterstoffen II
(R1/3a) aldehyde naar carbonzuur
H
H
ox
R C C
-1 H2O
O
H
aldehyde
NAD+ +H+ +2e
red
H
OH
+2H+ +2e
R C C
O
H
carbonzuur
NADH
3 ATP
(R1/3b) aldehyde naar carbonzuur-f osf aat
P
H
H
H
O
ox
+2H+ +2e
R C C
R C C
-1 P
O
O
H
H
carbonzuur-fosfaat
aldehyde
NAD+ +H+ +2e
H
O
R C C
O
H
red
NADH
P
H
OH
R C C
O
H
-1 ADP
3 ATP
1 ATP
carbonzuur
carbonzuur-fosfaat
(R1/4) oxidatieve decarboxylering
OH
*
R C C
O
O
-ketozuur
*
+1 CO
2
ox
R C SCoA +2H+ +2e
O
zuur-CoA thiolester
-1 CoASH
NAD+ +H+ +2e
red
NADH
+1 CoASH
R C SCoA
-1 ADP
O
zuur-CoA thiolester
R C OH
O
carbonzuur
46
3 ATP
1 ATP
47
48
49
Citroenzuurcyclus II (alleen aeroob)
O
OH
O 2 OH
O 2 OH
O 2 OH
C
C
C
C
3
3
3
3
CH2 +1 FADH2 C H hydra- H C OH +1 NADH C O
3
3
3
tatie
CH2 (R1/1) H C 3
(R1/2b) CH2
CH2
2
2
2
2
C
C
C
C
O OH
O OH
O OH
O OH
2
barnsteenzuur
(succinaat)
fumaarzuur
appelzuur
(malaat)
oxaalazijnzuur
Netto energiewinst: 1 acetyl-CoA
1 oxaalazijnzuur:
3 NADH, 1 FADH2, 1 GTP
Netto energiewinst in ATP eenheden (aeroob):
- 1 glucose: 38 (36) ATP
- 1 glyceraldehyde-3-fosfaat: 20 ATP
- 1 pyruvaat: 15 ATP
- 1 acetyl-CoA: 12 ATP
Netto energiewinst in ATP eenheden (anaeroob):
- 1 glucose: 2ATP
ENERGIEWINST-SCHEMA BIJ AFBRAAK GLUCOSE
glucose
-1 ATP
-1 ATP
2x
glyceraldehyde-3-fosfaat
+1 NADH
+1 ATP
+1 ATP -1 NADH
pyruvaat
(anaeroob)
+1 NADH
acetyl-CoA
oxaalazijnzuur
CZC
+1 NADH
+1 FADH2
+1 NADH
+1 NADH
+1 GTP
50
lactaat
Deaminering van aminozuren
(energie neutraal: G0' = 0)
X
R1
H C NH2
C
O OH
+
R1
C O
C
O OH
X
C O
C
O OH
+
NH2-acceptor
aminozuur
H C NH2
C
O OH
NH2-donor
-ketozuur
alanine
asparaginezuur
glutaminezuur
pyruvaat
oxaalazijnzuur
-keto-glutaarzuur
-oxidatie van vetzuren
H H H H
OH -2 ATP
R C C C C C
O -1 CoASH
H H H H
H H H H
R C C C C C
H H H H O
vetzuur
vetzuur-CoA thiolester
aantal C-atomen: n
H H
R C C C C C
H H H H O
SCoA
H H H H
R C C C C C
H H OHH O
SCoA
H H
H
R C C C C C
(R1/2b)
H H O H O
SCoA
+1 FADH2
(R1/1)
hydratatie
SCoA
+1 NADH
H H
H
R C C C SCoA + H C C SCoA
-1 CoASH
H H O
H O
vetzuur-CoA (n-2)
acetyl-CoA
hydrolyse
H H H
OH
Netto energiewinst: 1 H C C C C
geeft 27 ATP
O
H H H
51
Oxidatieve fosforylering
- vindt plaats aan de binnenmembraan van mitochondrien
- omvat electronentransport van NADH (of FADH2) naar O2
- stapsgewijze oxidatie en reductie van electronencarriers
- NADH, FADH2, CoQ worden geoxideerd door dehydrogenatie,
andere electronencarriers door verandering van valentie (Fe2+, Cu+)
4H+
4H+
rotenon
NADH
(complex I)
2H+
antimycine
cyanide
O2
ubiquinon
Cyt.C
(complex III)
(complex IV)
(CoQ)
(complex II)
FADH2
- chemi-osmotische theorie (Mitchell): netto transport van
electronen uit de mitochondrien leidt tot een electrochemische
gradient van protonen (combinatie van pH en ladingsgradient)
die als proton-motive force (pmf) de ATPase aanzet om
ADP om te zetten in ATP (complex V)
NADH
2e
CoQ
2e
Cyt.C
2e
O2
DNP (ontkoppelaar):
maakt mitochondriale
membraan permeabel
voor protonen
H+
Oligomycine: remt
mitochondriale ATPase
ATP
52
Structuur en functie van vetzuren (Lehninger 6, pag. 357-359)
Vetzuren bestaan uit lange, verzadigde koolwaterstof-ketens, eindigend met een –COOH
groep. Algemeen kunnen wij hun structuur dus weergeven als CH3-(CH2)n -COOH. De
meeste vetzuren in ons lichaam hebben een lengte van 16 tot 22 koolstof-atomen. Naast
verzadigde vetzuren bestaan er ook onverzadigde vetzuren, die een of meer dubbele bindingen
bevatten. Cis-dubbele bindingen induceren een knik in de structuur van een vetzuur, terwijl
trans-dubbele bindingen dat in veel mindere mate doen.
Vetzuren kunnen op twee manieren worden genummerd. De –COOH groep is officieel het
nummer C1, maar daarnaast wordt het laatste C-atoom (CH3-groep) vaak als het omega (ω)
C-atoom aangeduid. Naast verzadigde vetzuren (geen dubbele bindingen) kennen wij dan ook
ω-9 vetzuren (laatste cis dubbele binding 9 C-atomen van het eind), ω-6 vetzuren (laatste cis
dubbele binding 6 C-atomen van het eind) en ω-3 vetzuren (laatste cis dubbele binding 3 Catomen van het eind). Onderstaand een overzicht van de belangrijkste vetzuren:
naam
code
dubbele bindingen
laatste dubbele binding
palmitinezuur
stearinezuur
elaidinezuur
oliezuur
linolzuur
arachidonzuur
linoleenzuur
eicosapentaeenzuur (EPA)
docosahexaeenzuur (DHA)
C16:0
C18:0
C18:1 trans
C18:1 cis
C18:2 cis
C20:4 cis
C18:3 cis
C20:5 cis
C22:6 cis
verzadigd
verzadigd
∆9
∆9
∆9,12
∆5,8,11,14
∆9,12,15
∆5,8,11,14,17
∆4,7,10,13,16,19
nvt
nvt
ω-9
ω-9
ω-6
ω-6
ω-3
ω-3
ω-3
53
Verzadigde vetzuren (C16:0; C18:0) komen vooral in dierlijke vetten, roomboter, cacao en
palmolie voor. Trans-onverzadigde vetzuren komen van nature niet bij de mens voor, maar
ontstaan vooral bij het kunstmatig verzadigen van dubbele bindingen in oliën (hardingsproces
om oliën langer houdbaar te maken). Oliezuur komt vooral voor in olijfolie en eieren, terwijl
linolzuur veel voorkomt in zonnebloem-olie (dieet-margarine). Van de ω-3 vetzuren komt
linoleenzuur vooral voor in plantaardige oliën en walnoten, terwijl EPA en DHA vooral
gevonden worden in vette vis.
Verzadigde vetzuren en ω-9 vetzuren (oliezuur) kan ons lichaam zelf aanmaken, maar ω-6 en
ω-3 vetzuren moeten essentieel via onze voeding worden opgenomen. Wel kunnen wij van
essentiële vetzuren de keten verlengen (per groep van 2C-atomen aan –COOH), maar alleen
extra dubbele bindingen tussen ω-9 en de –COOH groep aanleggen. De enige echte essentiële
vetzuren voor ons lichaam (zie figuur links) zijn dan ook linolzuur (waar wij de overige ω-6
vetzuren uit kunnen synthetiseren) en linoleenzuur (waar wij de overige ω-3 vetzuren uit
kunnen synthetiseren).
Het ω-6 vetzuur arachidonzuur kunnen wij dus zelf maken uit het ω-6 vetzuur linolzuur (zie
figuur links), door ketenverlenging en het aanleggen van extra dubbele bindingen aan de –
COOH kant. Uit arachidonzuur kan ons lichaam farmacologisch belangrijke stoffen maken,
waaronder prostaglandinen. Dit zijn cyclische vormen van arachidonzuur, waaraan extra –
OH groepen zijn gekoppeld. Het prostaglandine E2 (zie figuur rechts) verlaagt de bloeddruk,
ontspant de gladde spieren en reguleert de persweeën.
Het eten van verzadigde en trans-vetzuren leidt tot een verhoging van cholesterol in ons
bloed, en daarmee een verhoogde kans op hart- en vaatziekten. Zowel ω-6 vetzuren
(linolzuur; Becel) als ω-3 vetzuren (visolie) verlagen het cholesterol-gehalte van ons bloed.
54
De gemiddelde Europeaan krijgt te weinig ω-3 vetzuren binnen. Hebben Eskimo’s in hun
voeding een ω-6/ ω-3 verhouding van 2:1, bij ons is die verhouding 20:1. Of dit ook de reden
is dat bij Eskimo’s minder hart-en-vaatziekten en kanker voorkomen, wordt momenteel
uitgebreid onderzocht.
Triglyceriden en fosfolipiden (Lehninger 6, pag. 360-363)
Vetzuren zijn een belangrijke energiebron voor ons lichaam. Vetopslag vindt plaats in de
vorm van triglyceriden; deze bestaan uit 3 vetzuurmoleculen, die elk via een ester-binding
gekoppeld aan een van de 3 –OH groepen van glycerol (zie bovenste helft figuur).
Fosfolipide-moleculen vormen de
bouwstenen van biologisch membranen.
Fosfolipide-moleculen hebben een
apolair gedeelte (2 vetzuren gekoppeld
aan C1 en C2 van glycerol) en een polair
gedeelte, dat gekoppeld is aan de C3 van
glycerol. Dit polaire gedeelte bestaat uit
een fosfaat-groep en een polaire
kopgroep (in figuur linksonder is dat de
base choline). De fosfolipiden in
biologische membranen hebben meestal
een verzadigd vetzuur op C1 en een
onverzadigd vertzuur op C2. In
fosfolipide-moleculen is C2
asymmetrisch. Alle natuurlijk
voorkomende fosfolipide-moleculen
hebben op C2 de L-configuratie (dus
afgeleid van L-glyceraldehyde; dat is niet
in deze figuur te zien).
Cholesterol en cholesterol-ester (Lehninger 6, pag. 864)
Cholesterol is ook een belangrijke component van biologische membranen. Het molecuul
bestaat uit een steroide-kern, een vertakte alkyl zijketen, en een kleine polaire kop (-OH). In
het bloed wordt cholesterol getransporteerd als cholesterol-ester, waarbij deze –OH groep via
een esterbinding gekoppeld is aan een vetzuur. Ongeveer 2/3 van het cholesterol wordt door
ons lichaam zelf aangemaakt (dit kan geremd worden met zgn. statines). De overige 1/3
krijgen wij via onze voeding binnen (met name via voedingsmiddelen met veel verzadigde
vetzuren, zoals kaas, vlees en ei). Cholesterol is ook de bron voor steroid hormonen in ons
lichaam, waaronder estrogeen, testosteron, vitamine D en cortisol. Hoewel cholesterol een
“slechte naam” heeft, is het dan ook onmisbaar voor het functioneren van ons lichaam.
55
Lipoproteinen (Lehninger 6, pag. 865-866)
Via ons bloed worden vetten en cholesterol getransporteerd tussen de lever en vetweefsel. Dit
gebeurt in de vorm van zgn. lipoproteinen. De kern, die bestaat uit triglyceriden en
cholesterol-ester, wordt omgeven door een monolaag van fosfolipiden en niet-veresterd
cholesterol, zodat de buitenkant van de lipoproteinen polair is, en zij dus goed in water
oplossen.
56
De buitenkant van lipoproteinen bevat daarnaast specifieke eiwitten, die bekend staan als
apolipoproteinen. De bekendste lipoproteinen zijn LDL (low density lipoprotein) and HDL
(high density lipoprotein). LDL, dat het eiwit ApoB bevat, heeft veel triglyceriden en
cholesterol-ester in zijn kern, en staat bekend als “slecht cholesterol” als het gaat om het risico
voor hart en bloedvaten. HDL, dat onder andere de eiwitten ApoA en ApoC bevat, heeft
weinig triglyceriden en cholesterol-ester in zijn kern, en staat bekend als “goed cholesterol”.
Structuur van fosfolipiden (Lehninger 6, pag. 363-364)
Zoals eerder aangegeven, bestaan fosfolipiden uit een glycerol-molecuul met daaraan
gekoppeld twee vetzuren, een fosfaatgroep en een polaire kopgroep. De belangrijkste polaire
kopgroepen zijn: ethanolamine (HO-CH2-CH2-NH2); choline (HO-CH2-CH2-N-(CH3)3);
serine (aminozuur met zijketen HO-CH2) en glycerol (HO-CH2-CHOH-CH2-OH). Deze
verbindingen kunnen met hun –OH groep een –OH van de fosfaatgroep binden via een
etherbinding, onder afsplitsing van H2O (dus P-O-C).
Fosfolipiden met deze polaire kopgroepen heten phosphatidyl-ethanolamine (PE),
phosphatidyl-choline (PC), phosphatidyl-serine (PS) en phosphatidyl-glycerol (PG). De
fosfaatgroep heeft altijd een enkele negatieve lading, terwijl de polaire kopgroep positief
57
(choline, ethanolamine) of neutraal (serine, glycerol) kan zijn. Als gevolg daarvan zijn
fosfolipiden in zijn geheel ofwel neutraal (PE, PC) of negatief (PS, PG) geladen. Als alleen de
fosfaatgroep aanwezig is, maar de polaire kopgroep ontbreekt, spreken wij van phosphatidic
acid (PA), dat negatief geladen is.
Bovenstaande fosfolipiden zijn vooral van belang voor de structuur van biologische
membranen. Een fosfolipide dat daarnaast van belang is voor het doorgeven van signalen van
buiten naar binnen de cel, is phosphatidyl-inositol (PI). Dit heeft als polaire kopgroep een
cyclische suikerring met 6 –OH groepen. Aan deze suikerring kunnen extra fosfaat-groepen
geplaatst worden, waardoor de belangrijke stoffen phosphatidyl-inositol-phosphate (PIP) en
phosphatidyl-inositol-bisphosphate (PIP2) ontstaan. Al deze inositol-houdende lipiden hebben
een netto negatieve lading.
Naast fosfolipiden, die zijn opgebouwd vanuit glycerol, bestaan er ook sphingolipiden, die
zijn opgebouwd vanuit het molecuul sphingosine. Het belangrijkste lipide-molecuul uit deze
klasse is sphingomyeline (Sph) dat evenals PC een negatieve fosfaat-groep heeft met daaraan
gekoppeld een positieve choline-groep. Sph is dan ook neutraal van lading.
Liposomen en micellen (Lehninger 6, pag. 387-388)
Als fosfolipiden in een waterig milieu worden gebracht, vormen zij (dankzij hun cylindrische
vorm) spontaan bilagen, waarbij de apolaire vetzuren van het water afgekeerd worden, en de
polaire kopgroepen naar het water toe gericht worden. Dergelijke kunstmatige bilagen van
fosfolipide-moleculen in waterig milieu worden liposomen (of ook wel vesicles) genoemd.
Binnen in het liposoom bevindt zich een waterig compartiment. In dit waterig compartiment
kunnen stoffen worden opgeslagen. Liposomen spelen dan ook een belangrijke rol bij “drug
delivery” van geneesmiddelen in het lichaam.
Lipide-moleculen die maar één vetzuur-molecuul hebben (zgn. lysolipiden), kunnen (vanwege
hun wig-vorm) geen bilaag vormen, omdat hun apolaire volume te klein is. In plaats daarvan
vormen zij in waterig milieu spontaan micellen, zoals wij dat ook gezien hebben bij
detergentia zoals SDS.
58
Cholesterol reguleert de membraan-vloeibaarheid
membraan
(Lehninger 6, pag. 395-396
396)
Cholesterol speelt een dubbele rol bij het reguleren van de vloeibaarheid van biologische
membranen. Fosfolipiden met verzadigde vetzuren
vetzu
bevinden zich bij een fysiologische
temperatuur van 37°C in een vaste, geordende toestand (crystalline state),, vergelijkbaar met
de vaste vorm van vetten. Door de temperatuur te verhogen,
verhogen kunnen dergelijke fosfolipiden
smelten tot een vloeibare, niet-geordende
geordende toestand (liquid-crystalline
(liquid crystalline state), vergelijkbaar met
de vloeibare vorm van een olie. De temperatuur waarbij dit smelten optreedt, staat bekend als
de fase-overgangstemperatuur
overgangstemperatuur (Tm) van een lipid. Bij fosfolipiden met onverzadigde
verzadigde vetzuren
ligt Tm ruim beneden de 37°C,, zodat deze zich onder fysiologische omstandigheden al in een
vloeibare toestand bevinden.
Cholesterol gaat in membranen tussen de fosfolipide-moleculen
fosfolipide moleculen in zitten. Het resultaat is dat
fosfolipiden
en in de vaste crystalline state vloeibaarder worden (vaste pakking wordt
verbroken),, terwijl fosfolipiden in de vloeibare liquid-crystalline
liquid crystalline toestand minder vloeibaar
worden. Voor het goed functioneren van biologische membranen is het van groot belang dat
hun fosfolipiden voldoende vloeibaar zijn.
zijn. Als wij veel verzadigde vetzuren eten, zal ons
lichaam veel cholesterol aanmaken om onze membranen de benodigde vloeibaarheid te
geven. Als wij voldoende onverzadigde vetzuren eten, hoeft ons lichaam dus minder
cholesterol aan te maken. De beste manier om het cholesterol gehalte van ons bloed te
verlagen, is dan ook om minder verzadigd vet te eten.
Fluid Mosaic Model voor biologische membranen (Lehninger 6, pag. 387)
Biologische membranen bestaan uit een lipide bilaag (fosfolipiden, cholesterol) met daaraan
diverse soorten eiwitten gebonden. Integrale eiwitten steken door de lipide-bilaag
bilaag heen.
Dergelijke eiwitten hebben doorgaans een alpha-helix
alpha
van apolaire aminozuren,, dat hydrofobe
interacties aan kan gaan met het apolaire deel van de bilaag.
bilaag. Integrale eiwitten hebben vaak
59
een functie als transport-eiwit (stoffen de cel in en uit transporteren) of als receptor (signalen
van buiten de cel opvangen en naar het binnenste van de cel doorgeven). Perifere eiwitten
zitten aan de binnen- of buitenkant van de cel, en hechten zich aan de lipide bilaag met name
via electrostatische interacties (bijv. via de negatieve fosfaatgroep van de fosfolipiden). De
perifere eiwitten aan de binnenkant van de plasmamembraan (cytoskelet-eiwitten) spelen een
belangrijke rol bij de specifieke vorm die cellen kunnen aannemen (bijv. uitlopers in
zenuwcellen; bloedcellen die door nauwe haarvaten moeten kunnen bewegen). De perifere
eiwitten aan de buitenkant van de plasmamembraan (hechtings-eiwitten) spelen een
belangrijke rol bij de hechting van cellen aan elkaar (bijv. voor de vorming van organen) en
aan eiwitten van de zgn. extracellulaire matrix (bedoeld voor versteviging en structuur van
weefsels).
Zowel eiwitten als lipiden aan de buitenkant van de cel kunnen suikergroepen bevatten. Deze
spelen een belangrijke rol bij de herkenning van cellen, bijvoorbeeld door ons afweersysteem
(bijv. A-, B- en O- bloedgroepen). Fosfolipide moleculen kunnen zich niet snel van de ene
monolaag naar de andere bewegen, een proces dat bekend staat als flip-flop. Wel kunnen de
fosfolipiden zich snel bewegen in het vlak van de lipide-bilaag, een proces dat bekend staat
als laterale diffusie. Integrale membraan-eiwitten kunnen ook lateraal bewegen, maar vaak
wordt dit beperkt door binding aan eiwitten van het cytoskelet.
Asymmetrische verdeling van fosfolipiden in membranen (Lehninger 6, pag. 386; 388)
De plasma-membraan van zoogdiercellen heeft een andere fosfolipide-samenstelling dan de
membraan van de diverse intracellulaire organellen. Het meest opvallend is het verschil met
de membraan van mitochondriën, die veel minder cholesterol en veel meer phosphatidylethanolamine bevat. Ook bevat de mitochondriale membraan het lipide-molecuul cardiolipin,
dat normaal gesproken alleen bij lagere organismen zoals bacteriën voorkomt. Dit is één van
60
de argumenten op basis waarvan verondersteld wordt dat mitochondriën ontstaan zijn uit een
symbiose tussen eukaryotische cellen en aerobe bacteriën.
Rode bloedcellen (erythrocyten) bevatten
alleen een plasma-membraan, omdat zij
hun intracellulaire organellen hebben
verloren. Van deze plasma-membraan is
aangetoond dat de neutrale fosfolipiden
PC en Sph zich vooral in de buitenste
monolaag bevinden, terwijl de negatief
geladen fosfolipiden PS, PA en PI zich
nagenoeg uitsluitend in de binnenste
monolaag bevinden. Van andere cellen is
aangetoond dat zodra PS aan de
buitenkant van de cel terechtkomt, dit de
cel kan aanzetten tot geprogrammeerde
celdood (apoptose).
Diffusie en osmose (Lehninger 6, pag. 56,57,403)
De plasma-membraan vormt de scheiding tussen de interne en externe wereld van de cel. De
membraan moet er voor zorgen dat belangrijke stoffen door de cel kunnen worden
opgenomen, zonder dat dergelijke stoffen ongecontroleerd de cel weer kunnen verlaten.
Biologische membranen zijn daarom semi-permeabel, hetgeen inhoudt dat sommige stoffen
wel, en andere niet, door de membraan heen kunnen diffunderen.
De lipide-bilaag met zijn apolair karakter laat alleen kleine, ongeladen moleculen spontaan
door. Daartoe behoren onder andere H2O en glycerol. Overigens vereist de permeatie van H2O
en glycerol door een lipide-bilaag wel een hoge activeringsenergie, want eerst moeten hun Hbruggen met (andere) water-moleculen worden verbroken. Grotere, ongeladen moleculen
(zoals glucose) en geladen stoffen, zoals Na+, K+ en Cl-, kunnen niet spontaan door een lipidebilaag diffunderen. Daarvoor zijn specifieke transport-eiwitten in de membraan nodig.
61
Indien glycerol (verdund in een zoutoplossing)
zoutoplossing) aan de buitenkant van een cel wordt gebracht,
gebracht
zal het spontaan door de lipide-bilaag
bilaag de cel ingaan.
ingaan Dit proces van spontane diffusie zal
doorgaan, totdat de concentratie van
va glycerol (blauwe 6-hoekjes) binnen en buiten de cel
gelijk is (Cin = Cout). Bij de diffusie van glycerol door de membraan komt geen warmte vrij.
De drijvende kracht voor spontane diffusie is dan ook volledig een winst aan entropie.
Ook H2O kan door de bilaag diffunderen, maar zolang de totale concentratie aan opgeloste
deeltjes aan beide zijden van de membraan gelijk is, zal er per tijdseenheid evenveel water de
cel instromen als uitstromen.
omen. Is echter de concentratie van opgeloste deeltjes
eltjes aan de ene kant
van de membraan anders dan aan de andere kant, zal de H2O-concentratie
concentratie aan beide zijden
van de membraan iets anders zijn. Als gevolg daarvan zal er netto water stromen van het
compartiment met lage naar dat met hoge concentratie opgeloste
opge
deeltjes (suiker--moleculen in
het voorbeeld). Dit proces, dat bekend staat als osmose,, gaat door totdat de concentratie aan
opgeloste stoffen in beide compartimenten gelijk is. De som van het aantal opgeloste deeltjes
in een oplossing (toniciteit) wordt
ordt uitgedrukt in de hoeveelheid Osmol/liter (OsM). Voor
sucrose geldt dat 1 OsM overeenkomt met met 1 mol/liter, terwijl voor NaCl, dat in water
uiteenvalt in 2 deeltjes, geldt dat 1 OsM overeenkomt met 0.5 mol/liter.
Het cytoplasma van een cel heeft een toniciteit van 300 mOsM, vooral door de aanwezigheid
van K+ en Cl- ionen. Oplossingen met een toniciteit hoger dan 300 mOsM heten hypertoon
(cellen krimpen er in), terwijl oplossingen met een toniciteit lager dan 300 mOsM heten
hypotoon (cellen zwellen
wellen er in op).
62
Kanalen, carriers en pompen (Lehninger 6, pag. 404-406)
Zoals gezegd, zijn er maar weinig stoffen die spontaan door een lipide-bilaag kunnen
diffunderen (bijv. H2O, glycerol). Om andere stoffen de cel in en uit te krijgen, zijn specifieke
transport-eiwitten nodig. Daarbij kan een onderscheid worden gemaakt tussen kanalen en
carriers.
Kanalen vormen een opening in de
membraan, waardoor specifiek een
bepaald ion (meestal Na+, K+, Ca2+ of
Cl-) kan diffunderen. Kanalen kunnen,
naar behoefte, open en dicht worden
gezet. Kanalen geven aanleiding tot
een hoge transport-snelheid en zijn
niet verzadigbaar. Dat houdt is dat het
kanaal het ion waarvoor het specifiek
is, ongehinderd doorlaat (geen
maximum snelheid).
Carriers zijn membraan-eiwitten die de te transporteren stof aan de ene kant van de
membraan binden, deze vervolgens in zich opsluiten, en ze daarna aan de andere kant van de
membraan weer loslaten. Aangezien carriers na binding van de stof eerst een conformatieverandering moeten ondergaan, de stof weer moeten loslaten en vervolgens weer leeg naar de
oorspronkelijke kant van de membraan moeten terugkeren, kunnen carriers stoffen met een
lagere snelheid transporteren dan kanalen. Daarenboven zijn carriers verzadigbaar. Dat houdt
in dat bij steeds toenemende concentratie van de transporteren stof er een maximum transportsnelheid zal optreden. Ook al zal de leeg terugkerende carrier onmiddellijk door botsing een
nieuw substraat-molecuul binden, dan heeft de carrier toch tijd nodig om het substraatmolecuul naar de andere kant van de membraan te transporteren en weer leeg terug te komen.
De kinetiek waarmee carriers stoffen transporteren, lijkt dan ook erg veel op de kinetiek
waarmee enzymen werken. Voor de transportsnelheid via carriers geldt dan ook de formule:
V0 =
.
In deze formule is V0 de initiële transportsnelheid, die gemeten wordt onmiddellijk na
toevoegen van het transporteren substraat-molecuul [S] aan de buitenkant van de cel, Vmax de
maximale transportsnelheid die optreedt als [S] = ∞, en Kt de transport-constante die aangeeft
bij welke [S] de transport-snelheid de helft van Vmax bedraagt. Deze constante Kt wordt met
name bepaald door de affiniteit waarmee de carrier het substraat bindt.
Kanalen (bijv. Na+-kanaal; K+-kanaal) en carriers (bijv. glucose-carrier) zullen doorgaans
alleen stoffen transporteren van een hoge naar een lage concentratie (met de concentratiegradiënt mee). Wij zullen echter zien dat er ook transport nodig is, waarbij stoffen van een
lage naar een hoge concentratie getransporteerd moeten worden. Eiwitten die ionen tegen hun
63
gradiënt in transporteren, worden pompen genoemd. Een voorbeeld is de Ca2+-ATPase, die
Ca2+ uit de cel pompt, en er daarmee voor zorgt dat de Ca2+-concentratie in de cel veel lager is
dan buiten de cel. De energie die het kost om Ca2+ tegen zijn gradiënt in naar buiten de cel te
pompen, wordt geleverd door de hydrolyse van ATP.
Actief transport, passief transport en co-transport (Lehninger 6, pag. 409)
Men kan bij transport-processen door carriers onderscheid maken tussen actief en passief
transport. Bij passief transport vindt de diffusie van stoffen over de membraan plaats in de
richting van hun concentratie-gradiënt. Deze processen vereisen doorgaans geen energie en
worden gedreven door de te behalen winst aan entropie (voorbeeld: glucose-opname in de
rode bloedcel). Actief transport zijn alle transport-processen waarbij stoffen tegen hun
concentratie-gradiënt in worden getransporteerd. Daarbij kan onderscheid worden gemaakt
tussen primair en secondair actief transport. Bij primair actief transport wordt een stof
tegen zijn concentratie-gradiënt in getransporteerd (van x naar X), waarbij de benodigde
energie geleverd wordt door hydrolyse van een hoog-energetische verbinding zoals ATP
(voorbeeld: Ca2+-ATPase). Bij secondair actief transport wordt de ene stof tegen zijn
concentratie-gradiënt in getransporteerd (van s naar S), terwijl tegelijkertijd een andere stof
met zijn concentratie-gradiënt mee wordt getransporteerd (van X naar x). De benodigde
energie voor het actieve transport (van S) wordt daarbij geleverd door de Gibbs-energiewinst
die vrijkomt doordat de andere stof (hier X) met zijn gradient mee wordt getransporteerd (om
de stof x vervolgens tegen zijn concentratie-gradiënt weer de cel uit te pompen, is wel weer
ATP energie nodig). Een voorbeeld is de Na+/glucose cotransporter in epitheelweefsel, die
glucose tegen zijn gradiënt in de cel in transporteert, terwijl tegelijk Na+ (hoge concentratie
buiten de cel, lage concentratie binnen de cel) met zijn gradiënt mee de cel instroomt.
Ongeacht het soort transport, kan nog een ondersOngeacht het soort transport, kan nog een
onderscheid gemaakt worden tussen carrier-eiwitten die werken als uniporter, symporter of
antiporter. Bij uniport wordt door de carrier slechts een enkele stof getransporteerd
(voorbeeld: glucose-opname in de rode bloedcel), bij symport worden twee stoffen door de
carrier tegelijk en in dezelfde richting getransporteerd, vaak als onderdeel van secondair actief
transport (voorbeeld: Na+/glucose cotransporter in epitheelweefsel), terwijl bij antiport de
ene stof de ene richting en de andere de tegengestelde richting op wordt getransporteerd
(voorbeeld: Cl-/HCO3- uitwisseling in de rode bloedcel).
64
Voorbeelden van transport-processen (Lehninger 6, pag. 406-407)
De erythrocyte (rode bloedcel) heeft een carrier-eiwit Glut1, waarmee glucose kan worden
opgenomen. De glucose concentratie in het bloed is hoog (4.5-5.0 mM), terwijl eenmaal
opgenomen glucose door de erythrocyte snel wordt afgebroken tot pyruvaat. De opname van
glucose vindt dus plaats via uniporter-gemedieerd passief transport. De kinetiek waarmee
glucose wordt opgenomen, voldoet aan de Michaelis-Menten vergelijking, waarbij Kt een
waarde heeft van 1.5 mM. Dat houdt in dat [S] ≈ 3.Kt is, en dus de opnamesnelheid V0
ongeveer 75% van Vmax bedraagt.
De carrier heeft twee conformaties,
één waarbij de glucose-bindingsite
aan de buitenkant van de cel zit (en
daar glucose kan binden; T1) en één
waarbij de glucose-bindingsite aan de
binnenkant van de cel zit (en daar
gebonden glucose kan loslaten; T2).
De chloride-bicarbonaat exchanger (uitwisselaar) is een electroneutrale antiporter, die Clionen uitwisselt tegen HCO3- ionen. Deze exchanger speelt onder andere een belangrijke rol
bij de afvoer van het tijdens de glycolyse/ citroenzuurcyclus ontstane CO2 via onze longen.
CO2 lost maar heel beperkt op in water, dat in tegenstelling tot zijn zoutvorm HCO3- , die heel
goed in water oplost. De rode bloedcel bevat het enzym carbonic anhydrase (CA), dat de
reactie CO2 + H2O ↔ HCO3- + H+ versnelt. Deze reactie vereist geen netto energie in de vorm
van ATP hydrolyse en kan beide kanten op goed verlopen. CO2 in het bloed kan als klein,
neutraal molecuul via spontane diffusie de rode bloedcel binnenkomen. Daar wordt het door
CA in HCO3- omgezet.
Dit HCO3- wordt vervolgens via de Cl-/
HCO3- exchanger de erythrocyte uitgepomt,
zodat netto CO2 in het bloed wordt omgezet
in het veel beter oplosbare HCO3-. In de
longen moet CO2 in gasvormige toestand via
onze adem worden afgevoerd. Daarom moet
in de longen de in het bloed aanwezige
HCO3- door de rode bloedcel via de Cl-/
HCO3- exchanger weer worden opgenomen,
omgezet in CO2 + H2O, waarna het CO2 de
rode bloedcel weer via spontane diffusie
verlaat en aan de longen wordt afgestaan.
65
Transport van ionen door membranen (Lehninger 6, pag. 412; 417)
De concentratie van ionen in het cytoplasma (intracellulair medium) van zoogdiercellen is
geheel anders dan buiten de cel (extracellulair medium). Binnen de cel is de K+-concentratie
hoog (140 mM) en de Na+-concentratie laag (12 mM), terwijl buiten de cel de K+-concentratie
laag (4 mM) en de Na+-concentratie hoog is (145 mM). In beide gevallen is Cl- het
belangrijkste tegenion. De Ca2+- concentratie buiten de cel bedraagt 1-2 mM, terwijl de
concentratie binnen de cel slechts 100 nM bedraagt (dus een factor 10.000 lager). Een
langdurig hoge calcium concentratie in de cel leidt tot geprogrammeerde celdood (apoptose).
Deze ion-gradiënten worden in stand gehouden door ionen-pompen, met name de Na+/K+ATPase en de Ca2+-ATPase.
De Na+/K+-ATPase is een electrogene pomp, die ten koste van 1 molecuul ATP 3 Na+-ionen
de cel uitpompt en 2 K+-ionen de cel inpompt (antiporter). Dit actieve transport heeft twee
gevolgen: op de eerste plaats dat de concentratie K+ in de cel toeneemt en die van Na+ in de
cel afneemt. Op de tweede plaats dat er meer Na+ de cel wordt uitgepompt dan K+ de cel
wordt ingepompt, met als gevolg dat het cytoplasma van de cel een netto iets negatievere
lading zal hebben dan het buitenmedium. Als gevolg van dit netto ladingsverschil zal er een
spanningsverschil over de membraan ontstaan, waarbij het cytoplasma negatief geladen is ten
opzichte van het buitenmedium. Dit spanningsverschil is te meten met behulp van microelectroden en wordt de membraan-potentiaal (∆Vm) genoemd. Voor de meeste cellen bedraagt
∆Vm -50 tot -70 mV.
66
Veel processen in de cel, zoals de eiwitsynthese en de vorming van het cytoskelet, kunnen
alleen plaatsvinden in de aanwezigheid van de hoge K+-concentratie die in de cel aanwezig is.
Het is voor de cel dan ook essentieel dat de Na+/K+-ATPase goed functioneert. Van alle ATP
die de cel aanmaakt, wordt circa 25% gebruikt voor het voortdurend de cel uitpompen van
Na+ en daarmee het de cel inpompen van K+. Ouabaine is een plantaardige, non-competitieve
remstof van de Na+/K+-ATPase, die in staat is het membraanpotentiaalverschil over de
plasmamembraan te niet te doen.
Door de werking van de Na+/K+-ATPase bevindt er zich een stijle Na+-gradient over de
plasmamembraan (145 naar 12 mM). Na+ wil dan ook niets liever dan de cel instromen,
allereerst omdat de Na+-concentratie buiten hoger is dan binnen (concentratie-gradiënt),
maar op de tweede plaats omdat het cytoplasma negatief geladen is ten opzichte van het
buitenmedium (electrische gradiënt). De cel laat normaal gesproken Na+ echter niet zomaar
de cel inlopen (er is maar weinig permeabiliteit door Na+-kanalen). Wel bestaat er een aantal
exchangers (electroneutrale antiporters) die gebruik maken van de Na+-gradiënt om ionen de
cel uit te transporteren. Zo kan de Na+/H+-exchanger Na+ de cel inlaten, op voorwaarde dat
tegelijk een H+ de cel wordt uitgetransporteerd. Dit is van belang als de pH in het cytoplasma
te laag dreigt te worden. Aangezien de H+-concentratie in de cel maar 10-7 M bedraagt, terwijl
de Na+-concentratie buiten de cel 145 mM bedraagt, zal de H+-concentratie in de cel
doorgaans beperkend zijn voor de activiteit van de Na+/H+-exchanger, waardoor voorkomen
wordt dat de cel volloopt met Na+.
Een andere manier om de Na+-gradiënt te gebruiken is om glucose de cel in te transporteren.
Dit gebeurt door de Na+/glucose symporter in epitheelcellen, die via een secundair actief
transport-mechanisme werkt.
67
In de darmen komt glucose vrij bij de afbraak van lange suikerketens, die wij via ons voedsel
hebben opgenomen. Vanwege het grote watervolume, is desondanks de concentratie aan
glucose in de darm lager dan in de aanliggende epitheel-cellen, en daarom zal glucose door
deze cellen via een actief transport-proces vanuit de darmen moeten worden opgenomen. Aan
de kant van de epitheelcellen die naar de darmen wijst (zgn. apicale zijde), bevindt zich de
Na+/glucose symporter, die tegelijk 2 Na+ ionen en 1 molecuul glucose van de darm de cel in
transporteert. De instroom van Na+ in de cel met zijn gradiënt mee levert zoveel energie op,
dat dit het transport van glucose tegen zijn gradiënt in mogelijk maakt. Als gevolg van dit
proces wordt glucose vanuit de darm geaccumuleerd (binnen de cel hogere concentratie dan
buiten de cel) in de darm-epitheelcellen, die het vervolgens via een passieve glucosetransporter (Glut2) kunnen afstaan aan het bloed (basolaterale zijde; basal surface).
Regulatie van de membraanpotentiaal (Lehninger 6, pag. 464-466)
De meeste cellen hebben onder normale condities een membraanpotentiaal tussen de -50 tot 70 mV. Deze waarde wordt niet alleen bepaald door de activiteit van de Na+/K+-ATPase,
maar vooral ook door de aanwezigheid van ionkanalen in de plasma-membraan. Dergelijke
ion-specifieke kanalen in de membraan kunnen op een gecontroleerde manier open en dicht
worden gezet. De belangrijkste ionkanalen in de plasma-membraan zijn Na+-kanalen, K+kanalen, Ca2+-kanalen en Cl--kanalen.
Sommige van deze
kanalen gaan open
zodra de membraanpotentiaal een
bepaalde waarde heeft
bereikt. Wij spreken
dan van spanningsafhankelijke ionkanalen. Andere
kanalen gaan open als
er een signaal in de cel
wordt afgegeven
waardoor kanaaleiwitten op bepaalde
bepaalde aminozuren
gefosforyleerd
worden.
68
Algemeen geldt dat bij processen waarbij de membraan-potentiaal sterker negatief wordt, wij
spreken van hyperpolarisatie, terwijl bij processen waarbij de membraan-potentiaal minder
sterk negatief (of zelfs positief) wordt, gesproken wordt van depolarisatie.
De plasmamembraan van zoogdier-cellen heeft doorgaans een hoge K+-permeabiliteit (veel
open K+-kanalen) en een lage Na+-permeabiliteit (weinig open Na+-kanalen). Dat is er mede
de oorzaak van dat bij de meeste cellen het buitenmedium van de cel positief is ten opzichte
van het binnenmedium (∆Vm < 0). Volgens zijn concentratie-gradiënt wil K+ de cel
uitstromen, maar wordt daarin tegen gehouden door de electrische gradiënt (van – naar +) .
Na+ wil daarentegen volgens zijn concentratie-gradiënt de cel instromen, en wordt daarin
versterkt door de electrische gradiënt (van + naar –). Wij zullen in de volgende sectie zien,
dat er voortdurend K+ de cel verlaat via K+-kanalen, tenzij de membraanpotentiaal
hyperpolariseert tot circa -95 mV. Die membraanpotentiaal staat bekend als de
evenwichtspotentiaal van K+, omdat dan de concentratie-gradiënt van K+ (gericht op
transport naar buiten) precies gecompenseerd wordt door de electrische gradiënt, die K+ in de
cel wil houden. Bij deze evenwichtspotentiaal zal er netto geen K+ door de K+-kanalen
diffunderen.
Zodra Na+-kanalen geopend worden, zal Na+ de cel instromen, gedreven door zowel de
concentratie-gradiënt als de electrische gradiënt. Alleen als de membraan depolariseert tot
positieve waarden zal de Na+-instroom tegengewerkt worden door de electrische gradiënt.
Berekend kan worden dat de evenwichtspotentiaal van Na+ circa +65 mV bedraagt. Pas die
sterk positieve membraanpotentiaal zal er netto geen Na+ door de Na+-kanalen stromen.
Zoals al gememoreerd, hebben de meeste zoogdiercellen een membraanpotentiaal tussen de 50 en -70 mV. Deze waarde wordt wel de rust-membraanpotentiaal van de cel genoemd.
De Na+/K+-ATPase is verantwoordelijk voor het ontstaan van de membraanpotentiaal, maar
de precieze waarde van de rust-membraanpotentiaal wordt mede bepaald door de
voortdurende uitstroom van K+-ionen en instroom van Na+-ionen. Uit het feit dat deze rustmembraanpotentiaal veel dichter bij de evenwichtspotentiaal van K+ (-95 mV) ligt dan bij die
van Na+ (+65 mV), kan geconcludeerd worden dat normaal gesproken de permeabiliteit van
de plasma-membraan voor K+ veel hoger is dan voor Na+.
Om aan te tonen dat de waarde van de rust-membraanpotentiaal voor een groot deel wordt
bepaald door de verhouding van de permeabiliteit voor K+ en Na+, kunnen stoffen worden
toegevoegd die specifiek de permeabiliteit voor een van deze twee ionen verhogen. Dergelijke
stoffen staan bekend als ionophoren, en worden door bacteriën gemaakt ter bescherming tegen
virale infecties (antibiotica). De bekendste ionophoren zijn valinomycine, dat specifiek K+
transporteert en daardoor de permeabiliteit voor K+ sterk verhoogt, en monensine, dat de
membraan sterk permeabel maakt voor Na+ (heeft activiteit als Na+/H+-exchanger). Het
toevoegen van valinomycine aan cellen leidt tot verhoogde uitstroom van K+, hetgeen
resulteert in hyperpolarisatie. Het toevoegen van monensine aan cellen leidt tot verhoogde
instroom van Na+, hetgeen resulteert in depolarisatie.
69
Sommige stoffen kunnen tijdelijk de Na+-permeabiliteit van cellen verhogen. Een voorbeeld
is acetylcholine, dat in zenuw-uiteinden wordt aangemaakt en daardoor spiercellen tot
contractie aanzet. Acetylcholine bindt aan de acetylcholine-receptor die zich op spiercellen
bevindt. Deze receptor is een Na+-kanaal, dat door binding van acetylcholine wordt
opengezet. Omdat acetylcholine ter plaatste weer snel wordt afgebroken (door het enzym
acetylcholine-esterase), gaat dit Na+-kanaal maar korte tijd open. Door het openen van het
Na+-kanaal zal positieve lading snel de cel instromen en daarmee de cel depolariseren (tot
positieve waarden). Zodra het Na+-kanaal weer dicht is, zal door de werking van K+-kanalen
de cel weer snel hyperpolariseren, totdat de rust-membraanpotentiaal weer bereikt is. Een
dergelijke snelle, maar tijdelijke verandering van de membraan-potentiaal staat bekend als een
actie-potentiaal. Actiepotentialen spelen een belangrijke rol in ons lichaam, niet alleen bij het
aanzetten tot spiercontractie, maar ook bij zenuwgeleiding.
Er zijn diverse remstoffen van de werking van acetylcholine bekend. Bungarotoxine is een
stof die in slangengif zit. Het gaat de werking van acetylcholine tegen door de acetylcholinereceptor te blokkeren, waardoor er geen Na+-influx op kan treden, en de spieren zich dus niet
kunnen samentrekken. Op deze manier verlamt de slang zijn prooi, alvorens deze met huid en
haar op te eten. Daarnaast zijn er synthetische acetylcholine-esterase remmers gemaakt, die
de afbraak van acetylcholine voorkomen. Dit zal leiden tot een permanente spiercontractie en
uiteindelijk de dood. Acetylcholine-esterase remmers zitten in zenuwgassen en insecticiden.
Bioenergetica van transport-processen (Lehninger 6, pag. 409-410; 417-418)
De drijvende kracht achter transportprocessen is een winst aan Gibbs-energie. Bij spontane
diffusie van ongeladen moleculen is de drijvende kracht uitsluitend een winst aan entropie,
maar bij actief transport en de permeabiliteit van ionen speelt ook de enthalpie een belangrijke
rol. Via de bioenergetica is te berekenen of er voor bepaalde transport-processen voldoende
energie aanwezig is. De bioenergetica zegt echter niets over het mechanisme waarmee
transport-processen plaatsvinden.
70
Zoals wij eerder hebben gezien, hangt de Gibbs-energie van een stof in oplossing af van de
concentratie van die stof (X), volgens: G = G’° + RT ln X. Indien wij nu twee
compartimenten hebben (in en out), dan zal een verschil in concentratie van X leiden tot een
verschil in Gibbs-energie volgens ∆Gt = Gin – Gout = RT ln (Xi/Xo). Zolang Xi < Xo zal ∆Gt
(∆G transport) kleiner zijn dan 0 en zal dit een drijvende kracht opleveren voor X om te
diffunderen van compartiment out naar compartiment in. Pas als Xi=Xo zal er geen netto
transport meer optreden (∆Gt=0).
Voor een ion hangt de Gibbs-energie niet alleen af van zijn concentratie, maar ook van zijn
potentiële energie als gevolg van het electrisch veld (V) waarin het zich bevindt, volgens G =
G’° + RT ln X + zFV. In deze formule is z de valentie van het ion (inclusief + of - lading) en
F de constante van Faraday (lading van een mol electronen; 96.5 kJoule/Volt.mol). Indien wij
nu twee compartimenten hebben (in en out), gescheiden door een membraan waarover een
potentiaalverschil ∆Vm (buiten positief) staat, met daarin een ion in verschillende
concentraties (Xi en Xo), dan geldt dat voor het transport van buiten (out) naar binnen (in):
∆Gt = RT ln (Xi/Xo) + z.F. ∆Vm
In deze formule geeft de eerste term rechts de drijvende kracht aan voor transport volgens de
concentratie-gradiënt (met name entropie), en de tweede term voor transport volgens de
electrische gradiënt (met name enthalpie). Wij kunnen wij deze formule vereenvoudigen tot:
∆Gt = 5.9 log (Xi/Xo) + z.(96.5).∆Vm
waarin Xi de ion-concentratie binnen is, Xo de ion-concentratie buiten, z de valentie van het
ion en ∆Vm de membraan-potentiaal (overeenkomend met de potentiële energie van een
geladen deeltje in een electrisch veld). Wij kunnen deze formule nu toepassen op het transport
van K+-ionen van buiten naar binnen de cel, uitgaande van een K+-concentratie in de cel (Xi)
van 140 mM en buiten de cel (Xo) van 4 mM, met z = +1 en ∆Vm= -50 mV. Op basis van
deze getallen volgt dat de concentratie-gradiënt van K+ overeenkomt met een Gibbs energie
verschil van ∆Gt = 5.9 log (140/4) = + 9.1 kJ/mol, terwijl de electrische gradiënt van K+
overeenkomt met ∆Gt = (96.5)(-0.05) = – 4.8 kJ/mol. Dat betekent dat er een positieve ∆Gt
van 9.1 kJ/mol is om K+ tegen zijn concentratie-gradiënt in de cel in te laten stromen en een
negatieve ∆Gt van -4.8 kJ/mol is om K+ met de electrische gradient mee de cel in te laten
stromen. Het netto resultaat is dus dat de resulterende drijvende kracht om K+ de cel in te
laten stromen een waarde heeft van ∆Gt = +4.3 kJ/mol. Aangezien deze waarde positief is, zal
er netto geen K+ de cel instromen. In plaats daarvan zal er juist K+ de cel uitstromen, en wel
met een ∆Gt = - 9.1 + 4.8 = -4.3 kJ/mol. In conclusie, bij een membraan-potentiaal van – 50
mV heeft de concentratiegradient meer energie-inhoud dan de electrische gradiënt, en zal er
door openstaande K+-kanalen netto K+ uit de cel diffunderen, dit ondanks de tegenwerkende
kracht van de electrische gradiënt. Willen wij dat er geen netto K+ door de kanalen stroomt,
dan moeten wij de energie-inhoud van de electrische gradiënt verhogen. Dit kan gebeuren
door de cel te hyperpolariseren tot een membraanpotentiaal waarbij 96.5 ∆Vm= - 9.1 kJ/mol,
71
ofwel ∆Vm= -95 mV. Er ontstaat dan een evenwichtssituatie, waarbij de concentratie-gradiënt
en de electrische gradient even sterk en tegengericht zijn, en elkaar dus opheffen (∆Gt = 0).
Bij deze waarde voor de membraan-potentiaal (evenwichtspotentiaal voor K+) bevindt K+
zich in een electrochemisch evenwicht, waarbij geen netto diffusie optreedt. Anders dan bij
ongeladen deeltjes kan bij ionen de drijvende kracht voor diffusie dus nul zijn, ook al blijft er
sprake van een concentratie-gradiënt. In onderstaand schema staan de waarden voor de
concentratie- en ladingsgradiënt van K+ bij een membraanpotentiaal van -50 en -95 mV. Bij
Vm= - 50 mV zal er netto K+ de cel uitstromen (∆Gt < 0) , bij Vm = - 95 mV is er evenwicht
tussen K+ influx en efflux (∆Gt = 0).
Een vergelijkbare analyse kan ook gebruikt worden om te bepalen tot welke concentratie
glucose kan accumuleren in epitheelcellen als gevolg van Na+/glucose cotransport. De Na+gradiënt in deze cellen resulteert in een concentratie-gradiënt met ∆Gt = 5.9 log (12/145) = 6.4 kJ/mol en een electrische gradiënt met ∆Gt = 1. (96.5)(-0.05) = -4.8 kJ/mol, tezamen -11.2
kJ/mol. Aangezien er per mol glucose 2 mol Na+ wordt getransporteerd, is er voor het
transport van 1 mol glucose een ∆Gt = -22.4 kJ beschikbaar. Als al deze energie uit de Na+gradiënt gebruikt wordt om glucose te accumuleren in de darmepitheelcellen, kan dit
resulteren in een concentratie-gradiënt van glucose, gegeven door 5.9 log (glucose-in/glucoseout) = 22.4, ofwel glucose-in/glucose-out = 10 ^ (22.4/5.9) = ∿ 6000. Kortom, door gebruik te
maken van de energie aanwezig in de natrium-gradiënt kunnen darmepitheel-cellen glucose
vanuit de darm accumuleren tot een concentratie die een factor 6000 hoger ligt dan in de darm
zelf. Gezien de hoge concentratie van glucose die op deze manier in deze darmepitheel-cellen
72
gevormd wordt, kan het glucose vervolgens via een passief werkende glucose-carrier (Glut2)
met de concentratie-gradiënt mee aan het bloed worden afgestaan.
Bovenstaande berekeningen hebben betrekking op de membraanpotentiaal over de plasmamembraan, die vooral het gevolg is van het verschil in Na+ en K+ concentraties binnen en
buiten de cel. Tijdens oxidatieve fosforylering zal er ook een membraanpotentiaal over de
mitochondriële membraan (∆Vm ≈ -150 mV) ontstaan als gevolg van de netto export van H+.
Via bovenstaande formules kunnen wij nu ook begrijpen hoe de ∆H+, die bij het
electronentransport van NADH naar O2 in de mitochondriën ontstaat, gebruikt kan worden om
ADP in ATP om te zetten. Bij het electronentransport wordt H+ uit de mitochondriën
getransporteerd en blijft OH- in de mitochondriën achter. Dit leidt tot een concentratiegradiënt van H+, als gevolg waarvan de mitochondriën aan de buitenkant een pH hebben die
0.75 eenheden lager is dan aan de binnenkant. Daarnaast resulteert het uitstoten van positieve
H+ deeltjes in een membraanpotentiaal van ongeveer -150 mV (buiten positief). Per mol H+
leidt dit tot een ∆Gt = (5.9).(-0.75) + 1. (96.5)(-0.15) = - 4.4 - 14.5 = -18.9 kJ/mol. Deze
gecombineerde concentratie-gradiënt en electrische gradiënt van H+ wordt de proton motive
force (pmf) over de mitochondriële membraan genoemd, en is de drijvende kracht voor de
vorming van ATP in de mitochondriën. Om 1 mol ADP in ATP om te zetten, is +30 kJ/mol
nodig, en dus is transport van tenminste 2 (in de praktijk 3) H+-ionen via de oligomycinegevoelige ATPase nodig om 1 molecuul ADP in ATP om te zetten. Bij electronen-overdracht
van NADH naar O2 worden 10 H+-ionen uit de mitochondriën gepompt (genoeg voor 3 ATP)
en bij FADH2 naar O2 zijn dat 6 H+-ionen (genoeg voor 2 ATP). Realiseer je dat volgens dit
soort thermodynamische berekeningen de verhouding ATP/NADH en ATP/FADH2 niet per
definitie een geheel getal hoeft te zijn.
73
Verantwoording figuren:
Pag.1: Pearson Education, 2003
Pag.2: Lehninger 5th edition, table 2-5 (with permission)
Pag.4: Lehninger 5th edition, figure 3-5 (with permission)
Pag.5: Lehninger 5th edition, table 3-1 (with permission)
Pag.9 (boven): Lodish 6th edition, figure 3-3
Pag.9 (links-onder): Lodish 6th edition, figure 3-4
Pag.9 (rechts-onder): http://www.embl.de/~seqanal/courses/commonCourseContent/
commonProteinStructureFunctionExercises.html
Pag.10 (links): Lodish 6th edition, figure 3-2
Pag 10 (rechts): http://tmp.kiwix.org:4201/I/300px_1GZX_Haemoglobin.png
Pag.11: E.J.J. van Zoelen
Pag.13: Lehninger 5th edition, figures 3-19; 3-20; 3-21 (with permission)
Pag.14 (links): Lehninger 5th edition, figure 3-16 (with permission)
Pag.14 (rechts): E.J.J. van Zoelen
Pag.15: E.J.J. van Zoelen
Pag.16: http://www.biology.arizona.edu/immunology/tutorials/antibody/structure.html
(modified)
Pag.18: https://www.bio.cmu.edu/courses/03231/LecF04/Lec16/lec16_sds.html
Pag.19 (links): http://www.genosphere-biotech.com/Anti-Protein-Antibodies.html
Pag.19 (rechts): http://www.uiowa.edu/~cmrf/methodology/cytochemistry/index.html
Pag.20: E.J.J. van Zoelen
Pag.22-24: E.J.J. van Zoelen
Pag.25: http://www.civil.uwaterloo.ca/enve375/Background.htm
Pag.26: E.J.J. van Zoelen
Pag.27: http://www.civil.uwaterloo.ca/enve375/Background.htm
Pag.28: E.J.J. van Zoelen
Pag.30: http://nl.wikipedia.org/wiki/Wet_van_Lambert-Beer
Pag.31 (boven): http://en.wikipedia.org/wiki/Adenosine_triphosphate
Pag.31 (onder): Lehninger 5th edition, figure 7-1a (with permission)
Pag.32 (onder): Lehninger 5th edition, figure 7-2 (with permission)
Pag.35: Lehninger 5th edition, figure 7-3 (with permission; modified)
Pag.36: Lehninger 5th edition, figure 7-3 (with permission; modified)
Pag.37 (boven): Lehninger 5th edition, figure 7-6 (with permission)
Pag.37 (onder): Lehninger 5th edition, figure 7-7 (with permission; modified)
Pag.38: Lehninger 5th edition, figure 7-12 (with permission; modified)
Pag.39: http://www.scienceblogs.de/diaxs-rake/2010/01/fundamentales-entropie.php
Pag.42 (boven): http://en.wikipedia.org/wiki/Adenosine_triphosphate
Pag.43: http://asterix.cs.gsu.edu/~weber/GK-glc-atp03.gif
Pag.53 (links): http://www.cdd-tum.de/uploads/pics/Elaidic_Oleic_Stearic.jpg
Pag.53 (rechts): http://www.chem1.com/acad/webtext/states/polymer-images/cis_trans.png
Pag.54 (links): http://chemistry.gravitywaves.com/CHE450/Images9-13/EssenFAs.gif
Pag.54 (rechts): http://en.wikipedia.org/wiki/Prostaglandin_E2
74
Pag.55: http://www.naturalhealthwizards.com/Understanding_files/image026.jpg (modified)
Pag.56 (boven): Lehninger 5th edition, figure 10-17 (with permission)
Pag.56 (onder): http://openwetware.org/wiki/User:Johnsy/Lipoprotein_Modelling
Pag.57: Lehninger 5th edition, figure 10-9 (with permission; modified)
Pag.58: Lehninger 5th edition, figure 11-4 (with permission)
Pag.59: http://obsil.tripod.com/membran.html (modified)
Pag.60: Lehninger 5th edition, figure 11-3 (with permission)
Pag.61 (boven): Lehninger 5th edition, figure 11-5 (with permission)
Pag.61 (onder): Stryer 4th edition, figure 11-17 (modified)
Pag.62 (boven): http://ecx.images-amazon.com/images/I/51Y3jXPaBIL._SL500_AA300_.jpg
Pag.62 (onder): http://mrsmaineswiki.wikispaces.com/file/view/osmosis.jpeg/32858825/
osmosis.jpeg
Pag.63: http://en.wikipedia.org/wiki/Facilitated_diffusion
Pag.64 (links): Lehninger 5th edition, figure 11-34 (with permission; modified)
Pag.64 (rechts): Lehninger 5th edition, figure 11-33 (with permission)
Pag.65 (boven): Lehninger 5th edition, figure 11-31 (with permission)
Pag.65 (onder): Lehninger 5th edition, figure 11-32 (with permission)
Pag.66: http://www.unizar.es/departamentos/bioquimica_biologia/docencia/
ELFISICABIOL/PM/Diapositiva15.gif
Pag.67: Lehninger 5th edition, figure 11-44 (with permission)
Pag.68: Lehninger 5th edition, figure 12-24 (with permission)
Pag.70: http://users.telenet.be/zeldzame.ziekten/List.m/meg%281%29.gif
Pag.72: E.J.J. van Zoelen
75











