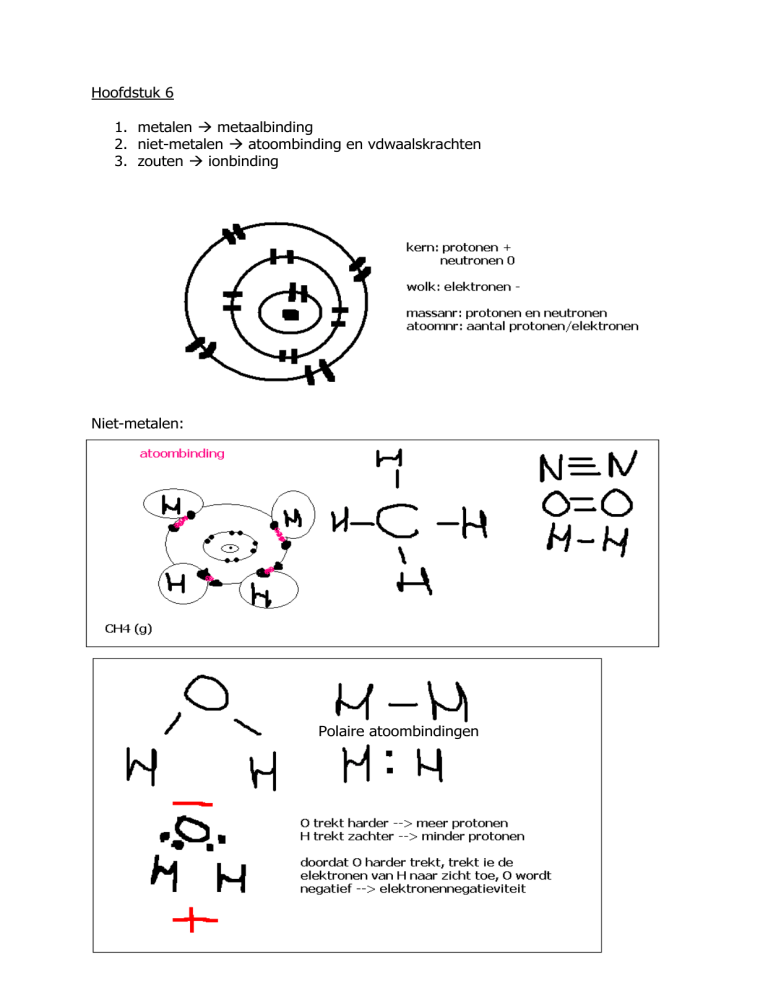
Hoofdstuk 6
1. metalen metaalbinding
2. niet-metalen atoombinding en vdwaalskrachten
3. zouten ionbinding
Niet-metalen:
Polaire atoombindingen
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce
Dipool:
o asymmetrisch (bij symmetrisch heft het elkaar op)
o polaire atoombinding
Elektronegativiteit: hoe hard trekt het atoom?
Verschil in elektronegativiteit > 0,4 polaire atoombinding
Verschil in elektronegativiteit > 1,7 ionbinding
Polaire binding: overgang tussen een gewone atoombinding en de ionbinding.
A-polaire binding:
Als binding precies in het midden zit: O=C=O
Polaire stoffen hebben een hoger kookpunt dan a-polaire stoffen dipool dipool
aantrekking.
Symmetrisch:
o structuur
o welk atoom
Waterstofbruggen:
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce
Waterstofbruggen komen voor bij OH, HF, NH
Tussen moleculen:
o vdwaalskrachten
o waterstofbruggen (polaire aantrekkingskrachten)
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce
Zeep en water
Een zeepdeeltje heeft een hydrofiele kop en een hydrofobe staart.
Zeepbel
Schuim
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce
C17H35COONa oplossen Na+ (aq) + C17H35COO- (aq)
Ca2+ (aq) + C17H35COO- (aq) (C17H35COO)2 Ca (s)
(C17H35COO)2 Ca (s) is grijs/wit, kalkzeep/grouwsluier wat je overhoudt als je wast.
Zeep bind met hard water, dus hoe harder het water, hoe meer zeep je nodig hebt.
Harskorreltjes zit Na aan vast water erin Na wisselt met Ca water zonder Ca
hars vol regenereren Na oplossing erin Na wisselt met Ca nu kun je
hem weer opnieuw gebruiken.
De ionenwisselaar de ionen worden gewisselt
Voor Ca heb je Na nodig, voor anderen weer anderen ionenwisselaars nodig.
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce
Hard en zacht water
Ontharden: Ca eruit halen
o koken
o neerslaan (neerslag reactie, zie binas)
o ionenwisselaar
o inkapselen (zeolieten kapselen Ca in spoelen met water Ca weg)
Berg bestaat uit CaCO3 (s)
CO2 (g) + H2O (l) HCO3- (aq)
Lucht
regenwater
CaCO3, zorgt voor het ontstaan van hard water en blijft vaak achter in de ketel,
daarom ook wel ketelsteen/kalk genoemt
CaCO3 + CO2 + H2O Ca 2+ (aq) + 2HCO3- (aq)
Reactie andere kant op:
Ca2+ (aq) + 2HCO3- (aq) H2O + CO2 + CaCO3
Boven 80 graden
Zelfde als met magnesium (zorgt ook voor hardheid)
Hydratatie: om elk ion een mantel van waterionen geeft kleur door hoeveelheid
water en op welke manier (structuur)
Andere omringing andere structuur andere kleur
Water
Alcohol
Ammonia
CuCl2
Licht blauw
Licht groen
Blauw
CoCl2
Licht rood
Paars
Bruin
CaCl2
Kleurloos
Kleurloos
Kleurloos
CuSO4 . 5H2O (s) is blauw, verwarmen, wit, water erbij, blauw, verwarmen, wit, etc.
Blijft een vaste stof, ook al zit er water in
1 deeltje CuSO4 heeft 5H2O bij zicht daarom die .
Vaste stof met water erin, omdat er gaten in het rooster zitten door verschillende
grote van moleculen. Water in het rooster van een stof heet kristal water.
CaSO4.2H2O (s) verwarmen CaSO4 (s) + 2H2O (l)
Vaste stof
poeder
water
Gips
Endotherm
Energie in
exotherm
energie uit (de warmte)
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce
Hydrofiele stoffen mengen met water
Hydrofobe stoffen niet
A-polaire stoffen mengen met a-polaire stoffen, niet met polaire
Grensvlakspanning/oppervlaktespanning: door de waterstofbruggen kunnen dingen
op water drijven en bijv. niet op ethanol.
Detergens: een stof die de grensvlakspanning verlaagt (denk aan zeep)
Hoofdstuk 7
Gram/u = mol
D= massa/volume = g/ml
1 mol = 6,0 x 10²³ deeltjes
Vm= 22,4 liter
M = mol/l = mmol/ml
Reactie vergelijking
Gegeven en gevraagd
Molverhouding
Gegeven uitrekenen in mol
Molverhouding toepassen
Gevraagd uitrekenen in juiste eenheid
Controleren (juiste antwoord en significante cijfers)
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce
M = Molariteit: mol opgeloste stof per liter oplossing
P1 x V1 = P2 +V2
T1
T2
P1 = 0
V1 = 22,4 dm³/mol
T1 = 273 K
Hoofdstuk 8
Reactietijd = mol per seconde
Hangt af van:
o concentratie
o soort stof
o temperatuur
o katalysator (vergroot snelheid v/d reactie, wordt gebruikt maar niet VERbruikt, enzymen)
o verdelingsgraad
Isotherme reactie/isotherm proces: temperatuur blijft hetzelfde
Hoe hoger de concentratie/temperatuur, hoe hoger de reactie snelheid
Het botsende deeltjes model: aantal effectieve botsingen per seconde tussen deeltjes.
Verklaart:
o temperatuur
o concentratie
o verdelingsgraad
Omkeerbare reacties: 2NO2 (g) en N2O4 (g)
Reactie : heengaande reactie
Reactie : teruggaande reactie
Evenwichtstoestand: bij die temperatuur blijft de kleur gelijk heengaande en teruggaande
reactie verlopen even snel.
Dynamisch evenwicht: zichtbaar verandert er niets, er vinden wel voortdurend reacties plaats,
maar omkeerbare reacties even snel.
Statisch evenwicht: verandert niets, geen reacties
Chemische evenwichten en fase overgangen zijn dynamische evenwichten.
Insteltijd: snelheden van de teruggaande en heengaande reactie aan elkaar gelijk laten worden
Aflopende reactie: ervoor zorgen dat een reactie niet meer kan teruggaan door bijv. een stof weg
te halen.
Chemische evenwichten:
o homogeen evenwicht: alle stoffen zijn in dezelfde fase
o heterogeen evenwicht: stoffen in verschillende fase
o verdelingsevenwicht: een stof die oplosbaar is in 2 oplosmiddelen die zelf niet met elkaar
mengen.
Samenvatting Scheikunde
4vA
Toetsweek 3
Joyce










