Een rondleiding door de cel (COO 2)
Vragen bij de oefen- en zelftoets-module behorende bij hoofdstuk 7 en 8 van ‘Biology’,
Campbell, 9e druk
Versie 2012-2013
De vragen die voorkomen in het COO-programma zijn op dit formulier weergegeven. Het is
de bedoeling dat je, als je dat nodig vindt, aantekeningen maakt bij de vragen.
Deze aantekeningen kun je gebruiken bij de voorbereiding van het tentamen.
Inleiding
1.
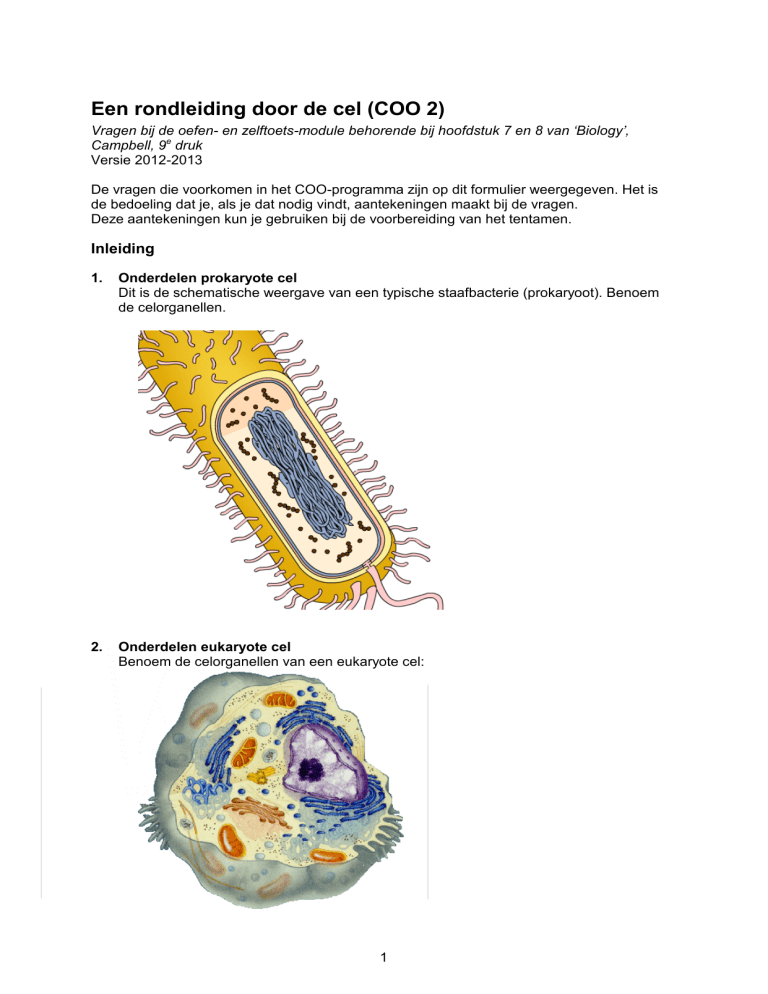
Onderdelen prokaryote cel
Dit is de schematische weergave van een typische staafbacterie (prokaryoot). Benoem
de celorganellen.
2.
Onderdelen eukaryote cel
Benoem de celorganellen van een eukaryote cel:
1
3.
Functies celonderdelen
Elk compartiment heeft een aantal specifieke functies. Geef van elk compartiment een
kenmerkende functie.
ribosomen
RER
Mitochondrium
Golgi-appraat
Kern
plasma-membraan
SER
Lysosoom
centrosoom
4.
Verschil pro- en eukaryoot
Prokaryote cellen (zoals bacteriën en blauwwieren) onderscheiden zich in verschillende
opzichten van eukaryote cellen. Geef de juiste kenmerken aan voor pro- en eukaryoten.
Prokaryoten
Eukaryoten
afmetingen (in µm)
plasmamembraan
interne membraansystemen
eiwitsynthese
DNA
kern
ribosomen
5.
Verhouding inhoud/volume
A. Welke cel heeft de meeste plasma-membraan in verhouding tot zijn volume?
o prokaryote cel
o eukaryote cel
B. Hoe verandert de verhouding membraan-oppervlak/inhoud als een prokaryoot een
factor 10 in omvang toe zou nemen?
2
6.
Compensatie klein oppervlak
Een groter wordende cel krijgt verhoudingsgewijs een te klein membraanoppervlak. Hoe
kan een cel deze beperkingen compenseren?
Plaats van eiwitsynthese
7.
Naam en plaats dogma
Het algemene dogma is: DNA RNA eiwit.
A. waar in de cel vindt de eerste stap plaats?
B. Hoe heet dit proces van DNA RNA?
C. Waar in de cel vindt de tweede stap plaats?
D. Hoe heet dit proces van RNA eiwit?
8.
Opbouw ribosoom
Waaruit is een ribosoom opgebouwd?
9.
Plaats van synthese
De componenten die betrokken zijn bij de synthese van eiwitten worden op verschillende
plaatsen in de cel gesynthetiseerd. Geef aan waar de volgende de molecuulcomplexen
gesynthetiseerd/samengesteld worden.
DNA
tRNA
mRNA
RNA processing eiwitten
RNA-polymerase
ribosomale subeenheden
ribosomale eiwitten
3
10. Vlek in kern
Op deze half schematische/half EM-foto is de
kern van een eukaryotische cel te zien. De
ribosomale subeenheden worden in een
speciaal gedeelte van de kern
gesynthetiseerd.
Hoe heet dit gedeelte?
11. Kern import en export
Geef aan of onderstaande stoffen door de kern worden geïmporteerd of geëxporteerd.
DNA
RRNA
tRNA
mRNA
RNA-polymerase
ribosomale eiwitten
ribosomale subeenheden
RNA processing eiwitten
eiwitten < 40.000 Dalton
12. Stappen in eiwitsynthese
Het ribosoom begint met het aflezen aan de 5’-zijde van het messenger RNA.
A. Welk uiteinde van het eiwit wordt het eerst gesynthetiseerd?
B. Stel dat dit eiwit bedoeld is voor het lumen van het RER. Waaraan moet het eiwit
voldoen om naar het lumen van het RER getransporteerd te worden?
C. Waaraan hecht dit?
4
D. Er moet een structuur in de membraan van het RER aanwezig zijn om dit complex te
herkennen. Welke structuur is dat?
E. Hoe heet het eiwit dat voor de transfer van eiwit naar het lumen van
het RER zorgt?
F.
Hoe ontstaat er een vrijliggend eiwit?
13. Transferpeptiden
Sommige eiwitten bevatten behalve start- ook stop-transferpeptiden. Wat zijn de
eigenschappen van stop-transferpeptiden?
14. Start- en stopsignalen
Hieronder zie je een aantal eiwitten. Geef aan hoe deze zich in het ER bevinden.
A.
B.
C.
D.
E.
F.
Hoe moet een eiwit eruit zien om op deze manier in de membraan van
het RER terecht te komen?
5
15. Translocatie
Op welke manier vindt translocatie van eiwitten naar het lumen van het RER plaats?
ER, Golgi-apparaat en lysosoom
16. Transport tussen compartimenten
In nevenstaande figuur worden de
transportmogelijkheden tussen de verschillende
compartimenten weergegeven. Geef aan waar
vesiculair transport plaatsvindt tussen de
compartimenten.
17. Eigenschappen SER en RER
Geef aan of de volgende structuren of processen in het RER of SER te vinden
zijn/plaatsvinden.
koraalachtg labyrinth
plaatvormige cisternen
bezet met ribosomen
synthese steroïd hormonen
synthese lysosomale enzymen
opslag calcium-ionen
detoxificatie
6
18. EM-foto ER
Dit is een EM-foto/schematische tekening. Wijs aan: RER, mitochondrium, SER, cytosol,
overgang van SER naar RER.
19. Plaats functies in Golgi
In de EM-foto zie je een gedeelte van een cel met het Golgi-systeem.
Waar liggen: ER,
transportblaasjes, trans-Golginetwerk, secretie-blaasjes.
Waar vinden de volgende functies plaats:
mortering van gemodificeerde eiwitten
modificatie van suikergroepen
opslag van de eindproducten van het
Golgi-systeem
eiwitsynthese
transport van halffabrikaten
aanhechten van mannose aan
lysosomale eiwitten
7
20. Oriëntatie van suikergroepen
Membraan-glycoproteïnen worden via blaasjes getransporteerd van het
ER via het Golgi-apparaat naar de celmembraan.
A. Teken de oriëntatie van de suikergroep in het blaasje.
B. Uiteindelijk worden de membraan-glycoproteïnen ingebouwd in de
celmambraan. Teken de oriëntatie van de suikergroep in de
celmembraan.
21. Route eiwitsynthese
Men is in staat om eiwitten radioactief te labelen, door één van de
aminozuren te labelen. Met deze methode kan men soms eiwitten volgen in de cel.
Je gebruikt deze methode voor het volgen van een secetie-eiwit in pancreascellen. Je
voegt radioactief gelabeld methionine toe, dat nu in nieuwe eiwitten wordt ingebouwd.
Na een half uur voeg je een overmaat aan niet-radio-actief methionine toe. Nu kun je het
radioactieve eiwit volgen.
A. In welke organellen zie je het eerst gelabeld eiwit?
B. In welke organellen zie je ze daarna verschijnen?
C. In welke organellen komt het eiwit uiteindelijk terecht?
22. Afbraak in lysosoom
De enzymen in het lysosoom kunnen bijna alle macromoleculen afbreken. Wat voor type
enzymen zijn werkzaam in het lysosoom?
23. Afbraak buiten lysosoom
Als een lysosoom kapot gaat, komen de enzymen vrij in het cytosol. Het blijkt dat deze
enzymen hun werking dan vrijwel hebben verloren en niet veel schade aanrichten. Hoe
komt dit?
24. Synthese lysosomale enzymen
De hydrolytische enzymen in het lysosoom worden elders gesynthetiseerd.
A. In welke organellen worden ze gesynthetiseerd?
B. In welke organellen worden ze geglycolyseerd?
C. In welke organellen worden ze gemodificeerd?
8
25. Sortering lysosomale enzymen
Van het Golgi-apparaat snoeren blaasjes af met hydrolytische enzymen voor de
lysosomen. Hiervoor moeten deze enzymen van de andere eiwitten in het Golgi-apparaat
worden gescheiden. Hoe vindt sortering plaats van lysosomale enzymen in het Golgiapparaat?
Enzymen
26. Reactie-energie
Dit is een grafiek van de omzetting van substraat in eindproducten.
A. Geef aan wat in deze grafiek de activatie-energie
EA is.
B. Geef in deze grafiek aan wat ∆G is.
C. Teken in de grafiek hoe de lijn zal lopen in
aanwezigheid van een enzym dat de activatieenergie halveert.
D. Verandert ∆G door een enzym?
E. Geef aan wat in deze grafiek de activatie-energie
EA is in aanwezigheid van een enzym.
F.
Welke term beschrijft het beste deze reactie?
27. Activiteit enzym
Hier zie je een enzym (sucrase) met zijn substraat (sucrose).
Eerst bindt het enym aan het substraat, vervolgens bindt een watermolecuul aan het
complex. Het enzym verandert van vorm zodat de verbinding tussen de twee delen van
het sucrose-molecuul wordt verbroken. Aan glucose bindt OH, aan fructose H van het
watermolecuul.
De gevormde eindproducten glucose en fructose worden weer afgegeven. Het enzym
verandert weer terug in de oorspronkelijke vorm, zodat er opnieuw een sucrose-molecuul
kan binden.
Welke twee omstandigheden veranderen de activiteit van het enzym?
9
28. Allosterie
Dit enzym heeft niet de juiste vorm om aan het substraat te binden. Behalve een
bindingssite voor het substraat is er nog een site: de allosterische site. Hieraan bindt de
activator. Dan verandert het enzym van vorm zodat het aan het substraat kan binden: het
enzym is geactiveerd.
Het geactiveerde enzym bindt aan het substraat.
In aanwezigheid van X wordt substraat A omgezet in eindproduct B. In de tabel zie je dat
de werking van M in aanwezigheid van X vijf keer zo snel is.
Met behulp van genetische technieken heeft men een aminozuur van M (valine op plek
57) vervangen door een andere. De activiteit van het enzym werd in verschillende mate
aangetast, afhankelijk van het aminozuur dat voor valine in de plaats kwam. Dit is
weergegeven in de tabel.
Nmol B/(min)(mg M)
M (onveranderd)
M (Val 57 Ser 57)
M (Val 57 Glu 57)
M (Val 57 Ala 57)
zonder X
10,3
10,5
10,2
10,1
met X
51,4
30,2
11,1
49,5
A. Waar in het enzym zit valine 57?
B. Waarom is het resultaat zo verschillend bij de substitutie door de verschillende
amninozuren?
29. Enzymremming
Hieronder staat een metabolische
route, van A tot eindproducten E, H en
I. Iedere pijl representeert een
enzymatische stap.
A. Welke enzymatische stap wordt waarschijnlijk geremd bij accumulatie van product
E?
B. En welke bij accumulatie van product H?
C. Via welk mechanisme remmen E en H de respectievelijke enzymen?
10
30. Hulpstoffen bij enzymen
Veel enzymen hebben hulpstoffen nodig voor hun katalytische activiteit. Deze stoffen
kunnen permanent gebonden zijn aan de actieve site, of losjes aan het substraat. Hoe
worden deze moleculen genoemd?
31. Competitor
Hier zie je een enzym en zijn substraat. Het enzym heeft een
competitieve inhibitor. Waar bindt deze inhibitor?
32. Multi units
Dit enzym kan per vier moleculen een complex vormen. Het blkijkt dat de enzymactiviteit
van dit enzym voor 90% te remmen veel minder inhibitor nodig is dan
voor enzymen die als losse moleculen blijven bestaan. Hoe komt dat?
11












