Dieetbehandelingsrichtlijn
Doelgroep
17
Patiënten die ondervoed zijn, of een verhoogd risico hebben op het ontwikkelen van
ondervoeding
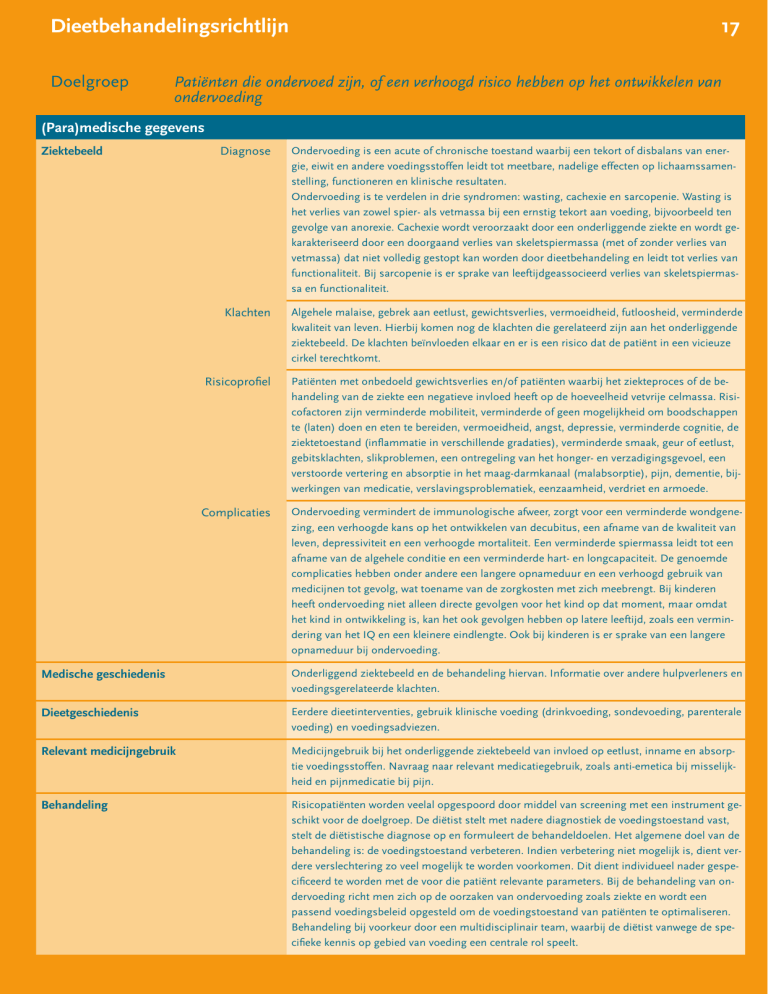
(Para)medische gegevens
Ziektebeeld
Diagnose
Ondervoeding is een acute of chronische toestand waarbij een tekort of disbalans van energie, eiwit en andere voedingsstoffen leidt tot meetbare, nadelige effecten op lichaamssamenstelling, functioneren en klinische resultaten.
Ondervoeding is te verdelen in drie syndromen: wasting, cachexie en sarcopenie. Wasting is
het verlies van zowel spier- als vetmassa bij een ernstig tekort aan voeding, bijvoorbeeld ten
gevolge van anorexie. Cachexie wordt veroorzaakt door een onderliggende ziekte en wordt gekarakteriseerd door een doorgaand verlies van skeletspiermassa (met of zonder verlies van
vetmassa) dat niet volledig gestopt kan worden door dieetbehandeling en leidt tot verlies van
functionaliteit. Bij sarcopenie is er sprake van leeftijdgeassocieerd verlies van skeletspiermassa en functionaliteit.
Klachten
Algehele malaise, gebrek aan eetlust, gewichtsverlies, vermoeidheid, futloosheid, verminderde
kwaliteit van leven. Hierbij komen nog de klachten die gerelateerd zijn aan het onderliggende
ziektebeeld. De klachten beïnvloeden elkaar en er is een risico dat de patiënt in een vicieuze
cirkel terechtkomt.
Risicoprofiel
Patiënten met onbedoeld gewichtsverlies en/of patiënten waarbij het ziekteproces of de behandeling van de ziekte een negatieve invloed heeft op de hoeveelheid vetvrije celmassa. Risicofactoren zijn verminderde mobiliteit, verminderde of geen mogelijkheid om boodschappen
te (laten) doen en eten te bereiden, vermoeidheid, angst, depressie, verminderde cognitie, de
ziektetoestand (inflammatie in verschillende gradaties), verminderde smaak, geur of eetlust,
gebitsklachten, slikproblemen, een ontregeling van het honger- en verzadigingsgevoel, een
verstoorde vertering en absorptie in het maag-darmkanaal (malabsorptie), pijn, dementie, bijwerkingen van medicatie, verslavingsproblematiek, eenzaamheid, verdriet en armoede.
Complicaties
Ondervoeding vermindert de immunologische afweer, zorgt voor een verminderde wondgenezing, een verhoogde kans op het ontwikkelen van decubitus, een afname van de kwaliteit van
leven, depressiviteit en een verhoogde mortaliteit. Een verminderde spiermassa leidt tot een
afname van de algehele conditie en een verminderde hart- en longcapaciteit. De genoemde
complicaties hebben onder andere een langere opnameduur en een verhoogd gebruik van
medicijnen tot gevolg, wat toename van de zorgkosten met zich meebrengt. Bij kinderen
heeft ondervoeding niet alleen directe gevolgen voor het kind op dat moment, maar omdat
het kind in ontwikkeling is, kan het ook gevolgen hebben op latere leeftijd, zoals een vermindering van het IQ en een kleinere eindlengte. Ook bij kinderen is er sprake van een langere
opnameduur bij ondervoeding.
Medische geschiedenis
Onderliggend ziektebeeld en de behandeling hiervan. Informatie over andere hulpverleners en
voedingsgerelateerde klachten.
Dieetgeschiedenis
Eerdere dieetinterventies, gebruik klinische voeding (drinkvoeding, sondevoeding, parenterale
voeding) en voedingsadviezen.
Relevant medicijngebruik
Medicijngebruik bij het onderliggende ziektebeeld van invloed op eetlust, inname en absorptie voedingsstoffen. Navraag naar relevant medicatiegebruik, zoals anti-emetica bij misselijkheid en pijnmedicatie bij pijn.
Behandeling
Risicopatiënten worden veelal opgespoord door middel van screening met een instrument geschikt voor de doelgroep. De diëtist stelt met nadere diagnostiek de voedingstoestand vast,
stelt de diëtistische diagnose op en formuleert de behandeldoelen. Het algemene doel van de
behandeling is: de voedingstoestand verbeteren. Indien verbetering niet mogelijk is, dient verdere verslechtering zo veel mogelijk te worden voorkomen. Dit dient individueel nader gespecificeerd te worden met de voor die patiënt relevante parameters. Bij de behandeling van ondervoeding richt men zich op de oorzaken van ondervoeding zoals ziekte en wordt een
passend voedingsbeleid opgesteld om de voedingstoestand van patiënten te optimaliseren.
Behandeling bij voorkeur door een multidisciplinair team, waarbij de diëtist vanwege de specifieke kennis op gebied van voeding een centrale rol speelt.
Diëtistische gegevens
Voedingsanamnese, voedingsmiddelen en
voedingsstoffen
Navraag van de eetlust, misselijkheid (braken), defecatie, stoma’s, fistels en wonden en gebruikelijke en huidige voedselinname. De regelmaat van het eetpatroon en de recente (ziektegerelateerde) veranderingen (aversies, slik- en kauwproblemen) en gebruik van dieetpreparaten zoals drinkvoeding en vitamine- en/of mineralensupplementen. Eventueel gebruik van
enterale en/of parenterale voeding in de voorgeschiedenis. Anamnese gericht op eventuele
deficiënties in macro- (met name eiwit) en micronutriënten.
Antropometrische gegevens
Lengte, gebruikelijk gewicht (in afgelopen 1 en 6 maanden geleden), huidig gewicht en BMI,
vetvrijemassa-index, gewicht in vetvrije massa, spierkracht (onder andere handknijpkracht) en
bovenarmomtrek.
Biochemische gegevens
Biochemische gegevens: voor deficiëntie macronutriënten zijn geen goede waarden, voor evaluatie deficiëntie micronutriënten:onder andere ferritine (in combinatie met MCV), ijzerverzadiging, Hb, 25 (OH) vitamine D, calcium, vitamine B12. Mate van inflammatie en ziekte: Bezinking, C-reactieve proteïne (CRP) en albumine. Bij refeedingsyndroom met name fosfaat en
secundair kalium en magnesium.
Gegevens over ADL, eventueel aanwezige depressiviteit en/of een (post operatief) delier.
Dagelijks eetpatroon
Het normale eetpatroon moet worden aangepast.
Emotionele beleving van het eten
Motivatie patiënt voor dieetbehandeling. Toepassen van motiverende gesprekstechnieken kan
positief bijdragen. Mate van stigmatisering van het voedingsbeleid, pijn, veranderde smaak,
misselijkheid, braken, diarree, eenzaamheid, verdriet, angst, verwarring, onbegrip beïnvloeden het eetpatroon en/of de beleving van het eten. Noodzaak gebruik van drink-, sonde en/of
parenterale voeding ten opzichte van normale voedingsmiddelen.
Externe factoren
Partner, sociale omgeving, zorgverlener, veranderde omgeving (instelling), financiële vergoeding van het voedingsbeleid hebben alle invloed op het voedingsbeleid en de beleving hiervan.
Diversen
Het toepassen van principes van motiverende gesprekstechnieken, waarop de begeleiding
van ondervoede patiënten door de diëtist is gebaseerd, draagt bij aan het voorbereiden van
patiënten met ondervoeding op veranderingen in het eetpatroon en het vertrouwen dat het
gaat lukken veranderingen door te voeren.
Diëtistische diagnose
De diëtistische diagnose wordt gevormd op basis van het gezondheidsprobleem zoals de patiënt dat ervaart, de medische factoren (onder andere de diagnostische uitkomsten, prognose, klachten), de sociale factoren (woon- leef- en arbeidsomstandigheden) en persoonlijke
factoren (voedings- en bewegingsgewoonten, taalbeheersing, motivatie, ziekte-inzicht). Op
basis van de diëtistische diagnose kunnen, multidisciplinair en in zorgvuldige afstemming
met de patiënt, de doelen van de behandeling worden vastgesteld en kan de voedingsbehandeling verder worden uitgewerkt.
Dieetbehandelplan
Doel
Toename van de voedingsinname van de patiënt naar 100% van de vastgestelde eiwit- en
energiebehoefte en optimalisering micronutriëntenstatus. Naast een optimale voedingsinname is beweging een essentieel onderdeel van de behandeling om de spiermassa te optimaliseren. Vanwege de complexiteit is de behandeling multidisciplinair.
Kenmerken
Volwassenen:
Energie: volgens behoefte (gemeten of berekend met de Harris & Benedict-formule + 30%
of met de FAO/WHO/UNU-formule + 30%).
Eiwit: bij ziekte 1,2 – 1,5 gram eiwit/kg (bij BMI > 27 terugrekenen naar BMI = 27) met uitzondering van aangepaste behoefte bij lever- en nierziekten.
Vitaminen en mineralen: alle volgens 100% ADH tenzij er bewezen deficiënties of verhoogde behoeften zijn.
Vocht 1,5 liter + verliezen.
Let op specifieke nutriënten die van belang zijn bij het betreffende ziektebeeld.
Refeedingsyndroom: evalueren risico en adequaat behandelen.
••
••
••
••
••
••
Kinderen:
Voor de berekening van de energiebehoefte wordt uitgegaan van energiebehoefte = rustenergieverbruik (REE) + toeslagen, waarbij REE berekend kan worden met behulp van de
Schofield (H+W)-formule (Schofield 1985) of REE gemeten met behulp van indirecte calorimetrie + toeslagen.
Eiwit: Bij kinderen jonger dan 1 jaar wordt de eiwitbehoefte gebaseerd op de (berekende)
energiebehoefte. De WHO-aanbevelingen voor eiwit gelden: voor acuut ondervoede kinderen
is een energiepercentage van 9 – 11,5% eiwit adequaat en bij chronisch ondervoede kinderen
een energiepercentage van 11 – 15% eiwit. Voor kinderen ouder dan 1 jaar geldt dezelfde aanbeveling als voor volwassenen: 1,2 – 1,5 gram eiwit per kg lichaamsgewicht per dag.
Vitaminen en mineralen: volgens 100% ADH. Suppletie van 10 mcg vitamine D per dag bij
kinderen onder de 4 jaar.
••
••
••
Inhoud
Zorgniveau 2.
Nadat bij een patiënt ondervoeding is gesignaleerd (bijvoorbeeld via screening), dient binnen
1 werkdag de ondervoede patiënt naar de diëtist te worden verwezen voor het maken van een
behandelplan dat binnen 2 werkdagen toegepast moet worden.
Eerste consult
Mondeling:
Op basis van de uitkomsten van het risicoprofiel en de diagnostische bepalingen formuleert
de diëtist samen met de patiënt de algemene hulpvraag en welke risicofactor(en) het belangrijkste is/zijn om het eerst aan te pakken. Het behandelplan kan uitgewerkt worden in een actieplan zoals beschreven in bijlage 3. De patiënt dient uitleg te krijgen over:
Ondervoeding in relatie tot het ziektebeeld (katabolie, verminderde voedingsinname, verhoogde energie- en eiwitbehoefte, verliezen van voedingsstoffen).
De analyse van de voedingsinname ten opzichte van de behoefte.
Het te volgen voedingsbeleid en het verloop van de voedingsbehandeling.
Mogelijkheden om de voedingstoestand te verbeteren (eiwitinname, energie-inname, lichamelijke activiteit).
De uitwerking van het eerste consult heeft de volgende onderdelen:
Formuleer de diëtistische diagnose; geef een analyse en interpretatie van gegevens uit het
diëtistisch onderzoek in termen van gezondheidsproblemen, functioneren met achterliggende medische factoren, externe factoren en persoonlijke factoren.
Bereken de voedingsinname en de energie- en eiwitbehoefte.
Formuleer behandeldoelen en eindpunten op het gebied van effect van dieetbehandeling,
benodigde kennis, houding en vaardigheden (eventueel naar aanleiding van het actieplan).
Formuleer een dieetbehandelplan, een weegbeleid en andere multidisciplinaire afspraken.
Bepaal de termijn van evaluatie naar aanleiding van de ernst van de toestand zoals uitgewerkt in tabel 2.
Rapporteer aan de (huis)arts of specialist, in ieder geval na het eerste consult en na het
laatste consult.
••
••
••
••
••
••
••
••
••
••
Vervolgconsulten
Laatste consult/follow-up
Vervolgconsulten bestaan uit de volgende onderdelen:
Evaluatie punten die passen bij het de behandeldoelen.
Bespreking van eventuele problemen met het voedingsbeleid.
Verzamelen van nieuwe medische, sociale, fysieke en psychische gegevens.
Indien nodig dieetbehandelplan aanpassen. Nadere uitleg.
Motiveren van de patiënt.
Begeleiden van de patiënt met de gedragsverandering.
Indien nodig: overleg met andere betrokkene hulpverleners (arts, verpleegkundige, fysiotherapeut, apotheker, maatschappelijk werk).
••
••
••
••
••
••
••
••
De behandeling wordt afgesloten als de behandeldoelstelling(en) is (zijn) gehaald, de voedingstoestand is hersteld, de voedingsinname is genormaliseerd of het gebruik van klinische
voedingsproducten gestopt kan worden.
Afspraken maken voor monitoren van voedingstoestand.
Afspraken maken over wanneer de behandeling hervat moet worden.
Adviezen geven om voedingstoestand te behouden/verbeteren.
••
••
••
Methodieken en materialen
Geraadpleegde literatuur
Op www.stuurgroepondervoeding.nl zijn veel materialen te vinden die gebruikt kunnen worden in de voorlichting aan de patiënt en andere hulpverleners.
••
Zie literatuurlijst en de relevante websites.
Datum richtlijn: mei 2012, evaluatie in principe binnen vijf jaar.
Ondervoeding*
(Para)medische gegevens
Ziektebeeld
Definitie en prevalentie
Ondervoeding is een acute of chronische toestand waarbij een tekort of disbalans van
energie, eiwit en andere voedingsstoffen leidt tot meetbare, nadelige effecten op lichaamssamenstelling, functioneren en klinische resultaten (Soeters et al. 2008, Stratton et al. 2003). Het probleem van aan ziekte gerelateerde ondervoeding is al jaren internationaal bekend en de prevalentie wordt in Nederland sinds 2004 elk jaar gemeten
als onderdeel van de Landelijke Prevalentiemeting Zorgproblemen (LPZ, figuur 1). De
prevalentie van matige en ernstige ondervoeding is in alle sectoren van de Nederlandse
gezondheidszorg hoog. Gemiddeld is één op de vier tot vijf patiënten1 in ziekenhuizen,
zorginstellingen en de thuiszorg ernstig ondervoed (Kruizenga et al. 2003, Halfens et al.
2011). Risicogroepen voor ondervoeding zijn kwetsbare ouderen, chronisch zieken, oncologische patiënten, patiënten die een grote operatie (hebben) ondergaan en patiënten
met een ernstig trauma (Mensink et al., Van Asselt et al. 2010, CBO 2007).
Figuur 1 Prevalentie ondervoeding in Nederland 2004-2011, LPZ (AlgZ = Algemene ziekenhuizen,
WZW = Woon Zorg Welzijn instellingen) (Halfens et al. 2011)
Over de prevalentie van ondervoeding bij kinderen is minder bekend. Uit een Nederlandse screening uit 2010 bleek dat in de Nederlandse ziekenhuizen één op de vijf kinderen ondervoed is (Joosten et al. 2010).
* Dit protocol is geschreven door mevrouw C. Jonkers-Schuitema, diëtist voedingsteam AMC, Amsterdam, mevr. Mariël Klos, voedingsverpleegkundige Gelre ziekenhuizen, Apeldoorn, mevrouw drs. K. Kouwenoord-van Rixel, diëtist
Zorgbalans, Velserduin, mevrouw dr. ir. H.M. Kruizenga, projectleider Stuurgroep Ondervoeding en diëtist VUmc,
Amsterdam en mevrouw W. Remijnse-Meester, beleidsadviseur Nederlandse Vereniging van Diëtisten, Houten.
1 In deze dieetbehandelingsrichtlijn spreken we van patiënten aangezien ondervoeding meestal aan ziekte gerelateerd is.
Dir 33/47
DIRAV33.indb 1
Ondervoeding
1
05-07-12 14:28
Criteria ondervoeding
Aangezien ondervoeding een complex geheel is en gerelateerd is aan andere factoren,
zoals ziekte-intensiteit, ziekteaard en leeftijd, is het nog niet gelukt om internationaal
consensus te bereiken over een gouden standaard voor ondervoeding. De onderstaande
criteria worden (inter)nationaal het meest toegepast en zijn te gebruiken als algemene
criteria voor ondervoeding.
Ondervoeding bij volwassenen
Bij volwassenen (≥ 18 jaar) wordt gesproken van ondervoeding wanneer er sprake is van
onbedoeld gewichtsverlies van meer dan 10% in de laatste 6 maanden of meer dan 5%
in de laatste maand. Verder is er ook sprake van ondervoeding bij een Body Mass Index
(BMI (gewicht/lengte2)) van lager dan 18,5 kg/m2 (CBO 2007).
Ondervoeding bij ouderen
Ouderen (> 65 jaar) zijn ondervoed wanneer er sprake is van onbedoeld gewichtsverlies
van meer dan 10% in de laatste 6 maanden of meer dan 5% in de laatste maand en/of
een BMI van < 20 kg/m2 (Sergi et al. 2005, Omran & Morley 2000, Volkert et al. 2006,
Beck & Ovesen 1998).
Ondervoeding bij kinderen
Omdat kinderen in de groei zijn, wordt gebruikgemaakt van groeicurves (lengte/leeftijd,
gewicht/leeftijd en/of gewicht/lengte) om ondervoeding vast te stellen. Er wordt onderscheid gemaakt tussen acute en chronische ondervoeding en verschillende leeftijdscategorieën (Joosten & Hulst 2011).
Acute ondervoeding:
–– kinderen > 2 dagen en < 1 jaar: < -2 standaarddeviatie (SD) voor gewicht/leeftijd;
–– kinderen > 1 jaar: < -2 SD voor gewicht/lengte;
–– alle kinderen: > 1 SD afbuiging op gewicht/ leeftijd of gewicht/ lengte in de afgelopen 3 maanden.
Chronische ondervoeding:
–– alle kinderen: < -2 SD voor lengte/leeftijd;
–– kinderen < 4 jaar: 0,5 – 1 SD afbuiging in afgelopen jaar voor lengte/leeftijd;
–– kinderen ≥ 4 jaar: 0,25 SD afbuiging in afgelopen jaar voor lengte/leeftijd.
Risicoprofiel/oorzaken
De oorzaken van ondervoeding zijn in te delen in fysieke, psychische, medische en sociale factoren. Voorbeelden van fysieke factoren zijn een verminderde mobiliteit, verminderde of geen mogelijkheid om boodschappen te (laten) doen en eten te bereiden en
vermoeidheid. Psychische factoren zijn angst, depressie en verminderde cognitie. Medische factoren zijn de ziektetoestand (inflammatie in verschillende gradaties), verminderde smaak, geur, en eetlust, gebitsklachten, slikproblemen, een ontregeling van het
honger- en verzadigingsgevoel, een verstoorde vertering en absorptie in het maagdarmkanaal, pijn, dementie, bijwerkingen van medicatie en verslavingsproblematiek.
Sociale factoren zijn eenzaamheid, verdriet en armoede. Op grond van de oorzaak van
ondervoeding is een onderscheid te maken tussen cachexie, sarcopenie en wasting
(Halfens et al. 2011, Morley 1997, Jensen et al. 2009).
2
DIRAV33.indb 2
Ondervoeding
Dir 33/48
05-07-12 14:28
Ondervoedingssyndromen
Er wordt in de definiëring van ondervoeding onderscheid gemaakt tussen drie verschillende syndromen waarbij ondervoeding een rol speelt: wasting, cachexie en sarcopenie.
Wasting is het verlies van zowel spier- als vetmassa bij een ernstig tekort aan voeding,
bijvoorbeeld ten gevolge van anorexie. Hieronder valt anorexia nervosa maar ook bijvoorbeeld het gewichtsverlies door verwaarlozing of eenzaamheid. Bij wasting (ook wel
starvation genoemd) gaat de negatieve voedingsbalans eerst met name ten koste van
de vetreserves en pas in een later stadium ook ten koste van de spiermassa (Soeters et
al. 2008).
Bij cachexie is er sprake van een multifactorieel syndroom dat wordt veroorzaakt door de
onderliggende ziekte (zoals kanker, COPD, reuma, hartfalen), waarbij inflammatie, metabole veranderingen en verminderde energie- en eiwitinname op de voorgrond staan.
Cachexie wordt gekarakteriseerd door een doorgaand verlies van skeletspiermassa (met
of zonder verlies van vetmassa) dat niet volledig gestopt kan worden door dieetbehandeling en leidt tot verlies van functionaliteit (Fearon et al. 2011).
Bij sarcopenie is er sprake van leeftijdgeassocieerd verlies van skeletspiermassa en functionaliteit. Het is eveneens een complex multifactorieel syndroom, maar sarcopenie
wordt veroorzaakt door veranderde anabole hormoonspiegels (onder andere testosteron, oestrogenen, groeihormoon), verminderde energie- en eiwitinname, verminderde
lichamelijke activiteit, chronische ziekte, inflammatie en insulineresistentie (Fielding et
al. 2011, Muscaritoli 2010). Sarcopenie kan gemaskeerd worden door een gelijkblijvend
gewicht. Een aan ondervoeding gerelateerde term is ‘frailty’. Dit is een toestand van
leeftijdgerelateerde fysiologische kwetsbaarheid die voortkomt uit een verstoorde homeostatische reserve en een verminderd vermogen om weerstand te bieden aan belasting. Er is sprake van frailty als drie van de volgende vijf verschijnselen aanwezig zijn:
gewichtsverlies, uitputting, lichamelijke inactiviteit, lage loopsnelheid en lage handknijpkracht (Fried et al. 2001).
In de praktijk zijn deze syndromen waarbij ondervoeding een rol speelt moeilijk van elkaar te onderscheiden. Zo zullen de verschillende vormen vaak met elkaar samengaan,
dan wel in elkaar overvloeien. De indeling is niet altijd passend. Een voorbeeld hiervan
zijn ondervoede patiënten die herstellen van een grote operatie waarbij geen cachexie,
maar wel inflammatie aanwezig is. Het onderscheid en de overlap tussen cachexie, sarcopenie en wasting zijn inzichtelijk gemaakt in tabel 1.
Tabel 1 Karakteristieken van cachexie, sarcopenie en wasting (Fearon 2011, Fielding
2011, Muscaritoli 2010, Roubenoff et al. 1997)
Dir 33/49
DIRAV33.indb 3
Cachexie
Sarcopenie
Wasting
Verminderde
skelet­spiermassa
Ja
Skeletspiermassa index
< 7,26 kg/m2 voor
mannen en < 5,45 kg/m2
voor vrouwen
Ja
Skeletspiermassa index
< 7,26 kg/m2 voor
mannen en < 5,45 kg/m2
voor vrouwen
Skeletspiermassa niet
gedefinieerd.
BMI-criterium: BMI
< 18,5 kg/m2
> 65 jaar: BMI < 20 kg/m2
Gewichtsverlies
> 5% in de laatste
6 maanden of > 2% in
combinatie met BMI
< 20 kg/m2
Niet altijd
> 5% in de laatste maand
of > 10% in de laatste
6 maanden
Verminderde
energie-inname
Ja
Niet altijd
Ja
Verhoogd basaal
basaal­
metabolisme
Ja
Niet altijd
Niet altijd
Ondervoeding
3
05-07-12 14:28
Cachexie
Sarcopenie
Wasting
Verminderde
functionaliteit
Ja
Ja
Ja
Inflammatie
Ja
Niet altijd
Niet altijd
Verminderde
immuunstatus
Ja
Niet altijd
Niet altijd
Verhoogde
mortaliteit
Ja
Ja
Ja
Behandeling
Adequate voeding
Beweging
Anticytokinemiddelen en
anabole hormonen
Adequate voeding
Krachttraining
Beweging
Adequate voeding
Beweging
Complicaties/gevolgen
Ondervoeding heeft ernstige gevolgen voor de totale gezondheidstoestand van de pa­
tiënt. In, veelal associatieve studies is aangetoond dat het leidt tot onder meer een langzamer herstel, meer en ernstiger complicaties. Bij ziekte en inactiviteit leidt het tot een
verminderde spiermassa met als gevolg een afname van de algehele conditie en een
verminderde hart- en longcapaciteit. Ondervoeding vermindert de immunologische afweer, zorgt voor een verminderde wondgenezing, een verhoogde kans op het ontwikkelen van decubitus, een afname van de kwaliteit van leven, depressiviteit en een verhoogde mortaliteit (Elia et al. 2005, Correia & Waitzberg 2003, Kyle et al. 2005, Kyle et al.
2005, Banks et al. 2010, Stechmiller 2010). De genoemde complicaties van ondervoeding hebben onder andere een langere opnameduur en een verhoogd gebruik van medicijnen tot gevolg, wat toename van de zorgkosten met zich meebrengt (Elia 2009, Nijs
et al. 2009, Norman et al. 2008). Bij kinderen heeft ondervoeding niet alleen directe gevolgen voor het kind op dat moment, maar omdat het kind in ontwikkeling is, kan het
ook gevolgen hebben op latere leeftijd, zoals een vermindering van het IQ en een kleinere eindlengte (Black et al. 2007, Corbett et al. 2007). Recent onderzoek in Nederlandse ziekenhuizen heeft aangetoond dat kinderen die bij opname ondervoed zijn significant langer in het ziekenhuis liggen (Joosten et al. 2010).
Figuur 2 De gevolgen van ondervoeding
4
DIRAV33.indb 4
Ondervoeding
Dir 33/50
05-07-12 14:28
De effectiviteit van vroege herkenning en behandeling van ondervoeding
In diverse studies naar de effecten van screenen en vroeg behandelen van ondervoeding
wordt een afname in opnameduur en complicaties als infecties en decubitus geconstateerd. Vroege herkenning en behandeling van ondervoeding in het ziekenhuis blijkt kosteneffectief. Door te screenen op ondervoeding in ziekenhuizen verbetert de herkenning
van ondervoeding van 50% naar 80% en wordt de behandeling eerder gestart (Kruizenga et al. 2005). Voor de andere zorgsectoren zijn hierover nog geen getallen beschikbaar. Tijdige behandeling van (dreigende) ondervoeding leidt tot verbetering van de
voedingsinname, stabilisatie van het gewicht of gewichtstoename, een verbetering van
de voedingstoestand en functionele uitkomstparameters zoals spierkracht en kwaliteit
van leven (fysiek, emotioneel en mentaal) en vermindering van het aantal complicaties,
opnameduur en mortaliteit (Elia et al. 2005, Correia & Waitzberg 2003, Kyle et al. 2005a,
Kyle et al. 2005b, Kruizenga et al. 2005, Rypkema et al. 2004, Perry & McLaren 2003).
Figuur 3 Het belang van vroege herkenning en behandeling van ondervoeding
Vroege herkenning en behandeling van ondervoeding is essentieel. Opsporing en interventie in de thuissituatie, vroeg in het ziekteproces, kan ervoor zorgen dat de ernst van
de ondervoeding beperkt blijft en de zorgcomplexiteit en zorgbehoefte daalt. In figuur 3
is dit schematisch weergegeven. De donkere pijl geeft een mogelijke ontwikkeling van
de voedingstoestand weer zonder screening. De ondervoeding wordt laat herkend en
behandeld en de patiënt wordt in een slechte voedingstoestand opgenomen in het ziekenhuis. De lichte pijl laat de wenselijke situatie zien waarin de patiënt in de thuissituatie is gescreend in de huisartspraktijk of door de thuiszorg. Bij deze patiënt blijft de
voedingstoestand op een beter niveau en worden veel problemen voorkomen. Ook laat
deze figuur zien dat achteruitgang van de voedingstoestand soms onvermijdelijk is
door ziekte maar dat interventie verdere achteruitgang voorkomt en sneller herstel indiceert.
Medische geschiedenis – screening op ondervoeding en risicogroepen
Een eerste stap om ondervoeding aan te pakken is elke patiënt bij ziekte te screenen op
ondervoeding en zo nodig een behandelplan op te stellen. De afgelopen jaren zijn verschillende screeningsinstrumenten ontwikkeld en geïmplementeerd.
Dir 33/51
DIRAV33.indb 5
Ondervoeding
5
05-07-12 14:28
Screenen in de eerstelijnszorg en thuiszorg
Risicogroepen in de huisartspraktijk zijn kwetsbare ouderen thuis, in een verzorgingshuis of woonzorgcentrum; patiënten die meerdere ziekten hebben, chronisch ziek zijn
of veel medicatie gebruiken; patiënten met lichamelijke beperkingen; patiënten met een
niet-passende gebitsprothese, kauw- of slikproblemen; patiënten (met name oudere en
ernstig zieke) die recent ontslagen zijn uit het ziekenhuis; patiënten met psychosociale
problemen en verwaarlozing; patiënten met alcohol- of drugsmisbruik. Van de ziekten
zijn met name van belang: COPD, CVA, decubitus, dementie, depressie, hartfalen, inflammatoire darmziekten, kanker en reumatoïde artritis (Mensink et al. 2010). Een verminderde eetlust en functionaliteit (het niet meer de trap kunnen opklimmen) blijken
onafhankelijke voorspellers van de ontwikkeling van ondervoeding te zijn (Schilp et al.
2011).
Alle patiënten die een vorm van thuiszorg krijgen behoren tot de risicogroep. Screenen
op ondervoeding dient onderdeel te zijn van de verpleegkundige anamnese bij de start
van de zorg en de evaluatie van de zorg (eens per half jaar) (Zichtbare Zorg verpleging
2010).
Voor de eerstelijnszorg en thuiszorg kan ondervoeding bij ouderen (> 65 jaar) gesignaleerd worden met behulp van de SNAQ65+ (Short Nutritional Assessment Questionnaire
for 65+) (Wijnhoven et al. 2011) en bij volwassenen (18 – 65 jaar) met behulp van het
berekenen van de BMI en het percentage onbedoeld gewichtsverlies.
Screenen op de polikliniek
Voor het screenen van volwassenen (≥ 18 jaar) op de polikliniek wordt aangeraden gebruik te maken van de criteria voor ondervoeding op basis van BMI en percentage onbedoeld gewichtsverlies (zie ‘Criteria ondervoeding) of van de combinatie van SNAQ en
BMI. Uit nog niet gepubliceerd onderzoek is gebleken dat zowel de SNAQ als de MUST
(Malnutrition Universal Screening Tool) niet bruikbaar zijn voor de poliklinische populatie. De MUST heeft een te lage voorspellende waarde (43%) en wijst daarmee ten onrechte veel patiënten als ondervoed aan. De SNAQ heeft een te lage sensitiviteit (43%)
en herkent daardoor veel ondervoede patiënten niet. Dit komt doordat poliklinisch veel
patiënten ondervoed zijn door een lage BMI met daarbij geen recent gewichtsverlies terwijl de SNAQ-score met name wordt bepaald door de aanwezigheid van onbedoeld gewichtsverlies (Van Venrooij et al. 2011, Leistra et al. 2009). In eerder onderzoek is wel
gebleken dat de vragen van de SNAQ de best voorspellende vragen voor ondervoeding
zijn (Neelemaat et al. 2008).
Als er op de polikliniek gebruikgemaakt wordt van een elektronisch patiëntendossier
heeft het de voorkeur om daarin de criteria voor ondervoeding op te nemen zoals beschreven in deze richtlijn. Wordt er niet elektronisch gewerkt, dan kan vanuit praktisch
oogpunt de combinatie van de SNAQ met BMI (sensitiviteit: 95%) gekozen worden
(eventueel met een BMI-draaischijf, zodat er niet gerekend hoeft te worden). Op basis
van de afkappunten van de BMI kunnen de volgende punten opgeteld worden bij de
SNAQ-score:
Patiënten ≤ 65 jaar:
BMI < 18,5 kg/m2
BMI 18,5 – 20 kg/m2
3 punten
2 punten
Patiënten > 65 jaar:
BMI < 20 kg/m2
BMI 20 – 22 kg/m2
3 punten 2 punten
Voor specifieke ouderenpoliklinieken kan gebruikgemaakt worden van de SNAQ65+, de
MNA (Mini Nutritional Assessment) en de MNA short form (MNA-SF) (Van Asselt et
al. 2010, Schilp et al. 2011).
6
DIRAV33.indb 6
Ondervoeding
Dir 33/52
05-07-12 14:28
Screening in het ziekenhuis
Voor screening van volwassen patiënten (≥ 18 jaar) in het ziekenhuis zijn verschillende
screeningsinstrumenten beschikbaar. Het in de Nederlandse ziekenhuizen meest gebruikte screeningsinstrument is de SNAQ (Short Nutritional Assessment Questionnaire) (Kruizenga et al. 2005). De SNAQ is een valide ‘quick-and-easy’ screeningsinstrument en bestaat uit drie vragen. Een meer diagnostisch screeningsinstrument is de
MUST (Malnutrition Universal Screening Tool, www.bapen.org.uk). Voor dit screeningsinstrument worden bij elke patiënt de BMI (Body Mass Index) en het percentage gewichtsverlies berekend en wordt de patiënt een ziektefactor toegekend.
Screenen in verpleeg- en verzorgingshuizen
Voor screening op ondervoeding in verpleeg- en verzorgingshuizen is de SNAQRC (Short
Nutritional Assessment Questionnaire for Residential Care) (Kruizenga et al. 2010) beschikbaar. Dit screeningsinstrument werkt met een stoplichtscore; met behulp van drie
vragen en het meten van de BMI kan bepaald worden of een patiënt goed gevoed
(groen), matig ondervoed (oranje) of ernstig ondervoed (rood) is.
Screenen bij kinderen
Kinderen worden gescreend door middel van het meten van gewicht en lengte en het
beoordelen van de ingevulde groeicurven. Daarnaast wordt in de ziekenhuizen de
STRONGkids (Screening Tool Risk On Nutritional Status and Growth) (Hulst et al. 2010)
gebruikt. Dit is een vragenlijst die risico op het ontwikkelen van ondervoeding gedurende de ziekenhuisopname in kaart brengt.
Van screeningsuitslag naar behandelplan
Op basis van de screeningsuitslag of (protocollaire) verwijzing treedt het multidisciplinaire behandelplan in werking:
–– Bij een score ‘geen ondervoeding’ hoeft er geen dieetbehandeling te worden gestart.
–– Bij een score ‘matige ondervoed’ of score ‘risico op ondervoeding’ (SNAQ65+) krijgt
de patiënt globale mondelinge en schriftelijke informatie over energie- en eiwitrijke
hoofdmaaltijden en tussentijdse verstrekkingen en het advies om zich regelmatig te
wegen.
–– Bij een score ‘ernstig ondervoed’ schakelt de arts of verpleegkundige de diëtist in.
Dieetgeschiedenis
Ondervoede patiënten met een chronische aandoening zijn vaak eerder behandeld door
een diëtist voor ziektegerelateerde voedingsadviezen. Relevante gegevens die een diëtist bij aanvang van de behandeling dient te verzamelen staan in het transmurale overdrachtsformulier, ontwikkeld door de DON (netwerk Diëtisten Ondervoeding Nederland) in 2011.
Tabel 2 Transmuraal overdrachtsformulier ondervoeding
Algemene gegevens
Dir 33/53
DIRAV33.indb 7
Ondervoeding
7
05-07-12 14:28
Cliëntgegevens
Behandelaars
Medische gegevens
Cliëntgegevens (indien beveiligde lijn)
••
••
••
naam diëtist
naam behandelend arts
naam verpleegkundige
Medische diagnose, informatie over onder andere hulpverleners,
voedingsgerelateerde klachten, medicatie (voor zover relevant)
Diagnostisch onderzoek
Voedingstoestand
voedingsinname versus
-behoefte
••
••
••
••
••
••
••
••
••
uitslag van screening
huidig gewicht, lengte, gebruikelijk gewicht
gewichtsverloop (in afgelopen 1 en 6 maanden, opname/ontslag,
eerste/laatste polibezoek)
BMI en/of bovenarmomtrek
vetvrijemassa-index en/of de bovenarmspieromtrek
Conclusie: ernstige, matige of risico op ondervoeding
inname en behoefte eiwit en energie
inname en behoefte overige relevante (micro)nutriënten
oorzaken verminderde eetlust, verminderde absorptie en/of
verhoogde behoefte
Diëtistische diagnose
Hulpvraag, probleemdefinitie, psychosociale omstandigheden, fase van
gedragsverandering, beweging
Doelstelling behandeling
Doelen
••
••
lange termijn
korte termijn
Behandelplan
Dieetadvies
Evaluatie
Vervolg en reden
overdracht
••
••
••
••
••
••
••
••
••
••
wensen vanuit de cliënt
hoeveelheid energie en eiwit en andere relevante nutriënten
suppleties
consistentie
dieetvoeding voor medisch gebruik
interventies ten aanzien van andere problemen, zoals pijn,
slikklachten, misselijkheid
multidisciplinaire samenwerkingsafspraken
resultaat tot nu toe en voorstel voor evaluatie
voorstel voor follow-up inclusief gewenste termijn
taakverdeling transmuraal
Overig
Opmerkingen/
bijzonderheden
8
DIRAV33.indb 8
••
••
voorbeelddagmenu meegestuurd ja/nee
aantal gebruikte dieetbehandelingsminuten
Ondervoeding
Dir 33/54
05-07-12 14:28
Relevant medicijngebruik
In de meeste gevallen is de onderliggende ziekte de oorzaak van ondervoeding. Gezien
de diversiteit van ziekten die ondervoeding kunnen veroorzaken, is er een grote diversiteit in medicatiegebruik. Navraag naar relevant medicatiegebruik, zoals anti-emetica bij
misselijkheid, en pijnmedicatie bij pijn is essentieel.
In de Landelijke richtlijn ondervoeding bij kanker (2011) van het integraal kankercentrum is de effectiviteit van medicatie in de behandeling van kankergerelateerde anorexie
en misselijkheid op een rij gezet. In deze richtlijn zijn conclusies geformuleerd over de
relatie van verschillende medicatiegroepen en voeding(stoestand) voor deze patiëntengroep (www.oncoline.nl).
Behandeling
Tijdens de behandeling van ondervoeding richt men zich op de oorzaken van ondervoeding zoals ziekte en wordt een passend voedingsbeleid opgesteld om de voedingstoestand van patiënten te optimaliseren. Evaluatie van de oorzaak en de ernst van de ondervoeding en het voedingsbeleid dient te gebeuren door professionals met kennis en
ervaring op het gebied van voedingsbehoeften, verschillende voedingsmogelijkheden,
voedingstechnieken, specifieke voedingen en dieetpreparaten, lichaamssamenstelling,
metabole regulatie van patiënten en de bij de gekozen voeding of dieetpreparaten behorende risico’s en complicaties. De diëtist heeft specifieke kennis op dit gebied en speelt
hierdoor een centrale rol in de behandeling van ondervoede patiënten. In figuur 4 staan
de meest relevante disciplines genoemd. Samenwerking van deze disciplines, elk vanuit
haar eigen expertise, zal een uitgebalanceerde medische behandeling opleveren waar de
voedingsbehandeling er een van zal zijn.
Figuur 4 Disciplines die betrokken kunnen zijn bij een ondervoede patiënt
Dir 33/55
DIRAV33.indb 9
Ondervoeding
9
05-07-12 14:28
Diëtistische gegevens
Bepalen van de voedingstoestand
Screening en diagnostiek zijn twee duidelijk te onderscheiden stappen in de herkenning
en behandeling van de ondervoede patiënt. Een screeningsinstrument is slechts bedoeld om de ondervoede patiënt op een eenvoudige manier in een vroeg stadium te
herkennen zodat er tijdig een adequate (voedings)behandeling kan worden ingezet. In
de diagnostische fase wordt de voedingstoestand pas echt in kaart gebracht. De ernst
van de ondervoeding wordt zo meetbaar en het effect van de behandeling kan worden
geëvalueerd met (de combinatie van) uitkomstmaten. De instrumenten Subjective Global Assessment (SGA) en de Patient-Generated Subjective Global Assessment (PGSGA) worden vaak omschreven als screeningsinstrumenten maar zijn diagnostisch van
aard en ook zo te gebruiken.
Voor de geriatrische groep wordt in de ‘leidraad ondervoeding bij de geriatrische pa­
tiënt’ (Van Asselt et al. 2010) gesteld dat een Comprehensive Geriatric Assessment
(CGA) de basis is voor het vaststellen van voedingsproblemen. De CGA wordt door de
geriater afgenomen en de uitslag geeft inzicht in de problematiek die ten grondslag ligt
aan de ondervoeding op het somatische, psychische, sociale of functionele domein. Als
aanvullend assessment- en monitorinstrument wordt de Mini Nutritional Assessment
(MNA) geadviseerd (Van Asselt et al. 2010).
Een eerste stap in de diagnostiek is het verzamelen van relevante gegevens. Dit kan op
een gestructureerde manier gedaan worden door het risicoprofiel ondervoeding voorafgaand aan het consult door de patiënt in te laten vullen of tijdens het eerste consult
samen in te vullen.
Tabel 3 1. Bent u onbedoeld
afgevallen?
Nee
Ja, een beetje
Ja, best veel
2. Wat vindt u van uw
gewicht?
Goed
Iets te mager
Te mager
3. Heeft u in de
afgelopen maand
minder gegeten dan
normaal?
Nee
Iets minder door:
O verminderde eetlust
O misselijkheid
O smaakverandering
O kauwproblemen
O slikproblemen
O anders, namelijk
Veel minder door:
O verminderde eetlust
O misselijkheid
O smaakverandering
O kauwproblemen
O slikproblemen
O anders, namelijk
4. Heeft u maag- of
darmproblemen?
Nee
Soms
Ja
5. Vindt u dat u gezond
eet?
Meestal
Soms
Bijna nooit
6. Heeft u hulp nodig
bij boodschappen doen
en koken?
Nee
O Ja bij boodschappen doen
O ja bij koken
O Ja bij koken én
boodschappen doen
7. Heeft u last van
vermoeidheid?
Nee
Ja soms
Ja regelmatig
8. Heeft u pijnklachten? Nee
Ja soms
Ja regelmatig
10
DIRAV33.indb 10
Het risicoprofiel ondervoeding
Ondervoeding
Dir 33/56
05-07-12 14:28
9. Bent u somber en/of
verdrietig?
Nee
Ja soms
Ja regelmatig
Omdat de oorzaak van de ondervoeding het gevolg voorspelt, is het belangrijk om in de
diagnostiek gegevens te verzamelen uit onderstaande set van diagnostische maten. Met
deze gegevens is ook beter te zeggen aan welk ondervoedingssyndroom/syndromen de
patiënt lijdt. De cursieve onderdelen vormen de minimale set voor elke situatie; optimaal is om alle maten te gebruiken.
1
De balans van inname en behoefte van energie en eiwit
a Voedingsanamnese en behoefte
b Verlies van voedingsstoffen
c Eetlust
d Indirecte calorimetrie (REE)
e Stikstofbalans
2 De lichaamssamenstelling
a Gewicht en gewichtsverloop
b Lengte
c BMI
d Bovenarmomtrek/bovenarmspieromtrek
e Bio-elektrische impedantie analyse (BIA/BIS)
f DEXA
g Huidplooidikten
3 De mate van inflammatie en ziekte
a C-Reactive Protein
b Albumine
c BSE/Bezinking
d Hemoglobine
4 De functionaliteit, medische en sociale factoren
a ADL
b Delirium
c Medicatiegebruik
d Spierkracht (onder andere handknijpkracht)
e Cognitie (Mini Mental State Examination (MMSE))
f Depressie
g Kwaliteit van leven
h Short Physical Performance Battery (SPPB)
De bovenstaande punten worden kort uitgewerkt.
1 De balans van inname en behoefte van energie en eiwit
a Voedingsanamnese en behoefte
Om een goed beeld te krijgen van de voedingsinname en de veranderingen in voedingsinname in de afgelopen periode is het noodzakelijk een voedingsdagboekje te laten invullen of een voedinganamnese volgens de dietary history-methode af te nemen. Voorafgaand aan het eerste consult kan de patiënt een tweedaags voedingsdagboekje
invullen. Aan de hand van dit ingevulde voedingsdagboekje kunnen de regelmaat van
het eetpatroon en de recente (ziektegerelateerde) veranderingen (aversies, slik- en
kauwproblemen) besproken worden. Vraag ook het gebruik van vitamine- en/of mineralensupplementen na. Navraag van inname aan voedingsstoffen is niet altijd betrouwbaar en zal geïnterpreteerd moeten worden op zijn waarde.
Dir 33/57
DIRAV33.indb 11
Ondervoeding
11
05-07-12 14:28
b Verlies van voedingsstoffen
Evaluatie van inname aan voedingsstoffen moet altijd gepaard gaan met evaluatie van
output. Navraag moet gedaan worden naar misselijkheid met braken, defecatie, stoma’s en fistels.
–– Braken leidt tot verlies van voedingsstoffen, vocht en elektrolyten en vermindert de
mogelijkheid tot voedingsinname.
–– Dunnere en frequentere feces dan normaal duidt op malabsorptie en derhalve verlies aan voedingsstoffen. Evaluatie van de plaats en oorzaak van malabsorptie is
van belang om te evalueren of alleen vocht niet wordt opgenomen of dat ook de
micro- en macronutriënten verminderd opgenomen worden in de darm.
–– Bij een stoma is de totale productie van belang. Een colostoma geeft veelal geen
problemen met malabsorptie, maar een stoma hoger in de darm met (te) grote
hoeveelheid dunne feces (ileostoma) zorgt voor een groot verlies aan voedingsstoffen en een verminderde absorptie. Het verlies kan meestal niet gecompenseerd
worden door een verhoogde inname van vocht, elektrolyten en voedingsstoffen. Een
verhoogde inname leidt tot een verhoogde stomaproductie en een groter verlies. Intraveneuze aanvulling met vocht, elektrolyten en/of voedingsstoffen is dan noodzakelijk.
–– Feces via enterocutane fistels kan een reden zijn om de voedselinname sterk te beperken om de fistel de kans te geven te sluiten. In dat geval zal tijdelijk een andere
weg van voeden gekozen moeten worden.
c Eetlust
Eetlust is een subjectief begrip. Het is te objectiveren en te monitoren met de VAS (Visual Analogue Scale). Deze schaal bestaat uit een horizontale lijn van 10 cm. Patiënten
kunnen op de lijn zelf aangeven hoe zij de eetlust op dat moment ervaren. De waarde
10 geeft een situatie met een zeer goede eetlust. De waarde 0 geeft een situatie met helemaal geen eetlust.
Hoe beoordeelt u uw eetlust over de afgelopen week?
Mijn
eetlust
was heel
goed
Ik had
helemaal
geen
eetlust
Figuur 5 VAS eetlust
d Indirecte calorimetrie
De energiebehoefte in rust kan gemeten worden met behulp van indirecte calorimetrie.
Dit wordt aanbevolen als het inschatten van de energiebehoefte met behulp van de formules onbetrouwbaar of onmogelijk is door bijvoorbeeld amputaties, onbekende lengte
en/of gewicht, afwijkende lichaamssamenstelling, onbetrouwbaar gewicht bij ascites en
dehydratie en bij verdenking op een afwijkende energiebehoefte door bijvoorbeeld chronische inflammatie of schildklierafwijkingen.
12
DIRAV33.indb 12
Ondervoeding
Dir 33/58
05-07-12 14:28
Figuur 6
e Stikstofbalans
De stikstof(N)balans is het verschil tussen de N-opname in de voeding en de N-uitscheiding in de urine en feces, waarbij het grootste verlies (80%) in de urine meetbaar
is. Bij een hoge eiwitafbraak (katabolie) zal de patiënt een verhoogde N-uitscheiding in
de urine hebben. Voor een betrouwbare N-balans is het nodig om een aantal achtereenvolgende dagen de 24 uurs-urine te verzamelen en de eiwitinnname van die dagen zeer
nauwkeurig te inventariseren. Een acute verslechtering of verbetering van de nierfunctie
kan de N-balans beïnvloeden. Hiervoor is het belangrijk naast de N-balans ook de plasmaureum- en kreatininegehalten te evalueren.
2 De lichaamssamenstelling
a Gewicht en gewichtsverloop
Een regelmatige bepaling (wekelijks) van het lichaamsgewicht is belangrijk omdat dit
een indicatie geeft voor het aanslaan van de voedingstherapie en ook aanwijzingen
geeft wanneer de voedingstherapie kan worden afgebouwd.
Met behulp van een geijkte (digitale) weegschaal wordt het lichaamsgewicht bepaald.
Bij deze meting moet rekening gehouden worden met het gewicht van eventuele kleding
van de patiënt. Bij voorkeur wordt de patiënt gewogen zonder schoenen en met zo licht
mogelijke kleding, op een vaste tijd en na toiletbezoek.
Als de patiënt niet op een staweegschaal kan worden gewogen, kan een weegstoel, plateauweegschaal, weegapparatuur voor de tillift of weegbed worden gebruikt. In verband
met afwijkingen tussen verschillende weegschalen is het van belang om elke keer dezelfde weegschaal te gebruiken. Het gewicht is niet bruikbaar bij patiënten bij wie sprake is van oedeem, ascites, dehydratie of andere verstoringen van de vochtbalans. Indien
wegen niet mogelijk is, kan het gewicht worden nagevraagd aan patiënt of familie.
b Lengte
De lengte wordt bepaald met behulp van een aan de muur bevestigde meetlat. De patiënt wordt gemeten zonder schoenen, staat rechtop, met de hakken tegen de muur en
kijkt recht vooruit. Als dit niet mogelijk is, is de kniehoogtemeting een alternatief. De
methodiek en de te gebruiken formules zijn te vinden op http://www.nutritionalassessment.azm.nl/algoritme+na/onderzoek/lichaamssamenstelling/
lengte+adhv+kniehoogte.htm.
c Body Mass Index
De BMI wordt berekend door het gewicht (kg) te delen door de lengte (m) in het kwadraat. Bij volwassenen (≥ 18 jaar) is het afkappunt voor ondervoeding een BMI ≤
18,5 kg/m2 (CBO 2007). Bij ouderen (≥ 65 jaar) is dit ≤ 20 kg/m2 (Sergi et al. 2005,
Dir 33/59
DIRAV33.indb 13
Ondervoeding
13
05-07-12 14:28
Omran & Morley 2000, Volkert et al. 2006, Beck & Ovesen 1998). Een patiënt met een
normale of te hoge BMI kan ondervoed zijn door onbedoeld gewichtsverlies.
d Bovenarmomtrek/bovenarmspieromtrek
Omtrekmaten geven een indicatie van de hoeveelheid vet en spiermassa van het lichaam. De bovenarmomtrek is in combinatie met de huidplooidikte van de triceps een
maat voor de spiermassa in het lichaam (bovenarmspieromtrek). Bij deze methode
gaat men ervan uit dat de gemeten spieromtrek representatief is voor het hele lichaam.
De bovenarmomtrek is toepasbaar als alternatief voor de BMI. Het afkappunt voor ondervoeding voor volwassenen (18 – 65 jaar) is 23,5 cm en voor ouderen is dit 25 cm
(Wijnhoven et al. 2010).
De bovenarmomtrek wordt als volgt gemeten:
1 Buig de linkerarm in een hoek van 90° met de handpalm naar binnen.
2 Bepaal het midden tussen de voelbare knobbel op de top van het schouderblad en
de onderste punt van de elleboog.
3 Meet de armomtrek op het midden van de bovenarm met de arm ontspannen langs
het lichaam.
Figuur 7
e Bio-elektrische impedantieanalyse (BIA/BIS)
Deze indirecte methode voor het meten van de lichaamssamenstelling is gebaseerd op
de elektrische geleiding van een wisselstroom door het lichaam, dan wel het bieden van
weerstand daartegen. Weefsels met veel water en elektrolyten, zoals bloed en spieren,
geleiden goed. Vetmassa, lucht of bot daarentegen geleiden nauwelijks stroom. Dus
hoe groter de vetvrije massa, hoe groter het geleidingsvermogen van het lichaam. Met
behulp van de BIA-meting kunnen de watercompartimenten in het lichaam worden bepaald. Het intracellulaire (ICW) en het extracellulaire water (ECW) vormen samen het
totaal lichaamswater (TBW).
Een groot nadeel van deze methode is de onvoldoende gevalideerde toepassing ervan
bij zieke en/of oudere personen. Waarschijnlijk is er bij deze personen sprake van storende factoren, zoals veranderingen in membraaneigenschappen en mate van hydratie,
waardoor de meting onbetrouwbaar wordt.
Voor het berekenen van de lichaamssamenstelling op basis van BIA-metingen zijn verschillende benaderingen in gebruik:
–– ‘Single-frequency’ BIA (SF-BIA) meet de weerstand (R) bij één frequentie (50 kHz)
en met regressievergelijkingen gebaseerd op de weerstandindex (L2/R) worden totaal lichaamswater (TBW) of vetvrije massa (FFM) berekend. SF-BIA is niet in staat
intracellulair (ICW) en extracellulair water (ECW) apart te meten. Omdat ondervoeding gekarakteriseerd wordt door een afname van ICW, vaak in combinatie met
14
DIRAV33.indb 14
Ondervoeding
Dir 33/60
05-07-12 14:28
ECW-expansie, zijn TBW-waarden niet in staat het verlies van lichaamscelmassa
vast te stellen.
–– ‘Multi-frequency’ BIA (MF-BIA) meet de impedantie bij verschillende frequenties.
Bij lage frequenties wordt de stroom alleen door ECW geleid omdat celmembranen
en contactoppervlaktes tussen weefsels zich gedragen als condensatoren. Bij hoge
frequenties gaat deze eigenschap verloren en vindt er geleiding door zowel ECW als
ICW plaats. Weerstanden gemeten bij lage en hoge frequenties worden gebruikt om
ECW en TBW te berekenen gebaseerd op de weerstandindex bij de specifieke frequenties.
–– Bio-elektrische Impedantie Spectroscopie (BIS) meet de impedantie bij een reeks
van frequenties (meestal 50 frequenties) en de data worden toegepast op een theoretisch model, het Cole-Colemodel, waardoor de weerstand bij een frequentie van 0
en oneindig (Rinf) kan worden geëxtrapoleerd. Deze methode geeft weerstandwaarden voor intracellulair water (Ricw) en extracellulair water (Recw). Deze waarden
kunnen worden gebruikt om vochtcompartimenten te berekenen met behulp van
vergelijkingen gebaseerd op de zogenaamde Hanai mixture-theorie (Kyle et al.
2004a, Kyle et al. 2004b).
f DEXA
Met een DEXA-scan worden met behulp van röntgenstralen vetmassa, vetvrije massa en
botmassa onderscheiden. In ziekenhuizen wordt deze meting vaak uitgevoerd om de
botdichtheid te meten bij patiënten met (risico op) osteoporose. Bij deze meting worden alleen het heupgewricht en de ruggengraat in beeld gebracht. Om informatie te krijgen over het hele lichaam moet een ‘total body scan’ gemaakt worden.
g Huidplooidikten
De dikte van een huidplooi kan met een huidplooimeter worden bepaald. Met behulp
van de gemeten huidplooien kan een voorspelling worden gedaan over de totale lichaamsvetmassa.
De metingen zijn gebaseerd op de veronderstelling dat het vet regelmatig verdeeld is
over het lichaam en de dikte van huidplooien dus maat is voor de hoeveelheid subcutaan vet die representatief is voor de totale hoeveelheid lichaamsvet. Met behulp van referentietabellen kan een schatting worden gemaakt van de vetmassa en de vetvrije
massa van het lichaam. De patiënt moet voor deze meting rechtop kunnen zitten of
staan. Om een schatting te maken van het totale lichaamsvet worden vier huidplooien
gemeten, te weten: de bicepshuidplooi (voorkant, midden bovenarm); de tricepshuidplooi (achterkant midden bovenarm); de subscapilaire huidplooi (onder de punt van
het schouderblad) en de supra-iliacale huidplooi (vlak boven de bovenrand van het
heupbeen). Van alle huidplooimetingen is de tricepshuidplooi de meest betrouwbare,
aangezien oedeem in de bovenarm weinig voorkomt. De metingen zijn minder betrouwbaar bij ouderen, omdat de huidturgor vaak verminderd is en de spieren slapper zijn.
Bij vrouwen is de huidplooi minder goed te definiëren dan bij mannen; daardoor bestaat de kans dat ten onrechte spieren in de huidplooi worden meegenomen. Ook bij
chronische spierziekten, dehydratie en oedeemvorming geeft deze parameter geen betrouwbare waarde. Bij voorkeur dient de meting door dezelfde (getrainde) hulpverlener
gedaan te worden om meetfouten te voorkomen. De plaats van de meting en de manier
waarop men meet, dragen bij aan de validiteit van de meting.
3 De mate van inflammatie
a C-Reactive Protein
C-Reactive Protein (CRP) is een positief acutefase-eiwit. CRP is gecorreleerd aan IL-6 en
een verhoogd CRP-gehalte duidt op inflammatie. Het kan verduizendvoudigen als reactie op ontsteking, sepsis of infectie. CRP kan worden gebruikt om de stressrespons te
monitoren tijdens de acute fase. De normaalwaarde voor CRP is <10 mg/l. Het heeft
een halfwaardetijd van 4 – 6 uur.
Dir 33/61
DIRAV33.indb 15
Ondervoeding
15
05-07-12 14:28
b Albumine
Albumine is een negatief acutefase-eiwit. Het is verantwoordelijk voor 80% van de colloïdosmotische druk en omvat 50 – 60% van het totale plasma-eiwit. Een snelle daling
van albumine is een teken van toenemende inflammatoire reactie. Stijgend albumine
kan worden beschouwd als verbetering, wat wil zeggen dat de patiënt in een anabole situatie komt. Het albuminegehalte stijgt pas als de ontstekingsreactie vermindert. Voeding heeft hierop geen invloed.
De normaalwaarde voor albumine is 35 – 45 g/l. Het heeft een halfwaardetijd van
20 dagen. Bij een albumine van 34 g/l of lager kan een inflammatoire respons in het lichaam aanwezig zijn (vaak samen met een snelle stijging van het CRP).
Albumine in het bloed is niet bruikbaar als maat voor acute ondervoeding, omdat het
door vele factoren wordt beïnvloed, onder andere ziekte. Bij een zieke patiënt verandert
het verdelingsvolume: albumine lekt naar extravasaal. Het lichaam kan tevens lange tijd
uit zijn grote pool putten. Bij gezonde personen leidde een verlies van 25% van het lichaamsgewicht slechts tot een daling van 10% van het albumine. Het is dus geen weerspiegeling van de eiwitsynthese.
c BSE/bezinking
De bezinkingssnelheid van de erytrocyten is de snelheid (mm/uur) waarmee de rode
bloedcellen in een buisje bloed onder invloed van de zwaartekracht naar beneden zakken. Het bezinkingsgetal wordt door vele parameters beïnvloed, maar is een vrij goede
maat voor de activiteit van ontstekingsprocessen in het lichaam. De halfwaardetijd van
immunoglobulinen is enkele weken en van fibrinogeen ongeveer 4 dagen, waardoor ook
een daling van de BSE pas laat meetbaar wordt. Omdat CRP een heel korte halfwaardetijd heeft wijst een hoge CRP-waarde met een normaal of licht verhoogde bezinkingswaarde op een acute, nog niet lang bestaande ontsteking.
d Hemoglobine
Hemoglobine (Hb) kan gebruikt worden om de ziekterespons van de patiënt in te
schatten. Bij ziekte kan het Hb snel dalen. Deze acute daling van het Hb wordt veroorzaakt door vasodilatatie, waarbij de hoeveelheid vocht in de bloedbaan toeneemt en het
bloed verdund wordt. Een geleidelijke daling van het Hb wordt veroorzaakt door onvoldoende aanmaak van rode bloedcellen (anemie). Normaalwaarden voor mannen zijn
8,6 – 10,9 mmol/l en voor vrouwen 7,4 – 9,6 mmol/l. Bij chronisch zieken kan het Hb
verlaagd zijn door een verminderd vermogen van het beenmerg om hemoglobine aan te
maken. Dit wordt wel de ‘anemie der chronisch zieken’ genoemd en kan moeilijk behandeld worden. Voor evaluatie van het Hb zijn het totaal ijzer, het microcitair volume
(MCV), de totale ijzerbindingscapaciteit, de hydratietoestand en het ferritinegehalte van
belang. Het Hb kan alleen goed zijn als de patiënt een goede hydratietoestand, voldoende beschikbaar ijzer en een goed werkend beenmerg heeft.
4 Functionaliteit, medische en sociale factoren
a ADL
Algemene dagelijkse levensverrichtingen (ADL) zijn de handelingen die mensen dagelijks in het gewone leven verrichten. Het begrip wordt gebruikt om te bepalen in hoeverre iemand zelfredzaam is. ADL is te meten met de Barthel-index (www.platvormouderenzorg.nl bij screening) of de ADL-schaal van Katz (www.vmszorg.nl) (Zorg 2009).
b Delirium
Een delirium is een tijdelijke, psychische stoornis die wordt veroorzaakt door één of
meerdere somatische verstoringen of het gebruik van of staken van medicatie. Een delirium kan ontstaan door een combinatie van kwetsbaarheid en uitlokkende factoren
zoals een grote operatie, verblijf op de IC, meerdere psychofarmaca, slapeloosheid en
slaapmedicatie. Screeningsinstrumenten die gebruikt worden zijn de Delirium Observa-
16
DIRAV33.indb 16
Ondervoeding
Dir 33/62
05-07-12 14:28
tie Screening Schaal (DOSS) en op de IC de Confusion Assessment Method-ICU (CAMICU) en de Intensive Care Delirium Screening (IC-DSC). De diagnostiek wordt gedaan
met de DSM-IV criteria (Zorg 2009). Kennis van de aanwezigheid en het stadium van
het delirium is relevant voor de voedingsbehandeling.
c Medicatiegebruik
De soort en de hoeveelheid medicatie kunnen invloed hebben op voedselinname, absorptie van voedingsstoffen en defecatie en output. Kennis van de bijwerkingen van de
gebruikte medicatie is van belang en het is goed navraag te doen naar bijwerkingen als
misselijkheid en/of diarree na starten van medicatie. Aanpassen van tijd van inname,
vorm van inname (oraal, rectaal, subcutaan, intramusculair, intraveneus) zou de voedselinname kunnen verbeteren. Het farmacotherapeutisch kompas en de website van het
college ter beoordeling van geneesmiddelen geven duidelijke informatie over bijwerkingen.
d Spierkracht (onder andere handknijpkracht, beenspierkracht)
Om de spierkracht te meten is de handknijpkracht de meest gebruikte maat. De maximale knijpkracht van de hand geeft een goede inschatting van de perifere spierfunctie
en is gerelateerd aan de totale hoeveelheid spiermassa in het lichaam. Afname van de
spierkracht kan een teken zijn van spierafbraak. Bij een verlies van 10% van de spiereiwitten zal tevens de spierkracht afnemen. Meer informatie over de uitvoering en referentiewaardes van de handknijpkracht is te vinden op http://www.nutritionalassessment.azm.nl/algoritme+na/onderzoek/functionele+parameters/knijpkrachtmeting.htm.
e Cognitie (Mini Mental State Examination (MMSE))
De Mini Mental State Examination (MMSE) (www.platvormouderenzorg.nl bij
screening) wordt gebruikt om vast te stellen of en in welke mate cognitieve stoornissen
aanwezig zijn. De MMSE bevat twintig items en de te behalen scores variëren van nul
tot dertig punten, waarbij een hogere score staat voor een beter cognitief functioneren.
De vragen zijn gegroepeerd in zeven categorieën, waarvan elke categorie een verschillend domein van cognitief functioneren representeert: oriëntatie in de tijd (vijf punten),
ruimtelijke oriëntatie (vijf punten), het registreren van drie woorden (drie punten), concentratie en rekenen (vijf punten), het herinneren van drie woorden (drie punten), taal
(acht punten) en visueel inzicht (een punt). Een vaak gebruikt afkappunt is > 24 (wel/
niet cognitieve stoornissen). Indien relevant is deze score vaak opvraagbaar bij huisarts
of specialist.
f Depressie
Men spreekt van klinische depressie wanneer aan een uitgebreid aantal criteria wordt
voldaan. In Nederland volgt men de indeling (Richtlijn depressie 2009):
–– depressieve episode, licht, eerste episode korter dan drie maanden bestaand;
–– depressieve episode, licht, eerste episode langer dan drie maanden bestaand of recidief;
–– depressieve episode, (matig) ernstig, eerste episode;
–– depressieve episode, (matig) ernstig, recidief.
g Kwaliteit van leven
De kwaliteit van leven kan gemeten worden met behulp van vragenlijsten waarvan de
SF-36 en SF-12 de meest gebruikte zijn (Aaronson et al. 1998). Voor patiënten met kanker wordt de EORTC-C30 gebruikt en voor patiënten met een tumor in het hoofd-halsgebied de EORTC H&N35 (www.oncoline.nl). Deze vragenlijsten bevatten ook vragen over
voedingsproblematiek, wat voor de diëtist relevant is.
Dir 33/63
DIRAV33.indb 17
Ondervoeding
17
05-07-12 14:28
h Short Physical Performance Battery (SPPB)
De Short Physical Performance Battery (SPPB) (Aging) is een set van tests die de mate
van functionaliteit weergeeft bij ouderen. Hij bestaat uit een balanstest, een looptest,
zit-statest. Het afnemen van deze test duurt gemiddeld tussen de 5 en 10 minuten bij
relatief gezonde ouderen en gemiddeld 12 minuten bij ouderen die in het ziekenhuis liggen. De totaalscore van de SPPB is de optelling van het aantal behaalde punten (range
tussen 0 en 12) in elk van de testonderdelen. Hoe hoger de score, hoe beter de prestatie
van de patiënt.
Dagelijks eetpatroon
Bij de behandeling van ondervoeding zal het normale eetpatroon moeten worden aangepast. Hierbij moet rekening worden gehouden met voedingsklachten, beperkingen bij
het eten en eventuele onderliggende ziekte(n) en de behandeling daarvan. Tussenmaaltijden, extra energierijke en/of eiwitrijke voedingsmiddelen, drinkvoeding, sondevoeding
of parenterale voeding kunnen allemaal tot de opties behoren. Als de patiënt sondevoeding gebruikt heeft toediening in porties de voorkeur boven continu-toediening. Voeding in porties lijkt voor een optimale opbouw van eiwit te zorgen (Peters et al. 2003).
Eten in weekends en bijzondere gelegenheden
Ook de mogelijkheden rond het eten in de weekends of bij bijzondere gelegenheden
(bijvoorbeeld uit eten gaan) is volledig afhankelijk van de diagnose en de uitgezette behandeling. Indien mogelijk kan en zal het voedingsbeleid tijdens bijzondere gelegenheden enigszins worden aangepast. Als er redenen zijn om juist minder te eten in deze situaties (misselijkheid door geur, toename diarree door eten, angst voor diarree), dan is
het goed alternatieven te adviseren.
Emotionele beleving van het eten
Het gebrek aan eetlust, het niet kunnen eten in verband met vermoeidheid, (angst voor)
pijn of misselijkheid, braken of diarree en/of een veranderde smaak, hebben een nadelige invloed op de emotionele beleving van eten. Het moeten gebruiken van tussenmaaltijden of klinische voedingen zoals drinkvoeding, sondevoeding, parenterale voeding is ook emotioneel beladen. Met name sondevoeding en parenterale voeding zijn
stigmatiserend en gaan vaak gepaard met ingrijpende toedieningstechnieken. De smaak
van drinkvoeding kan op den duur als eentonig worden ervaren. Deze aspecten kunnen
leiden tot een negatieve emotionele associaties bij eten. Daarnaast kunnen ingrijpende
wijzigingen in het voedingsbeleid zorgen voor verwarring, angst en onbegrip. Een goed
voorbeeld hiervan is de overgang van een voedingsbeleid dat eerst tot doel had het behalen van een adequate voeding maar uiteindelijk een palliatief karakter krijgt en zich zo
veel mogelijk richt op het bestrijden van klachten en het optimaliseren van de kwaliteit
van leven. De taak van de diëtist ligt met name in een goede uitleg van de oorzaak en
het nut van het te volgen voedingsbeleid.
Externe factoren
Afhankelijk van de oorzaak en de ernst van ondervoeding kunnen patiënten problemen
hebben met hun functioneren. Het uitoefenen van een beroep of hobby en het verrichten van huishoudelijke werkzaamheden zijn soms niet meer mogelijk door achteruitgang in conditie en functie. Het risico om in een sociaal isolement te komen is dan ook
18
DIRAV33.indb 18
Ondervoeding
Dir 33/64
05-07-12 14:28
verhoogd. De rol van de partner, de sociale omgeving en de hulpverlener zijn belangrijk
om de patiënt te informeren en te motiveren om de dieetbehandeling voort te zetten.
Diversen
Het toepassen van principes van motiverende gesprekstechnieken, waarop de begeleiding van ondervoede patiënten door de diëtist is gebaseerd, draagt bij aan het voorbereiden van patiënten met ondervoeding op veranderingen in het eetpatroon en het vertrouwen dat het gaat lukken veranderingen door te voeren. In eerste instantie wordt
vaak gedacht dat het gebruik van deze technieken minder geschikt is bij ondervoede patiënten. Maar een vergelijking tussen een ondervoede patiënt en een patiënt met overgewicht of diabetes mellitus laat zien dat die verschillen soms beperkt zijn. Steeds gaat
het om een gedragsverandering waarbij onder meer ziekte-inzicht (op lange termijn)
noodzakelijk is om veranderingen vol te houden. Nu zien veel diëtisten ondervoede patiënten te laat, waardoor de mogelijkheden om te komen tot blijvende veranderingen in
eetgedrag beperkt(er) zijn. Omdat het de bedoeling is om ondervoede patiënten door
systematische screening vroeg te herkennen, zullen deze patiënten in toenemende
mate met behulp van motiverende gesprekstechnieken te begeleiden zijn.
Diëtistische diagnose
De diëtistische diagnose wordt gevormd op basis van het gezondheidsprobleem zoals
de patiënt dat ervaart, de medische factoren (het ziektebeeld en de behandeling die ten
grondslag ligt aan het ontstaan van ondervoeding, de prognose, klachten), de sociale
factoren (woon-, leef- en arbeidsomstandigheden) en persoonlijke factoren (voedingsen bewegingsgewoonten, taalbeheersing, motivatie, ziekte-inzicht). Specifieke factoren
die bij ondervoeding naar voren komen zijn de mate van ondervoeding (BMI, het percentage gewichtsverlies, afbuiging groei, lichaamssamenstelling, inflammatie), de soort
ondervoeding (sarcopenie, cachexie, wasting of een mengvorm) en de gevolgen op
mentale functies, functies bewegingssysteem, voedingsgerelateerde klachten, verliezen
van voedingsstoffen en de invloed op voedselinname.
Op basis van de diëtistische diagnose kunnen, multidisciplinair en in zorgvuldige afstemming met de patiënt, de doelen van de behandeling worden vastgesteld en kan de
voedingsbehandeling verder worden uitgewerkt.
Een voorbeeld van een diëtistische diagnose:
81-jarige man, weduwnaar en zelfstandig wonend met voldoende hulp in de omgeving.
Status na operatief gefixeerde heupfractuur, waarvoor fysiotherapie. Slechte voedingstoestand, 8% gewichtsverlies in 5 weken (BMI 19 kg/m2, FFMI 15,4), door slechte voedselinname (energie 60% van behoefte en eiwit 55% van behoefte) ten gevolge van vermoeidheid. Tevens droge mond, gebitsproblemen en het niet meer zelf kunnen koken.
Dieetbehandelplan
Doel
Ondervoede patiënten zijn doorgaans complexe patiënten. De behandeling is daarom
ook altijd multidisciplinair van aard en goede samenwerking is essentieel. Het behandelend team streeft naar toename van de voedingsinname van de patiënt naar 100% van
de vastgestelde eiwit- en energiebehoefte. Naast een optimale voedingsinname is beweDir 33/65
DIRAV33.indb 19
Ondervoeding
19
05-07-12 14:28
ging een essentieel onderdeel van de behandeling om de spiermassa te behouden
(Roubenoff 2003, Sauerwein & Serlie 2010). De Council of Europe Alliance heeft aanbevelingen gepubliceerd die moeten bijdragen aan het ontwikkelen van voedingsrichtlijnen voor (ziekenhuis)patiënten (Hairon 2007).
Het doel van een voedingsbehandeling bij een ondervoede patiënt is de voedingstoestand te verbeteren (toename van gewicht, vetvrije massa, functionaliteit en kwaliteit
van leven). Indien verbetering van de voedingstoestand niet mogelijk is, is de doelstelling handhaven en/of verdere verslechtering zo veel mogelijk voorkomen.
Een optimale voedingsbehandeling houdt in dat:
–– een ziekenhuispatiënt, een bewoner in een verpleeg- of verzorgingshuis en een
­patiënt in de eerstelijnszorg en thuiszorg wordt gescreend op ondervoeding;
–– door een professional door middel van nutritional assessment de ernst van de ondervoeding wordt vastgesteld;
–– binnen twee tot vier dagen na vaststelling van matige of ernstige ondervoeding een
dieetbehandelplan is ingezet; en
–– het behandelplan wat betreft eiwit- en energie-inname wordt geëvalueerd.
Kenmerken
De diëtist stelt van de ondervoede patiënt de eiwit- en energiebehoefte vast en berekent
aan de hand van de voedingsanamnese de voedingsinname van de patiënt. De eiwit- en
energiebehoefte en de huidige voedingsinname worden berekend, gevolgd door het
multidisciplinair afstemmen van het de behandeldoelen en behandelplan. De diëtist
gaat in overleg met de patiënt en/of zijn familie en verzorgers na of met wijziging van
het normale voedingsgewoonten de vastgestelde eiwit- en energiebehoefte gehaald kan
worden. Hierbij wordt rekening gehouden met de prognose van de patiënt en andere
factoren die bepalend zijn voor de aard van de medische interventies.
1
Bij 100% inname van de vastgestelde energie- en eiwitbehoefte wordt de gebruikte
voeding gecontinueerd. Monitoring van de voedingsinname blijft gewenst.
2 Bij 75 – 100% van de vastgestelde energie- en eiwitbehoefte bestaat het behandelplan uit eiwit- en energierijke voeding in de vorm van verrijkte hoofdmaaltijden, tussentijdse verstrekkingen en eventueel drinkvoeding. Binnen zeven tot tien dagen
wordt het behandelplan geëvalueerd en zo nodig bijgesteld. Ook na de evaluatie
van het behandelplan blijft monitoring van de voedingsinname gewenst.
3 Bij 50% – 75% van de vastgestelde energie- en eiwitbehoefte is het advies drink- en/
of sondevoeding naast eiwit- en energierijke voeding. Binnen vier tot zeven dagen
wordt het behandelplan geëvalueerd en zo nodig bijgesteld. Ook na de evaluatie
van het behandelplan blijft monitoring van de voedingsinname gewenst.
4 Ligt de intake lager dan 50% van de energie- en eiwitbehoefte en is er geen kans op
snelle verbetering van de voedingsinname, dan is volledige sondevoeding aangewezen aangevuld met wat per os mogelijk is. Binnen twee tot vier dagen wordt het behandelplan geëvalueerd en zo nodig bijgesteld. Ook na de evaluatie van het behandelplan blijft monitoring van de voedingsinname noodzakelijk.
20
DIRAV33.indb 20
Ondervoeding
Dir 33/66
05-07-12 14:28
Tabel 4 Behandelplan ondervoede patiënten
Voedings­
inname versus behoefte
Dieetbehandeling
door diëtist
Evaluatie en
actie
ziekenhuis
Evaluatie en actie
verpleeghuis
Evaluatie en actie
eerstelijnszorg
100% van
de behoefte
Energie- en
eiwitrijke voeding
en eventueel
drinkvoeding
Globale
monitoring
(weegbeleid)
Globale monitoring Patiënt houdt inname en
(weegbeleid)
gewicht bij
≤ 10 werkdagen
(telefonische) evaluatie
75 – 100%
van de
behoefte
Energie- en
eiwitrijke voeding
en eventueel
drinkvoeding
< 48 uur:
evaluatie
Continueren/
aanvullen met
drinkvoeding
≤ 10 werkdagen:
evaluatie
Continueren of
aanvullen met
drinkvoeding
≤10 werkdagen:
evaluatie
Continueren of
aanvullen met
drinkvoeding
50 – 75%
van de
behoefte
Energie- en
eiwitrijke voeding
aangevuld met
drinkvoeding en/of
sondevoeding
< 48 uur:
evaluatie
Continueren of
overgaan op
sondevoeding
≤ 5 werkdagen:
evaluatie
Continueren of
overgaan op
sondevoeding
≤ 5 werkdagen: evaluatie
< 50% van
de behoefte
Energie- en
eiwitrijke voeding
aangevuld met
sondevoeding of
volledige
sondevoeding
< 48 uur:
evaluatie
Continueren of
hoeveelheid/
volume
aanpassen
≤ 2 werkdagen:
evaluatie
Continueren of
overgaan op orale
voeding
(drinkvoeding)
indien mogelijk
≤ 2 werkdagen: evaluatie
Continueren of overgaan
op sondevoeding
Continueren of overgaan
op orale voeding
(drinkvoeding) indien
mogelijk
Indien blijkt dat de vastgestelde voedingsbehoefte ook met het behandelplan niet is behaald, wordt een nieuw behandelplan afgesproken volgens het schema. Voor kinderen
is afhankelijk van de leeftijd een aangepast behandelplan nodig. De evaluatie vindt
plaats binnen 48 uur nadat de behandeling is gestart.
Als het voeden via de enterale weg niet mogelijk is, is parenterale voeding geïndiceerd.
Meer informatie hierover is te vinden in dieetbehandelingsrichtlijn 43 ‘Enterale en parenterale voeding’.
Energie- en eiwitbehoefte
De eiwitbehoefte is verhoogd. Om ervoor te zorgen dat de afbraak van spiermassa zo
laag mogelijk wordt gehouden, is het belangrijk om voldoende energie en eiwit te
geven. Door ziekte verandert ook het metabolisme en is er sprake van katabolie. Hierdoor wordt inefficiënt gebruikgemaakt van voedingsstoffen en wordt in verhouding
meer spiermassa afgebroken bij een tekort aan energie uit de voeding Jensen et al.
2009, Muscaritoli 2010, Elia 2005).
Volwassenen
De minimale adequate eiwitinname bij (ziektegerelateerde) ondervoeding voor volwassenen is 1,2 – 1,5 gram eiwit per kg lichaamsgewicht per dag (consensus based (CBO
2007)). Bij een BMI > 27 kg/m2 wordt het lichaamsgewicht bij BMI = 27 kg/m2 in deze
berekening gebruikt. Een eerste schatting van de energiebehoefte wordt berekend met
de Harris & Benedict-formule2 + 30% (Weijs et al. 2008, Sauerwein & Strack van Schijn2 De Harris & Benedict-formule volgens Roza (Farmacotherapeutisch kompas))
Mannen: 13,397 gewicht (kg) + 4,799 lengte (cm) - 5,677 leeftijd + 88,362
Vrouwen: 9,247 gewicht (kg) + 3,098 lengte (cm) - 4,33 leeftijd + 477,593
Dir 33/67
DIRAV33.indb 21
Ondervoeding
21
05-07-12 14:28
del 2007, Roza & Shizgal 1984)of met de FAO/WHO/UNU-formule en nadrukkelijk niet
met de richtlijn 25 30 kcal/kg omdat deze formule een te grote onnauwkeurigheid kent
(Weijs & Kruizenga 2009). In geval van overgewicht of ondergewicht hoeft het gewicht
in de formules niet te worden teruggerekend naar een gezonde BMI (Weijs & Kruizenga
2009, Weijs 2008).
Kinderen
Bij kinderen jonger dan 1 jaar wordt de eiwitbehoefte gebaseerd op de (berekende) energiebehoefte. De WHO-aanbevelingen voor eiwit gelden: voor acuut ondervoede kinderen is een energiepercentage van 9 – 1,5% eiwit adequaat en bij chronisch ondervoede
kinderen een energiepercentage van 11 – 5% eiwit (Consultation 2007). Voor kinderen
ouder dan 1 jaar geldt dezelfde aanbeveling als voor volwassenen: 1,2 – 1,5 gram eiwit
per kg lichaamsgewicht per dag (Koletzko et al. 2005). Voor de berekening van de energiebehoefte wordt uitgegaan van energiebehoefte = rustenergieverbruik (REE) + toeslagen, waarbij REE berekend kan worden met behulp van de Schofield (H+W)-formule
(Schofield 1985) of REE gemeten met behulp van indirecte calorimetrie. Toeslagen dienen berekend te worden voor: ziektefactor, activiteitsfactor, groeifactor, inhaalgroeifactor en energie-absorptiecoëfficiënt. Uitgebreide informatie hierover is te vinden in de
factsheets energiebehoefte en eiwitbehoefte in de toolkit voor de kinderafdelingen van
ziekenhuizen op http://www.stuurgroepondervoeding.nl/index.php?id=149.
Vitaminen en mineralen
De aanbevolen hoeveelheden van vitaminen, mineralen en spoorelementen zijn opgesteld door de Gezondheidsraad en bestemd voor gezonden. Het is onduidelijk, door gebrek aan goed onderzoek, in hoeverre tijdens ziekte een veranderde behoefte aan vitaminen, mineralen en spoorelementen bestaat. Een tekort aan vitaminen en/of
mineralen bij patiënten is moeilijk vast te stellen, doordat de plasmawaarden van vitaminen en mineralen niet altijd een weerspiegeling zijn van de lichaamsvoorraden en
sterk worden beïnvloed door ziekte. Zolang onvoldoende onderzoeksresultaten beschikbaar zijn, dienen minimaal de aanbevolen dagelijkse hoeveelheden te worden toegediend, bij voorkeur gesuppleerd met een multivitiamine/mineralensupplement. Bij gebruik van drink-, sonde- en/of parenterale voeding is de voorziening van
micronutriënten veelal goed. De diëtist kan de inname evalueren en indien nodig adviseren om ontbrekende micronutriënten te suppleren.
Extra aandacht vraagt de voorziening van:
–– vitamine B1: bij mensen die langdurig slecht of eenzijdig eten (alcoholisten, ouderen, anorexia nervosa) is suppletie bij de start van de dieetbehandeling te adviseren
(100 mg/dag gedurende 1 week);
–– vitamine B12, suppletie is nodig:
–– na resectie van terminaal ileum, maag of grote delen van de darm;
–– bij ouderen met atrofische gastritis;
–– bij een tekort aan Intrinsic Factor.
Suppletie in deze gevallen één maal per 1 – 2 maanden intramusculair, levenslang.
–– vitamine A: bij patiënten met grote darmresectie en verminderde absorptie van vetten en dus ook vetoplosbare vitamines. Grote dosering (5.000 – 10.000 IE dagelijks) kan een tekort aanvullen, na aanvullen kan de dosering teruggebracht worden
naar een onderhoudsdosering;
–– Vitamine D:
De gezondheidsraad adviseert suppletie van 10 microgram vitamine D aan:
–– kinderen tot vier jaar;
–– mensen van 4 tot 50 (vrouwen) of 70 (mannen) jaar die een donkere huidskleur
hebben of onvoldoende buitenkomen;
22
DIRAV33.indb 22
Ondervoeding
Dir 33/68
05-07-12 14:28
–– vrouwen tot 50 jaar die een sluier dragen;
–– vrouwen die zwanger zijn of borstvoeding geven;
–– vrouwen vanaf 50 en mannen vanaf 70 jaar die een lichte huidskleur hebben en
voldoende buitenkomen.
Dagelijks 20 microgram vitamine D extra wordt geadviseerd aan:
–– mensen die osteoporose hebben;
–– mensen die in een verzorgings- of verpleeghuis wonen;
–– vrouwen vanaf 50 en mannen vanaf 70 jaar die een donkere huidskleur of die
onvoldoende buitenkomen;
–– vrouwen vanaf 50 jaar die een sluier dragen.
Bepaling van de 25 OH vitamine D-status (normaalwaarde > 50 nmol/l) evalueert
de behoefte aan suppletie. Risicogroepen die nog buiten bovenstaande suppletie
vallen zijn patiënten die een grote darmresectie hebben ondergaan, bij wie de opname van vetachtige stoffen beperkt is. Suppletie van orale vitamine D-druppels
25.000 – 50.000 IE 1 × per week kan de vitamine D-spiegel normaliseren. Bij evaluatie van de vitamine D-spiegel moeten ook het parathormoon PTH en de serumcalciumwaarde meegenomen worden. Is de calciumwaarde normaal of laag en het
PTH hoog, dan is er een absoluut tekort aan vitamine D en kan osteoporose optreden.
Hoewel de gezondheidsraad een minimale vitamine D-spiegel van 50 nmol/l voor
ouderen adviseert, laat recente literatuur zien dat vitamine D-waarden hoger dan
65 – 75 nmol/l kunnen bijdragen aan de preventie van vallen en fracturen (Van Asselt et al. 2010).
–– IJzer: bij kinderen, zwangere vrouwen en bij groot bloedverlies is de kans op anemie
groot. De normale voeding is niet rijk aan ijzer en ijzergebreksanemie kan snel optreden. Suppletie van ijzer in de vorm van orale of intraveneuze preparaten is aan te
raden; met gewone voeding is het moeilijk de ijzerstatus te normaliseren. Parenterale voeding bevat weinig ijzer, goede evaluatie van het Hb in combinatie met MCV,
ijzerbindingscapaciteit en ferritine is van belang.
–– Calcium: de behoefte aan calcium bij vrouwen > 50 jaar is verhoogd. Aandacht aan
het gebruik van calciumhoudende producten, vooral bij problemen bij inname van
zuivel is van belang. Er zijn veel supplementen, veelal in combinatie met vitamine D
in de handel.
Refeedingsyndroom
Het refeedingsyndroom is een gevaarlijke complicatie bij het voeden van ernstig ondervoede patiënten. Het voedingsteam van het VU medisch centrum in Amsterdam heeft
in 2011 een refeedingprotocol opgesteld. Dit protocol is als bijlage 2 aan deze richtlijn
toegevoegd.
Inhoud dieetbehandelplan
Eerste consult
Nadat bij een patiënt ondervoeding is gesignaleerd, dient binnen 1 werkdag de ondervoede patiënt naar de diëtist te worden verwezen. De diëtist neemt vervolgens binnen
2 werkdagen na aanmelding/verwijzing contact op met de patiënt of verwijzer.
In het eerste consult neemt de diëtist het risicoprofiel door met de patiënt en worden
de hier boven beschreven diagnostische bepalingen gedaan om tot een goede diëtistische diagnose te komen.
Dir 33/69
DIRAV33.indb 23
Ondervoeding
23
05-07-12 14:28
Op basis van de uitkomsten van het risicoprofiel en de diagnostische bepalingen formuleert de diëtist samen met de patiënt de algemene hulpvraag en welke risicofactor(en)
het belangrijkste is/zijn om het eerst aan te pakken. Het behandelplan kan uitgewerkt
worden in een actieplan zoals beschreven in bijlage 3. De patiënt dient uitleg te krijgen
over:
–– het ziektebeeld in relatie tot ondervoeding (katabolie, verminderde voedingsinname, verhoogde behoefte, verliezen van voedingsstoffen);
–– mogelijkheden om de voedingstoestand te verbeteren (energie-inname, eiwitinname, lichamelijke activiteit, ziekte);
–– de analyse van de voedingsinname ten opzichte van de behoefte;
–– het te volgen voedingsbeleid en het verloop van de voedingsbehandeling.
De uitwerking van het eerste consult heeft de volgende onderdelen:
–– Formuleer de diëtistische diagnose; geef een analyse en interpretatie van gegevens
uit het diëtistisch onderzoek in termen van gezondheidsproblemen, functioneren
met achterliggende medische factoren, externe factoren en persoonlijke factoren.
–– Bereken de inname en de behoefte.
–– Formuleer behandeldoelen en eindpunten op het gebied van effect van dieetbehandeling, benodigde kennis, houding en vaardigheden (eventueel naar aanleiding van
het actieplan).
–– Formuleer een behandelplan, een weegbeleid en andere multidisciplinaire afspraken.
–– Bepaal de termijn van evaluatie naar aanleiding van de ernst van de toestand zoals
uitgewerkt in tabel 2.
–– Rapporteer aan de huisarts of specialist, in ieder geval na het eerste consult en na
het laatste consult.
Vervolgconsult
Vervolgconsulten bestaan uit de volgende onderdelen:
–– Evaluatie specifieke evaluatiepunten die passen bij de behandeldoelen.
–– Bespreking van eventuele problemen met het voedingsbeleid.
–– Verzamelen van nieuwe medische, sociale, fysieke en psychische gegevens.
–– Indien nodig dieetbehandelplan aanpassen.
–– Nadere uitleg.
–– Motiveren van de patiënt.
–– Begeleiden van de patiënt met de gedragsverandering.
–– Overleg met andere betrokkene hulpverleners (arts, verpleegkundige, fysiotherapeut, apotheker).
Laatste consult
–– De behandeling wordt afgesloten als de behandeldoelstelling(en) is (zijn) gehaald,
de voedingstoestand is hersteld, de voedingsinname is genormaliseerd of het gebruik van klinische voedingsproducten gestopt kan worden.
–– Afspraken maken voor monitoren van voedingstoestand.
–– Afspraken maken over wanneer de behandeling hervat moet worden.
–– Adviezen geven om voedingstoestand te behouden/verbeteren.
24
DIRAV33.indb 24
Ondervoeding
Dir 33/70
05-07-12 14:28
Methodieken en materialen
Op www.stuurgroepondervoeding.nl zijn veel materialen te vinden die gebruikt kunnen
worden in de voorlichting aan de patiënt en andere hulpverleners.
Verantwoording
Deze richtlijn is geaccordeerd door DON (Diëtisten Ondervoeding Nederland) en de
Stuurgroep Ondervoeding (www.stuurgroepondervoeding.nl) en mw. W.K. Visser, diëtist
Dienst Diëtetiek Leids Universitair Medisch Centrum (LUMC)/lid werkgroep Classificaties Diëtetiek Nederlands Paramedisch Instituut (NPi).
Geraadpleegde literatuur
Aaronson, N.K. e.a. (1998), ‘Translation, validation, and norming of the Dutch language version of the
SF-36 Health Survey in community and chronic disease populations’. In: J Clin Epidemiol 51, nr. 11,
pp. 1055-1068.
Asselt, D.Z.B. van, M.A. Van Bokhorst-de van der Schueren & M. Olde Rikkert (2010), Leidraad ondervoeding bij de geriatrische patiënt. Nederlandse Vereniging voor Klinische Geriatrie, Utrecht.
Banks, M. e.a. (2010), ‘Malnutrition and pressure ulcer risk in adults in Australian health care facilities’.
Nutrition 26, nr. 9, pp. 896-901.
Beck, A.M. & L. Ovesen (1998), ‘At which body mass index and degree of weight loss should hospitalized elderly patients be considered at nutritional risk?’ In: Clin Nutr 17, nr. 5, pp. 195-198.
Black, M.M. e.a. (2007), ‘Early intervention and recovery among children with failure to thrive: follow-up
at age 8’. In: Pediatrics 120, nr. 1, pp. 59-69.
CBO (2007), Richtlijn perioperatief voedingsbeleid. Kwaliteitsinstituut voor de Gezondheidszorg CBO,
Utrecht.
College ter beoordeling van geneesmiddelen. Beschikbaar via: http://www.cbg-meb.nl/cbg/nl.
Corbett, S.S., e.a. (2007), ‘The relationship between birthweight, weight gain in infancy, and educational
attainment in childhood’. In: Paediatr Perinat Epidemiol 21, nr.1, pp. 57-64.
Correia, M.I. & D.L. Waitzberg (2003), ‘The impact of malnutrition on morbidity, mortality, length of hospital stay and costs evaluated through a multivariate model analysis’. In: Clin Nutr 22, nr. 3, pp. 235-239.
Elia, M. (2008), ‘Insights into energy requirements in disease’. In: Public Health Nutr 8, nr. 7A,
pp. 1037-1052.
Elia, M. (2009), ‘The economics of malnutrition’. In: Nestle Nutr Workshop Ser Clin Perform Programme
12, pp. 29-40.
Elia, M., L. Zellipour & R.J. Stratton (2005), ‘To screen or not to screen for adult malnutrition?’ In: Clin
Nutr 24, nr. 6, pp. 867-884.
Farmacotherapeutisch Kompas. Beschikbaar via: www.fk.cvz.nl.
Fearon, K. e.a. (2011), ‘Definition and classification of cancer cachexia: an international consensus’. In:
Lancet Oncol.
Fielding, R.A. e.a. (2011), ‘Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences. International working group on sarcopenia’. In: J Am
Med Dir Assoc 12, nr. 4, pp. 249-256.
Fried, L.P. e.a. (2001), ‘Frailty in older adults: evidence for a phenotype’. In: J Gerontol A Biol Sci Med Sci
56, nr. 3, pp. M146-M156.
Hairon, N. (2007), ‘Guidance on improving the nutrition of hospital patients’. In: Nurs Times 103, nr. 42,
pp. 23-24.
Halfens, R.J. e.a. (2011), Landelijke Prevalentiemeting Zorgproblemen, Rapportage resultaten 2011. Universiteit van Maastricht, Maastricht.
Hulst, J.M. e.a. (2010), ‘Dutch national survey to test the STRONGkids nutritional risk screening tool in
hospitalized children’. In: Clin Nutr 29, nr. 1, pp. 106-111.
Dir 33/71
DIRAV33.indb 25
Ondervoeding
25
05-07-12 14:28
Jensen, G.L. e.a. (2009), ‘Malnutrition syndromes: a conundrum vs continuum’. In: JPEN J Parenter Enteral Nutr 33, nr. 6, pp. 710-716.
Joosten, K.F. & J.M. Hulst (2011), ‘Malnutrition in pediatric hospital patients: current issues’. In: Nutrition 27, nr. 2, pp. 133-137.
Joosten, K.F. e.a. 2010, ’National malnutrition screening days in hospitalised children in The Netherlands’. In: Arch Dis Child 95, nr. 2, pp. 141-145.
Koletzko, B. e.a. (2005), ‘1. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical
Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatric Research (ESPR)’.
In: J Pediatr Gastroenterol Nutr 41, Suppl 2, pp. S1-S87.
Kruizenga, H.M. e.a. (2003), ‘Screening of nutritional status in The Netherlands’. In: Clin Nutr 22, nr. 2,
pp. 147-152.
Kruizenga, H.M. e.a. (2005), ‘Effectiveness and cost-effectiveness of early screening and treatment of
malnourished patients’. In: Am J Clin Nutr 82, nr. 5, pp. 1082-1089.
Kruizenga, H.M. e.a. (2010), ‘The SNAQ(RC), an easy traffic light system as a first step in the recognition of undernutrition in residential care’. In: J Nutr Health Aging 14, nr. 2, pp. 83-89.
Kruizenga, H.M., e.a. (2005), ‘Development and validation of a hospital screening tool for malnutrition:
the short nutritional assessment questionnaire (SNAQ)’. In: Clin Nutr 24, nr. 1, pp. 75-82.
Kyle, U.G. e.a. (2004a), ‘Bioelectrical impedance analysis--part I: review of principles and methods’. In:
Clin Nutr 23, nr. 5, pp. 1226-1243.
Kyle, U.G. e.a. (2004b), ‘Bioelectrical impedance analysis-part II: utilization in clinical practice’. In: Clin
Nutr 23, nr. 6, pp. 1430-1453.
Kyle, U.G. e.a. (2005a), ‘Increased length of hospital stay in underweight and overweight patients at hospital admission: a controlled population study’. In: Clin Nutr 24, nr. 1, pp. 133-142.
Kyle, U.G., L. Genton & C. Pichard (2005b), ‘Hospital length of stay and nutritional status’. In: Curr Opin
Clin Nutr Metab Care 8, nr. 4, pp. 397-402.
Leistra, E. e.a. (2009), ‘Prevalence of undernutrition in Dutch hospital outpatients’. In: Eur J Intern Med
20, nr. 5, pp. 509-513.
Mensink, P.A.J.S. e.a. ‘Landelijke Eerstelijns Samenwerkingsafspraak Ondervoeding’. In: Huisarts & Wetenschap 53, nr.7, pp. S7-S10.
Morley, J.E. (1997), ‘Anorexia of aging: physiologic and pathologic’. In: Am J Clin Nutr 66, nr. 4,
pp. 760-773.
Muscaritoli, M., e.a. (2010), ‘Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by Special Interest Groups (SIG) "cachexia-anorexia in chronic wasting diseases" and
"nutrition in geriatrics"’. In: Clin Nutr 29, nr. 2, pp. 154-159.
National Institute on Aging. Beschikbaar via: http://www.grc.nia.nih.gov/branches/ledb/sppb/.
Neelemaat, F. e.a. (2008), ‘Screening malnutrition in hospital outpatients. Can the SNAQ malnutrition
screening tool also be applied to this population?’ In: Clin Nutr 27, nr. 3, pp. 439-446.
Nijs, K. e.a. (2009), ‘Malnutrition and mealtime ambiance in nursing homes’. In: J Am Med Dir Assoc 10,
nr. 4, pp. 226-229.
Norman, K. e.a. (2008), ‘Prognostic impact of disease-related malnutrition’. In: Clin Nutr 27, nr. 1,
pp. 5-15.
Omran, M.L. & J.E. Morley (2000), ‘Assessment of protein energy malnutrition in older persons, part I:
History, examination, body composition, and screening tools’. In: Nutrition 16, nr. 1 pp. 50-63.
Perry, L. & S. McLaren (2003), ‘Nutritional support in acute stroke: the impact of evidence-based guidelines’. In: Clin Nutr 22, nr. 3, pp. 283-293.
Peters, S.J. e.a. (2011), ‘Dose-dependent effects of leucine supplementation on preservation of muscle
mass in cancer cachectic mice’. In: Oncol Rep 26, nr. 1, pp. 247-254.
Richtlijn voor de diagnostiek, behandeling en begeleiding van volwassen patiënten met een depressieve stoornis
(2009). Beschikbaar via: http://www.cbo.nl/Downloads/1065/rl_depr_update_10.pdf
Roubenoff, R. (2003), ‘Exercise and inflammatory disease’. In: Arthritis Rheum 49, nr. 2, pp. 263-266.
Roubenoff, R. e.a. (1997), ‘Standardization of nomenclature of body composition in weight loss’. In: Am
J Clin Nutr 66, nr. 1, pp. 192-196.
Roza, A.M. & H.M. Shizgal (1984), ‘The Harris Benedict equation reevaluated: resting energy requirements and the body cell mass’. In: Am J Clin Nutr 40, nr. 1, pp. 168-182.
26
DIRAV33.indb 26
Ondervoeding
Dir 33/72
05-07-12 14:28
Rypkema, G. e.a. (2004), ‘Cost-effectiveness of an interdisciplinary intervention in geriatric inpatients to
prevent malnutrition’. In: J Nutr Health Aging 8, nr. 2, pp. 122-127.
Sauerwein, H.P. & M.J. Serlie (2010), ‘Optimal nutrition and its potential effect on survival in critically ill
patients’. In: Neth J Med 68, nr. 3, pp. 119-122.
Sauerwein, H.P. & R.J. Strack van Schijndel (2007), ‘Perspective: How to evaluate studies on peri-operative nutrition? Considerations about the definition of optimal nutrition for patients and its key role in the
comparison of the results of studies on nutritional intervention’. In: Clin Nutr 26, nr. 1, pp. 154-158.
Schilp, J. e.a. (2011), ‘Early determinants for the development of undernutrition in an older general population: Longitudinal Aging Study Amsterdam’. In: Br J Nutr pp. 1-10.
Schilp, J. e.a.(2011), ‘Assessing undernutrition in the geriatric outpatient clinic: comparison of instruments’. In: Clinical Nutrition. September, abstract book.
Schofield, W.N. (1985), ‘Predicting basal metabolic rate, new standards and review of previous work’. In:
Hum Nutr Clin Nutr 39, Suppl 1, pp. 5-41.
Sergi, G. e.a. (2005), ‘An adequate threshold for body mass index to detect underweight condition in elderly persons: the Italian Longitudinal Study on Aging (ILSA)’. In: J Gerontol A Biol Sci Med Sci 60, nr. 7,
pp. 866-871.
Soeters, P.B. e.a. (2008), ‘A rational approach to nutritional assessment’. In: Clin Nutr 27, nr. 5
pp. 706-716.
Stechmiller, J.K. 2010), ‘Understanding the role of nutrition and wound healing’. In: Nutr Clin Pract 25,
nr. 1, pp. 61-68.
Stratton, R.J., C.J. Green & M. Elia (2003), Disease-related malnutrition: an evidence-based approach to
­treatment. CABI Publishing, Wallingford, United Kingdom..
Venrooij, L.M. van e.a. (2011), ‘Accuracy of quick and easy undernutrition screening tools--Short Nutritional Assessment Questionnaire, Malnutrition Universal Screening Tool, and modified Malnutrition Universal Screening Tool--in patients undergoing cardiac surgery’. In: J Am Diet Assoc 111, nr. 12,
pp. 1924-1930.
VMS Zorg (2009), Praktijkgids kwetsbare ouderen.
Volkert, D. e.a. (2006), ‘ESPEN Guidelines on Enteral Nutrition: Geriatrics’. In: Clin Nutr 25, nr. 2,
pp. 330-360.
Weijs, P.J. & H. Kruizenga (2009), ‘Wat is de energiebehoefte van mijn patiënt?’ In: Nederlands Tijdschrift
voor Voeding & Diëtetiek 64, nr. 5, pp. S1-S8.
Weijs, P.J. (2008), ‘Validity of predictive equations for resting energy expenditure in US and Dutch overweight and obese class I and II adults aged 18-65 y’. In: Am J Clin Nutr 88, nr. 4, pp. 959-970.
Weijs, P.J. e.a. (2008), ‘Validation of predictive equations for resting energy expenditure in adult outpatients and inpatients’. In: Clin Nutr 27, nr. 1, pp. 150-157.
Wijnhoven, H.A. e.a. (2010), ‘Low mid-upper arm circumference, calf circumference, and body mass
index and mortality in older persons’. In: J Gerontol A Biol Sci Med Sci 65, nr. 10, pp. 1107-1114.
Wijnhoven, H.A. e.a. (2011), Development and validation of criteria for determining undernurition in community-dwelling older men and women: the Short Nutritional Assessment Questionnaire 65+.
World Health Organisation (2007), ‘Catch-up growth’. In: Protein and amino acid requirements in human
nutrition, pp.185-193.
Zichtbare Zorg verpleging, v.e.t. (2010), Kwaliteitskader Verantwoorde Zorg. Zichtbare Zorg, Den Haag.
Dir 33/73
DIRAV33.indb 27
Ondervoeding
27
05-07-12 14:28
Bijlage 1 Checklist ondervoeding
Naam ziektebeeld: ondervoeding
Gegevens patiënt:
Aandachtspunt
Mondeling
Schriftelijk
Doel van de behandeling
••
••
Voedingstoestand verbeteren (toename van gewicht, vetvrije
massa, functionaliteit en kwaliteit van leven)
Indien verbetering van de voedingstoestand niet mogelijk is, is de
doelstelling handhaven en/of verdere verslechtering zo veel
mogelijk voorkomen
Ziektebeeld
••
••
••
••
Ondervoeding in relatie tot het ziektebeeld
De analyse van de voedingsinname ten opzichte van de
voedingsbehoefte
Het te volgen voedingsbeleid en het verloop van de
voedingsbehandeling
Mogelijkheden om de voedingstoestand te verbeteren
(eiwitinname, energie-inname, lichamelijke activiteit)
Uitgangspunten van het dieet
••
••
••
••
••
Energie volgens behoefte, rekening houdend met verliezen
Eiwit bij ziekte 1,2 – 1,5 gram per kg (volwassenen), kinderen
afhankelijk van leeftijd 1,2 – 4 g/kg
Vitaminen en mineralen: 100 % ADH
Vocht: 1,5 liter + verliezen
Aandacht voor preventie en vroege herkenning van het
refeedingsyndroom
Dieetadvies in de praktijk
••
••
••
••
••
••
••
••
••
••
••
••
28
DIRAV33.indb 28
Opstellen behandeldoelen op basis van diëtistische diagnose
Opstellen behandelplan
Rekening houden met voedingsklachten, beperkingen bij het eten
en eventuele onderliggende ziekten
Beweegadviezen
Productinformatie onder andere over mogelijke dieetpreparaten en
supplementen
Eventuele voeding via kunstmatige weg (sonde, infuus)
Emotionele beleving van het eten
Eetmomenten (hoofd- en tussenmaaltijden)
Bereidingswijzen/recepten
Praktische tips
Weegbeleid
Evaluatietermijn
Ondervoeding
Dir 33/74
05-07-12 14:28
Dieet bij veranderde omstandigheden
••
••
••
••
weekends
buiten de deur eten
vakantie/reizen
onregelmatige diensten
Bijzonderheden
••
••
••
••
multidisciplinaire afstemming
leefadvies in relatie tot dieet (bewegen)
behandelplan, doel van het dieet, te verwachten effect,
bijwerkingen, kosten
vergoeding dieetpreparaten
Gebruik hulpmiddelen
••
••
••
••
••
••
Dir 33/75
DIRAV33.indb 29
Risicoprofiel
Meetapparatuur voor diagnostiek in de verschillende domeinen
Laboratoriumuitslagen
Vragenlijsten en scorelijsten
Actieplan
Folders
Ondervoeding
29
05-07-12 14:28
Bijlage 2 Refeedingsyndroom
30
DIRAV33.indb 30
Ondervoeding
Dir 33/76
05-07-12 14:28
Dir 33/77
DIRAV33.indb 31
Ondervoeding
31
05-07-12 14:28
32
DIRAV33.indb 32
Ondervoeding
Dir 33/78
05-07-12 14:28
Dir 33/79
DIRAV33.indb 33
Ondervoeding
33
05-07-12 14:28
34
DIRAV33.indb 34
Ondervoeding
Dir 33/80
05-07-12 14:28
Dir 33/81
DIRAV33.indb 35
Ondervoeding
35
05-07-12 14:28
36
DIRAV33.indb 36
Ondervoeding
Dir 33/82
05-07-12 14:28
Dir 33/83
DIRAV33.indb 37
Ondervoeding
37
05-07-12 14:28
38
DIRAV33.indb 38
Ondervoeding
Dir 33/84
05-07-12 14:28
Dir 33/85
DIRAV33.indb 39
Ondervoeding
39
05-07-12 14:28
40
DIRAV33.indb 40
Ondervoeding
Dir 33/86
05-07-12 14:28
Bijlage 3 Actieplan
Risicofactoren
Score risicofactor
Op welke risicofactor
wil ik mij richten?
1. Onbedoeld gewichtsverlies
2. Huidige gewicht
3. Huidige eetpatroon
4. Maag- of darmproblemen?
5. Eenzijdig voedingspatroon
6. Hulp nodig bij boodschappen doen en koken?
7. Vermoeidheid
8. Pijnklachten
9. Somber en/of verdrietig
Wat zou het me kunnen opleveren als ik beter gevoed zou zijn of als de hierboven aangekruiste risicofactor zou verbeteren?
••
••
••
Wat zou ik kunnen doen om dit te bereiken?
••
••
••
Mijn plan: hoe ga ik dat doen?
••
••
••
Waarom zou het niet lukken?
••
••
••
Dir 33/87
DIRAV33.indb 41
Ondervoeding
41
05-07-12 14:28
Wat ga ik doen zodat het wel gaat lukken?
••
••
••
Hoe zeker ben ik ervan dat ik dit kan? Ik kies het cijfer (op een schaal van 1 – 10, 1 betekent dat u geen vertrouwen heeft en 10 dat u zeer veel vertrouwen heeft): ..........
42
DIRAV33.indb 42
Ondervoeding
Dir 33/88
05-07-12 14:28











